ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 12, с. 1876-1884
УДК 541(64+49):539.199
СТАБИЛИЗАЦИЯ ДВУНИТЕВОГО Poly(A)·Poly(U)
МЕТАЛЛОПОРФИРИНОМ ZnTMPyP4 В ВОДНОМ
РАСТВОРЕ
© 2020 г. А. Г. Кудрев*
Санкт-Петербургский государственный университет, Университетская наб. 7-9, Санкт-Петербург, 190034 Россия
*e-mail: kudrevandrei@mail.ru
Поступило в Редакцию 20 июля 2020 г.
После доработки 7 августа 2020 г.
Принято к печати 14 августа 2020 г.
Проведен анализ УФ спектров поглощения водных растворов, содержащих одновременно металлопорфи-
рин Zn(X)TMPyP4 [H2TMPyP4 - 5,10,15,20-тетракис(1-метилпиридин-4-ил)-21H,23H-порфирин] и син-
тетическую полиадениловую-полиуридиловую кислоту Poly(A)·Poly(U), в интервале температур 20-70°С
(рН = 7.0, I = 0.15 M.). Деконволюция матрицы спектрометрических данных, без постулирования физи-
ко-химической модели равновесия, позволила оценить вклад комплекса Poly(A)·Poly(U)*(ZnTMPyP4)n
в суммарное изменение спектров. Хемометрический анализ показал, увеличене температуры плавления
этого тройного комплекса на 9.4°С по сравнению со свободным полирибонуклеотидом, что указывает
на стабилизацию связей между нуклеиновыми основаниями в полинуклеотиде Poly(A)·Poly(U) под
действием связанного порфирина.
Ключевые слова: стабилизация биополимера, Poly(A)·Poly(U), ZnTMPyP4, хемометрический анализ,
спектрофотометрия
DOI: 10.31857/S0044460X20120100
С целью проверки возможности стабилиза-
рамидальную геометрию. Ион металла занимает
ции нативной структуры двуспирального био-
некомпланарное положение, таким образом, вы-
полимера путем комплексообразования с ме-
зывая куполообразное искажение, так как Zn(II)
таллопорфирином методом УФ спектроскопии
координирует аксиальный лиганд (X) только с од-
исследовано поведение полиадениловой-полиури-
ной стороны от плоскости порфирина. Связывание
диловой кислоты Poly(A)·Poly(U) в присутствии
этого производного с ДНК и РНК может носить
комплекса
5,10,15,20-тетракис(1-метилпири-
характер частичной интеркаляции, связывания в
дин-4-ил)-21H,23H-порфирина (Н2TMPyP4) с цин-
бороздке, а также и поверхностного присоедине-
ком. Способность водорастворимого Н2TMPyP4 и
ния [11-14]. Вполне вероятно, что пяти координа-
его металлопроизводных Ме(X)TMPyP4 взаимо-
ционные свойства Zn(II) должны препятствовать
действовать с нативной ДНК и синтетическими
интеркаляции металлопорфирина между основа-
полинуклеотидами является предметом большого
ниями dsДНК и РНК. Указанное соединение яв-
числа исследований на протяжении ряда лет [1-9].
ляется наиболее эффективным при стабилизации
Введение металлоцентра позволяет создавать на
специфических структур ДНК среди многих про-
основе порфирина лиганды, стабилизирующие
тестированных порфиринов [15]. Хотя примеров
специфические структуры ДНК, а также имеющие
исследования взаимодействий достаточно много,
селективность по отношению к отдельным фор-
тем не менее, механизм связывания еще не уста-
мам [10].
новлен до конца. Было показано, что большая пло-
Катионный металлопорфирин Zn(Х)TMPyP4 в
ская π-система Zn(X)TMPyP4 способна обеспе-
водном растворе имеет заряд 4+ и квадратнопи-
чить сильные π-π-взаимодействия, а катионные
1876
СТАБИЛИЗАЦИЯ ДВУНИТЕВОГО Poly(A)·Poly(U)
1877
функциональные группы вместе с центральным
собствует подавлению перехода между нативной
ионом Zn(II) обеспечивают электростатические
упорядоченной структурой и неупорядоченным
взаимодействия с фосфатными группами на по-
состоянием статистичкского клубка, для данного
верхности РНК [14].
биополимера.
Вторым компонентом изучаемой системы явля-
В случае плавления тройного комплекса
ется двунитевая полиадениловая-полиуридиловая
[Poly(A)·Poly(U)](TMPyP4)n причина, лежащая
кислота Poly(A)·Poly(U) стабилизация которой
в основе стабилизации или дестабилизации био-
представляет практический интерес. Известно,
полимера лигандом, является комплексной функ-
что данный малотоксичный биополимер активно
цией многих термодинамических параметров. К
индуцирует интерферон in vivo [16-18]. Это свой-
ним относятся константа связывания лиганда и
ство позволило применить его в качестве лекар-
изменения параметров связывания с сайтом био-
ственного препарата в глазных каплях «Полудан».
полимера вследствие кооперативности, а также эн-
Лиофилизат для приготовления глазных капель
тальпия и энтропия разрыва цепей. Определение
растворяют непосредственно перед применением.
лиганд-индуцированного сдвига Tm с использова-
Однако даже при незначительном нагревании пре-
нием жесткой физико-химической модели требует
параты на основе раствора Poly(A)·Poly(U) теряют
установление всех перечисленных параметров,
свою активность. Это можно связать с тем, что при
что является нетривиальной задачей. Кроме того,
комнатной температуре Poly(A)·Poly(U) в раство-
в зависимости от степени насыщения лигандом,
ре находится в виде двуспирального полимера, а
кривые плавления могут стать многофазными за
при повышении температуры происходит развора-
счет перераспределения лигандов, что еще более
чивание цепей полимера. Трансформацию между
усложняет возможность интерпретации, особенно
формами (фазовый переход или плавление) можно
с использованием данных калориметрии. Поэтому
отнести к переходу мономеров из двуспиральной
в настоящей работе в качестве физического метода
структуры в одноцепочные структуры в результате
исследования выбрана электронная спектроскопия
разрыва связывающих их водородных связей. Тем-
поглощения, что позволяет различить соединения,
пературу фазового перехода Tm (температура плав-
участвующие в превращениях, по их характерно-
ления) определяют как температуру полупревра-
му спектру. Математическая обработка данных
щения нативной формы в высокотемпературную
измерений проведена с использованием мягкого
фору. В процессе плавления соседние нуклеино-
моделирования, не требующего постулирования
вые основания мономера меняют свою ориента-
модели равновесных взаимопревращений [27].
цию. В результате изменения характера стэкинга
Успешное применение мягкого моделирования
меняется интенсивность и энергия π-π*-перехо-
стало возможным в результате разработки методов
дов, что ведет к изменению ЭСП.
хемометрического анализа данных спектрометри-
Данные о температуре плавления для
ческих измерений MCR-ALS (Multivariate Curve
Poly(U)·Poly(A) весьма противоречивы, что обу-
Resolution-Alternating Least Squares) [28] объеди-
словлено чувствительностью данного полимера к
ненных в пакет компьютерных процедур MCR-
условиям эксперимента [19]. Сообщалось, что раз-
ALS [29]. Мягкое моделирование проводится с
деление нитей происходит при 37°C [20]. Причем
целью построения диаграмм концентрационных
в присутствии интеркалятора
[(terpy)Pt(HET)]+
профилей абстрактных спектральных форм, уча-
эта температура повышалась до 43°C [20]. В бо-
ствующих во взаимопревращениях в системе. Наи-
лее поздних работах были найдены температуры
более эффективно использование данного подхода
перехода от 46 до 47.5°C [21-25]. Присутствие
при изучении систем, в состав которых входят био-
интеркалятора увеличивало температуру перехода
полимеры. Для таких макромолекул трудно опре-
приблизительно на 8-9°C. Исследование терми-
делить набор химических форм и конформаций,
ческого поведения Poly(A)·Poly(U) в присутствии
взаимопревращение которых вызывает наблюдае-
неметаллизированного Н2TMPyP4 показало повы-
мые изменения спектров в процессе варьирования
шение температуры плавления на 1.2°C [26]. Это
равновесных концентраций компонентов раство-
указывает на то, что связывание порфирина спо-
ра. При мягком моделировании в ходе итерацион-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1878
КУДРЕВ
ной подгонки используются ограничения, позво-
ляющие придать физический смысл получаемому
абстрактному математическому решению. Наряду
с обычными ограничениями на одномодальность,
неотрицательность, баланс и равенство концен-
траций, связанное с селективностью, недавно в
алгоритмы MCR-ALS была добавлена физико-хи-
мическая модель [28]. Основное преимущество
нового подхода состоит в возможности вычитания
из общей экспериментальной дисперсии некото-
рой части, описываемой известной физико-хими-
ческой моделью. В настоящей работе также ис-
пользован данный подход. Следует отметить, что
при наличии в системе концентрационной селек-
тивности параметры равновесных реакций в слож-
ной системе можно вычислять непосредственно из
диаграмм, построенных с помощью ALS-MCR. В
отсутствии селективности, параметры взаимодей-
ствий полидентатной молекулы вычисляются из
диаграмм ALS-MCR с систематической ошибкой.
Неопределенность при вычислениях профилей
частично удается снять путем анализа сшитой из
параллельных экспериментов матрицы данных,
включающей область концентрационной селек-
тивности для чистых компонент системы. Указан-
ный хемометрический подход на основе мягкого
моделирования показал свою эффективность для
описания протонирования некоторых коротких
последовательностей ДНК [30], а также при изу-
чении плавления дуплекса Poly(A)·Poly(U) в вод-
ном растворе и для описания его взаимодействия с
интеркалирующим лигандом [31, 32].
Добавление к водному раствору дуплекса
Poly(A)·Poly(U) (10 мкМ., рН = 7.0) металлопор-
фирина Zn(X)TMPyP4 при комнатной температуре
ведет к присоединению последнего на поверхности
полинуклеотида с образованием трехкомпонент-
ного комплекса Poly(A)·Poly(U)*(ZnTMPyP4)n
[14]. Термическое разрушение данного соедине-
ния, стабилизированного электростатическим
взаимодействием центрального иона Zn(II) с
фосфатными группировками дуплекса, сопрово-
ждается изменением оптического поглощения не
только в области поглощения полинуклеотидов
(250-300 нм), но и в области поглощения метал-
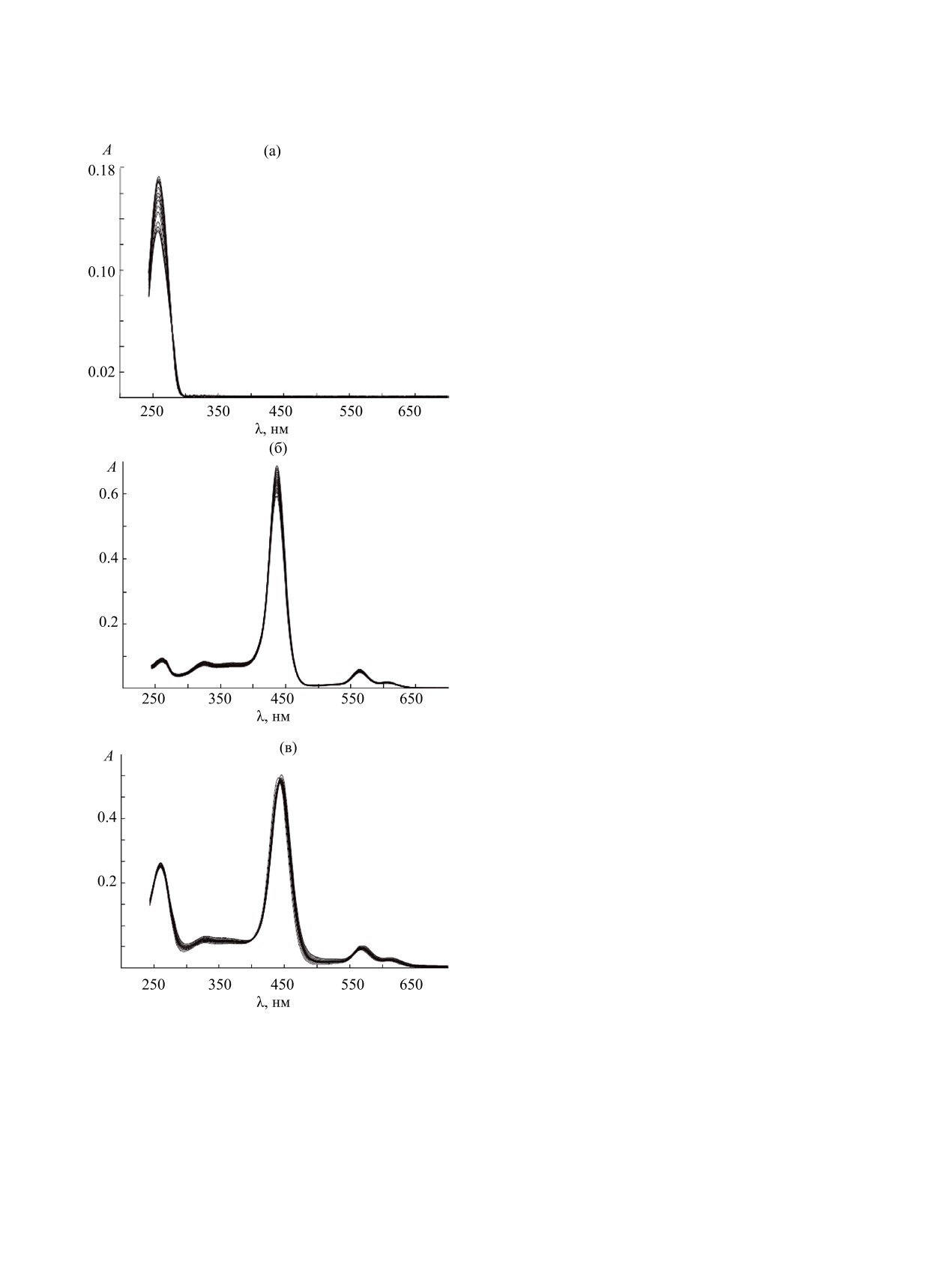
Рис. 1. Изменения электронных спектров поглощения
лопорфирина (300-700 нм). Для ответа на вопрос
водных растворов (рН = 7.0) дуплекса Poly[A]·Poly[U]
(а), металлопорфирина Zn(X)TMPyP4 (б) и их смеси
о том, как комплексообразование с металлопор-
Poly[A]·Poly[U]-Zn(X)TMPyP4 (в) при варьировании
фирином влияет на термическую устойчивость
температуры.
дуплекса (рис. 1а), были изучены водные рас-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
СТАБИЛИЗАЦИЯ ДВУНИТЕВОГО Poly(A)·Poly(U)
1879
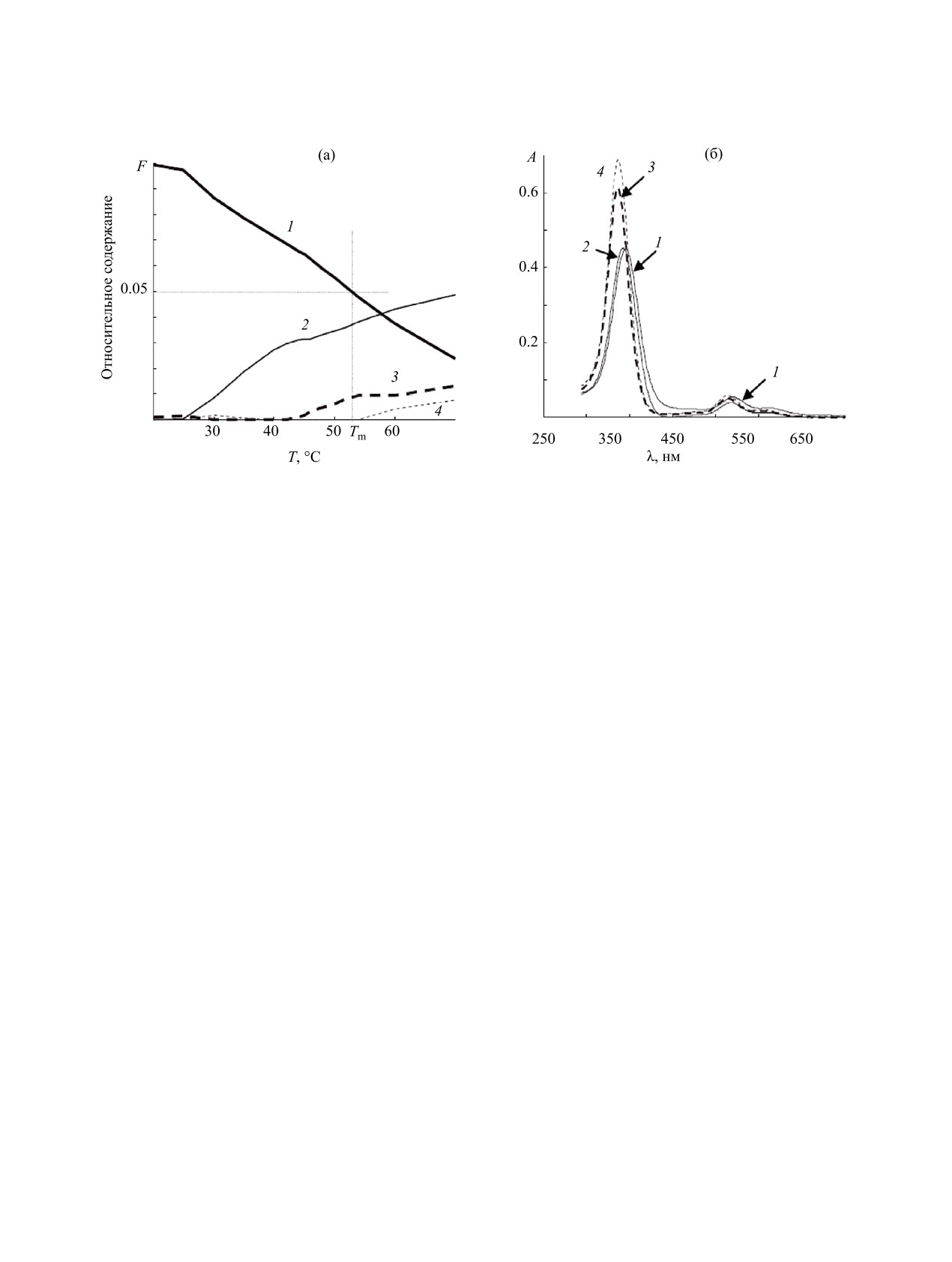
Рис. 2. Диаграмма распределения форм металлопорфирина в зависимости от температуры (а) и спектры форм (б) для
спектральной области поглощения лиганда, вычисленные с помощью процедуры KALS деконволюции матрицы А1.
1 - Poly[A]·Poly[U]*(ZnTMPyP4)n, 2 - частично диссоциированная форма ZnPPA_U, 3 - высокотемпературная форма
Zn(Х)TMPyP4HT, 4 - Zn(Х)TMPyP4.
творы смеси Poly(A)·Poly(U)-Zn(X)TMPyP4 при
интенсивности полос поглощения возможно свя-
различных мольных соотношениях компонентов.
зано с изменением гидратной оболочки молекулы,
Электронные спектры поглощения (ЭСП) сме-
вызывающей изменение вращательной свободы
си Poly(A)·Poly(U)-Zn(X)TMPyP4 для мольно-
метилпиридиновых заместителей, аналогичное
го отношения компонентов 3:1, измеренные при
тому, что наблюдается при связывании произво-
температурах от 20 до 70°С, показаны на рис. 1в.
дных порфиринов в комплексы с биомолекула-
Набору измеренных ЭСП соответствует матрица
ми. Ранг матрицы данных ZnP, соответствующей
данных ZnPPAU. Ранг Rf матрицы ZnPPAU равен
набору ЭСП раствора металлопорфирина, равен
3 (рис. 1б). Следовательно, дисперсию абсорбции
2. Следовательно, в термических превращениях
определяют 3 спектральные формы. Аналогичный
Zn(X)TMPyP4 в растворе, можно допустить уча-
результат был получен при М = 4 и М = 5. Наличие
стие двух спектральных и соответствующих им
области спектральной селективности металлопор-
химических форм: низкотемпературной Zn(Х)
фирина позволяет провести хемометрический ана-
TMPyP4 и высокотемпературной Zn(Х)TMPyP4HT.
лиз только для этой области спектра, показываю-
Спектрофотометрические данные по темпе-
щий изменение состояния металлопорфирина при
ратурному поведению раствора Poly(A)·Poly(U)-
температурных превращениях в системе. С целью
Zn(X)TMPyP4 и растворе чистого металлопор-
проведения этого анализа также были получены
фирина объединены в матрице A1. Матрица A1 =
данные для раствора чистого металлопорфирина.
[ZnPPAU ZnP] сшита из матрицы ZnPPAU и ма-
ЭСП раствора Zn(X)TMPyP4 в условиях экс-
трицы ZnP. Ранг матрицы A1 равен 4. Однако сум-
перимента заметно меняется при варьировании
ма рангов матриц ZnPPAU и ZnP равна 5. Сниже-
температуры (см. рис. 1б). Как видно из рисун-
ние ранга при сшивании матриц указывает, что в
ка, наблюдается уменьшение интенсивности по-
смеси имеется одна спектральная форма общая
глощения на 10% без изменения положения max
со спектральными формами свободного металло-
наиболее интенсивной полосы Соре при 437 нм,
порфирина. Для выяснения химической природы
а также Q-полос в области 550-650 нм и полосы
этой формы была использована процедура мяг-
поглощения в УФ спектре при 260 нм при повы-
кого моделирования MCR-ALS [28]. MCR-ALS
шении температуры от 20 до 70°С. Понижение
деконволюция матрицы A1 дает матрицы Cf и ST,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1880
КУДРЕВ
произведение которых воспроизводит A1 в преде-
зоне 250-700 нм, включая матрицу данных PAU
лах экспериментальной погрешности. Здесь ма-
для свободного Poly(A)·Poly(U). Эксперимен-
трица спектров спектральных форм ST = [SZnPPAU
тально наблюдаемые ЭСП свободного дуплекса
SZnPPA_U SZnP SZnP_HT]T, а матрица Cf =[CZnPPAU
Poly(A)·Poly(U) в водном растворе при (рН = 7.0,
CZnPPA_U CZnP CZn_HT] в данном случае является
I = 0.15 M.) при температурах 20-70°С (рис. 1а)
сшитой матрицей долей форм металлопорфирина,
были описаны ранее в работе [31]. Форма кривых
находящихся в различных формах (состояниях,
плавления Poly(A)·Poly(U), сохраняющаяся в ши-
соответствующих спектральным формам свобод-
роком диапазоне температур, свидетельствует о
ного и координированного металлопорфирина).
монофазном характере плавления исследуемого
Число столбцов Cf равно рангу матрицы A1, а чис-
биополимера. Наличие линейного участка на за-
ло строк равно 2NТ (NТ - число измерений темпе-
висимости величины логарифма KU=[RNA]дестр/
ратур). Вычисленное распределение по формам,
[RNA]сверн от обратной температуры позволили
соответствующее первым N строкам Cf в зави-
определить термодинамические параметры плав-
симости от температуры показано на рис. 2А. На
ления [31].
рис. 2б показаны профили чистых спектральных
Для
анализа
плавления
Poly(A)·
форм, вычисленных с помощью MCR-ALS. На
Poly(U)*(ZnTMPyP4)n использовали матрицу A2 =
рис. 2б виден гипсохромный сдвиг (4 нм) полосы
[ZnPPAU-ν*ZnP-γ*PAU ZnP PAU], где коэффици-
Соре для ZnPPA_U по сравнению с ZnPPAU. Как
енты γ и ν - мольные доли свободного порфирина
можно видеть из рис. 2А уменьшение доли формы
и свободного биополимера в растворе. Указанные
ZnPPAU=Poly(A)·Poly(U)*(ZnTMPyP4)n в интер-
коэффициенты находили из диаграммы распре-
вале 20-45°С сопровождается ростом доли формы
деления в соответствие с отношением компонент
ZnPPA_U. Эту форму можно отнести к состоянию,
смеси (см. рис. 3 в работе [14]). Ранг матрицы
в котором металлопорфирин связан с полинукле-
A2 для всех изученных мольных отношений ра-
отидом, но водородные связи между нуклеиновы-
вен 6. Сумма рангов матриц ZnPPAU, ZnP и PAU
ми основаниями разорваны. Из диаграмы, пока-
равна 7. Снижение ранга при сшивании матриц
занной на рис. 2а, легко определить температуру
обусловлено присутствием высокотемпературной
полупревращения формы ZnPPAU, которая как
формы свободного металлопорфирина в смеси
было сказано во введении соответствует темпера-
Poly(A)·Poly(U)-Zn(X)TMPyP4. Таким образом,
туре плавления Tm. Из рисунка видно, что темпе-
химический ранг 3 матрицы ZnPPAU обусловлен
ратуры плавления тройного комплекса составляет
взаимопревращением трех химических форм: ис-
53°С. Это на 9.4°С выше по сравнению с чистым
ходного комплекса Poly(A)·Poly(U)*(ZnTMPyP4)n,
полирибонуклеотидом. При температуре раствора
его частично диссоциированной формы ZnPPA_U и
выше 45°С наблюдается появление высокотемпе-
высокотемпературной формы Zn(Х)TMPyP4HT. Де-
ратурной формы свободного металлопорфирина
конволюция матрицы A2 позволяет вычислить ма-
(см. рис. 2а). Следовательно, спектральные изме-
трицы Cf =[CZnPPAU CZnPPA_U CZnP CZn_HT CPPAU CPA_U]
нения, наблюдаемые выше 45°С, можно объяснить
и ST = [SZnPPAU SZnPPA_U SZnP SZnP_HT SPAU SPA_U]T .
процессом диссоциации (1).
Произведение матриц Cf и ST воспроизводит A2 в
пределах экспериментальной погрешности. Ди-
Poly(A)·Poly(U)*[Zn(X)TMPyP4]n
аграмма распределения по формам в зависимо-
→ Poly(A) + Poly(U) + nZn(X)TMPyP4.
(1)
сти от температуры для N строк Cf показана на
При нагревании выше 60°С появляется еще
рис. 3а. Спектральные профили чистых форм
одна форма, спектр которой похож на спектр Zn(X)
(рис. 3б), совпадают с соответствующими профи-
TMPyP4. Возможно, это другая высокотемпера-
лями, вычисленными для области спектральной се-
турная форма металлопорфирина, но более точная
лективности металлопорфирина. Из рис. 3а видно,
интерпретации требует проведение дополнитель-
что появление высокотемпературной формы Zn(Х)
ных экспериментов при высокой температуре, что
TMPyP4HT совпадает с появлением заметной доли
выходит за рамки данной работы.
формы, отвечающей денатурированной PA_U. Ре-
Чтобы проследить за превращениями цепей
зультат проведенного расчета подтверждает схему
дуплекса были проанализированы ЭСП в диапа-
процесса представленного уравнением (1).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
СТАБИЛИЗАЦИЯ ДВУНИТЕВОГО Poly(A)·Poly(U)
1881
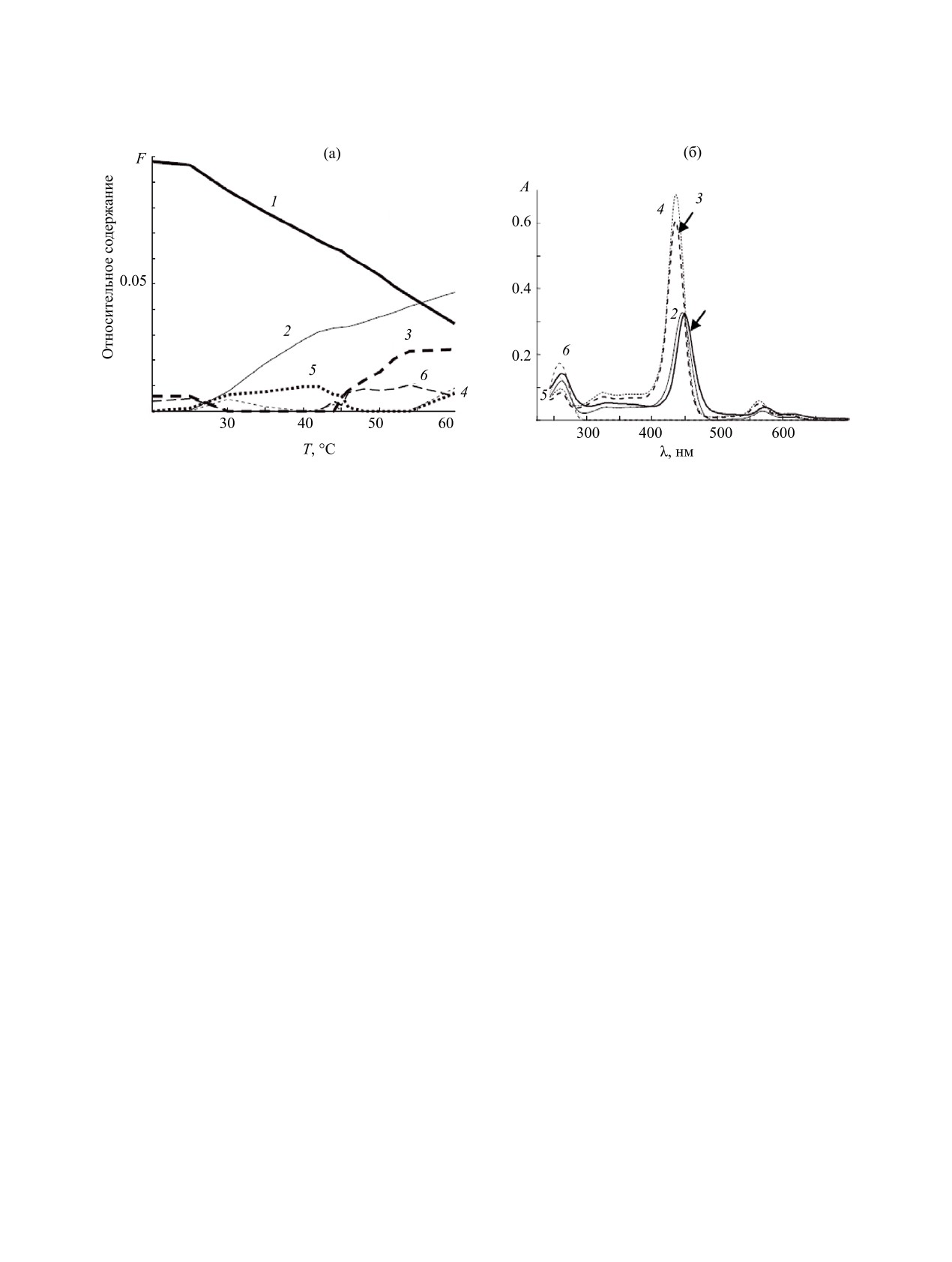
Рис. 3. Диаграмма изменения относительного содержания форм Poly[A]·Poly[U] и металлопорфирина Zn(Х)TMPyP4 при
изменении температуры (а) и спектры форм в видимой и УФ области спектра (б), вычисленные с помощью процедуры
KALS из матрицы А2. 1 - Poly[A]·Poly[U]*(ZnTMPyP4)n, 2 - частично диссоциированная форма ZnPPA_U, 3 - высокотем-
пературная форма Zn(Х)TMPyP4HT, 4 - Zn(Х)TMPyP4, 5 - Poly[A]·Poly[U], 6 - высокотемпературная форма PA_U.
В заключение можно отметить, что в настоя-
мерения проводили в диапазоне 230-700 нм на
щей работе, с применением хемометрики, впервые
средней скорости. Шаг сканирования спектра -
проведено количественное описание плавления
1 нм. Эксперименты по определению температуры
Poly(A)·Poly(U) в присутствии металлопорфири-
плавления проводили в закрытой ячейке. Темпе-
на Zn(X)TMPyP4, которое может быть полезно
ратуру поддерживали c помощи устройства Пель-
для более глубокого понимания характера связы-
тье. Спектры поглощения измерены в интервале
вания этих соединений. Математический анализ
температур 20-70°С с шагом 1-5°С и временем
матриц данных позволил установить, что при на-
выдержки 3 мин при каждом значении темпера-
гревании выше 45°С раствора, содержащего ком-
туры. В работе использованы кварцевые кюветы с
плекс Poly(A)·Poly(U)*(ZnTMPyP4)n, происходит
l = 1 см.
разрыв цепей дуплекса, который сопровождается
Poly(A)·Poly(U) растворяли в фосфатном бу-
диссоциацией тройного комплекса с частичным
фере (K2HPO4/KH2PO4), рН = 7.0. К раствору до-
выделением свободного Zn(X)TMPyP4. Также
бавляли KCl для достижения конечной ионной
впервые вычислены спектры химических форм
силы раствора I = 0.15 М. Отсутствие примесей
металлопорфирина, участвующих в температур-
в буферном растворе контролировали путем из-
ных превращениях: Zn(Х)TMPyP4HT и ZnPPA_U,
мерения ЭСП в УФ части спектра и спектра лю-
что может быть полезно для квантово-химическо-
минесценции. Вклад поглощения воды мал в из-
го моделирования.
учаемом диапазоне длин волн и дополнительно
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
компенсируется измерением спектра относитель-
Гидроксид калия KOH (Chemapol, ЧДА), ди-
но кюветы с буферным раствором. Концентрация
гидрофосфат калия KH2PO4 (РеаХим, ЧДА), на-
Poly(A)·Poly(U) в растворе одинакова во всех экс-
триевую соль синтетической полиадениловой-по-
периментах (сtMon = 10 мкМ.) и принята равной
лиуридиловой кислоты Poly(A)·Poly(U) (Sigma,
концентрации пар нуклеиновых оснований, кото-
содержание основного компонента 98%) исполь-
рые являются мономерными звеньями в полину-
зовали без дополнительной очистки. Методика
клеотидной цепи. Для достижения определенного
синтеза металлопорфирина Zn(X)TMPyP4 описа-
мольного отношения компонентов (M = сtMon/сtL)
на в работе [14].
в мерную колбу помещали микронавеску сухо-
Спектры поглощения регистрировали на дву-
го Poly(A)·Poly(U) и после полного растворения
лучевом спектрофотометре Shimadzu1800. Из-
полимера добавляли аликвоту раствора Zn(X)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1882
КУДРЕВ
TMPyP4 известной концентрации, а затем доводи-
Химический ранг R матрицы данных Аi равен
ли объем до метки при 25°С.
Rf, т. е. числу значимых главных компонент, кото-
рых достаточно чтобы восстановить исходную ма-
Хемометрическая процедура. Первым ша-
трицу в пределах уровня экспериментальной по-
гом примененного в настоящей работе хемоме-
грешности в случае, когда все химические формы
трического анализа данных является вычисление
спектрально активны. Исходя из допущения, что
числа основных факторов Rf, равное числу спек-
наименьший ранг С или S не может быть больше,
тральных форм в равновесной смеси, взаимопре-
чем общее число спектральных форм, следует, что
вращением которых обусловлена дисперсия аб-
ранг Аi также не может быть больше, чем общее
сорбции, измеренной при заданном наборе длин
число спектральных форм и равен числу химиче-
волн. Найденное значение Rf является ключевым
ских форм.
для дальнейшего математического моделирования
равновесия в системе. Ранг матриц данных вычис-
Сущность подхода, использованного для
лялся на основе метода главных компонент [33].
вычисления концентрационных профилей из
В результате применения метода главных компо-
матрицы спектрофотометрических данных,
состоит в том, что, согласно закону Бугера-Ламбер-
нент размерность набора данных, состоящих из
та-Бера, матрицу абсорбций i-го эксперимента Ai =
большого числа взаимосвязанных переменных,
Aexp(Np, Nw) [Np - число экспериментальных точек
сводится к новому набору переменных главных
(температур), Nw - число спектральных каналов]
компонент, которые сохраняют максимальный
можно представить в виде:
объем исходной информации. Число факторов Rf,
определяющих дисперсию, можно также найти из
Aexp = Cf ST + δ = CformET + δ =Acalc + δ.
(5)
расхождения между исходной матрицей и воспро-
Здесь Cf - матрица долей спектральных форм
изведенной с помощью метода сингулярного раз-
в растворе, S - матрица чистых спектров форм,
ложения (SVD, Matlab-2014a).
присутствующих в растворе, Acalc
- матрица,
Ai = USVT = URSRVRT + τi = Ai* + τi.
(2)
рассчитанная для предполагаемой модели рав-
новесных превращений, Cform(Np, R) - матрица
Здесь U, VT и S - матрицы, вычисленные с помо-
концентраций, EТ(R, Nw) - матрица молярных коэф-
щью процедуры SVD (Matlab-2014a), UR , VRT и SR -
фициентов поглощения всех спектральных форм,
матрицы, составленные соответственно из первых
δ(Np, Nw) - матрица экспериментальных погреш-
строк, столбцов и диагональных элементов матриц
ностей. Учитывая найденное ранее значение Rf,
U, VT и S; A* - воспроизведенная матрица Ai с по-
вычисляем начальное приближение SТ(Rf, Nw), ис-
мощью Rf факторов, τi - погрешность воспроизве-
пользуя процедуру PURE (Pure Variable Detection
дения.
Method) [34]. Данная процедура основана на мето-
(3)
де поиска так называемых чистых спектров форм.
Умножение обеих частей уравнения (5) на матри-
Число основных факторов Rf выбирается та-
цу S+, псевдообратную [35] матрице чистых спек-
ким, чтобы ошибка воспроизведения τi была мень-
тров, вычисленную c помощью PURE, дает оценку
ше, либо равна погрешности эксперимента (τi ≤ δi).
истинной матрицы Cf .
Для сравнения экспериментальных и вычис-
C* =AexpS+.
(6)
ленных матриц использован фактор Гамильтона.
Фактор Гамильтона (ошибка предсказания, %) вы-
Дальнейшее уточнение профилей C* прово-
числяли с помощью формулы (4).
дили с помощью итерационной процедуры ALS,
представленной в пакете MCR-ALS. Успешное
ALS-уточнение дает произведение матриц Cf и ST,
(4)
которое воспроизведет исходную матрицу данных
с точностью, как правило, превышающую экспе-
Здесь Trace - сумма диагональных элементов ма-
риментальную погрешность. Для минимизации
трицы, Ai =Fexp и A* = Fcalc
. При использовании
неопределенности математического решения ите-
уравнения (4) для вычисления расхождения кон-
рационный расчет выполнен с ограничением на
центрационных профилей, в качестве Fexp и Fcalc
неотрицательность концентраций и коэффициен-
выступают матрицы концентраций.
тов поглощения.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
СТАБИЛИЗАЦИЯ ДВУНИТЕВОГО Poly(A)·Poly(U)
1883
Графическое представление матрицы Cf в виде
17.
Thang M.N., Guschlbauer W. // Pathol. Biol. 1992.
диаграмы распределения форм металлопорфирина
Vol. 40. P. 1006.
в зависимости от температуры позволяет опреде-
18.
De Clercq E. // Top. Curr. Chem. 1974. Vol. 52. P. 173.
лить температура плавления Tm.
doi 10.1007/3-540-06873-2_17
19.
Saenger W. Principles of Nucleic Acid Structure. New
КОНФЛИКТ ИНТЕРЕСОВ
York: Springer-Verlag, 1988. 556 р.
Автор заявляет об отсутствии конфликта
20.
Barton J.K., Lippard S.J. // Biochem. 1979. Vol. 18.
интересов.
P. 2661.
СПИСОК ЛИТЕРАТУРЫ
21.
Ray A., Kumar G. S., Das S., Maiti M. // Biochem. 1999.
Vol. 38. P. 6239.
1.
Kim Y.-H., Lee C., Kim S.K., Jeoung S.C. // Biophys.
22.
He X., Li J., Zhanga H., Tan L. // Mol. BioSyst. 2014.
Chem. 2014. Vol. 190-191. P. 17. doi 10.1016/j.
Vol. 10. P. 2552. doi 10.1039/c4mb00304g
bpc.2014.03.005
2.
Alberti E., Zampakou M., Donghi D. // J. Inorg.
23.
Tan L.-F., Liu J., Shen J.-L., Liu X.-H., Zeng L.-L.,
Biochem. 2016. Vol. 163. P. 278. doi 10.1016/j.
Jin L.-H. // Inorg. Chem. 2012. Vol. 51. P. 4417. doi
jinorgbio.2016.04.021.
10.1021/ic300093h
3.
Choi J.K., D’Urso A., Balaz M. // J. Inorg. Biochem.
24.
Li J., Sun Y., Xie L., He X., Tan L. // J. Inorg. Bio-
2013. Vol. 127. P. 1. doi 10.1016/j.jinorgbio.2013.05.018
chem. 2015. Vol. 143. P. 56. doi 10.1016/j.jinorg-
4.
Kim Y.R., Gong L., Park J., Jang Y.J., Kim J., Kim S.K. //
bio.2014.12.007
J. Inorg. Biochem. 2012. Vol. 116. P. 2330. doi 10.1021/
25.
Li J., Sun Y., Zhu Z., Zhao H., Tan L. // J. Inorg. Bio-
jp212291r
chem. 2017. Vol. 161. P.128. doi 10.1016/j.jinorg-
5.
Gong L., Bae I., Kim S.K. // J. Phys. Chem. (B). 2012.
Vol. 116. P. 12510 doi 10.1021/jp3081063
bio.2016.04.024
6.
Gong L., Jang Y.J., Kim J., Kim S.K. // J. Phys. Chem.
26.
Ivanov M., Sizov V., Kudrev A. // J. Mol. Struct.
(B). 2012. Vol. 116. P. 9619. doi 10.1021/jp3041346
2020. Vol. 1202. P. 127365. doi 10.1016/j.mol-
7.
Zhou Z-X., Gao F., Chen X., Tian X-J., Ji L-N. // Inorg.
struc.2019.127365
Chem. 2014. Vol. 53. P. 10015. doi 10.1021/ic501337c
27.
Tauler R., de Juan A. In: Practical Guide to Chemom-
8.
Ghazaryan A.A., Dalyan Y.B., Haroutiunian S.G.,
etrics / Ed. P. Gemperline. Boca Raton; London; New
Tikhomirova A., Taulier N., Wells J.W., Chalikian T.V. //
York: Taylor&Francis Group, LLC, 2006. P. 421.
J. Am. Chem. Soc. 2006. Vol. 128. P. 1914. doi 10.1021/
28.
Tauler R., de Juan A. In: Practical Guide to Chemom-
ja054070n
9.
Tolstykh G., Kudrev A. // J. Mol. Struct. 2015. Vol. 1098.
etrics / Ed. P. Gemperline. Boca Raton; London; New
P. 342. doi 10.1016/j.molstruc.2015.06.031
York: Taylor&Francis Group, LLC, 2006. P. 453.
10.
Sabharwal N.C., Mendoza O., Nicoludis J.M., Ruan T.,
29.
Mergny J.-L., Yatsunyk L.A. // J. Biol. Inorg. Chem.
down_mcrt.html
2016. Vol. 21. P.227. doi 10.1007/s00775-015-1325-8
30.
Гаргалльо Р., Эритя Р., Кудрев А.Г. // ЖОХ.
2010.
11.
Briggs B.N., Gaier A.J., Fanwick P.E., Dogutan D.K.,
T. 80. С. 462; Gargallo R., Eritja R., Kudrev A. //
McMillin D.R. // Biochem. 2012. Vol. 51. P. 7496. doi
Russ. J. Gen. Chem. 2010. Vol. 80. P. 485. doi 10.1134/
10.1021/bi300828z
S1070363210030205
12.
Uno T., Aoki K., Shikimi T., Hiranuma Y., Tomisugi Y.,
Ishikawa Y. // Biochem. 2002. Vol. 41. P. 13059. doi
31.
Кудрев А.Г. // ЖOХ. 2017. Т. 87. С. 657; Kudrev A.G. //
10.1021/bi026139z
Russ. J. Gen. Chem. 2017. Vol. 87. P. 788. doi 10.1134/
13.
Qin T., Liu K., Song D., Yang C., Zhao H., Su H. //
S107036321704020X
Int. J. Mol. Sci. 2018. Vol. 19. P. 1071. doi 10.3390/
32.
Kudrev A. // Biopolymers. 2013. Vol. 99. P. 621. doi
ijms19041071
10.1002/bip.22227.
14.
Tolstykh G., Sizov V., Kudrev A. // J. Inorg. Bio-
33.
Jollife I.T. Principal Component Analysis. Berlin;
chem. 2016. Vol. 161. P. 83. doi 10.1016/j.jinorg-
London; New York: Springer Verlag, 2002. 487 p.
bio.2016.05.004
34.
Windig W., Guilment J. // Anal. Chem. 1991. Vol. 63.
15.
Pan J., Zhang S. // J. Biol. Inorg. Chem. 2009. Vol. 14.
P. 1425. doi 10.1021/ac00014a016.
P. 401. doi 10.1007/s00775-008-0457-5
16.
De Clercq E., Torrence P., De Somer V., Witkop B. // J.
35.
Golub G.H., Van Loan C.F. Matrix computations. Lon-
Biol. Chem. 1975. Vol. 250. P. 2521.
don: The Johns Hopkins Univ. Press, 1989. 687 p.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1884
КУДРЕВ
Stabilization of Double-Stranded Poly(A)·Poly(U)
with ZnTMPyP4 Metalloporphyrin in Aqueous Solution
A. G. Kudrev*
St. Petersburg State University, St. Petersburg, 190034 Russia
*e-mail: kudrevandrei@mail.ru
Received July 20, 2020; revised August 7, 2020; accepted August 14, 2020
UV-Vis absorption spectra of aqueous solutions containing both metalloporphyrin Zn(X)TMPyP4 [H2TMPyP4 -
5,10,15,20-tetrakis(1-methylpyridin-4-yl)-21H,23H-porphyrin] and synthetic polyadenylic-polyuridylic acid
Poly(A)·Poly(U) in the temperature range from 20 to 70°C (pH = 7.0, I = 0.15 M.) were analyzed. Decon-
volution of the spectrometric data matrix, without postulating a physicochemical equilibrium model, made it
possible to estimate the contribution of the Poly(A)·Poly (U)*(ZnTMPyP4)n complex to the total change in the
spectra Chemometric analysis showed an increase in the melting temperature of this ternary complex by 9.4°С
compared to pure polyribonucleotide, which indicates the stabilization of bonds between nucleic bases in the
Poly(A)·Poly(U) polynucleotide under the influence of bound porphyrin.
Keywords: biopolymer stabilization, Poly(A)·Poly(U), ZnTMPyP4, chemometric analysis, spectrophotometry
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020