ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 12, с. 1885-1892
УДК 547.979.057:661.7.091
СИНТЕЗ И СВОЙСТВА МЕТАЛЛОКОМПЛЕКСОВ
ОКТА(4-ЦИКЛОГЕКСИЛФЕНОКСИ)ФТАЛОЦИАНИНОВ
© 2020 г. С. А. Знойко*, Н. А. Толстых, А. И. Михайлова, И. В. Новиков,
А. С. Вашурин, В. Е. Майзлиш
Научно-исследовательский институт химии макрогетероциклических соединений, Ивановский государственный
химико-технологический университет, Шереметевский пр. 7, Иваново, 153000 Россия
*е-mail: znoykosa@yandex.ru
Поступило в Редакцию 16 октября 2020 г.
После доработки 22 октября 2020 г.
Принято к печати 24 октября 2020 г.
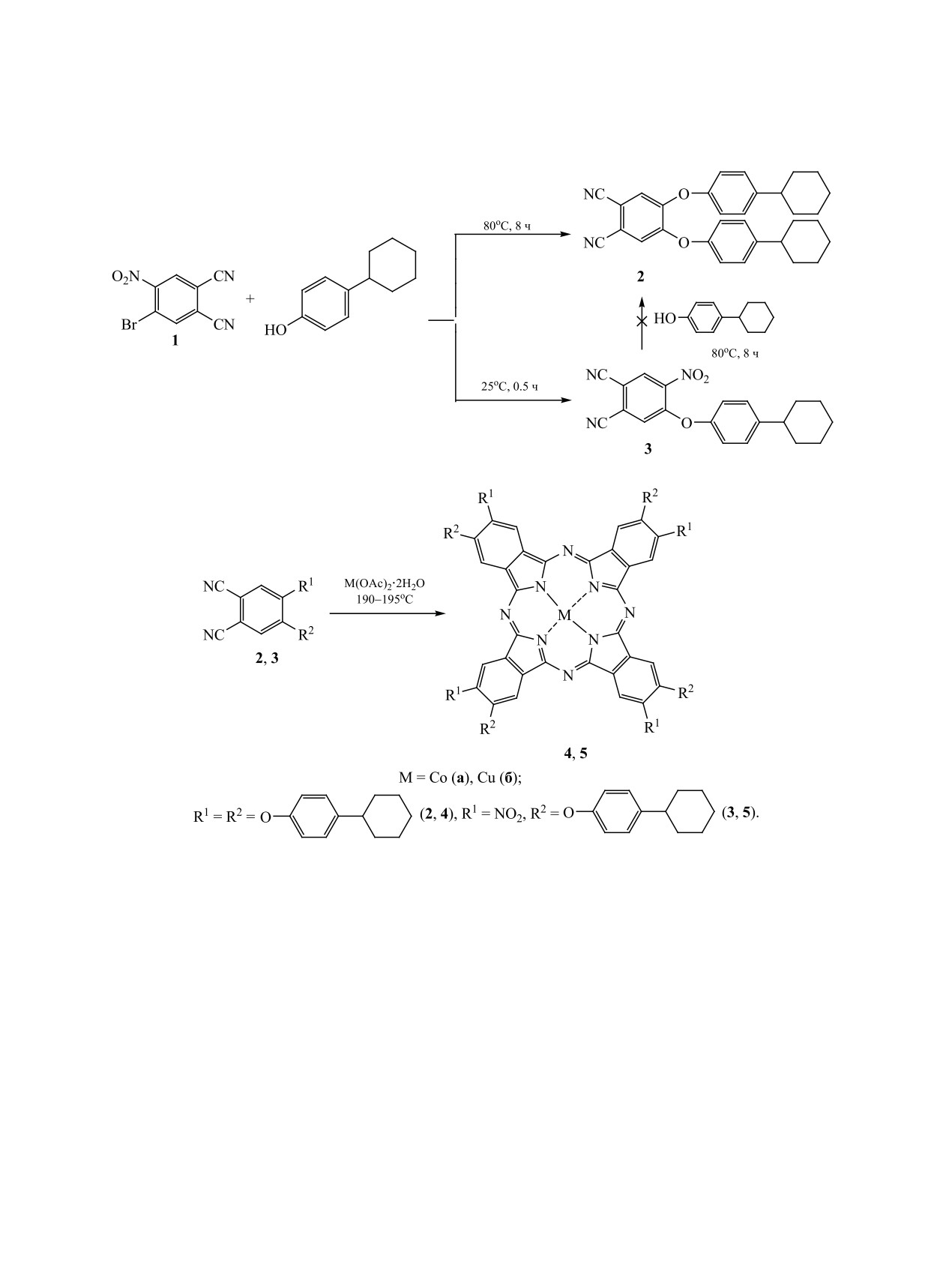
На основе 4-бром-5-нитробензол-1,2-дикарбонитрила получены фталонитрилы с п-циклогексилфе-
ноксигруппами, на основе которых синтезированы октазамещенные фталоцианины кобальта и меди,
охарактеризованные спектральными методами.
Ключевые слова: 4-бром-5-нитрофталонитрил, фталоцианины, сульфокислоты, электронные спектры
поглощения
DOI: 10.31857/S0044460X20120112
Производные фталоцианина, благодаря широ-
лонитрил с двумя
4-циклогексилфеноксигруп-
кой вариабельности структуры за счет возмож-
пами. Синтез
4,5-бис(4-циклогексилфенокси)
ности введения атомов различных химических
бензол-1,2-дикарбонитрила 2 проводили путем за-
элементов в координационный центр или заме-
мещения атома брома и нитрогруппы в соединении
стителей на периферию этих соединений, рассма-
1 на 4-циклогексилфенольные фрагменты (схема 1)
в среде водного ДМФА при 80°С в присутствии
триваются как перспективные исходные соеди-
K2CO3, выступающего в качестве депротонирую-
нения для создания новых наноматериалов [1, 2].
щего агента [14-16], продолжительность синтеза -
Незамещенные фталоцианины малорастворимы в
8 ч. Уменьшение длительности взаимодействия
большинстве органических растворителей [1, 2].
не позволяло получить соединение 2 в качестве
Для придания растворимости в бензольные коль-
единственного продукта реакции. Введение одной
ца изоиндольных фрагментов фталоцианиновой
4-циклогексилфеноксигруппы в молекулу соеди-
молекулы вводят объемистые или протяженные
нения 1 протекает за 0.5 ч при комнатной темпе-
алкильные [3-5] или арильные [6, 7] заместите-
ратуре [17]. Получить фталонитрил 2 нуклеофиль-
ли. Введение в бензольные кольца фталоцианина
ным замещением нитрогруппы в соединении 3
циклогексильных заместителей придает получен-
(схема 1) не удалось, по-видимому, вследствие ее
ным соединениям растворимость в хлороформе,
сильной дезактивации и стерических затруднений,
способность формировать мезофазы в растворе
создаваемых 4-циклогексилфеноксигруппой в мо-
или при нагревании [8, 9], а также каталитические
лекуле соединения 3.
[10], сенсорные [11], флуоресцентные [12] свой-
Соединение 2 охарактеризовано данными эле-
ства, фотодинамическую активность [13].
ментного анализа, масс-спектрометрии (MALDI-
Нами получены металлокомплексы фталоциа-
TOF), ИК спектроскопии. В масс-спектре соедине-
нинов с 4-циклогексилфеноксигруппами и изуче-
ния 2 обнаружены сигналы молекулярного иона, а
ны их некоторые физико-химические свойства. На
в ИК спектре - полосы валентных колебаний ме-
первом этапе работы на основе 4-бром-5-нитро-
тиленовых групп, связи C≡N, а также полоса коле-
бензол-1,2-дикарбнитрила
1 синтезирован фта-
баний связей Ar-O-Ar [18].
1885
1886
ЗНОЙКО и др.
Схема 1.
Схема 2.
Температура плавления 4,5-бис(4-циклогексил-
чательное разложение соединения 2. На кривой
фенокси)бензол-1,2-дикарбонитрила 2 составляет
ДСК присутствуют два экзопика при 254 и 592°С.
132-135°С, тогда как точка плавления соединения
При нагревании соединений 2 и 3 с ацетатами
3 [17] находится в области более высоких темпе-
кобальта и меди синтезированы соответствующие
ратур (155-157°С [17]), что, по-видимому, обу-
металлофталоцианины (схема 2).
словлено межмолекулярными взаимодействиями с
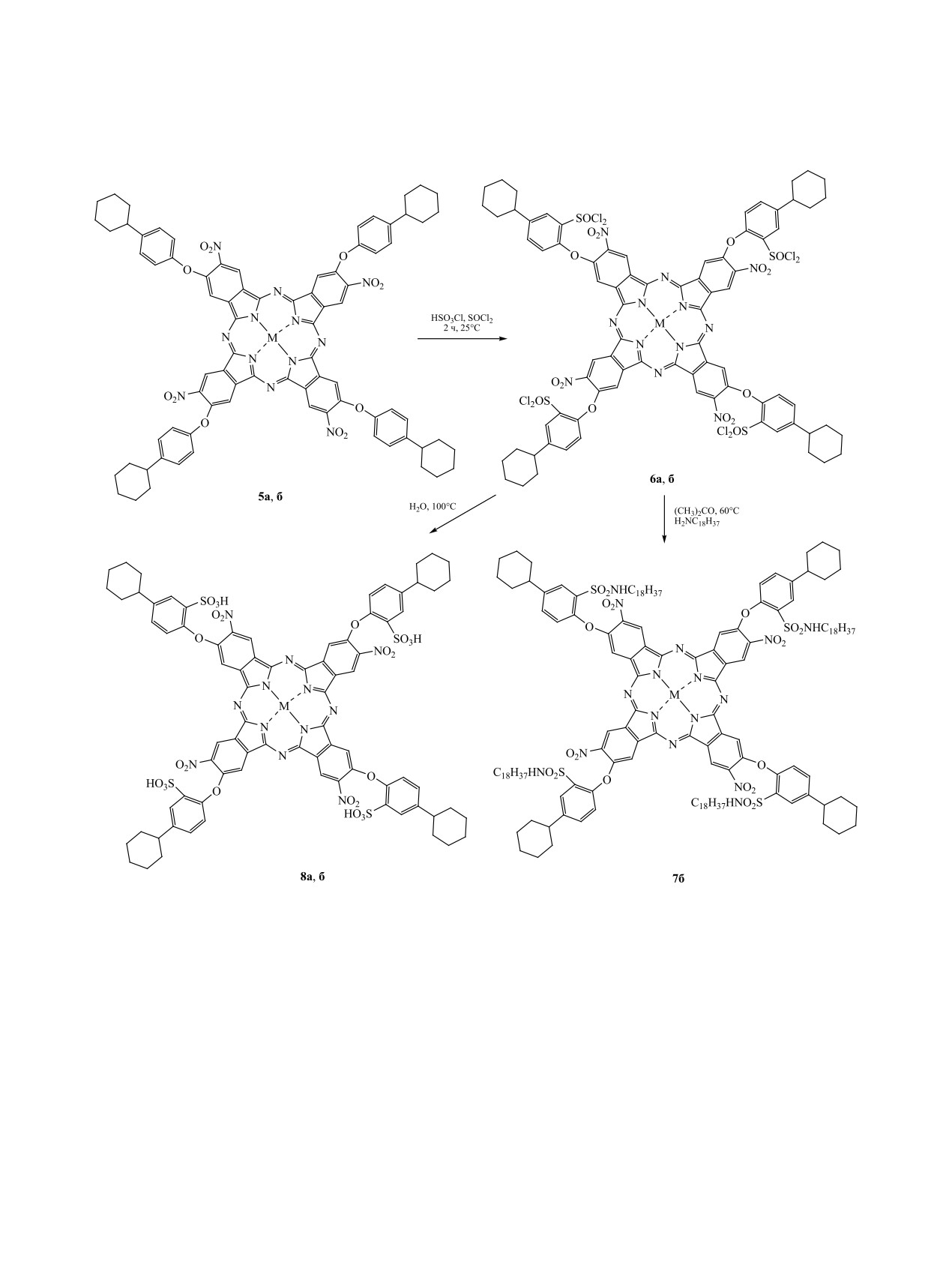
Соединение 5б далее вводили в реакцию со
участием нитрогруппы.
смесью тионилхлорида и хлорсульфоновой кисло-
При исследовании соединения 2 методом диф-
ты (схема 3). Взаимодействие полученного суль-
ференциальной сканирующей калориметрии вы-
фохлорида 6б с октадециламином приводило к об-
явлен эндопик при 133°С. Термодеструкция начи-
разованию сульфонамида 7б. Сульфокислоты 8а, б
нается при 221°С и протекает в два этапа, первый
из которых сопровождается убылью массы на 36%
получали гидролизом сульфохлоридов 6а, б [17].
вследствие отщепления одной из 4-циклогексил-
Получить сульфохлориды из металлокомплексов
феноксигрупп. На втором этапе происходит окон-
окта[4,5-(4-циклогексилфенокси)]фталоцианина с
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
НАЗВАНИЕ
1887
Схема 3.
медью и кобальтом 4а, б в тех же условиях, что
Отмечено небольшое батохромное смещение по-
из фталоцианина 5б, не удалось из-за нераствори-
лосы Q при переходе от комплексов с кобальтом
мости комплексов 4а, б в смеси хлорсульфоновой
к фталоцианинам меди. Кроме того, наблюдается
кислоты и тионилхлорида.
небольшой батохромный сдвиг (3 нм, хлороформ)
при замене нитрогрупп в соединениях 5а, б на
Полученные производные фталоцианина иден-
4-циклогексилфеноксигруппы (4а, б). Oбнаружен
тифицировали с привлечением данных масс-спек-
трометрии, элементного анализа, ИК и электрон-
сольватохромный эффект, проявляющийся в ба-
тохромном сдвиге полосы Q исследуемых соеди-
ной спектроскопии. Как можно видеть из данных
нений при замене ДМФА на хлороформ.
таблицы, природа металла-комплексообразователя
влияет на положение полос поглощения в элек-
Bведение в циклогексилфеноксигруппу окта-
тронных спектрах синтезированных соединений.
децилсульфамоильных заместителей вызывает
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1888
ЗНОЙКО и др.
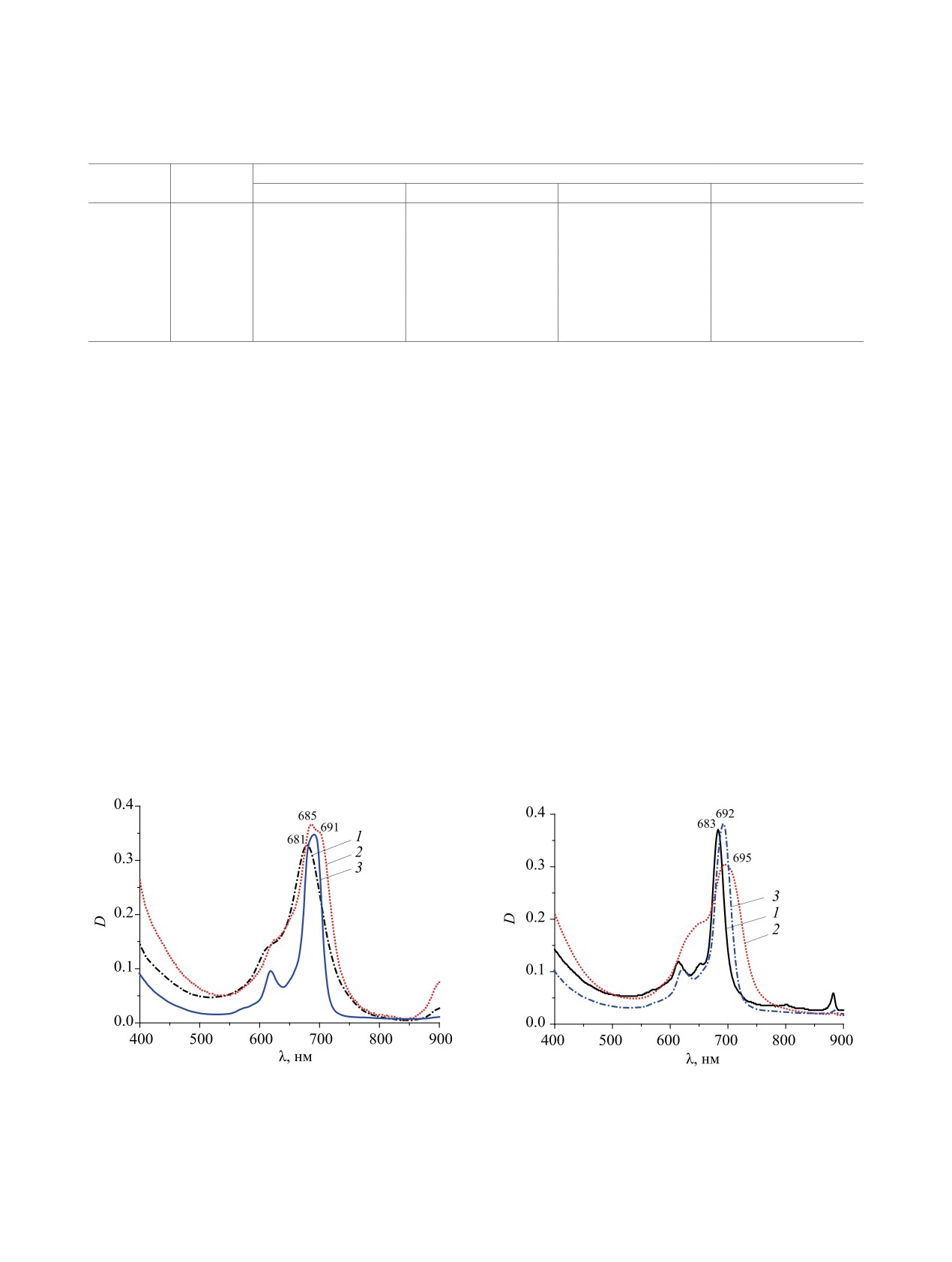
Параметры электронных спектров поглощения фталоцианинов 4, 5, 7, 8
λmax, нм
№
M
ДМФА
CHCl
3
H2O
H2SO4
4а
Со
680
684
-
-
4б
Cu
683
687
-
-
5аa
Co
678
681
-
782
5бa
Cu
679
683
-
795
7б
Cu
685
695
-
789
8аa
Со
677
-
644
777
8б
Cu
683
-
651
785
а Данные из работы [17].
батохромный сдвиг основных полос поглощения
тра{4-[4-циклогексил-2-(октадецилсульфамоил)-
в органических растворителях и гипсохромный
фенокси]}тетра(5-нитро)фталоцианина меди 7б с
сдвиг - в серной кислоте (см. таблицу, рис. 1).
его бензотриазолилзамещенным аналогом обнару-
При сравнении полученного нами октадецил-
жено, что природа заместителя-электроноакцепто-
сульфамоилпроизводного тетра[4-(4-циклогексил-
ра практически не влияет на положение полосы Q
фенокси)]тетра(5-нитро)фталоцианина меди 7б и
в этом растворителе (см. таблицу). Комплексы ок-
ранее полученного тетра[4-(бензотриазол-1-ил)]-
та[4,5-бис(4-циклогексилфенокси)]фталоцианина
тетра[5-(4-циклогексил-2-октадецилсульфамоил)-
с медью и кобальтом совершенно не растворяются
фенокси]фталоцианина меди [19] зафиксирован
в концентрированной серной кислоте.
гипсохромный сдвиг полосы Q в хлороформе
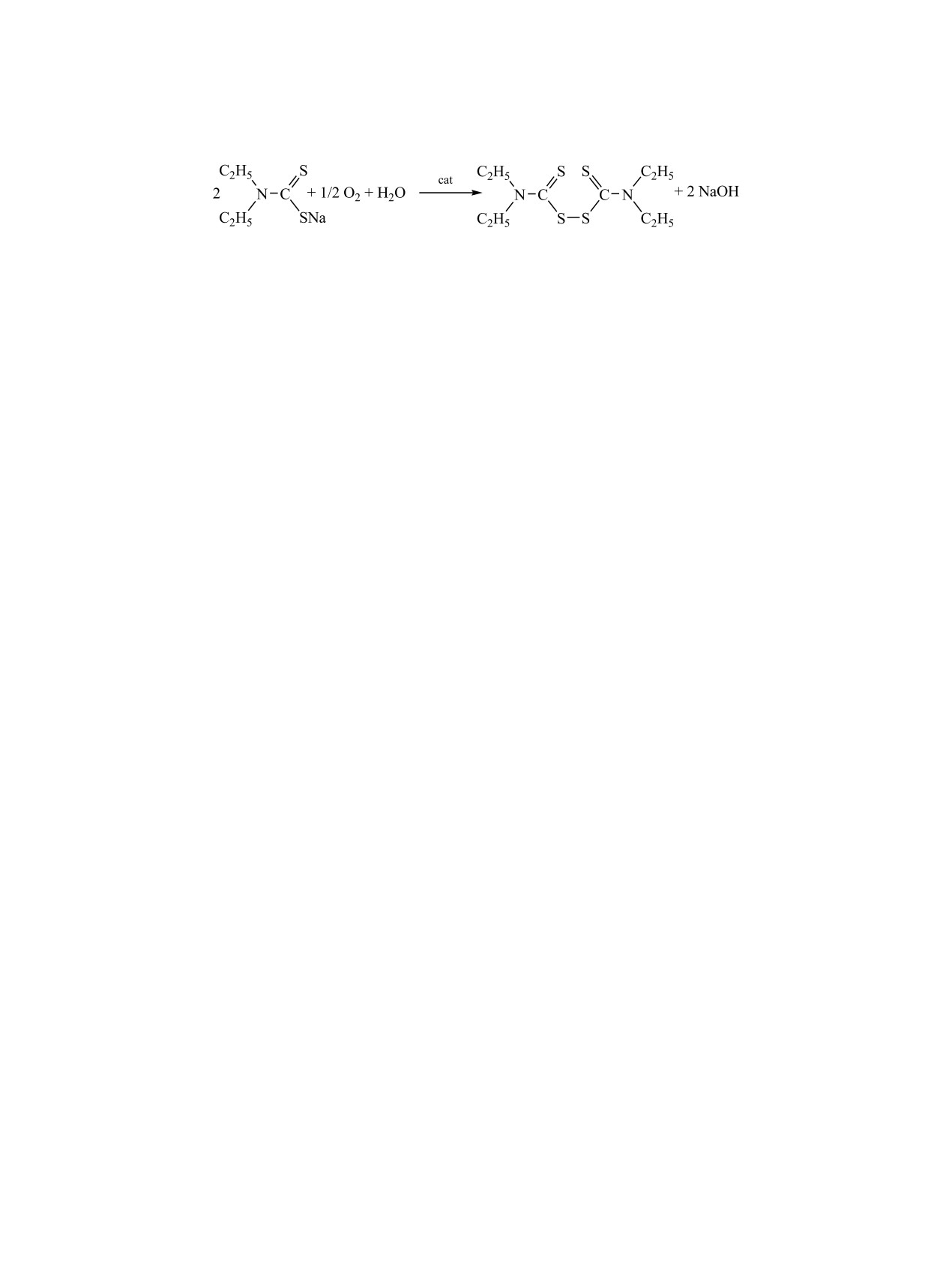
Каталитическая активность тетра[4-(4-цикло-
(рис. 2) и небольшой батохромный сдвиг - в ДМФА
гексил-2-сульфофенокси)]фталоцианина кобаль-
(рис. 1). Положение полосы Q в концентрирован-
та 8а измерена по известной методике [22, 23] на
ной серной кислоте не зависит от природы введен-
примере реакции окисления N,N-диэтилкарбамо-
ного в орто-положение циклогексилфеноксигруп-
дитиоата натрия (схема 4).
пы акцепторного фрагмента (см. таблицу).
Обнаружена каталитическая активность водо-
В концентрированной серной кислоте на-
блюдается батохромный сдвиг полосы Q соеди-
растворимого соединения 8а в реакции гомоген-
нения 7б более чем на 100 нм, обусловленный
ного жидкофазного окисления диэтилкарбамоди-
протонированием по мезо-атомам азота фталоциа-
тиоата натрия. Эффективная константа скорости
нинового макрокольца [20, 21]. При сравнении те-
окисления составляет 15×10-5 c-1.
Рис. 1. Электронные спектры поглощения соеди-
Рис. 2. Электронные спектры поглощения 5б (1), 7б
нений 5б (1), 7б (2) и тетра[4-(1-бензотриазолил)]-
(2) и тетра[4-(1-бензотриазолил)]тетра[5-(4-циклогек-
тетра[5-(4-циклогексил-2-октадецилсульфамоилфен-
сил-2-октадецилсульфамоилфенокси)]фталоцианина
окси)]фталоцианина меди (3) в ДМФА.
меди (3) в хлороформе.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
НАЗВАНИЕ
1889
Схема 4.
Таким образом, нами синтезирован новый
го термического анализа STA 449 F3 Jupiter Netzsch
4,5-бис(4-циклогексилфенокси)бензол-1,2-ди-
(Германия) в атмосфере кислород-аргон, скорость
карбонитрил, на основе которого получены соот-
нагрева - 5 град/мин, материал тигля - платина.
ветствующие фталоцианины меди и кобальта, а
Перед проведением элементного и термограви-
также октадецилсульфамоил производное тетра-
метрического анализа образцы исследуемых сое-
[4-(4-цикло-гексилфенокси)]тетра(5-нитро)фтало-
динений подвергали термообработке при 110°С в
цианина меди. Фталоцианины c восемью 4-цикло-
течение 2 ч.
гексилфеноксигруппами нерастворимы в концен-
4-Бром-5-нитробензол-1,2-дикарбонитрил
трированной серной кислоте. При замене нитро-
(1) получали по методике [24]. Выход 37.6%, т. пл.
групп на 4-циклогексилфеноксигруппы наблюда-
140-142°С. Масс-спектр, m/z: 252 [M]+. Найдено,
ется небольшой батохромный сдвиг в хлороформе
%: C 38.10; Н 0.68; N 16.50. C8H2BrN3O2. Вычис-
при переходе от соответствующих комплексов
лено, %: C 38.16; Н 0.80; N 16.67.
с кобальтом к фталоцианинам меди, а также при
4,5-Бис(циклогексилфенокси)бензол-1,2-ди-
введении октадецилсульфамоильных групп в
карбонитрил (2). Смесь 0.25 г (1 ммоль) дикар-
4-циклогексилфеноксигруппу.
бонитрила 1 и 0.36 г (2 ммоль) 4-циклогексилфе-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
нола растворяли в 50 мл ДМФА, к полученной
смеси прибавляли раствор 0.28 г (2 ммоль) K2CO3
Электронные спектры поглощения записывали
в 5 мл воды. Реакционную смесь перемешивали
в ДМФА и хлороформе, в водно-щелочных средах
8 ч при 70-80°С, затем выливали в воду. Образо-
и в концентрированной серной кислоте на спек-
вавшийся осадок отфильтровывали и промывали
трофотометре HITACHI U-2001 при комнатной
пропан-2-олом, затем - водой и сушили на воздухе
температуре в диапазоне длин волн 325-900 нм.
при 80-90°С. Выход 3.33 г (70%), т. пл. 122-125°С.
ИК спектры регистрировали на приборе Avatar 360
ИК спектр, ν, см-1: 2887, 2929 (СН2), 2227 (C≡N),
FT-IR ESP в области 4000-400 см-1 в тонких плен-
1222 (Ar-O-Ar). Масс-спектр (MALDI-TOF), m/z:
ках (хлороформ) и в таблетках с бромидом калия.
476 [M]+. Найдено, %: C 80.50; H 6.48; N 5.80.
Элементный анализ выполняли на элементном
C32H32N2O2. Вычислено, %: C 80.64; H 6.77; N 5.88.
анализаторе CHNS-O FlashEA 1112 series. Спектры
ЯМР 1Н 5%-ных растворов соединений в CDCl3
4-(4-Циклогексилфенокси)-5-нитробен-
регистрировали на приборе Bruker DRX-500, вну-
зол-1,2-дикарбонитрил (3) получали по методике
тренний стандарт - тетраметилсилан. Масс-спек-
[17]. Выход 63%, т. пл. 155-157°С. ИК спектр, ν,
тры (MALDI-TOF) получены на масс-спектроме-
см-1: 3082, 3007 (СН2), 2233 (C≡N), 1529 [νas(NO2)],
тре Shimadzu Biotech Axima Confidence в режиме
1380 [νs(NO2)], 1218 (Ar-O-Ar). Спектр ЯМР 1Н, δ,
регистрации положительных ионов. В качестве
м. д.: 8.35 с (1Н, Н1), 7.73 с (1Н, Н2), 7.13-7.15 м
матрицы использовали 2,5-дигидроксибензойную
(4Н, Н3,4), 3.36 с (1Н, Н5), 2.88 м (10Н, Н6,7). Масс-
кислоту. Образцы готовили растворением соеди-
спектр, m/z: 346 [M - Н]+. Найдено, %: С 69.00; H
нений в хлороформе (с = 10-4-10-5 моль/л), затем
5.05; N 12.46. С20H17N3O3.Вычислено, %: С 69.15;
смешивали в соотношении 1:1 (по объему) с рас-
H 4.93; N 12.82.
твором матрицы (30 мг/мл) в тетрагидрофуране.
Замещенные фталоцианины с 4-циклогек-
Температуры фазовых переходов измеряли
силфеноксигруппами (общая методика). Тща-
методом термомикроскопии на термостолике,
тельно растертую смесь 0.24 г (0.5 ммоль) соеди-
поддерживая температуру с допуском +/-0.1°, со
нения 2, 0.05 г (0.8 ммоль) мочевины и 1 ммоль
скоростью нагрева 0.3-0.5 град/мин. Исследова-
ацетатов меди моногидрата или кобальта тетраги-
ние термоокислительной деструкции полученных
драта нагревали 2 ч при 195-200°С. Реакционную
фталонитрилов проводили на приборе синхронно-
массу промывали разбавленной соляной кислотой
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1890
ЗНОЙКО и др.
для удаления продуктов разложения мочевины, за-
экстрагировали ацетоном. К экстрату прибавляли
тем водой до исчезновения реакции на хлорид-а-
8-кратный мольный избыток (0.22 г) октадеци-
нионы с нитратом серебра и сушили на воздухе
ламина и кипятили 1.5 ч при 60°С. Ход реакцию
при 70-80°С. Полученное вещество растворяли в
контролировали по полноте растворения пробы
хлороформе и хроматографировали на колонке с
реакционной массы в хлороформе. По окончании
оксидом алюминия, элюент - хлороформ. Получи-
реакции ацетон отгоняли, продукты реакции экс-
ли твердое темно-зеленое вещество, не раствори-
трагировали из реакционной массы хлороформом
мое в воде, хорошо растворимое в хлороформе и
и хроматографировали на колонке с силикагелем
ДМФА.
М 60, элюент - хлороформ. Получали твердое
Окта[4,5-(4-циклогексилфенокси)]фталоци-
темно-зеленое вещество, ограничено растворимое
анин кобальта (4а) получали из соединения 2 и
в ДМФА, хорошо растворимое в бензоле, ацето-
0.21 г ацетата кобальта тетрагидрата при 195°С.
не, хлороформе. Выход 197 мг (71%). ИК спектр
Выход 0.21 г (91%). ИК спектр, ν, см-1: 2847, 2919
(KBr), ν, см-1: 3063 (N-H), 2920, 2861 (CH2, CH3),
(СН2), 1200 (Ar-O-Ar). Масс-спектр, m/z: 1966.51
1631 [δ(NH)], 1550 [νas(NO2)], 1364 [νs(NO2)], 1312
[M + Н]+. Найдено, %: С 76.81; H 6.89; N 5.55.
[δ(NH)], 1238 (Ar-O-Ar),
1141
[νs(S=O)],
1108
С128H128CoN8O8. Вычислено: С 78.22; H 6.56; N
(C-S). Найдено, %: C 67.20; H 8.03; N 7.42; S 4.33.
5.70.
C152H216CuN16O20S4. Вычислено, %: C 65.69; H
Окта[4,5-(4-циклогексилфенокси)]фталоци-
7.83; N 8.06; S 4.61.
анин меди (4б) получали из соединения 2 и 0.22 г
Тетра[4-(4-циклогексил-2-сульфофенокси)]-
ацетата меди моногидрата при 200°С. Выход 0.20
тетра(5-нитро)фталоцианин кобальта (8а) по-
г (89%). ИК спектр, ν, см-1: 2924, 2849 (СН2), 1201
лучали по методике [17]. Выход 87%. ИК спектр, ν,
(Ar-O-Ar). Масс-спектр, m/z: 1970.12 [M]-. Най-
см-1: 2924, 2857 (CH2, CH3), 1551 [νas(NO2)], 1370
дено, %: С 77.91; H 7.01; N 5.58. С128H128CuN8O8.
[νs(NO2)], 1238 (Ar-O-Ar), 1135 [νs(S=O)], 1108
Вычислено, %: С 78.04; H 6.55; N 5.69.
(C-S). Найдено, %: С 53.91; H 4.11; N 21.32; S 7.10.
Тетра[4-(4-циклогексилфенокси)]тетра-
С80H68CоN12O24S4. Вычислено, %: С 54.33; H 3.88;
(5-нитро)фталоцианин кобальта (5а) получали
N 21.71; S 7.25.
по методике [17]. Выход 0.32 г (89 %). ИК спектр,
ν, см-1: 2998 (СН2), 1532 [νas(NO2)], 1380 [νs(NO2)],
Тетра[4-(4-циклогексил-2-сульфофенокси)]-
1216 (Ar-O-Ar). Масс-спектр, m/z:
1449.50
тетра(5-нитро)фталоцианин меди (8б) получа-
[M + Н]+. Найдено, %: С 66.01; H 4.89; N 11.44.
ли по методике [17]. Выход 91%. ИК спектр, ν,
С80H68CoN12O12. Вычислено: С 66.34; H 4.73; N
см-1: 2918, 2860 (CH2, CH3), 1550 [νas(NO2)], 1366
11.60.
[νs(NO2)], 1241 (Ar-O-Ar), 1140 [νs(S=O)], 1107
Тетра[4-(4-циклогексилфенокси)]тетра-
(C-S). Найдено, %: С 53.91; H 4.02; N 21.28; S 7.18.
(5-нитро)фталоцианин меди (5б) получали по ме-
С80H68CuN12O24S4. Вычислено, %: С 54.19; H 3.87;
тодике [17]. Выход 0.30 г (82 %). ИК спектр, ν, см-1:
N 21.65; S 7.23.
3000 (СН2), 1530 [νas(NO2)], 1381 [νs(NO2)], 1217
ФОНДОВАЯ ПОДДЕРЖКА
(Ar-O-Ar). Масс-спектр, m/z: 1453.13 [M]-. Найде-
но, %: С 65.91; H 5.01; N 11.58. С80H68CuN12O12.
Работа выполнена при поддержке Министер-
Вычислено: С 66.13; H 4.72; N 11.57.
ства образования и науки Российской Федерации
Tетра{4-[4-циклогексил-2-(октадецилсуль-
(тема № FZZW-2020-0008) и также Президента РФ
фамоил)фенокси]}тетра(5-нитро)фталоцианин
(МК-204.2019.3) с использованием оборудования
меди (7б). Смесь 0.14 г (0.1 ммоль) соединения
Центра коллективного пользования Ивановского
4б, 2 мл (18 ммоль) хлорсульфоновой кислоты и
государственного химико-технологического уни-
2 мл (18 ммоль) тионилхлорида перемешивали при
верситета.
комнатной температуре в течение 2 ч. По оконча-
КОНФЛИКТ ИНТЕРЕСОВ
нии реакции смесь выливали на лед с хлористым
натрием. Осадок отфильтровывали и сушили 3 сут
Авторы заявляют об отсутствии конфликта
в эксикаторе над серной кислотой. Сульфохлорид
интересов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
НАЗВАНИЕ
1891
СПИСОК ЛИТЕРАТУРЫ
15.
Абрамов И.Г., Смирнов А.В., Ивановский С.А., Абра-
мова М.Б., Плахтинский В.В. // ХГC. 2000. Т. 36.
1.
Wohrle D., Schnurpfeil G., Makarov S.G., Kazarin A.,
№ 9. С. 1219; Abramov I.G., Smirnov A.V., Ivanov-
Suvorova O.N. // Macroheterocycles. 2012. Vol. 5. N 3.
skii S.A., Abramova M.B., Plachtinsky V.V. // Chem.
P. 191. doi 10.6060/mhc2012.120990w
Heterocycl. Compd. 2000. Vol. 36. N 9. P. 1062. doi
2.
The Porphyrin Handbook / Eds K.M. Kadish, K.M.
10.1023/A:1002786015976
Smith, R. Guilard. San Diego: Academic Press, 2003.
16.
Знойко С.А., Савинова А.И., Майзлиш В.Е., Шапош-
Vol. 16. 285 p.
ников Г.П., Абрамов И.Г. // ЖOX. 2016.Т. 86. Вып. 6.
3.
Cammidge A.N., Tseng Chiung-Hui, Chambrier I.,
C. 1016; Znoyko S.A., Savinova A.I., Maizlish V.E.,
Hughes D.L., Cook M.J. // Tetrahedron Lett. 2009.
Shaposhnikov G.P., Abramov I.G. // Russ. J. Gen.
Vol. 50. P. 5254. doi 10.1016/j.tetlet.2009.07.016
Chem. 2016. Vol. 86. N 6. P. 1345. doi 10.1134/
4.
İşci Ü., Dumoulin F., Ahsen V., Sorokin A.B. // J.
S1070363216060207
Porph. Phthal. 2010. Vol. 14. P. 324. doi 10.1142/
17.
Знойко С.А., Тихомирова Т.В., Петлина А.И., Нови-
S1088424610002069
ков И.В., Вашурин А.С., Койфман О.И. // Изв. АН.
5.
Zorlu Y., İşci Ü., Un I., Kumru U., Dumoulin F.,
Сер. хим. 2019. № 6. С. 1271; Znoiko S.A., Tikhomiro-
Ahsen V. // Struct. Chem. 2013. Vol. 24. P. 1027. doi
va T.V., Petlina A.I., Novikov I.V., Vashurin A.S.,
10.1007/s11224-012-0126-8
Koifman O.I. // Russ. Chem. Bull. 2019.Vol. 68. N 6.
6.
Basova T., Hassan A., Durmus M., Gürek A.G.,
P. 1271. doi 10.1007/s11172-019-2552-x
Ahsen V. // Coord. Chem. Rev. 2016. Vol. 310. P. 131.
18.
Смит А. Прикладная ИК-спектроскопия. Основы,
doi 10.1016/j.ccr.2015.11.005
техника, аналитическое применение. М.: Мир, 1982.
7.
Tekdas D.A., Gürek A.G., Ahsen V. // J. Porph. Phthal.
328 с.
2014. Vol. 18. P. 899. doi 10.1142/S1088424614500709
19.
Знойко С.А., Бумбина Н.В., Акопова О.Б., Берези-
8.
Li Q., Li L. In: Thermotropic Liquid Crystal / Ed.
на Г.Р., Смирнова А.И., Усольцева Н.В., Майзлиш В.Е.,
A. Ramamorthy. Dordrecht: Springer, 2007. P. 297.
Шапошников Г.П. // Жидкие кристаллы и их прак-
9.
Усольцева Н.В., Акопова О.Б., Быкова В.В., Смир-
нова А.И., Пикин С.А. Жидкие кристаллы: дискоти-
тическое использование. 2017. Т. 17. № 1. С. 56. doi
10.18083/Appl.2017.1.56
ческие мезогены. Иваново: Иван. гос. унив. 2004.
546 с.
20.
Шапошников Г.П., Кулинич В.П., Майзлиш В.Е. Мо-
10.
Enow C.A., Marais C., Bezuidenhoudt B.C.B. // J.
дифицированные фталоцианины и их структурные
Porph. Phthal. 2014. Vol. 18. P. 582. doi 10.1142/
аналоги. М.: КРАСАНД. 2012. 480 с.
S108842461450103X
21.
Березин Б.Д., Березин Д.Б. Хромофорные системы
11.
Kakı E., Özkaya A.R., Altındal A., Salihc B., Bekaroğlu
макроциклов и линейных молекул. М.: URSS, 2013.
Ö. // Sensors and Actuators (B). 2013. Vol. 188. P. 1033.
240 с.
doi 10.1016/j.snb.2013.07.103
22.
Vashurin A.S., Kuzmin I.A., Mayzlish V., Razumov M.,
12.
Romero M.P., Gobo N.R.S., de Oliveira K.T., Iamamoto Y.,
Golubchikov O., Koifman O. // J. Serb. Chem. Soc. 2016.
Serra O.A., Louro S.R.W. // J. Photochem.
Vol. 81. N 9. P. 1025. doi 10.2298/JSC160105048V
Photobiol. (A). 2013. Vol. 253. P. 22. doi 10.1016/j.
23.
Tyapochkin E.M., Kozliak E.I. // J. Mol. Catal. (A). 2005.
jphotochem.2012.12.009
Vol. 242. N 1-2. P. 1. doi 10.1016/j.molcata.2005.07.008
13.
Zheng B.-Y., Jiang X.-J., Lin T., Ke M.-R., Huang J.-D. //
24.
Шишкина О.В., Майзлиш В.Е., Шапошников Г.П.,
Dyes and Pigments. 2015. Vol. 112. P. 311. doi
Любимцев А.В., Смирнов Р.П., Бараньски A. //
10.1016/j.dyepig.2014.07.029
ЖOX. 1997. Т. 67. Вып. 5. С. 842; Shishkina O.V.,
14.
Abramov I.G., Smirnov A.V., Plakhtinskii V.V.,
MaizlishV.E., Shaposhnikov G.P., Lubimtsev A.V.,
Krasovskaya G.G. // Mendeleev Commun. 2002. Vol. 2.
Smirnov R.P., Baran’sky A. // Russ. J. Gen. Chem. 1997.
P. 72. doi 10.1070/MC2002v012n02ABEH001538
Vol. 67. N 5. P. 793.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1892
ЗНОЙКО и др.
Synthesis and Some Properties of Metal Complexes
with Octa(4-cyclohexylphenoxy)phthalocyanines
© 2020 S. A. Znoiko*, N. A. Tolstykh, A. I. Mikhailova, I. V. Novikov,
A. S. Vashurin, and V. E. Maizlish
Research Institute of Chemistry of Macroheterocyclic Compounds, Ivanovo State University of Chemistry and Technology,
Ivanovo, 153000 Russia
*e-mail: znoykosa@yandex.ru
Received October 16, 2020; revised October 22, 2020; accepted October 24, 2020
Phthalonitriles bearing p-cyclohexylphenoxy groups were obtained on the basis of 4-bromo-5-nitroben-
zene-1,2-dicarbonitrile. Synthesis of octasubstituted cobalt and copper phthalocyanines was proposed. The
obtained compounds were characterized by spectral methods.
Keywords: 4-bromo-5-nitrophthalonitrile, phthalocyanines, sulfonic acids, electronic absorption spectra
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020