ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 12, с. 1893-1902
УДК 546.98;541.14
ФОТОЛИЗ РАСТВОРОВ КОМПЛЕКСНЫХ
СОЕДИНЕНИЙ ПАЛЛАДИЯ(II) С ОРГАНИЧЕСКИМИ
КИСЛОТАМИ
© 2020 г. Е. И. Исаева*, В. В. Горбунова, А. М. Назарова
Российский государственный педагогический университет имени А. И. Герцена,
наб. р. Мойки 48, Санкт-Петербург, 191186 Россия
*e-mail: katiavolkova@yandex.ru
Поступило в Редакцию 31 июля 2020 г.
После доработки 31 июля 2020 г.
Принято к печати 14 августа 2020 г.
Фотохимическим восстановлением комплексных соединений палладия(II) K2[Pd(C2O4)2], [Pd(Gly)2],
[Pd(β-Ala)2] получены наночастицы палладия в объеме фотолита. Наибольшая скорость формирования
наночастиц палладия в объеме фотолита наблюдается при фотолизе комплекса K2[Pd(C2O4)2], наимень-
шая - при фотолизе [Pd(β-Ala)2]. Наибольшей стабильностью при хранении обладают частицы палладия,
полученные при фотолизе водных растворов комплексов [Pd(β-Ala)2] и [Pd(Gly)2] даже в отсутствие
стабилизатора. При прокаливании на воздухе в присутствии нанокомпозитых частиц Pd на носителе
CeO2 температура начала окисления понижается, а потеря массы образца (сажи) увеличивается.
Ключевые слова: фотолиз, наночастицы палладия, комплексные соединения палладия(II) с аминокис-
лотами
DOI: 10.31857/S0044460X20120124
Наночастицы благородных металлов приме-
в эмульсиях, сонохимический синтез, электрохи-
няются в различных областях науки, техники,
мический и термический синтез [19-22]. В каче-
медицины, энергетики благодаря их уникальным
стве восстановителей при получении наночастиц
свойствам и значительной стабильности. Высо-
палладия в растворах обычно используют гидри-
кая адсорбционная способность наноразмерного
ды щелочных металлов, тетрагидридобораты,
палладия позволяет отнести его к перспективному
амино- и гидразинобораны, гипофосфиты, соли
материалу водородной энергетики [1, 2]. Палладий
щавелевой, лимонной и винной кислот, формаль-
широко применяется в химической промышленно-
дегид, гидрохинон, полиолы, и т. д. Ранее фотохи-
сти в качестве катализатора низкотемпературного
мическим методом синтеза нами были получены
дожига выхлопных газов, окисления углеводоро-
наночастицы палладия на поверхности кварцевого
дов, реакций гидрирования 1,3-бутадиена, в реак-
стекла и в его объеме, а также в объеме фторугле-
циях Хека и Сузуки [3-9]. Активно ведутся работы
родной катионообменной мембраны МФ-4СК [15].
по использованию наночастиц палладия в биоло-
Нами исследованы оптические свойства и со-
гических и медицинских целях [10]. В связи с этим
став продуктов фотолиза комплексных соединений
актуальна разработка методики фотохимического
палладия(II) с органическими кислотами, в том
синтеза наночастиц палладия, а также исследова-
числе с аминокислотами, и изучена зависимость
ние их каталитической активности.
протекания фотохимического синтеза наночастиц
палладия от состава, концентрации комплексного
Известно большое количество методов получе-
соединения и стабилизатора.
ния наноструктур палладия: химическое восста-
новление [11-14], фото- и радиационно-химиче-
Для получения наночастиц палладия использо-
ское восстановление [15-18], синтез наночастиц
вали водные растворы фоточувствительных ком-
1893
1894
ИСАЕВА и др.
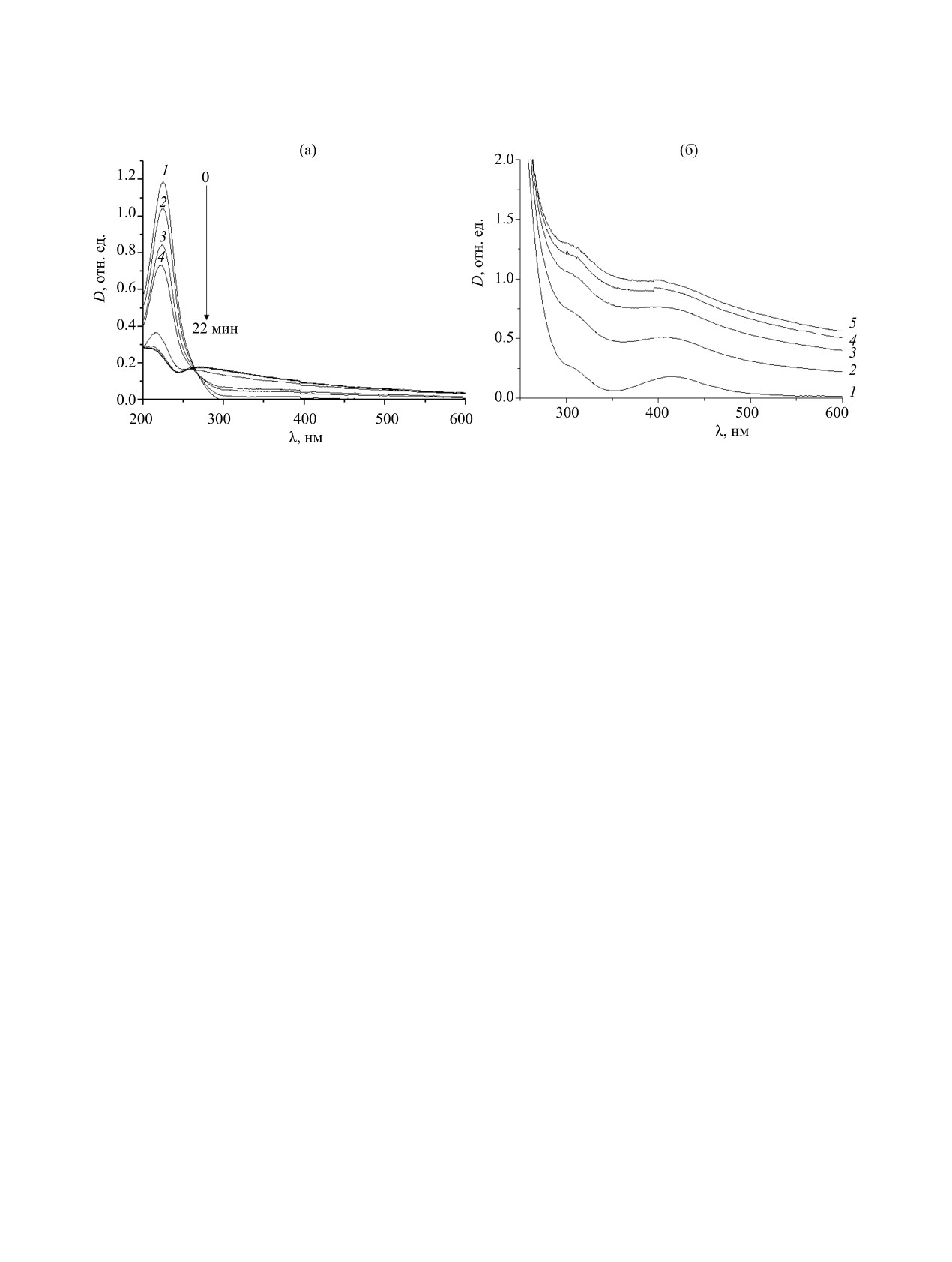
Рис. 1. Эволюция спектров поглощения водных 1×10-4 (а) и 1×10-3 М. (б) растворов K2[Pd(C2O4)2] при фотолизе монохро-
матическим светом, λвозб = 254 нм, в течение: 1 - 0, 2 - 1, 3 - 2, 4 - 3, 5 - 4 мин.
плексных соединений палладия(II) с анионами
Для ИК спектров комплексных соединений
щавелевой кислоты, глицина (Gly) и β-аланина
палладия(II) характерны менее выраженные по-
(β-Ala), фотолиз которых в области переноса заря-
лосы поглощения в области 3300-2500 см-1 по
да лиганд→металл (λвозб 254 нм) приводит к вос-
сравнению с аминокислотами, что может указы-
становлению палладия(II) до нульзарядных форм.
вать на связывание аминогруппы с ионами пал-
ладия(II); исчезновение полос поглощения в об-
Состав синтезированных фоточувствительных
ласти 1700-1680 см-1 в спектрах комплексных
комплексных соединений палладия(II) подтверж-
соединений c аминокислотами и уменьшение их
ден методами электронной и ИК спектроскопии
интенсивности в спектре оксалатного комплекса
поглощения. Комплекс K2[Pd(C2O4)2] характери-
палладия(II) свидетельствует о координации кар-
зуется антисимметричными и симметричными
боксильных групп к палладию.
валентными колебаниями карбоксильной группы
при 1657-1710 и 1408 см-1 соответственно. Поло-
По данным электронной спектроскопии, ком-
сы при 1641 см-1 (νas) и в области 1321-1388 см-1
плексные соединения палладия(II) с оксалат-иона-
(νs) в ИК спектре комплекса [Pd(Gly)2] подтвер-
ми, а также с анионами аминокислот поглощают
ждают координацию групп СОО- к атому палла-
в области 210-250 и 320-430 нм. Максимум по-
дия. Две полосы поглощения в области 3125-3227
глощения в УФ области спектра характеризует по-
см-1 с расщеплением между ними около 100 см-1
лосу переноса заряда лиганд→металл (ПЗЛ→М).
относятся к валентным колебаниям группы NH2,
Поэтому для формирования наночастиц палладия
координированной к металлу. Полосы в области
использовали источник облучения, λвозб = 254 нм.
504-597 см-1 относятся к валентным колебаниям
Состав комплексного соединения K2[Pd(C2O4)2]
связи Pd-N. В ИК спектре хелатного комплекса
подтверждали методом термогравиметрического
[Pd(β-Ala)2] присутствует интенсивная полоса при
анализа. Анализ термограммы позволяет выде-
1642 см-1, относящаяся к валентным антисимме-
лить три области, соответствующие ступеням тер-
тричным колебаниям карбоксильной группы, свя-
мического разложения соединения. В диапазоне
занной с палладием, а также полосы валентных
20-90°С наблюдается незначительное уменьше-
колебаний координированной аминогруппы при
ние массы образца, связанное с удалением кри-
3228 и 3125 см-1. Так же, как и для комплексно-
сталлизационной воды. В диапазоне температур от
го соединения палладия(II) с глицином, в спек-
100-230°С происходит основная потеря массы об-
тре [Pd(β-Ala)2] наблюдаются полосы при 504-
разца, обусловленная разложением К2[Pd(C2O4)2],
598 см-1, которые можно отнести к валентным ко-
формированием металлического палладия, оксала-
лебаниям связи Pd-N.
та калия и с удалением оксида углерода(IV). При
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
ФОТОЛИЗ Р
АСТВОРОВ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ ПАЛЛАДИЯ(II)
1895
330°С начинается ступень (третья) разложения
оксалата калия на карбонат калия и оксид углеро-
да(II). Стабильная конечная масса достигается при
380°С.
Облучение
1×10-4 М. водного раствора
K2[Pd(C2O4)2] УФ светом (λвозб = 254 нм), в тече-
ние 13 мин приводит к уменьшению оптической
плотности при λ = 240 нм от 1.18 до 0.28 отн. ед.
(рис. 1а), что указывает на восстановление кати-
онов палладия(II) при возбуждении комплекса
светом с энергией, соответствующей переносу
заряда лиганд→металл. Одновременно происхо-
дит возрастание оптической плотности в видимом
диапазоне спектра и изменение светло-желтого
цвета раствора на коричневый, что свидетельству-
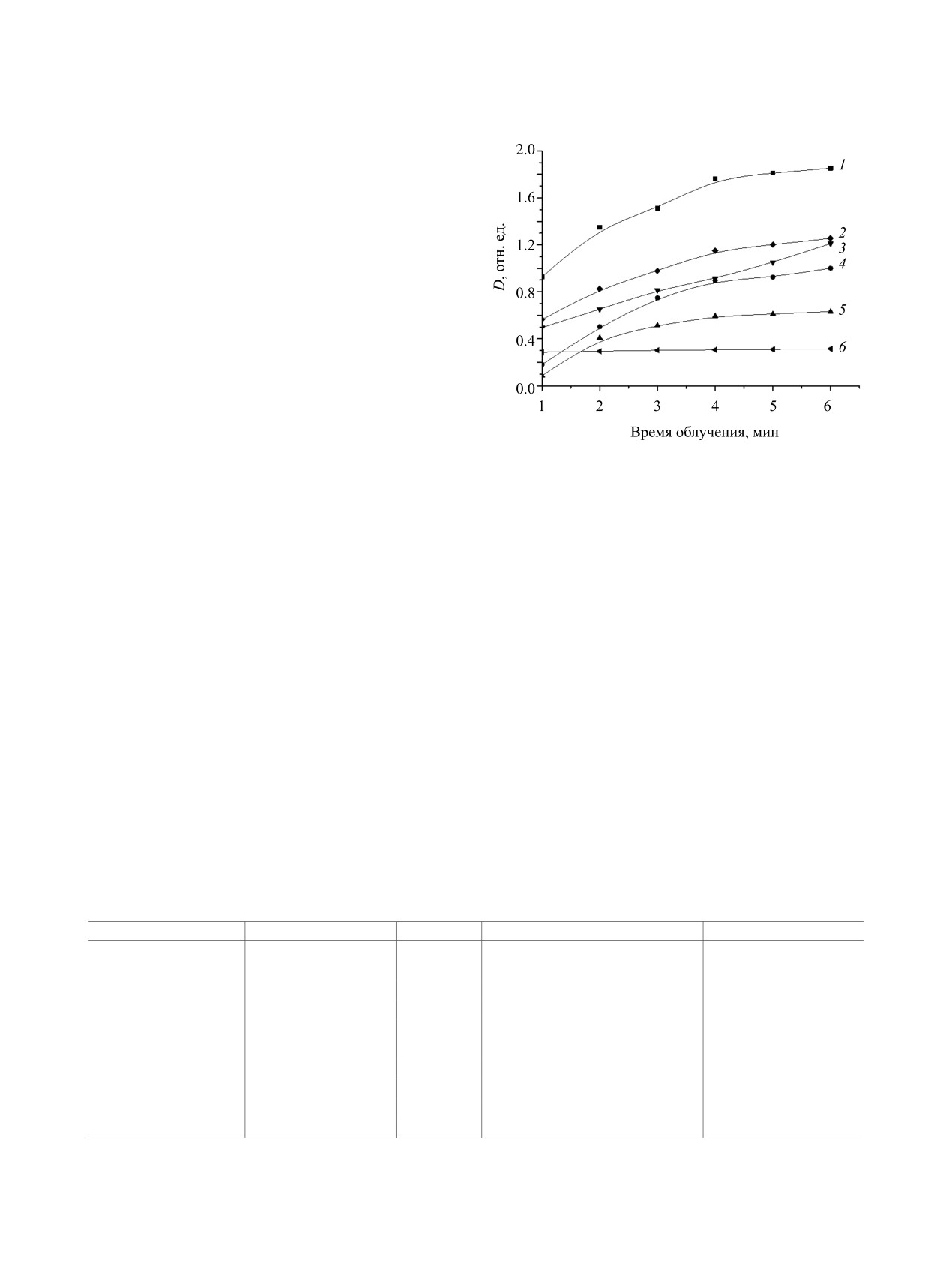
Рис. 2. Кинетические кривые формирования нано-
ет о формировании нульвалентных наноразмер-
частиц палладия при фотолизе водного раствора
ных форм палладия. Продолжение облучения до
K2[Pd(C2O4)2] при с = 5×10-3 (1), 1×10-3 (4), 5×10-4 (5)
22 мин не приводит к изменениям в спектральных
моль/л без стабилизаторов; 1×10-3 (3) в присутствии
поливинил-N-пирролидона, 1×10-3 (2) в присутствии
характеристиках фотолита, что свидетельствует о
додецилсульфата натрия, 1×10-3 (6) моль/л в присут-
полном восстановлении палладия(II) и формиро-
ствии цитрата натрия.
вании наночастиц палладия.
Фотолиз 1×10-3 М. раствора K2[Pd(C2O4)2] со-
Кинетические закономерности формирования
провождается резким скачком оптической плот-
наночастиц палладия при фотолизе K2[Pd(C2O4)2]
ности в течение 4 мин в видимом диапазоне спек-
представлены на рис. 2 и в табл. 1. Как видно из
тра поглощения (рис. 1б). Дальнейшее облучение
данных таблицы, средние скорости фотохими-
(более 5 мин) приводит к коагуляции коллоидного
ческого формирования наночастиц очень близки
раствора и седиментации осадка палладиевой черни.
в диапазоне концентраций комплекса 5×10-3-5×
Фазовый состав и кристаллическая структура
10-4 моль/л, однако наибольшая скорость наблю-
полученного осадка исследованы рентгено-диф-
дается при использовании 5×10-3 М. раствора
ракционным методом анализа. Образцы характе-
ризуются низкоинтенсивными дифракционными
K2[Pd(C2O4)2]. Уменьшение концентрации ком-
пиками при 2θ = 39.97 и 46.65°, соответствующи-
плексного соединения приводит к закономерному
ми гранецентрированной кубической решетке пал-
понижению начальной скорости формирования
ладия [23].
наночастиц палладия.
Таблица 1. Кинетические закономерности фотохимического формирования наночастиц палладия из водных раство-
ров комплексов палладия(II) в присутствии стабилизаторов различной природы (λвозб = 254 нм)
Комплекс
с, моль/л
λmax, нм
Стабилизатор
vнач, мин-1
K2[Pd(C2O4)2]
5×10-3
418
-
0.361
1×10-3
-
0.322
5×10-4
-
0.320
1×10-3
Додецилсульфат натрия
0.262
Цитрат натрия
0.008
Поливинил-N-пирролидон
0.156
[Pd(Gly)2
1×10-3
322
-
0.0035
Поливинил-N-пирролидон
0.0041
[Pd(β-Ala)2]
1×10-3
320
-
0.0022
Поливинил-N-пирролидон
0.0053
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1896
ИСАЕВА и др.
Рис. 3. Эволюция спектров поглощения водных 1×10-3 М. растворов [Pd(Gly)2] (а) и [Pd(β-Ala)2] (б) при фотолизе монохро-
матическим светом (λвозб = 254 нм) в течение: 1 - 0, 2 - 15, 3 - 30, 4 - 60, 5 - 80, 6 - 140, 7 - 180 мин.
Фотолиз в течение 3 мин 1×10-3 М. растворов
увеличению оптической плотности фотолита даже
K2[Pd(C2O4)2] с добавками додецилсульфата на-
при облучении в течение 60 мин и его использова-
трия или поливинил-N-пирролидона в качестве
ние в качестве стабилизатора при синтезе наноча-
стабилизаторов также сопровождается измене-
стиц палладия нецелесообразно (табл. 1).
нием светло-желтого цвета раствора на серо-ко-
Образцы, полученные фотохимическим вос-
ричневый и возрастанием оптической плотности
становлением K2[Pd(C2O4)2] в присутствии доде-
в видимом диапазоне длин волн. Начальная ско-
цилсульфата натрия не изменяли оптических ха-
рость фотохимического формирования наноча-
рактеристик при хранении на воздухе в течение 2
стиц уменьшается в 2 раза в присутствии поли-
недель, в присутствии поливинил-N-пирролидона -
винил-N-пирролидона и в 1.7 раз - в присутствии
в течение 1.5 лет. Следовательно, для стабили-
додецилсульфата натрия (рис. 2, табл. 1). Добавле-
зации наночастиц палладия, образующихся при
ние цитрата натрия не приводит к значительному
фотолизе оксалатного комплекса палладия(II), це-
лесообразно использовать поливинил-N-пирроли-
дон.
При фотолизе 1×10-3 М. раствора [Pd(Gly)2] в
течение 140 мин изменение светло-желтого цвета
раствора на серо-коричневый сопровождается воз-
растанием оптической плотности в видимом диа-
пазоне длин волн (рис. 3а). Увеличение продолжи-
тельности облучения не приводит к возрастанию
оптической плотности. Введение в фотолит до-
бавки поливинил-N-пирролидона практически не
влияет на характер изменения оптических характе-
ристик образцов при облучении, однако скорость
восстановления ионов палладия(II) возрастает.
Наибольшая скорость фотохимического формиро-
вания наночастиц наблюдается при использовании
Рис. 4. Кинетические кривые формирования наноча-
1×10-3 М. раствора [Pd(Gly)2] в присутствии поли-
стиц палладия при фотолизе 1×10-3М. водного раствора
винил-N-пирролидона она в 1.2 раза больше, чем
[Pd(Gly)2] в присутствии (1) и в отсутствие (2) поливи-
нил-N-пирролидона; [Pd(β-Ala)2] в присутствии (3) и в
в отсутствие стабилизатора (рис. 4, табл. 1). Од-
отсутствие (4) поливинил-N-пирролидона.
нако разница в скорости формирования частиц в
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
ФОТОЛИЗ Р
АСТВОРОВ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ ПАЛЛАДИЯ(II)
1897
Схема 1.
Схема 2.
присутствии и отсутствие стабилизатора не столь
Независимо от природы лиганда формирование
велика, как при фотолизе оксалатного комплекса
частиц протекает без индукционного периода, и
палладия(II), что позволяет сделать вывод о ста-
скорости разложения комплексов с формировани-
билизации образующихся частиц глицинат-ионом.
ем частиц палладия уменьшаются в ряду комплек-
сов K2[Pd(C2O4)2], [Pd(Gly)2], [Pd(β-Ala)2] от 0.322
Аналогичное изменение окраски фотолита и
до 0.0022 мин-1, т. е. более чем в 100 раз.
увеличение оптической плотности наблюдаются
при облучении 1×10-3 М. раствора [Pd(β-Ala)2]
Стабильность полученных наночастиц при
в течение 180 мин как в присутствии поливи-
хранении неодинакова. Наночастицы, полученные
нил-N-пирролидона, так и без него (рис. 3б). Фо-
при фотолизе K2[Pd(C2O4)2] устойчивы лишь в те-
тохимическое восстановление протекает без ин-
чение нескольких минут, для повышения их агре-
дукционного периода, и наибольшая скорость
гативной устойчивости необходимо использовать
формирования наночастиц наблюдается при фо-
стабилизаторы. Наночастицы, полученные при
толизе 1×10-3 М. раствора [Pd(β-Ala)2] с добавкой
облучении комплексов [Pd(Gly)2] и [Pd(β-Ala)2]
поливинил-N-пирролидона: она в 2.5 раза больше,
достаточно устойчивы без использования допол-
чем в отсутствие стабилизатора (рис. 4, табл. 1).
нительных стабилизаторов и могут храниться,
не изменяя оптических характеристик, в течение
Анализируя кинетические закономерности об-
года. Стабилизаторами частиц в данном случае
разования наноразмерного палладия при фотохи-
выступают сами аминокислоты и их кислотные
мическом разложении комплексных соединений
остатки.
палладия(II) с различными лигандами, необходи-
мо отметить, что использование оксалат-иона в
Высокие скорости фотохимического формиро-
качестве лиганда позволяет получить наночасти-
вания наночастиц палладия из оксалатного ком-
цы уже через 3 мин облучения, глицина - через
плекса палладия(II) обусловлены значительной
140 мин, а β-аланина - более чем через 180 мин.
восстановительной активностью оксалат-иона
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1898
ИСАЕВА и др.
[E0(2CO2/C2O42-) = -0.49 В] и окислительной спо-
экспериментального подтверждения, однако на
собностью катионов палладия(II) [E0(Pd2+/Pd) =
данном этапе исследования позволяет объяснить
0.95 В]. На основании литературных данных [24,
особенности фоторазложения комплексов палла-
25] можно предположить следующий механизм
дия в зависимости от природы лиганда.
фоторазложения комплекса K2[Pd(C2O4)2]. Под
Каталитические свойства наноразмерного пал-
действием света (λвозб = 254 нм) происходит обра-
ладия позволяют проводить реакции в более мяг-
зование ион-радикала 1, распадающегося в даль-
ких условиях по сравнению с применяемыми в
нейшем с формированием оксалат-ион-радикала
промышленности никелевыми катализаторами.
3, который выступает в роли восстановителя одно-
Наночастицы палладия чаще всего используют в
зарядных форм 2 палладия до нульзарядных форм
катализе на различных носителях: оксидах алюми-
(схема 1).
ния, кремния, церия(IV) и на магнетите [28, 29].
На примере глицинатного комплекса палладия
Нанесение наночастиц палладия на оксид цери-
на основе литературных [26, 27] и эксперимен-
я(IV) приводит к созданию гибридных материа-
тальных данных предложен механизм формирова-
лов, обладающих новым набором каталитических
ния наноразмерного палладия в результате фото-
свойств [30]. Применение цериевых носителей
лиза комплексов палладия(II) c аминокислотами.
для палладиевых катализаторов позволяет суще-
При облучении водного раствора (λвозб = 254 нм)
ственно улучшить их характеристики за счет дис-
комплекса палладия(II) с глицином происходит од-
пергирования металла на поверхности носителя,
ноэлектронное восстановление центрального иона
причем увеличивается не только каталитическая
активность, но и термическая устойчивость гете-
с образованием ион-радикала 4 и карбоксиламин-
росистем, что продлевает срок службы катализа-
ного радикала 5. Радикал 5 декарбоксилируется с
тора.
образованием CO2 и метиламинного радикала 6,
который при взаимодействии с Pd(NH2CH2COO)2
В связи с этим были изучены состав и свойства
дает NH=CH2 и радикал 4 (схема 2). Неустойчивый
систем на основе оксида церия(IV), полученного по
в водном растворе метилиденимин NH=CH2 рас-
разработанной нами ранее методике [31], и нано-
падается на аммиак и формальдегид. Разложение
частиц палладия. Модификацию оксида церия(IV)
ион-радикала 4 сопровождается декарбоксилиро-
частицами палладия проводили путем фотолиза
ванием и образованием наноразмерного палладия
растворов светочувствительных комплексных со-
и аминометильного радикала 6. Аминометильные
единений палладия(II) K2[Pd(C2O4)2] и [Pd(Gly)2].
радикалы участвуют в реакции продолжения цепи,
Состав образцов подтверждали методом рентге-
а также в реакции рекомбинации.
нодифракционного анализа. На рентгенограммах
образцов CeO2, модифицированных палладием,
Таким образом, кинетические закономерности
полученных при фотолизе оксалатного и глици-
формирования наноразмерного палладия в резуль-
натного комплексов палладия(II), наблюдаются
тате фотолиза комплексных соединений палла-
только пики кубической кристаллической решет-
дия (II) с аминокислотами определяются устой-
ки церианита, углы 2θ которых близки к соответ-
чивостью комплексных соединений в растворе,
ствующим значениям, приведенным в литературе
восстановительными свойствами лиганда, устой-
[32]. Размер кристаллитов (D) оксида церия(IV),
чивостью промежуточных продуктов фотолиза,
рассчитанный по уравнению Селякова-Шеррера
их восстановительной способностью и степенью
(1), составил 27-30 нм.
участия в конкурирующих процессах.
D = k·λ/βcosθ.
(1)
Предположительно меньшая скорость образо-
вания частиц палладия при фотолизе комплекса
Здесь k - постоянная величина (k = 1.0747); λ -
длина волны рентгеновского излучения CuKα1, β -
[Pd(β-Аla)2] связана с повышенной устойчивостью
шестичленного хелатного комплекса по сравне-
полуширина пика рентгеновской дифракции (рад),
нию с пятичленным [Pd(Gly)2], а также с меньшей
θ - угол дифракции Брэгга.
восстановительной способностью промежуточ-
Отсутствие четких рефлексов палладия объ-
ных продуктов фотолиза. Предполагаемый меха-
ясняется малым размером образующихся частиц
низм фотолиза требует тщательного изучения и
палладия, которые не дают яркой дифракционной
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
ФОТОЛИЗ Р
АСТВОРОВ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ ПАЛЛАДИЯ(II)
1899
Таблица 2. Зависимость температуры начала окисления сажи и потери массы образца при прокаливании в атмосфе-
ре воздуха от состава катализатора
Температура начала
Образец
Δm, %
окисления, °C
Сажа, НЧа Pd из K2[Pd(C2O4)2]
416
47
Сажа, CeO2, НЧ Pd из K2[Pd(C2O4)2]
409
68
Сажа, CeO2, НЧ Pd из [Pd(Gly)2]
415
50
а НЧ - наночастицы.
картины, и большой долей аморфной фазы в об-
тура начала окисления сажи понижается, а потеря
разцах (69-71%).
массы образца при прокаливании увеличивается
(табл. 2). Наибольшее понижение температуры
По результатам энергодисперсионного анализа
в спектре образца CeO2/Pd, полученного фотоли-
начала окисления сажи до 409°С и наибольшая
зом водного раствора K2[Pd(C2O4)2], присутство-
потеря массы (до 68%) наблюдается при использо-
вали линии Kα кислорода (52.28 ат%), Lα церия
вании образца CeO2/Pd, полученного при фотолизе
(20.95 ат%), Lα палладия (2.54 ат%) и Kα алюминия
K2[Pd(C2O4)2] (2.54% палладия).
(24.23 ат%). Отсутствие линий Kα углерода свиде-
Таким образом, разработана методика получе-
тельствует о формировании частиц палладия и об
ния наночастиц палладия в объеме фотолита при
отсутствии исходного комплекса в исследуемом
фотолизе комплексных соединений палладия(II)
образце. Пересчет ат% с учетом использования в
с анионами щавелевой, аминоуксусной, 3-амино-
качестве подложки алюминия, покрытого оксид-
пропановой кислот. Исследование кинетических
ной пленкой, позволяет предположить, что состав
закономерностей формирования наночастиц пал-
образцов включает CeO2 и палладий.
ладия позволило предложить механизм фотохими-
В образце CeO2/Pd, полученном фотолизом
ческого разложения комплексных соединений пал-
водного раствора K2[Pd(C2O4)2], находится боль-
ладия(II) с оксалат- и глицинат-ионами. Нанесение
ше палладия (2.54 ат%), чем в образце, синтези-
наночастиц палладия на оксид церия(IV) способ-
рованном в аналогичных условиях из [Pd(Gly)2]
ствует понижению температуры начала модельной
(1.16 ат%).
реакции окисления сажи, что указывает на прояв-
Каталитическая активность наночастиц палла-
ление ими каталитических свойств.
дия исследована на примере модельной реакции
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
окисления сажи с использованием метода термо-
В качестве исходных соединений для синтеза
гравиметрии. Использование наноразмерного пал-
наноразмерных частиц палладия использовали
ладия, в том числе нанесенного на оксид церия
фоточувствительные комплексные соединения
(IV) при фотолизе комплексных соединений пал-
палладия(II) с анионами щавелевой кислоты, гли-
ладия(II), приводит к уменьшению температуры
цина (Gly) и β-аланина (β-Ala). Для синтеза ком-
начала окисления сажи, которая по литературным
данным [33] лежит в диапазоне 550-600°С, и к
плексных соединений палладия(II) K2[Pd(C2O4)2],
увеличению полноты сгорания сажи.
[Pd(Gly)2], [Pd(β-Ala)2] использовали хлорид пал-
ладия(II) (Ч), оксалат калия (ЧДА), глицин (ХЧ),
Из анализа кривых ТГА/ДСК следует, что тем-
β-аланин (ХЧ).
пература начала окисления сажи в присутствии
наночастиц палладия, полученных при фотоли-
ИК спектры образцов регистрировали на ИК
зе оксалатного комплекса палладия(II) в течение
Фурье-спектрометре Shimadzu IR Prestige-21.
2 мин, составляет 416°С, убыль массы образца в
Электронные спектры поглощения регистриро-
ходе прокаливания - 47%. При прокаливании сажи
вали на спектрофотометре СФ-2000 в диапазо-
в присутствии катализатора на основе оксида це-
не длин волн 200-1000 нм. Концентрацию ком-
рия(IV), модифицированного наночастицами пал-
плексных соединений варьировали в диапазоне от
ладия, полученными при фотолизе комплексных
5×10-3 до 1×10-4 моль/л. В качестве растворителя
соединений K2[Pd(C2O4)2] и [Pd(Gly)2], темпера-
использовали дистиллированную воду, в качестве
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1900
ИСАЕВА и др.
стабилизаторов - додецилсульфат натрия, цитрат
K2[Pd(C2O4)2] и [Pd(Gly)2]. К водной дисперсии
натрия (ЧДА), поливинил-N-пирролидон (Поли-
оксида церия(IV) при перемешивании добавляли
дон-А, «Оргполимерсинтез») в концентрации 1 мас%.
комплексное соединение палладия(II) в мольном
соотношении n(Pd):n(CeO2) = 1:10 из расчета, что
Растворы комплексных соединений с заданной
комплексное соединение полностью фотохимиче-
концентрацией помещали в кварцевые кюветы с
ски разлагается. Полученный раствор облучали 40
длиной оптического пути 1 см и облучали моно-
мин монохроматическим УФ светом лампы Philips
хроматическим УФ светом ртутной лампы Philips
TUV 4W/G4 T5 (λвозб = 254 нм), затем центрифуги-
TUV 4W/G4 05, λвозб = 254 нм, интенсивность па-
ровали 2 мин (2000 об/мин) и промывали осадок
дающего света 4.8×1016 квант×см-2с-1.
водой и спиртом.
Диоксалатопалладат(II) калия K2[Pd(C2O4)2]
Исследование кристаллической структуры и
получали по модифицированной методике [18].
фазового состава полученных образцов проводи-
0.2213 г хлорида палладия(II) растворяли в 2 мл 6 н.
ли на рентгеновском дифрактометре ДРОН-7 с
HCl и прибавляли 10 мл дистиллированной воды.
использованием характеристического излучения
К полученному раствору медленно приливали
медного анода CuKα1. Состав образцов CeO2/Pd,
10 мл водного раствора оксалата калия (1.15 г мо-
нанесенных на алюминиевую подложку, опреде-
ногидрата оксалата калия), выдерживали 20 мин
ляли с помощью рентгеноструктурного спектраль-
на холоде для осаждения избытка оксалата калия,
ного микроанализа на сканирующем электронном
который отфильтровывали. К фильтрату прили-
микроскопе Zeiss EVO 40, оснащенном энергодис-
вали равный объем этилового спирта, выпавший
персионным рентгеноспектральным детектором.
осадок отфильтровывали, полученный светлый
Каталитическую активность частиц палладия
желто-коричневый порошок сушили на воздухе.
и композитов CeO2/Pd в реакциях окисления сажи
Палладий(II)диглицинат [Pd(Gly)2] и пал-
изучали на синхронном термическом анализаторе
ладий(II)ди-β-аланинат
[Pd(β-Ala)2] получали
STA NETZSH 449F Jupiter. Образец массой 10-
по методике [34] в два этапа. К раствору хлорида
15 мг помещали в корундовый тигель и нагрева-
палладия (II) в 6 н. HCl добавляли рассчитанное
ли от 20 до 800°C (15 град/мин), скорость потока
количество хлорида калия и получали хлоропал-
воздуха 100-200 мл/мин. В камеру весов подавали
ладат(II) калия. Затем к K2[PdCl4] добавляли эк-
аргон со скоростью 40 мл/мин и фиксировали тем-
вивалентное количество аминокислоты и равный
пературу начала окисления, потерю массы.
объем этилового спирта. Образовавшийся осадок
перекристаллизовывали и анализировали метода-
БЛАГОДАРНОСТЬ
ми электронной и ИК спектроскопии, термограви-
Физико-химические исследования выполнены с
метрии.
использованием оборудования центров коллектив-
Термогравиметрический анализ проводили
ного пользования факультета химии и Научно-ис-
на синхронном термическом анализаторе STA
следовательского института физики Российского
NETZSH 449F Jupiter. Термическое разложение
государственного педагогического университета
комплексного соединения проводили в атмосфе-
им. А. И. Герцена.
ре аргона в температурном режиме от 20 до 600°С
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
при скорости нагрева 15 град/мин. Скорость пото-
К данной статье приложены дополнительные
ка аргона - 40 мл/мин. Тигель корундовый. Для из-
материалы.
учения каталитических свойств наночастиц палла-
дия в реакциях окисления сажи (сажа П-803, ООО
КОНФЛИКТ ИНТЕРЕСОВ
«Авапровайдинг») в ряде опытов в качестве носи-
Авторы заявляют об отсутствии конфликта ин-
теля использовали оксид церия(IV), полученный в
тересов.
лаборатории термическим методом при прокали-
вании нитрата церия(III) на целлюлозе в качестве
СПИСОК ЛИТЕРАТУРЫ
темплата [31].
1. Horinouchi S., Yamanoi Y., Yonezawa T., Mouri T.,
Модификацию оксида церия(IV) частицами
Nishihara H. // Langmuir. 2006. Vol. 22. N 4. P. 1880.
палладия проводили путем фотолиза растворов
doi 10.1021/la052657+
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
ФОТОЛИЗ Р
АСТВОРОВ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ ПАЛЛАДИЯ(II)
1901
2.
Kobayashi H., Yamauchi M., Kitagawa H., Kubota Y.,
22.
Янилкин В.В., Настапова Н.В., Султанова Э.Д., На-
Kato K., Takata M. // J. Am. Chem. Soc. 2008. Vol. 130.
сретдинова Г.Р., Мухитова Р.К., Зиганшина А.Ю.,
N 6. P. 1818. doi 10.1021/ja078126k
Низамеев И.Р., Кадиров М.К. // Изв. АН. Сер. хим.
3.
Miyaura N., Suzuki A. // Chem. Rev. 1995. Vol. 95.
2016. № 1. С. 125; Yanilkin V.V., Nastapova N.V., Sulta-
N 7. P. 2457. doi 10.1021/cr00039a007
nova E.D., Nasretdinova G.R., Mukhitova R.K., Zigan-
4.
Li Y., Dai Y., Yang Z., Li T. // Inorg. Chim. Acta. 2014.
shina A.Y., Nizameev I.R., Kadirov M.K. // Russ. Chem.
Vol. 414. P. 59. doi 10.1016/j.ica.2014.01.041
Bull. 2016. Vol. 65. N 1. P. 125. doi 10.1007/s11172-
5.
Trzeciak A.M., Augustyniak A.W. // Coord. Chem. Rev.
016-1274-6
2019. Vol. 384. P.1. doi 10.1016/j.ccr.2019.01.008
23.
McMurdie H.F., Morris M.C., Evans E.H., Paretzkin B.,
6.
Ferri D., Elsener M., Krocher O. // Appl. Catal. (B).
Wong-Ng W., Ettlinger L., Hubbar C.R.
// Powder
2018. Vol. 220. P. 67. doi 10.1016/j.apcatb.2017.07.070
Diffr. 1986. Vol. 1. N 2. P.
64. doi 10.1017/
7.
Tereshchenko A., Polyakov V., Guda A., Lastovina T., Pi-
S0885715600011593
monova Y., Bulgakov A., Tarasov A., Kustov L., Butova V.,
24.
Катенин С.В., Логинов А.В., Воякин И.В., Шагисул-
Trigub A., Soldatov A. // Catalysts. 2019. Vol. 9. N 4.
танова Г.А. // Коорд. xим. 1986. Т. 12. № 12. С. 1621.
P. 385. doi 10.3390/catal9040385
8.
Feng Y., Zhou L., Wan Q., Lin S., Guo H. // Chem. Sci.
25.
Mangiante D.M., Schaller R.D., Zarzycki P., Ban-
2018. Vol. 9. N 27. P. 5890. doi 10.1039/C8SC00776D
field J.F., Gilbert B. // ACS Earth Space Chem. 2017.
9.
Saldan I., Semenyuk Y., Marchuk I., Reshetnyak O. //
Vol. 1. N 5. P. 270. doi 10.1021/acsearthspacechem.7b00026
J. Mater. Sci. 2015. Vol. 50. N 6. P. 2337. doi 10.1007/
26.
Исаева Е.И., Горбунова В.В. // ЖOX. 2017. Т. 87.
s10853-014-8802-2
Вып. 12. С. 2038; Isaeva E.I., Gorbunova V.V. // Russ.
10.
Phan T.T.V., Huynh T.C., Manivasagan P., Mondal S.,
J. Gen. Chem. 2017. Vol. 87. N 12. P. 2852. doi 10.1134/
Oh J. // Nanomaterials. 2020. Vol. 10. N 1. P. 66. doi
S1070363217120155
10.3390/nano10010066
27.
Lin C.J., Hsu C.S., Wang P.Y., Lin Y. L., Lo Y.S., Wu C.H. //
11.
Tan Y., Dai X., Li Y., Zhu D. // J. Mater. Chem. 2003.
Inorg. Chem. 2014. Vol. 53. N 10. P. 4934. doi 10.1021/
Vol. 13. N 5. P. 1069. doi 10.1039/B211386D
ic4031238
12.
Nguyen V. L., Nguyen, D. C. Hirata, H., Ohtaki, M.
28.
Иванова А.С., Корнеева Е.В., Славинская Е.М., Зю-
Hayakawa T., Nogami, M. // Adv. Nat. Sci. Nanosci.
зин Д.А., Мороз Э.М., Данилова И.Г., Гуляев Р.В.,
Nanotechnol. 2010. Vol. 1. N 3. P. 035012. doi
Боронин А.И., Стонкус О.А., Зайковский В.И. // Ки-
10.1088/2043-6262/1/3/035012
нетика и катализ. 2014. Т. 55. № 6. С. 767; Ivanova
13.
Kettemann F., Wuithschick M., Caputo G., Kraehnert R.,
A.S., Korneeva E.V., Slavinskaya E.M., Zyuzin D.A.,
Pinna N., Rademann K., Polte J. // Cryst. Eng. Comm.
Moroz E.M., Danilova I.G., Gulyaev R.V., Boro-
2015. Vol. 17. N 8. P. 1865. doi 10.1039/C4CE01025F
nin A.I., Stonkus O.A., Zaikovskii V.I. // Kinetics and
14.
Bugaev A.L., Polyakov V.A., Tereshchenko A.A., Isae-
Catalysis. 2014. Vol. 55. N 6. P. 748. doi 10.7868/
va A.N., Skorynina A.A., Kamyshova E.G., Budnyk A.P.,
Lastovina T.A., Soldatov A.V. // Metals. 2018. Vol. 8.
S0453881114060070
N 2. P. 135. doi 10.3390/met8020135
29.
Mauriello F., Ariga H., Musolino M. G., Pietropaolo R.,
15.
Boitsova T.B., Gorbunova V.V., Voronin Yu.M. // J. Opt.
Takakusagi S., Asakura K. // Appl. Catalysis (B). 2015.
Technol. 2001. Vol. 68. N 10. P. 789. doi 10.1364/
Vol. 166. P. 121. doi 10.1016/j.apcatb.2014.11.014
JOT.68.000789
30.
Tan Q., Du C., Sun Y., Yin G., Gao Y. // J. Mater.
16.
Соловов Р.Д., Ершов Б.Г. // Коллоидный журнал.
Chem. (A). 2014. Vol. 2. N 5. P. 1429. doi 10.1039/
Т. 76. № 5. С. 645; Solovov R.D., Ershov B.G. //
C3TA13843G
Colloid J. 2014. Vol. 76. N 5. P. 645. doi 10.7868/
31.
Волков А.А., Бойцова Т.Б., Стожаров В.М., Исае-
S0023291214050140
ва Е.И. // ЖОХ. 2020. Т. 90. Вып. 2. С. 308; Vol-
17.
Rojas J.V., Castano C.H. // Radiation Phys. Chem.
kov А.А., Boitsova T.B., Stozharov V.M., Isaeva E.I. //
2012. Vol. 81. N 1. P. 16. doi 10.1016/j.radphy-
Russ. J. Gen. Chem. 2020. Vol. 90. N 2. Р. 277.
schem.2011.08.010
doi 10.1134/S1070363220020188
18.
Navaladian S., Viswanathan B., Varadarajan T.K.,
32.
Natile M.M., Boccaletti G., Glisenti A. // Chem. Mater.
Viswanath R.P. // Nanoscale Res. Lett. 2009. Vol. 4.
2005. Vol. 17. P. 6272. doi 10.1021/cm051352d
N 10. P. 181. doi 10.1007/s11671-008-9223-4
33.
Сааб Е., Ауад С., Аби-Аад Е., Бокова М.Н., Жилин-
19.
Kim S.W., Park J., Jang Y., Chung Y., Hwang S., Hyeon T.,
ская Е.А., Абукаис А.А. // Кинетика и катализ. 2007.
Kim Y.W. // Nano Lett. 2003. Vol. 3. N 9. P. 1289. doi
Т. 48. № 6. С. 899; Saab E., Aouad S., Abi-Aad E.,
10.1021/nl0343405
Bokova M.N., Zhilinskaya E.A., Aboukaïs A. // Kinetics
20.
Nemamcha A., Rehspringer J.L., Khatmi D. // J. Phys.
Chem. (B). 2006. Vol. 110. N 1. P. 383. doi 10.1021/
and Catalysis. 2007. Vol. 48. N 6. P. 841. doi 10.1134/
jp0535801
S0023158407060134
21.
Uberman P.M., Pérez L.A., Martin S.E. Lacconi G.I. //
34.
Черняев И.И. Синтез комплексных соединений ме-
RSC Adv. 2014. Vol. 4. N 24. P. 12330. doi 10.1039/
таллов платиновой группы. Справочник. М.: Наука,
C3RA47854H
1964. 340 с.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1902
ИСАЕВА и др.
Photolysis of Palladium(II) Complex Compounds Solutions
with Organic Acids
E. I. Isaeva*, V. V. Gorbunova, and A. M. Nazarova
Herzen State Pedagogical University of Russia, St. Petersburg, 191186 Russia
*e-mail: katiavolkova@yandex.ru
Received July 31, 2020; revised July 31, 2020; accepted August 14, 2020
We report the results of a photochemical reduction of palladium(II) complexes K2[Pd(C2O4)2], [Pd(Gly)2],
[Pd(β-Ala)2]. The effect of the concentration of the initial palladium(II) complex compound and the nature of
the stabilizer on the rate of photochemical formation of palladium nanoparticles and their stability in aqueous
solutions was studied. The highest rate of formation of palladium nanoparticles in the photolith volume was
observed during the photolysis of the K2[Pd(C2O4)2] complex, the lowest is [Pd(β-Ala)2]. Palladium particles
obtained by photolysis of aqueous solutions of [Pd(β-Ala)2] and [Pd(Gly)2] complexes have the highest storage
stability even in the absence of a stabilizer.
Keywords: photolysis, palladium nanoparticles, palladium(II) complexes with aminoacids
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020