ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 12, с. 1903-1909
УДК 541.49 + 546.681 + 547.821/.239.2 + 544.18
КОМПЛЕКСООБРАЗОВАНИЕ КИСЛОТЫ ЛЬЮИСА
Ga[N(C6F5)2]3 С АЦЕТОНИТРИЛОМ И ПИРИДИНОМ
© 2020 г. А. С. Завгородний, А. В. Помогаева, А. Ю. Тимошкин*
Санкт-Петербургский государственный университет, Университетская наб. 7-9,
Санкт-Петербург, 199034 Россия
*e-mail: a.y.timoshkin@spbu.ru
Поступило в Редакцию 15 сентября 2020 г.
После доработки 21 сентября 2020 г.
Принято к печати 23 сентября 2020 г.
Методом ЯМР 19F охарактеризовано взаимодействие кислоты Льюиса Ga[N(C6F5)2]3 с ацетонитрилом и
пиридином. Квантово-химические расчеты показывают, что более короткая донорно-акцепторная связь в
комплексе с ацетонитрилом на 73 кДж/моль менее прочна, чем в комплексе с пиридином, что согласуется
с частичной диссоциацией комплекса Ga[N(C6F5)2]3-ацетонитрил в толуоле.
Ключевые слова: декафтордифениламид галлия, пиридин, ацетонитрил, донорно-акцепторный ком-
плекс, квантово-химические расчеты
DOI: 10.31857/S0044460X20120136
Кислоты Льюиса играют ключевую роль во
году И. Кроссинг предложил новую реперную
многих областях современной химии. Они широко
кислоту Льюиса для определения суперкислот-
используются в качестве катализаторов, например,
ности - мономерный пентафторид сурьмы [10].
в реакциях Дильса-Альдера [1], Фриделя-Крафт-
Квантово-химические расчеты [11] показывают
са [2], реакциях миграции сульфоксильной группы
близкие значения FIA для AlCl3 (503) и SbF5 (501),
[3] или при энантиоселективном синтезе асимме-
что делает эти реперные кислоты равноценными.
тричных соединений [4], как компоненты разде-
Легкодоступные тригалогениды алюминия, явля-
ленных Льюисовских пар [5], для стабилизации
ются суперкислотами Льюиса в газовой фазе, но
реакционноспособных катионов путем образова-
из-за димеризации обладают заметно меньшей
ния слабо координированных анионов [6].
кислотностью в конденсированной фазе. Удобным
В качестве параметра, количественно характе-
методом дизайна суперкислот Льюиса является
ризующего силу кислоты Льюиса, Хаарц и Мак-
использование сильных электрон-акцепторных за-
Дэниэл в 1973 году предложили использовать ве-
местителей, таких как перфторированные алкиль-
личину энергии сродства к фторид-иону в газовой
ные или арильные группы. В 2008 году Кроссинг
фазе (FIA, кДж/моль) [7]. Широкое применение
[10] выделил суперкислоту Al[OC(CF3)3]3 (FIA
кислот Льюиса в синтетической химии вызывало
547) в виде ее аддукта с фторбензолом (FIA 465).
интерес к созданию очень сильных кислот Лью-
Известны суперкислоты Льюиса Al[OC(C6F5)3]3
иса, так называемых суперкислот. Первое опре-
(FIA 555) [11], Al[N(C6F5)2]3 (FIA 555) [12], а так-
деление суперкислоты Льюиса было предложено
же галлиевый аналог Ga[N(C6F5)2]3 (FIA 472) [12].
в 1979 году Дж. Ола [8]: кислота Льюиса, кото-
Помимо FIA, для количественной характеристики
рая сильнее мономерного трихлорида алюминия
силы кислот Льюиса также используют энергии
в газовой фазе, является суперкислотой. Одна-
сродства к другим анионам, таким как H-, Cl- и
ко поскольку трихлорид алюминия существует в
CH3- [13]. Однако подобные критерии рассма-
виде димера Al2Cl6, устойчивого по отношению
тривают взаимодействие кислоты Льюиса только
к диссоциации на мономеры до 600 K [9], в 2008
с анионными основаниями, в то время как боль-
1903
1904
ЗАВГОРОДНИЙ и др.
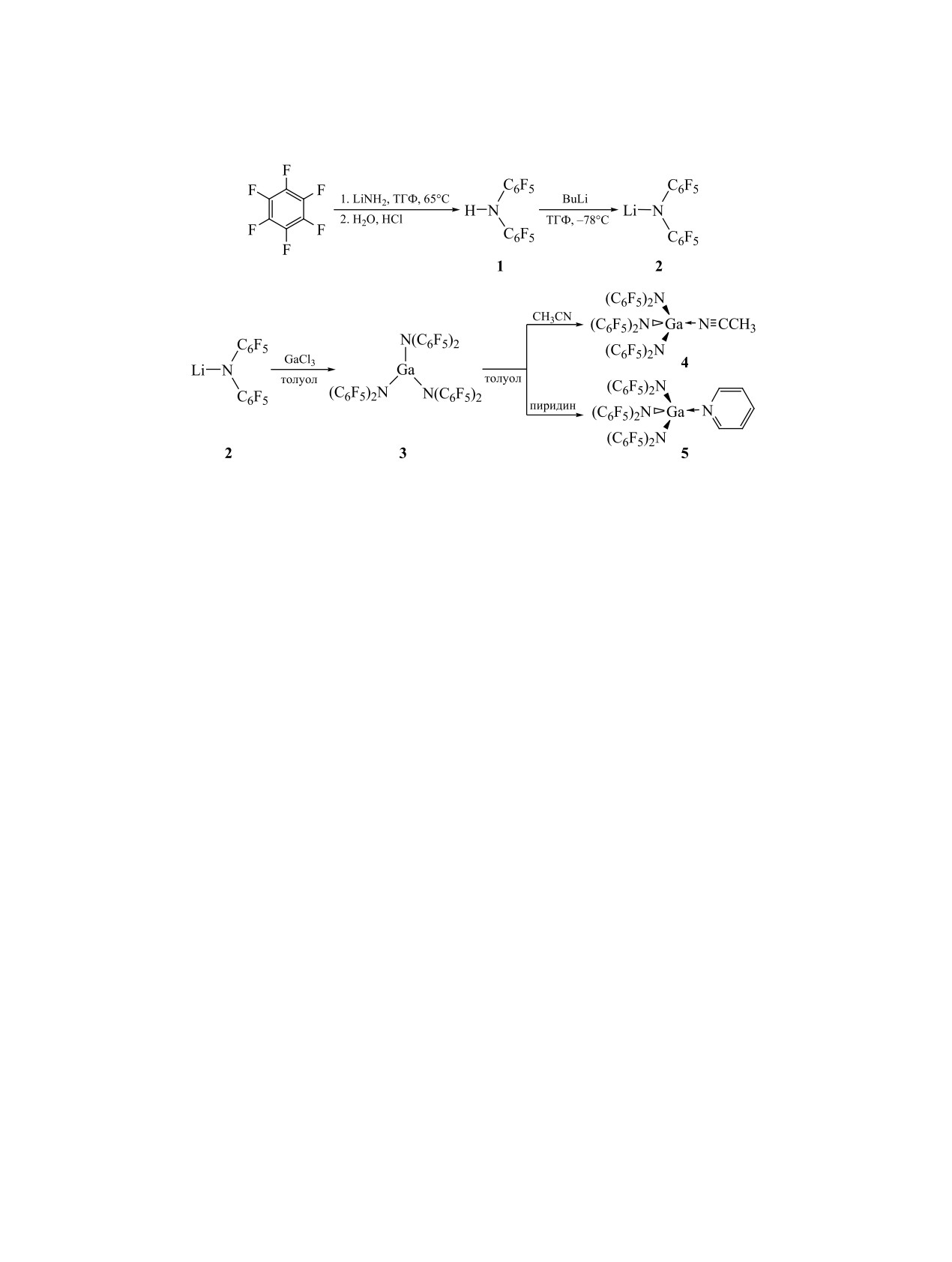
Схема 1.
шой интерес представляют донорно-акцепторные
-147.4 м. д.), а дублет, соответствующий пара-ато-
(донорно-акцепторная) комплексы с электроней-
мам фтора, наоборот, сдвигается в сторону сильного
тральными основаниями Льюиса, такими как ами-
поля (от -147.1 до -165 м. д.), что свидетельствует
ны и фосфины. Для сравнения силы кислот при
об образовании донорно-акцепторных комплек-
образовании молекулярных комплексов в качестве
сов. При этом в спектре ЯМР раствора комплекса
количественной характеристики можно использо-
с ацетонитрилом наблюдаются сигналы, отвечаю-
вать энергию донорно-акцепторной связи с моле-
щие свободной кислоте Льюиса Ga[N(C6F5)2]3, ко-
кулярными реперными донорами в газовой фазе
торые отсутствуют в спектре раствора комплекса с
[14]. В нашей работе в качестве таких реперных
пиридином, что свидетельствует о меньшей проч-
доноров для характеризации кислотности E(C6F5)3
ности комплекса Ga[N(C6F5)2]3·MeCN по сравне-
(E = B, Al, Ga, In) были использованы азотсодер-
нию с комплексом Ga[N(C6F5)2]3·Py.
жащие доноры ацетонитрил (MeCN) и пиридин
Для определения структурных и термодинами-
(Py). В рамках данной работы нами эксперимен-
ческих характеристик комплексов были проведе-
тально и теоретически изучено комплексообразо-
ны квантово-химические расчеты. Оптимизиро-
вание кислоты Льюиса Ga[N(C6F5)2]3 с пиридином
ванные структуры симметричной конфигурации
и ацетонитрилом.
кислоты Льюиса (точечная группа D3) и ее ком-
плексов с ацетонитрилом (С3) и пиридином (C1)
Синтез комплексов проводили согласно схеме 1.
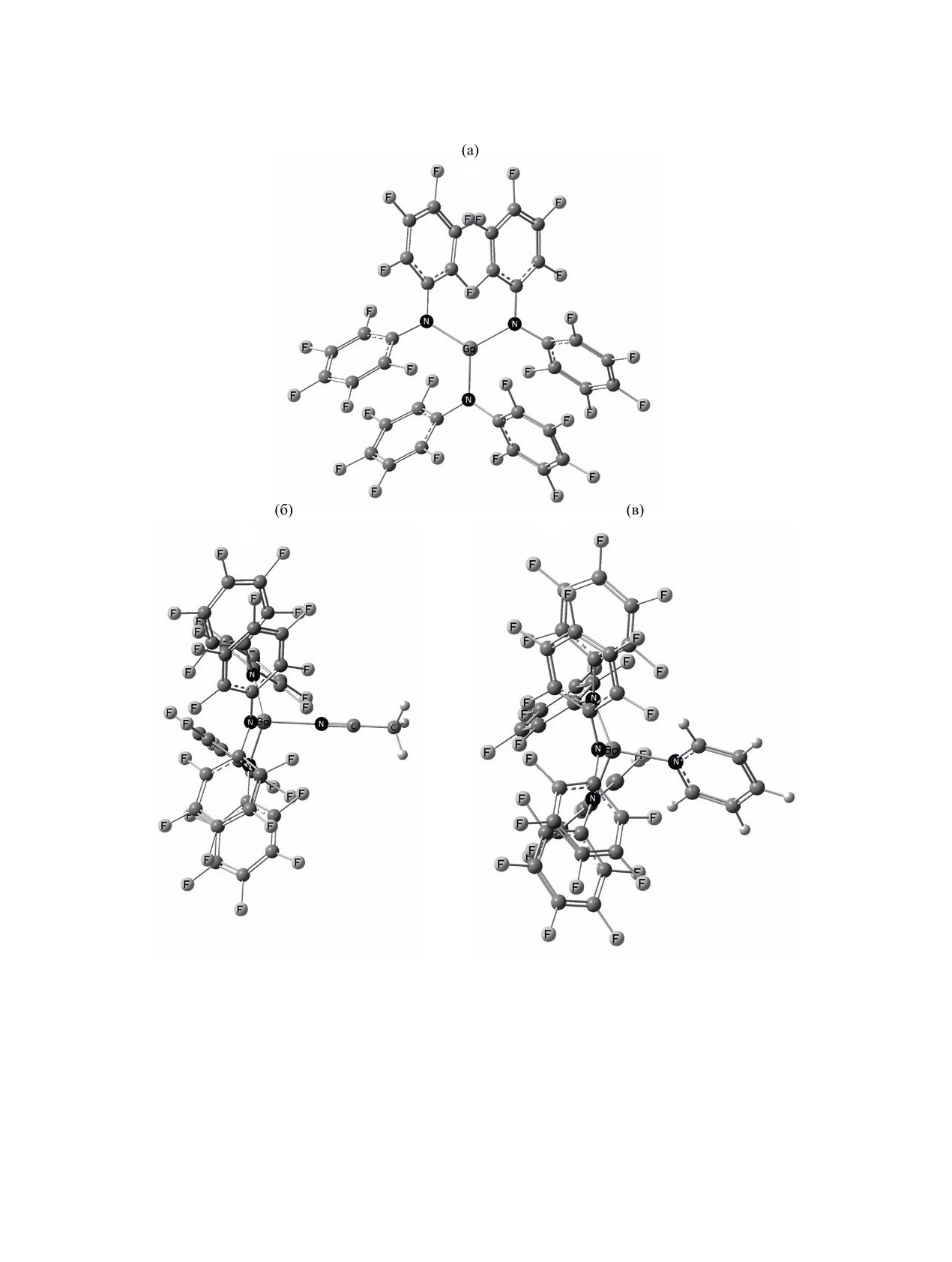
представлены на рисунке.
На первой стадии синтезировали амин HN(C6F5)2,
переводили его в амид LiN(C6F5)2, который на тре-
Структура Ga[N(C6F5)2]3 дополнительно стаби-
тьей стадии реагировал с трихлоридом галлия с
лизирована за счет попарного π-сопряжения бензо-
образованием Ga[N(C6F5)2]3 [12]. Синтез комплек-
льных колец N(C6F5)2-групп. Это сопряжение про-
сов проводили in situ добавлением ацетонитрила
является как в структуре молекулы Ga[N(C6F5)2]3 в
и пиридина к приготовленному в предыдущем
кристалле [12], так и в оптимизированной структу-
опыте раствору кислоты Льюиса Ga[N(C6F5)2]3 в
ре в газовой фазе (см. рисунок, а). Оптимизирован-
толуоле. Полученные растворы охарактеризовали
ная геометрия в газовой фазе хорошо согласуется
методом спектроскопии ЯМР 19F. На основании
с экспериментальными данными [12]. Ожидаемо,
анализа спектров ЯМР можно сделать вывод, что
длины связей Ga-N в оптимизированной структу-
кислота Льюиса Ga[N(C6F5)2]3 в растворе толуола
ре в газовой фазе в среднем на 0.041 Å больше, чем
претерпевает заметные изменения при добавлении
в экспериментальной структуре в кристалле.
пиридина или ацетонитрила. Так, синглет, соот-
Энергия молекулярной орбитали, значитель-
ветствующий орто-атомам фтора C6F5-группы
ный вклад в которую (около 50%) вносит непо-
сдвигается в сторону слабого поля (от -154.5 до
деленная пара на атоме азота (ВЗМО-2, -12.17 эВ
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
КОМПЛЕКСООБР
АЗОВАНИЕ КИСЛОТЫ ЛЬЮИСА Ga[N(C6F5)2]3
1905
Оптимизированная геометрия кислоты Льюиса Ga[N(C6F5)2]3 (а) и ее комплексов с ацетонитрилом (б) и пиридином (в).
Уровень теории M06-2X/6-311++G(2d,p).
для MeCN и ВЗМО-1, -8.81 эВ для Py) при ком-
комплекса вклад этой орбитали увеличивается до
плексообразовании с Ga[N(C6F5)2]3 повышается
57-60%. При этом энергия НСМО в пирамидали-
на 0.02 (MeCN) и 0.11 эВ (Py). В НСМО свободно-
зированном фрагменте понижается по сравнению
го Ga[N(C6F5)2]3 значительный вклад (около 32%)
с энергией D3 симметричной молекулы на 1.3 эВ
вносит вакантная орбиталь галлия, причем при
(комплекс с ацетонитрилом) и на 1.8 эВ (комплекс
перестройке акцепторного фрагмента в геометрию
с пиридином). Такие энергетические изменения
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1906
ЗАВГОРОДНИЙ и др.
а
по сравнению с пиридином при комплексообра-
Расчетные характеристики газофазных комплексов
зовании с Ga[N(C6F5)2]3, в то время как энергети-
ческие характеристики (энтальпии диссоциации
комплексов и энергии донорно-акцепторная свя-
Характеристика
зи) свидетельствуют об обратном. Следует отме-
комплекса
тить, что подобная ситуация недавно наблюдалась
нами и для комплексов пентахлорида сурьмы с
пиридином и ацетонитрилом: при одинаковой (в
пределах погрешности эксперимента) длине до-
R(DA), Å
2.071
2.080
норно-акцепторная связи энергия донорно-акцеп-
ΔH0298(diss), кДж/моль
80.1
112.4
торная связи в комплексах SbCl5·MeCN и SbCl5·Py
ΔS0298(diss), Дж/(моль·K)
130.5
206.2
ΔG0298(diss), кДж/моль
41.2
50.9
различалась на 92 кДж/моль [16]. Таким образом,
ΔEdiss, кДж/моль
84.6
119.3
результаты, полученные в настоящей работе, со-
Eпер(D), кДж/моль
0.7
3.0
гласуются с мнением [17], что структурные кри-
Eпер(А), кДж/моль
49.1
84.4
терии Льюисовской кислотности, такие как длина
Eсв(Ga-N), кДж/моль
134.4
206.7
донорно-акцепторная связи, следует использовать
qПЗ, ē
0.18
0.16
с осторожностью.
Σ(NGaN), град
344
336
Проведенные нами квантово-химические
EНСМО(А), эВ
-2.81
-3.30
расчеты влияния растворителя на комплексо-
ΔqN(D), ē
-0.13
-0.17
образование показывают, что в целом роль рас-
а
Уровень теории M06-2X/6-311++G(2d,p).
творителя невелика. Изменение энергии диссо-
циации комплексов на компоненты ΔΔdissE при
способствуют образованию комплекса и свиде-
переходе из газовой фазы в бензол, диэтиловый
тельствует о более эффективном комплексообра-
эфир, дихлорметан и ацетонитрил составляет 5.2,
зовании с пиридином.
2.3, 0.0, -2.3 кДж/моль соответственно для ком-
Поскольку пиридин (донорное число 33.1 [15])
плекса Ga[N(C6F5)2]3·MeCN, и -1.5, -3.3, -5.8,
является более сильным донором, чем ацетони-
-5.9 кДж/моль для комплекса Ga[N(C6F5)2]3·Py.
трил (донорное число 14.1 [15]) то вполне зако-
Следовательно, при увеличении диэлектрической
номерно, что энтальпия диссоциации комплекса с
проницаемости растворителя ε энергия диссоци-
пиридином более эндотермична (см. таблицу). Это
ации комплекса уменьшается, что обусловлено
согласуется с большей пирамидализацией акцеп-
большей стабилизацией продуктов диссоциации в
торного фрагмента при комплексообразовании, о
полярных растворителях.
чем можно судить по уменьшению суммы валент-
ных углов NGaN во фрагменте Ga[N(C6F5)2]3 (см.
Квантово-химические расчеты показывают,
таблицу).
что Ga[N(C6F5)2]3 (FIA 472) является чуть более
сильной кислотой Льюиса, чем Ga(C6F5)3 (FIA 465
Стерическое напряжение (обусловленное в
[18]). Энергии донорно-акцепторной связи в ком-
том числе и взаимодействием атомов фтора с ато-
плексах этих кислот Льюиса с ацетонитрилом так-
мами водорода пиридина), связанное с образо-
же близки: 134 кДж/моль для Ga[N(C6F5)2]3·MeCN
ванием комплекса Ga[N(C6F5)2]3·Py отражается
и 126 кДж/моль для Ga(C6F5)3·MeCN [19]. Отме-
как в заметно большей величине энергии пере-
тим, что энергия перестройки плоского акцеп-
стройки Ga[N(C6F5)2]3 фрагмента, так и в боль-
торного фрагмента при образовании комплекса с
шей длине донорно-акцепторной связи Ga-N в
ацетонитрилом для Ga[N(C6F5)2]3 (49 кДж/моль)
Ga[N(C6F5)2]3·Py (см. таблицу). По-видимому,
заметно больше, чем для Ga(C6F5)3 (21 кДж/моль
именно более короткая донорно-акцепторная
[19]), что свидетельствует о дополнительной ста-
связь обуславливает больший перенос заряда с до-
билизации плоского Ga[N(C6F5)2]3 и понижению
норного на акцепторный фрагменты в комплексе с
его льюисовской кислотности.
ацетонитрилом. Величины переноса заряда и дли-
ны донорно-акцепторная связи свидетельствуют
Таким образом, методом спектроскопии ЯМР
о большей донорной способности ацетонитрила
установлено образование донорно-акцепторных
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
КОМПЛЕКСООБР
АЗОВАНИЕ КИСЛОТЫ ЛЬЮИСА Ga[N(C6F5)2]3
1907
комплексов кислоты Льюиса Ga[N(C6F5)2]3 с
до 4, затем добавляли диэтиловый эфир. Отделяли
ацетонитрилом и пиридином. Квантово-химиче-
органическую фазу, сушили безводным сульфатом
ским методом рассчитаны энергии донорно-ак-
натрия в течение суток, после чего удаляли раство-
цепторная связи в этих комплексах, равные 134 и
ритель. Остаток переносили в колбу Шленка и пе-
207 кДж/моль соответственно. Более короткая
ресублимировали под вакуумом при 90°С. Полу-
донорно-акцепторная связь Ga-N в комплексе с
ченный грязно-белый твердый продукт собирали в
ацетонитрилом является на 73 кДж/моль менее
атмосфере аргона и пересублимировали вторично.
прочной, чем в комплексе с пиридином, что со-
Выход 19.53 г (57.4%), белое твердое вещество.
гласуется с частичной диссоциацией комплекса
Синтез LiN(C6F5)2.
15.714 г HN(C6F5)2
Ga[N(C6F5)2]3·MeCN в растворе толуола, по дан-
(45.03 ммоль, 1 экв.) растворяли в 90 мл ТГФ в ат-
ным ЯМР. Причиной этого могут быть стериче-
мосфере аргона. Раствор охлаждали до -78°С, по-
ские затруднения для образования комплекса от-
сле чего добавляли 18 мл 2.5 М. раствора н-бутил-
носительно крупного донора пиридина с объемной
лития в гексане (45 ммоль, 1 экв.). Полученную
молекулой Ga[N(C6F5)2]3. Структурные и энерге-
смесь перемешивали при -78°С в течение 1 ч, за-
тические характеристики приводят к разным ве-
тем медленно нагревали до комнатной температу-
личинам кислотности акцептора по отношению
ры. После удаления растворителя в вакууме обра-
к нейтральным молекулам, что свидетельствует о
зовавшийся желтый порошок сушили в вакууме в
необходимости создания различных шкал кислот-
течение ночи. Выход 14.514 г (90.5%), белое твер-
ности кислот Льюиса.
дое вещество
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез Ga[(N(C6F5)2]3.
550 мг GaCl3
Во избежание контакта со следами воды и кис-
(3.12 ммоль,
1 экв.) и
4.295 г LiN(C6F5)2
лорода воздуха, все операции по синтезу и взя-
(12.06 ммоль, 4 экв.) растворяли в 20 и 60 мл то-
тию навесок проводили с использованием линии
луола в атмосфере аргона. Раствор LiN(C6F5)2
Шленка или перчаточного бокса mBraun Labmaster
охлаждали до -78°С и приливали к нему раствор
SP в атмосфере чистого аргона (содержание воды
GaCl3, после чего смесь перемешивали при ох-
и кислорода менее 0.1 м. д.). Реактивы GaCl3 (Alfa
лаждении в течение 1 ч, затем реакционную смесь
Aesar, 99.999%), NaNH2 (Sigma Aldrich, 98%),
оставляли для нагревания до комнатной темпера-
п-BuLi (Acros, 2.5M раствор в гексане), С6F6 (TCI
туры в течение 1 ч, после чего выдерживали при
Chemicals, 99.0%) использовали без дополнитель-
80-90°С в течение 19 ч. Полученный бурый рас-
ной очистки. Безводные растворители ТГФ, диэти-
твор отфильтровали через целиты в атмосфере ар-
ловый эфир, толуол, а также ацетонитрил и пири-
гона при 70°С. Спектр ЯМР 19F{H} (толуол), δF,
дин (Sigma Aldrich) очищали с помощью системы
м. д.: -147.10 (p-F, J = 88.3 Гц), -154.47 (o-F),
очистки растворителей mBraun SPS800, дегазиро-
-163.56 м (m-F).
вали на линии Шленка и выдерживали над активи-
Синтез Ga[N(C6F5)2]3·MeCN и Ga[N(C6F5)2]3·
рованными цеолитами марки 4 Å не менее суток.
Py. 1.793 г GaCl3 (10.16 ммоль, 1 экв.) и 10.785 г
Спектры ЯМР измеряли при комнатной тем-
LiN(C6F5)2 (30.38 ммоль, 3 экв.) растворяли в ат-
пературе на приборе Bruker AVMeCNCE NEO
мосфере аргона в 50 и 150 мл толуола соответ-
600, резонансная частота в спектре ЯМР 19F{H} -
ственно. Раствор LiN(C6F5)2 охлаждали до -78°С
565 МГц. В качестве внешнего стандарта исполь-
и приливали к нему раствор GaCl3, после чего
зовали CFCl3.
смесь перемешивали при охлаждении в течение
Синтез HN(C6F5)2. В атмосфере аргона к рас-
1 ч, затем реакционную смесь оставляли для на-
твору 8.545 г NaNH2 (0.219 моль, 4.5 экв.) в 100 мл
гревания до комнатной температуры в течение 1 ч,
ТГФ приливали 18.4 мл (36.4 г, 0.195 моль, 1 экв.)
после чего выдерживали при 80-90°С в течение 20
гексафторбензола при помощи капельной ворон-
ч. Полученный бурый раствор фильтровали через
ки при перемешивании в течение 20 мин. Раствор
целиты в атмосфере аргона при 70°С. Фильтрат
кипятили в течение 3 ч. После охлаждения прили-
делили на две равные части и приливали к ним
вали 150 мл дистиллированной воды и концентри-
по 3 мл ацетонитрила и пиридина соответствен-
рованной соляной кислотой доводили рН раствора
но. Полученные растворы характеризовали мето-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1908
ЗАВГОРОДНИЙ и др.
дом ЯМР 19F. Ga[(N(C6F5)2]3·MeCN. Спектр ЯМР
соединений в ацетонитриле показала, что измене-
19F{H} (толуол), δF, м. д.: -147.46 д. д (o-F, J = 45.3,
ние геометрии кислоты Льюиса и ее комплексов
19.8 Гц), -165.10 д. т (p-F, J = 190.2, 21.5 Гц),
под влиянием растворителя невелико и это изме-
-166.85 д. т (m-F, J = 204.3, 21.1 Гц); сигнал
нение крайне мало влияет на энергию диссоциа-
свободного Ga[(N(C6F5)2]3 регистрируется при
ции комплексов (различие ΔdissE не превышает
-154.82 м. д. (д, o-F, J = 17.1 Гц), интенсивность
1 кДж/моль как для комплекса с ацетонитрилом,
3% относительно сигнала o-F-группы в донорно-
так и для комплекса с пиридином.) Поэтому в
акцепторном комплексе. Ga[(N(C6F5)2]3·Py.
статье приведены результаты расчетов энергии
Спектр ЯМР 19F{H} (толуол), δF, м. д.: -147.41
сольватации молекул в геометрии, оптимизиро-
(o-F), -165.68 д. т (p-F, J = 90.7, 21.2 Гц), -167.11
ванной в газовой фазе.
д. т (m-F, J = 75.5, 19.8 Гц). Попытки вырастить
БЛАГОДАРНОСТЬ
монокристаллы комплексов из растворов путем
Авторы выражают благодарность научной груп-
охлаждения растворов, слоевания и выпаривания
пе профессора Й. Бекмана (Университет Бремена,
не увенчались успехом.
Германия), в частности Ю. Кегелю, Д. Дювинажу,
Квантово-химические расчеты в газовой фазе
Ф. Файге и М. Олару за помощь в эксперименталь-
выполнены с использованием стандартного пакета
ной части работы.
программ Gaussian 16 [20] в рамках теории функ-
ционала плотности методом M06-2X [21], учиты-
ФОНДОВАЯ ПОДДЕРЖКА
вающим дисперсионное взаимодействие, с полно-
Работа выполнена при финансовой поддерж-
электронным базисными набором 6-311++G(2d,p),
ке Российского научного фонда (грант № 18-
включающим диффузные функции. Структуры
13-00196) с использованием оборудования Вы-
всех соединений в газовой фазе полностью оп-
числительного центра Санкт-Петербургского
тимизированы с последующим колебательным
государственного университета и Центра химии
анализом и отвечают минимуму на поверхности
Университета Бремена (UBS-Zentrum für Chemie).
потенциальной энергии. Энергия донорно-акцеп-
КОНФЛИКТ ИНТЕРЕСОВ
торной связи определялась как сумма энергии дис-
социации комплекса и энергий перестройки до-
Авторы заявляют об отсутствии конфликта
норного (MeCN, Py) и акцепторного Ga[N(C6F5)2]3
интересов.
фрагментов из геометрии, оптимальной для этих
СПИСОК ЛИТЕРАТУРЫ
молекул в газовой фазе, в геометрию, которую они
принимают в комплексе. Перенос заряда в ком-
1. Fringuelli F., Piermatti O., Pizzo F. Vaccaro L. //
Eur. J. Org. Chem.
2001. Vol.
3. P.
439. doi
плексах оценивался через натуральную заселен-
10.1002/1099-0690(200102)2001:3<439::AID-
ность атомов (NPA) в рамках метода натуральных
EJOC439>3.0.CO;2-B
связывающих орбиталей (NBO) [23, 24].
2. Suyama K., Matsumoto K. Katsuki T. // Heterocycles.
Оценку влияния растворителя на процесс дис-
2009. Vol. 77. P. 817. doi 10.3987/COM-08-S(F)93.
социации комплексов проводили методом SMD
3. Flynn A.J., Fordband A., Maguire A.R. // Org. Biomol.
[25], в котором помимо поляризационного взаи-
Chem. 2020. Vol. 18. P. 2549. doi 10.1039/c9ob02587a
модействия молекулы со средой, рассчитываемого
4. Pellissier H. // Org. Biomol. Chem. 2017. Vol. 15.
методом самосогласованного поля реакции [26],
P. 4750 doi 10.1039/c7ob00903h
5. Stephan D.W. // J. Am. Chem. Soc. 2015 Vol. 137.
дополнительно рассчитывается вклад, определя-
P. 10018. doi 10.1021/jacs.5b06794
емый балансом сил дисперсионного притяжения
6. Riddlestone I.M., Kraft A., Schaefer J., Krossing I. //
и отталкивания электронных оболочек молекулы
Angew. Chem. Int. Ed. 2018. Vol. 57. P. 13982. doi
растворенного вещества с молекулами раствори-
10.1002/anie.201710782
теля. В качестве растворителей выбирали поляр-
7. Haartz J.C., McDaniel D.H. // J. Am. Chem. Soc. 1973.
ный ионизирующий растворитель ацетонитрил
Vol. 95. P. 8562. doi 10.1021/ja00807a011
(ε = 35.688), неполярный бензол (ε = 2.2706), а так-
8. Olah G.A., Prakash G.K.S., Sommer J. // Science 1979.
же диэтиловый эфир (ε = 4.240) и дихлорметан (ε =
Vol. 206. P. 13. doi 10.1126/science.206.4414.13
8.930). Оптимизация геометрии рассматриваемых
9. Blander M., Epel L.G., Fraas A.P., Newton R.F.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
КОМПЛЕКСООБР
АЗОВАНИЕ КИСЛОТЫ ЛЬЮИСА Ga[N(C6F5)2]3
1909
Aluminum chloride as a thermodynamic working fluid
2020. Vol. 646. P. 873. doi 10.1002/zaac.202000030
and heat transfer medium. Oak Ridge: Oak Ridge
20.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
National Lab., 1959. 29 p. doi 10.2172/4209651
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
10.
Müller L.O., Himmel D., Stauffer J., Steinfeld G.,
Petersson G.A., Nakatsuji H., Li X., Caricato M.,
Slattery J., Santiso-Quinones G., Brecht V., Krossing I. //
Marenich A.V., Bloino J., Janesko B.G., Gomperts R.,
Angew. Chem. Int. Ed. 2008. Vol. 47. P. 7659. doi
Mennucci B., Hratchian H.P., Ortiz J.V., Izmaylov A.F.,
10.1002/anie.200800783
Sonnenberg J.L.,Williams-YoungD.,DingF.,LippariniF.,
11.
Kögel J.F., Timoshkin A.Y., Schroder A., Lork E.,
Egidi F., Goings J., Peng B., Petrone A., Henderson T.,
Beckmann J. // Chem. Sci. 2018. Vol. 9. P. 8178. doi
Ranasinghe D., Zakrzewski V.G., Gao J., Rega N., Zheng G.,
10.1039/c8sc02981d
Liang W., Hada M., Ehara M., Toyota K., Fukuda R.,
12.
Kögel J.F., Sorokin D.A., Khvorost A., Scott M., Harms K.,
Hasegawa J., Ishida M., Nakajima T., Honda Y., Kitao O.,
Himmel D., Krossing I., Sundermeyer J. // Chem. Sci.
Nakai H., Vreven T., Throssell K., Montgomery J.A.,
2018. Vol. 9. P. 245. doi 10.1039/c7sc03988c
Peralta J.E., Ogliaro F., Bearpark M.J., Heyd J.J.,
13.
Böhrer H., Trapp N., Himmel D., Schleep M., Krossing I. //
Dalton Trans. 2015. Vol. 44. P. 7489. doi 10.1039/
Brothers E.N., Kudin K.N., Staroverov V.N., Keith T.A.,
C4DT02822H
Kobayashi R., Normand J., Raghavachari K., Ren-
14.
Гурьянова Е.Н., Гольдштейн И.П., Ромм И.П. До-
dell A.P., Burant J.C., Iyengar S.S., Tomasi J., Cossi M.,
норно-акцепторная связь. М.: Химия, 1973. 397 с.
Millam J.M., Klene M., Adamo C., Cammi R., Ochter-
15.
Gutmann V. // Coord. Chem. Rev. 1976. Vol. 18. P. 225.
ski J.W., Martin R.L., Morokuma K., Farkas O.,
doi 10.1016/S0010-8545(00)82045-7
Foresman J.B., Fox D.J. // Gaussian 16, Revision A.03;
16.
Давыдова Е.И., Вировец А.В., Пересыпкина Е.В.,
Gaussian, Inc.: Wallingford, CT. 2016.
Казаков И.В., Тимошкин А.Ю. // Изв. АН. Сер. хим.
21.
Zhao Y., Truhlar D.G. // Theor. Chem. Acc. 2008.
2020. Т. 69. № 1. С. 84; Davydova E.I., Virovets A.V.,
Vol. 120. P. 215. doi 10.1007/s00214-007-0310-x
Peresypkina E.V., Kazakov I.V., Timoshkin A.Y. // Russ.
22.
Weigend F., Ahlrichs R. // Phys. Chem. Chem. Phys.
Chem. Bull. 2020 Vol. 69. P. 84. doi 10.1007/s11172-
2005. Vol. 7. P. 3297. doi 10.1039/B508541A
020-2726-6
23.
Reed A.E., Curtiss L.A., Weinhold F. // Chem. Rev.
17.
Timoshkin A.Y., Bodensteiner M., Sevastianova T.N.,
1988. Vol. 88. P. 899. doi 10.1021/cr00088a005
Lisovenko A.S., Davydova E.I., Scheer M., Graßl C.,
24.
Glendening D., Reed A.E., Carpenter J.E., Weinhold F.
Butlak A.V. // Inorg. Chem. 2012. Vol. 51. P. 11602. doi
NBO Version 3.1, Gaussian Inc., Pittsburgh., 2003.
10.1021/ic301507c.
18.
Timoshkin A.Y., Frenking G. // Organometallics. 2008.
25.
Marenich A.V., Cramer C.J., Truhlar D.G. // J. Phys.
Vol. 27. P. 371. doi 10.1021/om700798t
Chem. (B). 2009. Vol. 113. Р. 6378. doi 10.1021/
19.
Shcherbina N.A., Pomogaeva A.V., Lisovenko A.S.,
jp810292n
Kazakov I.V., Gugin N.Y., Khoroshilova O.V.,
26.
Cancès E., Mennucci B., Tomasi J. // J. Chem.
Kondrat’ev Y.V., Timoshkin A.Y. // Z. anorg. allg. Chem.
Phys.1997. Vol. 107. P. 3032. doi 10.1063/1.474659
Complexes of Lewis Acid Ga[N(C6F5)2]3 with Acetonitrile
and Pyridine
A. S. Zavgorodnii, А. V. Pomogaeva, and A. Y. Timoshkin*
St. Petersburg State University, St. Petersburg, 199034 Russia
*e-mail: a.y.timoshkin@spbu.ru
Received September 15, 2020; revised September 21, 2020; accepted September 23, 2020
Interaction of Lewis acid Ga[N(C6F5)2]3 with acetonitrile and pyridine in toluene solution was characterized by
19F NMR. Quantum chemical computations show that shorter donor-acceptor bond in acetonitrile complex is by
73 kJ/mol weaker than longer donor-acceptor bond in Py complex, which agrees with partial dissociation of
Ga[N(C6F5)2]3·MeCN complex in solution. The longer DA bond length in pyridine complex is attributed to
steric hindrance of bulky Lewis acid Ga[N(C6F5)2]3.
Keywords: gallium decafluorodiphenylamide, pyridine, acetonitrile, donor-acceptor complex, quantum
chemical computations
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020