ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 12, с. 1921-1926
УДК 546.289.131;654.49;546.593
СОСТАВ, СТРОЕНИЕ ПРОДУКТОВ
КОМПЛЕКСООБРАЗОВАНИЯ В СИСТЕМАХ
GeCl4-ИЗОНИКОТИНОИЛГИДРАЗОН
2-ГИДРОКСИБЕНЗОЛ(2-ГИДРОКСИНАФТАЛИН-1)-
КАРБАЛЬДЕГИДА-ZnCl2-МЕТАНОЛ
© 2020 г. Н. В. Шматковаa,*, И. И. Сейфуллинаa, Л. С. Скороходa, А. Н. Морозовb,
Л. Д. Поповb, Г. А. Газиеваc
a Одесский национальный университет имени И. И. Мечниковa, ул. Дворянская 2, Одесса, 65082 Украина
b Южный федеральный университет, Ростов-на-Дону, 344090 Россия
c Институт органической химии имени Н. Д. Зелинского Российской академии наук, Москва, 119991 Россия
*e-mail: nshmatkova@ukr.net
Поступило в Редакцию 20 июля 2020 г.
После доработки 20 июля 2020 г.
Принято к печати 1 августа 2020 г.
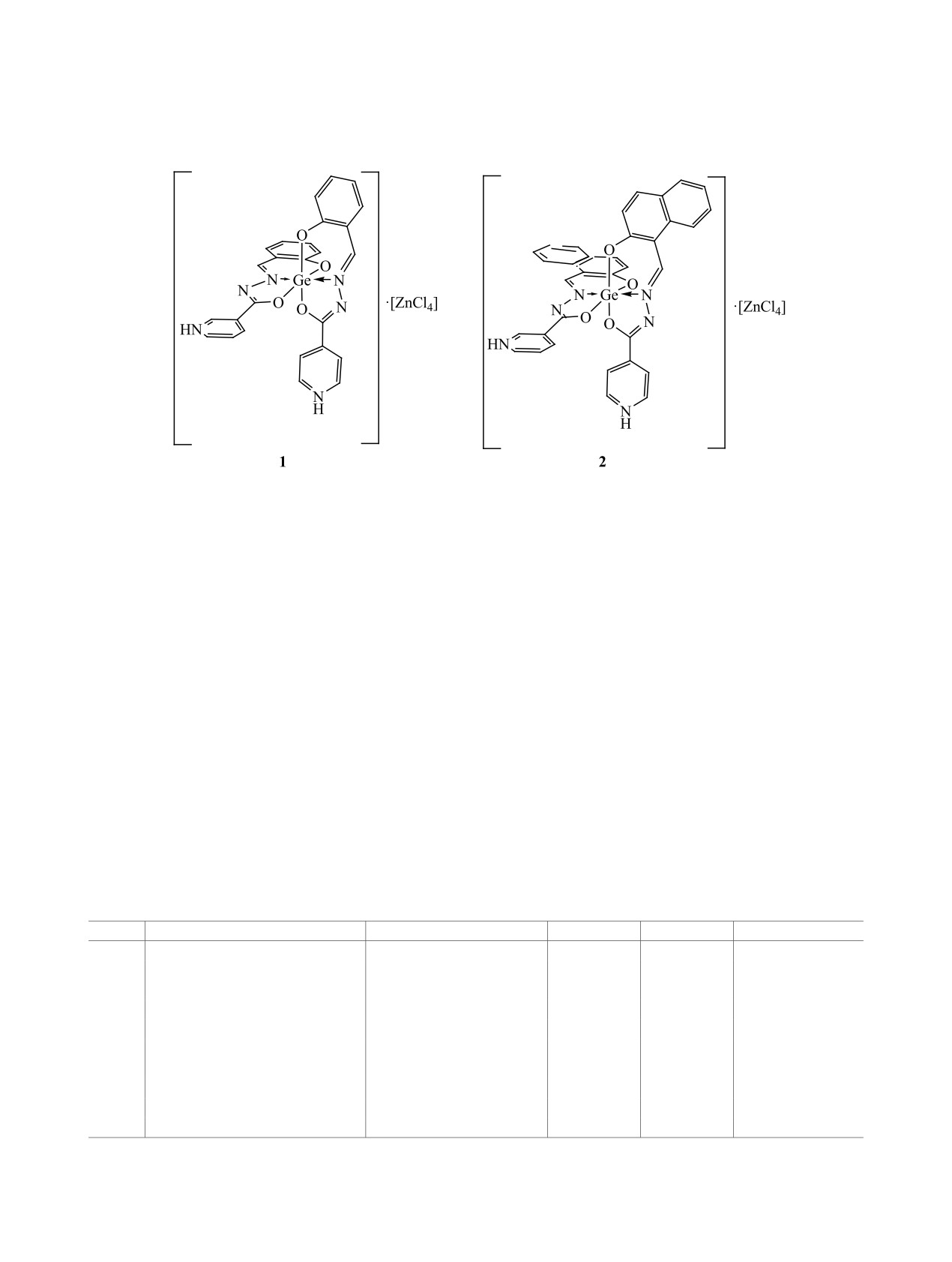
Из систем изоникотиноилгидразон 2-гидроксибензол(2-гидроксинафтил-1)карбальдегида (H2L)-GeCl4-
ZnCl2-CH3OH впервые выделены тетрахлороцинкаты [Ge(LH)2][ZnCl4]∙CH3OH, в которых катионами
служат протонированные по пиридиновому атому азота комплексы [Ge(L·H)2]2+ c лигандами L, три-
дентатно координированными через азометиновый атом азота и атомы кислорода депротонированных
гидроксиазино- и гидроксигрупп. Комплексы исследованы с применением методов кондуктометрии,
термогравиметрии, ИК и ЯМР 1Н спектроскопии.
Ключевые слова: изоникотиноилгидразон, тетрахлорид германия, тетрахлороцинкат, комплекс герма-
ния(IV)
DOI: 10.31857/S0044460X2012015X
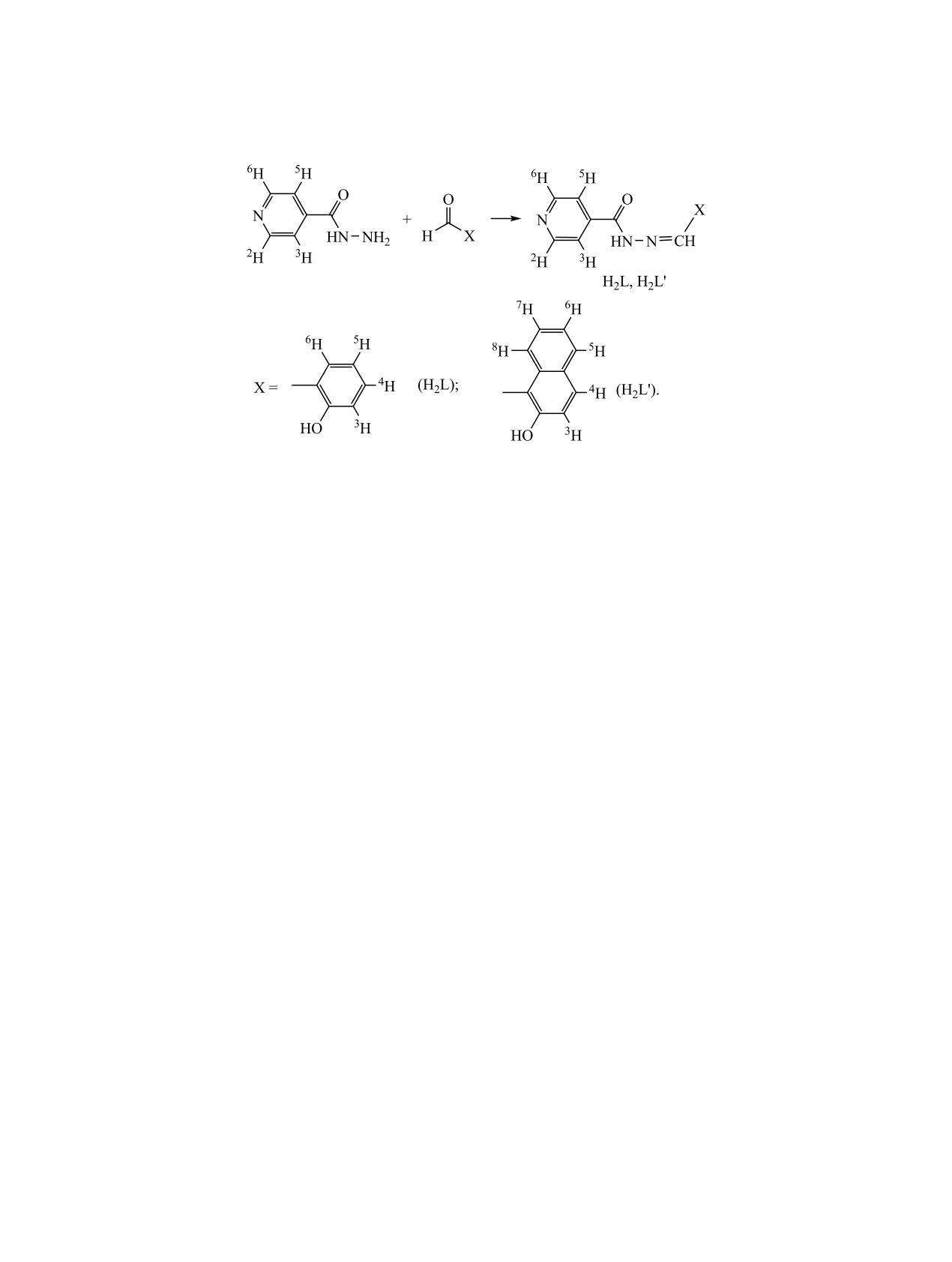
Функционализация молекул бензоилгидразо-
2H2L + 2 GeCl4 + nROH
нов 2-гидроксиаренкарбальдегидов (H2L) введени-
→ [Ge(L∙HCl)2]раствор + GeCl4-n(OR)n + (n + 2)HCl. (1)
ем аминогруппы в бензоильный фрагмент [1] либо
Исходя из уравнения
(1), соответствующие
замена последнего на β-, γ-пиридинкарбонильный
тетрахлорометаллаты комплексных катионов
[2, 3] в системе GeCl4-гидразон (H2L)-метанол
[Ge(L∙H)2]2+ могут быть получены при введении
(этанол) приводит к комплексам [Ge(L∙HCl)2] с
в систему (1) хлорида двухвалентного металла в
лигандами, тридентатно координированными че-
условиях, исключающих предварительное образо-
рез азометиновый атом азота и атомы кислорода
вание осадка комплекса [Ge(L∙HCl)2], (2). Это под-
депротонированных гидроксиазинной и гидрок-
тверждено на примере реакции с CoCl2 [5].
сигрупп, в гидрохлоридной форме [1-3]. Обра-
[Ge(L∙HCl)2]раствор + МCl2 → [Ge(L∙H)2][МCl4].
(2)
зование гидрохлоридной формы происходит за
счёт протонирования удаленных от координаци-
Нами получены подобные супрамолекулярные
онного узла германия(IV) атомов азота лиганда,
комплексные соли в системах GeCl4-изоникотино-
в частности, пиридиновых, соляной кислотой,
илгидразон 2-гидроксибензальдегида (H2L) [или
выделяющейся вследствие конкуренции реакций
2-гидроксинафталин-1-карбальдегида
(H2L′)]-
комплексообразования и сольволиза тетрахлорида
ZnCl2-метанол и исследованы их строение и
германия в спиртовой среде [4] (1).
свойства. В молекулах супрамолекулярных солей
1921
1922
ШМАТКОВА и др.
Схема 1.
такого типа присутствуют два физиологически ак-
нием в течение 24 ч) в ДМФА и ДМСО, средне
тивных фрагмента [Ge(L·H)2]2+ [6, 7] и [МCl4]2- ,
растворимые в СН3ОН, в СН3СN (с разложени-
где М - ионы биометаллов Co(II) [8], Zn(II) [9], что
ем) и нерастворимые в ацетоне, нитробензоле,
позволяет предполагать возможность их примене-
хлороформе. В свежеприготовленных растворах
ния в медицине [10].
в ДМФА комплексы диссоциируют как биионные
электролиты с молярной электропроводностью λ =
В системах GeCl4-изоникотиноилгидразон
68 (1) и 72 Ом-1∙см2∙моль-1 (2) [11]. Состав де-
2-гидроксиаренкарбальдегидa
(H2L)-GeCl4-
сольватированных комплексов определяли по кри-
ZnCl2-CH3OH, по результатам элементного анали-
вым ТГ (см. таблицу) и по результатам анализа
за, независимо от мольных соотношений исходных
продуктов их выдерживания при 90 (1) и 110°С (2).
реагентов образуются соединения с соотношени-
Интерпретация кривых термогравиметрическо-
ем Ge:H2L:Zn:Cl = 1:2:1:4, что соответствует фор-
го (ТГ) и дифференциально-термического анализа
мулам [Ge(L∙H)2][ZnCl4]∙CH3OH (1), [Ge(L′∙H)2]∙
(ДТА) показала, что после десольватации термо-
[ZnCl4]∙CH3OH (2) (схема 1). Подбором концен-
распад комплексов имеет ступенчатый характер.
траций компонентов найдены оптимальные усло-
Первая стадия при Тmax = 300 (1) и 310°С (2) сопро-
вия синтеза соединений 1 и 2, исключающие про-
вождается эндоэффектом с образованием продук-
межуточное выделение комплексов [Ge(L∙HCl)2] и
тов дегидрохлорирования, в которых, по результа-
[Ge(L′∙HCl)2] [1, 2].
там термогравиметрического анализа при 230°С,
Комплексы 1, 2 - кристаллические вещества,
мольное соотношение Ge:Zn:гидразон:Cl = 1:1:2:2
хорошо растворимые (с последующим разложе-
указывает на элиминирование в газовую фазу 2
Результаты исследования термической устойчивости сольватов комплексов 1 и 2
№
Температурный интервал по ТГ
Тmax, °С (↑↓, ДТА)
Δm (ТГ), %
Δmтеор, %
Отнесение
1
80-180
100↓
4.0
4.01
- СН3ОН
210-320
300↓
10.0
9.21
- 2НCl
480-530
490↑; 520↑
25.5
530-770
750↑
16.0
770-980
890↑
20.0
2
80-160
150↓
4.5
3.59
- СН3ОН
230-320
310↓
8.1
8.18
- 2НCl
520-560
550↑
38.8
560-660
600↑
14.5
660-850
830↑
12.7
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
СОСТАВ, СТРОЕНИЕ ПРОДУКТОВ КОМПЛЕКСООБР
АЗОВАНИЯ
1923
Схема 2.
моль НCl, что согласуется с величинами Δmвыдерж =
[2, 5] и появляются новые слабые полосы ν(Ge-O)
9.5
(1),
8.4%
(2), Δmтеор(-2НCl), Δm(ТГ) (см.
и ν(Ge←N) при ~680 и 620 см-1 [1-3]. Указанные
таблицу) и подтверждается качественными реак-
изменения, а также интенсивные полосы скелет-
циями выделяющегося газа на хлорид-ион (поло-
ных колебаний фрагмента >C=N-N=C< в области
жительная проба с раствором AgNO3 ) и на отсут-
1610-1605 см-1 [12-14], свидетельствуют о суще-
ствие Cl2 (отрицательная проба с раствором KI).
ствовании лигандов в енольной форме. Лиганды
тридентатно связываются с германием через атом
Дегидрохлорирование комплексов 1 и 2, сопро-
азота азометиновой группы и атомы кислорода
вождающееся удалением двух ковалентно связан-
ных хлорид-ионов от [ZnCl4]2-, происходит при
депротонированных гидроксиазинной и гидрокси-
более высокой температуре, чем от соответству-
групп. В спектрах комплексов 1 и 2, как и в спек-
ющих комплексов [Ge(L∙HCl)2] [1, 2], выделение
тре комплекса [Ge(L′∙HCl)2] [2], деформационные
в газовую фазу молекул хлороводорода (3) из ко-
колебания пиридинового кольца гипсохромно сме-
щаются на 10-12 см-1 по сравнению с гидразонами
торых происходит в интервале 130-290°С (Тmax =
230-240↓).
(~400, 1000 см-1), следовательно, в состав комплексов
1 и 2 входят лиганды, протонированные по пири-
[Ge(L∙HCl)2] → [Ge(L)2] + 2 HCl.
(3)
диновому атому азота [2, 3].
При нагревании образцов комплексов 1 и 2
Из практически одинакового набора основных
выше 480°С (см. таблицу) происходит окисли-
полос поглощения в ИК спектрах всех комплек-
тельная термодеструкция органических частей
сов следует, что в соединениях 1 и 2 комплексные
молекул с образованием в качестве конечных
катионы
[Ge(L∙H)2]2+, [Ge(L′∙H)2]2+ по составу
продуктов термолиза смеси GeO2 и ZnO, что под-
и строению идентичны катионам в комплексах
тверждается хорошей сходимостью рассчитанных
[Ge(L∙HCl)2] [3] и [Ge(L′∙HCl)2]·5H2O [2].
[23.5 (1), 20.8% (2)] и наблюдаемых на кривых ТГ
масс остатков [24.5 (1), 21.4% (2)].
При сравнении спектров ЯМР 1H комплекса
[Ge(L∙H)2][ZnCl4]·CH3OH 1 и гидразона H2L за-
Анализ ИК спектров комплексов 1 и 2 [3, 5, 12-
фиксировано исчезновение сигналов протонов
14] и структурно охарактеризованного комплексa
групп Ar-OH и NH-C=O, наблюдавшихся в спек-
[Ge(L′∙HCl)2] [2] показал, что в них по сравнению
тре Н2L, и заметное слабопольное смещение сиг-
с гидразонами {полосы (ν, см-1) при 3380-3370 ш
нала протона в группе СН=N гидразонного фраг-
(OH), 3223-3215 сл, 3190 сл (NH), 3050 сл, 2930 сл
мента. Уширенный сигнал протона, связанного с
(CHкольца), 1694-1682 с (C=O), 1625-1623 с (C=N),
пиридиновым атомом азота NРy-H+, проявляется в
1600 с, 1580 ср, 1490 ср (C=Cкольца), 1570-1560
спектре комплекса 1 при 4.95 м. д.
ср [δ(NH)]} отсутствуют полосы ν(ОН), ν(NH) и
ν(С=О), вместо полосы δ(NН) наблюдаются коле-
Аналогичные спектральные изменения за-
бания группы (N=С-О)- в области 1548-1546 см-1
регистрированы и в спектре ЯМР 1H комплек-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1924
ШМАТКОВА и др.
са [Ge(L′∙H)2][ZnCl4]·CH3OH 2 по сравнению со
связанные с комплексными катионами [Ge(L∙H)2]2+
спектром гидразона Н2L′. В спектре комплекса
и [Ge(L′·H)2]2+ (4).
наблюдается довольно редкое совпадение химиче-
2H2L + GeCl4 + ZnCl2 → [Ge(L∙H)2][ZnCl4] + 2HCl. (4)
ских сдвигов двух расщепленных сигналов хими-
С учетом 3d10-конфигурации Zn2+, координа-
чески неэквивалентных групп протонов при одно-
ционного числа цинка 4 и sp3-гибридизации его
временном совпадении их вицинальных констант.
орбиталей, тетрахлороцинкатный анион представ-
В спектре комплекса 2 обнаружен сигнал, δ 8.08
ляет собой тетраэдр.
м. д., имеющий форму идеального дублета со зна-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
чением вицинальной константы 7.5 Гц (компонен-
ты сигнала имеют небольшое различие в интен-
ИК спектры (4000-200 см-1) гидразонов H2L,
сивности вследствие эффекта Оверхаузера), при
H2L′ и комплексов 1, 2, таблетированных с KBr, за-
этом относительная интегральная интенсивность
писывали на спектрометре Shimadzu FTIR-8400S.
дублета соответствовала трем протонам. С учетом
Спектры ЯМР 1H растворов гидразонов H2L, H2L′
отсутствия в комплексе такого количества химиче-
и комплексов [Ge(L)2], [Ge(L′)2], [Ge(L∙HCl)2],
ски эквивалентных протонов (схема 2), этот сиг-
[Ge(L′∙HCl)2], а также комплексов 1 и 2 в ДМСО-d6
нал, по-видимому, является суммой сигналов двух
регистрировали на спектрометрах VXR-300 Varian
(300 МГц) и Varian Unity 300 (300 МГц). Хими-
протонов H3,5 (дублеты) пиридинового фрагмента
ческие сдвиги сигналов пересчитывали в шкалу
и одного протона Н8 (дублет) нафталиновой части
ТМС.
молекулы.
Термогравиметрические исследования ком-
Данное предположение согласуется с тем, что
плексов 1 и 2 проводили на Q-дериватографе си-
при добавлении D2O отмеченное вырождение сни-
стемы Паулик-Паулик-Эрдей. Образцы нагревали
мается и дублет трансформируется в более слож-
на воздухе от 20 до 1000°С со скоростью 10 град/
ный сигнал, представляющий собой наложение
мин. Навеску вещества 100 мг помещали в плати-
двух дублетов различной интенсивности. Более
новый тигель без крышки, эталон - прокаленный
интенсивный сигнал (от протонов H3,5 пиридино-
оксид алюминия. Продукты отдельных стадий тер-
вой части) смещается в слабое поле на 0.015 м. д.
молиза определяли в соответствии с кривыми ТГ,
При протонном обмене (трансформация связи N-
ДТГ и ДТА при изотермическом выдерживании
H+ в N-D+) вследствие некоторого возрастания
комплексов при в пределах температуры соответ-
относительной электроотрицательности изотопов
ствующих эффектов, убыль массы Δmвыдерж (0.2-
с возрастанием их массового числа дезэкранирую-
0.3%) совпадала с Δm на кривых ТГ. Полученные
щее действие ядра атома дейтерия увеличивается
продукты пиролиза анализировали на содержание
и происходит уменьшение констант экранирова-
хлора и металлов. Количество цинка определяли
ния атомов водорода H3,5 в пиридиновом цикле, а
методом комплексонометрии [15], германия - по-
не в периферийной части молекулы (Н8). Это до-
тенциометрическим титрованием трипирокате-
полнительно подтверждает локализацию протона
хингерманиевой кислоты [16], а также методом
на атоме азота пиридинового кольца.
атомно-эмиссионной спектроскопии с индуктивно
В спектрах ЯМР 1Н ранее полученных ком-
связанной плазмой на приборе Optima 2000 DV
плексов Ge(IV) с протонированной формой ли-
PerkinElmer; углерод, водород и азот определяли
гандов [Ge(L∙HCl)2], [Ge(L′∙HCl)2] [2, 3, 14] на-
с помощью СHN-анализатора Flash EA 1112, хлор
блюдается аналогичный уширенный сигнал
определяли по Шенигеру [17].
протона Npy-H+ в области 4.5-5.0 м. д., который
Удельную электропроводность свежеприготов-
отсутствует в спектрах комплексов-неэлектроли-
ленных 10-3 М. растворов комплексов измеряли в
тов [Ge(L)2] и [Ge(L′)2], полученных кристаллиза-
ДМФА с помощью цифрового измерителя Эконо-
цией [Ge(L∙HCl)2], [Ge(L′∙HCl)2] из смеси CH3OH
микс-эксперт, тип электролита определяли в соот-
(C2H5OH)-H2O [14].
ветствии с таблицами [11].
Таким образом, в условиях самосборки ком-
В работе использовали тетрахлорид германия
понентов в системах H2L(H2L′)-GeCl4-ZnCl2-ме-
марки ОСЧ (d 1.89 г/см3), хлорид цинка, получен-
танол образуются тетрахлороцинкатные анионы,
ный дегидратацией кристаллогидрата ZnCl2∙4H2O
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
СОСТАВ, СТРОЕНИЕ ПРОДУКТОВ КОМПЛЕКСООБР
АЗОВАНИЯ
1925
марки ОСЧ, гидразид изоникотиновой кислоты,
мывали диэтиловым эфиром (2×5 мл) и сушили
2-гидроксибензойный альдегид и 2-гидроксинаф-
при 60°С до постоянной массы. Выход сольватов
талин-1-карбальдегид марки Ч, а также раство-
комплексов 79 (1) и 70% (2).
рители ДМФА, ДМСО, ацетонитрил марки ОСЧ,
Бис(N-[(2-оксидофенил)метилиден]пири-
этанол, хлороформ, ацетон марки ХЧ и метанол,
диний-4-карбогидразоноат}тетрахлороцинкат
диэтиловый эфир, очищенные и абсолютирован-
германия(IV) (сольват с метанолом). Спектр
ные по методикам [18].
ЯМР 1Н (ДМСО-d6), δ, м. д. (J, Гц): 4.95 уш. с (1Н,
Изоникотиноилгидразоны
2-гидроксибен-
NH+), 6.78 д (1Н, Н6Ar, 3J = 8.2), 7.02 т (1Н, Н4Ar, 3J
зальдегида (H2L) и 2-гидроксинафталин-1-кар-
= 7.6), 7.52 т. д (1Н, Н5Ar, 3J = 7.7, 4J = 1.8), 7.77 д
бальдегида (H2L′) получены конденсацией гидра-
(1Н, Н3Ar, 3J = 7.6), 8.04 д (2Н, Н3,5Py, 3J = 5.7), 8.81
зида изоникотиновой кислоты с альдегидами [2,
д (2Н, H2,6Py, 3J = 5.7), 9.61 с (1Н, СН=N). Найдено,
3] (схема 2). К насыщенным растворам 0.1 моль
%: С 40.87; Н 3.08; Сl 17.96; Ge 9.15; N 10.71; Zn
гидразида в этаноле прибавляли 0.1 моль альдеги-
8.18. C27H24Cl4GeN6O5Zn. Вычислено, %: С 40.92;
да, 0.5 мл CH3COOH и кипятили до образования
Н 3.03; Сl 17.94; Ge 9.17; N 10.61; Zn 8.21. М 792.35.
осадка H2L′, который отделяли горячим фильтро-
Десольватированный комплекс 1. Найдено, %: Cl
ванием и промывали метанолом. При получении
18.73; Ge 9.51; Zn 8.47. C26H20Cl4GeN6O4Zn. Вы-
гидразона H2L реакционную смесь кипятили 1 ч с
числено, %: Cl 18.71; Ge 9.55; Zn 8.50.
последующим выдерживанием при 20°С для пол-
Бис{N-[(2-оксидонафталин-1-ил)метилиден]-
ноты осаждения гидразона, который после отде-
пиридиний-4-карбогидразоноат}тетрахлоро-
ления перекристаллизовывали из ацетонитрила.
цинкат германия(IV) (сольват с метанолом).
Чистоту полученных соединений контролировали
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д. (J, Гц): 5.54
методом ТСХ на пластинах Silufol UV-254, элюен-
уш. с (1Н, NH+), 6.97 д (1Н, Н5Naphth, 3J = 7.5), 7.51 т
ты - хлороформ-ацетон, 1:10 (H2L), и хлороформ-
(1Н, Н6Naphth, 3J = 7.5), 7.70 т (1Н, Н7Naphth, 3J = 7.6),
метанол, 20:1 (H2L′).
7.90 д (1Н, Н4Naphth, 3J = 8.1), 8.08 д (3Н, Н8Naphth,
Н3,5Py, 3J = 7.5), 8.63 д (1Н, Н3Naphth, 3J = 8.1), 8.81
N′-[(2-Гидроксифенил)метилиден]пири-
д (2Н, H2,6Py, 3J = 7.5), 10.33 с (1Н, СН=N). Найде-
дин-4-карбогидразид (H2L). Выход 87%, т. пл.
но, %: С 46.05; Н 3.23; Сl 15.96; Ge 8.13; N 9.50; Zn
249°C. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д. (J, Гц):
7.23. C35H28Cl4GeN6O5Zn. Вычислено, %: С 47.10;
6.94 м (2Н, Н4,6Ar) , 7.33 т (1Н, Н5Ar, 3J = 7.6), 7.60 д
Н 3.14; Сl 15.93; Ge 8.14; N 9.42; Zn 7.29. М 892.47.
(1Н, Н3Ar, 3J = 8.1), 7.85 д (2Н, Н3,5Py, 3J = 5.7), 8.70
Десольватированный комплекс 2. Найдено, %: Cl
с (1Н, СН=N), 8.82 д (2Н, H2,6Py, 3J = 5.7), 11.12 уш.
16.50; Ge 8.41; Zn 7.51. C34H24Cl4GeN6O4Zn. Вы-
с (1H, NH-C=O, 12.20 уш. с (1Н, Ar-OH).
числено, %: Cl 16.52; Ge 8.45; Zn 7.56.
N′-(2-Гидроксинафтaлин-1-ил)метилиден]-
пиридин-4-карбогидразид (H2L′). Выход 75%,
КОНФЛИКТ ИНТЕРЕСОВ
т. пл. 255°C. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.
Авторы заявляют об отсутствии конфликта
(J, Гц): 6.94 м (2Н, Н5,6Naphth), 7.33 т (1Н, Н7Naphth,
интересов.
J = 7.6), 7.60 д (1Н, Н4Naphth, J = 8.1), 8.18 м (3Н,
Н8Naphth, Н3,5Py), 8.48 д (1Н, Н3Naphth, J = 8.1), 9.12 д
СПИСОК ЛИТЕРАТУРЫ
(2Н, H2,6Py, J = 7.2), 9.84 с (1Н, СН=N), 12.64 уш. с
1. Сейфуллина И.И., Шматкова Н.В., Старико-
(1H, NH-C=O), 13.01 уш. с (1Н, Ar-OH).
ва З.А. // ЖНХ. 2005. Т. 50. Вып. 7. С. 1079;
Seifullina I.I., Shmatkova N.V., Starikova Z.A. //
Комплексы 1, 2. К горячему (~55°С) раствору
Russ. J. Inorg. Chem. 2005. Vol. 50. N 7. P. 992. doi
2×10-3 моль гидразона H2L′ в 75 мл или к взвеси
9395,35400013146858.0050
гдразона H2L в 20 мл абсолютного метанола при-
2. Сейфуллина И.И., Шматкова Н.В., Шишкин О.В.,
бавляли при перемешивании эквимолярное коли-
Зубатюк Р.И. // ЖНХ. 2007. Т. 52. Вып. 4. С. 550;
чество GeCl4 (0.24 мл). Полученный желтый (H2L)
Seifullina I.I., Shmatkova N.V., Shishkin O.V., Zuba-
или оранжевый (H2L′) раствор выдерживали 5 мин
tyuk R.I. // Russ. J. Inorg. Chem. 2007. Vol. 52. N 4.
при 50°С и прибавляли при перемешивании 2×10-3
Р. 486. doi 10.1134/S0036023607040055
моль ZnCl2. Образовавшиеся желтые осадки ком-
3. Сейфуллина И.И., Шматкова Н.В., Старикова З.А. //
плексов 1 и 2 отделяли из теплых растворов, про-
ЖНХ. 2004. Т.49. № 3. С. 401; Seifullina I.I.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1926
ШМАТКОВА и др.
Shmatkova N.V., Starikova Z.A. // Russ. J. Inorg. Chem.
khin A.O. // J. Struct. Chem. 2010. Vol. 51. N 5. P. 980.
2004. Vol. 49. N 3. Р. 352.
doi 10.1007/s10947-010-0151-7
4. Назарова И.Н., Сейфуллина И.И., Белоусова Е.М.,
10. Тожибоев А.Г., Тургунов К.К., Ташходжаев Б., Муса-
Чубарь Д.И. // ЖОХ. 1973. Т. 63. С. 1518.
ева Г. В. // ЖСХ. 2005. Т. 46. № 5. С. 982.
5. Шматкова Н. В., Сейфуллина И. И., Власенко В. Г.,
11. Geary W.J. // Coord. Chem. Rev. 1971. N 7. P. 81. doi
Тригуб А. Л., Левченков С. И., Хитрич Н.В. // ЖОХ.
10.1016/S0010-8545(00)80009-0
2017. Т. 87. Вып. 1. С. 113; Shmatkova N.V., Seifulli-
12. Aggarwal R.C., Singh N.K., Singh R.P. // Inorg. Chem.
na I.I., Vlasenko V.G., Trigub A.L., Levchenkov S.I.,
1981. Vol. 20. P. 2794. doi 10.1021/ic50223a012
Khitrich N.V. // Russ. J. Gen. Chem. 2017. Vol. 87. N 1.
13. Yin H.D., Hong M., Li G., Wang Da. Q. // J. Orga-
P. 107. doi 10.1134/S1070363217010170
nometallic Chem. 2005. Vol. 690. N 11. P. 3714. doi
6. Сейфуллина И.И. // Вісник ОНУ. 2007. Т. 13. № 2.
10.1016/j.jorganchem.2005.04.049
С. 5.
14. Шматкова Н.В., Сейфуллина И.И., Ткаченко В.Н. //
7. Varbanets L.D, Kyrychenko А.N., Seifullina I.I.,
Вопр. химии и хим. технол. 2004. Вып. 6. С. 33.
Shmatkova N.V., Brovarskaya О.S., Yaroshenko L.V.,
15. Шварценбах Г., Флашка Г. Комплексонометрическое
Popov L.D. // Biotechnol. Аcta. 2016. Vol. 9. N 1. P. 64.
титрование. М.: Химия. 1970. С. 360.
doi 10.15407/biotech9.01.064
16. Назаренко В.В. Аналитическая химия германия. М.:
8. Васильев А. Д., Головнев Н. Н. // ЖСХ. 2013. Т. 54.
Наука, 1973. С. 116.
№ 3. С. 553; Vasilyev A.D., Golovnev N.N. // J.
Struct. Chem. 2013. Vol. 54. N 3. P. 607. doi 10.1134/
17. Cheng F.W. // Microchem. J. 1959. Vol. 24. N 6. P. 989.
S0022476613030219
doi 10.1016/0026-265X(59)90085-2
9. Головнев Н.Н. , Наумов Н.Г., Бахтина А.А.,
18. Вайсбергер А., Проскауэр Э., Риддик Дж., Тупс Э.
Лыхин А.О. // ЖСХ. 2010. Т. 51. № 5. С. 1011;
Органические растворители. Физические свойства
Golovnev N.N., Naumov N.G., Bakhtina A.A., Ly-
и строение. М.: ИЛ, 1958. 519 с.
Composition and Structure of Complexes in
GeCl4-2-Hydroxybenzene(2-hydroxynaphthaline-1)carbaldehyde
Isonicotinoylhydrazone-ZnCl2-Methanol
N. V. Shmatkovaa,*, I. I. Seifullinaa, L. S. Skorokhoda, A. N. Morozovb,
L. D. Popovb, and G. A. Gazievac
a Mechnikov Odessa National University, Odessa, 65082 Ukraine
b South Federal University, Rostov-on-Don, 344090 Russia
c N. D. Zelinsky Institute of Organic Chemistry of the Russian Academy of Sciences, Moscow, 119991 Russia
*e-mail: nshmatkova@ukr.net
Received July 20, 2020; revised July 20, 2020; accepted August 1, 2020
Tetrachlorozincates [Ge(L·H)2][ZnCl4]∙CH3OH were first isolated from the systems of isonicotinoylhydrazones
of 2-hydroxybenz- and 2-hydroxy-1-naphthaldehydes (H2L)-GeCl4-ZnCl2-CH3OH, in which cations are the
complexes [Ge(L·H)2]2+ protonated at the exo-chelate pyridine atom of nitrogen, with tridentate coordination
through the azomethine nitrogen atom and the oxygen atoms of the oxyazine and oxy groups ligands. The
complexes were investigated by a combination of methods of conductometry, thermogravimetry, IR and PMR
spectroscopy. The type of their electrolytic dissociation and the features of thermolysis were established.
Keywords: isonicotinoylhydrazone, germanium tetrachloride, tetrachlorocincate, germanium(IV) complex
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020