ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 12, с. 1927-1932
УДК 546.865;547.53.024;539.264;547.463.3;547.475
ОСОБЕННОСТИ ВЗАИМОДЕЙСТВИЯ
ПЕНТАФЕНИЛСУРЬМЫ С 3-ГИДРОКСИБЕНЗОЙНОЙ
И 1,2,4,5-БЕНЗОЛТЕТРАКАРБОНОВОЙ КИСЛОТАМИ
© 2020 г. Ю. О. Губанова, В. В. Шарутин, О. К. Шарутина
Национальный исследовательский Южно-Уральский государственный университет,
пр. Ленина 76, Челябинск, 454080 Россия
*e-mail: ulchik_7757@mail.ru
Поступило в Редакцию 24 июля 2020 г.
После доработки 24 июля 2020 г.
Принято к печати 6 августа 2020 г.
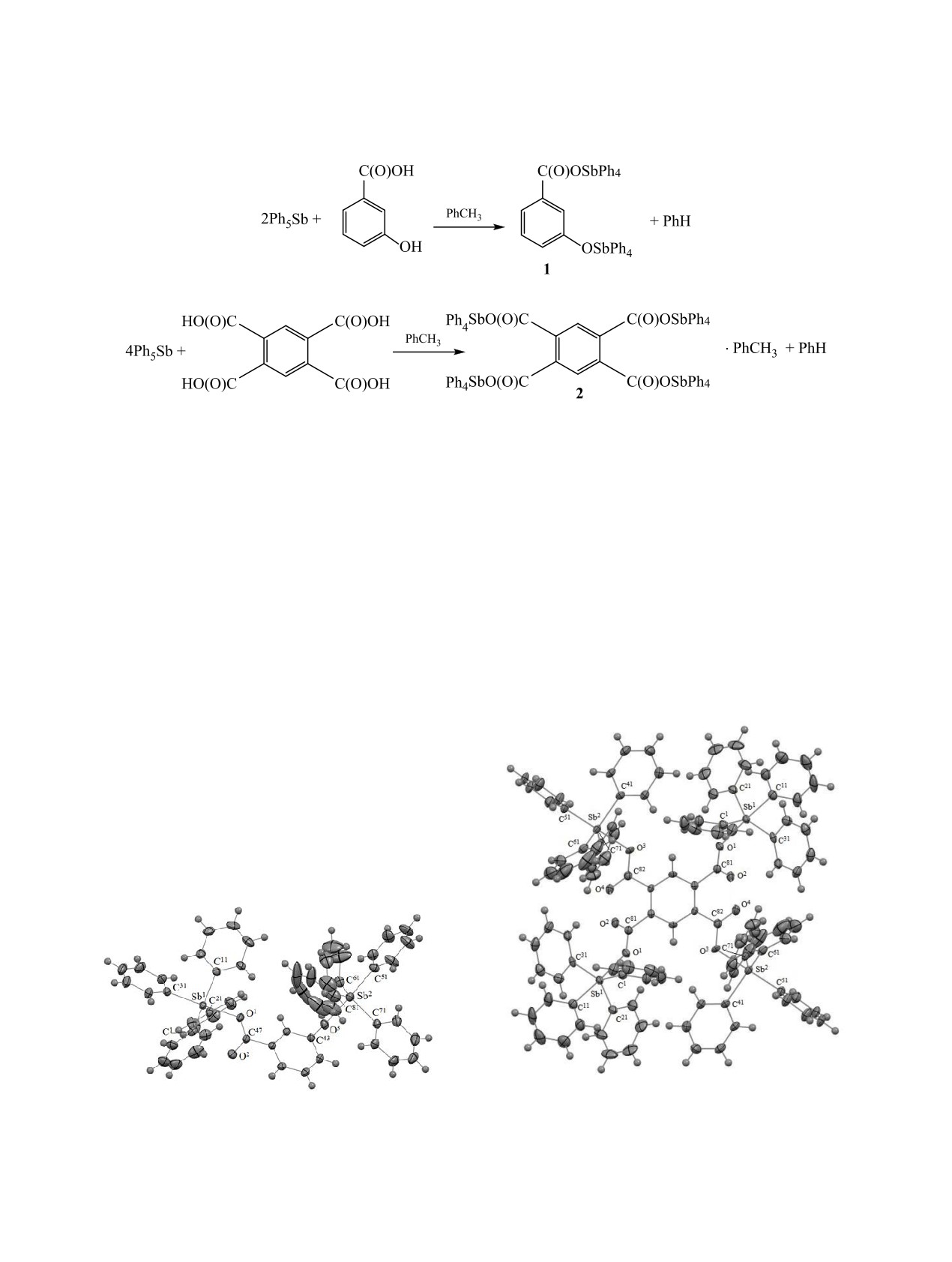
Взаимодействие пентафенилсурьмы с 3-гидроксибензойной кислотой в диоксане при нагревании проте-
кает с участием карбоксильной и гидроксильной групп с образованием 3-тетрафенилстибоксибензоата
тетрафенилсурьмы. 1,2,4,5-Бензолтетракарбоновая кислота в реакции с пентафенилсурьмой проявляет
себя как полифункциональное соединение и образует тетраядерный комплекс - 1,2,4,5-бензолтетракар-
боксилат тетракис(тетрафенилсурьмы). Особенности строения синтезированных соединений установ-
лены методом рентгеноструктурного анализа.
Ключевые слова: пентафенилсурьма, дефенилирование, 3-гидроксибензойная кислота, 1,2,4,5-бензол-
тетракарбоновая кислота, молекулярная структура, рентгеноструктурный анализ
DOI: 10.31857/S0044460X20120161
Арильные соединения пятивалентной сурьмы
Производные сурьмы(V) с тетракарбоновыми
широко применяются в качестве катализаторов в
кислотами в литературе не описаны. Известно
органическом синтезе [1-5], анион-связующих ре-
несколько соединений с четырьмя сурьмаоргани-
агентов и сенсоров [6-8]. Арилпроизводные сурь-
ческими фрагментами [18-21], в частности, в про-
мы(V) проявляют биологическую активность и ис-
дукте взаимодействия сукцината бис(тетрафенил-
сурьмы) с иодом четыре фрагмента Ph4Sb связаны
пользуются в качестве антилейшманиозных [9, 10]
и противоопухолевых препаратов [11-14]. Реак-
с кислотным остатком [22].
ции пентафенилсурьмы с полифункциональными
При непродолжительном кипячении раствора
соединениями могут приводить к комплексам раз-
пентафенилсурьмы с 3-гидроксибензойной кисло-
личного строения (полиядерным, циклическим,
той в диоксане (мольное соотношение 2:1) атомы
каркасным и т. д.). Дефенилирование пентафенил-
водорода в карбоксильной и гидроксильной груп-
сурьмы гетерофункциональными соединениями
пах замещаются на фрагменты Ph-4Sb с образова-
является своеобразным показателем подвижности
нием
3-(тетрафенилстибокси)бензоата тетрафе-
нилсурьмы 1 (схема 1).
атомов водорода, например, в гидроксикарбоно-
вых кислотах. Взаимодействие пентафенилсурьмы
В более мягких условиях образуется сольват
с салициловой и 5-бромсалициловой кислотами не
3-гидроксибензотата тетрафенилсурьмы с диокса-
зависимо от мольного соотношения реагентов про-
ном (мольное соотношение 2:1, диоксан, комнат-
текает с участием только карбоксильной группы
ная температура) или аддукт 3-гидроксибензоата
[15, 16]. В 4-гидроксибензойной кислоте гидрок-
тетрафенилсурьмы с 3-(тетрафенилстибокси)бен-
зоатом тетрафенилсурьмы и толуолом (мольное
сигруппа может быть активирована введением в
соотношение 2:1, толуол, нагревание) [23].
реакцию алкоголята натрия, и при взаимодействии
с галогенидом тетрафенилсурьмы образуется би-
Взаимодействие пентафенилсурьмы с 1,2,4,5-
ядерный комплекс с мостиковым лигандом [17].
бензолтетракарбоновой (пиромеллитовой) кисло-
1927
1928
ГУБАНОВА и др.
Схема 1.
Схема 2.
той протекает с участием четырех карбоксильных
ного кольца, атомы сурьмы, связанные с карбок-
групп не зависимо от мольного соотношения реа-
силатными лигандами в положениях 1 и 4, 2 и 5,
гентов с образованием тетраядерного комплекса -
попарно эквивалентны. Атомы сурьмы Sb1,2 выхо-
бензол-1,2,4,5-тетракарбоксилата тетракис(тетра-
дят из экваториальных плоскостей в сторону ак-
фенилсурьмы) 2, выделенного из реакционной
сиально расположенного атома углерода на 0.160,
смеси в виде сольвата с толуолом (схема 2).
0.179 Å (1) и 0.138, 0.191 Å (2). Аксиальные углы
В ИК спектре соединения 1 полоса поглощения
CaxSb1,2O - 177.14(8), 176.28(11) (1) и 174.7(2),
178.1(2)°
(2), суммы углов в экваториальной
карбонильной группы (1632 см-1) смещена в низ-
плоскости:
358.30(10)
[112.49(11)-125.60(10)°],
кочастотную область по сравнению с аналогичной
полосой в исходной кислоте (1709 см-1). В спек-
357.87(17)° [118.02(14)-120.92(18)°] (1) и 358.6(3)
тре соединения 2 аналогичное смещение более
[102.7(3)-141.7(2)°], 357.7(3)° [113.1(3)-127.2(3)°]
100 см-1: νСО 1602 (2), 1705 см-1 (исходная кислота).
(2). Углы CaxSb1,2Ceq изменяются в диапазонах
93.66(10)-95.32(10),
94.63(14)-95.24(12)°
(1) и
Согласно данным рентгеноструктурного ана-
92.4(3)-95.0(3), 91.6(3)-98.9(3)° (2). Cвязи Sb1,2-
лиза, атомы сурьмы в молекулах соединений 1
и 2 имеют искаженную тригонально-бипирами-
дальную координацию (рис. 1, 2). В аксиальных
положениях находятся атомы кислорода карбок-
сильной или гидроксильной групп. В молекуле
соединения 1 искажение тригонально-бипирами-
дальной координации атомов сурьмы различает-
ся. Молекула соединения 2 центросимметрична,
центр симметрии совпадает с центром бензоль-
Рис. 2. Молекулярная структура бензол-1,2,4,5-тетра-
Рис. 1. Молекулярная структура 3-(тетрафенилстибок-
карбоксилата тетракис(тетрафенилсурьмы) 2 (сольват-
си)бензоата тетрафенилсурьмы 1.
ная молекула толуола не показана).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
ОСОБЕННОСТИ ВЗАИМОДЕЙСТВИЯ ПЕНТАФЕНИЛСУРЬМЫ
1929
Cax [2.182(3), 2.171(3) Å] в соединении 1 длин-
Основные длины связей и валентные углы в молекулах
нее экваториальных [2.126(3)-2.132(3), 2.108(4)-
соединений 1, 2
2.123(3) Å] (см. таблицу). Особенность структуры
Связь
d, Å
Угол
ω, град
2 - нетипичные для тригональной бипирамиды
1
значения связей Sb-C: одна из экваториальных
Sb1-O1
2.2163(19)
C1Sb1C11
120.21(10)
связей в каждом из фрагментов Sb1-C1 и Sb2-C41
Sb1-C11
2.132(3)
C11Sb1C31
93.66(10)
Sb1-C1
2.126(3)
C1Sb1C31
95.32(10)
[2.265(7) и 2.236(7) Å соответственно, нумерацию
Sb1-C21
2.126(3)
C21Sb1C11
112.49(11)
атомов см. на рис. 1, 2] длиннее не только двух дру-
Sb1-C31
2.182(3)
C21Sb1C1
125.60(10)
гих экваториальных [2.120(6), 2.126(7) и 2.186(7),
Sb2-O3
2.169(2)
C21Sb1C31
93.88(10)
2.081(7) Å], но и аксиальных [2.117(7), 2.101(6) Å]
Sb2-C51
2.171(3)
C31Sb1O1
177.14(8)
связей, которые незначительно различаются меж-
Sb2-C81
2.118(3)
C51Sb2O3
176.28(11)
ду собой. Возможно, это связано со стерическими
Sb2-C71
2.123(3)
C81Sb2C51
94.73(13)
препятствиями, создаваемыми объемными фраг-
Sb2-C61
2.108(4)
C81Sb2C61
120.92(18)
ментами Ph4Sb вокруг остатка 1,2,4,5-бензолтетра-
С47-O1
1.284(3)
C71Sb2C51
95.24(12)
карбоновой кислоты.
С46-O2
1.233(3)
C71Sb2C81
118.93(17)
Связи Sb1,2-O в молекуле
1
[2.2163(19) и
С43-O3
1.339(3)
C71Sb2C61
118.02(14)
2.169(2) Å] различаются между собой в связи
C51Sb2C61
94.63(14)
с различной природой функциональных групп
2
(карбоксильной и гидроксильной соответствен-
C1Sb1C11
93.2(3)
Sb1-O1
2.172(4)
но) и несколько отличаются от длин аналогичных
C1Sb1C21
114.2(3)
Sb1-C1
2.265(7)
C11Sb1O1
174.7(2)
связей в известных сурьмаорганических произ-
Sb1- C11
2.117(7)
C31Sb1C21
102.7(3)
водных гидроксибензойных кислот. В молекуле
Sb1- C21
2.120(6)
C31Sb1C11
95.0(3)
3-(тетрафенилстибокси)бензоата тетрафенилсу-
Sb1- C31
2.126(7)
C1Sb1C31
141.7(2)
рьмы, входящей в состав аддукта с 3-гидрокси-
Sb2-O3
2.138(4)
C21Sb1C11
92.4(3)
бензоатом тетрафенилсурьмы, аналогичные связи
Sb2-C41
2.236(7)
C41Sb2C71
117.4(3)
имеют величины 2.287(7) и 2.144(8) Å [23], а в мо-
Sb2-C71
2.186(7)
Sb2- C61
2.081(7)
C61Sb2C41
113.1(3)
лекуле 2-гидрокси-4-(тетрафенилстибокси)бензоа-
C51Sb2O3
178.1(2)
Sb2- C51
2.101(6)
та тетрафенилсурьмы связи Sb-O имеют близкие
C61Sb2C71
127.2(3)
C81-O1
1.369(8)
значения: 2.254(3) и 2.245(3) Å [24].
C61Sb2C51
98.9(3)
C81-O2
1.171(7)
C51Sb2C41
94.7(2)
C82-O3
1.348(8)
C51Sb2C71
91.6(3)
C82-O4
1.278(8)
В молекуле 2 связи Sb-O [2.172(4) и 2.138(4) Å]
меньше аналогичных расстояний в молекуле фта-
лата бис(тетрафенилсурьмы)
2.2421(8) Å
[25].
H74
Расстояния Sb∙∙∙O=C [3.189(2) Å (1) и 3.217(2),
C46
3.244(4) Å] (2) меньше суммы ван-дер-ваальсовых
C34
H62
H33
радиусов атомов (3.58 Å [26]).
H15
Структура соединения 1 в кристалле сформи-
H74
рована посредством межмолекулярных связей
C46
H33
H15
H62
СPh∙∙∙H между атомами углерода бензольных ко-
C34
лец фрагментов Ph4Sb и карбоксилатного лиган-
да (рис. 3). В кристалле соединения 2 возникают
многочисленные связи Сπ∙∙∙H между бензольны-
ми кольцами, сольватная молекула толуола также
принимает участие в образовании связей Сπ∙∙∙H.
Таким образом, взаимодействие петафенил-
Рис. 3. Межмолекулярные связи в кристалле соеди-
нении 1.
сурьмы с 3-гидроксибензойной кислотой (моль-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1930
ГУБАНОВА и др.
ное отношение 2:1, диоксан, 101°С) протекает с
1077.49 г/моль; а = 18.587(12), b = 14.677(12), c =
участием карбоксильной и гидроксильной групп
19.925(13) Å, β = 114.074(17), V = 4963(6) Å3, dвыч =
с образованием
3-тетрафенилстибоксибензоата
1.442 г/см3, Z = 4, пространственная группа P21/c.
тетрафенилсурьмы, в молекуле которого атомы
Измерено всего 58924 отражений, 6819 независи-
сурьмы имеют в различной степени искаженную
мых отражений, μ = 1.136 мм-1. Окончательные
тригонально-бипирамидальную координацию. В
значения факторов расходимости: R1 = 0.0696 и
реакции 1,2,4,5-бензолтетракарбоновой кислоты
wR2 = 0.1065 (по всем рефлексам), R1 = 0.0445 и
с пентафенилсурьмой (толуол, 100°С) не зависи-
wR2 = 0.0955 [по рефлексам F2 > 2σ(F2)].
мо от мольного соотношения реагентов участву-
Полные таблицы координат атомов, длин свя-
ют 4 карбоксигруппы, и образуется тетраядер-
зей и валентных углов депонированы в Кембридж-
ный комплекс. В центросимметричной молекуле
ском банке структурных данных [CCDC 1964863
1,2,4,5-бензолтетракарбоксилата тетракис(тетра-
(1), 1974748 (2)].
фенилсурьмы) атомы сурьмы попарно эквивалент-
3-(Tетрафенилстибокси)бензоат тетрафенил-
ны и имеют искаженную тригонально-бипирами-
сурьмы (1). Смесь 0.25 г (0.5 ммоль) пентафенил-
дальную координацию.
сурьмы и 0.04 г (0.25 ммоль) 3-гидроксибензойной
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
кислоты в 10 мл диоксана доводили до кипения
(101°С) и выдерживали при комнатной температу-
ИК спектры записывали на ИК-Фурье спектро-
ре в течение 1 сут. Твердый остаток перекристал-
метре Shimadzu IR Affinity-1S в таблетке KBr. РСА
лизовывали из смеси бензол-диметилформамид,
кристаллов соединений 1, 2 проводили на авто-
3:1 об. Выход 0.25 г (85%), бесцветные кристаллы,
матическом четырехкружном дифрактометре D8
т. пл. 187°С (разл.). ИК спектр, υ, см-1: 3443, 3067,
QUEST Bruker (MoKα-излучение, λ = 0.71073 Å,
3051, 1632, 1611, 1580, 1564, 1478, 1433, 1333,
графитовый монохроматор). Сбор, редактирова-
1319, 1299, 1269, 1182, 1157, 1065, 997, 935, 804,
ние данных и уточнение параметров элементар-
775, 732, 693, 448. Найдено, %: С 66.15; Н 4.48.
ной ячейки, а также учет поглощения проведены
C55H44O3Sb2. Вычислено, %: С 66.20; Н 4.42.
с помощью программы SMART SAINT-Plus [27].
Бензол-1,2,4,5-тетракарбоксилат тетракис-
Определение и уточнение структуры кристаллов
(тетрафенилсурьмы) (2). Смесь 0.25 г (0.5 ммоль)
выполнено c помощью программ SHELX/PC [28]
пентафенилсурьмы и
0.03 г
(0.13 ммоль)
и OLEX2 [29]. Структура расшифрована прямым
1,2,4,5-бензолтетракарбоновой кислоты в 5 мл то-
методом и уточнена методом наименьших квадра-
луола нагревали в стеклянной ампуле на кипящей
тов вначале в изотропном, затем в анизотропном
водяной бане 1 ч, затем медленно охлаждали. Ам-
приближении для неводородных атомов. Атомы
пулу вскрывали и удаляли растворитель. Выход
водорода помещены в геометрически рассчитан-
0.10 г (71%), бесцветные кристаллы, т. пл. 250°С.
ные положения и включены в уточнение по моде-
ИК спектр, υ, см-1: 3051, 1602, 1574, 1553, 1493,
ли наездника. Основные длины связей и валент-
1479, 1431, 1406, 1394, 1364, 1333, 1309, 1286,
ные углы в структурах 1, 2 приведены в таблице.
1188, 1132, 1063, 1020, 997, 985, 984, 927, 912, 876,
Кристаллы соединения
1, C55H44O3Sb2, М
853, 814, 735, 711, 696, 575, 530, 473, 450. Найдено,
996.40 г/моль, бесцветные, призматические, моно-
%: С 66.83; Н 4.65. C60H49O4Sb2. Вычислено, %: С
клинные; а = 10.087(4), b = 17.517(6), c = 13.498(6) Å,
66.80; Н 4.55.
β = 99.15(2), V = 2354.6(16) Å3, dвыч = 1.405 г/см3,
Z = 2, пространственная группа P21. Измерено
ФОНДОВАЯ ПОДДЕРЖКА
всего 106313 отражений, 26644 независимых от-
Исследование выполнено при финансовой под-
ражений, μ = 1.189 мм-1. Окончательные значения
держке Российского фонда фундаментальных ис-
факторов расходимости: R1 = 0.0827 и wR2 = 0.1129
следований (проект № 19-33-90061).
(по всем рефлексам), R1 = 0.0436 и wR2 = 0.0995
КОНФЛИКТ ИНТЕРЕСОВ
[по рефлексам F2 > 2σ(F2)].
Кристаллы соединения
2 бесцветные, при-
Авторы заявляют об отсутствии конфликта
зматические, моноклинные, C60H49O4Sb2, М
интересов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
ОСОБЕННОСТИ ВЗАИМОДЕЙСТВИЯ ПЕНТАФЕНИЛСУРЬМЫ
1931
СПИСОК ЛИТЕРАТУРЫ
18.
Шарутин В.В., Шарутина О.К., Чагарова О.В., Мо-
локова О.В. // ЖОХ. 2011. Т. 81. Вып. 11. С. 1793;
1.
Li N., Qui R., Zhang X., Chen Y., Yin S.-F., Xu X. //
Sharutin V.V., Sharutina O.K., Chagarova O.V., Moloko-
Tetrahedron. 2015. Vol. 71. P. 4275. doi 10.1016/j.
va O.V. // Russ. J. Gen. Chem. 2011. Vol. 81. N 11. P.
tet.2015.05.013
2246. doi 10.1134/S1070363211110065
2.
Yang M., Gabbai F.P. // Inorg. Chem. 2017. Vol. 56.
19.
Ugandhar U., Baskar V. // Dalton Trans. 2013. Vol. 45.
P. 8644. doi 10.1021/acs.inorgchem.7b00293
N 14. P. 6269. doi 10.1039/C5DT03449C
3.
Yang M., Pati N., Bélanger-Chabot G., Gabbaï F.P. //
Dalton Trans. 2018. Vol. 47. N 34. P. 11843. doi
20.
Yin H., Wu Q., Hong M., Li W. // Z. anorg. allg. Сhem.
10.1039/C8DT00702K
Bd 638. N 5 S. 725. doi 10.1002/zaac.201100513
4.
Yang M., Hirai M., Gabbai F.P. // Dalton Trans. 2019.
21.
Jiang J., Yin H., Wang F., Han Z., Wang F., Cheng S.,
Vol. 48. N 20. P. 6685. doi 10.1039/C9DT01357A
Hong M. // Dalton Trans. 2013. Vol. 42. N 24. P. 8563.
5.
Zhang X.-Y., Cui L.-S., Zhang X., Jin F., Fan Y.-H. //
doi 10.1039/c3dt50221j
J. Mol. Struct. 2017. Vol. 1134. P. 742. doi 10.1016/j.
22.
Шарутин В.В. Шарутина О.К., Губанова Ю.О.,
molstruc.2017.01.039
Андреев П.В., Сомов Н.В. // Коорд. хим. 2017.
6.
Wade C.R., Lin T.-P., Nelson R.C., Mader E.A.,
Т. 43. № 7. С. 444; Sharutin V.V., Sharutina O.K., Gu-
Miller J.T., Gabbai F.P. // J. Am. Chem. Soc. 2011.
banova Yu.O., Andreev P.V., Somov N.V. // Russ. J. Co-
Vol. 133. N 23. P. 8948. doi 10.1021/ja201092g
ord. Chem. 2017. Vol. 43. N 7. P. 453. doi 10.1134/
7.
Lin T.-P., Nelson R.C., Wu T., Miller J.T., Gabbai F.P. //
S1070328417060070
Chem. Sci. 2012. Vol. 3. N 4. P. 1128. doi 10.1039/
23.
Шарутин В.В. Шарутина О.К., Губанова Ю.О., Ель-
C2SC00904H
цов О.С. // ЖНХ. 2019. Т. 64. № 9. С. 957; Sharutin V.V.,
8.
Jones J.S., Gabbai F.P. // Acc. Chem. Res. 2016.
Sharutina O.K., Gubanova Yu.O., Eltsov O.S. // Russ. J.
Vol. 49. N 5. P 857. doi 10.1021/acs.accounts.5b00543
Inorg. Chem. 2019. Vol. 64. N 9. P. 1138. doi 10.1134/
9.
Mushtaq R., Rauf M.K., Bolte M., Nadhman A., Bad-
S0036023619090195
shah A., Tahir M.N., Yasinzai M., Khan K.M. // Appl.
24.
Шарутин В.В., Шарутина О.К., Губанова Ю.О. //
Organometal. Chem. 2016. P. 1. doi 10.1002/aoc.3606
Вестн. ЮУрГУ. Сер. Химия. 2017. Т. 9. № 4. С. 56.
10.
Duffin R.N., Blair V.L., Kedzierskib L., Andrews P.C. //
Dalton Trans. 2018. Vol. 47. N 3. P. 971. doi 10.1039/
doi 10.14529/chem170409
c7dt04171c
25.
Шарутин В.В., Шарутина О.К., Сенчурин В.С.,
11.
Wang F., Yin H., Yue C., Cheng S., Hong M. // J.
Платонова Т.П., Насонова Н.В., Пакусина А.П.,
Organomet. Chem. Vol. 738. N 15. P. 35. doi 10.1016/j.
Герасименко А.В., Сергиенко С.С. // Коорд. хим.
jorganchem.2013.03.046
2001. Т. 27. № 9. С. 710; Sharutin V.V., Sharutina O.K.,
12.
Islam A., Rodrigues B.L., Marzano I.M., Perreira-
Senchurin V.S., Platonova T.P., Nasonova N.V., Pa-
Maia E.C., Dittz D., Lopes M.T.P., Ishfaq M., Frezard F.,
kusina A.P., Gerasimenko A.V., Sergienko S.S. //
Demicheli C. // Eur. J. Med. Chem. 2016. Vol. 109.
Russ. J. Coord. Chem. 2001. Vol. 27. N 9. P. 669. doi
P. 254. doi 10.1016/j.ejmech.2016.01.003
10.1023/a:1017909824029
13.
Gkaniatsou E.I., Banti C.N., Kourkoumelis N., Skoulika S.,
26.
Mantina M., Chamberlin A.C., Valero R., Cramer C.J.
Manoli M., Tasiopoulos A.J., Hadjikakou S.K. // J.
Truhlar D.G. // J. Phys. Chem. (A). 2009. Vol. 113.
Inorg. Biochem. 2015. Vol. 150. P. 108. doi 10.1016/j.
N 19. P. 5806. doi: 10.1021/jp8111556
jinorgbio.2015.04.014
27.
Bruker (1998). SMART and SAINT-Plus. Versions
14.
Geng H., Hong M., Yang. Y., Li D., Li H., Lui F.,
5.0. Data Collection and Processing Software for the
Niu M. // J. Coord. Chem. 2015. Vol. 68. N. 16. P. 2938.
SMART System. Bruker AXS Inc., Madison, Wisconsin,
doi 10.1080/00958972.2015.1060322
USA.
15.
Шарутин В.В., Шарутина О.К., Пакусина А.П.,
28.
Bruker (1998). SHELXTL/PC. Versions 5.10. An
Бельский В.К. // ЖОХ. 1997. Т. 67. Вып. 9. С. 1536.
Integrated System for Solving, Refining and Displaying
16.
Quan L., Yin H., Cui J., Hong M., Wang D. // J.
Crystal Structures from Diffraction Data. Bruker AXS
Organometal. Chem. 2009. Vol. 694. N 23. P. 3708. doi
10.1016/j.jorganchem.2009.07.040
Inc., Madison, Wisconsin, USA.
17.
Quan L., Yin H., Cui J., Hong M., Cui L., Yang M.,
29.
Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
Wang D. // J. Organometal. Chem. 2009. Vol. 694.
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
N. 23. P. 3683. doi 10.1016/j.jorganchem.2009.07.041
Vol. 42. P. 33. doi 10.1107/ S0021889808042726
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1932
ГУБАНОВА и др.
Features of the Reaction of Pentaphenylantimony
with 3-Hydroxybenzoic Acid
and Benzene-1,2,4,5-tetracarboxylic Acid
Yu. O. Gubanova, V. V. Sharutin, and O. K. Sharutina
National Research South Ural State University, Chelyabinsk, 454080 Russia
*e-mail: ulchik_7757@mail.ru
Received July 24, 2020; revised July 24, 2020; accepted August 6, 2020
The reaction of pentaphenylantimony with 3-hydroxybenzoic acid in dioxane on heating proceeds with the
participation of carboxyl and hydroxyl groups to form tetraphenylantimony 3-tetraphenylstiboxybenzoate. Ben-
zene-1,2,4,5-tetracarboxylic acid in reaction with pentaphenylantimony acts as a polyfunctional compound and
forms a tetranuclear complex -tetrakis(tetraphenylantimony) benzene-1,2,4,5-tetracarboxylate. The structural
features of the synthesized compounds were established by X-ray diffraction analysis.
Keywords: pentaphenylantimony, dephenylation, 3-hydroxybenzoic acid, benzene-1,2,4,5-tetracarboxylic acid,
molecular structure, X-ray diffraction analysis
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020