ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 12, с. 1939-1952
УДК 547.1’181.54:547.791.7
1,2,3-ТРИАЗОЛЬНЫЕ ТРИПОДАЛЬНЫЕ ЛИГАНДЫ
НА ТРИФЕНИЛФОСФИНОКСИДНОЙ ПЛАТФОРМЕ.
КООРДИНАЦИОННЫЕ И ЭКСТРАКЦИОННЫЕ
СВОЙСТВА
© 2020 г. А. Г. Матвееваа,*, Т. В. Баулинаa, И. Ю. Кудрявцевa, М. П. Пасечникa,
Р. Р. Айсинa, О. В. Быховскаяa, М. И. Годовиковаa, С. В. Матвеевa, А. Н. Турановb,
В. К. Карандашевc,d, В. К. Брельa
a Институт элементоорганических соединений имени А. Н. Несмеянова Российской академии наук,
ул. Вавилова 28, Москва, 119991 Россия
b Институт физики твердого тела Российской академии наук, Черноголовка, 142432 Россия
c Институт проблем технологии микроэлектроники и особо чистых материалов Российской академии наук,
Черноголовка, 142432 Россия
d Национальный исследовательский технологический университет «МИСиС», Москва, 119991 Россия
*e-mail: matveeva@ineos.ac.ru
Поступило в Редакцию 27 августа 2020 г.
После доработки 27 августа 2020 г.
Принято к печати 14 сентября 2020 г.
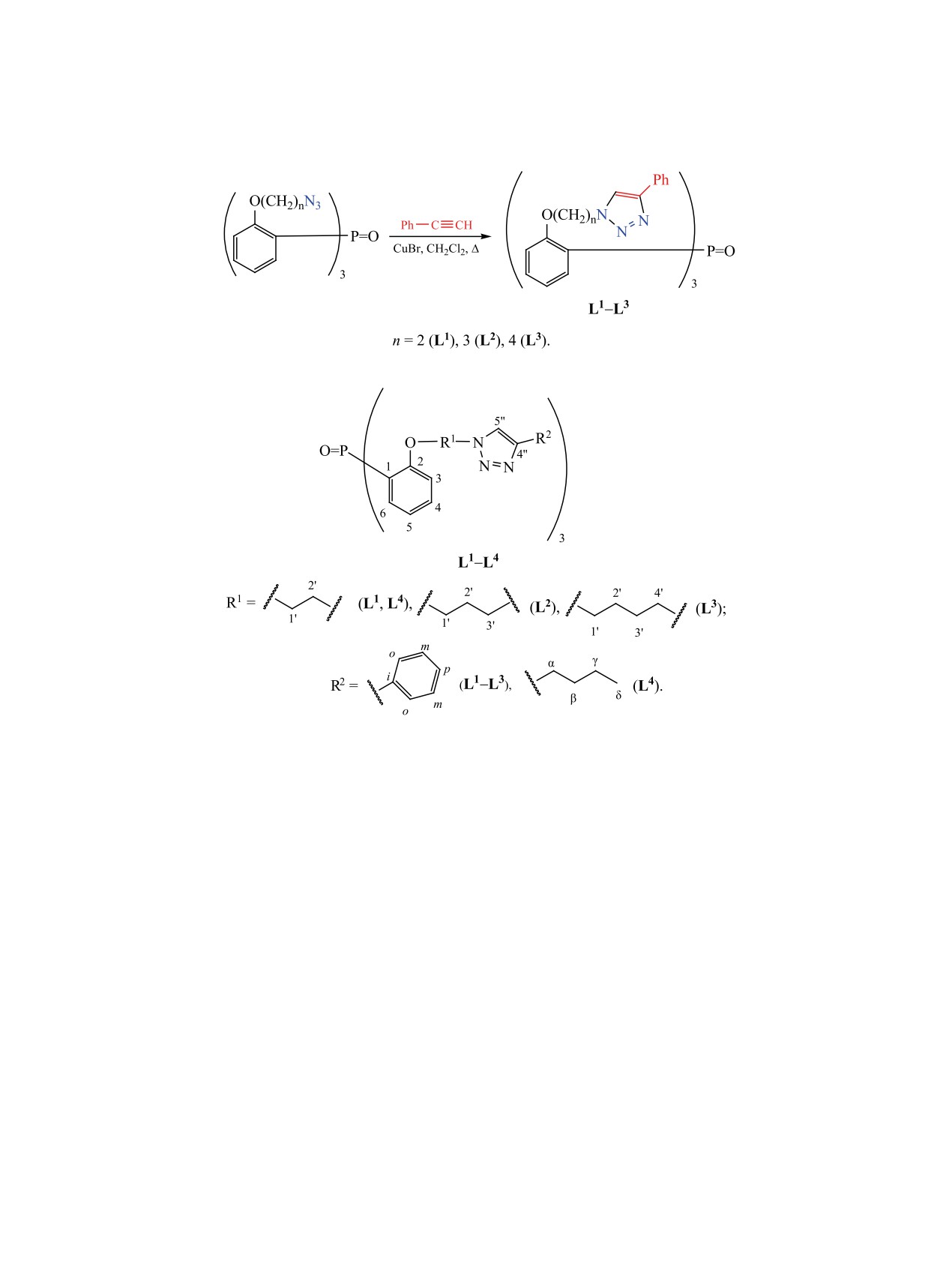
Синтезированы новые 1,2,3-триазольные триподальные лиганды на трифенилфосфиноксидной платфор-
ме с различными по длине линкерами. Состав и строение установлены методами элементного анализа,
мультиядерного (1H, 13C, 31P) ЯМР, масс-спектрометрии, колебательной (ИК, КР) спектроскопии. Коор-
динационные и экстракционные свойства лигандов исследованы на примере комплексообразования с
нитратом уранила и извлечения микроколичеств U(VI) из водной фазы в 1,2-дихлорэтан.
Ключевые слова: 1,2,3-триазольные триподальные лиганды, функционализированные фосфиноксиды,
комплексы с UO2(NO3)2, экстракция
DOI: 10.31857/S0044460X20120185
Среди множества политопных триазольных
фосфинокисида
[4-7], мы синтезировали ряд
лигандов известно всего несколько примеров три-
триподальных лигандов с разными по длине линке-
подальных лигандов с разнообразными каркаса-
рами с 1,2,3-триазольными фрагментами у ω-атома
ми и с триазольными циклами в подвесках [1, 2].
(схема 1) и исследовали их координационные и
Эти соединения формируют прочные комплексы
экстракционные свойства.
с катионами d- и f-элементов. Среди них найдены
Координационные свойства соединений L1-L3
структуры, образующие координационные поли-
исследовали на примере комплексообразования с
меры с полезными свойствами [1]. Комплексы с
нитратом уранила, экстракционные - на примере
Fe(II) демонстрируют свойства спин-кроссоверов,
извлечения микроколичеств U(VI) из водных рас-
а комплексы с лантанидами известны как много-
творов в 1,2-дихлорэтан. В качестве модельных
обещающие контрастные реагенты для магнито-
резонансной томографии и катализа [1, 2]. Сое-
соединений использовали трис{2-[2-(4-бутил-
динения с триазольными циклами представляют
1,2,3-триазол-1-ил)этокси]фенил}фосфиноксид L4
интерес для медико-биологических целей [3].
[7] и уранильный комплекс этого лиганда.
Продолжая исследования по созданию три-
Выбор катиона уранила обусловлен несколь-
подальных лигандов на платформе трифенил-
кими причинами. Во-первых, катион уранила
1939
1940
МАТВЕЕВА и др.
Схема 1.
Схема 2.
образует комплексы как с О-, так и с N-донорны-
Соединения L2 и L3 получены впервые. Оба
ми лигандами [8-10]. Во-вторых, доступная для
лиганда выделены в виде белых порошкообраз-
координации экваториальная плоскость катиона
ных веществ. Соединения хорошо растворимы в
уранила ограничивает количество возможных
хлороформе, хлористом метилене и умеренно в
комплексов и способов координации лиганда в от-
MeCN. Их состав и строение подтверждены дан-
личие от катионов с объемным координационным
ными элементного анализа, мультиядерного ЯМР
полиэдром. Возможность располагаться в эквато-
(1H,
13C, 31P), колебательной спектроскопии и
риальной плоскости с эффективной координацией
масс-спектрометрии. По строению они аналогич-
в большей мере зависит от строения политопных
ны соединению L1, структура которого установле-
лигандов. В-третьих, комплексы уранила не па-
на методом рентгеноструктурного анализа [7].
рамагнитны, что позволяет при их исследовании
успешно использовать спектроскопию ЯМР.
По данным рентгеноструктурного исследова-
ния, в кристалле сольвата лиганда L1 присутству-
Координационные соединения уранила пред-
ставляют интерес для биомедицинской химии, при
ют внутримолекулярные связи между протонами
создании катализаторов, электролюминесцентных
триазольных циклов и атомом кислорода фосфо-
устройств и металлоорганических полимеров, а
рильной группы [7]. В ИК спектре полоса ν(P=O)
также для использования в экстракции [8, 11].
наблюдается в виде плеча при ~1176 см-1 на по-
Соединения L1 [7], L2, L3 получены клик-реак-
лосе с максимумом при 1165 см-1, т. е. понижение
цией соответствующих триазидов с фенилацети-
частоты ν(P=O) незначительно (табл. 1). (В спек-
леном в присутствии CuBr в качестве катализатора
трах родственных соединений в отсутствие Н-свя-
(схема 1).
зей колебание ν(P=O) регистрируется при 1178-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1,2,3-ТРИАЗОЛЬНЫЕ ТРИПОДАЛЬНЫЕ ЛИГАНДЫ
1941
Таблица 1. Избранные данные ИК и КР спектроcкопии для лигандов L1-L3 и их комплексов 1-3 в твердом состоянии
ν, см-1
Колебания триазольных
Соединение
P=O
C
5′′-H5′′
C-Hа
колец в спектре КР
L1 [7]
~1176
~3130
3080
1555, 1358, 1229, 1042, 667
L2
1176
3132
3080
1556, 1358, 1223, 1041, 671
L3
~1176
~3130
3080
1553, 1361, 1229, 1044, 674
L4 [7]
1177
3129
-
1551, 1368, 1240, 1040, 668
1
1112
3139
3102
1556, 1358, 1235, 1043, 673
2
1113
3138
3102
1556, 1358, 1228, 1043, 676
3
1111
3138
3102
1556, 1362, 1240, 1043, 676
4
1115
3144
-
1555, 1375, 1246, 1044, 676
а С-Н колебания фенильного заместителя в триазольном цикле.
1183 см-1 [5]). Уширенная полоса колебаний связи
азольном кольце имеют обычные для них значения
C-H в триазольном цикле проявляется без выра-
в области 7.3-7.8 м. д.
женного максимума около 3130 см-1. В спектре КР
В спектрах ЯМР 13C{1H} (CDCl3) сигналы цен-
к колебаниям двойных связей триазольных циклов
тральных метиленовых групп линкеров R прояв-
относится линия при 1555 см-1; линии при 1358,
ляются в виде синглетов при 25-29 м. д., а ядра
1229, 1042, 667 см-1, чувствительные к координа-
концевых атомов углерода линкера резонируют
ции атомов азота [7], можно отнести к валентным
при 46-50 (CH2N) и 64-67 м. д. (CH2O). Сигналы
и деформационным колебаниям циклов.
атомов углерода трифенилфосфиноксидного ядра
Колебательные спектры соединений L2, L3 по-
имеют химические сдвиги и мультиплетности,
добны спектрам гомолога L1 (табл. 1), что под-
типичные для соединений этой серии: синглеты
тверждает однотипность их строения. Небольшие
и дублеты в области 112-161 м. д. Ядра атомов
отличия спектров соединения L2 от спектров го-
углерода триазольного цикла проявляются в виде
мологов L1 и L3 [более узкие ИК полосы ν(P=O) и
синглетных сигналов при 120-121 и 147-148 м. д.
ν(C5′-H5′)], по-видимому, обусловлены некоторы-
Сигналы фенильных заместителей в триазольных
ми различиями в образовании внутри- и межмо-
циклах имеют характерные химические сдвиги
лекулярных контактов C-H···O=P, C-H···N в твер-
при ~125.7, 128.1, 128.8, 131 м. д. соответственно
дых образцах. Образование различных контактов
для атомов См,п,o,и.
в соединениях с 1,2,3-триазольными циклами от-
В спектрах ЯМР 31P{1H} (CDCl3) соединений
мечено в обзоре [2].
L2 и L3 синглетные сигналы ядер фосфора на-
Отнесения в спектрах ЯМР 1H и 13C сделаны
блюдаются при ~25 м. д., в масс-спектрах при-
на основании двумерных корреляций HMBC и
сутствуют пики молекулярных ионов [M]+. Таким
HMQC и сравнения со спектрами известных три-
образом, строение гомологов L1-L3 однотипно и
подальных лигандов на трифенилфосфиноксид-
различается лишь в незначительных деталях.
ной платформе [5] и соединений с 1,2,3-триазоль-
Реакция
стехиометрических
количеств
ным фрагментом [2, 7].
UO2(NO3)2·6H2O с соответствующим лигандом в
В спектрах ЯМР 1Н (CDCl3) соединений L2 и
растворе приводит к твердым комплексам 1-4, со-
L3 (схема 2) сигналы метиленовых протонов лин-
став которых, по данным элементного анализа и
кера R проявляются в виде триплетов или кварте-
колебательной спектроскопии, соответствует фор-
тов в диапазоне 1.3-4.1 м. д. Сигналы фенильных
муле [UO2(NO3)2(L)]·nH2O (1-4), где L = L1, n = 2
протонов трифенилфосфиноксидного ядра имеют
(1), L = L2, n = 2 (2), L = L3, n = 3 (3), L = L4, n = 2
химические сдвиги и мультиплетности, типичные
(4).
для соединений этой серии, и проявляются в виде
1,4-Замещенный 1,2,3-триазольный фрагмент
дублетов, триплетов или мультиплетов при 6.8-
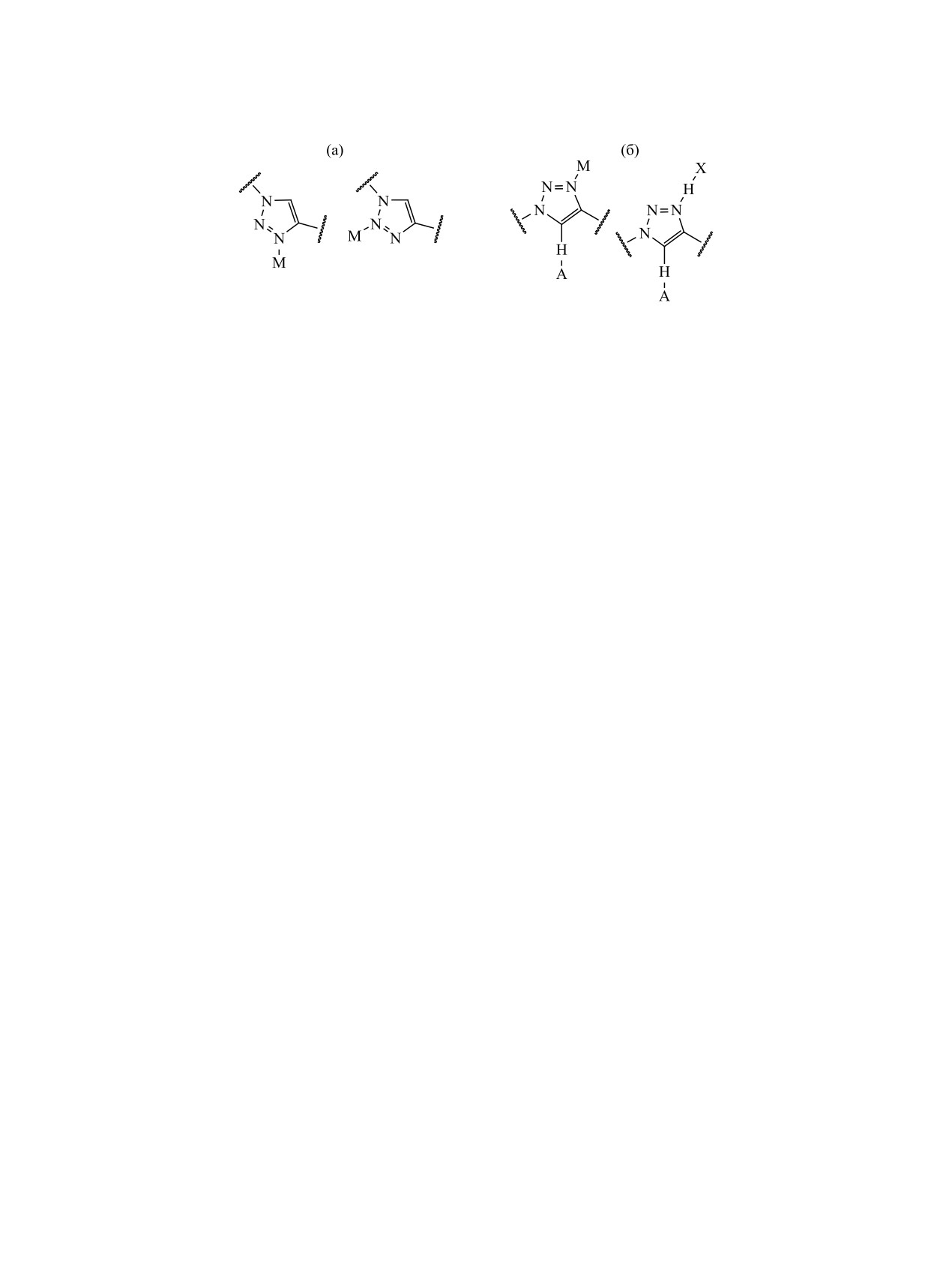
может взаимодействовать с катионами метал-
7.7 м. д. Протоны H5′′ при атомах С5′′ триазольных
лов атомами N3 или N2 (рис. 1а) в зависимости
циклов проявляются в виде синглетов при 7.8 м. д.
от пространственных особенностей координаци-
Сигналы протонов фенильных заместителей в три-
онного полиэдра металла и строения комплекса
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1942
МАТВЕЕВА и др.
Рис. 1. (а) Варианты N-координации 1,2,3-триазолов с катионами металлов (М - катион металла) и (б) одновременное
образование водородной связи с участием триазольного протона и координационной либо водородной связи с участием
атома N3 (А - акцептор водородной связи, H-X - донор водородной связи, М - катион металла).
[1, 2]. 1,4-Замещенный 1,2,3-триазол, имеющий
1113 и ~1097 см-1, соответственно, относящиеся к
большой дипольный момент (~4.5 Д), может вы-
колебанию координированной группы Р=О и сме-
ступать и как акцептор, и как донор водородной
шанной моде, содержащей вклад ν(P=O). Таким
связи, причем оба взаимодействия усиливают друг
образом, фосфорильная группа координирована
друга [2]. Известны кооперативные взаимодей-
во всех комплексах примерно одинаково. Поло-
ствия, когда одновременно наблюдаются межмо-
сы ν(С5′′-H5′′) в спектрах комплексов 1-3 также
лекулярная водородная связь с участием СН-про-
одинаковы и проявляются при 3138 см-1. Кро-
тона и координационная, либо водородная связь с
ме того, появляется слабое поглощение при 3102
см-1 и уменьшается интенсивность полосы при
атомом N3 1,4-дизамещенного триазола (рис. 1б)
3082 см-1, которая относится к колебаниям связей
[2, 13].
СPh-Н фенильных групп при триазольных циклах,
Гибридные лиганды L1-L4 могут образовать
реагирующих на перераспределение электронной
координационные связи с катионом уранила с уча-
плотности вследствие координации атомов азота.
стием фосфорильной группы и/или атомов азота
Для проверки этого предположения был получен
триазольных циклов. Спектральный признак такой
уранильный комплекс 4, лиганд которого в триа-
координации - смещение полос колебаний связей
зольном кольце содержит вместо фенильного бу-
Р=О, C5′′-H5′′ и цикла. Хотя внутри- или межмо-
тильный заместитель. В спектре комплекса 4 по-
лекулярные контакты в твердых лигандах также
глощение при 3102 см-1 отсутствует, в остальном
влияют на эти полосы, уменьшение частоты коле-
спектр подобен спектрам родственных соедине-
бания ν(Р=О) при координации с металлом значи-
ний (табл. 1). Следовательно, слабая полоса при
тельно больше, чем при образовании водородной
3102 см-1 может служить признаком координации
связи с протоном триазольного цикла. Поэтому
азота триазольного фрагмента. Однако при столь
координация фосфорильного кислорода легко
малых спектральных проявлениях нельзя опреде-
определяется по смещению полосы ν(P=O). Сме-
лить, сколько триазольных циклов координирова-
щения полос валентных колебаний связей C5′′-H5′′
но и какой именно атом азота цикла участвует в
и цикла при образовании водородных связей и при
координации.
координации с металлом сопоставимы, что затруд-
Заметны изменения, происходящие в спек-
няет их использование в качестве индикаторов ко-
трах КР (табл. 1). Так, например, линия в обла-
ординации атомов азота с металлом. Кроме того,
сти 1230-1240 см-1 в спектрах комплексов 1-3
частоты колебаний
«свободных» триазольных
смещается относительно линии индивидуаль-
фрагментов в спектрах индивидуальных твердых
ного лиганда на ~6-11 см-1. Полосы нитрат-и-
соединений L1-L4 неизвестны.
онов при 1525, 1270, 1030 см-1 соответствуют
Параметры колебательных спектров твердых
бидентатной координации. Полоса νas(UO2) на-
комплексов 1-4 и лигандов L1-L4 приведены в
блюдается при 937 см-1, линия νs(UO2) - при
табл. 1. В ИК спектрах всех комплексов полоса
855 см-1.
свободной группы Р=О отсутствует и наблюдают-
Хорошо известно, что большинство уранильных
ся два новых максимума поглощения при 1111-
комплексов имеют гексагональную геометрию, и в
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1,2,3-ТРИАЗОЛЬНЫЕ ТРИПОДАЛЬНЫЕ ЛИГАНДЫ
1943
Таблица 2. Рассчитанные энергия и геометрические параметры комплексов
Тип
Etot,
ΔE,
Межатомные расстояния, Å
Комплекс
координации
ат. ед.
ккал/мольа
d(P=O∙∙∙U)
d(NO
∙∙∙U)
d(N∙∙∙U)
3
n = 2
А
цис-η2-NO3
-31130.586221
0
2.373
2.493, 2.482; 2.505, 2.492
2.702
Б
транс-η2-NO3
-31130.560792
16.0
2.307
2.335; 2.456, 2.473
2.658
В
P=O
-31130.585788
0.3
2.271
2.434, 2.471; 2.473, 2.440
-
n = 3
А
цис-η2-NO3
-31248.446123
0
2.38
2.486, 2.481; 2.511, 2.504
2.671
Б
транс-η2-NO3
-31248.425284
13.1
2.333
2.532, 2.513; 2.493, 2.492
2.686
В
P=O
-31248.442716
2.1
2.289
2.425, 2.476; 2.442, 2.471
-
n = 4
А
цис-η2-NO3
-31366.296302
0
2.416
2.499, 2.487; 2.480, 2.497
2.728
Б
транс-η2-NO3
-31366.286217
6.3
2.323
2.482, 2.456; 2.511, 2.508
3.025
В
P=O
-31366.299712
-2.1
2.289
2.460, 2.431; 2.479, 2.433
-
а Относительная устойчивость комплексов рассчитана относительно комплексов А.
экваториальной плоскости уранильного катиона
нить возможность существования в растворе ком-
обычно имеется шесть координационных вакан-
плексов разного строения на уровне PBE/λ1 в про-
сий [8, 13]. Спектральные данные для твердых
грамме Priroda [14-16] были проведены расчеты
уранильных комплексов 1-3 позволяют предполо-
возможных изомеров комплексов UO2(L)(NO3)2
жить, что их строение однотипно: два нитрат-иона
(1:1), где L - лиганды, различающиеся длиной лин-
координированы бидентатно к катиону уранила, а
кера R, n = 2-4. Для упрощения расчетов исполь-
две оставшиеся в экваторильной плоскости коор-
зованы модельные лиганды, в которых фенильный
динационные вакансии занимает O,N-бидентат-
заместитель (R′) в триазольном кольце заменен на
но координированный лиганд. Не участвующие
метильный. На поверхности потенциальной энер-
в координации триазольные фрагменты лигандов
гии обнаружены комплексы как с бидентатной,
образуют дополнительные внутри- и межмолеку-
так и c монодентатной координацией лигандов.
лярные контакты, стабилизирующие структуру
Рассчитанные энергетические и геометрические
твердого комплекса.
параметры приведены в табл. 2.
Строение комплексов в растворе и в твердой
Самыми устойчивыми для лигандов с линке-
фазе может существенно различаться. Чтобы оце-
рами n = 2, 3 оказались цис-комплексы (А), в ко-
А
Б
В
Рис 2. Типы координации А-В на примере комплексов с длиной линкера в лиганде с n = 3.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1944
МАТВЕЕВА и др.
Таблица 3. Основные данные ИК спектроскопии растворов соединений L1-L4 и их комплексов 1-4 в CDCl3
ν, см-1
Соединение
P=O
C5′′-H5′′
С
Ph
-На
L1 [7]
1173
3149, 3117
3080
L2
1174
3145, 3120
3080
L3
1174
3146, 3100
3080, 3101
L4 [7]
1173
3149, 3117
-
1
1115, 1094б
3144
3080, 3102
2
1114, 1102б
3141
3080, 3102
3
1117, 1104б
3148
3080, 3102
4
1119, 1107б
3148
-
а С-Н колебания фенильного заместителя в триазольном цикле.
б Смешанное колебание с вкладом ν(Р=О).
торых лиганд η2-координирован по P=O группе
ν(C5′′-H5′′), наблюдаемая при 3149-3145 см-1, мо-
и атому азота одного триaзольного цикла, и оба
жет быть отнесена к колебаниям свободных групп
нитрат аниона бидентатны (рис. 2а). Аналогич-
С-Н в триазольных циклах. В спектре раствора
ные транс-изомеры для комплексов со всеми ли-
соединения L1 присутствует менее интенсивная
гандами (Б, рис. 2б) менее устойчивы, однако их
полоса при 3117 см-1, а в спектре раствора сое-
устойчивость возрастает с увеличением длины
динения L2 - еще менее интенсивная полоса при
линкера до n = 4, для которого ΔEtot не превышает
3120 см-1. Эти полосы исчезают при координации
6.3 ккал/моль (табл. 2). Действительно, таким
атома кислорода фосфорильной группы, поэтому
комплексам (В, рис. 2в) соответствуют локальные
они могут быть отнесены к колебаниям ν(C5′′-H5′′),
минимумы на поверхности потенциальной энер-
смещающихся при образовании водородной свя-
гии. В комплексе с лигандом L3, имеющим самым
зи С-Н···О=Р [смещение полосы ν(P=O) при этом
длинный линкер (n = 4), это самый выгодный тип
может не наблюдаться, так как взаимодействие с
координации.
протоном при С5′′, вероятно, не сильнее сольвата-
ции]. В спектре раствора соединения L3, в отли-
Комплексы с координацией В энергетически
чие от аналогов, наблюдается слабая полоса при
близки (ΔEtot = 0.3-2.1 ккал/моль) к комплексам А.
~3101 см-1 и уменьшается интенсивность полосы
Такую малую разницу в энергии можно объяснить
ν(СPh-Н) при 3080 см-1, поэтому можно предполо-
тем, что выигрыш от слабой координации триазо-
жить, что эта полоса смещается в высокочастот-
льного цикла компенсируется менее выгодными
ную сторону вследствие контакта C5′′-H5′′···N. Та-
конформациями линкера. В растворе координация
ким образом, в растворах в равновесии находятся
В более выгодна, поскольку большая конформаци-
молекулы с разного рода взаимодействиями между
онная подвижность лиганда и больший дипольный
донорно-акцепторными атомами и свободные от
момент способствуют возрастанию устойчивости
них, причем в соединениях L1 и L2 предпочтитель-
при сольватации. Специфическая сольватация,
ны контакты C5′′-H5′′···О=Р, а в соединении L3 с
например, за счет образования водородных свя-
самым длинным линкером - контакты C5′′-H5′′···N.
зей, может изменить найденные соотношения. Ре-
зультаты расчетов сопоставлены с экспериментом
В спектрах растворов комплексов 1-4 полосы
(данные ИК, ЯМР спектроскопии).
ν(P=O) наблюдаются при 1114-1119 см-1, свиде-
тельствуя о координации фосфорильной группы.
Строение комплексов в растворах в CDCl3 ис-
Полосы при 1094-1104 см-1, по-видимому, мож-
следовали методами ИК и мультиядерной ЯМР
но отнести к смешанному колебанию с вкладом
спектроскопии, сопоставляя данные спектров
ν(P=O). Положение полос ν(C5′′-H5′′) в спектрах
для растворов свободных лигандов и их комплек-
комплексов 1-4 практически совпадает с положе-
сов. В ИК спектрах растворов соединений L1-L4
нием полос свободных групп C5′′-H5′′ в спектрах
в CDCl3 полоса ν(P=O) наблюдается при 1173-
соответствующих соединений L1-L4. В спектрах
1174 см-1 (табл. 3), что типично для сольватирован-
комплексов 1-3 присутствует полоса при 3102 см-1,
ной хлороформом фосфорильной группы. Полоса
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1,2,3-ТРИАЗОЛЬНЫЕ ТРИПОДАЛЬНЫЕ ЛИГАНДЫ
1945
Таблица 4. Избранные полосы ИК и ЯМР 31P{1H}, 13C спектров соединений L1-L4 и их комплексов 1-4 в CDCl3
(0.01 моль/л) при 298 K
δС, м. д.
ν(P=O),
δP, м. д.
Соединение
см-1
(W
1/2
)a
C1
C5''
C4''
C2
Cи
OCH2
NCH2
L1 [7]
1173
25.2
(0.01)
120.74 д
122.02 с
147.52 с
159.54 с
130.59 с
49.05 c
66.67 c
1
1114
50.2 (0.3),
– в
121.9 с,
147.4 уш.
160.0 уш. с
130.5
49.1
66.5
44.3 (1.6)б
121.1 уш. с
с,
160.4 уш. с
уш. с
уш. с
уш. с
147.0 с
130.3
48.8
66.0
уш. с
уш. с
уш. с
L2
1175
24.9
(0.02)
121.12 д
120.93 с
147.34 с
160.30 д
130.69 с
46.16 с
64.02 с
2
1114
46.6 (1.5),
116.7
120.2 уш. с
147.60
160.8 уш. с
130.31 с
46.51 с
64.62 с
43.7
(0.7)
уш. д
уш. с
L3
1174
25.0
(0.02)
120.59 д
119.98 с
147.55 c
160.53 д
130.85 с
49.68 с
67.29с
3
1117
47.0 (1.7),
– в
119.96 с
147.58 с
160.8 уш. с
130.42 с
49.75 с
67.6
44.1
(1.2)
уш. с
L4 [7]
1173
24.4
(0.02)
121.39 д
122.23 с
148.22 с
159.95 д
-г
48.92 с
67.50 с
4
1119
43.4
(1.0)
117.32 д
121.8 уш. с
148.2
160.45
-г
48.62
67.10
уш. с
уш. с
уш. с
уш. с
а Полуширина сигнала на половине высоты (м. д.).
б Дополнительный минорный сигнал при 47.0 (~ 15%).
в Сигнал не регистрируется.
г Сигнал отсутствует.
относящаяся к колебаниям связей CPh-H фениль-
сигнал протона при С5′′ не регистрируется. Сигнал
ных групп при триазольных циклах, в которых
воды в спектрах также уширен, наибольшее уши-
атом азота либо координирован, либо образует во-
рение сигнала наблюдается в спектре комплекса 2:
дородную связь. Полоса при 3080 см-1, характер-
W1/2 ~ 0.7 м. д. В спектрах комплексов 1 и 3 ушире-
ная для некоординированного цикла, сохраняется.
ние гораздо меньше: W1/2 = ~ 0.1 и ~ 0.2 м. д.
Полосы нитрат-ионов при 1527 и 1270 см-1 соот-
Спектры ЯМР 13C комплексов существенно
ветствуют их бидентатной координации [13].
различаются. В спектре комплекса 1 наблюдается
Таким образом, на основании данных ИК спек-
два набора сигналов, один из которых практически
троскопии можно предположить, что в растворах
соответствует спектру свободного лиганда, а сиг-
существуют моноядерные комплексы 1-4 с двумя
налы второго отличаются от сигналов свободного
бидентатно координированными нитрат-ионами.
лиганда (табл. 4).
Во всех комплексах уверенно определяется коор-
Сдвиги сигналов атомов углерода платфор-
динация фосфорильной группы лиганда. Спек-
мы подтверждают координацию фосфорильной
тральные проявления координации триазольных
группы. В качестве примера в табл. 4 приведе-
циклов столь незначительны, что можно сделать
ны химические сдвиги атомов C1 и C2. Коорди-
только предположения о существовании слабой
нация атома азота триазольного цикла влияет на
координационной связи между атомом азота три-
сдвиги углеродных атомов цикла, и в меньшей
азольного цикла с катионом уранила.
степени - на сдвиги атомов углерода линкера и
Спектроскопия ЯМР в исследовании строе-
фенильного заместителя в триазольном цикле
ния уранильных комплексов 1-4 оказалась более
(табл. 4). Совокупность данных ЯМР 13C и ИК
спектроскопии позволяет предположить в раство-
информативной, чем ИК спектроскопия. Во всех
спектрах ЯМР 1H сигналы протонов уширены,
ре бидентатную O,N-координацию лиганда L1 в
уранильном комплексе (рис. 3а).
тонкая структура отсутствует, что свидетельству-
ет о протекании динамических процессов, замед-
В спектре ЯМР 31P раствора комплекса 1 на-
ленных в шкале времени ЯМР. Во всех спектрах
блюдаются два сигнала при 50.2 и 44.3 м.д. разной
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1946
МАТВЕЕВА и др.
Рис. 3. Схемы строения комплексов 1 (а), 2 (б), 3 (в) в растворе, согласно спектральным данным. В кружках: P - фосфо-
рильная группа лиганда, N - атомы азота триазольного цикла лиганда; S - растворитель.
полуширины с примерным соотношением инте-
ение и уширение сигналов. Учитывая особенности
гральной интенсивности 1:0.6. Анализ литератур-
спектра ЯМР 1H, мы полагаем, что лиганд L2 ко-
ных [17-20] и собственных данных показал, что в
ординирован O,N,N-тридентатно, причем атомы
спектрах уранильных комплексов достаточно ча-
азота образуют связь во второй координационной
сто появляются два сигнала атомов Р вследствие
сфере с атомами водорода координированной мо-
динамических процессов, цис/транс-изомери-
лекулы воды, а фосфорильный кислород обра-
зации, анионной изомерии, обмена и различной
зует связь непосредственно с катионом уранила
координации анионов и/или молекул растворите-
(рис. 3б). Такого рода взаимодействия с участием
ля и т. д. [17-20]. Можно сделать вывод, что ядра
молекул воды описаны для ряда уранильных ком-
атомов фосфора в уранильных комплексах весьма
плексов как в кристаллах, так и в растворе [4, 22].
чувствительны к магнитному окружению. При
В спектре ЯМР 13C комплекса 3 также наблю-
практически одинаковом значении ν(P=O) в ИК
дается один набор сигналов, однако сигналы ато-
спектрах комплексов 1 и 4 в спектре ЯМР 31P ком-
мов С триазольных фрагментов не отличаются от
плекса 1 наблюдаются два сигнала, а в спектре
сигналов свободного соединения L3 (табл. 4). Учи-
комплекса 4 - один (табл. 4).
тывая всю совокупность данных, можно предпо-
ложить, что в этом комплексе лиганд L3 координи-
В спектре ЯМР 13C комплекса 2 наблюдается
рован монодентатно через кислород (рис. 3в).
один набор сигналов, причем сигналы триазоль-
ных фрагментов смещены относительно сигна-
Таким образом, в растворе строение ураниль-
лов свободного соединения L2 почти так же, как
ных комплексов зависит от длины линкера R в ли-
в спектре комплекса 1. Учитывая, что координа-
гандах L1-L3. По данным расчетов, монодентатная
ционное число катиона уранила 6, тетрадентатной
O-координация предпочтительна для лиганда с
наиболее длинным линкером (n = 4), а бидентатная
O,N,N,N-координации лиганда ожидать нельзя.
O,N-координация - для лиганда с самым коротким
По данным ИК спектроскопии, в этом комплексе
оба нитрат-иона координированы бидентатно, а
линкером (n = 2).
лиганд, как минимум, координирован через фос-
Экстракционные свойства соединений L1-L3 в
форильную группу. Можно предположить, что в
отношении f-элементов изучены на примере извле-
растворе комплекса 2 происходит быстрый дина-
чения микроколичеств урана(VI), Th(IV) и Eu(III)
мический обмен слабо координированных и сво-
из нейтральных водных растворов в 1,2-дихлор-
бодных триазольных фрагментов, в результате чего
этан. Так как коэффициенты распределения
в спектре регистрируется один усредненный набор
(DM = [Morg]/[Maq], где M - металл), найденные
углеродных сигналов. Подобная «карусель» коор-
для Eu(III) и Th(IV), невелики (DEu <0.001, DTh ≤
динированных и свободных триазольных циклов
1), то в дальнейшем обсуждаются только данные
предполагалась в работе [21] («triazole dance»).
для урана
При понижении температуры до 253 K (0.05 М.
Эффективность экстракции определяется мно-
раствор комплекса 2 в CD2Cl2) динамические про-
гими факторами: прочностью экстрагируемых
цессы замедляются, и в спектре наблюдается удво-
комплексов, составом этих комплексов, липо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1,2,3-ТРИАЗОЛЬНЫЕ ТРИПОДАЛЬНЫЕ ЛИГАНДЫ
1947
фильностью экстрагента и его комплексов и т. д.
ционные свойства исследуемых соединений. Хотя
Необходимо учитывать, что строение и состав
причины такого необычного эффекта экспери-
экстрагируемых комплексов могут отличаться от
ментально окончательно не установлены, можно
строения и состава модельных соединений. В пер-
предположить, что структура соединения L3 в от-
вом приближении, данные о строении модельных
личие от его гомологов больше подходит для уча-
соединений позволяют делать адекватные пред-
стия триазольных фрагментов в дополнительных
положения об эффективности экстракции и могут
взаимодействиях, что приводит к смешению фаз
быть использованы при обсуждении эффективно-
при проведении экстракции. Амбидентный харак-
сти экстракции в зависимости от строения гомо-
тер триазольных циклов, способность участвовать
логов.
в образовании Н-связей и в качестве донора, и в
качестве акцептора, образовывать связи с катио-
Липофильность гомологов L1-L3 близка, ко-
нами и анионами, высокий дипольный момент и
эффициенты распределения (DL = [Lorg]/[Laq]) =
способность к специфической сольватации - все
23000, 24000 и >20000 соответственно. Величины
это приводит к усложнению строения комплексов
DL родственных триподальных соединений с кар-
в растворах и к возникновению динамических рав-
бамоильными заместителями в подвесках, пока-
новесий.
завших хорошие экстракционные свойства, почти
Несмотря на высокую собственную липофиль-
вдвое ниже [5]. Строение модельных комплексов
ность, исследованные соединения проявляют не-
1-3 в хлороформе различается. Наиболее прочные
значительную эффективность при извлечении
комплексы образуются с лигандом L1. Однако в
протестированных металлов.
исследуемом ряду в этом соединении существует
наиболее прочная внутримолекулярная Н-связь,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
которая должна разорваться при образовании ко-
Органические растворители марки ХЧ обезво-
ординационной связи. Поэтому эффективность из-
живали и очищали по стандартным методикам
влечения урана соединением L1 гораздо ниже, чем
[23]. Дейтерированные растворители, CDCl3 и
соединением L2, DU = 2.9 и 44.7 соответственно.
CD2Cl2, фирмы Acros использовали без дополни-
Соединение L3 с самым длинным линкером обра-
тельной очистки.
зует комплекс с монодентатной P(O)-координаци-
ИК спектры получены на ИК Фурье-спек-
ей лиганда. В отличие от гомологов L1 и L2 с эти-
трометре Bruker Tensor 37 для твердых образцов
леновым и пропиленовым линкерами определить
(таблетки в KBr) в диапазоне 4000-400 см-1 и
величину DU для этого соединения не удается. В
для 0.01 M. растворов в CDCl3 в диапазоне 4000-
эксперименте происходило смешение органиче-
950 см-1 [толщина кювет (CaF2) 0.022 мм]. Спек-
ской и водной фазы.
тры КР в области 3500-100 см-1 зарегистриро-
Вероятно, это объясняется различным строе-
ваны на спектрометре Jobin-Yvon LabRAM 300,
нием комплексов 1-3. В комплексах 1 и 2 присут-
снабженном микроскопом и лазерным ССD-де-
ствуют как свободные, так и координированные
тектором. В качестве возбуждающей линии ис-
триазольные фрагменты, тогда как в комплексе
пользована линия He-Ne-лазера с длиной волны
3 - только свободные, не связанные с металлом.
632.8 нм и мощностью не более 2 мВт. Спектры
Амбидентные триазольные фрагменты способны
ЯМР 1Н, 13С{1Н} и 31P{1Н} растворов синтезиро-
к разным типам ассоциации и сольватации за счет
ванных соединений в CD3Cl (0.01 моль/л) и CD2Cl2
образования Н-связей [2]. Можно предположить,
(0.05 моль/л) регистрировали на приборе Bruker
что степень внутри- и межмолекулярной ассоци-
Avance 500 (рабочие частоты 1Н, 13С и 31P - 500.13,
ации при участии трех свободных триазольных
125.77 и 242.97 МГц соответственно) и Bruker
фрагментов в комплексе 3 будет выше, чем для
Avance 400 (рабочие частоты 1Н, 13С и 31P - 400.13,
гомологов 1, 2, что в итоге приводит к смешению
100.61 и 161.98 МГц соответственно). В спектрах
фаз при проведении экстракции с использованием
ЯМР 1Н и 13С сигналы остаточных протонов и ато-
соединения L3.
мов углерода растворителя использованы в каче-
Таким образом, изменение длины линкера в
стве внутренних стандартов, точность определе-
гомологах L1-L3 кардинально изменяет экстрак-
ния химических сдвигов не менее 0.01 и 0.03 м. д.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1948
МАТВЕЕВА и др.
соответственно. Значения химических сдвигов в
(3H, Hп, 3JHH = 7.2), 7.36 т (6H, Hм, 3JHH = 7.4), 7.48
спектрах ЯМР 31P получены относительно внеш-
т (3H, H4, 3JHH = 7.8), 7.66 д. д (3H, H6, 3JHH = 7.6,
него стандарта (85%-ная H3PO4). Масс-спектры
3JHP = 14.4), 7.72 д (6H, Hо, 3JHH = 7.2), 7.82 c (3H,
растворов соединений L1-L3 в метаноле записа-
H5′′). Спектр ЯМР 13C (CDCl3), δС, м. д. (J, Гц) :
ны с использованием масс-спектрометра AmaZon
29.45 (C2′), 46.16 (C3′), 64.02 (C1′), 111.92 д (С3, 3JCP =
Bruker Daltonik GmbH в режиме ультра-сканиро-
6.4), 120.92 д (С5, 3JCP = 12.3), 120.93 (C5′′), 121.12
вания с положительной ионизацией в диапазоне
д (С1, 1JCP = 109.9), 125.65 (Cм), 128.06 (Cп), 128.80
m/z 70-2200. Температуры плавления измеряли
(Со), 130.69 (Cи), 133.84 д (C4 , 4JCP =1.3 ), 134.43
укороченными термометрами Аншютца в специ-
д (С6, 2JCP = 8.8), 147.34 (C4′′), 160.30 д (С2, 2JCP =
альном блоке с использованием капилляров. С, H,
1.8).Спектр ЯМР 31P{1H} (CDCl3): δP 24.9 м. д.
N определяли на приборе Carlo Erba 1106, P - по
Масс-спектр, m/z: 882 [М]+. Найдено, %: C 69.21;
известной методике [24].
H 5.68; N 14.14; P 3.48. C51H48N9O4P. Вычислено,
Азид натрия (Acros), UO2(NO3)2·6H2O (ХЧ)
%: C 69.42; H 5.49; N 14.30; P 3.51.
использовали без дополнительной очистки. Три-
Трис{2-[4-(4-фенил-1,2,3-триазол-1-ил)бу-
азиды [N3(CH2)nOC6H4]3PO (n = 2, 3, 4) синтези-
токси]фенил}фосфиноксид (L3). К раствору
ровали по известным методикам [25-27]. Трис{2-
0.4 г (0.65 ммоль) трис[2-(4-азидобутокси)фенил]-
[2-(4-фенил-1,2,3-триазол-1-ил)этокси]фенил}
фосфиноксида [N3(CH2)4OC6H4]3PO в 7 мл без-
фосфиноксид L1 и трис{2-[2-(4-бутил-1,2,3-три-
водного хлористого метилена добавляли 0.01 г
азол-1-ил)этокси]фенил}фосфиноксид L4 синте-
(0.07 ммоль) CuBr и 0.27г (2.6 ммоль) фенилаце-
зировали по известной методике [7]. Спектр КРС
тилена (Ph≡CCH). Смесь кипятили 7 ч. Реакцион-
соединения L4, см-1: 1590 с, 1551 сл, 1440 ср, 1397
ную смесь пропускали через колонку с Al2O3, элю-
ср, 1368 ср, 1240 ср, 1217 ср, 1179 ср, 1164 ср, 1040
ировали смесью хлороформ-метанол, 20:1. Выход
о. с, 988 о. сл, 899 сл, 880 сл, 797 сор, 668 ср, 611 о.
0.33 г (55.0%), т. пл. 152°C (хлористый метилен-
сл, 516 сл, 480 сл.
пентан). ИК спектр, ν, см-1: 3402 ш (H2O), 3130 пл
Трис{2-[3-(4-фенил-1,2,3-триазол-1-ил)про-
(C5′′-H5′′), 3105 пл, 3079 сл, 3027 сл, 2945 ср, 2929
покси]фенил}фосфиноксид (L2). К раствору
пл, 2876 сл, 1589 о. с, 1577 ср, 1560 о. сл, 1483 с,
0.58 г (10 ммоль) трис[2-(3-азидопропокси)фенил]-
1466 о. с, 1443 о. с, 1384 сл, 1356 о. сл, 1280 о. с,
фосфиноксида [N3(CH2)3OC6H4]3PO в 5 мл без-
1246 с., 1223 пл, 1196 пл, ~1175 пл (Р=О), 1164 ср,
водного хлористого метилена добавляли 0.01 г
1138 ср, 1084 ср, 1039 с, 1025 ср, 972 сл, 956 сл,
(7 моль) CuBr и 0.41 г (40 ммоль) фенилацетиле-
768 о. с, 696 с, 558 ср, 527 ср. Спектр КР, ν, см-1:
на (PhC≡CH). Смесь кипятили 5 ч. Реакционную
1610 о. с, 1553 ср, 1486 о. сл, 1444 о. сл, 1361 ср,
смесь пропускали через колонку с Al2O3, элюи-
1229 сл, 1168 ср, 1044 ср, 1001 с, 975 с, 674 сл, 619
ровали смесью хлороформ-метанол, 20:1. Выход
сл. Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 1.33
0.68 г (77.3%), т. пл. 112-113°C (хлористый ме-
к (6Н, H3′, 3JHH = 6.5), 1.64 к (6Н, H2′, 3JHH = 7.2),
тилен-пентан). ИК спектр, ν, см-1: 3397 ш (H2O),
3.73 т (6Н, H4′, 3JHH = 5.4), 4.11 т (6Н, H1′, 3JHH =
3132 сл (C5′′-H5′′), 3083 пл, 3064 сл, 3027 сл, 2993
7.0), 6.75 д. д (3H, H3, 3JHH = 8.0, 4JHP = 5.2), 6.89
о. сл, 2953 сл, 2931 сл, 2883 сл, 1589 о. с, 1577 ср,
т (3H, H5, 3JHH = 7.0), 7.27 - 7.37 м (6H, H4, Hп),
1560 о. сл, 1483 с, 1466 о. с, 1443 о. с, 1384 сл, 1356
7.37-7.50 м (9H, H6, Hм), 7.82 д (6H, Hо, 3JHH = 5.6),
о. сл, 1280 о. с., 1246 с, 1223 пл, 1196 пл, 1177 ср
7.85 c (3H, H5′′). Спектр ЯМР 13C (CDCl3), δС, м.
(Р=О), 1164 пл, 1138 ср, 1084 ср, 1039 с, 1025 ср,
д. (J, Гц): 25.49 (C3′), 26.87 (C2′), 49.69 (C4′), 67.30
768 о. с, 696 с, 558 ср, 527 ср. Спектр КР, ν, см-1:
(C1′), 111.54 д (С3, 3JCP = 6.7), 120.00 (C5′′), 120.19 д
1610 о. с, 1556 ср, 1441 сл, 1358 ср, 1305 о. сл, 1223
(С5, 3JCP = 12.8), 120.71 д (С1, 1JCP = 110.3), 125.70
о. сл, 1179 сл, 1155 сл, 1041 ср, 999 с, 974 с, 903
(Cм), 128.06 (Cп), 128.85 (Cо), 130.86 (Cи), 134.45
о. сл, 836 о. сл, 772 о. сл, 671 сл, 609 о. сл, 518 о.
(C4), 134.52 д (С6, 2JCP = 8.7), 147.56 (C4′′), 160.54
сл. Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 2.02
д (С2, 2JCP = 2.0 Гц). Спектр ЯМР 31P{1H} (СDCl3):
т (6Н, H2′, 3JHH = 5.2), 3.85 т (6Н, H3′, 3JHH = 5.4),
δP 25.0 м. д. Масс-спектр, m/z: 924 [М]+. Найдено,
4.20 т (6Н, H1′, 3JHH = 6.4), 6.90 д. д (3H, H3, 3JHH =
%: C 69.94; H 5.92; N 13.23; P 3.51. C54H54N9O4P.
8.0, 4JHP = 5.2), 7.04 т (3H, H5, 3JHH = 7.4), 7.29 т
Вычислено, %: C 70.19; H 5.89; N 13.64; P 3.35.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1,2,3-ТРИАЗОЛЬНЫЕ ТРИПОДАЛЬНЫЕ ЛИГАНДЫ
1949
Общая методика синтеза комплексов 1-4.
(0.0783 ммоль) UO2(NO3)2·6H2O в ацетонитриле.
Комплексы 1-4 синтезировали при соотношении
Выход 0.0842 г (82%), т. пл. >140° С (разл.). ИК
реагентов 1:1. К раствору соответствующего сое-
спектр, ν, см-1: 3400 ш (H2O), 3138 сл (C5′′-H5′′),
динения L1-L4 в хлороформе по каплям при пере-
3102 сл, 3066 сл, 2976 сл, 1590 с, 1578 ср, 1560 сл,
мешивании прибавляли раствор UO2(NO3)2·6H2O
1525 о. с. ш (NO3), 1481 с, 1442 о. с, 1386 ср, 1283
в ацетонитриле. Прозрачный светло-желтый рас-
о. с, 1270 пл (NO3), 1249 с, 1223 пл, 1196 сл, 1165
твор перемешивали несколько часов при 45-50°С
ср, 1142 ср, 1112 ср (Р=О), 1097 пл, 1088 с, 1059
и выдерживали ~12 ч при комнатной температуре.
пл, 1040 с, 1026 пл, 936 о. с [νas(UO2)], 760 о. с,
Растворитель удаляли в вакууме. Остаток сушили
694 с, 554 ср, 515 ср. Спектр КР, ν, см-1: 1611 о.
3 ч в вакууме (1-2 мм рт. ст.) над P2O5 при 62°С.
с, 1556 ср, 1487 о. сл, 1442 о. сл, 1358 ср, 1252 сл,
Выход 70-90%.
1228 сл, 1168 сл, 1157 сл, 1116 о. сл, 1043 ср, 1001
с, 975 с, 852 ср (νsUO2), 770 о. сл, 746 о. сл, 708 о.
Комплекс
[UO2(L1)(NO3)2]·2(H2O)
(1).
К
сл, 676 сл, 619 сл. Спектр ЯМР 1Н (CDCl3), δ, м. д.:
раствору 0.1062 г (0.1266 ммоль) соединения
~1.7 уш. с, 3.7 уш. с , 3.8 уш. с , 6.8 уш. с, 7.0 уш. с,
L1 в хлороформе прибавляли раствор 0.0636 г
7.7-7.4 уш.м, 7.8 уш. д, ~8 оч. уш. с. Спектр ЯМР
(0.1266 ммоль) UO2(NO3)2·6H2O в ацетонитриле.
13C (CDCl3), δС, м. д.: 29.13 с (C2′), 46.51 с (C3′),
Выход 0.1313 г (81%), т. пл. >155° С (разл.). ИК
64.62 с (C1′), 112.0 уш. с (С3), 116.7 д (С1, 1JCP = 110),
спектр, ν, см-1: 3430 ш (H2O), 3139 сл (C5′′-H5′′),
120.20 уш. с (C5′′), 121.2 уш. с (С5), 125.66 с (Cм),
3102 сл, 3068 ср, 1590 с, 1577 ср, 1559 сл, ~1525
128.27 с (Cп), 128.89 с (Cо), 130.31 с (Cи), 135.2 уш.
с. ш (NO3), 1477 о. с, 1443 о. с, 1384 сл, 1360 сл,
с (C4), 135.4 уш. с (С6), 147.56 уш. с (C4′′), 160.81
1285 о. с, 1270 пл, 1240 с, 1200 пл, 1167 сл, 1144
уш. с (С2). Спектр ЯМР 31Р{1Н} (CDCl3): δP 46.6
ср, 1112 пл (Р=О), 1097 ср, 1049 пл, 1037 ср, 937 с
м. д. (W1/2 = 1.5 м. д.), 43.7 м. д. (W1/2 = 0.7 м. д.),
[νas(UO2)], 910 пл, 850 сл, 799 сл, 761 о. с 740 пл,
примерное соотношение интегральных интенсив-
608 о. сл, 555 ср, 517 ср. Спектр КР, ν, см-1: 3148
ностей 0.3:1. Найдено, %: С 46.61; Н 3.79; N 12.01.
о. сл, 3071 ср, 2962 сл, 1610 о. с, 1556 ср, 1444 сл,
C51H52N11O14PU. Вычислено, %: С 46.69; Н 3.99;
1358 ср, 1302 о. сл, 1235 о. сл, 1200 о. сл, 1156 о. сл,
N 11.74.
1114 о. сл, 1043 ср, 1000 с, 972 с, 855 ср [νs(UO2)],
Комплекс
[UO2(L3)(NO3)2]·3(H2O)
(3).
К
794 о. сл, 741 о. сл, 707 о. сл, 673 сл, 643 о. сл, 612
раствору 0.0343 г (0.0371 ммоль) соединения
о. сл, 556 о. сл, 516 о. сл, 464 о. сл. Спектр ЯМР
L3 в хлороформе прибавляли раствор 0.0186 г
1Н (CDCl3), δ, м. д.: ~4.1 оч. ш. м, ~4.5 оч. ш. с, 6.3
(0.0371 ммоль) UO2(NO3)2·6H2O в ацетонитриле.
уш. с, 6.6 уш. с, 6.7 уш. с, 6.9 уш. с, 7.4 уш. с, 7.5
Выход 0.0428 г (84%), т. пл. >130° С (разл.). ИК
уш. с, 7.6 уш. с. Спектр ЯМР 13C (CDCl3), δC, м. д.:
спектр, ν, см-1: 3425 ш (H2O), 3138 сл (C5′′-H5′′),
48.8 уш. с и 49.1. уш. с (C2′), 66.0 уш. с и 66.5 оч.
3063 сл, 2947 сл, 2878 сл, 1590 с, 1576 ср, 1560 пл,
ш. с (C1′), 111.7 уш. с и 112.1 уш. с (C3), С1 не на-
1526 о. с. ш (NO3), 1478 с, 1466 пл, 1444 о. с, 1380
блюдается, 121.1 оч. ш. с (C5), 121.9 (C5′′) с и 121.1
ср, 1284 о. с, 1270 пл (NO3), 1254 с, 1220 пл, 1165
уш. с, 125.79 с и 126.02 с (Cо), 128.32 с (Cп), 128.69
сл, 1142 ср, 1112 пл (Р=О), 1097 пл, 1088 ср, 1055
с (Cм), 130.5 уш. с и 130.3 уш. с (Cи), 133.5 уш. с
ср, 1041 ср, 1025 пл, 937 о. с [νas(UO2)], 761 о. с,
и 134.3 оч. ш. с (C6), 135.7 уш. с (C4), 146.95 с и
695 ср, 556 ср, 516 ср. Спектр КР, ν, см-1: 1611 о.
147.4 оч. ш. с (C4′′), 60.0 оч. ш. с и 160.4 уш. с (C2).
с, 1556 ср, 1362 ср, 1255 о. сл, 1229 о. сл, 1043 ср,
Спектр ЯМР 31Р{1Н} (CDCl3): δP 50.2 м. д. (W1/2 =
1001 с, 974 с, 855 ср [νs(UO2)], 772 о. сл, 746 о. сл,
0.3 м. д.), 44.3 м. д. (W1/2 = 1.6 м. д.), примерное
676 сл, 612 о. сл. Спектр ЯМР 1Н (CDCl3), δ, м.
соотношение интегральных интенсивностей 1.7:1;
д.: 0.9 уш. с, 1.4 уш. с, 3.6 уш. с, 4.0 уш. с, 6.7 уш.
дополнительный минорный сигнал (~ 15%) δP 47.0
с, 6.8 уш. с, 7.32-7.35 м, 7.41-7.45 м, 7.6 оч. ш. с,
м. д. (W1/2 ~ 1 м. д.) Найдено, %: С 45.60; Н 3.35;
7.81 с, 7.83 с. Спектр ЯМР 13C (CDCl3), δC, м. д.:
N 12.16. C48H46N11O14PU. Вычислено, %: С 45.39;
25.3 уш. с (C3′), 26.65 с (C2′), 49.75 с (C4′), 67.6 оч.
Н 3.62; N 12.13.
уш. с (C1′), 112.0 уш. с (С3), 119.96 с (C5′′), ~120.6
Комплекс
[UO2(L2)(NO3)2]·2(H2O)
(2).
К
уш. с (С5), сигнал С1 не наблюдается, 125.65 с (Cм),
раствору 0.0691 г (0.0783 ммоль) соединения
128.30 с (Cп), 128.97 с (Cо), 130.42 с (Cи), 135.1 уш.
L2 в хлороформе прибавляли раствор 0.0393 г
с (C4 +С6), 147.58 с (C4′′), 160.8 уш. с (С2). Спектр
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1950
МАТВЕЕВА и др.
ЯМР 31Р{1Н} (CDCl3): δP 47.0 м. д. (W1/2 = 1.7 м. д.),
фазе определяли после реэкстракции 0.1 М. рас-
44.1 м. д. (W1/2 = 1.2 м. д.), примерное соотноше-
твором
1-гидроксиэтан-1,1-дифосфоновой кис-
ние интегральных интенсивностей 0.5:1. Найдено,
лоты. Коэффициенты распределения элементов
%: С 47.09; Н 4.09; N 11.28. C54H60N11O15PU. Вы-
рассчитывали как отношение их концентраций в
числено, %: С 47.27; Н 4.41; N 11.23.
равновесных органической и водной фазах (DM =
Комплекс
[UO2(L4)(NO3)2]·2(H2O)
(4).
К
[Morg]/[Maq]). Погрешность определения DM не бо-
раствору 0.0322 г (0.0413 ммоль) соединения
лее 5%.
L4 в хлороформе прибавляли раствор 0.0207 г
Коэффициенты распределения (DL = [Lorg]/[Laq])
(0.0413 ммоль) UO2(NO3)2·6H2O в ацетонитриле.
для соединений L1-L3 расчитывали как отноше-
Выход 0.0425 г (85%), т. пл. >115° С (разл.). ИК
ние равновесных концентраций в органической и
спектр, ν, см-1: 3370 ш (H2O), 3144 сл (C5′′-H5′′),
водной фазе. Исходная концентрация экстрагентов
3072 сл, 2956 с, 2931 с, 2870 ср, 1591 с, 1578 ср,
в органической фазе 0.05 моль/л, концентрация
1522 о. с. ш (NO3), 1479 о. с, 1285 о. с, 1242 с, 1166
NH4NO3 в водной фазе 3 моль/л. Концентрацию
сл, 1143 с, 1115 с (Р=О), 1090 с, 1061 пл, 1042 с,
экстрагентов в равновесной водной фазе оценива-
933 с [νas(UO2)], 798 ср, 766 с, 705 ср, 556 с, 538
ли путем определения фосфора с помощью атом-
ср. Спектр КР, ν, см-1: 1591 ср, 1555 сл, 1457 сл,
но-эмиссионной спектрометрии с индуктивно
1289 сл, 1246 ср, 1149 ср, 1119 сл, 1044 о. с, 853 о. с
связанной плазмой (ИСП-МС) с использованием
[νs(UO2)], 797 ср, 676 ср. Спектр ЯМР 1Н (CDCl3),
спектрометра ICAP-61 (Thermo Jarrel Adh).
δ, м. д.: 0.9 уш. с, 1.3 уш. с, 1.5 уш. с, 2.6 уш. с, 4.0
уш. с, 4.2 уш. с, 6.8 уш. с, 7.0 уш. с, 7.1 уш. с, 7.6 уш.
ФОНДОВАЯ ПОДДЕРЖКА
с, 7.8 оч. ш. с. Спектр ЯМР 13C (CDCl3), δC, м. д.:
Работа выполнена при поддержке Российско-
13.81 с (Cδ), 22.34 с (Cγ), 25.34 с (Cβ), 31.43 с (Cα),
го научного фонда (проект № 20-13-00329) с ис-
48.6 уш. с (C2′), 67.1 уш. с (C1′), 112.45 c (C3), 117.32
пользованием оборудования Центра исследования
д (C1, 1JPC = 121.2), 121.75 уш. с (C5), 121.8 (C5′′),
строения молекул Института элементоорганиче-
134.86 с (C4), 135.35 с (C6), 148.2 уш. с (C4′′), 160.45
ских соединений РАН.
уш. с (C2). Спектр ЯМР 31Р{1Н} (CDCl3): δP 43.4 м.
д. (W1/2 = 1.0 м. д.). Найдено, %: С 41.59; Н 4.79; N
КОНФЛИКТ ИНТЕРЕСОВ
11.68. C42H58N11O14PU. Вычислено, %: С 41.69; Н
Авторы заявляют об отсутствии конфликта
4.83; N 12.73.
интересов.
Исследование экстракции. В качестве органи-
СПИСОК ЛИТЕРАТУРЫ
ческого растворителя использовали 1,2-дихлорэ-
тан марки ХЧ без дополнительной очистки. Рас-
1. Aromí G., Barrios L.A., Roubeau O., Gamez P. // Coord.
творы экстрагентов концентрации
0.05 моль/л
Chem. Rev. 2011. Vol. 255. P. 485. doi 10.1016/j.
готовили по точной навеске. Исходные водные
ccr.2010.10.038
2. Schulze B., Schubert U.S.// Chem. Soc. Rev. 2014.
растворы U(VI), Th(IV) и Eu(III) готовили рас-
Vol. 43. P. 2522. doi 10.1039/c3cs60386e
творением соответствующих нитратов в воде с
3. Götzke L., Schaper G., März J., Kaden P., Huittinen N.,
последующим добавлением NH4NO3. Исходная
Stumpf T., Kammerlander K.K.K., Brunner E., Hahn P.,
концентрация ионов металлов - 4×10-6 моль/л,
Mehnert A., Kersting B., Henle T., Lindoy L.F., Zanoni
концентрация NH4NO3 - 3 моль/л. Контакт фаз
G., Weigand J.J. // Coord. Chem. Rev. 2019. Vol. 386.
происходил при комнатной температуре в аппа-
P. 267. doi 10.1016/j.ccr.2019.01.006
рате для перемешивания со скоростью 60 об/мин
4. Kudryavtsev I.Yu., Baulina T.V., Pasechnik M.P.,
в течение 1 ч, что достаточно для установления
Matveev S.V., Matveeva A.G. // Phosphorus, Sulfur,
постоянных значений коэффициентов распреде-
Silicon, Relat. Elem. 2014. Vol. 189. N 7-8. P. 946. doi
ления. Концентрацию металлов в исходных и рав-
10.1080/10426507.2014.904865
новесных водных растворах определяли методом
5. Matveeva A.G., Kudryavtsev I.Yu., Pasechnik M.P., Vo-
масс-спектрометрии с ионизацией пробы в индук-
logzhanina AV., Baulina T.V., Vavina A.V., Sukat G.Ya.,
тивно связанной плазме (ИСП-МС) с использова-
Matveev S.V., Godovikov I.A., Turanov A.N., Karandas-
нием масс-спектрометра X-7 (Thermo Elemental,
hev V.K., Brel V.K. // Polyhedron. 2018. Vol. 142. P. 71.
США) [28]. Количество элементов в органической
10.1016/j.poly.2017.12.025
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1,2,3-ТРИАЗОЛЬНЫЕ ТРИПОДАЛЬНЫЕ ЛИГАНДЫ
1951
6.
Быховская О.В., Матвеева А.Г., Пасечник М.П., Во-
19.
Wahu S., Berthet J.-C., Thuéry P., Guillaumont D.,
логжанина А В., Матвеев С.В., Кудрявцев И.Ю.,
Ephritikhine M., Guillot R., Cote G., Bresson C. // Eur.
Баулина Т.В., Брель В.К. // ЖОХ. 2019. Т. 89. Вып. 12.
J. Inorg. Chem. 2012. Vol. 23. P. 3747. doi 10.1002/
С. 1885. doi 10.1134/S0044460X19120126; Bykhovska-
ejic.201200243
ya O.V., Matveeva A.G., Pasechnik M.P., Vologzhani-
20.
Hä1ller L.J.L., Kaltsoyannis N., Sarsfield M.J., May I.,
na A.V., Matveev S.V., Kudryavtsev I.Yu., Baulina T.V.,
Cornet S.M., Redmond M.P, Helliwell M. // Inorg. Chem.
Brel V.K. // Russ. J. Gen. Chem. 2019. Vol. 89. N 12.
P. 2400. doi 10.1134/S1070363219120120
2007. Vol. 46, N 12. P. 4868. doi 10.1021/ic062031m
7.
Kudryavtsev I.Yu., Bykhovskaya O.V., Matveeva A.G.,
21.
Colasson B., Le Poul N., Le Mest Y., Reinaud O. //
Baulina T.V., Pasechnik M.P., Matveev S.V.,
Inorg. Chem. 2011. Vol. 50, P. 10985. doi 10.1021/
Vologzhanina A.V., Turanov A.N., Karandashev V.K.,
ic201540x
Brel V.K. // Monatsh. Chem. 2020. Vol. 151. P. 1705.
22.
Das D., Kannan S., Maity D.K., Drew M.G.B. // Inorg.
doi 10.1007/s00706-020-02702-6
Chem. 2012. Vol. 51. P. 4869. doi 10.1021/ic300398a
8.
Jones M.B., Gaunt A.J. // Chem. Rev. 2013. Vol. 113.
23.
Armarego W.L.F., Chai C.L.L. Purification of labora-
P. 1137. doi 10.1021/cr300198m
tory chemicals. New York: Elsevier, 2009. P. 743. doi
9.
Carter K.P, Cahill C.L. // Inorg. Chem. Front. 2015.
Vol. 2. P. 141.doi 10.1039/c4qi00183d
10.1134/S0044460X1809024X
10.
Mazzanti M., Wietzke R., Pécaut J.,. Latour J.-M, Mal-
24.
Гельман Н.Е., Терентьева Е.А., Шанина Т.М., Кипа-
divi P., Remy M. // Inorg. Chem. 2002. Vol. 41. P. 2389.
ренко Л.М. Методы количественного органического
doi 10.1021/ic010839v
элементного микроанализа. М.: Химия, 1987. 296 с.
11.
Van Horn J.D., Huang H. // Coord. Chem. Rev. 2006.
25.
Кудрявцев И.Ю., Быховская О.В., Аладжева И.М.,
Vol. 250. P. 765. doi:10.1016/j.ccr.2005.09.0
Баулина Т.В., Брель В.К. // ЖОХ. 2017. Т. 87. Вып.
12.
Urankar D., Pevec A., Turel I., Košmrlj J. // Cryst.
11. С. 1922; Kudryavtsev I.Yu., Bykhovskaya O.V.,
Growth Des. 2010. Vol. 10. N 11. P. 4920. doi 10.1021/
cg100993k
Aladzheva I.M., Baulina T.V., Brel V.K. // Russ. J.
13.
Nakamoto K. Infrared and Raman Spectra of Inorganic
Gen. Chem. 2017. Vol. 87. N 11. P. 2744. doi 10.1134/
and Coordination Compounds. Hoboken: J. Wiley &
S1070363217110366
Sons, Inc., 2009. 408 p.
26.
Баулина Т.В., Кудрявцев И.Ю., Сукат Г.Я.,
14.
Laikov D.N. // Chem. Phys. Lett. 1997. Vol. 281. P. 151.
Брель В.К. // ЖОХ. 2018. Т. 88. Вып. 9. С. 1559.
doi 10.1016/S0009-2614(97)01206-2
doi 10.1134/S0044460X1809024X; Baulina Т.V.,
15.
Laikov D.N. // Chem. Phys. Lett. 2005. Vol. 416. P. 116.
Kudryavtsev I.Yu., Sukat G.Ya., Brel V.K. // Rus. J.
doi 10.1016/j.cplett.2005.09.046
16.
Лайков Д.Н., Устынюк Ю.Н. // Изв. АН. Сер. хим.
Gen. Chem. 2018. Vol. 88. N 9. P. 1927. doi 10.1134/
2005. № 3. С. 804; Laikov D.N., Ustynyuk Y.A. // Russ.
S1070363218090281
Chem. Bull. 2005. Vol. 54. P. 820. doi 10.1007/s11172-
27.
Baulina T.V., Kudryavtsev I.Yu., Smolyakov A.F., Pa-
005-0329-x
sechnik M.P., Brel V.K. // Heteroatom Chem. 2018.
17.
Szabó Z., Toraishi T., Vallet V., Grenthe I. // Coord.
Vol. 29. P. e21454. doi 10.1002/hc.21454
Chem. Rev. 2006. Vol. 250. P. 784. doi 10.1016/j.
28.
Туранов А.Н., Карандашев В.К., Баулин В.Е., Цвет-
ccr.2005.10.005
ков Е.Н. // ЖНХ. 1995. Т. 40. С. 1926; Turanov A.N.,
18.
Redmond M.P., Cornet S.M., Woodall S.D., Whittaker D.,
Collison D., Helliwell M., Natrajan L.S. // Dalton Trans.
Karandashev V.K., Baulin V.E., Tsvetkov E.N. // Russ. J.
2011. Vol. 40. P. 3914. doi: 10.1039/c0dt01464h
Inorg. Chem. 1995. Vol. 40. P. 1926.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1952
МАТВЕЕВА и др.
Triphenylphosphine Oxide Based 1,2,3-Triazole Tripodal
Ligands. Coordination and Extraction Properties
A. G. Matveevaa,*, T. V. Baulinaa, I. Yu. Kudryavtseva, M. P. Pasechnika, R. R. Aysina,
O. V. Bykhovskayaa, M. I. Godovikovaa, S. V. Matveeva, A. N. Turanovb,
V. K. Karandashevc,d, and V. K. Brela
a Nesmeyanov Institute of Organoelement Compounds, Russian Academy of Sciences, Moscow, 119991 Russia
b Institute of Solid-State Physics, Russian Academy of Sciences, Chernogolovka, 142432 Russia
c Institute of Microelectronics Technology and High Purity Materials, Russian Academy of Sciences,
Chernogolovka, 142432 Russia
d National University of Science and Technology MISiS, Moscow, 119991 Russia
*e-mail: matveeva@ineos.ac.ru
Received August 27, 2020 ; revised August 27, 2020 ; accepted September 14, 2020
New 1,2,3-triazole tripodal ligands on the triphenylphosphine oxide platform with different linker length were
synthesized. Their composition and structure were established by elemental analysis, mass spectrometry, vibra-
tional (IR, Raman), and multinuclear (1H, 13C, 31P) NMR spectroscopy. Coordination and extraction properties
of the ligands were studied by the example of complexation with uranyl nitrate and recovery of micro amounts
of U(VI) from aqueous phase into 1,2-dichloroethane.
Keywords: 1,2,3-triazole tripodal ligands, functionalized phosphine oxides, complexes with UO2(NO3)2,
extraction
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020