ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 12, с. 1958-1960
КРАТКИЕ
СООБЩЕНИЯ
УДК 547.732;547.772.2
ОСОБЕННОСТИ ОКИСЛЕНИЯ
1-КАРБАМОИЛЗАМЕЩЕННЫХ ГЕКСАГИДРО-1H-
ТИЕНО[3,2-c]ПИРАЗОЛ-4,4-ДИОКСИДОВ
© 2020 г. И. Е. Ефремоваa,*, А. В. Серебрянниковаb, Л. В. Лапшинаc, И. И. Савельевa
a Российский государственный педагогический университет имени А. И. Герцена,
наб. р. Мойки 48, Санкт-Петербург, 191186 Россия
b Санкт-Петербургский государственный университет, Санкт-Петербург, 199034 Россия
c Военно-медицинская академия имени С. М. Кирова, Санкт-Петербург, 194044 Россия
*e-mail: kohrgpu@yandex.ru
Поступило в Редакцию 30 сентября 2020 г.
После доработки 30 сентября 2020 г.
Принято к печати 14 октября 2020 г.
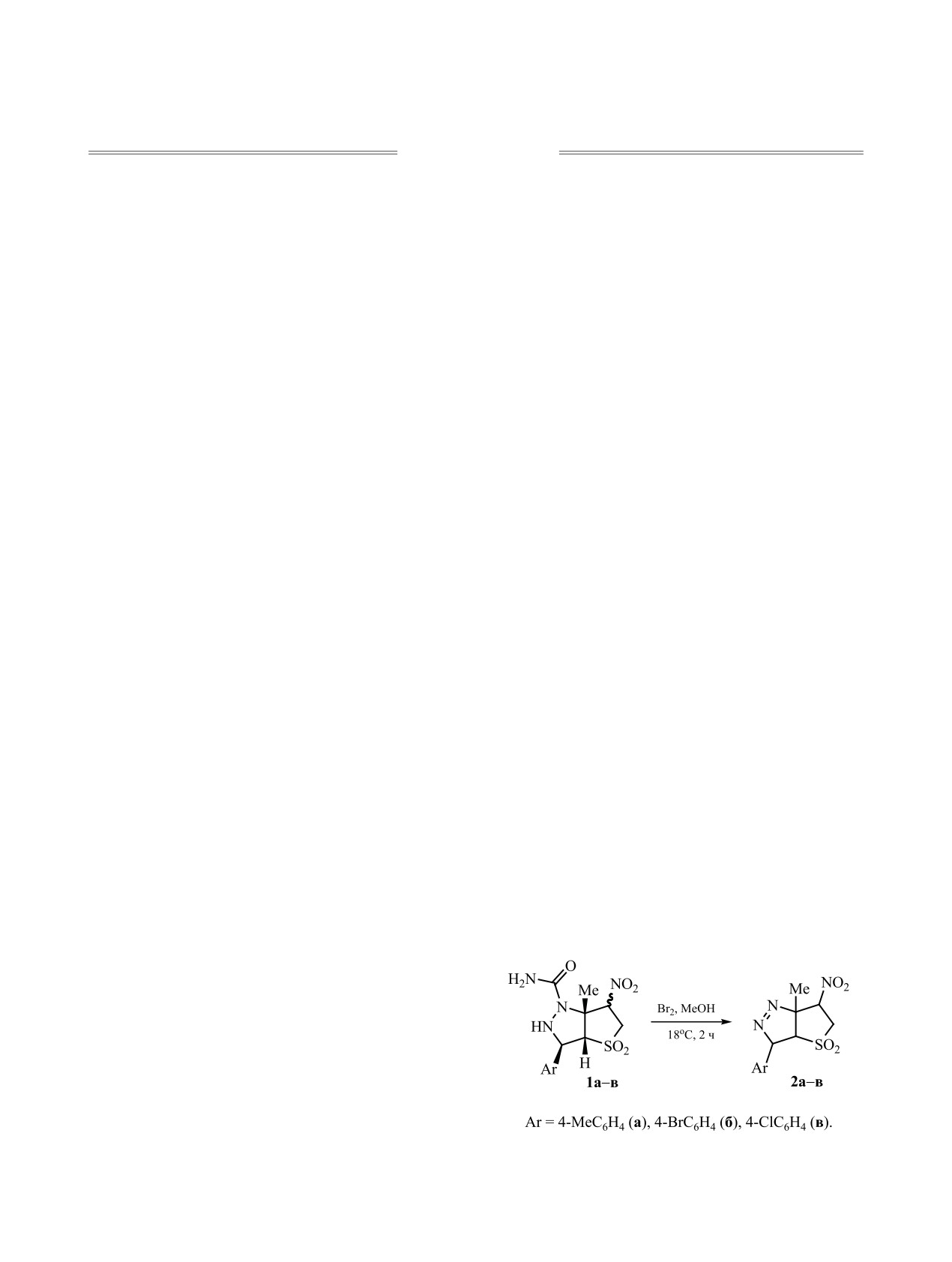
Окислением 3-арил-1-карбамоил-6а-метил-6-нитрогексагидро-1H-тиено[3,2-c]пиразол-4,4-диоксидов по-
лучены новые бициклические производные нитросульфолана, конденсированного с 4,5-дигидро-3Н-пира-
золом, - 3-арил-6а-метил-6-нитро-3а,5,6,6а-тетрагидро-3Н-тиено[3,2-c]пиразол-4,4-диоксиды. Строение
полученных соединений установлено методами ИК, ЯМР 1Н, 13С{1Н}, 1Н-13С HMQC, 1Н-13С HMBC
спектроскопии.
Ключевые слова: сульфоланы, пиразолы, пиразолины, окисление
DOI: 10.31857/S0044460X20120203
Интерес к разработке способов получения
ления. Кратковременное действие двукратного
структур с пиразолиновыми циклами [1-3] обу-
избытка брома (MeOH, 18°С, 2 ч) на диастереои-
словлена их практической значимостью, в том чис-
зомерные соединения 1а-в завершалось образова-
ле потенциальной биологической активностью [4,
нием стереооднородных соединений 2а-в с выхо-
5]. Методы синтеза соединений с конденсирован-
дами 52-66% (схема 1).
ными циклами пиразолина и сульфолана до недав-
Аналогичные реакции окисления N-карбамоил-
него времени ограничивались реакциями 1,3-ди-
замещенных соединений, приводящие к образова-
полярного циклоприсоединения диазометана к
нию структур с циклом 4,5-дигидро-3Н-пиразола,
дигидротиофен-1,1-диоксидам, протекающими в
протекали при действии пероксида никеля [9, 10].
жестких условиях [6, 7]. Ранее был предложен про-
Схема 1.
стой способ получения бициклических структур
с аннелированными циклами нитросульфолана и
4,5-дигидро-1Н-пиразола при окислении бромом
3-арил-6а-метил-6-нитрогексагидротиено[3,2-c]-
пиразол-4,4-диоксидов [8].
Дальнейшие исследование этого метода пока-
зало, что присутствие карбамоильной группы в
положении 1 тиено[3,2-c]пиразол-4,4-диоксидов
1а-в вносит специфику в направленность их окис-
1958
ОСОБЕННОСТИ ОКИСЛЕНИЯ 1-КАРБАМОИЛЗАМЕЩЕННЫХ
1959
Соединения 2a-в представляют собой бесцвет-
131.77 (Ar). Найдено, %: N 13.17. C13H15N3O4S.
ные кристаллические вещества, устойчивые при
Вычислено, %: N 13.58.
хранении. Их строение установлено на основа-
3-(4-Бромфенил)-6а-метил-6-нитро-
нии данных ИК, ЯМР 1Н, 13С{1Н}, 1Н-13С HMQC,
3а,5,6,6а-тетрагидро-3Н-тиено[3,2-c]пиразол-
1Н-13С HMBC спектроскопии. В ИК спектрах про-
4,4-диоксид (2б) получали аналогично из 0.5 ммоль
являются полосы поглощения несопряженной ни-
соединения 1б и 0.16 г (0.05 мл) брома. Выход
трогруппы (1366-1378, 1575 см-1) и сульфониль-
0.098 г (52%), белый порошок, т. пл. 155-157°С
ной группы (1149-1153, 1302-1305 см-1).
(метанол). ИК спектр, ν, см-1: 1153, 1303 (SO2);
Спектры ЯМР 1Н, свидетельствующие о стере-
1367, 1575 (NO2). Спектр ЯМР 1Н (CD3CN), δ, м. д.
ооднородности соединений 2a-в, содержат близ-
(J, Гц): 1.49 с (3Н, Ме), 3.66 д (1Н, С3аН, 3J = 3.0),
кие по химическим сдвигам сигналы протонов
3.69 д. д (1Н, С5Н2, 2J = 14.0, 3J = 7.1), 4.18 д. д (1Н,
всех структурных фрагментов молекул. Например,
С5Н2, 2J = 14.0, 3J = 7.5), 5.52 д. д (1Н, С6Н, 3J = 7.1,
в спектре соединения 2a протоны метильной груп-
3J = 7.5), 6.49 д (1Н, С3Н, 3J = 3.0), 7.12 д и 7. 57 д
пы проявляются в виде синглета при 1.52 м. д.,
(4Н, 4-BrC6H4, 3J = 8.5). Спектр ЯМР 13С (CD3CN),
протоны метиленовой и нитрометиновой групп
δС, м. д.: 19.46 (Me), 52.99 (C5), 66.76 (C3a), 83.55
образуют систему АВХ с химическими сдвигами
(C6), 93.25 (C3), 100.15 (C6a), 122.42, 129.08, 132.45,
134.13 (Ar). Найдено, %: N 11.68. C12H12BrN3O4S.
3.67, 4.14, 5.52 м. д. (2JАВ = 14.5, 3JАХ =7.0, 3JВХ =
Вычислено, %: N 11.23.
7.5 Гц); сигналы метиновых протонов при атомах
углерода С3a и С3 проявляются в виде дублетов при
6а-Метил-6-нитро-3-(4-хлорфенил)-
3.61 и 6.48 м.д. (3J = 3.1 Гц).
3а,5,6,6а-тетрагидро-3Н-тиено[3,2-c]пиразол-
4,4-диоксид (2в) получали аналогично из 0.5 ммоль
Таким образом, нами выявлено влияние карба-
соединения 1c и 0.16 г (0.05 мл) брома. Выход 0.11 г
моильной группы на направленность окисления
(66%), белый порошок, т. пл. 159-160°С (метанол).
тиено[3,2-c]пиразол-4,4-диоксидов и предложен
ИК спектр, ν, см-1:1151, 1302 (SO2); 1368, 1571
метод синтеза бициклических производных с
(NO2). Спектр ЯМР 1Н (CD3CN), δ, м. д. (J, Гц):
конденсированными циклами нитросульфолана и
1.50 с (3Н, Ме), 3.66 д (1Н, С3аН, 3J = 3.3), 3.70 д.
4,5-дигидро-3Н-пиразола, что позволило расши-
д (1Н, С5Н2, 2J = 14.5, 3J = 7.1), 4.17 д. д (1Н, С5Н2,
рить ряд ранее синтезированных аннелированных
2J = 14.5, 3J = 7.6), 5.52 д. д (1Н, С6Н, 3J = 7.1, 3J =
производных сульфолана [8, 11-14].
7.6), 6.51 д (1Н, С3Н, 3J = 3.3), 7.18 д и 7.42 д (4Н,
Исходные соединения 1а-в получены по из-
4-ClC6H4, 3J = 8.5). Спектр ЯМР 13С (CD3CN), δС,
вестной методике [12].
м. д.: 19.49 (Me), 53.13 (C5), 67.02 (C3a), 83.60 (C6),
6а-Метил-3-(4-метилфенил)-6-нитро-
93.40 (C3), 100.17 (C6a), 128.75, 129.35, 133.64,
3а,5,6,6а-тетрагидро-3Н-тиено[3,2-c]пиразол-
134.35 (Ar). Найдено, %: N 12.19. C12H12ClN3O4S.
4,4-диоксид (2а). К суспензии 0.5 ммоль соеди-
Вычислено, %: N 12.74.
нения 1а в 5 мл абс. метанола прибавляли 0.16 г
ИК спектры записаны на Фурье-спектрометре
(0.05 мл, 1 ммоль) брома. Реакционную смесь пе-
Shimadzu IRPrestige-21 в таблетках KBr. Спектры
ремешивали 2 ч при комнатной температуре. Об-
ЯМР 1Н, 13С для образцов в CD3CN зарегистриро-
разовавшийся осадок отфильтровывали, промыва-
ваны на спектрометре Jeol ECX400A с рабочими
ли метанолом, сушили на воздухе. Выход 0.095 г
частотами 400 (1H) и 100 МГц (13С). Элементный
(61%), белый порошок, т. пл. 157-159°С (метанол).
анализ выполнен на анализаторе Eurovector EA
ИК спектр, ν, см-1: 1149, 1305 (SO2); 1366, 1570
3000 (CHN Dualmode). Температуры плавления
(NO2). Спектр ЯМР 1Н (CD3CN), δ, м. д. (J, Гц):
определены на приборе ПТП(М) ТУ 92-891.001-90.
1.52 с (3Н, Ме), 3.61 д (1Н, С3аН, 3J = 3.1), 3.67 д.
ФОНДОВАЯ ПОДДЕРЖКА
д (1Н, С5Н2, 2J = 14.5, 3J = 7.0), 4.14 д. д (1Н, С5Н2,
2J = 14.5, 3J = 7.5), 5.52 д. д (1Н, С6Н, 3J = 7.0, 3J =
Работа выполнена при финансовой поддержке
7.5), 6.48 д (1Н, С3Н, 3J = 3.1), 7.09 д и 7. 24 д (4Н,
Российского фонда фундаментальных исследова-
4-MeC6H4, 3J = 8.2). Спектр ЯМР 13С (CD3CN),
ний (проект № 20-33-90071) и Министерства про-
δС, м. д.: 20.19 (Me), 52.97 (C5), 67.16 (C3a), 83.64
свещения России в рамках государственного зада-
(C6), 93.78 (C3), 99.88 (C6a), 127.17, 128.94, 130.02,
ния (проект № FSZN-2020-0026).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020
1960
ЕФРЕМОВА и др.
КОНФЛИКТ ИНТЕРЕСОВ
8. Ефремова И.Е., Серебрянникова А.В., Лапшина Л.В.,
Гуржий В.В., Рябинин А.Е. // ХГС. 2019. Т. 55.
Авторы заявляют об отсутствии конфликта
Вып. 9. С. 902; Efremova I.E., Serebryannikova A.V.,
интересов.
Lapshina L.V., Gurzhiy V.V., Ryabin A.E. // Chem.
Heterocyclic Compd. 2019. Vol. 55. N 9. P. 902. doi
СПИСОК ЛИТЕРАТУРЫ
10.1007/s10593-019-02556-9
1. Bianchi L., Giorgi G., Maccagno M., Petrillo G., Rocca V.,
9. Coms F. D., Dougherty D. A. // Tetrahedron Lett. 1988.
Sancassan F., Scapolla C., Severi E., Tavani C. // J.
Vol 29. N 31. P. 3753.
Org. Chem. 2007. Vol. 72. N 24. P. 9067. doi 10.1021/
10. Hogenkamp D. J., Greene F. D. // J. Org. Chem. 1993.
jo701460k
Vol 58. N 20. P. 5393. doi 10.1021/jo00072a021
2. Albertin G., Antoniutti S., Botter A., Castro J.,
11. Berestovitskaya V.M., Efremova I.E., Lapshina L.V.,
Giacomello M. // Organometallics. 2014. Vol. 33. P. 3570.
Serebryannikova A.V., Gurzhiy V.V., Abzianidze V.V. //
doi 10.1021/om500481d
Mendeleev Commun. 2015. N 25. P. 191. doi 10.1016/j.
3. Яцынич Е.А., Петров Д.В., Докичев В.А., Томи-
mencom.2015.05.010
лов Ю.В. // ЖОрХ. 2005. Т. 41. Вып. 8. С. 1210;
12. Ефремова И.Е., Серебрянникова А.В., Лапшина Л.В.,
Yatsynich E.A., Petrov D.V., Dokichev V.A., Tomi-
Гуржий В.В., Берестовицкая В.М. // ЖОХ. 2016. Т. 86.
lov Yu.V. // R. J. Org. Chem. 2005. Vol. 41. N 8. P. 1187.
Вып. 3. С. 481; Efremova I.E., Serebryannikova A.V.,
doi 10.1007/s11178-005-0313-9
Lapshina L.V., Gurzhiy V.V. Berestovitskaya V.M. //
4. Shafikova E. A., Petrov D. V., Dokichev V. A. // Chem.
Rus. J. Gen. Chem. 2016. Vol. 86. P. 622. doi 10.1134/
Heterocycl. Compd. 2007. Vol. 43. N 4. P. 434. doi
S1070363216030191
10.1007/s10593-007-0062-5
13. Берестовицкая В.М., Ефремова И.Е., Серебрянни-
5. Yusuf M., Jain P. // Arabian J. Chem. 2014. Vol.7. P. 553.
кова А.В., Лапшина Л.В., Гуржий В.В. // ХГС. 2018.
doi 10.1016/j.arabjc.2011.09.013
Т. 54. Вып. 1. С. 76; Berestovitskaya V.M., Efremo-
6. Мухамедова Л.А., Коноплев М.В., Махмутова С.Ф.,
va I.E., Serebryannikova A.V., Lapshina L.V., Gur-
Бузыкин Б.И., Хайруллин В.К. // ХГС. 1976. Вып. 10.
zhiy V.V. // Chem. Heterocycl. Compd. 2018. Vol. 54.
С. 1426; Mukhamedova L.A., Konoplev M.V.,
N 1. P. 76. doi 10.1007/s10593-018-2233-y
Makhmutova S.F., Buzykin B.I., Khairullin V.K. // Chem.
14. Ефремова И.Е., Серебрянникова А.В., Беляков А.В.,
Heterocycl. Compd. 1976. Vol. 12. N 10. P. 1182. doi
Лапшина Л.В. // ЖОХ. 2019. Т. 89. Вып. 3. С. 468;
10.1007/BF00945615
Efremova I.E., Serebryannikova A.V., Belyakov A.V.,
7. Mock W.L. // J. Am. Chem. Soc. 1970. Vol. 92. N 23.
Lapshina L.V. // Rus. J. Gen. Chem. 2019. Vol. 89. N 3.
P. 6918. doi 10.1021/ja00726a032
P. 536. doi 10.1134/S1070363219030277
Some Peculiarities of Oxidation of 1-Carbamoyl-Substituted
Hexahydro-1H-thieno[3,2-c]pyrazole-4,4-dioxides
I. E. Efremovaa,*, A. V. Serebryannikovab, L. V. Lapshinac, and I. I. Saveleva
a Herzen State Pedagogical University of Russia, St. Petersburg, 191186 Russia
b St. Petersburg State University, St. Petersburg, 199034 Russia
c Kirov Military Medical Academy, St. Petersburg, 194044 Russia
*e-mail: kohrgpu@yandex.ru
Received September 30, 2020; revised September 30; accepted October 14, 2020
New bicyclic derivatives of nitrosulfolane with condensed rings of pyrazoline-1 ─ 3-aryl-6a-methyl-6-nitro-
3a,5,6,6a-tetrahydro-3H-thieno[3,2-c]pyrazole-4,4-dioxides were obtained by oxidation of 3-aryl-1-carbam-
oyl-6a-methyl-6-nitrohexahydro-1H-thieno[3,2-c]pyrazole-4,4-dioxides. Structure of the obtained sulfola-
no-1-pyrazolines was established by IR, 1H NMR, 13C {1H}, 1H-13C HMQC, 1H-13C HMBC spectroscopy
methods.
Keywords: sulfolanes, pyrazolidines, pyrazolines, bicycles, oxidation
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 12 2020