ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 2, с. 167-172
УДК 547.514.72:541.62:544.18
3,3-СИГМАТРОПНЫЕ СДВИГИ
АЛЛИЛЬНОЙ ГРУППЫ ПО ПЕРИМЕТРУ
ЦИКЛОПЕНТАДИЕНОВОГО КОЛЬЦА
© 2020 г. Г. А. Душенкоa,*, И. Е. Михайловa,b, О. И. Михайловаa,
Р. М. Миняевa, В. И. Минкинa
a Научно-исследовательский институт физической и органической химии Южного федерального университета,
пр. Стачки 194/2, Ростов-на-Дону, 344090 Россия
b Федеральный исследовательский центр «Южный научный центр Российской академии наук»,
Ростов-на-Дону, 344006 Россия
*e-mail: dushenko@ipoc.sfedu.ru
Поступило в Редакцию 5 июля 2019 г.
После доработки 5 июля 2019 г.
Принято к печати 7 июля 2019 г.
Методом ЯМР исследованы обратимые невырожденные 3,3-сигматропные сдвиги аллильной группы
по периметру пятичленного кольца в аллильных производных 5-метил-1,2,3,4-тетраметоксикарбонилц
иклопентадиена (ΔG°≠ = 28.5-30.2 ккал/моль, o-дихлорбензол-d4). Методом DFT B3LYP/6-311++G(d,p)
показано, что вырожденные миграции аллильной группы в родственном 5-аллил-1,2,3,4,5-пентамето
ксикарбонилциклопентадиене должны происходить по механизму 3,3-сигматропных сдвигов через
переходные состояния с конформацией шестичленного кольца типа кресла или ванны с близкими
барьерами ΔG°≠ = 27.4 или 27.7 ккал/моль, соответственно. Рассчитанный более высокий барьер
альтернативных 1,5-сигматропных сдвигов аллильной группы (ΔG°≠ = 30.8 ккал/моль) указывает на
энергетическую предпочтительность ее миграций по пути 3,3-сдвигов.
Ключевые слова: перегруппировки Коупа, температурно-зависимые спектры ЯМР аллилцикло-
пентадиенов, квантово-химические расчеты
DOI: 10.31857/S0044460X20020018
Перегруппировки Коупа, связанные с необрати-
траметоксикарбонилциклопентадиена и изучение
мыми сдвигами аллильных групп, широко исполь-
протекающих в них ранее неизвестных обратимых
зуются в органическом синтезе, в частности, при
круговых перегруппировок Коупа представляют
получении природных соединений [1]. С другой
собой актуальную задачу.
стороны, структурно нежесткие циклопентадиены
Нами при взаимодействии таллиевой соли 5-ме-
вследствие обратимых миграций органических
тил-1,2,3,4-тетраметоксикарбонилциклопентадиена
и элементоорганических групп по периметру
с аллилбромидом в ацетонитриле были получены
пятичленного кольца могут рассматриваться как
аллильные производные 5-метил-1,2,3,4-тетра-
прототипы молекулярных роторных моторов [2-5],
метоксикарбонилциклопентадиена в виде смеси
а производные циклопентадиена с метоксикар-
изомеров 1-3 (схема 1). Изомеры 1-3 были препа-
бонильными заместителями используются при
ративно выделены в индивидуальном виде путем
получении широкого ряда металлокомплексов [6],
хроматографии и многократной кристаллизации.
стереоселективных катализаторов в органическом
Строение полученных соединений было доказано
синтезе [7, 8], комплексов с переносом заряда и
методами ЯМР 1H, 13С и ИК спектроскопии.
допантов в молекулярной электронике [9]. В связи
Спектр ЯМР 1H изомера 1 благодаря Cs-сим-
с этим, синтез аллильных производных метилте-
метрии существенно отличается от спектров
167
168
ДУШЕНКО и др.
Схема 1.
Me
CH2
CH
H2C
5
CO2Me
CO2Me
CH
Me
CH
2
5
4
1
Me
CO2Me
CO2Me
H2C
5
3
2
CH2
4
1
CO2Me
CO2Me
CO
Me
CO2Me
4
1
2
CH
3
2
CO
Me
CO2Me
2
3
2
CH2
CO2Me
CO2Me
1
2
3
изомеров 2 и 3. Выбор между структурами 2 и 3
очередь образуется изомер 2, а затем изомер 3.
удалось провести в результате анализа сигналов
Подобным образом, из изомера 3 в первую очередь
аллильного фрагмента. Из-за различия в хими-
образуется изомер 2, а затем изомер 1. Изучение
ческом окружении метиленовых протонов при
временной зависимости спектров ЯМР 1H изомеров
sp3-гибридизованном атоме углерода циклопен-
1-3 указывает на то, что их взаимопревращение
тадиенового (Cp) кольца в изомере 3 (в соседних
происходит путем обратимых невырожденных
положениях находятся группы CO2Me и Me)
3,3-сигматропных сдвигов аллильной группы (пе-
протоны CH2-группы обнаруживают диастерео-
регруппировок Коупа) по периметру пятичленного
топное расщепление (Δδ = 0.18 м. д., Jгем = 14.5 Гц,
кольца 1 →← 2 →← 3. При этом отсутствует концентра-
C6D6), а так как имеет место еще и спин-спиновое
ционная зависимость динамики спектров ЯМР 1H
взаимодействие с олефиновым протоном (3JHH =
соединений 1-3, что указывает на внутримолекуляр-
7.0 Гц), то они проявляются в виде двух квартетов,
ный характер данного процесса (схема 1).
т. е. имеют мультиплетность, равную 8. В изомере
Кинетические и активационные параметры
2 различие в химическом окружении CH2-группы
данных перегруппировок были определены путем
невелико (в соседних положениях находятся груп-
изучения временной зависимости спектров ЯМР
пы CO2Me и диастереотопное расщепление между
1H соединений 1-3 в о-дихлорбензоле-d4 в темпе-
протонами метиленовой группы не проявляется),
ратурном интервале 353-403 K: 1→2 ΔH≠ = 25.7±
поэтому ее протоны проявляются в виде дублета
0.6 ккал/моль, ΔS≠ = -9.5±0.8 э. е., ΔG°≠ =
(3.50 м. д., 3JHH = 7.0 Гц, C6D6) из-за спин-спи-
28.5 ккал/моль, k403 = 8.1×10-4 c-1; 2→1 ΔH≠ =
нового взаимодействия с олефиновым протоном
26.9±0.7 ккал/моль, ΔS≠ = -9.5±1.0 э. е., ΔG°≠ =
аллильного фрагмента.
29.7 ккал/моль, k403 = 1.8×10-4 c-1; 2→3 ΔH≠ =
Данные ЯМР 13С изомера 2 (C6D6) подтвержда-
27.9±0.6 ккал/моль, ΔS≠ = -7.8±0.9 э. е., ΔG°≠ =
ют правильность отнесения сигналов в спектрах
30.2 ккал/моль, k403 = 1.1×10-4 c-1; 3→2 ΔH≠ =
ЯМР 1H. В спектре монорезонанса 13С атом Сsp3
27.8±0.8 ккал/моль, ΔS≠ = -8.1±1.0 э. е., ΔG°≠ =
Cp-кольца (66.48 м. д.) проявляется в виде сложного
30.2 ккал/моль, k403 = 1.1×10-4 c-1.
мультиплета из-за спин-спинового взаимодействия
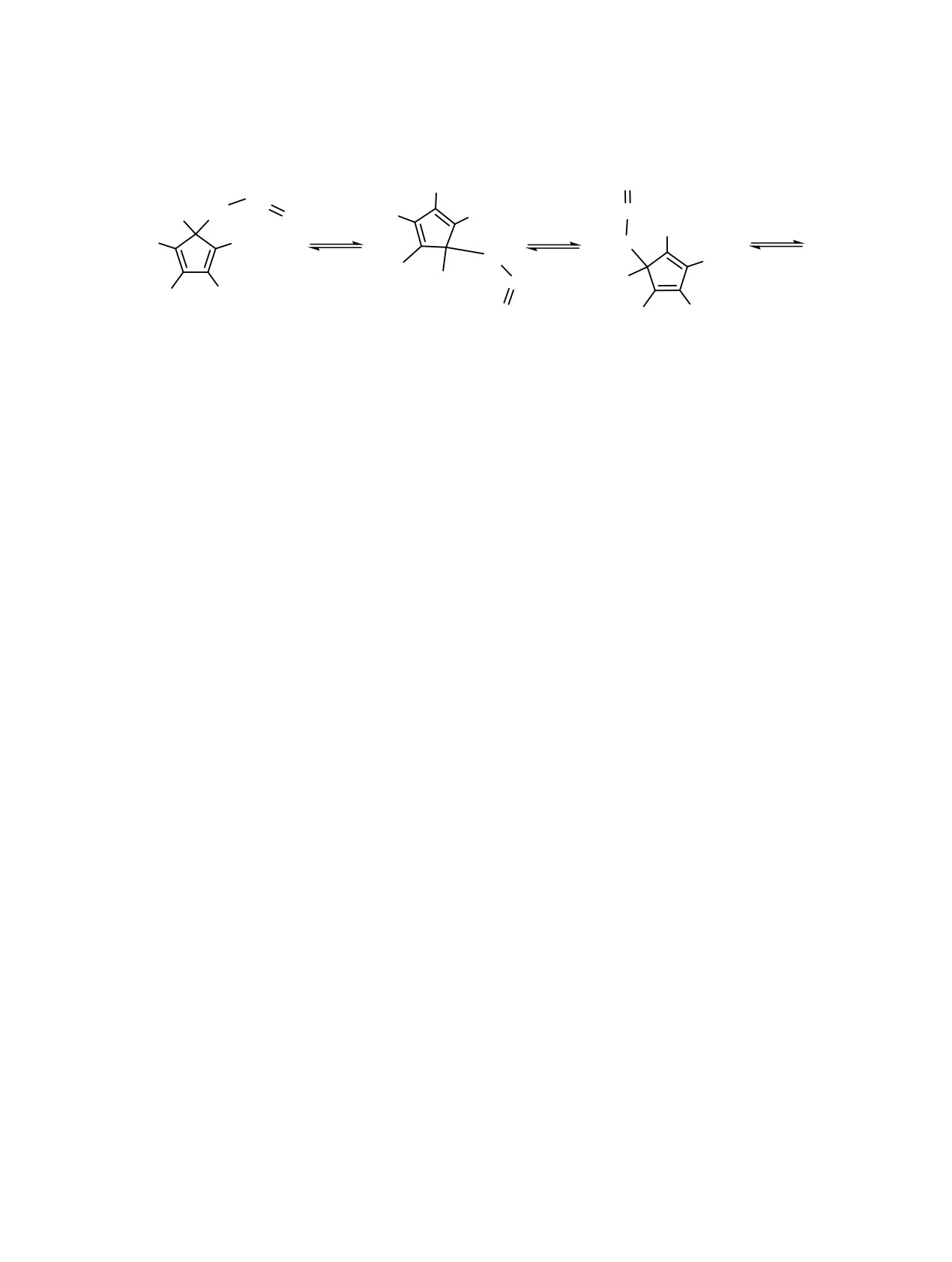
В полученном по ранее описанной методике [10]
с протонами метиленовой и олефиновой (=CH)
5-аллил-1,2,3,4,5-пентаметоксикарбонилциклопен-
групп. Селективное облучение CH2- и =CH-групп
позволяет наблюдать сигнал этого атома углерода
тадиене 4 нам не удалось зафиксировать методом
в виде дублета (3JСH = 3.5 Гц) и триплета (2JСH =
динамического ЯМР 1H вырожденные миграции
5.6 Гц). При этом КССВ с протонами метильной
аллильной группы при нагревании его растворов в
группы (4JСH), разделенными с атомом Сsp3 Cp-коль-
о-дихлорбензоле-d4 вплоть до 433 K.
ца четырьмя связями, не проявляется.
Для подтверждения механизма взаимопревра-
Выдерживание о-дихлорбензольных-d4 раство-
щений изомеров 1-3 и определения возможности
ров каждого из изомеров 1-3 при 353-403 K в тече-
вырожденных миграций аллильной группы в со-
ние 0.5-3 ч. приводит, по данным ЯМР 1H, к одной
единении 4, которые могут быть связаны с 1,5-,
и той же равновесной смеси с соотношением 1:2:3 =
1,3-, 3,3-сигматропными сдвигами по периметру
0.10:0.45:0.45. При нагревании изомера 1 в первую
пятичленного кольца или процессом диссоциаци-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
3,3-СИГМАТРОПНЫЕ СДВИГИ АЛЛИЛЬНОЙ ГРУППЫ
169
Схема 2.
MeO
O
O
1
O
MeO
5
2
OMe
H2C
CH2
O
*
H
C
CH
2
3
OMe
OMe
4
OMe
O
OMe
OMe
CH
MeO
H
C
1
2
O O
1
5
MeO
O
2
2
O
O
ɉɋ
O
5
*CH
2
4
3
O
O
MeO
MeO
O
4
3
CH
MeO
OMe
O
O
MeO
H
C
1
O
2
MeO
MeO
O
5
4-ɷɧɞɨ
2
OMe
4-ɷɧɞɨ'
CH CH2
*
3
CH2
4
OMe
MeO
O O
ɉɋ
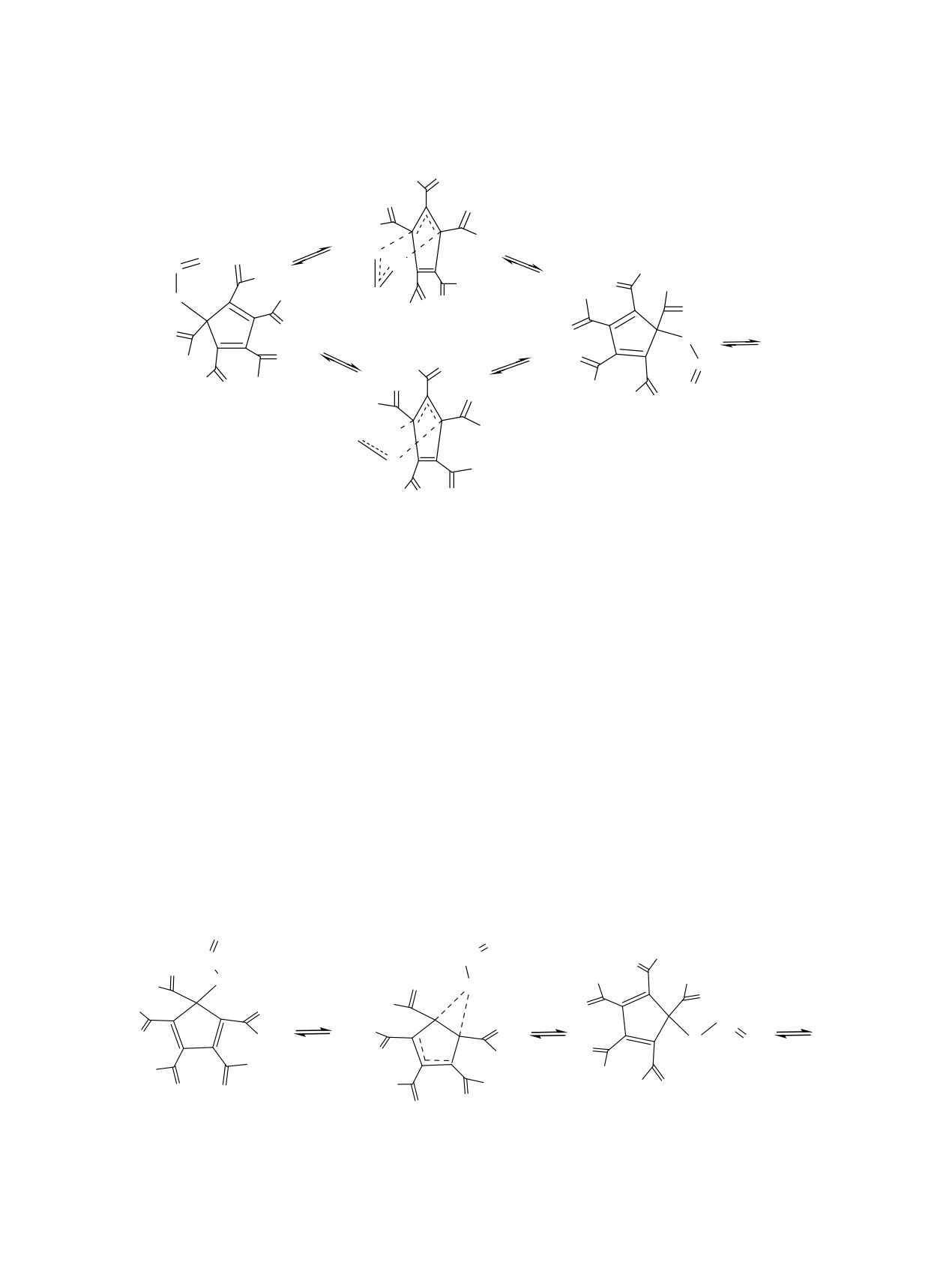
и-рекомбинации, нами при помощи метода DFT
ми энергетическими барьерами ΔG°≠ = 27.4 или
B3LYP/6-311++G(d,p) были проведены расчеты
27.7 ккал/моль соответственно (схема 2, см. таблицу).
соответствующих путей реакций в газовой фазе.
В менее устойчивом конформере 4-экзо, по
По данным расчетов, конформер 4-эндо с эндо-
данным расчетов, должны осуществляться 1,5-сиг-
расположением аллильной группы относительно
матропные сдвиги аллильной группы по периметру
кольца циклопентадиена устойчивее на ΔEZPE =
кольца циклопентадиена через переходное со-
3.4 ккал/моль, чем конформер 4-экзо (схемы 2, 3).
стояние ПС-3 с активационным барьером ΔG°≠ =
30.8 ккал/моль, который на 3.4 ккал/моль выше, чем
По данным расчетов, 3,3-сигматропные сдви-
барьер 3,3-сдвигов, что указывает на энергетиче-
ги аллильной группы по периметру кольца
скую предпочтительность пути перегруппировок
циклопентадиена в конформере 4-эндо могут
Коупа в соединении 4 (схема 3, см. таблицу).
осуществляться двумя путями: через переходные
состояния с конформацией шестичленного кольца
Структурам, отвечающим механизмам 1,3-сиг-
типа кресла (ПС-1) или ванны (ПС-2) с близки-
матропных сдвигов и диссоциации-рекомбинации
Схема 3.
*
CH2
*
CH
2
OMe
CH
CH
O
O
MeO
OMe
CH2
O
MeO
CH2
5
5
O
MeO
MeO
O
O
5
4
CH
4
1
MeO
O
1
*
O
3
OMe
C
CH2
3
4
1
O
O
H
2
OMe
2
2
OMe
3
MeO
2
MeO
MeO
OMe
MeO
O
O O
O O
4 ɷɤɡɨ
ɉɋ
4 ɷɧɞɨ'
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
170
ДУШЕНКО и др.
Полные и относительные энергии структур основного состояния 4-эндо и 4-экзо и переходных состояний ПС-1-
ПС-3 миграций аллильной группы, рассчитанные методом B3LYP/6-311++G(d,p) в газовой фазеа,б
Структура
Eполн, а. е.
ΔEZPE, ккал/моль
ΔG°, ккал/моль
ω1, см-1
4-эндо
-1450.59605
0
0
23
ПС-1
-1450.55156
26.5
27.4
-193
ПС-2
-1450.55086
26.8
27.7
-105
4-экзо
-1450.59078
3.4
3.9
17
ПС-3
-1450.53904
34.1
34.7
-277
a Eполн - полная энергия; ΔEZPE - относительная энергия с учетом энергии нулевых гармонических колебаний; ω1 - наименьшая
величина гармонической колебательной частоты или величина единственной мнимой гармонической колебательной частоты.
б EZPE = -1450.23036, G° = -1450.29621 а. е. (4-эндо).
для миграций аллильных групп в соединении 4, не
аллильной группы по периметру пятичленного
соответствуют локальные минимумы на поверхно-
кольца с энергетическими барьерами ΔG°≠ = 27.4-
сти потенциальной энергии, что свидетельствует о
30.2 ккал/моль.
низкой вероятности протекания перегруппировок
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
по данным путям.
Данные расчетов находятся в хорошем соответ-
ИК спектры снимали на спектрометре Varian
ствии с экспериментом для соединения 4, в котором
Excalibur 3100 FT-IR в вазелиновом масле. Спек-
в шкале времени динамического ЯМР не удалось
тры ЯМР 1Н (250.13 МГц) и 13С (62.90 МГц)
наблюдать круговые миграции аллильной группы,
регистрировали на приборе Bruker DPX-250.
и родственных соединений 1-3, барьеры 3,3-сиг-
Квантово-химические расчеты выполняли методом
матропных сдвигов аллильной группы в которых
DFT с трехпараметрическим потенциалом B3LYP
находятся в пределах ΔG°≠ = 28.5-30.2 ккал/моль.
в валентно-расщепленном базисе 6-311++G(d,p) в
Ранее было обнаружено, что высокотемпера-
газовой фазе с использованием программного паке-
турные сдвиги аллильной группы по циклопро-
та Gaussian-09. Идентификацию всех стационарных
точек осуществляли путем расчета матрицы Гессе.
пенильному кольцу в 1,2-дифенил-3-аллил-3-ме-
тилциклопропене происходят как двухстадийные
Аллильные производные 5-метил-1,2,3,4-те-
перегруппировки Коупа, включающие стабиль-
траметоксикарбонилциклопентадиена (1-3).
ные синглетные бирадикальные интермедиаты
К раствору 2.06 г (0.004 моль) таллиевой соли
[11]. В системе циклопентадиена, как нами было
5-метил-1,2,3,4-тетраметоксикарбонилциклопен-
показано ранее [2, 12-18], круговые миграции
тадиена [8] в 50 мл ацетонитрила при комнатной
алкильных, ацильных, нитро, O-, S-, Se-, Te- цен-
температуре и перемешивании прибавляли 0.4 мл
трированных групп и галогенов протекают по ме-
(0.005 моль) аллилбромида в 10 мл ацетонитрила.
ханизму 1,5-сигматропного сдвига, арилазогрупп -
После 3 ч перемешивания при комнатной темпе-
через образование тесных ионных пар, а изо(тио,
ратуре осадок TlBr отфильтровывали. Раствори-
селено)цианато-, амидинильных, ацилокси- и ди-
тель удаляли в вакууме, остаток (смесь изомеров
тиоацилоксигрупп - как гетеро-Коуповские пере-
1-3, 1.41 г, выход 86%) для выделения изомеров
группировки.
в индивидуальном виде хроматографировали на
Таким образом, методом ЯМР и DFT расчетами
силохроме (элюент - хлороформ-гексан, 1:1), отби-
рая фракции с Rf 0.80, 0.70 и 0.65. После удаления
показано, что в аллильных производных 5-ме-
элюента твердые остатки многократно перекристал-
тил-1,2,3,4-тетраметоксикарбонилциклопентадиена
и в 5-аллил-1,2,3,4,5-пентаметоксикарбонилцикло-
лизовывали из гексана.
пентадиене протекают обратимые невырожден-
5-Аллил-5-метил-1,2,3,4-тетраметокси-
ные и вырожденные 3,3-сигматропные сдвиги
карбонилциклопентадиен (1). Выход 0.17 г (12%),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
3,3-СИГМАТРОПНЫЕ СДВИГИ АЛЛИЛЬНОЙ ГРУППЫ
171
Rf 0.80, бесцветные кристаллы, т. пл. 104-105°С.
5-Аллил-1,2,3,4,5-пентаметоксикарбонилци-
ИК спектр (вазелиновое масло), ν, см-1: 1625
клопентадиен (4) получали аналогично взаимо-
(C=С); 1715, 1745, 1765 (C=O). Спектр ЯМР
действием таллиевой соли 1,2,3,4,5-пентаметокси-
1Н (C6D6), δ, м. д.: 1.45 c (3H, CH3), 3.30 c (6H,
карбонилциклопентадиена [8] с аллилбромидом.
CO2CH3), 3.35 c (6H, CO2CH3), 3.45 д (2H, CH2,
Выход 1.19 г (75%), бесцветные кристаллы, т. пл.
J = 7.0 Гц), 4.45 д (2H, CH2=, J = 5.0 Гц), 4.93-5.25
86-87°С (т. пл. 86.0-86.5°С [10]). Спектр ЯМР 1Н
м (1H, CH=). Спектр ЯМР 1Н (C6d4Cl2-1,2), δ, м. д.:
(C6d4Cl2-1,2), δ, м. д.: 3.44 c (3H, CO2CH3), 3.50 c
1.51 c (3H, CH3), 3.38 д (2H, CH2, J = 6.5 Гц), 3.46
(6H, CO2CH3), 3.64 c (6H, CO2CH3), 5.42 д (2H,
c (6H, CO2CH3), 3.50 c (6H, CO2CH3), 4.37 д (2H,
CH2=, J = 4.8 Гц), 4.72-5.04 м (1H, CH=), 3.25 д (2H,
CH2=, J = 6.3 Гц), 4.87-5.10 м (1H, CH=). Найдено,
CH2, J = 7.5 Гц).
%: С 57.80; Н 5.43. С17H20O8. Вычислено, %: С
ФОНДОВАЯ ПОДДЕРЖКА
57.95; Н 5.72.
5-Аллил-2-метил-1,3,4,5-тетраметоксикар-
Работа выполнена в рамках реализации проект-
бонилциклопентадиен (2). Выход 0.30 г (21%),
ной части госзадания Министерства образования и
науки России (проект № 4.844.2017/4.6) и в рамках
Rf 0.70, бесцветные кристаллы, т. пл. 94-95°С. ИК
спектр (вазелиновое масло), ν, см-1: 1630 (C=С);
Программы фундаментальных исследований Пре-
1720, 1745, 1770 (C=O). Спектр ЯМР 1Н (C6D6), δ,
зидиума РАН № 14 (направление «Теоретическое
и экспериментальное изучение природы хими-
м. д.: 2.27 c (3H, CH3), 3.24 c (3H, CO2CH3), 3.25
ческой связи и механизмов важнейших химиче-
c (3H, CO2CH3), 3.29 c (3H, CO2CH3), 3.39 c (3H,
ских реакций и процессов», № госрегистрации
CO2CH3), 3.50 д (2H, СH2, J = 7.0 Гц), 4.70-5.70 м
АААА-А18-118011290115-6, И.Е. Михайлов).
(1H, CH=), 4.90 д (2H, CH2=, J = 5.2 Гц). Спектр ЯМР
1Н (C6d4Cl2-1,2), δ, м. д.: 2.24 c (3H, CH3), 3.04 д (2H,
КОНФЛИКТ ИНТЕРЕСОВ
CH2, J = 5.5 Гц), 3.21 c (3H, CO2CH3), 3.33 c (3H,
CO2CH3), 3.35 c (3H, CO2CH3), 3.41 c (3H, CO2CH3),
Авторы заявляют об отсутствии конфликта
4.58-5.13 м (1H, CH=), 4.73 д (2H, CH2=, J =
интересов.
4.8 Гц). Спектр ЯМР 13C (C6D6), δC, м. д.: 13.62
СПИСОК ЛИТЕРАТУРЫ
(CH3), 36.32 (CH2), 51.11 (OCH3), 51.77 (OCH3),
51.92 (OCH3), 52.43 (OCH3), 66.48 (С), 118.01
1. Hiersemann M., Jaschinski T.
// Comprehensive
(=CH2), 131.15 (CH=), 138.15 (=C), 141.81 (=C),
Chirality. 2012. Vol. 2. P. 625. doi 10.1016/B978-0-08-
148.48 (=C), 152.33 (=C), 162.24 (C=O), 163.30 (C=O),
095167-6.00213-5
164.48 (C=O), 168.43 (C=O). Найдено, %: С 57.78;
2. Минкин В.И., Михайлов И.Е., Душенко Г.А.,
Жунке А. // Усп. хим. 2003. Т. 72. P. 978; Min-
Н 5.83. С17H20O8. Вычислено, %: С 57.95; Н 5.72.
kin V.I., Mikhailov I.E., Dushenko G.A., Zschunke A. //
5-Аллил-1-метил-2,3,4,5-тетраметокси-
Russ. Chem. Rev. 2003. Vol. 72. P. 867. doi 10.1070/
карбонилциклопентадиен (3). Выход 0.49 г (35%),
RC2003v072n10ABEH000848
Rf 0.65, бесцветные кристаллы, т. пл. 91-92°С. ИК
3. Gridnev I.D., Rosario M.K.C. // Organometallics. 2005.
спектр (вазелиновое масло), ν, см-1: 1625 (C=С);
Vol. 24. P. 4519. doi 10.1021/om050039i
1725, 1740, 1775 (C=O). Спектр ЯМР 1Н (C6D6) δ,
4. Bulo R.E., Allaart F., Ehlers A.W., de Kanter F.J.J.,
м. д.: 2.07 c (3H, CH3), 2.95-3.40 м (2H, CH2), 3.05
Schakel M., Lutz M., Spek A.L., Lammertsma K. // J.
Am. Chem. Soc. 2006. Vol. 128. P. 12169. doi 10.1021/
c (3H, CO2CH3), 3.15 c (3H, CO2CH3), 3.24 c (3H,
ja0627895
CO2CH3), 3.59 c (3H, CO2CH3), 4.70-5.20 м (1H,
5. Dushenko G.A., Mikhailov I.E., Mikhailova O.I.,
CH=), 4.80 к (2H, CH2=, J = 5.2 Гц). Спектр ЯМР 1Н
Minyaev R.M., Minkin V.I. // Mendeleev Commun. 2015.
(C6d4Cl2-1,2), δ, м. д.: 2.18 c (3H, CH3), 3.00-3.29 м
Vol. 25. N 1. P. 21. doi 10.1016/j.mencom.2015.01.007
(2H, CH2), 3.31 c (3H, CO2CH3), 3.42 c (3H, CO2CH3),
6. Bruce M.I., White A.H. // Australian J. Chem. 1990.
3.49 c (3H, CO2CH3), 3.66 c (3H, CO2CH3), 4.65-5.18
Vol. 43. N 6. P. 949. doi 10.1071/CH9900949
м (1H, CH=), 4.84 к (2H, CH2=, J = 5.8 Гц). Найде-
7. Gheewala C.D., Collins B.E., Lambert T.H. // Science.
но, %: С 58.03; Н 5.38. С17H20O8. Вычислено, %: С
2016. Vol. 351. N 6276. P. 961. doi 10.1126/science.
57.95; Н 5.72.
aad0591
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
172
ДУШЕНКО и др.
8. Gheewala C.D., Radtke M.A., Hui J., Hon A.B.,
15. Mikhailov I.E., Dushenko G.A., Kisin A.V., Mugge C.,
Lambert T.H. // Org. Lett. 2017. Vol. 19. P. 4227. doi
Zschunke A., Minkin V.I. // Mendeleev Commun.
10.1021/acs.orglett.7b01867
1994. Vol.
4. N
3. P.
85. doi
10.1070/
9. Jayanty S., Kumar D.B.K., Radhakrishnan T.P. //
MC1994v004n03ABEH000358
Synth. Met. 2000. Vol. 114. P. 37. doi 10.1016/S0379-
16. Душенко Г.А., Михайлов И.Е., Михайлова О.И., Ми-
6779(00)00204-6
няев Р.М., Минкин В.И. // Докл. АН. 2018. Т. 479.
10. Qiu C., Wu M., Zhou Z. // Chem. J. Chin. Univ. 1987.
№ 6. С. 634; Dushenko G.A., Mikhailov I.E., Mikhailo-
Vol. 8. N 8. P. 712.
va O.I., Minyaev R.M., Minkin V.I. // Doklady Chem.
11. Padwa A., Blacklock T.J. // J. Am. Chem. Soc. 1978.
2018. Vol.
479. N
2. P.
53. doi
10.1134/
Vol. 100. N 4. P. 1321. doi 10.1021/ja00472a064
S0012500818040067
12. Минкин В.И., Михайлов И.Е., Душенко Г.А., Саде-
17. Душенко Г.А., Михайлов И.Е., Михайлова О.И., Ми-
ков И.Д., Максименко А.А., Черныш Ю.Е. // Докл.
няев Р.М., Минкин В.И. // Изв. АН. Сер. хим. 2015.
АН. 1992. Т. 322. № 4. С. 706.
№ 9. С. 2043; Dushenko G.A., Mikhailov I.E.,
13. Михайлов И.Е., Минкин В.И., Кленкин А.А., Душен-
Mikhailova O.I., Minkin V.I., Minyaev R.M. // Russ.
ко Г.А., Компан О.Е., Стручков Ю.Т., Яновский А.И.,
Chem. Bull. 2015. Vol. 64. N 9. P. 2043. doi 10.1007/
Олехнович Л.П., Борисенко Н.И. // ЖОрХ. 1988.
Т. 24. Вып. 11. С. 2301.
s11172-015-1115-z
14. Mikhailov I.E., Kompan O.E., Dushenko G.A., Min-
18. Minkin V.I., Mikhailov I.E., Dushenko G.A. // J. Chem.
kin V.I. // Mendeleev Commun. 1991. Vol. 1. N 4.
Soc. Chem. Commun. 1988. N 17. P. 1181. doi 10.1039/
P. 121. doi 10.1070/MC1991v001n04ABEH000074
C39880001181
3,3-Sigmatropic Shifts of Allyl Group Along Cyclopentadiene
Ring Perimeter
G. A. Dushenkoa,*, I. E. Mikhailova,b, O. I. Mikhailovaa, R. M. Minyaeva, V. I. Minkina
a Institute of Physical and Organic Chemistry of Southern Federal University, Rostov-on-Don, 344090 Russia
b Federal Research Center Southern Scientific Center of the Russian Academy of Science,
Rostov-on-Don, 344006 Russia
*e-mail: dushenko@ipoc.sfedu.ru
Received July 5, 2019; revised July 5, 2019; accepted July 7, 2019
Reversible non-degenerate 3,3-sigmatropic shifts of the allyl group along the perimeter of the five-membered
ring occurring with energy barriers ΔG°≠ = 28.5-30.2 kcal/mol (o-dichlorobenzene-d4) were detected in the
allyl derivatives of 5-methyl-1,2,3,4-tetramethoxycarbonylcyclopentadiene by NMR method. Using DFT
B3LYP/6-311++G(d,p) method, it was shown that degenerate migrations of the allyl group in the related 5-al-
lyl-1,2,3,4,5-pentamethoxycarbonylcyclopentadiene should occur through a 3,3-sigmatropic shift mechanism
via transition states with conformation of a six-membered ring like a chair or a boat with close barriers ΔG°≠ =
27.4 or 27.7 kcal/mol, respectively. The calculated higher barrier of alternative 1,5-sigmatropic shifts of the
allyl group (ΔG°≠ = 30.8 kcal/mol) indicates the energy preference of its migrations along the path of 3,3-shifts.
Keywords: Cope rearrangements, temperature-dependent NMR spectra of allylcyclopentadienes, DFT calcu-
lations
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020