ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 2, с. 192-198
УДК 547.727
СИНТЕЗ НОВЫХ ПРОИЗВОДНЫХ 2-АМИНОПИРРОЛОВ
РЕАКЦИЕЙ 3-АЦИЛГИДРАЗОНОВ
2,3-ФУРАНДИОНОВ С CH-НУКЛЕОФИЛАМИ
© 2020 г. И. А. Кизимоваa,*, Н. М. Игидовa, М. А. Киселевa, М. В. Дмитриевb,
С. В. Чащинаa,b, А. И. Сюткинаa
a Пермская государственная фармацевтическая академия Министерства здравоохранения Российской Федерации,
ул. Екатерининская 10, Пермь, 614990, Россия
b Пермский государственный национальный исследовательский университет, Пермь, 614068 Россия
*e-mail: icekingakiratotsuka@gmail.com
Поступило в Редакцию 8 июля 2019 г.
После доработки 8 июля 2019 г.
Принято к печати 11 июля 2019 г.
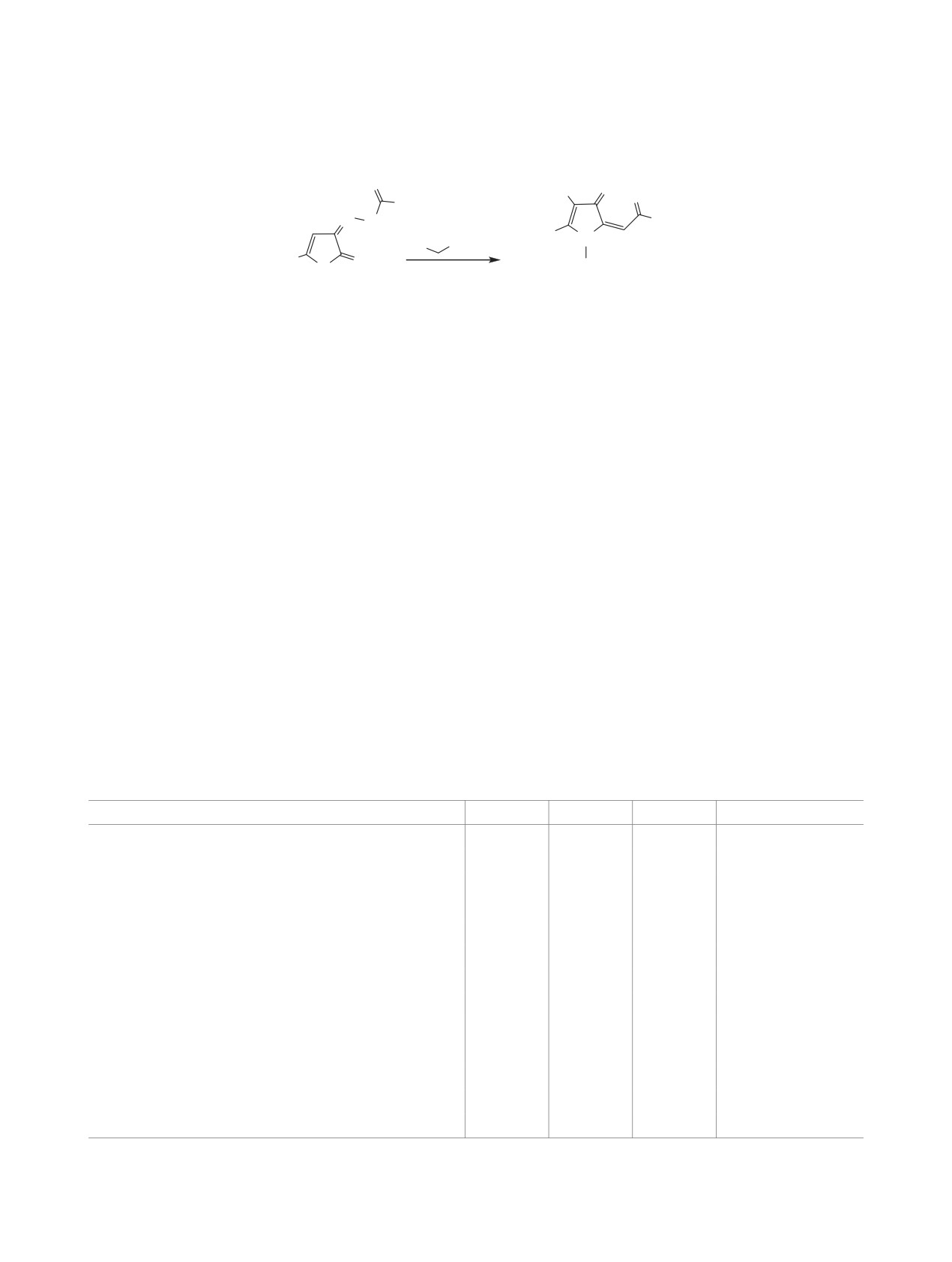
Рециклизацией ацилгидразонов 2,3-фурандионов под действием эфиров, амидов и нитрилов циануксус-
ных кислот получены соответствующие эфиры, амиды и нитрилы 2-амино-1-R-4-оксo-5-(2-оксо-2-арил/
трет-бутилэтилиден)-4,5-дигидро-1Н-пиррол-3-карбоновых кислот.
Ключевые слова: производные 2-амино-1-R-4-оксo-5-(2-оксо-2-арил/трет-бутилэтилиден)-4,5-диги-
дро-1Н-пиррол-3-карбоновых кислот, 3-ацилгидразоны 2,3-фурандионов, рециклизация
DOI: 10.31857/S0044460X20020031
Ранее было показано, что 5-арил-3-имино-3Н-
СН-нуклеофилами нами изучено их взаимодей-
фуран-2-оны и 4-ариламино-2-трет-бутил-5-ок-
ствие с этилцианоацетатом, амидами циануксус-
со-2,5-дигидрофуран-2-илацетаты вступают в
ной кислоты, динитрилом малоновой кислоты. При
реакции с производными циануксусной кислоты
нагревании эквимолярных количеств реагентов в
с образованием продуктов рециклизации - 2-ами-
абсолютном толуоле в присутствии триэтиламина
но-1-арил-4-оксо-5-(2-оксоэтилиден)-1H-4,5-ди-
в качестве основания образуются этиловые эфиры,
гидропиррол-3-карбоновых кислот
[1-6]. При
амиды и нитрилы 2-амино-1-R-4-оксo-5-(2-оксо-2-
взаимодействии
5-R-3-арилгидразоно-3Н-фуран-
арил/трет-бутилэтилиден)-4,5-дигидро-1Н-пир-
2-онов с малондинитрилом образуются иные
рол-3-карбоновых кислот 2а-т (схема 1).
продукты рециклизации - производные пиразо-
Полученные соединения 2а-т представляют
ла [3]. Литературные данные об участии 3-ацил-
собой бесцветные или окрашенные кристалличе-
гидразонов 2,3-фурандионов в реакциях с СН-
ские вещества, растворимые в диметилсульфокси-
нуклеофилами ограничиваются несколькими при-
де, диметилформамиде, трудно растворимые в эта-
мерами [7, 8]. Результаты исследований последних
ноле и нерастворимые в бензоле, воде и гексане.
лет показали, что производные 2-аминопирролов
ИК спектры синтезированных соединений
проявляют антирадикальную, антигипоксическую
характеризуются наличием полос поглощения
и противовоспалительную активность [4, 5, 8], а
валентных колебаний NH-групп в области 3204-
также обладают цитотоксичностью в отношении
3479 см-1, карбонильных групп в области 1699-
опухолевых клеток сарком мягких тканей, в том
1711 и 1658-1679 см-1, а также валентных колеба-
числе гастроинтестинальной стромальной опухо-
ний двойной связи С=С в области 1590-1628 см-1.
ли [4, 5, 7, 9].
В спектрах ЯМР 1H помимо сигналов замести-
С целью исследования химического поведения
телей в ароматическом кольце и сложноэфирной
3-ацилгидразонов 2,3-фурандионов в реакции с
группы регистрируются синглеты протонов NH-
192
СИНТЕЗ НОВЫХ ПРОИЗВОДНЫХ 2-АМИНОПИРРОЛОВ
193
Схема 1.
O
X O
O
R2
N
R1
NH
NH2
N
CN
X,
Et3N
R1
O O
R2
ɚ ɬ
R1 = t-Bu (2a, ɥ, ɨ, ɪ), Ph = ( ɛ, ɟ, ɦ, ɫ), 4-MeC6H4 ( ɠ, ɩ, ɬ), 4-EtC6H4 ( ɜ),
4-EtOC6H4 ( ɡ), 1-Napht ( ɝ, ɧ), 4-BrC6H4 ( ɢ), 4-FC6H4 ( ɞ), 4-ClC6H4 ( ɤ);
R2 = PhCONH (2a-ɞ, ɥ-ɧ, ɪ-ɬ), 2-PhNHPhCONH ( ɟ-ɤ, ɨ, ɧ); X = COOEt (2a-ɤ),
CONH2 ( ɥ-ɧ), 4-MeC6H4NHCO ( ɪ), CN ( ɫ, ɬ).
группы амидного фрагмента при 10.65-11.11 м. д.,
ной сингонии. Кристаллографически независимая
сигналы протонов аминогруппы при
9.07-
часть элементарной ячейки состоит из двух моле-
9.39 м. д., вторичной аминогруппы при 8.40-
кул с близкой геометрией, на рисунке изображена
8.80 м. д., мультиплетные сигналы ароматических
одна из них (нумерация атомов второй молекулы
протонов при 7.18-7.48 м. д. и синглет винильного
имеет дополнительный индекс A). Пиррольные
циклы в обеих независимых молекулах плоские
протона при 6.42-6.66 м. д.
в пределах 0.03-0.04 Å. Первичные аминогруп-
Для установления пространственной струк-
пы и карбамоильные заместители участвуют в
туры соединения 2о в кристаллическом состоянии
образовании внутримолекулярных водородных
были получены монокристаллы в результате
связей (см. таблицу), и, как следствие, лежат прак-
медленной кристаллизации из этанола для про-
тически в плоскостях гетероциклов, торсионные
ведения рентгеноструктурного анализа. Получен-
углы N1C5C2C3 5.5(3)°, N1AC5AC2AC3A 0.8(3)°.
ные результаты свидетельствуют о полном соответ-
Остальные заместители развернуты на значитель-
ствии предложенной структуры соединения
ные углы относительно пиррольных циклов. В
данным РСА (см. рисунок).
кристалле наблюдается развитая система внутри-
Соединение 2о кристаллизуется в центросим-
и межмолекулярных связей: каждая из групп NH
метричной пространственной группе моноклин-
и NH2 участвует в их образовании (см. таблицу).
Геометрия водородных связей в молекуле соединения 2о
D-H···A
D-H, Å
H···A, Å
D···A, Å
Угол D-H···A, град
N1-H1A···O1A
0.83(3)
2.24(3)
3.059(3)
169(2)
N1-H1B···O2
0.96(3)
2.08(3)
2.872(3)
138(2)
N2-H2A···O1[-x, y-1/2, -z+1/2]
0.98(3)
1.88(3)
2.846(3)
168(2)
N2-H2B···O1
0.86(2)
2.20(2)
2.852(3)
131(19)
N4-H4···O1A [x, y-1, z]
0.84(2)
2.08(2)
2.895(3)
163(2)
N5-H5···O4
0.82(3)
2.15(3)
2.768(3)
132(3)
N1A-H1AA···O2A
0.91(3)
2.11(3)
2.839(3)
137(2)
N1A-H1AB···O4 [-x, y+1/2, -z+1/2]
0.84(3)
2.36(3)
2.972(3)
130(2)
N2A-H2AA···O3 [x, y+1, z]
0.90(3)
2.10(3)
2.852(3)
141(2)
N2A-H2AA···O1A
0.90(3)
2.29(3)
2.899(3)
125(2)
N2A-H2AB···O2 [-x+1/2, -y+3/2, -z+1/2]
0.88(3)
2.02(3)
2.836(3)
153(2)
N4A-H4A···O3A
0.85(3)
2.11(3)
2.748(3)
132(3)
N5A-H5A···O4A
0.86(3)
1.96(3)
2.654(3)
138(3)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
194
КИЗИМОВА и др.
программы SHELXS [11] и уточнена полноматрич-
ным МНК по F2 в анизотропном приближении
для всех неводородных атомов с использованием
программы SHELXL [12] с графическим интер-
фейсом OLEX2 [13]. Атомы водорода, связанные
с гетероатомами, уточнены независимо в изотроп-
ном приближении. При уточнении остальных
атомов водорода использована модель наездника.
Окончательные параметры уточнения: R1 = 0.0675,
wR2 = 0.1354 [для 6077 отражений с I > 2σ(I)],
R1 = 0.1367, wR2 = 0.1684 (для всех 11187 независи-
мых отражений), S = 1.022. Результаты РСА заре-
гистрированы в Кембриджском центре кристалло-
графических данных под номером CCDC 1937434.
Общий вид молекулы соединения 2о в кристалле.
Общая методика получения производных
За счет межмолекулярных связей молекулы в кри-
2-амино-1-R-4-оксo-5-(2-оксо-2-арил/трет-
сталле связаны в параллельную плоскости (001)
бутилэтилиден)-4,5-дигидро-1Н-пиррол-3-кар-
двумерную сеть, состоящую из двух слоев молекул.
боновых кислот (2а-т). К раствору 0.001 моль
Таким образом, реакция рециклизации 3-ацил-
соответствующего 3-ацилгидразона 2,3-дигидро-
гидразонов 2,3-фурандионов с СН-нуклеофилами
2,3-фурандиона в 20 мл безводного толуола добав-
открывает широкие возможности в синтезе
ляли эквивалентное количество этилового эфи-
новых потенциально биологически активных
ра или амида циануксусной кислоты, динитрила
производных 2-аминопиррола.
малоновой кислоты и эквивалентное количество
триэтиламина. Полученную смесь нагревали в те-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
чение 30-40 мин, затем охлаждали до 0°C. Осадок
отфильтровывали и перекристализовывали.
ИК спектры записаны на приборе ФСМ-1201
в вазелиновом масле. Спектры ЯМР 1Н (400 и
Этил-(E)-2-амино-1-бензамидо-5-(3,3-
100 МГц) зарегистрированы на приборе
диметил-2-оксобутилиден)-4-оксо-4,5-дигидро-
BrukerAvance III в ДМСО-d6. Контроль за чисто-
1H-пиррол-3-карбоксилат
(2а). Выход
1.2 г
той соединений и протеканием реакций осущест-
(63%), желтые кристаллы, т. пл.
262-263°C
вляли методом ТСХ на пластинах Sorbfil ПТСХ
(AcOH). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 0.95 с
П-А-УФ-254 в системе диэтиловый эфир-бензол-
(9Н, 3Ме), 1.25 т (3Н, Ме, J = 7.4 Гц ), 4.14 к (2Н,
ацетон (10:9:1), детектирование проводили парами
СН2, J = 7.4 Гц), 6.22 с (1Н, СН), 7.55 м (5Н, НAr),
иода. Температуры плавления определяли на при-
8.29 с (1Н, NH), 9.04 с (1Н, NH), 10.75 с (1Н, NH).
боре SMP40. Элементный анализ проводили на
Найдено, %: C 62.33; H 6.02; N 10.90. C20H23N3O5.
приборе Leco CHNS-932.
Вычислено, %: C 62.34; H 6.03; N 10.92.
Рентгеноструктурный анализ. Рентгено-
Этил-(E)-2-амино-1-бензамидо-4-оксо-5-
(2-оксо-2-фенилэтилиден)-4,5-дигидро-1H-
структурный анализ выполнен на монокри-
стальном дифрактометре Xcalibur Ruby с ССD-
пиррол-3-карбоксилат (2б). Выход 1.43 г (71%),
детектором по стандартной методике
[MoKα-
желтые кристаллы, т. пл.
258-259°C (AcOH).
излучение, 295(2) K, ω-сканирование с шагом 1°].
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 1.23 т (3Н,
Поглощение учтено эмпирически с использовани-
Ме, J = 7.4 Гц), 4.15 к (2Н, СН2, J = 7.4 Гц), 6.58 с
(1Н, СН), 7.46 м (10Н, НAr), 8.40 с (1Н, NH), 9.10 с
ем алгоритма SCALE3 ABSPACK [10]. Сингония
(1Н, NH), 10.93 с (1Н, NH). Найдено, %: C 65.18; H
кристалла (C24H25N5O4, M 447.49) моноклинная,
4.72; N 10.37. C22H19N3O5. Вычислено, %: C 65.17;
пространственная группа I2/a, a = 24.782(5) Å,
H 4.73; N 10.35.
b = 10.4247(16) Å, c = 38.542(10) Å, β = 107.98(2)°,
V = 9471(4) Å3, Z = 16, dвыч = 1.255 г/см3, μ =
Этил-(E)-2-амино-1-бензамидо-5-[2-(4-этил-
0.088 мм-1. Структура расшифрована с помощью
фенил)-2-оксоэтилиден]-4-оксо-4,5-дигидро-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
СИНТЕЗ НОВЫХ ПРОИЗВОДНЫХ 2-АМИНОПИРРОЛОВ
195
1H-пиррол-3-карбоксилат (2в). Выход 1.23 г
4.21 к (2Н, СН2, J = 7.0 Гц), 6.66 с (1Н, СН), 7.22
(57%), желтые кристаллы, т. пл.
248-250°C
м (9Н, НAr), 8.44 с (1Н, NH), 9.12 с (1Н, NH), 9.18
(AcOH). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 1.18
уш. с (1Н, NH), 10.94 уш. с (1Н, NH). Спектр
т (3Н, Ме, J = 7.5 Гц), 1.29 т (3Н, СН2, J = 6.9 Гц),
ЯМР 13С (ДМСО-d6), δС, м. д.: 14.47, 21.07, 58.48,
2.65 к (2Н, СН2, J = 7.5 Гц), 4.21 к (2Н, СН2, J =
84.89, 102.52, 114.02, 117.1, 120.22, 122.21, 128.22,
6.9 Гц), 6.63 с (1Н, СН), 7.48 м (9Н, НAr), 8.32 с (1Н,
129.03, 129.18, 129.93, 132.91, 134.68, 140.66,
NH), 9.07 с (1Н, NH), 10.82 с (1Н, NH). Найдено, %:
140.99, 143.67, 145.35, 163.66, 167.21, 167.48,
C 66.50; H 5.35; N 9.69. C24H23N3O5. Вычислено,
174.11, 189.72. Найдено, %: C 68.22; H 5.13; N
%: C 66.52; H 5.36; N 9.68.
10.97. C29H26N4O5. Вычислено, %: C 68.23; H 5.14;
N 10.98.
Этил-(E)-2-амино-1-бензамидо-5-[2-(нафт-
1-ил)-2-оксоэтилиден]-4-оксо-4,5-дигидро-1H-
Этил-(E)-2-амино-5-[2-(4-этоксифенил)-
пиррол-3-карбоксилат (2г). Выход 1.58 г (70%),
2-оксоэтилиден]-4-оксо-1-[2-(фениламино)-
желтые кристаллы, т. пл.
210-212°C (AcOH).
бензамидо]-4,5-дигидро-1H-пиррол-3-кар-
боксилат
(2з). Выход
1.25 г
(52%), желтые
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 1.24 т (3Н,
кристаллы, т. пл. 238-240°C (этанол). Спектр ЯМР
Ме, J = 7.4 Гц), 4.15 к (2Н, СН2, J = 7.4 Гц), 6.48 с
1Н (ДМСО-d6), δ, м. д.: 1.25 т (3Н, Ме, J =
(1Н, СН), 7.75 м (12Н, НAr), 8.47 с (1Н, NH), 9.21 с
6.3 Гц), 1.29 т (3Н, Ме, J = 6.1 Гц), 3.99 к (2Н,
(1Н, NH), 11.07 с (1Н, NH).Найдено, %: C 68.56; H
СН2, J = 6.9 Гц), 4.19 к (2Н, СН2, J = 7.0 Гц), 6.61 с
4.65; N 9.23. C26H21N3O5. Вычислено, %: C 68.54;
(1Н, СН), 7.18 м (9Н, НAr), 8.35 уш. с (1Н, NH),
H 4.67; N 9.24.
9.1 уш. с (2Н, 2NH), 10.65 уш. с (1Н, NH). Масс-
Этил-(E)-2-амино-1-бензамидо-5-[2-(4-фтор-
спектр, m/z (Iотн, %): 540 (100.0) [M]+, 495 (5.6) [M -
фенил)-2-оксоэтилиден]-4-оксо-4,5-дигидро-
OC2H5]+, 391 (21.5) [M - 4-EtOС6Н4CO]+, 196
1H-пиррол-3-карбоксилат
(2д). Выход
1.14 г
(30.0) [2PhNHС6Н4CO)]+. Найдено, %: C 66.66; H
(54%), желтые кристаллы, т. пл.
252-254°C
5.22; N 10.36. C30H28N4O6. Вычислено, %: C 66.67;
(AcOH). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 1.23
H 5.23; N 10.35.
т (3Н, Ме, J = 6.5 Гц), 4.12 к (2Н, СН2, J = 6.5 Гц),
Этил-(E)-2-амино-5-[2-(4-бромфенил)-2-
6.58 с (1Н, СН), 7.37 м (9Н, НAr), 8.46 с (1Н, NH),
оксоэтилиден]-4-оксо-1-[2-(фениламино)бенз-
9.22 с (1Н, NH), 10.98 с (1Н, NH). Найдено, %: C
амидо]-4,5-дигидро-1H-пиррол-3-карбоксилат
62.41; H 4.29; N 9.92. C22H18FN3O5. Вычислено, %:
(2и). Выход 1.3 г (51%), желтые кристаллы, т. пл.
C 62.44; H 4.28; N 9.93.
235-237°C (этанол). ИК спектр, ν, см-1: 3227 ш,
Этил-(E)-2-амино-4-оксо-5-(2-оксо-2-фенил-
1774, 1659, 1657. Спектр ЯМР 1Н (ДМСО-d6), δ,
этилиден)-1-[2-(фениламино)бензамидо]-4,5-
м. д.: 1.27 т (3Н, Me, J = 7.1 Гц), 4.21 к (2Н, СН2,
дигидро-1H-пиррол-3-карбоксилат (2е). Выход
J = 7.0 Гц), 6.63 с (1Н, СН), 7.29 м (9Н, HAr), 8.49 уш. с
1.6 г (73%), желтые кристаллы, т. пл. 220-222°C
(1Н, NH), 9.12 с (2Н, 2NH), 9.23 уш. с (1Н, NH),
(этанол). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 1.27
10.98 уш. с (1Н, NH). Спектр ЯМР 13С (ДМСО-d6),
т (3Н, Ме, J = 7.0 Гц), 4.21 к (2Н, СН2, J = 6.8 Гц),
δС, м. д.: 14.54, 58.57, 84.92, 101.99, 113.95, 114.15,
6.66 с (1Н, СН), 7.25 м (9Н, НAr), 8.44 уш. с (1Н,
117.18,
120.32,
122.38,
127.46,
129.25,
130.06,
NH), 9.11 с (1Н, NH), 9.18 уш. с (1Н, NH), 10.94
131.61, 133.05, 136.05, 140.66, 141.39, 145.48,
уш. с (1Н, NH). Найдено, %: C 67.73; H 4.87; N
163.68, 167.29, 167.67, 174.03, 189.44. Найдено, %:
11.28. C28H24N4O5. Вычислено, %: C 67.74; H 4.86;
C 58.45; H 4.03; N 9.74. C28H23BrN4O5. Вычислено,
N 11.27.
%: C 58.46; H 4.05; N 9.73.
Этил-(E)-2-амино-4-оксо-5-[2-оксо-2-(4-
Этил-(E)-2-амино-5-[2-(4-хлорфенил)-2-
метилфенилэтилиден)-1-(2-(фениламино)бенз-
оксоэтилиден]-4-оксо-1-[2-(фениламино)бенз-
амидо]-4,5-дигидро-1H-пиррол-3-карбоксилат
амидо]-4,5-дигидро-1H-пиррол-3-карбоксилат
(2ж). Выход 1.3 г (58%), желтые кристаллы, т. пл.
(2к). Выход
1.37 г
(58%), светло-оранжевые
260-262°C (этанол). ИК спектр, ν, см-1: 3354, 3274,
кристаллы, т. пл. 235-237°C (этанол). ИК спектр,
1750, 1689, 1612. Спектр ЯМР 1Н (ДМСО-d6), δ,
ν, см-1: 3238, 1753, 1656, 1594. Спектр ЯМР 1Н
м. д.: 1.27 т (3Н, Ме, J = 7.0 Гц), 2.28 с (3Н, Ме),
(ДМСО-d6), δ, м. д.: 1.26 т (3Н, Me, J = 7.1 Гц), 4.19 к
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
196
КИЗИМОВА и др.
(2Н, СН2, J = 7.0 Гц), 6.65 с (1Н, СН), 7.29 м (9Н,
дигидро-1H-пиррол-3-карбоксамид (2о) . Выход
HAr), 8.47 уш. с (1Н, NH), 9.14 с (2Н, 2NH), 9.21 уш. с
1.2 г (50%), белые кристаллы, т. пл. 265-267°C
(1Н, NH), 10.96 уш. с (1Н, NH). Найдено, %: C
(этанол). ИК спектр, ν, см-1: 3450, 3310, 1685,
63.34; H 4.37; N 10.55. C28H23ClN4O5. Вычислено,
1647, 1598. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
%: C 63.35; H 4.38; N 10.56.
1.14 с (9Н, 3 Me), 6.39 с (1Н, СН), 6.46 с (1Н, СН),
2-Амино-1-бензамидо-5-(3,3-диметил-2-
7.37 м (9Н, HAr), 7.11 с (1Н, NH), 7.13 с (1Н, NH),
оксобутилиден)-4-оксо-4,5-дигидро-1H-пиррол-
7.77 с (1Н, NH), 7.79 с (1Н, NH), 7.92 с (1Н, NH),
3-карбоксамид (2л). Выход 0.92 г (52%), желтые
7.94 с (1Н, NH). Масс-спектр, m/z (Iотн, %): 447
кристаллы, т. пл. 230-231°C (AcOH). ИК спектр,
(100.0)
[M]+, 196 (74.0) [2PhNHC6H4CO)]+, 168
ν, см-1: 3408, 3318, 3204, 1679, 1648, 1591. Спектр
(5.5) [2PhNHC6H4)]+. Найдено, %: C 64.42; H 5.63;
ЯМР 1Н (ДМСО-d6), δ, м. д.: 1.02 с (9Н, 3 Me),
N 15.65. C24H25N5O4. Вычислено, %: C 64.43; H
6.42 с (1Н, СН), 7.01 уш. с (1Н, NH), 7.34 уш. с
5.62; N 15.66.
(1Н, NH), 7.65 м (5Н, HAr), 8.70 уш. с (1Н, NH),
2-Амино-4-оксо-5-(2-оксо-2-метил-
9.15 с (1Н, NH), 10.86 с (1Н, NH). Спектр ЯМР 13С
фенилэтилиден)-1-[2-(фениламино)бензамидо]-
(ДМСО-d6), δС, м. д.: 25.98, 87.47, 101.80, 128.02,
4,5-дигидро-1H-пиррол-3-карбоксамид
(2п).
128.05, 131.16, 132.08, 141.20, 164.90, 165.52,
Выход 1.06 г (50%), желтые кристаллы, т. пл. 238-
167.01, 179.99, 204.57. Масс-спектр, m/z (Iотн, %):
240°C (этанол). ИК спектр, ν, см-1: 3479, 3344, 1666,
356 (74.7) [M]+, 300 (19.2) [M - 2CO]+, 299 (38.9)
1601. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 2.24 с
[М - t-BuCO]+, 282 (23.7) [M - 2CO - H2O]+, 105
(3Н, Me), 6.70 с (1Н, СН), 7.27 м (9Н, HAr), 8.69
(100.0) [PhСО]+, 77 (20.9) [Ph]+. Найдено, %: C
уш. с (1Н, NH), 9.11 уш. с (2Н, 2NH), 10.70 уш. с
60.66; H 5.66; N 15.72. C18H20N4O4. Вычислено, %:
(1Н, NH). Найдено, %: C 67.35; H 4.81; N 14.54.
C 60.65; H 5.64; N 15.73.
C27H23N5O4. Вычислено, %: C 67.36; H 4.82; N
2-Амино-1-бензамидо-4-оксо-5-(2-оксо-2-
14.56.
фенилэтилиден)-4,5-дигидро-1H-пиррол-3-
2-Амино-1-бензамидо-5-(3,3-диметил-2-оксо-
карбоксамид (2м). Выход 1.1 г (59%), желтые
бутилиден)-4-оксо-1-N-(п-толил)-4,5-дигидро-
кристаллы, т. пл. 235-237°C (AcOH). ИК спектр,
1H-пиррол-3-карбоксамид (2р). Выход 1.72 г
ν, см-1: 3441, 3398, 3290, 1699, 1666, 1619. Спектр
(77%), желтые кристаллы, т. пл. 178-180°C (AcOH).
ЯМР 1Н (ДМСО-d6), δ, м. д.: 6.75 с (1Н, СН), 7.12 с
Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 0.98 с (9Н,
(1Н, NH), 7.65 м (11Н, Ar + NH), 8.73 с (1Н, NH),
3Me), 2.28 с (3Н, Me), 6.51 с (1Н, СН), 7.14 д (2Н,
9.26 с (1Н, NH), 11.04 с (1Н, NH). Найдено, %: C
HAr, J = 8.1 Гц ), 7.50 д (2Н, HAr, J = 8.1 Гц ), 7.57 м
63.83; H 4.29; N 14.89. C20H16N4O4. Вычислено, %:
(3Н, HAr), 7.94 д (2Н, HAr, J = 7.5 Гц), 8.77 уш. с (1Н,
C 63.84; H 4.28; N 14.87.
NH), 9.39 с (1Н, NH), 9.99 с (1Н, NH), 10.94 с (1Н,
2-Амино-1-бензамидо-5-(2-(нафталин-1-
NH). Спектр ЯМР 13С (ДМСО-d6), δС, м. д.: 20.29,
ил)-2-оксоэтилиден)-4-оксо-4,5-дигидро-1H-
25.96, 87.90, 102.55, 118.95, 128.02, 128.10, 128.78,
пиррол-3-карбоксамид (2н). Выход 1.28 г (60%),
129.23,
131.13,
131.82,
132.11,
136.08,
140.73,
желтые кристаллы, т. пл. 260-262°C (AcOH). ИК
161.90, 164.94, 166.51, 176.16, 204.48. Найдено, %:
спектр, ν, см-1: 3406, 3337, 3206, 1701, 1679, 1628.
C 67.25; H 5.87; N 12.55. C25H26N4O4. Вычислено,
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 6.69 с (1Н,
%: C 67.26; H 5.88; N 12.56.
СН), 7.06 с (1Н, NH), 7.70 м (13Н, HAr), 8.80 уш. с
(1Н, NH), 9.25 уш. с (1Н, NH), 11.11 с (1Н, NH),
N-[5-Амино-4-циано-3-оксо-2-(2-око-2-
11.86 уш. с (1Н, NH). Спектр ЯМР 13С (ДМСО-d6),
фенилэтилиден)-2,3-дигидро-1Н-пиррол-1-ил]-
δС, м. д.: 20.90, 87.64, 105.46, 124.71, 125.01, 126.27,
бензамид (2с). Выход 0.89 г (50%), бесцветные
127.59, 127.90, 128.38, 129.27, 129.85, 130.95,
кристаллы, т. пл. 261-263°C (AcOH). Спектр ЯМР
131.89, 132.96, 133.26, 134.99, 141.26, 165.30,
1Н (ДМСО-d6), δ, м. д.: 6.75 с (1Н, СН), 7.57 м
165.54, 166.96, 171.82, 176.00, 192.63. Найдено, %:
(10Н, Ar), 9.12 уш. с (1Н, NH), 9.49 уш. с (1Н, NH),
C 67.60; H 4.25; N 13.14. C24H18N4O4. Вычислено,
11.04 с (1Н, NH). Спектр ЯМР 13С (ДМСО-d6), δС,
%: C 67.62; H 4.26; N 13.15.
м. д.: 66.28, 103.81, 113.83, 127.86, 127.90, 128.27,
2-Амино-5-(3,3-диметил-2-оксобутилиден)-
128.55, 130.95, 132.00, 133.39, 136.82, 140.18,
4-оксо-1-[2-(фениламино)бензамидо]-4,5-
165.30, 165.97, 176.42, 189.92. Найдено,
%: C
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
СИНТЕЗ НОВЫХ ПРОИЗВОДНЫХ 2-АМИНОПИРРОЛОВ
197
67.03; H 3.94; N 15.63. C20H14N4O3. Вычислено, %:
Захматов А.В., Галембикова А.Р., Рамазанов Б.Р.
C 67.04; H 3.95; N 15.64.
А. с. 2605091 (2016) // Б. И. 2016. № 34.
N-{5-Амино-4-циано-3-оксо-2-[2-оксо-2-(п-
5. Игидов Н.М., Зыкова С.С., Киселев М.А. А. с.
толилэтилиден)-2,3-дигидро-1Н-пиррол-1-ил]}-
2607920 (2017) // Б. И. 2017. № 2.
бензамид (2т). Выход 0.95 г (60%), бесцветные
6. Зыкова С.С., Игидов Н.М., Захматов А.В., Кисе-
кристаллы, т. пл. 258-260°C (AcOH). Спектр ЯМР
лев М.А., Галембикова А.Р., Хуснутдинов Р.Р., Ро-
1Н (ДМСО-d6), δ, м. д.: 2.32 с (1Н, Me), 6.72 с (1Н,
дин, И.А. // Хим.-фарм. ж. 2018. Т. 52. № 3. С. 10;
СН), 7.22 д (2Н, HAr, J = 7.9 Гц), 7.42 м (2Н, HAr),
Zykova S.S., Igidov N.M., Zakhmatov A.V., Kiselev M.A.,
7.54 м (1Н, HAr), 7.63 д (2Н, HAr, J = 8.2 Гц), 7.67 д
Galembikova A.R., Khusnutdinov R.R., Rodin I.A. //
(2Н, HAr, J = 7.9 Гц), 9.08 уш. с (1Н, NH), 9.48 уш. с
Pharm. Chem. J. 2018. Vol. 52. N 3. P. 198. doi 10.1007/
(1Н, NH), 11.05 с (1Н, NH). Спектр ЯМР 13С
s11094-018-1790-9
(ДМСО-d6), δС, м. д.: 21.07, 66.23, 104.09, 113.90,
7. Зыкова C. С., Галембикова А.Р., Рамазанов Б.Р., Оде-
127.83, 127.90, 128.89, 128.44, 129.10, 130.90, 131.99,
гова Т.Ф., Игидов Н.М., Киселев М.А., Бойчук С.В. //
134.34, 139.91, 143.99, 165.24, 165.88, 176.45, 189.49.
Хим.-фарм. ж. 2015. Т. 49. № 12. С. 19; Zykova S.S.,
Найдено, %: C 67.73; H 4.33; N 15.05. C21H16N4O3.
Galembikova A.R., Ramazanov B.R., Odegova T.F.,
Вычислено, %: C 67.72; H 4.34; N 15.06.
Igidov N.M., Kiselev M.A., Boichuk S.V. // Pharm.
КОНФЛИКТ ИНТЕРЕСОВ
Chem. J. 2016. Vol. 49. N 12. P. 817. doi 10.1007/
s11094-016-1378-1
Авторы заявляют об отсутствии конфликта
8. Зыкова C.С., Даровских А.А., Одегова Т.Ф., Кисе-
интересов.
лев М.А., Игидов Н.М. // Хим.-фарм. ж. 2015. Т. 49.
СПИСОК ЛИТЕРАТУРЫ
№ 10. С. 15; Zykova S.S., Darovskikh A.A., Odegova T.F.,
Kiselev M.A., Igidov N.M. // Pharm. Chem. J. 2016.
1. Рубцов А.Е., Алиев З.Г., Майорова О.А. // ЖОрХ.
Vol. 49. N 10. P. 657. doi 10.1007/s11094-016-1347-8
2010. Т. 46. № 6. С. 932; Rubtsov A.E., Aliev Z.G.,
9. Зыкова С.С., Игидов Н.М., Киселев М.А., Бойчук С.В.,
Maiorova O.A. // Russ. J. Org. Chem. 2010. N 6. Р.933.
Галембикова А.Р., Загулова Д.В. // Здоровье и образо-
doi 10.1134/s107042801006028x
вание в XXI веке. 2016. Т. 18. № 7. С. 121.
2. Харитонова С.C., Игидов Н.М., Захматов А.В.,
10. CrysAlisPro, Agilent Technologies, Version 1.171.37.33
Рубцов А.Е. // ЖОрХ. 2013. Т. 49. № 2. С. 252;
(release 27-03-2014 CrysAlis171 .NET).
Kharitonova S.S., Igidov N.M., Zakhmatov A.V., Rubtsov
A.E. // Russ. J. Org. Chem. 2013. Vol. 49. N 2. P. 243.
11. Sheldrick G.M. // Acta Crystallogr. (A). 2008. Vol. 64.
doi 10.1134/s1070428013020115
P. 112. doi 10.1107/S0108767307043930
3. Игидов Н.М., Захматов А.В., Рубцов А.Е. // ЖОрХ.
12. Sheldrick G.M. // ActaCrystallogr. (C). 2015. Vol. 71.
2016. Т. 52. № 7. С. 981; Igidov N.M., Zakhmatov A.V.,
P. 3. doi 10.1107/S2053229614024218
Rubtsov A.E. // Russ. J. Org. Chem. 2016. Vol. 52. N 7.
13. Dolomanov O.V., Bourhis L.J., Gildea R.J, Ho-
P. 974. doi 10.1134/s1070428016070083
ward J.A.K., Puschmann H. J. // Appl. Cryst. 2009.
4. Зыкова С.С., Бойчук С.В., Игидов Н.М., Одегова Т.Ф.,
Vol. 42. P. 339. doi 10.1107/S0021889808042726
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
198
КИЗИМОВА и др.
Synthesis of New 2-Aminopyrrole Derivatives By Reaction
of Furan-2,3-diones 3-Acylhydrazones with CH-Nucleophiles
I. A. Kizimovaa,*, N. M. Igidova, M. A. Kiseleva, M. V. Dmitrievb,
S. V. Chashchinaa,b, and A. I. Siutkinaa
a Perm State Pharmaceutical Academy of the Ministry of Health of the Russian Federation, Perm, 614990 Russia
b Perm State National Research University, Perm, 614068 Russia
*e-mail: icekingakiratotsuka@gmail.com
Received July 8, 2019; revised July 8, 2019; accepted July 11, 2019
Recyclization of furan-2,3-diones acylhydrazones under the action of esters, amides and nitriles of cyanoacetic
acids gave the corresponding esters, amides and nitriles of 2-amino-1-R-4-oxo-5- (2-oxo-2-aryl/tert-
butylethylidene)-4,5-dihydro-1H-pyrrole-3-carboxylic acids.
Keywords: 2-amino-1-R-4-oxo-5-(2-oxo-2-aryl/tert-butylethylidene)-4,5-dihydro-1H-pyrrole-3-carboxylic
acids derivatives, furan-2,3-diones acylhydrazones, recyclization
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020