ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 2, с. 199-209
УДК 547.541.513:547.594.3:547.779
РЕГИОСПЕЦИФИЧНОЕ N-ТОЗИЛИРОВАНИЕ
4-АРИЛ-5-АЦЕТИЛ-6-ГИДРОКСИ-3,6-ДИМЕТИЛ-
4,5,6,7-ТЕТРАГИДРОИНДАЗОЛОВ
© 2020 г. А. И. Исмиевa, В. В. Доценкоb,c,*, А. В. Беспаловb,
Е. Е. Нетребаd, А. М. Магеррамовa
a Бакинский государственный университет, Баку, AZ 1148 Азербайджан
b Кубанский государственный университет, ул. Ставропольская 149, Краснодар, 350040 Россия
c Северо-Кавказский федеральный университет, Ставрополь, 355009 Россия
d Таврическая академия Крымского федерального университета имени В. И. Вернадского, Симферополь, 295007 Россия
*e-mail: victor_dotsenko_@mail.ru
Поступило в Редакцию 25 июля 2019 г.
После доработки 25 июля 2019 г.
Принято к печати 6 августа 2019 г.
Установлен региоспецифичный характер тозилирования 4-арил-5-ацетил-6-гидрокси-3,6-диме-
тил-4,5,6,7-тетрагидроиндазолов. Взаимодействие последних с тозилхлоридом в среде кипящего аце-
тона в присутствии триэтиламина протекает исключительно по положению N1 и приводит к 4-арил-5-
ацетил-6-гидрокси-3,6-диметил-1-тозил-4,5,6,7-тетрагидроиндазолам. Экспериментальные результаты
подтверждены данными квантово-химических расчетов. Проведен прогноз биологической активности
in silico.
Ключевые слова: β-циклокетолы, индазолы, региоспецифичное тозилирование, квантово-химические
расчеты
DOI: 10.31857/S0044460X20020043
Будучи полифункциональными соединениями,
времени наработан большой массив данных по
2,4-диацил(диалкоксикарбонил)-3-R-5-гидрок-
синтезу подобных индазолов с использованием
си-5-метилциклогексаноны 1, известные также как
различных β-циклокетолов и замещенных гидра-
β-циклокетолы, являются перспективными строи-
зинов [8-12, 19-22], однако направление, касаю-
тельными блоками для тонкого органического син-
щееся превращений и функционализации индазо-
теза [1, 2]. β-Циклокетолы легко вступают в реак-
лов 3, получило существенно меньшее развитие.
ции гетероциклизации с различными 1,2- и 1,3-би-
Следует также отметить, что индазольный фраг-
нуклеофильными агентами с образованием изохи-
мент является структурной основой многих сое-
нолинов 2 [3-7], индазолов 3 [1, 8-12], бензо[c]-
динений, представляющих терапевтическую цен-
изоксазолов 4 [1, 9-11], 1,2,4-триазоло[3,4-b]хи-
ность (см. обзорные работы [23-26]).
назолинов 5 [13] и пиразоло[3,4-c]изохинолинов 6
Продолжая наши исследования в области хи-
[14], 4,5,6,7,8,9-гексагидропиразоло[1,5-a]хиназо-
мии β-циклокетолов и их аналогов [15, 27-30], мы
линов 7 [15] и производных 6,7,8,8a-тетрагидропи-
решили изучить регионаправленность реакции
разоло[5,1-b]хиназолин-9(5H)-она 8 [16] (схема 1).
тозилирования индазолов 3. Тозилирование инда-
Из числа представленных гетероциклических
золов 3 может принципиально протекать по трем
систем наше внимание привлекли производные
различным направлениям: с образованием N1-, N2-
индазола 3. Синтез соединений 3 был впервые
и О-производных (схема 2). Образование региои-
описан еще в начале ХХ века [1, 17, 18]. С того
зомерных N1- и N2-продуктов можно допустить,
199
200
ИСМИЕВ и др.
Схема 1.
Ph
O
N
R
Ar
R
HO
O
NH
N
H3C
NH
O
N
NH2
N
N
O
N
N
H2N
Ph
N
H3C
N
N
HO
R
Ar
R
5
6
R Ar
R
R Ar
O
R
Ar
R
NH2XH
O
O
R
NCCH2C(X)NH2
O
NH
X
H3C
X = NH (3);
H3C
X = O, S, Se, C(CN)2
H3C
N
X = O (4)
O
X
HO
HO
HO
1
CN
OEt
Ar
O
2
H2N
R
Ar
O
Ar R
O
O
NH
CN
N
NC
NH
N
H3C
O
N
O
N
CN
NH2
N
HO
HN
H3C
CH3
N
HN
NH2
N
N
N
HO
OH
7
CN
8
Схема 2.
CH3
Ar
CH3
Ar
CH3
CH3
Ar
CH
3
CH3
O
O
O
N
NH
NH
H3C
H3C
N1
H3C
N
N
HO
HO
TsO
Ts
CH3
Ar
CH3
Ar
CH
3
CH3
O
O
N
N2 Ts
H3C
H3C
N
N
HO
H
HO
исходя из принципиально возможной прототроп-
(Et3N) в качестве единственных продуктов реакции
ной таутомерии индазолов 3.
образуются исключительно N1-тозилпроизводные
Экспериментально было установлено, что при
4а-д (схема 3). Продуктов О-тозилирования обна-
взаимодействии индазолов 3a-д с тозилхлоридом
ружено не было: вероятно, данное направление не
в безводном ацетоне в присутствии основания
реализуется по стерическим причинам.
Схема 3.
CH3
Ar
CH3
CH3
Ar
CH3
Et3N
O
O
O
(CH3)2C=O
N
NH
H3C
S Cl
H3C
N
H3C
N
HO
O
O
CH3
S
HO
O
3a-ɞ
4a-ɞ
Ar = Ph (ɚ ɋɇ3C6H4 (ɛ ɋɇ3Ɉ&6H4 (ɜ ɮɭɪɢɥ ɝ), 4-ClC6H4 (ɞ).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
РЕГИОСПЕЦИФИЧНОЕ N-ТОЗИЛИРОВАНИЕ
201
Строение N1-тозилиндазолов 4а-д подтвержде-
но данными спектроскопии ЯМР, а также резуль-
татами РСА для соединения 4а. Следует отметить
стереохимические особенности строения продук-
тов 4. Известно, что и сам исходный β-циклокетол
[1], и продукты его гидразинирования существуют
в виде смесей диастереомеров с предпочтительной
син-ориентацией НО- и СН3С(О)-групп. Согласно
данным РСА, индазол 3а [31] и его гидрохлорид
[32] кристаллизуются в центросимметричных
пространственных группах и представляют собой
рацемические смеси, для которых описаны как ми-
нимум две стереоконфигурации: (4S,5R,6S) либо
(4R,6R). Возможность существования индазолов 4
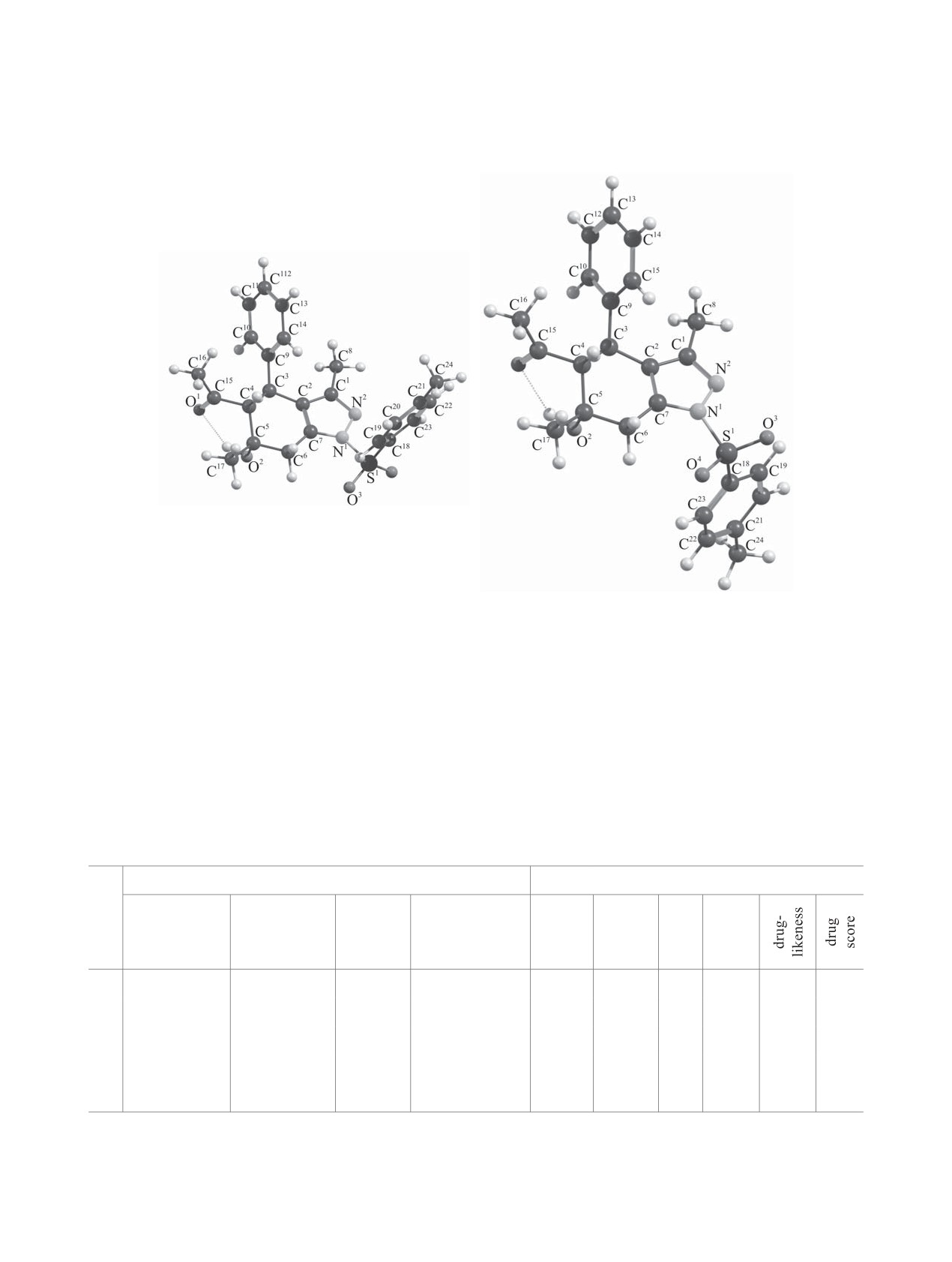
Рис. 1. Общий вид молекулы соединения 4а в кри-
сталле.
в виде смеси диастереомеров предопределяет ча-
стичное удвоение сигналов, наблюдаемое в неко-
ки приведены в табл. 1, длины связей и углы - в
торых спектрах ЯМР продуктов.
табл. 2. В структуре соединения 4а циклогексено-
По данным рентгеноструктурного анализа,
вое кольцо имеет конформацию полукресло, ато-
соединение 4а представляет собой производное
мы C5 и C4 значительно отклонены от плоскости
тетрагидроиндазола - 1-(6-гидрокси-3,6-диметил-
C6C7C2 и приподняты на 0.521(5) и 0.270(5) Å со-
1-тозил-4-фенил-4,5,6,7-тетрагидро-1H-индазол-
5-ил)этанон (рис. 1). Основные характеристики
ответственно, а атом C3 находится практически в
эксперимента и параметры элементарной ячей-
плоскости C6C7C2, отклонение составляет менее
Таблица 1. Основные кристаллографические данные эксперимента для соединения 4а
Параметр
Значение
Параметр
Значение
Формула
C24H26N2O4S
(MoKα), мм-1
0.179
M
438.53
F(000)
464
Т, K
296(2)
Размер кристалла, мм
0.37×0.30×0.20
λ, Å
MoKα (0.71073)
Область углов θ, град
1.70-24.71
Сингония
Триклинная
Интервалы индексов отражений
-9 ≤ h ≤ 9
-
Пространственная группа
P1
-13 ≤ k ≤ 13
а, Å
8.4141(6)
-14 ≤ l ≤ 14
b, Å
11.2364(8)
Число измеренных/ независимых
11826/3761 (Rint = 0.0626)
рефлексов
с, Å
12.6166(9)
Число рефлексов с I > 2σ(I)
2599
α, град
75.032(2)
Число уточняемых переменных
284
β, град
77.310(2)
R-Фактор [I > 2σ(I)]
R1 = 0.0642, wR2 = 0.1451
γ, град
77.678(2)
R-Фактор по всем отражениям
R1 = 0.1007, wR2 = 0.1639
V, Å3
1108.56(14)
GOOF по F2
0.999
Z
2
Δρmax/Δρmin, е/Å3
0.261/-0.276
dвыч, г/см3
1.314
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
202
ИСМИЕВ и др.
Таблица 2. Некоторые длины связей и валентные углы в молекуле соединения 4а
Угол
ω, град
Угол
ω, град
Связь
d, Å
O4S1O3
120.71(17)
N2C1C2
111.3(3)
S1-O4
1.421(3)
O4S1N1
106.77(15)
N2C1C8
120.4(3)
S1-O3
1.421(3)
O3S1N1
104.52(15)
C23C18S1
119.8(3)
S1-N1
1.680(3)
O4S1C18
108.82(17)
C19C18S1
119.4(3)
S1-C18
1.745(4)
O3S1C18
110.38(16)
O2C5C17
105.5(3)
O1-C15
1.200(4)
N1S1C18
104.26(15)
O2C5C6
110.4(3)
N1-N2
1.386(4)
N2N1C7
111.2(3)
O2C5C4
111.3(3)
N1-C7
1.388(4)
N2N1S1
115.6(2)
C2C7N1
106.1(3)
N2-C1
1.321(4)
C7N1S1
128.7(2)
N1C7C6
128.2(3)
C1N2N1
105.1(3)
0.1 Å. Углы внутри кольца составляют: C2C7C6
плоскости C7N1C1N2C2 составляет 0.001-0.011 Å.
125.0(3), C7C6C5 109.5(3), C6C5C4 108.6(3), C5C4C3
Наблюдаемые углы и длины связей в цикле, харак-
113.2(3), C4C3C2 110.3(3), C3C2C7 123.7(3)°. За
терны для пиразольных производных: 111.3(3)-
счет наличия заместителей различной природы
105.1(3)° и N2-C1 1.321(4), C1-C2 1.424(4), C2-C7
циклогексеновое кольцо имеет торсионные углы:
1.364(4), C7–N1 1.388(4), N1-N2 1.386(4) Å соот-
C7C6C5C4 51.0(4), C6C5C4C3 -63.0(4), C5C4C3C2
ветственно [35].
38.7(4), C4C3C2C7
-6.0(5), C3C2C7C6
-2.7(6),
Тозильный заместитель при атоме N1 располо-
C2C7C6C5 -21.0(5)°. Заместители циклогексено-
жен аксиально относительно пиразольного цикла.
вого кольца при атомах С3, С4 и С5 расположены
Метильная группа при атоме С1 имеет экватори-
экваториально относительно цикла, но направле-
альное положение. Данные заместители по-разно-
ны в различные стороны относительно друг друга.
му располагаются относительно плоскости цикла:
Гидроксогруппа при атоме С5 расположена акси-
тозильный заместитель (S1) отклонен и припод-
ально. Аналогичное расположение заместителей
нят на 0.502(5) Å, а метиловый (С8) находится
ранее описывалось в работах [33, 34].
практически в плоскости, отклонение составляет
Пиразольное кольцо в структуре 4а имеет прак-
0.043(5) Å соответственно.
тически плоское построение, отклонение атомов от
Молекулы в кристалле 4а объединены с помо-
щью межмолекулярных Н-связей (табл. 3, рис. 2).
Это взаимодействие связывает их в димер с графо-
вым мотивом R22 (8) [36].
Для объяснения предпочтительности N1-
тозилирования нами было проведено теорети-
ческое исследование реакционной способности
индазолов 3 и относительной термодинамиче-
ской стабильности возможных продуктов реак-
ции с целью выявления факторов, влияющих на
направленность процесса. Квантово-химические
расчеты методом DFT проводили в программном
комплексе GAMESS (US), с использованием ши-
роко известного гибридного функционала B3LYP
Рис. 2. Фрагмент упаковки кристалла соединения 4а.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
РЕГИОСПЕЦИФИЧНОЕ N-ТОЗИЛИРОВАНИЕ
203
Таблица 3. Длины водородных связей в молекуле 4а
Связь (D-H···A)
Операция симметрии
d(H···A), Å
d(D-H), Å
d(D···A), Å
ω(D-H···A), град
O2-H2A···N2
1-x, 1-y, 1-z
2.26(5)
0.78(5)
2.959(3)
151.0(4)
Таблица 4. Частичные отрицательные заряды на атомах азота, рассчитанные квантово-химическим методом
B3LYP/6-31G(d,p)
Атом
Заряд по Малликену
Электростатический заряд
N8
-0.387
-0.060
N9
-0.429
-0.626
[37,38] и валентно-расщепленного базисного на-
Эта разница возникает вследствие участия НЭП
бора 6-31G(d,p). Для визуализации полученных
азота N2 в круговом сопряжении, образующем
геометрических структур применяли программу
ароматическую систему пиразола, в то время как
ChemCraft. Расчет энергии в основном состоянии
НЭП азота N1 расположена в плоскости цикла и не
осуществляли после предварительного поиска
участвует в сопряжении.
наиболее устойчивых конформаций с последу-
Следует отметить, что термодинамический
ющей оптимизацией геометрии молекулы. Все
фактор в данном случае играет, по всей видимо-
расчеты проводили с учетом неспецифической
сти, второстепенную роль, так как рассчитанная
сольватации исследуемых соединений в рамках
разница в энергии между продуктами тозилирова-
континуумной модели CPCM (растворитель - аце-
ния по атомам N1 и N2 невелика и составляет всего
тон) [39].
4.8 кДж/моль. Конформационный анализ получен-
Тозилирование соединения 3a протекает реги-
ного продукта 3а показал, что наиболее устойчи-
оспецифично по атому N1 (рис. 3, 4), что объясня-
выми структурами являются 3а-1 и 3а-2 (рис. 4),
ется, в первую очередь, кинетическим фактором -
разница в абсолютной энергии которых чрезвычай-
существенной разницей в величине частичных от-
но мала, и составляет всего 0.06 кДж/моль (мень-
рицательных зарядов на атомах N1 и N2 (табл. 4).
шей энергией обладает конформер 3а-1, в котором
бензольные кольца расположены по одну сторону
от плоскости тетрагидроиндазольного цикла).
Для соединений 4a-д был проведен прогноз
активности in silico на сходство с лекарственны-
ми препаратами (drug-likeness), спрогнозирова-
ны параметры ADMET (Absorption, Distribution,
Metabolism, Excretion, Toxicity), предполагаемая
биологическая активность и вероятные мише-
ни. Для этой цели использовали следующие про-
граммные продукты: OSIRIS Property Explorer
[40], SwissADME
[41], SwissTargetPrediction
[42], Molinspiration Property Calculation Service
[43] и AntiBac-Pred [44]. Сервис OSIRIS Property
Explorer был использован для оценки сLogP (меры
липофильности), logS (растворимости), TPSA
(Topological Polar Surface Area, площади топологи-
ческой полярной поверхности), рисков побочных
эффектов (мутагенные, онкогенные, репродуктив-
ные эффекты), параметра drug-likeness, а также
Рис. 3. Оптимизированная геометрическая структура
соединения 3а.
общей оценки фармакологического потенциала
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
204
ИСМИЕВ и др.
ɛ
ɚ
Рис. 4. Наиболее устойчивые конформеры продукта 3а: (а) конформер с син-расположением безольных колец, (б) конформер
с анти-расположением бензольных колец.
соединения (drug score) [40]. Был проведен пер-
Согласно полученным результатам, расчетное
вичный анализ структуры на соответствие «прави-
значение LogP для соединений 4а-д не превышает
лу пяти» К. Липински (сLogP ≤ 5.0, молекулярная
2.9, что указывает на вероятную хорошую абсор-
масса (MW) ≤ 500, TPSA ≤ 140, число акцепторов
бцию и приемлемую липофильность [45-47]. Для
водородных связей ≤ 10, доноров ≤ 5) [45-47].
всех соединений (кроме продуктов 4б, д) расчеты
Расчетные данные, полученные с помощью сервиса
дают приемлемое значение показателя раствори-
OSIRIS Property Explorer, представлены в табл. 5.
мости logS. Молекулярная масса всех исследуемых
Таблица 5. Риски токсичности и физико-химические параметры соединений 4а-д, спрогнозированные с помощью
программы OSIRIS Property Explorer
Риск токсичностиа
Физико-химические параметры
№
репродуктивные
мутагенность
онкогенность
ирритант
сLogP
logS
MW
TPSA
эффекты
4a
-
-
-
+
2.27
-4.01
438
97.64
-0.14
0.31
4б
-
-
-
+
2.62
-4.36
452
97.64
-0.39
0.27
4в
-
-
-
+
2.20
-4.02
468
106.8
-0.19
0.29
4г
-
-
-
+
1.46
-3.69
428
110.7
-0.53
0.31
4д
-
-
-
+
2.88
-4.74
472
97.64
0.67
0.29
а Знак «-» указывает на прогнозируемое отсутствие токсичности, «+» - возможный риск токсичности.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
РЕГИОСПЕЦИФИЧНОЕ N-ТОЗИЛИРОВАНИЕ
205
Таблица 6. Параметры ADMET и биологическая активность для соединений 4а-д, рассчитанные с помощью
программных сервисов SwissADME и SwissTargetPrediction
Проник-
Ингибирование цитохромов Р450
а
Гастроинтес-
новение
Вероятные
Индекс
№
тинальная
через
мишени
биодоступности
CYP1A2
CYP2C19
CYP2C9
CYP2D6
CYP3A4
абсорбция
ГЭБ
4a
Высокая
Нет
-
+
-
-
+
А GPCRб
0.55
4б
Высокая
Нет
-
+
-
-
+
А GPCRб
0.55
4в
Высокая
Нет
-
+
-
-
+
Энзимы
0.55
4г
Высокая
Нет
-
+
-
-
+
-
0.55
Энзимы
0.55
4д
Высокая
Нет
-
+
+
-
+
А GPCRб
а Знаком «+» или «-» показано наличие или отсутствие эффекта. б А GPCR - рецепторы, сопряженные с G-белком, семейство А.
соединений не превышает 500 Да, что соответ-
Cytochrome P450) (табл. 6). По данным расчетов
ствует критериям «правила пяти» Липински. В то
с использованием SwissTargetPrediction, наибо-
же время, ни одно из соединений (кроме продукта
лее вероятными мишенями для всех соединений
4д) не показало положительных значений по кри-
(кроме соединения 4г, для которого не обнару-
терию сходства с лекарством (drug-likeness). Все
жено подходящих мишеней) является широкий
соединения 4а-д показывают умеренно высокое
круг ферментов и семейство А сопряженных с
значение (~0.3) показателя фармакологического
G-белком рецепторов. Индекс биодоступности со-
потенциала соединения (drug score). Для всех со-
ставляет 0.55 для всех соединений, что указывает
единений расчеты показывают возможные токси-
на соответствие критериям Липински [48].
кологические риски для репродуктивной системы.
Таким образом, установлено, что тозилирова-
Расчет с использованием Molinspiration Property
ние индазолов, полученных из β-циклокетолов и
Calculation Service указывает на наиболее вероят-
гидразина, протекает региоспецифично по атому
ную активность соединений 4а-д в качестве инги-
азота N1. Проведено теоретическое исследование
биторов киназ (индексы Molinspiration bioactivity
реакционной способности исходных индазолов и
score в диапазоне от -0.42 до -0.26).
термодинамической стабильности продуктов то-
Расчет вероятной антибактериальной актив-
зилирования, которое также подтверждает пред-
ности с помощью сервиса AntiBac-Pred ука-
почтительность N1-тозилирования и указывает
зывает на вероятную резистентность бактерий
на определяющее значение кинетических факто-
Staphylococcus simulans [показатель confidence (С)
ров. Анализ данных прогнозирования биологи-
составляет 0.28-0.42, рассчитывается как превы-
ческой активности показал, что синтезированные
шение вероятности активности над вероятностью
N-тозилиндазолы соответствуют критериям био-
неактивности, PA > PI] и Mycobacterium ulcerans
доступности и представляют интерес как перспек-
(С = 0.18-0.36). Вероятна антибактериальная ак-
тивные кандидаты для дальнейшего биоскрининга
тивность в отношении Staphylococcus lugdunensis
in vitro и in vivo.
(С = 0.24-0.33) и Staphylococcus sciuri (С = 0.29-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
0.32, для соединений 4а-в).
По данным расчетов с использованием серви-
Спектры ЯМР
1Н,
13С регистрировали на
сов SwissADME, для всех соединений прогнози-
приборе Bruker AC-300 (300 MГц на ядрах 1Н и
руется высокая гастроинтеральная абсорбция и
75 МГц на ядрах 13С) в растворе CDCl3 или
отсутствие проникновения через гематоэнцефа-
ДМСО-d6, в качестве стандарта использова-
лический барьер (ГЭБ), а также ингибирование
ли остаточные сигналы растворителя. ИК спек-
ряда белков семейства цитохромов Р450 (CYP,
тры регистрировали на ИК Фурье-спектрометре
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
206
ИСМИЕВ и др.
Varian 3600 FT-IR Excalibur Series в таблетках KBr.
c (3Н, СН3), 2.81 д (1Н, H5, 3J = 10.7 Гц), 3.15 уш. c
Элементный анализ на содержание C, H, N про-
(2Н, Н7), 4.17 д (1Н, H4, 3J = 10.7 Гц), 4.94 уш. с (1Н,
водили на приборе Carlo Erba 1106. Температуры
ОН), 6.99 д (2Н, Н, Ar, 3J = 7.5 Гц), 7.05 д (2Н, Н,
плавления определяли на столике Кофлера и не
Ar, 3J = 7.5 Гц), 7.42 д (2Н, Н3, Н5, Ts, 3J = 7.8 Гц),
корректировали. Контроль за чистотой получен-
7.79 д (2Н, Н2, Н6-Ts, 3J = 7.8 Гц). Спектр ЯМР
ных соединений осуществляли методом ТСХ на
13C (ДМСО-d6), δС, м. д.: 12.9, 20.6, 21.1, 28.0, 30.7,
пластинах Silufol UV-254, элюент ацетон-гексан
38.7, 38.9, 65.0, 69.4, 120.7, 127.3, 128.4, 129.2,
(1:1), проявитель - пары иода, УФ детектор.
130.2, 134.6, 136.0, 137.9, 141.7, 145.4, 152.3, 210.1.
1-(4-Арил-6-гидрокси-3,6-диметил-1-тозил-
Найдено, %: C 66.34; H 6.36; N 6.15. C25H28N2О4S
4,5,6,7-тетрагидро-1H-индазол-5-ил)этаноны
(M 452.57). Вычислено, %: C 66.35; H 6.24; N 6.19.
(4а-д). Смесь соответствующего тетрагидроинда-
1-[6-Гидрокси-3,6-диметил-4-(4-метокси-
зола 3а-д (50 ммоль), 9.53 г (50 ммоль) п-толуол-
фенил)-1-тозил-4,5,6,7-тетрагидро-1H-индазол-
сульфохлорида и 10 мл триэтиламина кипятили в
5-ил]этанон (4в). Выход 59%, т. пл. 184°С. Спектр
300 мл безводного ацетона в течение 6-8 ч (кон-
ЯМР 1Н (CDCl3), δ, м. д.: основной стереоизомер,
троль конверсии по ТСХ). Смесь охлаждали, и к
1.37 c (3Н, СН3), 1.52 c (3Н, СН3), 1.71 c (3Н, СН3),
остывшему раствору приливали 300 мл холодной
2.40 c (3Н, СН3), 2.89-3.02 м (2Н, H7, H5, наложе-
дистиллированной воды. Образовавшуюся суспен-
ние сигналов), 3.26 д (1Н, Н7, 2J = 18.1 Гц), 3.69
зию выдерживали 24 ч, осадок отфильтровывали
уш. с (1Н, ОН), 3.78 c (3Н, OСН3), 3.98 д (1Н, Н4,
и перекристаллизовывали из EtOH. Соединения
3J = 10.7 Гц), 6.82 д (2Н, Н3, Н5, 4-MeOC6H4, 3J =
4а-д были получены в виде белых мелкокристал-
8.3 Гц), 6.99 д (2Н, Н2, Н6, 4-MeOC6H4, 3J = 8.3 Гц),
лических порошков.
7.31 д (2Н, Н3, Н5, Ts, 3J = 8.0 Гц), 7.85 д (2Н, Н3,
1-[6-Гидрокси-3,6-диметил-1-тозил-4-фенил-
Н5, Ts, 3J = 8.0 Гц); минорный стереоизомер, 1.31 c
4,5,6,7-тетрагидро-1H-индазол-5-ил]этанон (4а).
(3Н, СН3), 1.69 c (3Н, СН3), 1.86 c (3Н, СН3), 2.68
Выход 65%, т. пл. 178°С. Спектр ЯМР 1Н (CDCl3),
д (1Н, Н7, 2J = 16.2 Гц), 3.54 уш. с (1Н, ОН), 4.04
δ, м. д.: основной стереоизомер, 1.39 c (3Н, СН3),
д (1Н, Н4, 3J = 11.1 Гц), 7.79 д (2Н, Н2, Н6, Ts, 3J =
1.50 c (3Н, СН3), 1.68 c (3Н, СН3), 2.41 c (3Н, СН3),
8.7 Гц). Соотношение основного и минорного сте-
2.91-3.05 м (2Н, H7, H5 наложение сигналов), 3.29
реоизомеров составляет ~4:1. Спектр ЯМР 13C
д (1Н, Н7, 2J = 17.9 Гц), 3.70 уш. с (1Н, ОН), 4.02 д
(CDCl3), δ, м. д.: основной стереоизомер, 13.4,
(1Н, Н4, 3J = 10.6 Гц), 7.07 д (2Н, Н Ph, 3J = 7.7 Гц),
21.6, 28.3, 34.7, 37.4, 40.9, 55.1, 62.7, 71.2, 114.4,
7.28-7.33 м (5Н, Н Ar), 7.86 д (2Н, Н2, Н6, Ts, 3J =
119.7, 127.5, 129.9, 131.9, 135.0, 140.6, 145.2, 152.5,
8.1 Гц); минорный стереоизомер, 1.32 c (3Н, СН3),
158.8, 162.2, 216.5; минорный стереоизомер, 11.8,
1.66 c (3Н, СН3), 2.71 д (1Н, Н7, 2J = 16.7 Гц), 3.55
21.6, 28.4, 37.0, 40.7, 63.2, 71.2, 114.3, 119.1, 127.6,
уш. с (1Н, ОН), 4.09 д (1Н, Н4, 3J = 11.5 Гц), 7.80
129.0, 129.8, 132.6, 139.7, 142.3, 152.0, 158.6,
д (2Н, Н2, Н6, Ts, 3J = 8.3 Гц). Соотношение ос-
162.3, 216.4. Найдено, %: C 64.04; H 6.06; N 6.00.
новного и минорного стереоизомеров составляет
C25H28N2О5S (M 468.57). Вычислено, %: C 64.08;
~3:1. Спектр ЯМР 13C (CDCl3), δС, м. д.: основной
H 6.02; N 5.98.
стереоизомер, 13.3, 21.6, 28.3, 34.7, 37.4, 41.7, 62.7,
1-[6-Гидрокси-3,6-диметил-1-тозил-4-(2-
71.2, 119.4, 127.5, 128.0, 129.1, 129.9, 135.0, 140.1,
фурил)-4,5,6,7-тетрагидро-1H-индазол-5-ил]-
140.8, 145.2, 152.4, 162.2, 216.3; Минорный сте-
этанон (4г). Выход 57%, т. пл. 136°С. Спектр ЯМР
реоизомер, 11.9, 28.2, 37.0, 41.6, 63.1, 71.3, 118.9,
1Н (CDCl3), δ, м. д.: 1.39 c (3Н, СН3), 1.66 c (3Н,
127.4, 129.8, 139.7, 140.9, 145.6, 152.6, 162.1, 216.2.
СН3), 1.86 c (3Н, СН3), 2.40 c (3Н, СН3), 2.97 д (1Н,
Найдено, %: C 65.70; H 6.06; N 6.37. C24H26N2О4S
H7, 2J = 17.9 Гц), 3.16-3.28 м (2Н, H7, H5, наложе-
(M 438.16). Вычислено, %: C 65.73; H 5.98; N 6.39.
ние сигналов), 3.64 уш. с (1Н, ОН), 4.20 д (1Н, H4,
1-[6-Гидрокси-3,6-диметил-4-(4-метил-
3J = 10.7 Гц), 6.15-6.16 м (1Н, H3, фурил), 6.31-
фенил)-1-тозил-4,5,6,7-тетрагидро-1H-индазол-
6.32 м (1Н, H4, фурил), 7.31 д (2Н, Н3, Н5, Ts, 3J =
5-ил]этанон (4б). Выход 62%, т. пл. 173°С. Спектр
7.9 Гц), 7.36-7.37 м (1Н, H5, фурил), 7.85 д (2Н, Н2,
ЯМР 1Н (ДМСО-d6), δ, м. д.: 1.28 c (3Н, СН3), 1.34
Н6, Ts, 3J = 7.8 Гц). Спектр ЯМР 13C (CDCl3), δС,
c (3Н, СН3), 2.02 c (3Н, СН3), 2.22 c (3Н, СН3), 2.37
м. д.: 12.3, 21.6, 28.3, 33.7, 34.9, 37.3, 58.9, 71.0,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
РЕГИОСПЕЦИФИЧНОЕ N-ТОЗИЛИРОВАНИЕ
207
108.3, 110.5, 117.3, 127.6, 129.9, 135.0, 140.6, 142.3,
КОНФЛИКТ ИНТЕРЕСОВ
145.2, 152.0, 162.3, 215.9. Найдено, %: C 61.60; H
Авторы заявляют об отсутствии конфликта
5.76; N 6.52. C22H24N2О5S (M 428.50). Вычислено,
интересов.
%: C 61.67; H 5.65; N 6.54.
1-[6-Гидрокси-3,6-диметил-1-тозил-4-(4-
СПИСОК ЛИТЕРАТУРЫ
хлорфенил)-4,5,6,7-тетрагидро-1H-индазол-5-
1. Кривенько A.П., Сорокин В.В. Замещенные цикло-
ил]этанон (4д). Выход 65%, т. пл. 181°С. Спектр
гексанолоны. Саратов: Саратовск. унив., 1999. С. 20.
ЯМР 1Н (ДМСО-d6), δ, м. д.: основной стереои-
2. Исмиев А.И., Магеррамов А.М., Сукач В.А.,
зомер, 1.27 c (3Н, СН3), 1.36 c (3Н, СН3), 2.04 c
Вовк М.В. // Ж. орг. фарм. хим. 2016. Т. 14. № 4 (56).
(3Н, СН3), 2.39 c (3Н, СН3), 2.82 д (1Н, H5, 3J =
С. 16.
11.2 Гц), 3.14 уш. c (2Н, Н7), 4.24 д (1Н, H4, 3J =
3. Озолс А.И., Пелчер Ю.Э., Калме З.А., Попе-
11.2 Гц), 5.00 уш. с (1Н, ОН), 7.16 д (2Н, Н, Ar,
лис Ю.Ю., Туровскис И.В., Дубурс Г.Я. // ХГС. 1996.
3J = 8.3 Гц), 7.32 д (2Н, Н, Ar, 3J = 8.3 Гц), 7.43 д
Т. 32. № 1. С. 59; Ozols A.I., Pelcher Yu.Ê., Kalme
(2Н, Н3, Н5, Ts, 3J = 8.3 Гц), 7.78 д (2Н, Н2, Н6, Ts,
Z.A., Popelis Yu. Yu., Turovskis I.V., Duburs G.Ya. //
Chem. Heterocycl. Compd. 1996. Vol. 32. N 1. P. 52.
3J = 8.3 Гц); минорный стереоизомер, 1.18 c (3Н,
doi 10.1007/BF01169354.
СН3), 1.82 c (3Н, СН3), 2.00 c (3Н, СН3), 2.61 д (1Н,
4. Дяченко В.Д., Сукач С.М., Дяченко А.Д. // Химия
Н7, 2J = 16.6 Гц), 2.77 уш. c (2Н, Н7), 4.28 д (1Н, H4,
гетероцикл. соед. 2015. Т. 51. № 1. С. 51; Dyachen-
3J = 11.0 Гц), 4.85 уш. с (1Н, ОН), 7.76 д (2Н, Н2, Н6,
ko V.D., Sukach S.M., Dyachenko A.D. // Chem.
Ts, 3J = 8.3 Гц). Соотношение основного и минор-
Heterocycl. Compds. 2015. Vol. 51. N 1. P. 51. doi
ного стереоизомеров составляет ~3:1. Найдено, %:
10.1007/s10593-015-1658-9
C 60.88; H 5.45; N 6.00. C24H25ClN2О4S (M 472.98).
5. Дяченко В.Д., Карпов Е.Н. // ЖОрХ. 2014. Т. 50. № 12.
Вычислено, %: C 60.94; H 5.33; N 5.92.
С. 1806; Dyachenko V.D., Karpov E.N. // Russ. J.
Org. Chem. 2014. Vol. 50. N 12. P. 1787. doi 10.1134/
Рентгеноструктурный анализ. Эксперимен-
S1070428014120136
тальные данные для соединения 4а получены при
6. Сукач С.М., Дяченко В.Д. // ЖОрХ. 2015. Т. 51. № 7.
296(2) K на автоматическом трехкружном дифрак-
С. 1037; Sukach S.M., Dyachenko V.D. // Russ. J.
тометре Bruker APEX-II CCD (MoKα, графитовый
Org. Chem. 2015. Vol. 51. N 7. P. 1020. doi 10.1134/
монохроматор, CCD-детектор, ω-сканирование,
S1070428015070210
2θ = 49.42°). Структура расшифрована прямым
7. Дяченко В.Д., Сукач С.М. // ХГС. 2010. Т. 46. № 12.
методом по комплексу программ SHELXL-2014
С. 1795; Dyachenko V.D., Sukach S.M. // Chem.
[49] с использованием интегрированной системы
Heterocycl. Compd. 2010. Vol. 46. N 12. P. 1467. doi
WINGX [50]. Начальные положения атомов водо-
10.1007/s10593-011-0693-4
8. Гейн В.Л., Носова Н.В., Потемкин К.Д., Алиев З.Г.,
рода найдены из разностного синтеза электронной
Кривенько А.П. // ЖОрХ. 2005. Т. 41. № 7. С. 1039;
плотности, рассчитаны геометрически и уточнены
Gein V.L., Nosova N.V., Potemkin K.D., Aliev Z.G.,
по модели наездника с Uизо=nUэкв несущего атома
Kriven’ko A.P. // Russ. J. Org. Chem. 2005. Vol. 41.
(n=1.5 для метильных групп, n=1.2 для остальных
N 7. P. 1016. doi 10.1007/s11178-005-0287-7
атомов водорода). Структура уточнена полнома-
9. Сорокин В.В., Григорьев А.В., Рамазанов А.К., Кри-
тричным МНК в анизотропном приближении для
венько А.П. // ХГС. 1999. Т. 35. № 6. С. 757; Soro-
неводородных атомов по F2. Молекулярная графи-
kin V.V., Grigoryev A.V., Ramazanov A.K., Kriven-
ка выполнена с помощью программ Platon [51] и
ko, A.P. // Chem. Heterocycl. Compds. 1999. Vol. 35.
Ortep-3 [52]. Координаты атомов и другие параме-
N 6. P. 671. doi 10.1007/BF02251624
тры структуры 4а депонированы в Кембриджском
10. Смирнова Н.О., Плотников О.П., Виноградо-
ва Н.А., Сорокин В.В., Кривенько А.П. // Хим.-фарм.
банке структурных данных (CCDC 1874578).
ж. 1995. Т. 29. № 1. С. 44; Smirnova N.O., Plotni-
ФОНДОВАЯ ПОДДЕРЖКА
kov O.P., Vinogradova N.A., Sorokin V.V., Kriven’-
ko A.P. // Pharm. Chem. J. 1995. Vol. 29. N 1. P. 49. doi
Работа выполнена при поддержке Министерства
10.1007/BF02219464
образования и науки Российской Федерации (тема
11. Hote B.S., Lokhande P.D. // Synth. Commun. 2014.
0795-2020-0010, В.В. Доценко).
Vol. 44. N 10. P. 1492. doi 10.1080/00397911.2013.862724
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
208
ИСМИЕВ и др.
12. Гейн В.Л., Гейн Н.В., Потемкин К.Д., Кривень-
25. Cankařová N., Hlaváč J., Krchňák V. // Org.
ко А.П. // ЖОХ. 2004. Т. 74. № 10. С. 1687; Gein V.L.,
Prep. Proced. Int. 2010. Vol. 42. N. 5. P. 433. doi
Gein N.V., Potemkin K.D., Kriven’ko A.P. // Russ. J.
10.1080/00304948.2010.513898
Gen. Chem. 2004. Vol. 74. N 10. P. 1564. doi 10.1007/
26. Schmidt A., Beutler A., Snovydovych B. // Eur. J. Org.
s11176-005-0056-x
Chem. 2008. Vol. 2008. N. 24. P. 4073. doi 10.1002/
13. Поплевина Н.В., Кузнецова А.А., Кривенько А.П. //
ejoc.200800227
ХГС. 2010. Т. 46. № 9. С. 1420; Poplevina N.V.,
27. Ismiyev A.I., Maharramov A.M., Aliyeva R.A., Aske-
Kuznetsova A.A., Krivenko A.P. // Chem. Heterocycl.
rov R.K., Mahmudov K.T., Kopylovich M.N., Naili H.,
Compd. 2010. Vol. 46. N 9. P. 1148. doi 10.1007/
Pombeiro A.J.L.// J. Mol. Struct. 2013. Vol. 1032. P. 83.
s10593-010-0644-5
doi 10.1016/j.molstruc.2012.08.006
14. Дяченко В.Д., Сукач С.М. // ЖОХ. 2012. Т. 82. № 2.
28. Магеррамов А.М., Исмиев А.И., Кадырова Н.А., Гад-
С. 310; Dyachenko V.D., Sukach S.M. // Russ. J.
жиева К.Э., Аскеров Р.К., Потехин К.А. // ЖСХ. 2013.
Gen. Chem. 2012. Vol. 82. N 2. P. 305. doi 10.1134/
Т. 54. № 6. С. 1107; Magerramov A.M., Ismiev A.I.,
S1070363212020211
Kadyrova N.A., Gadzhieva K.É., Askerov R.K., Pote-
15. Семенова А.М., Оганесян Р.В., Доценко В.В., Чи-
khin K.A. // J. Struct. Chem. 2013. Vol. 54. N. 6. P. 1137.
горина Е.А., Аксенов Н.А., Аксенова И.В., Нетре-
doi 10.1134/S002247661306019X
ба Е.Е. // ЖОХ. 2019. Т. 89. № 1. С. 25; Semeno-
29. Доценко В.В., Кривоколыско С.Г., Половинко В.В.,
va A.M., Oganesyan R.V., Dotsenko V.V., Chigorina
Литвинов В.П. // ХГС. 2012. № 2. С. 328; Dotsen-
E.A., Aksenov N.A., Aksenova I.V., Netreba E.E. // Russ.
ko V.V., Krivokolysko S.G., Polovinko V.V., Litvinov V.P. //
J. Gen. Chem. 2019. Vol. 89. N 1. P. 19. doi 10.1134/
Chem. Heterocycl. Compd. 2012. Vol. 48. P. 309. doi
S1070363219010043
10.1007/s10593-012-0991-5
16. Etman H.A., Sadek M.G., Khalil A.G.M. // Res. J.
30. Магеррамов А.М., Исмиев А.И., Аллахвердиев М.А.,
Pharm. Biol. Chem. Sci. 2015. Vol. 6. N 2. P. 247.
Малеев А.В., Потехин К.А. // ЖСХ. 2016. Т. 57.
17. Rabe P., Elze F. // Lieb. Ann. 1902. Bd. 323. S. 83. doi
№ 4. С. 802; Maharramov A.M., Ismiyev A.I.,
10.1002/jlac.19023230104
Allahverdiyev M.A., Maleev A.V., Potekhin K.A. // J.
18. Rabe P., Elze F. // Lieb. Ann. 1904. Bd. 332. S. 1. doi
Struct. Chem. 2016. Vol. 57. N. 4. P. 764. doi 10.1134/
10.1002/jlac.19043320102
S002247661604020X
19. Finar I.L. // J. Chem. Soc. 1961. N 2. P. 674. doi
31. Maharramov A.M., Ismiyev A.I., Rashidov B.A.,
10.1039/JR9610000674
Aliyev I.V. // Acta Crystallogr. (E). 2011. Vol. 67. N 5.
20. Гейн В.Л., Зорина А.А., Носова И.В., Воронина Э.В.,
P. o1127. doi 10.1107/S1600536811013195
Вахрин М.И., Кривенько А.И. // Хим.-фарм. ж. 2007.
32. Maharramov A.M., Ismiyev A.I., Rashidov B.A., Aske-
Т. 41. № 6. С. 31. doi 10.30906/0023-1134-2007-41-
rov R.K., Khrustalev V.N. // Acta Crystallogr. (E). 2010.
6-31-34; Gein V.L., Zorina A.A., Nosova I.V., Voroni-
Vol. 66. N 7. P. o1848. doi 10.1107/S1600536810024281
na É.V., Vakhrin M.I., Kriven’ko A.I. // Pharm. Chem.
33. Hema R., Parthasarathi V., Ravikumar K., Sridhar B.,
J. 2007. Vol. 41. N 6. P. 319. doi 10.1007/s11094-007-
Pandiarajan K. // Acta Crystallogr. (E). 2006. Vol. 62.
0072-8
P. o656. doi 10.1107/S1600536806001486
21. Гейн В.Л., Янкин А.Н., Носова Н.В., Левандовская Е.Б.,
34. Maharramov A.M., Ismiyev A.I., Rashidov B.A. //
Новикова В.В., Рудакова И.П. // ЖОХ. 2019. Т. 89.
Acta Cryst. (E). 2011. Vol. 67. P. o480. doi 10.1107/
№ 6. С. 954; Gein V.L., Yankin A.N., Nosova N.V.,
S160053681100242X
Levandovskaya E.B., Novikova V.V., Rudakova I.P. //
35. Burgi H.B., Dunitz J.D. Structure correlation. Weinheim:
Russ. J. Gen. Chem. 2019. Vol. 89. N 6. P. 1169. doi
VCH, 1994. Vol. 2. P. 741. doi 10.1002/9783527616091
10.1134/S1070363219060112
36. Bernstein J., Davis R.E., Shimoni L., Chang N.L. //
22. Гейн В.Л., Носова Н.В., Вагапов А.В., Дозморо-
Angew. Chem. Int. Ed. 1995. Vol. 34. N 15. P. 1555. doi
ва Н.В., Янкин А.Н. // ЖОХ. 2019. Т. 89. № 7. С. 987;
10.1002/anie.199515551
Gein V.L., Nosova N.V., Vagapov A.V., Dozmorova N.V.,
37. Becke A.D. // J. Chem. Phys. 1993. Vol. 98. N 7. P. 5648.
Yankin A.N. // Russ. J. Gen. Chem. 2019. Vol. 89. N 7.
doi 10.1063/1.464913
P. 1353. doi 10.1134/S1070363219070016
38. Lee C., Yang W., Parr R.G. // Phys. Rev (B). 1988. Vol. 37.
23. Denya I., Malan S.F., Joubert J. // Exp. Opin.
N 2. P. 785. doi 10.1103/PhysRevB.37.785
Therap. Pat. 2018. Vol. 28. N. 6. P. 441. doi
39. Tomasi J., Mennucci B., Cammi R. // Chem. Rev. 2005.
10.1080/13543776.2018.1472240
Vol. 105. P. 2999. doi 110.1021/cr9904009
24. Cerecetto H., Gerpe A., González M., Aran V.J., de
40. Sander T. OSIRIS Property Explorer. Idorsia
Ocariz C.O. // Mini Rev. Med. Chem. 2005. Vol. 5.
N. 10. P. 869. doi 10.2174/138955705774329564
chemistry.org/prog/peo/.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
РЕГИОСПЕЦИФИЧНОЕ N-ТОЗИЛИРОВАНИЕ
209
41. Daina A., Michielin O., Zoete V. // Sci. Rep. 2017.
46. Lipinski C.A. // Drug Discov. Today: Technologies. 2004.
Vol. 7. Article N 42717. doi 10.1038/srep42717
Vol. 1. N 4. P. 337. doi 10.1016/j.ddtec.2004.11.007
42. Gfeller D., Grosdidier A., Wirth M., Daina A., Michie-
47. Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J. //
lin O., Zoete V. // Nucl. Acids Res. 2014. Vol. 42. N W1.
Adv. Drug. Delivery Rev. 2012. Vol. 64. Suppl. P. 4. doi
P. W32. doi 10.1093/nar/gku293
10.1016/j.addr.2012.09.019
43. Molinspiration Property Calculation Service.
48. Martin Y.C. // J. Med. Chem. 2005.Vol. 48. N 9. P. 3164.
Molinspiration Cheminformatics, Slovak Republic,
doi 10.1021/jm0492002
49. Sheldrick, G.M. // Acta. Crystallogr. (С). 2015. Vol. 71.
44. Way2Drug, AntiBac-Pred. Laboratory for Structure-
P. 3. doi 10.1107/S2053229614024218
Function Based Drug Design, Institute of Biomedical
50. Farrugia L.J. // J. Appl. Cryst. 1999. Vol. 32. N 4.
Р. 837. doi 10.1107/S0021889899006020.
com/antibac/
51. Spek A.L. // J. Appl. Cryst. 2003. Vol. 36. Pt 1. P. 7. doi
45. Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J. //
10.1107/S0021889802022112.
Adv. Drug. Delivery Rev. 1997. Vol. 23. N 1-3. P. 4. doi
52. Farrugia L.J. // J. Appl. Cryst. 1997. Vol. 30. N 5.
10.1016/S0169-409X(96)00423-1
P. 565. doi 10.1107/S0021889897003117
Regiospecific N-Tosylation of 5-Acetyl-4-aryl-6-hydroxy-
3,6-dimethyl-4,5,6,7-tetrahydroindazoles
A. I. Ismieva, V. V. Dotsenkob,c,*, A. V. Bespalovb, E. E. Netrebad, and A. M. Maharramova
a Baku State University, Baku, AZ 1148 Azerbaijan
b Kuban State University, Krasnodar, 350040 Russia
c North Caucasus Federal University, Stavropol, 355009 Russia
d Taurida Academy, V. I. Vernadsky Crimean Federal University, Simferopol, 295007 Russia
*e-mail: victor_dotsenko_@mail.ru
Received July 25, 2019; revised July 25, 2019; accepted August 6, 2019
The regiospecific character of tosylation of 5-acetyl-4-aryl-6-hydroxy-3,6-dimethyl-4,5,6,7-tetrahydroinda-
zoles was revealed. The reaction of 5-acetyl-4-aryl-6-hydroxy-3,6-dimethyl-4,5,6,7-tetrahydroindazoles with
tosyl chloride in a boiling acetone in the presence of triethylamine occurs exclusively at the N1 position and
leads to the formation of 5-acetyl-4-aryl-6-hydroxy-3,6-dimethyl-1-tosyl-4,5,6,7-tetrahydroindazoles. The
experimental results were confirmed by quantum chemical calculations. Screening of biological activity in
silico was performed.
Keywords: β-cycloketols, indazoles, regiospecific tosylation, quantum-chemical calculations
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020