ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 2, с. 236-243
УДК 547.1.123
СИНТЕЗ И ЦИТОТОКСИЧНОСТЬ
СЕЛЕНСОДЕРЖАЩИХ ДИЕНОНОВ
© 2020 г. Д. М. Гусев, А. С. Бунев, А. А. Голованов*
Тольяттинский государственный университет, ул. Белорусская 14, Тольятти, 445020 Россия
*e-mail: aleksandgolovanov@yandex.ru
Поступило в Редакцию 19 июля 2019 г.
После доработки 19 июля 2019 г.
Принято к печати 25 июля 2019 г.
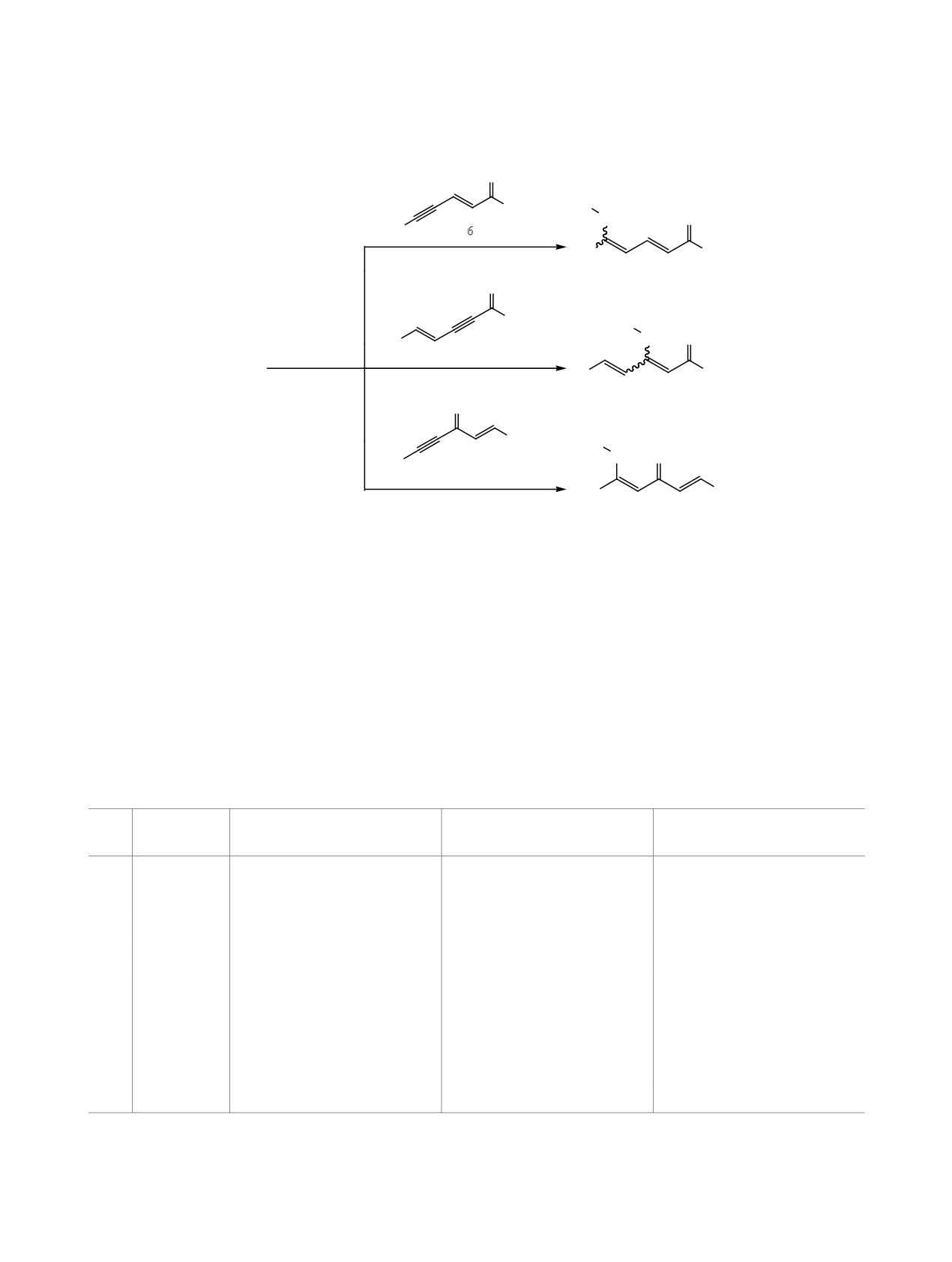
Нуклеофильное присоединение бензоселенола протекает региоселективно по β-атому углерода трой-
ной связи 1,5-дизамещенных пент-2-ен-4-ин-1-онов, пент-4-ен-2-ин-1-онов и пент-1-ен-4-ин-3-онов.
Образующиеся селенсодержащие сопряженные диеноны проявляют выраженную цитотоксичность в
отношении некоторым опухолевых клеточных линий.
Ключевые слова: селенсодержащие диеноны, сопряженные ениноны, бензоселенол, нуклеофильное
присоединение, цитотоксичность
DOI: 10.31857/S0044460X20020080
Органическая и биоорганическая химия селе-
ни неизвестны. Между тем, очевидно, что диено-
на в последние десятилетия интенсивно развива-
ны, возможные продукты таких реакций, могут
ется [1-4]. Это связано, прежде всего, с наличием
представлять прикладной интерес в качестве цито-
у органоселеновых производных полезных видов
токсических агентов и как прекурсоры селеносо-
биологической активности [5-8]. Например, они
держащих функциональных производных гетеро-
перспективны как профилактические противоопу-
циклических соединений [19]. Восполнению этого
холевые средства, а также, в сочетании с другими
пробела посвящено наше сообщение.
противоопухолевыми препаратами, при химио- и
Нуклеофильное присоединение селенофенола
радиотерапии онкологических заболеваний [7].
1, выбранного в качестве тестового объекта вви-
2-Фенил-1,2-бензоселеназол-3-он (нейропротек-
ду его доступности, к линейно- (соединения 2-8)
торный препарат эбселен) и его производные об-
и кросс-сопряженным (соединения 9 и 10) енино-
ладают антиоксидантными свойствами [9, 10]. В
нам, как и в случае тиолов [11, 12], осуществля-
этой связи актуален поиск новых селенооргани-
ется в присутствии Et3N. Реакция протекает при
ческих производных, обладающих противоопухо-
комнатной температуре и полностью завершается
левой и антиоксидантной активностью, а также
за 15-20 мин. Во всех случаях центром нуклео-
их синтетических предшественников. Ранее нами
фильной атаки является β-атом углерода тройной
был разработан эффективный способ получения
связи субстрата (схема 1).
5-сульфанилзамещенных пента-2,4-диен-1-онов,
В результате реакции образуются 5- и 3-(фенил-
основанный на реакции нуклеофильного присое-
динения тиолов к линейно-сопряженным енино-
селенил)пента-2,4-диен-1-оны 11-17 и 1-(фенил-
нам [11, 12]. В литературе имеются многочислен-
селенил)пента-1,4-диен-3-оны 18, 19 (табл.
1).
ные сведения о реакциях селенирования активиро-
Выход продуктов реакции зависит от взаимно-
ванных двойных и тройных связей [13-18], однако
го расположения кратных связей в сопряженных
данные о присоединении к полифункциональным
субстратах: в случае 2,4,1-енинонов 2-6, тройная
субстратам - сопряженным енинонам соединений,
связь которых отделена от кето-группы винильным
содержащих функцию SeH, до настоящего време-
фрагментом, выход целевых продуктов реакции
236
СИНТЕЗ И ЦИТОТОКСИЧНОСТЬ СЕЛЕНСОДЕРЖАЩИХ ДИЕНОНОВ
237
Схема 1.
O
R2
Ph
Se
O
R1
2 6
5
2
R1
3
1
R2
4
O
11-15
Ph
Ph
R
Se
O
Et3N
7, 8
4
2
Ph SeH
R
5
3
1
Ph
MeOH
1
16, 17
O
R
Ph
Se
O
Ph
9, 10
2
4
Ph
1
3
5
R
18, 19
R1 = R2 = Ph (2, 11); R1 = 4-MeC6H4, R2 = Ph (3, 12); R1 = Ph, R2 = 4-MeC6H4 (4, 13);
R1 = Ph, R2 = 4-FC6H4 (5, 14), 4-ClC6H4 (6, 15). R = Ph(7, 16), 4-ClC6H4 (8, 17).
R = Ph (9, 18), 3-FC6H4 (10, 19).
составляет 44-68%, тогда как в случае 4,2,1- (7, 8)
фенилселенил)пент-4-ин-1-оны 20 и 21 - проме-
и 1,4,3-енинонов (9, 10) выход соответствующих
жуточные кинетически контролируемые продукты
диенонов 16-19 гораздо выше (71-91%). Кроме
реакции (схема 2) [11, 20].
того, в случае 1,5-дифенилзамещенного енинона
Как и при тиилировании активированных трой-
2 и енинона 3, содержащего донорный п-толиль-
ных связей [11, 21], продукты реакции 11-17 обра-
ный заместитель в положении 5, в виде минорных
зуются в виде смеси (E,E)- и (E,Z)/(Z,E)-изомеров,
примесей были обнаружены 5-арил-1-фенил-3-(-
о чем свидетельствуют удвоенные сигналы в спек-
Таблица 1. Температуры плавления и данные масс-спектрометрии для селенсодержащих диенонов 11-19
Найдено m/z
Вычислено m/z
№
Т. пл.а, °C
Брутто-формула
[M + Na]+
[M + Na]+
11
96-97
413.0417
C23H18ONaSe
413.0421
12
78-79
427.0577
C24H20ONaSe
427.0577
13
116-117
427.0581
C24H20ONaSe
427.0577
14
111-112
431.0305
C23H17FONaSe
431.0326
15
99-101
447.0022
C23H17ClONaSe
447.0031
16
108-110
413.0414
C23H18ONaSe
413.0421
17
115-116
447.0008
C23H17ClONaSe
447.0031
18
132-134
413.0403
C23H18ONaSe
413.0421
19
152-154
431.0336
C23H17FONaSe
431.0326
а Растворитель для перекристаллизации - гексан.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
238
ГУСЕВ и др.
Схема 2.
Ph
2 ɢɥɢ 3
Se
1
X
O
Et3N, MeOH
(R2 = Ph)
Ph
R1
20, 21
X = H (20), Me (21).
трах ЯМР 1H и 13C (табл. 2). Сигналы винильных
карциноме (A431), карциноме молочной железы
атомов водорода в спектрах ЯМР 1H находятся в
(MCF7), опухоли мочевого пузыря (T24), мела-
области резонанса ароматических протонов, но с
номе (A375) и колоректальному раку (HCT116).
помощью двумерных гетероядерных эксперимен-
Цитотоксичность оценивали с помощью МТТ-
тов HMQC и HMBC (1H-13C) удается надежно
теста при обработке клеток исследуемыми соедине-
соотнести дублеты при 6.2-6.6 м. д. с протонами
ниями в концентрации 30 мкмоль/л в течение 48 ч.
H4 (E,E)-изомеров 5-(фенилселенил)пента-2,4-ди-
Данные табл. 3 показывают, что ярко выражен-
ен-1-онов 11-15 (3JHH = 9.9-10.8 Гц). Протоны H4
ную цитотоксичность проявляет соединение 15
(Z,E)-изомеров
3-(фенилселенил)пента-2,4-диен-
в отношении четырех исследуемых линий, менее
1-онов 16, 17 (3JHH = 15.9 Гц) резонируют в той же
выраженным эффектом обладает соединение 18.
области. Атомам H4 (E,E)-изомеров соединений
Отметим, что исследуемые соединения не прояви-
16, 17 соответствуют дублеты при 8.2 м. д. (3JHH
ли явно выраженного цитотоксического эффекта
~16 Гц), а синглеты около 6.7 и 8.0 м. д. принад-
в отношении линии HCT116. Наиболее чувстви-
лежат протонам H2 (E,E)- и (Z,E)-изомеров соот-
тельной к действию диенонов 11-18 оказалась
ветственно. В спектрах ЯМР 13C диенонов 11-15
клеточная линия MCF7.
надежно интерпретируются сигналы атома С4
Таким образом, нуклеофильное селенирование
(E,E)-изомера около 128 м. д. и кето-групп, кото-
линейно- и кросс-сопряженных пентенинонов мо-
рые резонируют в диапазоне 182-190 м. д., при-
жет служитьудобнымметодом синтеза5-и3-(фенил-
чем сильнопольный сигнал соответствует (E,E)-
селенил)пента-2,4-диен-1-онов и
1-(фенилселе-
изомеру, а слабопольный - (Z,E)-изомеру. Спектры
нил)пента-1,4-диен-3-онов, представляющих ин-
соединений 16, 17 аналогичны.
терес в качестве цитотоксических агентов и как
В отличие от 3- и 5-(фенилселенил)замещенных
исходных соединений для синтеза функциональ-
пента-2,4-диен-3-онов 11-17, 1-(фенилселенил)-
ных селеносодержащих производных азагетеро-
пента-1,4-диен-3-оны 18 и 19 представляют собой
циклов [19].
чистые (Z,E)-изомеры. На (Z)-конфигурацию двой-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ной связи C1=C2 указывает наличие корреляции
между протоном Н2 и орто-протоном бензольно-
Спектры ЯМР 1H, 13C и 19F соединений 11-21
го кольца в спектрах NOESY диенонов 18 и 19.
регистрировали в растворе ДМСО-d6 на прибо-
В спектрах ЯМР 1H этих веществ присутствуют
ре Bruker AVANCE III 400 при рабочих частотах
характеристические синглеты протонов H2 около
400, 101 и 376 МГц соответственно, енинонов 5 и
7.3 м. д. Атомы H4 и H5 попадают в области резо-
8 - в растворе CDCl3 на приборе Bruker AM-300
нанса ароматических протонов. В спектрах ЯМР
(300, 75.47 и 282.40 МГц). Внутренний стандарт
13C удается надежно интерпретировать сигналы
в спектрах ЯМР 1H, 13C - Me4Si, в спектрах ЯМР
при 124-125 м. д., относящиеся к атому С4, и сиг-
19F - CFCl3. ИК спектры записывали на Фурье-
налы кето-группы (187-188 м. д.).
спектрометре ФСМ-1201 в таблетках KBr. Масс-
Полученные диеноны 11-18 были испытаны на
спектры высокого разрешения получены мето-
цитотоксичность по отношению к ряду опухоле-
дом электрораспыления на приборе Bruker maXis
вых клеточных линий, а именно эпидермоидной
HRMS-ESI-QTOF. Чистоту продуктов контроли-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
СИНТЕЗ И ЦИТОТОКСИЧНОСТЬ СЕЛЕНСОДЕРЖАЩИХ ДИЕНОНОВ
239
Таблица 2. Спектральные характеристики селенсодержащих диенонов 11-19
№
δН, м. д.
δC, м. д.
ν
, см-1
C=O
11
6.28 д (H4, E,E-изомер, 3JHH = 9.9 Гц),
124.3, 125.11, 127.0, 127.6, 128.0 (C4, E,E-изомер), 128.2,
1649
6.64-6.72 м, 7.01-7.24 м, 7.28-7.77 м,
128.4, 128.6, 128.67, 128.74, 128.8, 128.9, 129.0, 129.02,
7.89-8.04 м, 8.04-8.11 м
129.09, 129.14, 129.3, 129.38, 129.41, 129.6, 129.7, 129.8,
130.2, 130.3, 130.4, 131.6, 131.9, 132.2, 133.3, 133.9, 134.0,
134.5, 134.9, 135.5, 136.6, 137.1, 137.7, 137.8, 138.1, 139.8,
142.2, 149.7, 189.9 (C1, E,E-изомер), 190.0 (C1, E,Z-изомер)
12
2.14 с (Me, E,E-изомер), 2.26 с (Me,
21.2 (Me, E,E-изомер), 21.3 (Me, E,Z-изомер), 124.5,
1647
E,Z-изомер), 6.23 д (H4, E,E-изомер,
126.9, 127.4, 127.5 (C4, E,E-изомер), 128.1, 128.2, 128.6,
3JHH = 10.0 Гц), 6.54-6.68 м, 6.84-6.93
128.7, 128.76, 128.79, 129.1, 129.2, 129.32, 129.34, 129.4,
м, 6.94-7.06 м, 7.11-7.46 м, 7.46-7.72
129.5, 129.7, 129.9, 130.3, 130.6, 131.3, 131.6, 133.4, 134.0,
м, 7.90-8.06 м
134.66, 134.72, 135.5, 136.5, 137.3, 137.6, 137.97, 138.04,
139.5, 140.0, 142.5, 150.1, 189.7 (C1, E,E-изомер), 189.9
(C1, E,Z-изомер)
13
2.36 с (Me, E,E-изомер), 2.40 с (Me,
21.6 (Me, E,E-изомер), 21.7 (Me, E,Z-изомер), 124.9, 127.5,
1649
E,Z-изомер), 6.64 д (H4, E,E-изомер,
127.8 (C4, E,E-изомер), 128.1, 127.79, 128.84, 128.87,
3JHH = 10.5 Гц), 7.08-7.24 м, 7.27-7.33
128.98, 129.02, 129.1, 129.5, 129.6, 129.7, 179.76, 129.83,
м, 7.34-7.48 м, 7.55-7.70 м, 7.82-7.88
129.2, 130.3, 130.4, 131.7, 134.7, 135.4, 135.5, 135.6, 137.6,
м, 7.90-8.04 м
139.4, 140.2, 141.9, 143.9, 144.2, 144.8, 149.5, 189.1 (C1,
E,E-изомер), 189.3 (C1, E,Z-изомер)
14а
6.62 д (H4, E,E-изомер, 3JHH = 10.5 Гц),
116.1, 116.3, 116.5, 124.5, 127.5 д (JCF = 7.0 Гц), 128.0 (C4,
1649
7.09-7.25 м, 7.25-7.49 м, 7.57-7.70 м,
E,E-изомер), 128.6, 128.9, 129.0 д (JCF = 7.5 Гц), 129.6,
7.94-8.15 м
129.7 д (JCF = 2.4 Гц), 129.8, 130.3, 131.6, 131.66 д (JCF
2.3 Гц), 131.74, 131.8, 134.5, 134.7, 134.66, 135.69, 137.6,
140.0 д (JCF = 26.9 Гц), 142.3, 145.4, 150.2, 164.1, 166.6,
188.2 (C1, E,E-изомер), 188.3 (C1, E,Z-изомер)
15
6.60 д (H4, E,E-изомер, 3JHH = 10.8 Гц),
124.3, 127.4, 127.6, 128.0 (C4, E,E-изомер), 128.5, 128.9,
1645
7.09-7.23 м, 7.27-7.49 м, 7.53-7.57 м,
129.0, 129.1, 129.3, 129.5, 129.6, 129.67, 129.73, 129.8,
7.58-7.70 м, 7.92-8.06 м
130.3, 130.4, 130.55, 130.60, 131.8, 134.4, 135.7, 136.58,
136.64, 137.5, 138.4, 138.6, 140.1, 140.2, 142.5, 145.7,
150.7, 188.5 (C1, E,E-изомер), 188.7 (C1, E,Z-изомер)
16
6.43 д (H4, Z,E-изомер, 3JHH = 15.9 Гц),
116.2 (C2, Z,E-изомер), 121.9 (C2, E,E-изомер), 126.4 (C4,
1620
6.67 с (H2, E,E-изомер), 7.10-7.17 м,
E,E-изомер), 127.1, 127.4, 127.9 (C4, Z,E-изомер), 128.0,
7.22-7.71 м, 7.74-7.81 м, 8.05 с (H2,
128.1, 128.6, 129.2, 129.26, 129.30, 129.4, 129.5, 129.7,
Z,E-изомер), 8.13-8.20 м, 8.26 д (H4,
129.9, 130.0, 130.2, 130.8, 133.2, 133.3, 133.6, 136.0, 136.1,
E,E-изомер, 3JHH = 16.0 Гц)
136.8, 137.2, 138.2, 138.6, 139.0, 155.4, 160.0, 187.4 (C1,
Z,E-изомер), 188.7 (C1, E,E-изомер)
17
6.42 д (H4, Z,E-изомер, 3JHH = 15.9 Гц),
116.7 (C2, Z,E-изомер), 122.2 (C2, E,E-изомер), 127.0 (C4,
1616
6.67 с (H2, E,E-изомер), 7.11-7.18 м,
E,E-изомер), 127.1, 128.1 (C4, Z,E-изомер), 128.6, 128.8,
7.24-7.72 м, 7.74-7.81 м, 8.03 с (H2,
129.0, 129.1, 129.26, 129.31, 129.34, 129.55, 129.66, 129.69,
Z,E-изомер), 8.10-8.19 м, 8.23 д (H4,
129.8, 130.3, 130.8, 132.3, 133.27, 133.31, 133.8, 134.4,
E,E-изомер, 3JHH = 16.2 Гц)
134.99, 135.03, 136.8, 137.1, 138.1, 138.9, 155.1, 159.7,
187.4 (C1, (Z,E)-изомер), 188.7 (C1, E,E-изомер)
18
7.02-7.28 м (11Н, HAr + H4 + H5), 7.32
124.8 (C2), 127.7, 128.0, 128.4, 128.6, 128.92, 128.94, 129.2,
1641
с (1Н, Н2), 7.42-7.50 м (3Н, HAr), 7.73-
129.5, 130.2, 130.9, 135.2, 136.2, 139.5, 142.7, 162.4, 187.9
7.83 м (3Н, HAr)
(C3)
19
7.03-7.09 м (2Н, HAr), 7.11-7.16 м (6Н,
114.4 д (JCF = 21.9 Гц), 116.9 д (JCF = 21.3 Гц), 124.2 (C2),
1643
HAr), 7.20-7.27 м (4Н, HAr + H4), 7.30
124.7 д (JCF = 2.7 Гц), 127.5, 128.0 д (JCF = 21.4 Гц), 128.4,
с (1Н, Н2), 7.46-7.53 (1Н, HAr), 7.57-
128.6, 129.6, 130.8 д (JCF = 8.4 Гц), 135.6, 137.4 д (JCF =
7.64 м (2Н, HAr), 7.76 д (1Н, H5, 3JHH =
8.0 Гц), 138.9, 140.6 д (JCF = 2.7 Гц), 161.7 д (JCF =
16.1 Гц)
95.4 Гц), 163.8, 187.2 (C3)
а Спектр ЯМР 19F, δF, м. д.: -106.2 (E,E-изомер), -105.8 (Z,E-изомер).
ровали методом ТСХ на пластинах Sorbfil, элю-
Использовали коммерчески доступный (Sigma
ент - EtOAc-гексан (1:5). Температуры плавления
Aldrich) селенофенол 1. Исходные ениноны 2-7, 9,
определяли в открытых капиллярах и не корректи-
10 получали по ранее разработанным методикам
ровали.
[22-24]. Метанол перед использованием сушили
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
240
ГУСЕВ и др.
Таблица 3. Цитотоксичность селеносодержащих диенонов 11-18
Доля выживших клеток, %а
№
A431
MCF7
T24
A375
HCT116
11
>99
42
83
61
>99
12
>99
>99
>99
>99
>99
13
>99
71
84
92
>99
14
>99
50
68
74
>99
15
27
47
14
54
95
16
>99
70
89
83
>99
17
>99
>99
>99
82
>99
18
42
57
84
55
87
а После 48 ч экспозиции в присутствии 30 мкМ. исследуемых соединений.
над молекулярными ситами (3 Å), Et3N перегоня-
20 мл насыщенного раствора NH4Cl. Эфирный
ли над KOH.
раствор отделяли, а водный экстрагировали эфи-
ром (3×20 мл). Объединенный эфирный раствор
1-Фенил-5-(4-фторфенил)пент-2-ен-4-ин-
1-он (5) получали по методике [24]. Выход 87%,
промывали раствором NaHCO3 и водой. После вы-
светло-желтые иглы, т. пл. 85-86°C (EtOH-H2O).
сушивания Na2SO4 и удаления растворителя полу-
Спектр ЯМР 1Н, δ, м. д.: 7.12-7.20 м (3H, HAr +
чили 1.87 г (~48%) сырого 1-фенил-5-(4-хлорфе-
H3), 7.35-7.44 (4H, HAr + H2), 7.53-7.55 (2H, HAr),
нил)пент-4-ен-2-ин-1-ола в виде коричневой вяз-
8.01-8.06 (2H, HAr). Спектр ЯМР 13С, δC, м. д.: 87.7
кой жидкости. К раствору 1.01 г (~3.76 ммоль) по-
(C5), 99.6 (C4), 115.9 д (JCF = 21.6 Гц), 122.2, 125.3,
лученного спирта в 8 мл ацетона добавляли 3.95 г
128.5, 129.3, 131.2 д (JCF = 9.4 Гц), 132.1, 132.6,
(45.5 ммоль) активного MnO2, приготовленного
133.6 д (JCF = 3.3 Гц), 165.8 (JCF = 254.8 Гц), 187.1
по методу [27]. Реакционную смесь перемеши-
(C1) [25]. Спектр ЯМР 19F: δF -105.4 м. д. Масс-
вали 4 ч, затем осадок MnO2 отфильтровывали,
спектр, m/z: 273.0683 [M + Na]+ (вычислено для
промывали ацетоном, и удаляли растворитель из
C17H11FNaO: 273.0692).
фильтрата. После перекристаллизации остатка из
смеси EtOH-H2O получили 410 мг (44 %) енинона
1-Фенил-5-(4-хлорфенил)пент-4-ен-2-ин-1-
8. Бесцветные иглы, т. пл. 93-95°C. ИК спектр, ν,
он (8). К раствору 14.5 ммоль EtMgBr в 15 абс.
см-1: 2180 (C≡C), 1632 (C=O). Спектр ЯМР 1Н, δ,
Et2O добавляли раствор
2.36 г
(14.5 ммоль)
м. д.: 6.38 д (1H, H5, 3JHH = 16.0 Гц), 7.26-7.37 м
1-(бут-1-ен-3-ин-1-ил)-4-хлорбензола, получен-
(1H, HAr), 7.37-7.48 м (4H, HAr + H4), 7.48-7.59 м
ного по методу [26], в равном объеме абс. Et2O.
(2H, HAr), 7.59-7.70 м (1H, HAr), 8.15-8.24 м (2H,
Полученную смесь кипятили 2 ч. К оранжевому
HAr). Спектр ЯМР 13С, δC, м. д.: 89.3 (C3), 92.3 (C2),
осадку комплекса Иоцича при перемешивании и
106.1, 128.1, 128.6, 129.3, 129.5, 133.7, 134.1, 136.0,
охлаждении до 3-5°C добавляли по каплям 1.53 г
136.9, 146.2, 177.8 (C1). Масс-спектр, m/z: 289.0387
(14.5 ммоль) свежеперегнанного бензальдегида
[M + Na]+ (вычислено для C17H11ClNaO: 289.0396).
в 12 мл абс. Et2O, после чего оставляли реакци-
онную смесь при комнатной температуре на 12 ч.
Общая методика селенирования сопря-
Осадок магниевого алкоголята енинола отделяли
женных енинонов
2-10. К раствору
183 мг
декантацией и промывали абс. Et2O (3×10 мл) для
(1.16 ммоль) бензоселенола 1 в 1 мл MeOH под
удаления непрореагировавших исходных соеди-
N2 добавляли раствор 1.16 ммоль соответству-
нений, после чего добавляли к осадку 20 мл Et2O
ющего енинона 2-10 в 3-4 мл MeOH и 2 капли
и при перемешивании гидролизовали алкоголят
(~0.5 ммоль) Et3N. Реакционную смесь перемеши-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
СИНТЕЗ И ЦИТОТОКСИЧНОСТЬ СЕЛЕНСОДЕРЖАЩИХ ДИЕНОНОВ
241
вали 15-20 мин, кристаллический осадок отфиль-
2.14 с (3Н, Ме), 4.67 д. д (1Н, 3JHH = 10.0, 6.3 Гц),
тровывали, промывали 1 мл холодного MeOH и
4.89 д. д (1Н, 3JHH = 10.0, 6.3 Гц).
сушили на воздухе.
Исследование цитотоксичности. Исполь-
1,5-Дифенил-5-(фенилселенил)пента-2,4-
зовали клеточные линии A431, MCF7 и T24, по-
диен-1-он (11). Продукт очищали методом коло-
лученные из Американской коллекции клеточ-
ночной хроматографии на силикагеле (элюент -
ных культур (ATCC). Культивирование клеток
смесь EtOAc-гексан). Выход 40%, желтые иглы.
производили в стандартных условиях (37°C, 5%
Соотношение изомеров (E,E):(E,Z) = 1.22:1.
CO2, влажность 95%), с применением следую-
5-(4-Метилфенил)-1-фенил-5-(фенил-
щих питательных сред: DMEM (Dulbecco’s modi-
fied Eagle’s medium), дополненная 10% FBS (fetal
селенил)пента-2,4-диен-1-он (12). Продукт очи-
щали методом колоночной хроматографии на си-
bovine serum) для A431; DMEM, дополненная
ликагеле (элюент - смесь EtOAc-гексан). Выход
10% FBS и 0.01 мг/мл инсулина для MCF7; среда
44%, желтые кристаллы. Соотношение изомеров
McCoy’s 5a, дополненная 10% FBS для T24. Все
(E,E):(E,Z) = 1.24:1.
среды дополнительно содержали пенициллин
(50 Ед/мл), гентамицин (25 мкг/мл), амфотерицин
1-(4-Метилфенил)-5-фенил-5-(фенил-
В 1 (мкг/мл) и глютамин (5 мг/мл).
селенил)пента-2,4-диен-1-он (13). Выход 50%,
желтые иглы. Соотношение изомеров (E,E):(E,Z) =
МТТ-Тест выполняли следующим образом: в
1.38:1.
384-луночный планшет (Greiner) вносили 30 мкл
суспензии клеток (2000 клеток на лунку) в соот-
5-Фенил-5-(фенилселенил)-1-(4-фторфенил)-
ветствующей питательной среде. Планшеты куль-
пента-2,4-диен-1-он (14). Выход 53%, желтые
тивировали в стандартных условиях 24 ч для при-
иглы. Соотношение изомеров (E,E):(E,Z) = 1.84:1.
крепления клеток, после чего добавляли в каждую
5-Фенил-5-(фенилселенил)-1-(4-хлорфенил)-
ячейку по 30 мкл раствора исследуемого соедине-
пента-2,4-диен-1-он (15). Выход 68%, желтые
ния (60 мкмоль/л) в питательной среде и инкуби-
иглы. Соотношение изомеров (E,E):(E,Z) = 1.83:1.
ровали еще 48 ч. Далее в каждую ячейку добавля-
1,5-Дифенил-3-(фенилселенил)пента-
ли 10 мкл раствора МТТ (5 мкг/мл) и инкубирова-
2,4-диен-1-он (16). Выход 81%, желтые иглы.
ли 4 ч. Образовавшиеся кристаллы формазана рас-
Соотношение изомеров (E,E):(Z,E) = 1:2.47.
творяли в ДМСО (60 мкл) и фотометрировали на
1-Фенил-3-(фенилселенил)-5-(4-хлорфенил)
планшетном ридере (GloMax Multi+) при 560 нм.
пента-2,4-диен-1-он (17). Выход 71%, желтые
Все эксперименты производили в трех независи-
кристаллы. Соотношение изомеров (E,E):(Z,E) =
мых повторах, расчет выживаемости клеток про-
1:2.40.
изводили относительно необработанных клеток.
(Z,E)-1,5-Дифенил-1-(фенилселенил)пента-
ФОНДОВАЯ ПОДДЕРЖКА
1,4-диен-3-он (18). Выход 71%, желтые кристаллы
Исследование выполнено при финансовой
[28].
поддержке Российского научного фонда (грант
(Z,E)-1-Фенил-1-(фенилселенил)-5-(3-
№ 18-13-00008).
фторфенил)-пента-1,4-диен-3-он
(19).
Выход
91%, желтые кристаллы.
КОНФЛИКТ ИНТЕРЕСОВ
1,5-Дифенил-3-(фенилселенил)пент-4-ин-1-
Авторы заявляют об отсутствии конфликта
он (20). Охарактеризован в виде минорной приме-
интересов.
си в соединении 11. Выход ~9%. Спектр ЯМР 1Н,
СПИСОК ЛИТЕРАТУРЫ
δ, м. д. (некоторые сигналы): 4.68 д. д (1Н, 3JHH =
10.0, 6.3 Гц), 4.88 д. д (1Н, 3JHH = 10.0, 6.3 Гц).
1. Organoselenium Chemistry: Synthesis and Reactions /
Ed. T. Wirth. Weinheim: Wiley VCH Verlag GmbH,
5-(4-Метилфенил)-1-фенил-3-(фенил-
селенил)пент-4-ин-1-он (21). Охарактеризован в
2012. 462 p. doi 10.1002/9783527641949
виде минорной примеси в соединении 12. Выход
2. Rocha J.B.T., Piccoli B.C., Oliveira C.S. // Arkivoc.
~8%. Спектр ЯМР 1Н, δ, м. д. (некоторые сигналы):
2017. Vol. ii. P. 457. doi 10.24820/ark.5550190.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
242
ГУСЕВ и др.
p009.784
Chem. 2003. Vol. 679. N 2. P. 162. doi 10.1016/S0022-
328X(03)00546-1
3. Młochowski J., Kloc K., Lisiak R., Potaczek P.,
16. Kawaguchi S., Kotani M., Atobe S., Nomoto A., Sonoda M.,
Wójtowicz H. // Arkivoc. 2007. Vol. vi. P. 14. doi
Ogawa A. // Organometallics. 2011. Vol. 30. N 24. P.
10.3998/ark.5550190.0008.603
6766. doi 10.1021/om200663k
4. Petragnani N., Stefani H.A., Valduga C.J. // Tetrahedron.
17. Ishii A., Kamon H., Murakami K., Nakata N. //
2001. Vol. 57. N 8. P. 1411. doi 10.1016/S0040-
Eur. J. Org. Chem. 2010. N 9. P. 1653. doi 10.1002/
4020(00)01033-4
ejoc.200901408
5. Nowak P., Saluk-Juszczak J., Olas B., Kołodziejczyk J.,
18. Nakata N., Ikeda T., Ishii A. // Inorg. Chem. 2010. Vol.
49. N 17. P. 8112. doi 10.1021/ic1011742
Wachowicz B. // Cell. Mol. Biol. Lett. 2006. Vol. 11.
19. Колос Н.Н., Комыхов С.А. // ХГС. 2019. Т. 55. №
N 1. P. 1. doi 10.2478/s11658-006-0001-y
4-5. С. 312; Kolos N.N., Komykhov S.A. // Chem.
6. Wang L., Yang Z., Fu. J., Yin H., Xiong K., Tan Q.,
Heterocycl. Compd. 2019. Vol. 55. N 4-5. P. 312. doi
Jin H., Li J., Wang T., Tang W., Yin J., Cai G., Liu M.,
10.1007/s10593-019-02460-2
Kehr S., Becker K., Zeng H. // Free Rad. Biol.
20. Голованов А.А., Бекин В.В., Один И.С., Чертов А.Ю.,
Med. 2012. Vol. 52. N 5. P. 898. doi 10.1016/j.
Григорьева О.Б., Писарева В.С. // ЖОрХ. 2015. Т. 51.
freeradbiomed.2011.11.034
№ 12. С. 1723; Golovanov A.A., Bekin V.V., Odin I.S.,
7. Brozmanová J., Mániková, Vlčková V., Chovanec M. //
Chertov A.Yu., Grigor’eva O.B., Pisareva V.S. // Russ.
J. Org. Chem. 2015. Vol. 51. N 12. P. 1688. doi 10.1134/
Arch. Toxicol. 2010. Vol. 84. N 12. P. 919. doi 10.1007/
S1070428015120039
s00204-010-0595-8
21. Стацюк В.Е., Краснов В.Л., Коршунов С.П., Бодри-
8. Tiekink E.R.T. // Dalton Trans. 2012. Vol. 41. N 21.
ков И.В. // ЖОрХ. 1983. Т. 19. № 3. С. 468.
P. 6390. doi 10.1039/C2DT12225A
22. Голованов А.А., Латыпова Д.Р., Бекин В.В., Писаре-
9. Saluk-Juszczak J., Wachowicz B., Wójtowicz, Kloc K.,
ва В.С., Вологжанина А.В., Докичев В.А. // ЖОрХ.
Bald E., Glovawacki R. // Cell. Biol. Toxicol. 2006.
2013. Т. 49. № 9. С. 1282; Golovanov A.A., Latypova D.R.,
Vol. 22. N 5. P. 323. doi 10.1007/s10565-006-0091-3
Bekin V.V., Pisareva V.S., Vologzhanina A.V., Doki-
chev V.A. // Russ. J. Org. Chem. 2013. Vol. 49. N 9.
10. Sakurai T., Kanayama M., Shibata T., Itoh K., Kobayashi A.,
P. 1264. doi 10.1134/S1070428013090030
Yamamoto M. Uchida K. // Chem. Res. Toxicol. 2006.
23. Vologzhanina A.V., Golovanov A.A., Gusev D.M.,
Vol. 19. N 9. P. 1196. doi 10.1021/tx0601105
Odin I.S., Apreyan R.A., Suponitsky K.Yu. // Crystal
11. Голованов А.А., Гусев Д.М., Вологжанина А.В., Бе-
Growth Design. 2014. Vol. 14. N 9. P. 4402. doi
кин В.В., Писарева В.С. // ЖОрХ. 2014. Т. 50. № 1.
10.1021/cg500512e
С. 21; Golovanov A.A., Gusev D.M., Vologzhanina A.V.,
24. Утехина Н.В., Коржова Н.В., Казанцева В.М., Су-
Bekinn V.V., Pisareva V.S. // Russ. J. Org. Chem. 2014.
ров Ю.Н., Орлов В.Д., Коршунов С.П. // ЖОХ. 1988.
Vol. 50. N 1. P. 13. doi 10.1134/S1070428014010035
Т. 58. № 3. С. 692.
12. Голованов А.А., Гусев Д.М., Злотский С.С. // ЖОрХ.
2016. Т. 52. № 8. С. 1212; Golovanov A.A., Gusev D.M.,
25. Chinta B.S., Baire B. // J. Org. Chem. 2015. Vol. 80.
Zlotskii S.S. // Russ. J. Org. Chem. 2016. Vol. 52. N 8.
N 20. P. 10208. doi 10.1021/acs.joc.5b01780
P. 1205. doi 10.1134/S1070428016080194.
26. Marvell E.N., Caple G., Delphey C., Platt J., Polston N.,
13. Tanini D., Scarpelli S., Ermini E., Capperucci A. // Adv.
Tashiro J. // Tetrahedron. 1973. Vol. 29. N 23. P. 3797.
Synth Catal. 2019. Vol. 361. N 10. P. 2337. doi 10.1002/
doi 10.1016/0040-4020(73)80197-8
adsc.201900168
27. Attenburrow J., Cameron A.F.B., Campton J.H.,
14. Battistelli B., Lorenzo T., Tiecco M., Santi C. // Eur.
Evans R.M., Jansen A.B.A., Walker T. // J. Chem. Soc.
J. Org. Chem. 2011. N 10. P 1848. doi 10.1002/
1952. P. 1094. doi 10.1039/JR9520001094
ejoc.201100045
28. Панов А.М., Ратовский Г.В., Кипович Т.В., Филип-
15. Ananikov V.P., Malyshev D.A., Beletskaya I.P.,
пова Т.М., Бузилова С.Р. // ЖОХ. 1982. Т. 52. № 8.
Aleksandrov G.G., Eremenko I.L. // J. Organomet.
С. 1761.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
СИНТЕЗ И ЦИТОТОКСИЧНОСТЬ СЕЛЕНСОДЕРЖАЩИХ ДИЕНОНОВ
243
Synthesis and Cytotoxicity of Selenium-Containing Dienones
D. M. Gusev, A. S. Bunev, and A. A. Golovanov*
Togliatti State University, Togliatti, 445020 Russia
* e-mail: aleksandgolovanov@yandex.ru
Received July 19, 2019; revised July 19, 2019; accepted July 25, 2019
The nucleophilic addition of benzoselenol occurs regioselectively at the β-carbon of the triple bond of 1,5-disub-
stituted pent-2-ene-4-yne-1-ones, pent-4-ene-2-yne-1-ones and pent-1-ene-4-yne-3-ones. The resulting seleni-
um-containing conjugated dienones exhibit pronounced cytotoxicity against some tumor cell lines.
Keywords: selenium-containing dienones, conjugated eninones, benzoselenol, nucleophilic addition, cytotox-
icity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020