ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 2, с. 244-249
К 80-летию со дня рождения Р.А. Черкасова
УДК 547.879;548.737
СИНТЕЗ НОВЫХ 1,3,5-АЗАДИФОСФОРИНАНОВ
НА ОСНОВЕ АЛИФАТИЧЕСКИХ АМИНОВ
© 2020 г. Э. И. Мусина*, Л. И. Мусин, И. А. Литвинов, А. А. Карасик
Институт органической и физической химии имени А. Е. Арбузова, Федеральный исследовательский центр
«Казанский научный центр Российской академии наук», ул. Академика Арбузова, 8, Казань, 420088 Россия
*e-mail: elli@iopc.ru
Поступило в Редакцию 12 июля 2019 г.
После доработки 12 июля 2019 г.
Принято к печати 18 июля 2019 г.
Взаимодействием бис(фенилфосфанил)метана, параформальдегида, изопропиламина и бензгидриламина
синтезированы новые 1-аза-3,5-дифосфоринаны в виде смеси RR/SS- и RS-изомеров.
Ключевые слова: шестичленные гетероциклы, дифосфины, аминометилфосфин, 1-аза-3,5-дифосфо-
ринан
DOI: 10.31857/S0044460X20020092
Химия циклических аминометилфосфиновых
термодинамически выгодного соединения. В то
лигандов, содержащих дифосфиновый фрагмент,
же время существуют так называемые кинетиче-
способный к хелатному связыванию с ионами
ские ловушки, когда под воздействием внешних
переходных металлов, и внутрициклическую ос-
факторов или за счет меньшей растворимости из
новную аминогруппу, взаимодействующую с
динамической системы выделяются продукты ки-
протоном/водородом на различных стадиях ката-
нетического контроля. В частности, исследование
литических процессов, вызывает значительный
взаимодействия
1,n-бис(арилфосфино)алканов
интерес с момента обнаружения высокой ката-
(n = 2-5) c формальдегидом и первичными аминами
литической активности их комплексов с неблаго-
показало, что во всех случаях основными продук-
родными переходными металлами (Ni, Co, Fe) в
тами реакции являются P4N2-макроциклические
процессах электрохимического синтеза водоро-
14-, 16-, 18- и 20-членные аминометилфосфины
да и его окисления в топливных элементах [1-4].
соответственно [8, 9]. Однако в случае n = 2 обра-
Основным подходом к синтезу таких лигандов яв-
зующиеся 14-членные макроциклы являются про-
ляется реакция конденсации в трехкомпонентной
дуктами кинетического контроля и при растворе-
системе, содержащей PH-фосфин или бисфосфин,
нии претерпевают достаточно быстрое обратимое
формальдегид и вторичный амин или бисамин [5].
превращение в 7-членные циклы [10-12]. При n =
Данный подход позволил получать циклические
3-5 макроциклы являются термодинамически бо-
и макроциклические аминометилфосфины разно-
лее устойчивыми, чем конкурирующие с ними 8-,
го строения, с различным количеством донорных
9- и 10-членные циклы, и при растворении претер-
центров и т. д. Вышеуказанные реакции, всегда
певают частичную стереоизомеризацию, а превра-
сопровождающиеся образованием лабильного
щение в 8-членные циклы наблюдается только для
PCH2N-фрагмента, являются объектами динами-
16-членных циклов (n = 3) в небольшом количе-
ческой ковалентной химии [6, 7], и предполагают
стве [13, 14]. Оказалось, что природа первичного
образование динамической системы из взаимо-
амина также влияет на структуру образующегося
превращающихся продуктов, которые в конеч-
продукта. Так, реакции 1,n-бисарилфосфиноалка-
ном итоге приводят к выделению одного самого
нов, где n = 2, 3, с формальдегидом и первичными
244
СИНТЕЗ НОВЫХ 1,3,5-АЗАДИФОСФОРИНАНОВ
245
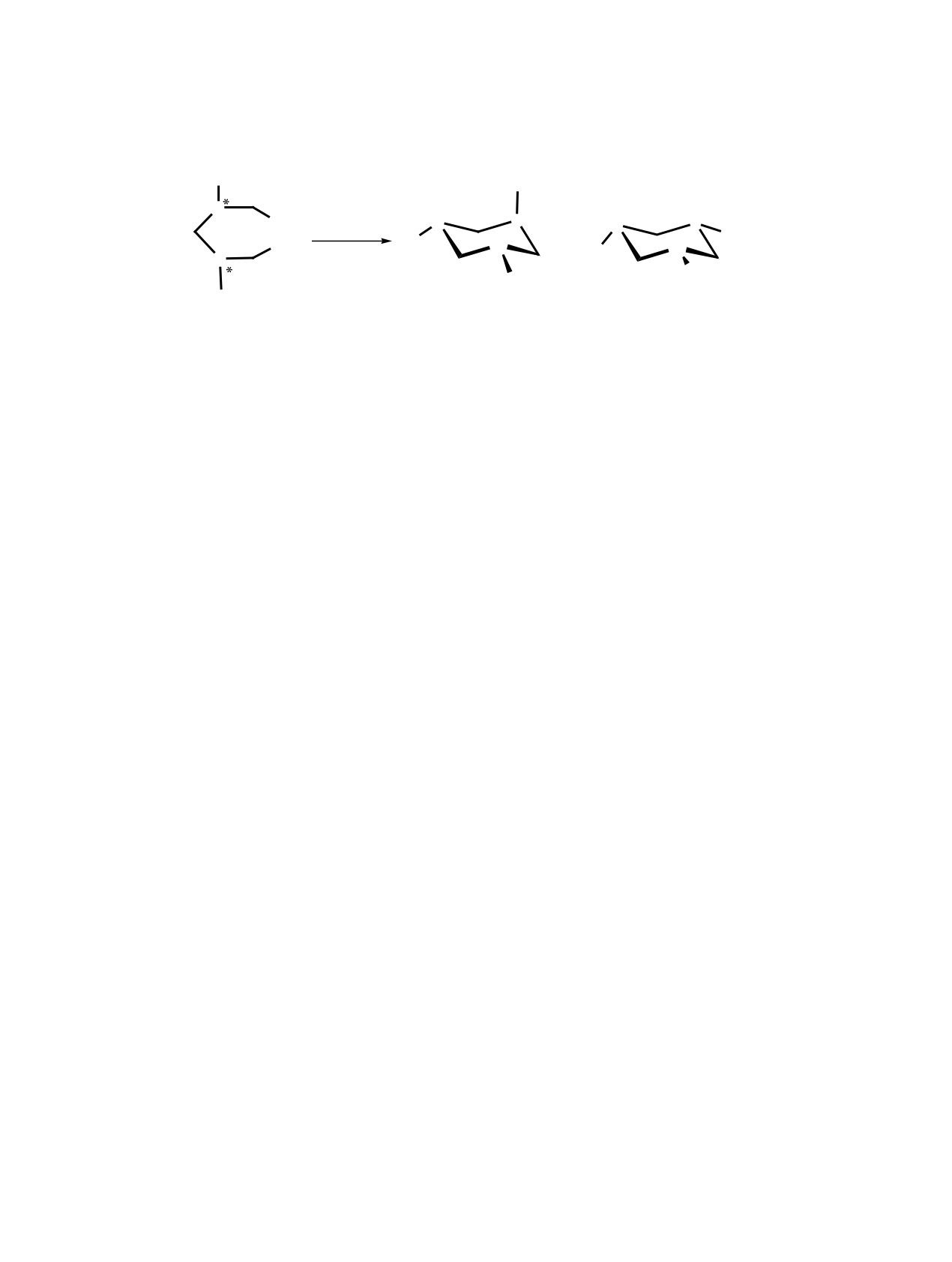
Схема 1.
Ph
Ph
P
OH
P
P
P
P
H2N R
Ph
Ph
+
OH
N
Ph
N
EtOH
P
R
R
Ph
1a, 2a
ɛ, ɛ
RR/SS
RS
R = ɋHMe2 (1), CHPh2 (2).
ариламинами всегда приводят к образованию 7- и
тана и параформа, с изопропиламином и бензги-
8-членных циклов соответственно [15-17], тог-
дриламином, значительно преобладали два узких
да как переход к более основным алифатическим
сигнала в области -40÷-50 м. д. с близким соот-
аминам (алкил- и бензиламинам для n = 3) или
ношением интегральных интенсивностей, свиде-
только алкиламинам (n = 2) способствует образо-
тельствующих об образовании двух диастереоме-
ванию макроциклических продуктов [10-14].
ров. В целом картина спектров ЯМР 31Р близка
к описанной ранее для смеси мезо- и рац-изоме-
Взаимодействие бис(фенилфосфанил)метана
ров 1,3,5-азадифосфоринанов [18]. Выделенные
(n = 1) с параформальдегидом и аминами впервые
в виде прозрачной вязкой смолы соединение 1 и
было изучено нами на основе ароматических ами-
в виде белых кристаллов соединение 2 представ-
нов - п-толуидина и анилина [18]. Как и для реак-
ляли собой также смесь диастереомеров, о чем
ций с бисфосфинами (n = 2, 3), в результате вза-
свидетельствовало наличие двойного набора сиг-
имодействия образовывались лишь соответствую-
налов в спектрах ЯМР. Следует отметить двукрат-
щие 1,3,5-азадифосфоринаны в виде смеси мезо- и
ное преобладание RR/SS-изомера в выделенном
рац-изомеров, причем RR/SS-изомер преобладал.
продукте 2, который в отличие от рац-изомеров
Обладая меньшей растворимостью, в чистом виде
арилзамещенных
1,3,5-азадифосфоринанов
[18]
из реакционной смеси выделялся лишь RS-изомер.
обладает меньшей растворимостью по сравнению
Однако до настоящего времени реакция конденса-
с мезо-формой. Хорошо известно, что диастерео-
ции бис[гидроксиметил(фенил)фосфанил]метана
меры обладают различными физико-химическими
с высокоосновными алифатическими аминами
свойствами, и поэтому достаточно легко подда-
не исследовалась, и оставался открытым вопрос,
ются разделению. Так, методом дробной кристал-
какие продукты будут образовываться в этом слу-
лизации удалось выделить рац-изомер 2а в прак-
чае - 6- или 12-членные циклы? Следует отметить,
тически чистом виде. Вычитание спектральных
что в литературе представлен лишь единичный
данных индивидуального изомера 2а из спектра
пример синтеза тетрафосфинового 12-членного
смеси изомеров позволило отнести сигналы, от-
коранда как побочного продукта при получении
носящиеся к соединению 2б. Оказалось, что, как
оптически активного полифосфина окислитель-
и в случае арилзамещенных 1,3,5-азадифосфо-
ным сочетанием хиральных борановых комплек-
ринанов, сигналы рац-изомера регистрируются в
сов метилфосфиновых олигомеров [19].
спектрах ЯМР 31Р в более слабом поле при -39.8 и
Для изучения влияния основности аминов на
-39.7 м. д. для соединений 1а и 2а соответственно,
протекание этой реакции конденсации в данной
тогда как для мезо-изомеров 1б и 2б - при -45.7
работе были исследованы представители алкил- и
и -50.9 м. д. соответственно. Положение сигна-
бензилзамещенных аминов, в частности, изопро-
лов протонов и общий вид спектра в области ре-
пиламин и бензгидриламин (схема 1).
гистрации метиленовых протонов цикла для каж-
В спектрах ЯМР 31P{1H} реакционных сме-
дого соответствующего изомера соединений 1 и 2
сей бис[гидроксиметил(фенил)фосфанил]метана,
очень схожи, что позволяет сделать вывод об их
полученного in situ из бис(фенилфосфанил)ме-
близкой структуре. Во всех случаях метиленовые
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
246
МУСИНА и др.
Как уже упоминалось выше, в спектрах реак-
ционных смесей значительно преобладали сигна-
лы шестичленных циклов, наличие других слабых
сигналов в этой же области могло свидетельство-
вать об образовании других циклических, в том
числе макроциклических, продуктов. Однако все
попытки сместить равновесие в сторону образо-
вания других продуктов (в частности, изменение
условий реакции, порядка смешивания, раствори-
телей) не приводило к желаемому результату, что
свидетельствует о значительном термодинамиче-
ском преимуществе 6-членных циклов по сравне-
нию с другими продуктами реакции. Растворение
образца соединения 2, содержащего около 85% RR/
SS-изомера и 15% RS-изомера в дейтеробензоле и
мониторинг образца в течение 1 месяца не показа-
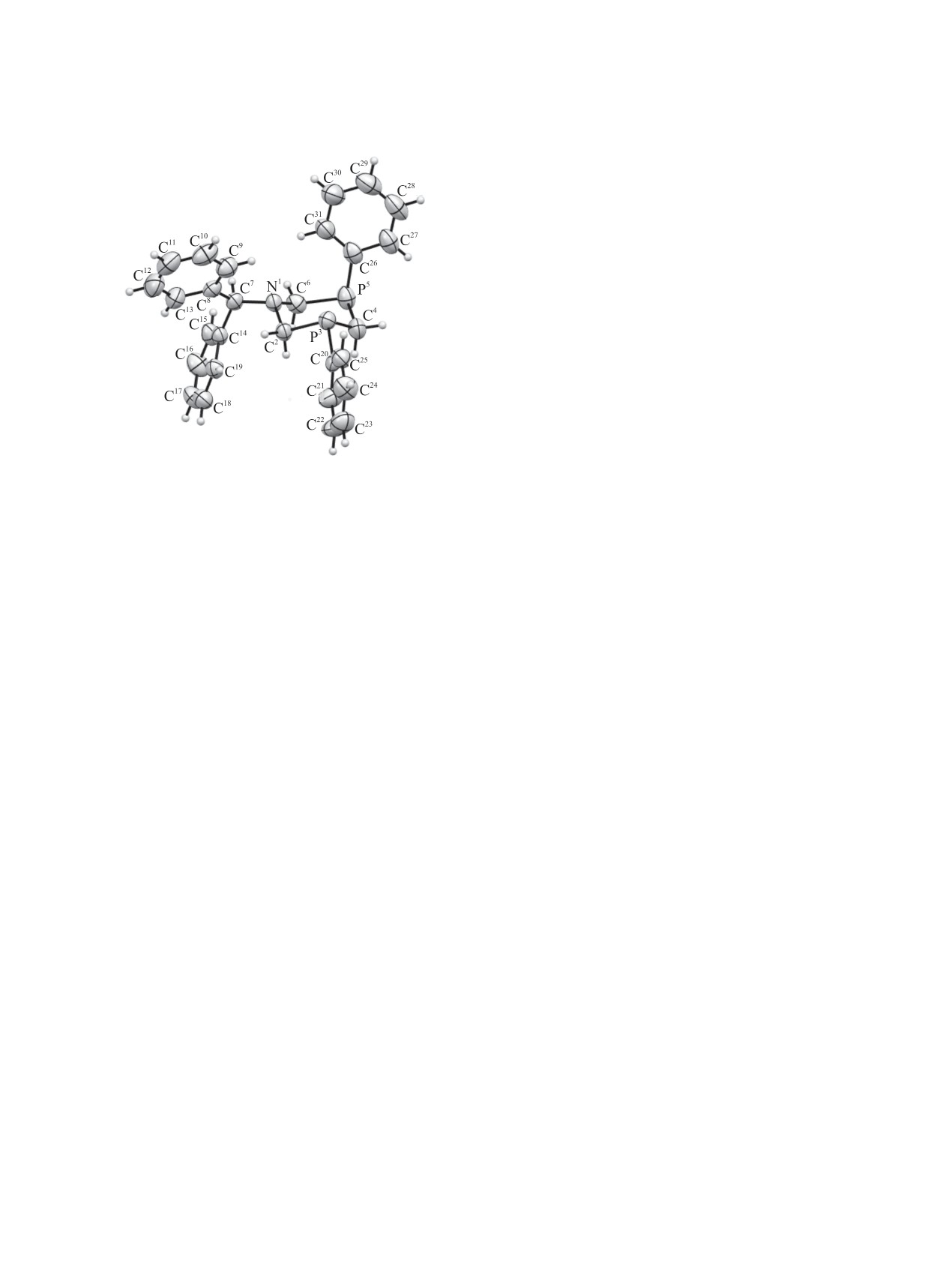
Общий вид молекулы RR/SS-изомера 2а в кристалле
ли изменений в изомерном составе, что свидетель-
(CCDC 1938348). Эллипсоиды тепловых колебаний
приведены с вероятностью 50%.
ствует о термодинамической предпочтительности
RR/SS-изомера. Следует отметить, что, согласно
протоны цикла неэквивалентны и описываются в
квантово-химическим расчетам, рац-форма явля-
виде AA'BB' (AA'XX') системы. Стоит отметить
ется более предпочтительной и для других несим-
значительное отличие положения сигналов мети-
метричных среднециклических аминометилфос-
леновых протонов цикла для разных изомеров. В
финов [15].
частности, в случае рац-изомера протоны PCH2P-
Таким образом, показано, что взаимодействие
фрагмента регистрируются в виде одной группы
бис[гидроксиметил(фенил)фосфанил]метана с вы-
сигналов в более сильном поле при 2.02-2.04 м. д.,
сокоосновными алифатическими аминами приво-
тогда как в случае мезо-изомера они регистриру-
ются в виде двух групп сигналов при 2.08-2.09
дит исключительно к 1,3,5-азадифосфоринанам, а
и 2.26-2.28 м. д. Протоны PCH2N-фрагмента для
не к потенциально возможным 12-членным 1,7-ди-
рац-изомеров регистрируются в виде одной груп-
аза-3,5,9,11-тетрафосфоациклододеканам, причем
пы сигналов при 2.84-2.88 м. д. (1а) или в виде
более термодинамически устойчивым является
двух групп сигналов при 2.85 и 3.07 м. д. (2а), тог-
рац-изомер с анти-расположением неподеленных
да как эти же протоны в мезо-изомерах проявля-
электонных пар хиральных атомов фосфора.
ются при 2.42 и 3.09-3.15 м. д. (1б), 2.62 и 3.53-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
3.61 м. д. (2б).
Структура RR/SS-изомера 2а подтверждена дан-
Реакции проведены в атмосфере чистого су-
ными РСА (см. рисунок). Действительно, соедине-
хого аргона или азота. Спектры ЯМР сняты на
ние 2а представляет собой (RR/SS)-изомер 1-бен-
спектрометре MSL-400 Bruker при 400 (1H) или
згидрил-3,5-дифенил-1-аза-3,5-дифосфоринана,
161 MГц (31P). Масс-спектры ионизации электро-
в котором два атома фосфора имеют одинаковую
распылением (ESI) получены на масс-спектро-
конфигурацию. Гетероцикл имеет характерную
метре AmazonX (Bruker Daltonik GmbH, Бремен,
для шестичленных циклов конформацию кресло,
Германия). Измерения проводили в режиме реги-
при этом один из фенильных заместителей при
страции положительных ионов в диапазоне m/z от
атомах фосфора расположен аксиально, а другой -
300 до 1000.
экваториально (что и обеспечивает одинаковую
конфигурацию атомов фосфора). Атом азота имеет
Рентгеноструктурный анализ кристаллов сое-
тригонально-пирамидальную конфигурацию (сум-
динения 2a проведен на автоматическом дифрак-
ма углов составляет 336.16°), бензгидрильный за-
тометре Bruker Smart APEX II CCD [графитовый
меститель расположен экваториально.
монохроматор, λ(MoKα) = 0.71073 Å, ω-сканиро-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
СИНТЕЗ НОВЫХ 1,3,5-АЗАДИФОСФОРИНАНОВ
247
вание, 296(2) K]. Монокристаллы соединения 2а
м (6H + 6Н, о,п-СН, рац + мезо), 3.09-3.15 м (2Н,
получены перекристаллизацией из смеси дихлор-
PCH2N, мезо), 2.84-2.88 м (2H +2H + 1Н, PCH2N-
метан-этанол. Проведен полуэмпирический учет
рац + PCH2N-мезо + СH-мезо, 3JHH = 6.6), 2.69 м
поглощения с помощью программы SADABS [20].
(1Н, СH-рац, 3JHH = 6.6), 2.44 уш. д (2Н, PCH2N-
Структура расшифрована прямым методом по
рац, 2JHH = 11.9), 2.24 уш. д (1Н, РСН2-мезо, 2JHH =
программе SHELXT 2014/4 [21] и уточнена вна-
10.9), 2.02-2.08 м (2Н +1H, PCH2, рац + мезо),
чале в изотропном, затем в анизотропном прибли-
0.87 д (6Н, СH3-рац, 3JHH = 6.6), 0.85 д (3Н, СH3-
жении по программе SHELXL-2018/3 [22]. Атомы
мезо, 3JHH = 6.9), 0.82 д (3Н, СH3-мезо, 3JHH = 6.6).
водорода помещены в геометрически рассчитан-
Спектр ЯМР 31P (C6D6), δP, м. д.: -39.8 (рац), -45.7
ные положения и включены в уточнение по моде-
(мезо) (рац:мезо = 0.92:1). Масс-спектр (ESI), m/z
ли наездника. Все расчеты проведены с помощью
(Iотн, %): 315.1 (100.0) [M]+. Найдено, %: C 68.62;
программ WinGX [23] и APEX2[24]. Все рисунки и
H 7.28; N 4.48; P 19.43. C18H23NP2. Вычислено, %:
анализ межмолекулярных взаимодействий выпол-
C 68.56; H 7.35; N 4.44; P 19.64.
нены с помощью программ PLATON [25].
1-Бензгидрил-3,5-дифенил-1-аза-3,5-дифос-
Кристаллы соединения 2a бесцветные, моно-
форинан (2). К раствору бис(гидроксиметилфос-
клинные, C28H27N1Р2, M = 439.45; параметры эле-
фанил)метана, полученного нагреванием смеси
ментарной ячейки: a = 27.72(2) Å, b = 9.496(7) Å,
0.77 г (3.3 ммоль) бис(фенилфосфанил)метана и
c = 18.560(16) Å, β = 103.72(2)°, V = 4746(6) Å3,
0.2 г (6.7 ммоль) параформальдегида при 110°С
dвыч = 1.230 г/см3, Z = 8, пространственная группа
до гомогенизации раствора, в 10 мл этанола до-
C2/c. Угол сканирования 1.5° < θ < 26.00°, μ(Mo) =
бавляли бензгидриламин (0.67 г, 3.7 ммоль) в 5 мл
0.199 мм-1. Измерено 13321 отражение, 4471 не-
спирта. Реакционную смесь нагревали при 60°С в
зависимое отражение, 2307 из которых с I ≥ 2σ.
течение 15 ч. После охлаждения белые кристаллы
Окончательные значения факторов расходимости:
отфильтровывали, промывали этанолом и суши-
R = 0.0747 и Rw = 0.1691 по наблюдаемым рефлек-
ли в вакууме. Выход 1.2 г (82%). Спектр ЯМР 1H
сам с F > 2σ(F2), R = 0.1334 и Rw = 0.2118 по всем
(C6D6), δ, м. д. (J, Гц): 7.52 д. м (4H, м-СН, мезо,
4471 отражениям, параметр подгонки 0.93.
3JHH = 8.0), 7.50 д. м (4H, м-СН, рац, 3JHH = 6.7,
Рентгеноструктурное исследование выполнено
3JHH = 6.6), 7.28 уш. д (2H + 2Н, Ph, рац + мезо),
в Федеральном спектроаналитическом центре кол-
7.22 уш. д (2H + 2Н, Ph, рац + мезо), 6.96-7.17 м
лективного пользования Института органической
(12H, Ph, рац + мезо), 5.14 с (1Н, Bzh, мезо), 4.42
и физической химии им. А.Е. Арбузова Казанского
с (1Н, Bzh, рац), 3.53-3.61 м (2Н, PCH2N, мезо),
научного центра РАН на базе Лаборатории диф-
3.07 д. д (2H, PCH2N-рац, 3JHH ≈ 2JPH ≈ 13.5), 2.85
ракционных методов исследования.
уш. д (2H, PCH2N-рац, 3JHH ≈ 13.5), 2.62 уш. д (2Н,
1-Изопропил-3,5-дифенил-1-аза-3,5-
PCH2N-мезо, 2JHH = 12.5), 2.26 уш. д (1Н, РСН2-
дифосфоринан (1). К раствору бис(гидроксиме-
мезо, 2JHH = 11.0), 2.09 д. д. д (1Н, РСН2-мезо, 2JHH =
тилфосфанил)метана, полученного нагреванием
11.0, 2JPH ≈ 2JPH ≈ 5.0), 2.04 д. д. д (2Н, PCH2-рац,
смеси 1.74 г (7.5 ммоль) бис(фенилфосфанил)ме-
2JНH = 13.5, 2JPH = 6.3, 2JPH = 1.7). Спектр ЯМР
тана и 0.45 г (15.0 ммоль) параформальдегида при
13С{1H} (C6D6), δС, м. д. (J, Гц): 142.2 д (ипсо-СN,
110°С до гомогенизации раствора, в 10 мл ДМФА
рац, 3JPС = 2.2), 141.47 (ипсо-СN, мезо), 139.62 д. д
добавляли изопропиламин (0.44 г, 7.5 ммоль) в
(ипсо-СР, мезо, 1JPС = 5.1, 3JPС = 3.9), 139.40 д. д
5 мл ДМФА. Реакционную смесь нагревали при
(ипсо-СР, рац, 1JPС = 18.8, 3JPС = 1.3), 132.25 д. д.
60°С в течение 15 ч. После охлаждения смесь пе-
(o-СPhP, рац, 2JPС = 17.3, 4JPС = 1.2), 131.38 д. д
ремешивали еще в течение 48 ч. После полного
(o-СPhP, мезо, 2JPС = 4JPС = 8.9), 128.90 (о-СPhС, рац),
удаления растворителя образовалось белое про-
128.8 д (м-СPhP, рац, 3JPС = 2.0), 128.7 (м,п-СPhС,
зрачное масло, представляющее собой смесь RR/
рац), 128.2 (м,п-СPhС, рац), 127.42 д (п-СPhP, рац,
SS(рац)- и RS(мезо)-изомеров соединения 1. Выход
4JPС = 4.2), 128.2-128.6 м (м,п-СPhP + о,м,п-СPhС,
2.10 г (89%). Спектр ЯМР 1H (C6D6), δ, м. д. (J, Гц):
мезо, перекрывается с сигналом растворителя),
7.31-7.38 м (4H + 4Н, м-СН, рац + мезо), 7.07-7.20
127.5 (м,п-СPhС, мезо) , 78.64 д. д (СHPh, рац, 3JPC =
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
248
МУСИНА и др.
5.36, 3JPC = 5.39), 76.21 д. д (СHPh, мезо, 3JPC =
sik A.A., Sinyashin O.G. // Dalton Trans. 2015. Vol. 44.
9.8, 3JPC = 9.8), 56.28 д. д (PСH2N, мезо, 2JPC =
N 30. P. 13565. doi 10.1039/C5DT01910A
11. Wittmann T.I., Musina E.I., Krivolapov D.B., Litvi-
5.15, 2JPC = 5.14), 53.41 д (PСH2N, рац, 2JPC =
nov I.A., Kondrashova S.A., Latypov Sh.K., Kara-
13.2), 25.99 д. д (PCH2P, мезо, 2JPC = 23.8, 2JPC =
sik A.A., Sinyashin O.G. // Dalton Trans. 2017. Vol. 46.
23.7), 17.8 д. д (PCH2P, рац, 2JPC = 29.0, 2JPC =
N 37. P. 12417. doi 10.1039/C7DT03010J
28.9).. Спектр ЯМР 31P (C6D6), δP, м. д.: -39.6
12. Musina E., Wittmann T., Latypov S., Kondrashova S.,
(рац), -51.1 (мезо) (рац:мезо = 2:1). Масс-спектр
Lönnecke P., Litvinov I., Hey-Hawkins E., Karasik A. //
(ESI), m/z (Iотн, %): 439.2 (100.0) [M]+. Найдено,
Eur. J. Inorg. Chem. 2019. doi 10.1002/ejic.201900386
%: C 76.39; H 6.14; N 3.21; P 14.13. C28H27NP2.
13. Musina E.I., Naumov R.N., Kanunnikov K.B., Dobry-
Вычислено, %: C 76.52; H 6.19; N 3.19; P 14.10.
nin A.B., Gomez-Ruiz S., Loennecke P., Hey-Hawkins
Перекристаллизацией из смеси CH2Cl2-C2H5OH
E., Karasik A.A., Sinyashin O.G. // Dalton Trans. 2018.
(1:20) выделен чистый рац-изомер 2а.
Vol. 47. N 47. P. 16977. doi 10.1039/C8DT03214A
14. Naumov R.N., Karasik A.A., Sinyashin O.G., Loennecke P.,
КОНФЛИКТ ИНТЕРЕСОВ
Hey-Hawkins E. // Dalton Trans. 2004. N 3. P. 357. doi
10.1039/B313487C
Авторы заявляют об отсутствии конфликта
15. Musina E.I., Karasik A.A., Balueva A.S., Strelnik I.D.,
интересов.
Fesenko T.I., Dobrynin A.B., Gerasimova T.P., Katsyu-
ba S.A., Kataeva O.N., Lönnecke P., Hey-Hawkins E.,
СПИСОК ЛИТЕРАТУРЫ
Sinyashin O.G. // Eur. J. Inorg. Chem. 2012. Vol. 2012.
1. Karasik A.A., Balueva A.S., Musina E.I., Sinyashin O.G. //
N 11. P. 1857. doi 10.1002/ejic.201101337
Mendeleev Commun. 2013. Vol. 23. N 5. P. 237. doi
16. Фесенко Т.И., Стрельник И.Д., Мусина Э.И., Кара-
10.1016/j.mencom.2013.09.001
сик А.А., Синяшин О.Г. // Изв. АН. Сер. хим. 2012.
2. Raugei S., Helm M.L., Hammes-Schiffer Sh., Appel A.M.,
№ 9. C. 1776; Fesenko T.I., Strelnik I.D., Musina E.I.,
O’Hagan M., Wiedner E.S., Bullock R.M. // Inorg. Chem.
Karasik A.A., Sinyashin O.G. // Russ. Chem. Bull. 2012.
2016. Vol. 55. P. 445. doi 10.1021/acs.inorgchem.5b02262
Vol. 61. N 9. P. 1792. doi 10.1007/s11172-012-0247-7
3. Prokopchuk D.E., Wiedner E., Walter E.D., Popescu C.V.,
17. Karasik A.A., Naumov R.N., Spiridonova Y.S., Sinya-
Piro N.A., Kassel W.S., Bullock R.M., Mock M.T. // J. Am.
shin O.G., Lönnecke P., Hey-Hawkins E. // Z. anorg.
Chem. Soc. 2017. Vol. 139. N 27. P. 9291. doi 10.1021/
allg. Chem. 2007. Vol. 633. N 2. P. 205. doi 10.1002/
jacs.7b04552
zaac.200600227
4. Wiedner E.S., Roberts J.A.S., Dougherty W., Scott Kas-
18. Карасик А.А., Бобров С.В., Ахметзянов А.И., Нау-
sel G.W., DuBois D.L.R., Bullock M. // Inorg. Chem.
мов Р.Н., Никонов Г.Н., Синяшин О.Г. // Коорд. хим.
2013. 2013. Vol. 52. N 17. P. 9975. doi 10.1021/
1998. Т. 24. № 7. С. 530.
ic401232g
19. Morisaki Y., Ouchi Y., Fukui T., Naka K., Chujo Y. //
5. Musina E.I., Karasik A.A., Sinyashin O.G., Nikonov G.N. //
Tetrahedron Lett. 2005. Vol. 46. N 41. P. 7011. doi
Adv. Heterocycl. Chem. 2015. Vol. 117. P. 83. doi
10.1016/j.tetlet.2005.08.039
10.1016/bs.aihch.2015.10.001
20. Sheldrick G.M. SADABS. Bruker AXS Inc., Madison,
6. Jin Y., Yu C., Denman R.J., Zhang W. // Chem. Soc. Rev.
WI-53719, USA, 1997.
2013. Vol. 42. N 16. P. 6634. doi 10.1039/C3CS60044K
21. Sheldrick G.M. SHELXT 2014/4, Program for the
7. Schaufelberger F., Timmer B.J.J., Ramström O.
Refinement of Crystal Structure. Göttingen University,
Dynamic Covalent Chemistry: Principles, Reactions,
Göttingen, 2014.
and Applications. Chichester: John Wiley & Sons, 2017.
22. Sheldrick G.M. SHELXL-2018/3, Program for the
P. 1.
Refinement of Crystal Structure. Göttingen University,
8. Karasik А.A., Balueva A.S., Sinyashin O.G. // C. R.
Chimie. 2010. Vol. 13. N 8-9. P. 1151. doi 10.1016/j.
Göttingen, 2018.
crci.2010.04.006
23. Farrugia L.J. // J. Appl. Cryst. 2012. Vol. 45. N 4.
9. Naumov R.N., Musina E.I., Kanunnikov K.B., Fesen-
P. 849. doi 10.1107/S0021889812029111
ko T.I., Krivolapov D.B., Litvinov I.A., Lönnecke P.,
24. APEX2. (Version 2.1). SAINTPlus. Data Reduction and
Hey-Hawkins E., Karasik A.A. Sinyashin O.G. // Dalton
Correction Program Version 7.31A, Bruker Advanced
Trans. 2014. Vol. 43. N 33. P. 12784. doi 10.1039/
X-ray Solution. Bruker AXS Inc., Madison, WI-53719.
C4DT01619J
USA. 2006.
10. Musina E.I., Fesenko T.I., Strelnik I.D., Polyancev F.M.,
25. Spek A.L. // Acta Crystallogr. (D). 2009. Vol. 56.
Latypov S.K., Lönnecke P., Hey-Hawkins E., Kara-
P. 148. doi 10.1107/S090744490804362X
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
СИНТЕЗ НОВЫХ 1,3,5-АЗАДИФОСФОРИНАНОВ
249
Synthesis of New 1,3,5-Azadiphosphorinanes
Based on Aliphatic Amines
E. I. Musina*, L. I. Musin, I. A. Litvinov, and A. A. Karasik
A.E. Arbuzov Institute of Organic and Physical Chemistry, Federal Research Center
“Kazan Scientific Center of the Russian Academy of Sciences”, Kazan, 420088 Russia
* e-mail: elli@iopc.ru
Received July 12, 2019; revised July 12, 2019; accepted July 18, 2019
New 1-aza-3,5-diphosphorinanes were synthesized as a mixture of RR/SS- and RS-isomers by the reaction of
bis(phenylphosphanyl)methane, paraformaldehyde, isopropylamine and benzhydrylamine.
Keywords: six-membered heterocycles, diphosphines, aminomethylphosphine, 1-aza-3,5-diphosphorinane
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020