ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 2, с. 268-273
УДК 547.537.9
СИНТЕЗ НОВЫХ МЕТАНОФУЛЛЕРЕНОВ
С ФТАЛИМИДНЫМ ФРАГМЕНТОМ
© 2020 г. И. М. Сахаутдинов*, Г. Ф. Сахаутдинова, А. Г. Мустафин
Уфимский институт химии Уфимского федерального исследовательского центра Российской академии наук,
пр. Октября 69, Уфа, 450054 Россия
*e-mail: ioh039@mail.ru
Поступило в Редакцию 12 июля 2019 г.
После доработки 23 июля 2019 г.
Принято к печати 25 июля 2019 г.
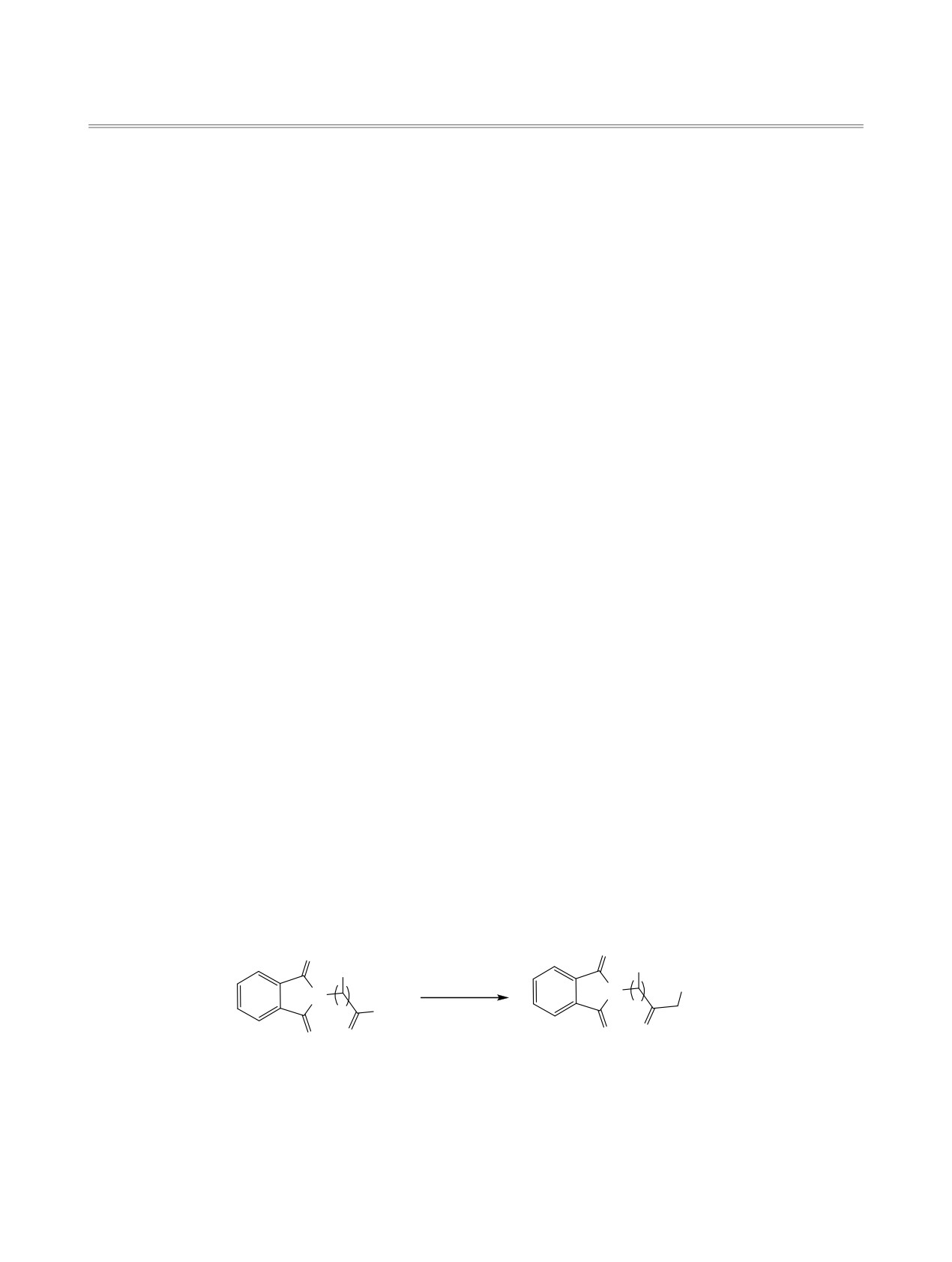
Реакцией Арндта-Эйстерта синтезированы бром- и хлорметилкетоны на основе N-фталилзамещенных
аминокислот. Путем [2+1]-циклоприсоединения последних к фуллереновому каркасу получены новые
моноаддукты фуллерена С60.
Ключевые слова: фталимид, аминокислоты, реакции [2+1]-циклоприсоединения, реакция Бингеля,
фуллерен
DOI: 10.31857/S0044460X20020134
Органическая фотовольтаика за последние
ма продуктивен и прост подход Бингеля-Хирша -
15 лет превратилась в приоритетное направление
[2+1]-циклоприсоединение к фуллереновому кар-
исследований мирового значения. Касаются они,
касу, ведущее к замещенным метанофуллеренам
прежде всего, синтеза и исследования свойств фо-
[2, 3].
тоактивных и электропроводящих органических
В продолжение работ по изучению [2+1]-ци-
веществ. Важная роль в этом направлении отво-
клоприсоединения галогенметилкетонов к фул-
дится фуллеренсодержащим материалам, которые
лереновому каркасу [4, 5], в настоящей работе
в сочетании с полисопряженными высокомоле-
синтезированы новые конъюгаты фуллерена на
кулярными соединениями демонстрируют повы-
основе бром- и хлорметилкетонов, полученных из
шенную эффективность преобразования света [1].
N-фталилзамещенных аминокислот.
Поэтому закономерна интенсификация работ по
Синтез N-фталилзамещенных аминокислот
получению новых продуктов, исходя из фуллере-
1a-д осуществляли прямым сплавлением
на С60, для их применения в солнечных батареях.
фталевого
ангидрида
с
различными
Для первичной функционализации ядра С60 весь-
аминокислотами - глицином, γ-аминомасляной,
Схема 1.
O
O
(1) SOCI2
R
R
(2) CH2N2
(3) HCl
X
N
N
n
n
OH
O O
O O
ɚ ɞ
ɚ ɞ, ɚ ɞ
R = H, n = 1 (ɚ), 3 (ɛ), 5 (ɜ); R = CH(CH3)2, n = 1 (ɝ, ɞ);
R = CH2CH(CH3)2, n = 1 (ɚ); X = Cl (2), Br (3).
268
СИНТЕЗ НОВЫХ МЕТАНОФУ
ЛЛЕРЕНОВ
269
Схема 2.
O
O
R
R
X
N
N
C60, DBU
n
20oC
O
O
O O
2, 3
ɚ ɞ
R = H, n = n = 1 (ɚ), 3 (ɛ), 5 (ɜ); R = CH(CH3)2, n = 1 (ɝ); R=CH2CH(CH3)2, n = 1 (ɞ).
5-аминовалериановой кислотами, валином и
Полученные данные указывают на влияние
лейцином
[6]. В условиях реакции Арндта-
природы галогена на ход реакции: хлорметил-
Эйстерта из карбоновых кислот
1a-д через
кетоны более предпочтительны для первичной
соответствующие хлорангидриды образуются
функционализации ядра С60 по Бингелю (схема 3).
диазокетоны, которые без выделения и
Вероятно, это объясняется большей электроотри-
дополнительной очистки вовлекали в реакцию с
цательностью атома хлора, что в совокупности с
хлористоводородной или бромистоводородной
влиянием кетогруппы делает протоны метилено-
кислотой с получением хлорметилкетонов 2a-д и
вого фрагмента более подвижными и образование
бромметилкетонов 3a-д (схема 1).
карбаниона по реакции Бингеля путем элиминиро-
Строение галогенметилкетонов 2 и 3 доказано
вания протона в присутствии сильного основания
физико-химическими методами. Хлорметильная
протекает лучше, чем в случае бромметилкетонов.
группа в хлорметилкетонах 2a-д проявляется в
спектрах ЯМР 13С характерным сигналом в области
Таким образом, путем [2+1]-циклофункцио-
46.0-48.2 м. д., а в спектрах ЯМР 1Н - в области
нализации ядра С60 по Бингелю бром- и хлорме-
4.0-4.2 м. д. В спектрах ЯМР бромметилкетонов
тилкетонами получены новые моноаддукты фул-
3a-д сигналы СН2Br-группы наблюдаются в
лерена С60 с фталимидным фрагментом. Лучшие
области 36.5-37.7 и 3.9-4.0 м. д. соответственно.
выходы метанофуллеренов получены на основе
Введение галогенметилкетонов 2a-д и 3a-д в
хлорметилкетонов в течение 20 мин. Дальнейшее
реакцию Бингеля с фуллереном С60 в среде толуола
увеличение времени реакции приводит к умень-
в присутствии диазабицикло[4.2.0]ундец-7-ена
шению моно-метанофуллеренов и увеличению
(DBU) приводит к образованию метанофуллеренов
содержания продуктов полиприсоединения.
4a-д (схема 2).
Метанофуллерены, полученные из α-аминокислот,
В спектре ЯМР 13С соединений 4a-д sp2-
плохо растворимы в органических растворителях,
углеродные атомы фуллерена резонируют сигна-
однако введение в состав производных фуллерена
лами различной интенсивности в области 136.4-
метиленовых мостиков повышает растворимость,
148.2 м. д.; сигналы sp3-углеродных атомов прояв-
ляются при 71.3-72.1 м. д. В спектрах ЯМР 1Н на-
что расширяет перспективы последующих транс-
блюдаются протоны циклопропанового фрагмента
формаций и возможности использования конъю-
в области 4.91-5.01 м. д.
гатов С60 в преобразователях солнечной энергии.
Схема 3.
O
O
R
R
O
O
C
DBU
60
Cl
Cl
Cl
R
R
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
270
САХАУТДИНОВ и др.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
шивали в течение 1 ч после окончания выделения
газа, затем отделяли органический слой, который
Хлористый метилен, этилацетат перегоняли над
промывали 5%-ным раствором NaHCO3 (20 мл),
P2O5. Толуол, петролейный эфир, бензол кипяти-
интенсивно встряхивали и экстрагировали CH2Cl2
ли и перегоняли над натрием. Хлористый тионил
(3×40 мл). Объединенную органическую фазу су-
(ЧДА) использовали без дополнительной очистки.
шили над безводным MgSO4 и растворитель отго-
Продукты реакции выделяли с помощью колоноч-
няли. Остаток разделяли колоночной хроматогра-
ной хроматографии на силикагеле Chemapol с раз-
фией на силикагеле (петролейный эфир:этилаце-
мером частиц 40/100 мкм.
тат = 7:3).
ИК спектры записывали на приборе IR-
Prestige-21 Shimadzu в тонком слое или вазелино-
2-(3-Хлор-2-оксопропил)изоиндол-1,3-ди-
вом масле. Спектры ЯМР получали на спектроме-
он (2a). Выход 1.93 г (82%), белый порошок. ИК
тре Bruker-AM 500 с рабочей частотой 500.13 (1Н),
спектр, ν, см-1: 713, 1378, 1418, 1465, 1718, 1747.
125.76 МГц (13С), внутренний стандарт - ТМС.
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 4.21 с (2Н, CH2),
Для корректного отнесения сигналов в спектрах
4.75 с (2Н, CH2), 7.72 м (2H, CHAr), 7.86 м (2H,
ЯМР использовали методы гомо- и гетероядерной
CHAr). Спектр ЯМР 13С (CDCl3), δC, м. д.: 44.68
двумерной корреляции COSY, NOESY, HSQC и
(CH2), 46.19 (CН2), 123.69 (2CHAr), 131.94 (2CAr),
HMBC. За ходом реакции следили с помощью тон-
134.35 (2CHAr), 167.38 (2С=О), 195.47 (С=О). Масс-
кослойной хроматографии на пластинках Sorbfil
спектр, m/z: 238 [M + H]+, 237 [M]-. Найдено, %: С
ПТСХ-АФ-А, которые проявляли с помощью па-
55.56; H 3.32, N 5.78. C11H8ClNO3. Вычислено, %:
ров иода, опрыскивания раствором нингидрина с
С 55.6; H 3.39; Cl 14.92; N 5.89; O 20.2.
последующим нагреванием при 100-120°С. Масс-
2-(5-Хлор-4-оксопентил)изоиндолин-1,3-ди-
спектры получали на хромато-масс-спектрометре
он (2б). Выход 2.1 г (78%), белый порошок. ИК
LCMS-2010EV Shimadzu в режиме химической ио-
спектр, ν, см-1: 725, 1038, 1373, 1463, 1709, 1772.
низации при атмосферном давлении. Элементный
Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 1.96 м (2Н,
анализ выполнен на приборе EURO EA-3000 CHN.
CH2), 2.63 т (2Н, CH2, J = 7.1), 3.71 т (2Н, CH2,
Температуру плавления определяли на нагрева-
J = 6.6), 4.09 с (2Н, CH2), 7.71 м (2H, CHAr), 7.82 м
тельном столике Boetius.
(2H, CHAr). Спектр ЯМР 13С (CDCl3), δС, м. д.:
N-Фталимидозамещенные аминокислоты 1a-д
22.57 (CH2), 36.67 (CH2), 36.87 (CH2), 48.21 (CН2),
получены по известной методике
[6]. Бром-
123.28
(2CHAr),
131.97
(2CAr),
134.06
(2CHAr),
метилкетоны 3a, 3г синтезированы по известным
168.47 (2С=О), 201.56 (С=О). Масс-спектр, m/z:
методикам и основные физико-химические харак-
266 [M + H]+, 265 [M]-. Найдено, %: С 58.71; H
теристики соответствуют литературным данным
4.62, N 5.28. C13H12ClNO3. Вычислено, %: С 58.77;
[7, 8].
H 4.55; Cl 13.34; N 5.27; O 18.07. Масс-спектр, m/z:
Общая методика синтеза хлорметилкетонов
266 [M + H]+, 265 [M]-.
2a-д и бромметилкетонов 3a-д в условиях ре-
2-(7-Хлор-6-оксогептил)изоиндолин-1,3-ди-
акции Арндта-Эйстерта. К раствору 10 ммоль
он (2в). Выход 2.2 г (75%), светло-желтое масло.
соответствующей N-фталимидзамещенной амино-
ИК спектр, ν, см-1: 725, 1403, 1463, 1709, 1772.
кислоты в 30 мл бензола добавляли 30 ммоль хло-
Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 1.34 м
ристого тионила. Реакционную смесь кипятили в
(2Н, CH2), 1.67 м (4Н, CH2), 2.68 т (2Н, CH2, J =
течение 3 ч, затем досуха упаривали. Полученный
7.3), 3.66 т (2Н, CH2, J = 7.1), 4.04 с (2Н, CH2), 7.68
хлорангидрид без дополнительной очистки охла-
м (2H, CHAr), 7.83 м (2H, CHAr). Спектр ЯМР 13С
ждали до -5°С и прибавляли к нему в один прием
(CDCl3), δС, м. д.: 23.00 (CH2), 26.22 (CH2), 28.29
охлажденный раствор диазометана, приготовлен-
ного из 60 ммоль нитрозометилмочевины. Смесь
(CH2), 37.52 (CH2), 39.40 (CH2), 48.15 (CН2), 123.18
перемешивали при -5°С в течение 2 ч, раствори-
(2CHAr),
132.10
(2CAr),
133.91
(2CHAr),
168.39
тель отгоняли. Остаток растворяли в 6 мл CH2Cl2
(2С=О), 202.39 (С=О). Масс-спектр, m/z: 294 [M +
и при перемешивании добавляли 1 мл 38%-ного
H]+, 293 [M]-. Найдено, %: С 61.33; H 5.48, N 4.75.
раствора HCl (либо 1 мл 48%-ного раствора HBr).
C15H16ClNO3. Вычислено, %: С 61.33; H 5.49; Cl
Далее при комнатной температуре смесь переме-
12.07; N 4.77; O 16.34.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
СИНТЕЗ НОВЫХ МЕТАНОФУ
ЛЛЕРЕНОВ
271
2-(1-Хлор-4-метил-2-оксопент-3-ил)изоиндо-
м (2H, CHAr), 7.72 м (2H, CHAr). Спектр ЯМР 13С
лин-1,3-дион (2г). Выход 2.23 г (80%), прозрачное
(CDCl3), δC, м. д.: 23.27 (CH2), 26.19 (CH2), 28.29
масло. ИК спектр, ν, см-1: 724, 1380, 1458, 1653,
(CH2), 34.26 (CН2), 37.68 (CH2), 39.52 (CH2), 123.18
1718, 1736. Спектр ЯМР 1Н (CDCl3), δ, м. д. (J,
(2CHAr),
132.10
(2CAr),
133.91
(2CHAr),
168.39
Гц): 0.84 м (3Н, CH3), 1.06 м (3Н, CH3), 2.73 м (1Н,
(2С=О), 201.82 (С=О). Найдено, %: С 53.23; H
CH), 4.04 д (2Н, CH2, J = 4.5), 4.74 д (1Н, CH, J =
4.75; N 4.16. C15H16BrNO3. Вычислено, %: С 53.27;
7.9), 7.78 м (2H, CHAr), 7.87 м (2H, CHAr). Спектр
H 4.77; Br 23.63; N 4.14; O 14.19. Масс-спектр, m/z:
ЯМР 13С (CDCl3), δС, м. д.: 18.73 (CH3), 20.64
339 [M + H]+, 338 [M]-.
(CH3), 27.57 (CH), 46.46 (CН2), 61.09 (CH), 123.58
2-(1-Бром-5-метил-2-оксогекс-3-ил)изоиндо-
(2CHAr),
131.31
(2CAr),
134.60
(2CHAr),
167.78
лин-1,3-дион (3д). Выход 2.43 г (72%), белый по-
(2С=О), 196.79 (С=О). Масс-спектр, m/z: 280 [M +
рошок. ИК спектр, ν, см-1: 721, 1060, 1385, 1468,
H]+, 279 [M]-. Найдено, %: С 60.03; H 5.09, N 4.98.
1709, 1774. Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц):
C14H14ClNO3. Вычислено, %: С 60.11; H 5.04; Cl
0.89 д (3Н, CH3, J = 6.6), 0.94 м (3Н, CH3, J = 6.6),
12.67; N 5.01; O 17.16.
1.47 м (1Н, CH), 1.89 м (1Ha, CH2), 2.25 м (1Hb,
2-(1-Хлор-5-метил-2-оксогекс-3-ил)изоиндо-
CH2), 3.96 c (2Н, CH2, J = 2.8), 5.14 д. д (1Н, CH, J =
лин-1,3-дион (2д). Выход 2.2 г (75%), белый по-
11.3, 4.1), 7.76 м (2H, CHAr), 7.85 м (2H, CHAr).
рошок. ИК спектр, ν, см-1: 724, 1063, 1383, 1464,
Спектр ЯМР 13С (CDCl3), δС, м. д.: 20.98 (CH3),
1713, 1738. Спектр ЯМР 1Н (CDCl3), δ, м. д. (J,
23.21 (CH3), 25.05 (CH), 31.20 (CН2), 36.49 (CН2),
Гц): 0.89 д (3Н, CH3, J = 6.6), 0.96 м (3Н, CH3,
55.23 (CH), 123.68 (2CHAr), 131.58 (2CAr), 134.42
J = 6.6), 1.48 м (1Н, CH), 1.93 м (1Ha, CH2), 2.27 м
(2CHAr), 167.73 (2С=О), 197.41 (С=О). Найдено, %:
(1Hb, CH2), 4.19 д (2Н, CH2, J = 2.8), 5.12 д (1Н,
С 53.28; H 4.77, N 4.13. C15H16BrNO3. Вычислено,
CH, J = 7.3), 7.77 м (2H, CHAr), 7.88 м (2H, CHAr).
%: С 53.27; H 4.77; Br 23.63; N 4.14; O 14.19. Масс-
Спектр ЯМР 13С (CDCl3), δС, м. д.: 21.03 (CH3),
спектр: m/z 339 [MH]+, 338 [M]-.
23.26 (CH3), 25.05 (CH), 36.38 (CН2), 45.99 (CН2),
Общая методика синтеза метанофуллеренов
55.59 (CH), 123.75 (2CHAr), 131.62 (2CAr), 134.48
4a-д. К раствору 0.14 ммоль С60 в 40 мл толуо-
(2CHAr),
167.79
(2С=О),
197.76 (С=О). Масс-
ла добавляли 0.21 ммоль хлорметилкетона 2a-д
спектр, m/z: 294 [M + H]+, 293 [M]-. Найдено, %: С
(или бромметилкетона 3a-д) и 0.21 ммоль DBU.
61.3; H 5.49, N 4.78. C15H16ClNO3. Вычислено, %:
Реакционную смесь перемешивали при комнат-
С 61.33; H 5.49; Cl 12.07; N 4.77; O 16.34.
ной температуре в течение 20 мин (ход реакции
2-(5-Бром-4-оксопентил)изоиндолин-1,3-ди-
контролировали методом ТСХ, элюент - толуол),
он (3а). Выход 2.35 г (76%), белый порошок. ИК
затем фильтровали. Полученный раствор промы-
спектр, ν, см-1: 726, 1378, 1463, 1712, 1771. Спектр
вали 5%-ным раствором HCl (30 мл), интенсивно
ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 1.97 м (2Н, CH2),
встряхивали и экстрагировали толуолом (3×10 мл).
2.59 т (2Н, CH2, J = 7.1), 3.69 т (2Н, CH2, J = 6.6),
Объединенную органическую фазу сушили безво-
3.93 с (2Н, CH2), 7.66 м (2H, CHAr), 7.82 м (2H,
дным MgSO4 и растворитель наполовину отгоня-
CHAr). Спектр ЯМР 13С (CDCl3), δС, м. д.: 22.81
ли. Остаток разделяли колоночной хроматографи-
(CH2), 34.31 (CH2), 36.76 (CH2), 36.84 (CН2), 123.23
ей на силикагеле, в качестве элюента использова-
(2CHAr),
131.92
(2CAr),
134.01
(2CHAr),
168.40
ли толуол.
(2С=О), 200.91 (С=О). Масс-спектр, m/z: 339 [M +
2'-[1f,2f-Метанофуллерен-3'-ил]-2'-оксоэтил-
H]+, 338 [M]-. Найдено, %: С 58.71; H 4.62; N 5.28.
фталимид (4a). Выход 64 мг (49.6% из 2a), 50 мг
C13H12BrNO3. Вычислено, %: С 50.34; H 3.90; Br
(39%, из 3a), темно-коричневый порошок. ИК
25.76; N 4.52; O 15.48.
спектр, ν, см-1: 470 ш, 1098 ш, 1377, 1411, 1462,
2-(7-Бром-6-оксогептил)изоиндолин-1,3-ди-
1711,1718. Спектр ЯМР 1H (CDCl3), δ, м. д.: 5.21 с
он (3в). Выход 2.66 г (79%), светло-желтое масло.
(2H, CH2), 5.02 с (1H, CH), 7.79 м (2H, CHAr), 7.98
ИК спектр, ν, см-1: 723, 1048, 1373, 1464, 1709,
м (2H, CHAr). Спектр ЯМР 13C (CDCl3), δС, м. д.:
1769. Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 1.33
42.06 (CH2), 47.73 (CH), 71.31 (C1f, C2f), 123.86
м (2Н, CH2), 1.65 м (4Н, CH2), 2.62 т (2Н, CH2, J =
(2CHAr),
132.05
(2CAr),
134.48
(2CHAr), 137.88,
7.3), 3.66 т (2Н, CH2, J = 7.1), 3.87 с (2Н, CH2), 7.68
140.60, 140.66, 140.92, 141.00, 141.98,
142.28,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
272
САХАУТДИНОВ и др.
142.38, 142.31, 142.77, 143.11, 143.73, 143.00, 144.50,
(CDCl3), δС, м. д.: 19.35 (CH3), 21.10 (CH3), 27.58
144.54, 144.63, 144.75, 145.08, 145.23, 145.43, 145.63,
(CH), 64.99 (CH), 71.31 (C1f, C2f), 124.05 (2CHAr),
145.67, 147.93, 147.99, 168.02 (C=O), 206.76 (C=O).
131.56
(2CAr),
134.79
(2CHAr),
136.43,
136.48,
Найдено, %: С 92.63; H 0.76, N 1.50. C71H7NO3.
137.82, 140.52, 140.87, 141.11, 142.01, 142.17, 142.27,
Вычислено, %: С 92.51; H 0.77; N 1.52; O 5.21.
142.66, 142.71, 142.94, 142.99, 143.12, 143.31, 143.67,
4'-[1f,2f-Метанофуллерен-5'-ил]-4'-оксобу-
144.02, 144.44, 144.63, 144.68, 144.85, 144.97, 145.03,
тилфталимид (4б). Выход 60 мг (45% из 2б), 56 мг
145.11, 145.19, 145.28, 145.48, 145.83, 147.88, 168.15
(42%, из 3б), темно-коричневый порошок. ИК
(2С=О), 195.68 (С=О). Найдено, %: С 92.22; H
спектр, ν, см-1: 526, 720, 1187, 1377, 1464, 1709,
1.36, N 1.44. C74H13NO3. Вычислено, %: С 92.21; H
1768. Спектр ЯМР 1H (CDCl3), δ, м. д. (J, Гц): 2.31 м
1.36; N 1.45; O 4.98.
(2Н, CH2), 3.29 т (2Н, CH2, J = 6.8), 3.93 т (2Н, CH2,
6'-[1f,2f-Метанофуллерен-7'-ил]-6'-оксогек-
J = 6.3), 5.00 с (Н, CH), 7.72 м (2H, CHAr), 7.87 м
силфталимид (4д). Выход 55 мг (40%, из 2д), 37 мг
(2H, CHAr). Спектр ЯМР 13C (CDCl3), δС, м. д.: 22.67
(27%, из 3д), темно-коричневый порошок. ИК
(CH2),37.36(CH2),41.77(CH2),45.20(CН),72.04(C1f,
спектр, ν, см-1: 526, 720, 1377, 1462, 1709 ш. Спектр
C2f), 123.40 (2CHAr), 129.04 (2CAr), 134.08 (2CHAr),
ЯМР 1H (CDCl3), δ, м. д. (J, Гц): 0.99 д (3Н, CH3,
136.37, 137.88, 140.38, 140.89, 141.14, 141.99,
J = 6.6), 1.12 м (3Н, CH3, J = 6.6), 1.68 м (1Н, CH),
142.09,142.25,142.45,142.76,142.97,143.014,143.32,
2.33 м (1Ha, CH2), 2.62 м (1Hb, CH2), 4.99 c (1Н,
143.69, 143.96, 144.30, 144.53, 144.66, 145.02, 145.14,
CH), 5.48 м (1Н, CH), 7.79 м (2H, CHAr), 7.96 м (2H,
145.26, 145.53, 145.84, 148.22,
168.68
(2С=О),
CHAr). Спектр ЯМР 13C (CDCl3), δС, м. д.: 21.43
200.24 (С=О). Найдено, %: С 92.3; H 1.16; N 1.49.
(CH3), 23.29 (CH3), 25.42 (CH), 36.59 (CН2), 58.46
C73H11NO3. Вычислено, %: С 92.31; H 1.17; N 1.47;
(CH), 71.71 (C1f, C2f), 123.92 (2CHAr), 131.75 (2CAr),
O 5.05.
134.63
(2CHAr), 136.45, 140.16, 140.96, 141.21,
6'-[1f,2f-Метанофуллерен-7'-ил]-6'-оксогек-
142.06, 142.14, 142.28, 142.95, 143.03, 143.18, 144.01,
силфталимид (4в) Выход 58 мг (42% из 2в), 54 мг
144.39, 144.56, 144.62, 144.70, 145.05, 145.20, 145.29,
(39%, из 3в), темно-коричневый порошок. ИК
145.72, 168.07 (2С=О), 199.56 (С=О). Найдено, %:
спектр, ν, см-1: 527, 720, 1377, 1455,1706, 1768.
С 92.12; H 1.56; N 1.42. C75H15NO3. Вычислено, %:
Спектр ЯМР 1H (CDCl3), δ, м. д. (J, Гц): 1.56 м (2Н,
С 92.11; H 1.55; N 1.43; O 4.91.
CH2), 1.79 м (2Н, CH2), 1.98 м (2Н, CH2), 3.18 т
(2Н, CH2, J = 7.2), 3.72 т (2Н, CH2, J = 7.2), 5.01 с
ФОНДОВАЯ ПОДДЕРЖКА
(2Н, CH2), 7.72 м (2H, CHAr), 7.86 м (2H, CHAr).
Работа выполнена в соответствии с планом
Спектр ЯМР 13C (CDCl3), δ, м. д.: 23.20 (CH2), 26.49
научно-исследовательской работы Уфимского
(CH2), 28.50 (CH2), 37.78 (CН2), 44.13 (CH2), 45.44
института химии РАН по теме «Создание мате-
(CH), 72.06 (C1f, C2f), 123.26 (2CHAr), 132.17 (2CAr),
риалов с заданными функциональными свойства-
133.95
(2CHAr), 136.37, 140.28, 140.92, 141.14,
ми электропроводимость, антикоррозионность
142.03, 142.08, 142.25, 142.44, 142.75, 142.96, 143.01,
и биологическая активность» (№ госрегистра-
143.13, 143.32, 143.95, 144.32, 144.53, 144.61, 144.65,
ции АААА-А19-119020890014-7). Спектральная
144.85, 145.02, 145.14, 145.25, 145.47, 145.92, 148.17,
часть исследования проведена с использованием
168.46 (2С=О), 200.86 (С=О). Найдено, %: С 92.15;
оборудования Центра коллективного пользования
H 1.56; N 1.41. C75H15NO3. Вычислено, %: С 92.11;
«Химия» Уфимского института химии РАН.
H 1.55; N 1.43; O 4.91.
4'-[1f,2f-Метанофуллерен-5'-ил]-4'-оксоб-
КОНФЛИКТ ИНТЕРЕСОВ
утилфталимид (4г) Выход 77 мг (57 % из 2г),
Авторы заявляют об отсутствии конфликта
48.6 мг (36%, из 3г), темно-коричневый порошок.
интересов.
ИК спектр, ν, см-1: 527, 723, 1062, 1155, 1377,
1456, 1710 ш. Спектр ЯМР 1Н (CDCl3), δ, м. д. (J,
СПИСОК ЛИТЕРАТУРЫ
Гц): 1.03 м (3Н, CH3), 1.31 м (3Н, CH3), 3.14 м (1Н,
CH), 4.91 c (1Н, CH), 5.13 д (1Н, CH, J = 8.6), 7.78
1. Трошин П.А., Трошина O.A., Любовская Р.Н., Разу-
м (2H, CHAr), 7.97 м (2H, CHAr). Спектр ЯМР 13C
мов В.Ф. Функциональные производные фуллеренов:
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
СИНТЕЗ НОВЫХ МЕТАНОФУ
ЛЛЕРЕНОВ
273
методы синтеза и перспективы использования в
Биглова Ю.Н., Атангулов А.Б., Юнусов М.С. // ХПС.
органической электронике и биомедицине. Иваново:
2018. Т. 54. № 3. С. 408; Sakhautdinov I.M., Maliko-
Ивановск. гос. унив., 2010. 340 с.
va R.N., Nugumanov T.R., Biglova Yu.N., Atangu-
2. Nierengarten J.F., Nicoud J.F. // Tetrahedron Lett.
lov A.B., Yunusov M.S. // Chem. Nat. Compd. 2018. Vol.
1997. Vol. 38. N 44. P. 7737. doi 10.1016/S0040-
54. N 3. P. 481. doi 10.1007/s10600-018-2384-1
4039(97)10066-1
6. Гринштейн Дж., Виниц М. Химия аминокислот и
3. Camps X., Hirsch A. // J. Chem. Soc. Perkin Trans. 1.
пептидов. М: Мир, 1965. C. 578.
1997. P. 1595. doi 10.1039/a702055d
7. Толстиков Г.А., Галин Ф.З., Лакеев С.Н. // Изв. АН.
4. Мухаметьянова А.Ф. , Сахаутдинов И.М. // ЖОХ.
Сер. хим. 1989. № 5. C. 1209.
2018. Т. 88. № 12. С. 2011; Sakhautdinov I.М.,
8. Химия и биологическая активность синтетических
Mukhamet’yanova А.F. // Russ. J. Gen. Chem. 2018.
и природных соединений. Азотистые гетероциклы и
Vol. 88. N 12. P. 2011. doi 10.1134/S1070363218120125
алкалоиды / Под ред. В.Г. Карцева, Г.А. Толстикова.
5. Сахаутдинов И.М., Маликова Р.Н., Нугуманов Т.Р.,
М.: ИРИДИУМ-ПРЕСС, 2001. Т. 1. С. 262.
Synthesis of New Methanofullerenes with Phthalimide Fragment
I. M. Sakhautdinov*, G. F. Sakhautdinova, and A. G. Mustafin
Ufa Institute of Chemistry, Ufa Federal Research Center, Russian Academy of Sciences, Ufa, 450054 Russia
*e-mail: ioh039@mail.ru
Received July 12, 2019; revised July 23, 2019; accepted July 25, 2019
Bromo- and chloromethyl ketones based on N-phthalyl substituted amino acids were synthesized by the Arndt-
Eistert adducts of fullerene C60.
Keywords: phthalimide, amino acids, [2 + 1] cycloaddition reactions, Bingel reaction, fullerene
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020