ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 2, с. 274-283
УДК 547.1:544.1:535.3:577
НОВЫЕ ЦИАНОАРИЛПОРФИРАЗИНЫ
С ВЫСОКОЙ ВЯЗКОСТНОЙ
ЧУВСТВИТЕЛЬНОСТЬЮ ФОТОФИЗИЧЕСКИХ
ПАРАМЕТРОВ КАК ПЕРСПЕКТИВНЫЕ АГЕНТЫ
ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ
© 2020 г. С. А. Лермонтоваa, Т. С. Любоваa, Е. Ю. Ладилинаa, В. И. Плехановb,
И. В. Балалаеваc, В. П. Боярскийd, Л. Г. Клапшинаa,b,*
a Институт металлоорганической химии имени Г. А. Разуваева Российской академии наук,
ул. Тропинина 49, Нижний Новгород, 603137 Россия
b Институт прикладной физики Российской академии наук, Нижний Новгород, 603950 Россия
c Нижегородский государственный университет имени Н. И. Лобачевского, Нижний Новгород, 603950 Россия
d Санкт-Петербургский государственный университет, Санкт-Петербург, 199034 Россия
*e-mail: klarisa@iomc.ras.ru
Поступило в Редакцию 24 июня 2019 г.
После доработки 24 июня 2019 г.
Принято к печати 27 июня 2019 г.
Ряд цианоарилпорфиразиновых пигментов проанализирован с точки зрения зависимости их фото-
физических свойств и фотодинамической активности от природы заместителей в арильных группах,
обрамляющих макроцикл, и их положения в ароматическом кольце. Показано, что замена атома фтора в
пара-положении на метоксигруппу приводит к существенному увеличению соотношения величин
темновой и фотоиндуцированной цитотоксичности, т. е. потенциального терапевтического индекса
порфиразина.
Ключевые слова: цианоарилпорфиразины, фотосенсибилизаторы, фотоиндуцированная и темновая
цитотоксичность, флуоресцентные молекулярные роторы, оптические зонды внутриклеточной вязкости
DOI: 10.31857/S0044460X20020146
Фотодинамическая терапия рака является ши-
высокой цитотоксичностью [7, 8]. Таким образом,
роко распространенным методом лечения онколо-
три нетоксичных компонента терапии (фотосенси-
гических заболеваний, основанным на использо-
билизатор, кислород и свет) способны эффективно
вании в качестве главного терапевтического ком-
инициировать гибель раковых клеток в опухоли и/
понента фотосенсибилизатора, избирательно на-
или разрушать ее кровеносную систему. Большая
капливающегося внутри опухоли и активируемого
часть известных в настоящее время фотосенсиби-
видимым или инфракрасным светом с подходящей
лизатора принадлежит к семейству флуоресцент-
длиной волны [1-6]. Такая активация приводит к
ных тетрапиррольных пигментов, полученных,
превращению возбужденного синглетного состоя-
главным образом, на основе производных порфи-
ния фотосенсибилизатора в триплетное. Известно,
ринов и фталоцианинов [9, 10]. Недавно перспек-
что в триплетном состоянии некоторые пигменты
тивность использования в качестве агентов фото-
способны генерировать активные формы кисло-
динамической терапии рака продемонстрирована и
рода: радикалы и/или синглетный кислород, обла-
для порфиразинов [11-13]. В последние несколько
дающий малым временем жизни, но чрезвычайно
лет в Институте металлоорганической химии РАН
274
НОВЫЕ ЦИАНОАРИЛПОРФИР
АЗИНЫ
275
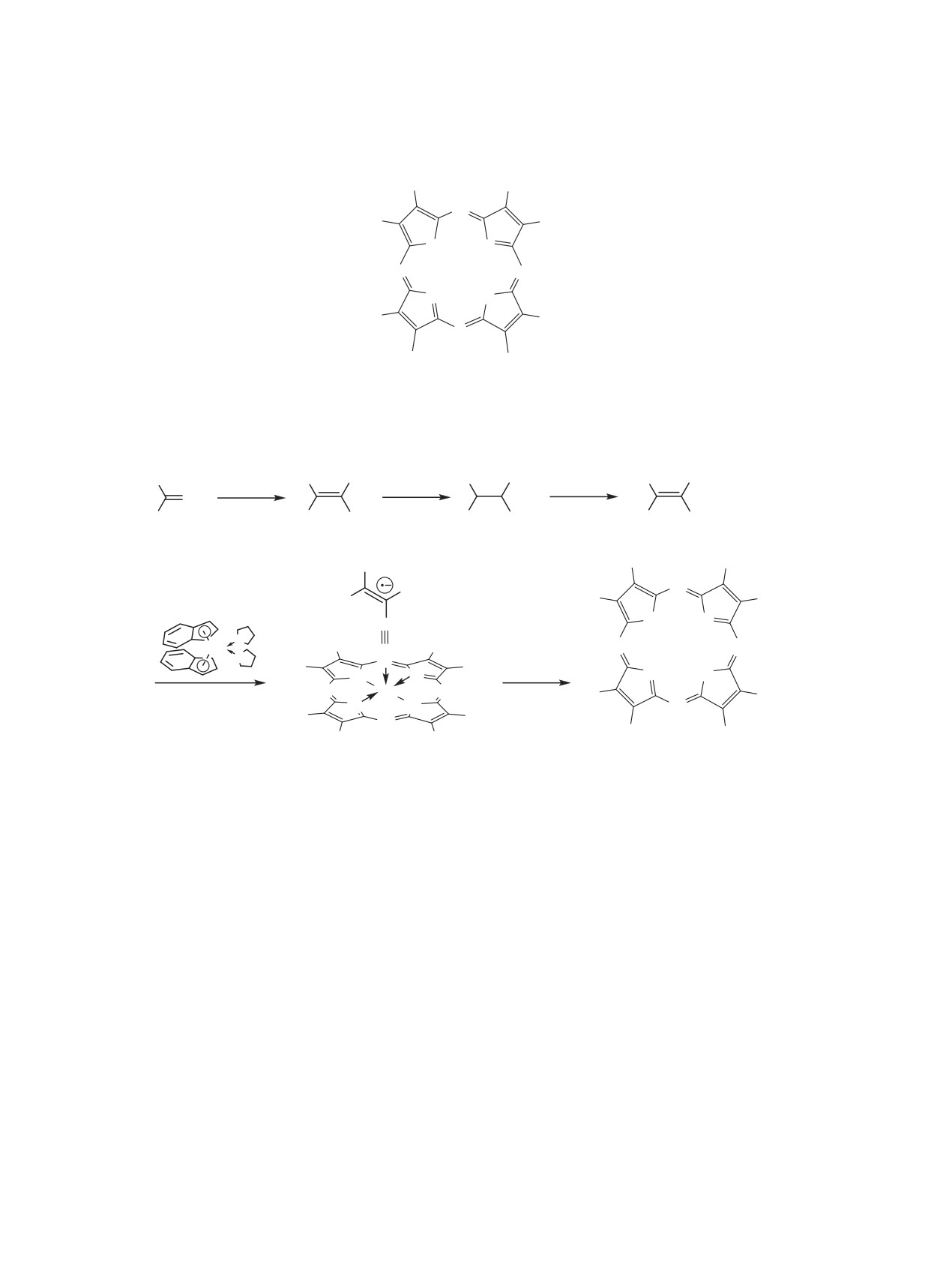
Схема 1.
R
CN
N
NC
R
NH
N
N
N
N
HN
R
CN
N
NC
R
1 7
R = Ph (1), 4-FC6H4 (2), 4-MeOC6H4 (3), 2-MeC6H4 (4),
2-MeOC6H4 (5), 3-MeO-4-EtOC6H3 (6), C6F5 (7).
Схема 2.
R
R
CN
R
CN
R
CN
NCS
CH2(CN)2
KCN, HCl
O
H
H CN
NC
CN
NC
CN
8 10
11 13
14 16
R
CN
R
CN
N
NC
NC
R
NH
N
C
O
Yb
R
CN
N
N
O
N
NC
N
R
TFA
N
HN
N
N
N
Yb
N
R
CN
N
N
N
R
CN
N
NC
R
NC
R
17 19
3 , 5, 6
R = 4-MeOC6H4 (3, 8, 11, 14, 17), 2-MeOC6H4 (5, 9, 12, 15, 18), 4-MeOC6H4 (6, 10, 13, 16, 19).
им. Г.А. Разуваева проводятся исследования фо-
сибилизатора без света или только света без фото-
тофизических и цитотоксических свойств новой
сенсибилизатора не дает цитотоксического эффек-
группы тетрапирролов - цианоарилпорфиразино-
та. Следует отметить, что использование активных
вых пигментов, демонстрирующих уникальный
форм кислорода в фотодинамической терапии рака
потенциал для разнообразных биомедицинских
имеет существенное преимущество по сравнению
приложений (фотодинамическая терапия, бимо-
с другими видами лечения онкологии, поскольку
дальная флуоресцентная/магнитно-резонансная
подвергаются фотоиндуцированной атаке толь-
диагностика, а также зондирование внутриклеточ-
ко клетки раковой опухоли, и, следовательно, в
ной вязкости) [14-20].
отсутствие облучения и при низкой собственной
Как и другие тетрапиррольные фотосенсибили-
(темновой) цитотоксичности фотосенсибилизато-
заторы, эти соединения являются не только тера-
ра здоровые ткани практически не подвергаются
певтическими, но и диагностическими агентами,
повреждению. Это также означает важность соот-
поскольку, селективно накапливаясь в опухоли,
ношения величин темновой и фотоиндуцирован-
они способны ее визуализировать за счет флуорес-
ной цитотоксичностей, поскольку оно является
ценции. При этом использование одного фотосен-
важным показателем безопасности использования
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
276
ЛЕРМОНТОВА и др.
ɚ
ɛ
Ȝ ɧɦ
Ȝ ɧɦ
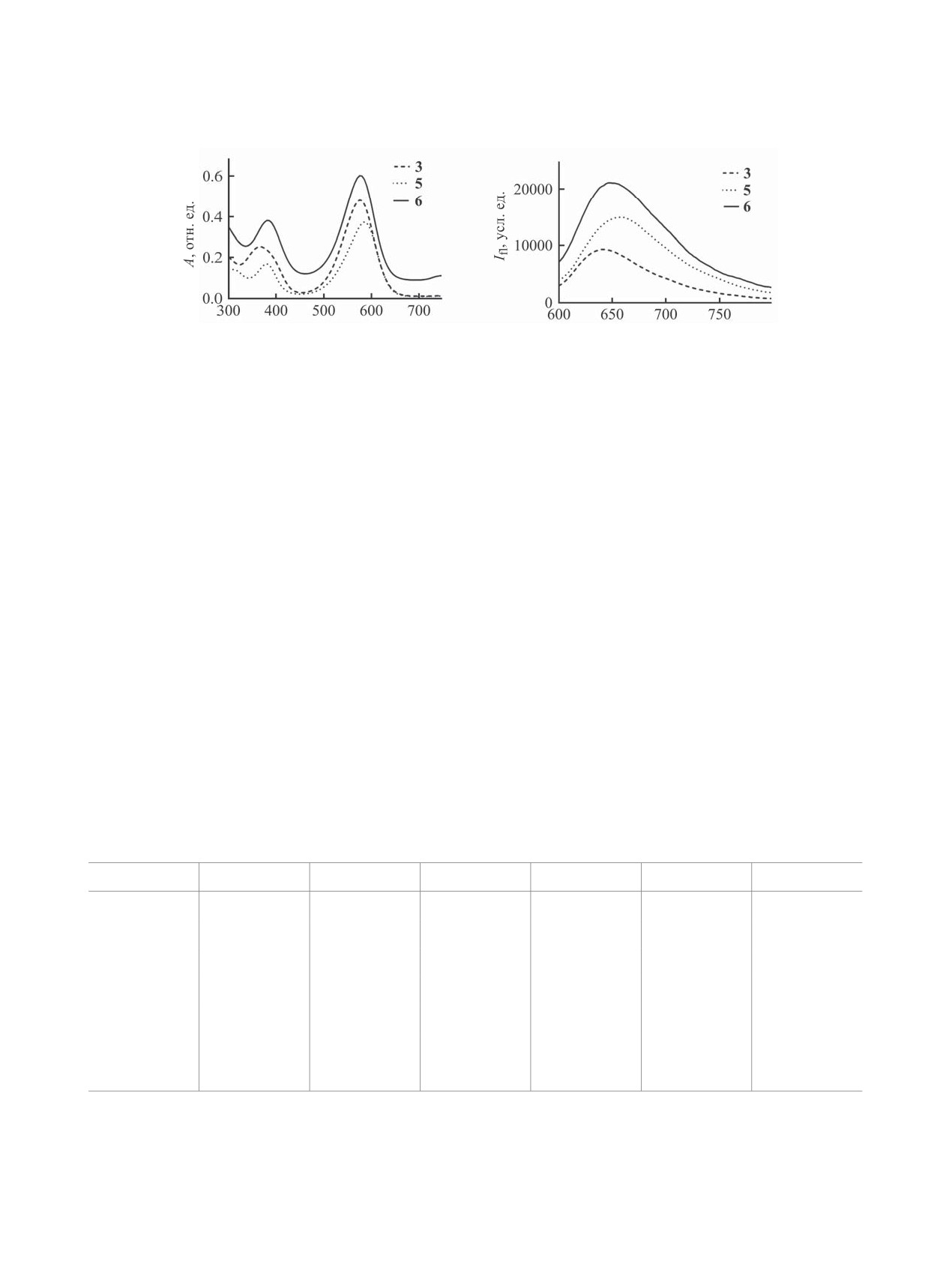
Рис. 1. Спектры поглощения (а) и эмиссии (б) (λex = 580 нм) в воде для порфиразинов 3, 5 и 6.
данного фотосенсибилизатора для здоровых тка-
3, 5, 6. Все новые порфиразины имеют спектры
ней организма.
поглощения, типичные для тетрапиррольных ма-
В настоящей работе мы представляем результа-
кроциклов.
ты исследования фотофизических и цитотоксиче-
В табл. 1 приведены фотофизические свойства,
ских свойств некоторых новых цианоарилпорфи-
важные для оценки потенциального применения в
разиновых пигментов, а также синтезированных
качестве фотосенсибилизатора для фотодинамиче-
нами ранее [14, 17, 20], демонстрирующие сильное
ской терапии рака, для всего ряда представленных
влияние как природы, так и положения различных
в данной работе порфиразинов. Интересно, что
заместителей в фенильном кольце на величину и
в большинстве рассмотренных случаев наличие
соотношение фотоиндуцированной и темновой
заместителей в фенильном кольце не оказывает
цитотоксичности.
существенного влияния на положение Q-полосы.
На схеме 1 приведены структуры новых и ра-
Это говорит о том, что введенные заместители
нее описанных [14, 18, 20] цианоарилпорфирази-
не вносят существенного вклада в систему π-со-
нов 1-7, исследованных в данной работе с точки
пряжения макроцикла. Исключение составляют
зрения влияния ароматического обрамления ма-
пентафторфенильные заместители в соединении
кроцикла на фотодинамическую активность сое-
7, которые обеспечивают существенный сдвиг
динений. Синтез новых порфиразинов 3, 5 и 6 осу-
Q-полосы этого порфиразина в красную область
ществляли согласно схеме 2.
спектра, природа которого пока остается неясной.
На рис. 1 приведены спектры поглощения и
Характерной особенностью всего ряда рас-
эмиссии для впервые полученных порфиразинов
сматриваемых порфиразинов является сильная
Таблица 1. Максимумы поглощения (Q-полоса) и флуоресценции в красной области, квантовый выход флуоресцен-
ции, молярный коэффициент экстинкции (lgε) порфиразинов 1-7 в водеа
№
Q-полоса, нм
lgε
λem, нм
Φ, %б
αв
Ссылка
1
579
4.23
650
0.3
0.5
[10]
2
579
4.42
650
0.3
0.6
[4, 7, 10]
3
576
4.63
645
0.7
0.5
4
585
4.53
650
0.4
0.3
[4, 10]
5
586
4.62
655
0.6
0.5
6
576
4.68
650
0.5
0.6
7
606
4.52
695
0.1
0.4
[10]
а c = 5 мкмол/л. б Квантовый выход рассчитан относительно крезола фиолетового, λвозб = 580 нм. в Значение параметра α в урав-
нениях Ферстера-Хоффмана.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
НОВЫЕ ЦИАНОАРИЛПОРФИР
АЗИНЫ
277
чувствительность фотофизических параметров к
локальной вязкости. Это связано с возможностью
безызлучательной релаксации возбужденного со-
стояния молекулы цианоарилпорфиразина (тем-
новое состояние), когда вследствие возбуждения
порфиразина светом и переноса заряда с π-донор-
ных арильных групп на электроно-акцепторные
CN-группы имеет место диссипация энергии воз-
буждения за счет внутримолекулярного вращения
мобильных сегментов молекулы красителя [18,
21-23]. Чем выше вязкость среды, тем более за-
Ȝ ɧɦ
труднено такое внутримолекулярное вращение,
выше квантовый выход флуоресценции и время
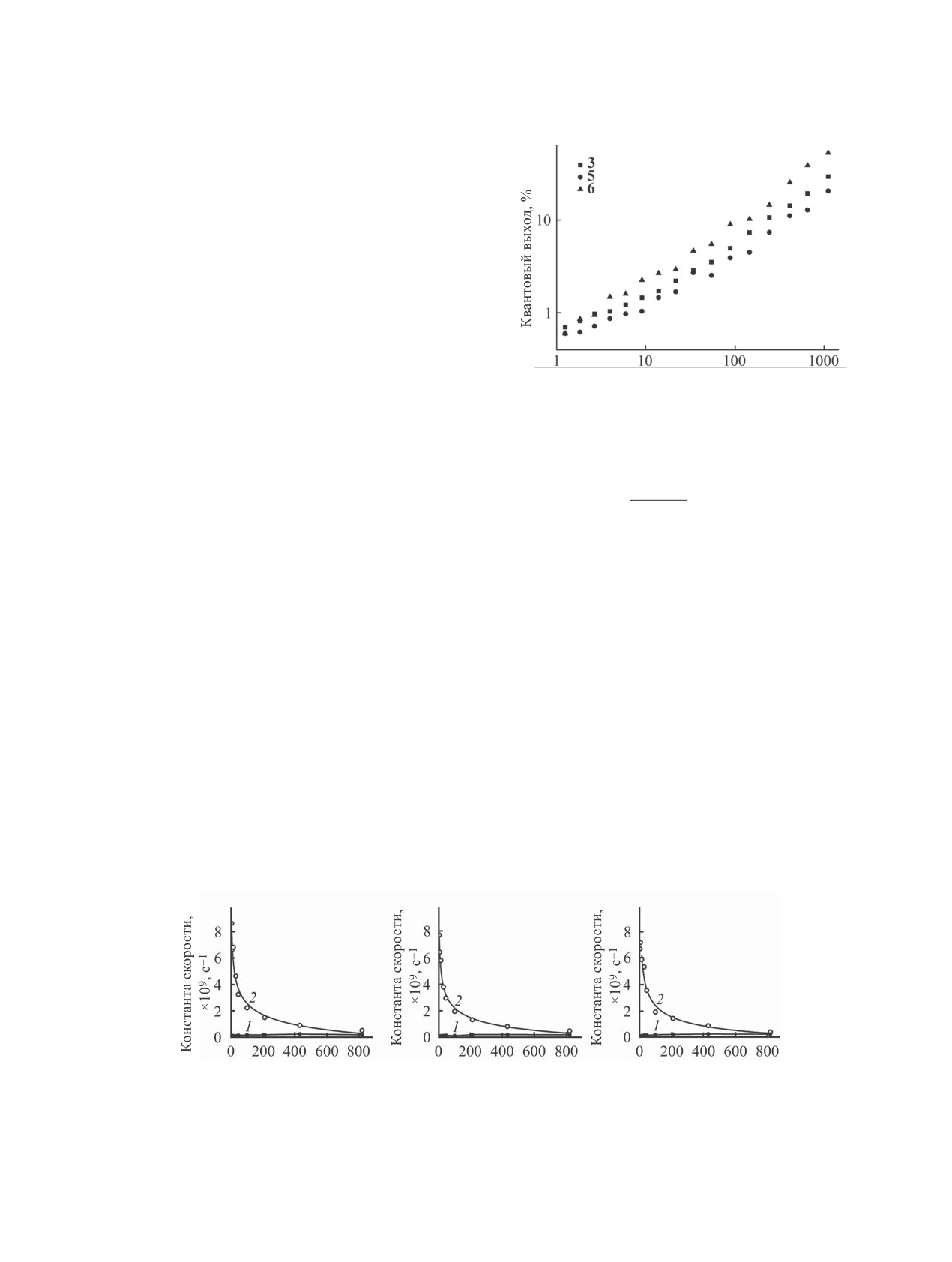
Рис. 2. Зависимость квантового выхода и времени жиз-
ее затухания. Зависимость этих фотофизических
ни флуоресценции порфиразинов 3, 5 и 6 от вязкости
параметров от вязкости для таких флуорофоров,
среды (модельные этанольно-глицериновые смеси).
определяемых в литературе термином «флуорес-
центные молекулярные роторы», описывается из-
k
(3)
ĭf =
= krIJav.
вестными уравнениями Ферстера-Хоффмана (1).
kr + knt
Все впервые полученные в данной работе ци-
lgΦ = z + αlgη,
(1)
аноарилпорфиразины (3, 5, 6), так же как и ранее
где Φ - квантовый выход, z и α - константы, η -
полученные соединения 1, 2, 4 и 7 [14, 20], являют-
вязкость.
ся типичными флуоресцентными молекулярными
Аналогичное уравнение существует и для дру-
роторами, что подтверждается хорошим соответ-
гого параметра флуоресценции - времени жизни
ствием уравнениям Ферстера-Хоффмана зависи-
[24].
мостей интенсивности флуоресценции и ее време-
lgτ = lg(z/kr) + αlgη,
(2)
ни жизни от вязкости среды (рис. 2).
где τ - время жизни возбужденного состояния, η -
Представленные на рис. 3 зависимости кон-
вязкость, z и α - константы, kr - константа скорости
стант скорости излучательных и безызлучатель-
излучательного перехода.
ных переходов от вязкости среды являются убеди-
Для порфиразинов константы скорости излу-
тельным доказательством принадлежности новых
чательных и безызлучательных переходов рассчи-
порфиразиновых пигментов к ряду флуоресцент-
тывали из значений параметров флуоресценции
ных молекулярных роторов. Как видно из рисунка,
(квантового выхода Φf и времени жизни τav), урав-
константа скорости безызлучательного перехода
нение 3) [23].
резко снижается при увеличении вязкости, тогда
ɚ
ɛ
ɜ
ȼɹɡɤɨɫɬɶ ɫɉ
ȼɹɡɤɨɫɬɶ ɫɉ
ȼɹɡɤɨɫɬɶ ɫɉ
Рис. 3. Зависимость констант скорости излучательного (1) и безызлучательного (2) переходов от вязкости этанольно-гли-
цериновой смеси при 25°С для порфиразинов 3 (а), 5 (б) и 6 (в).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
278
ЛЕРМОНТОВА и др.
Таблица 2. Значения IC50 в условиях облучения светом (λ = 615-635 нм) и темновой цитотоксичности цианоарил-
порфиразинов с различными арильными группами в обрамлении макроцикла
№
IC50(light), моль/л
IC50(dark), моль/л
IC50(dark)/ IC50(light)
1
3.7×10-6
1.1×10-5
3.0
2
8.0×107
6.9×10-6
8.6
3
1.3×106
2.1×105
16.1
4
3×106
1.4×105
4.7
5
2.4×106
1.1×105
4.6
6
2.4×106
1.2×105
5.0
7
9×107
3.6×106
4 .0
как на константу скорости излучательного перехо-
атомами фтора в арильных группах, обрамляющих
да вязкость практически не влияет.
макроцикл. Замена атома фтора (2) в пара-положе-
нии фенильной группы на группу OMe (3) лишь
Описанные выше фотофизические особенно-
сти цианоарилпорфиразиновых фотосенсибилиза-
несущественно снижает фотоиндуцированную
цитотоксичность IC50, но в то же время значитель-
торов открывают возможность использования их в
качестве зондов локальной вязкости, в том числе
но (почти в 2 раза) уменьшает цитотоксичность
порфиразина в темноте. Это позволяет надеяться
и внутриклеточной. Вязкость является важным па-
раметром, определяющим функциональный статус
на более высокую эффективность соединения 3 в
качестве фотосенсибилизатора для фотодинами-
клетки и ее жизнеспособность. Именно внутри-
клеточная вязкость определяет скорость диффузии
ческой терапии рака, поскольку уменьшается соб-
различных молекул, а, следовательно, и скорость
ственное токсическое воздействие этого порфира-
внутриклеточных бимолекулярных реакций, свя-
зина на здоровые ткани, не подвергавшиеся облу-
занных с ее питанием, энергетическим обменом, а
чению. Отношение ингибирующих концентраций
также разнообразными сигнальными процессами,
в темновых условиях и после облучения IC50(dark)/
отвечающими за ее жизнеспособность.
IC50(light) заметно увеличивается. Другими сло-
вами, наблюдается существенный рост потенци-
Для оценки новых цианоарилпорфиразинов как
ального терапевтического индекса соединения 3.
потенциальных фотосенсибилизаторов нами про-
В целом, исходя из полученных данных (табл. 2),
ведено измерение их темновой и фотоиндуциро-
можно предположить, что заместители в мета- и
ванной цитотоксичности на клетках эпидермоид-
орто-положениях не приводят к усилению фото-
ной карциномы человека линии А431. Известно,
динамической активности. При этом интересно
что широко распространенным эксперименталь-
отметить, что при отсутствии заместителей в фе-
ным методом такой оценки является метод МТТ-
нильной группе был получен наиболее слабый ре-
тестирования [25], т. е. измерение концентрации
зультат с точки зрения величины терапевтического
препарата, вызывающей снижение роста клеток
индекса.
(или их гибель) на 50% (IC50). Эта величина из-
мерялась как в темновых условиях, так в усло-
Таким образом, проведенные исследования по-
виях облучения светом. Полученные величины
зволили выяснить детали тонкой настройки фото-
IC50 приведены в табл. 2. Приведенные данные
физических и фотодинамических свойств цианоа-
демонстрируют заметную фотодинамическую ак-
рилпорфиразинов для повышения их потенциала
тивность всего ряда рассмотренных соединений.
при использовании в качестве фотосенсибилизато-
Самую высокую фотоиндуцированную цитоток-
ров для фотодинамической терапии рака, а также
сичность показывают цианоарилпорфиразины с
оптических зондов внутриклеточной вязкости.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
НОВЫЕ ЦИАНОАРИЛПОРФИР
АЗИНЫ
279
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ИК спектр, ν, cм-1: 2224 (C≡N). Спектр ЯМР 1H
(CDCl3), δ, м. д. (J, Гц): 3.93 с (3H, CH3О), 6.99
ИК спектры соединений в виде суспензий в
д (1H, 3J = 8.5 Гц), 7.08 т (1H, 3J = 7.7 Гц), 7.59 т
вазелиновом масле регистрировали на ИК Фурье-
(1H, 3J = 7.2 Гц), 8.18 д (1H, 3J = 9.1 Гц), 8.31 с [1H,
спектрометре ФСМ 1201. Спектры поглощения
CH=C(CN)2]. Масс-спектр, m/z (Iотн, %): 184 (100).
в УФ и видимой области снимали на спектроме-
тре PerkinElmer Lambda 25. Спектры ЯМР 1Н
2-(3-Метокси-4-этоксифенил)-1,1-дициано-
записывали на приборе Bruker Avance DPX-200
этилен (10). Выход 65%, желтое твердое веще-
(200 МГц) при 25°С. Исследования флуоресцен-
ство. ИК спектр, ν, cм-1: 2220 (C≡N). Спектр ЯМР
ции в стационарном режиме были проведены
1H (CDCl3), δ, м. д. (J, Гц ): 1.52 т (3Н, CH3CH2О,
на спектрометре PerkinElmer LS 55 в диапазоне
3J = 7.0), 3.93 с (3Н, CH3О), 4.21 к (2Н, CH3CH2О,
длин волн 300-800 нм. Масс-хроматограммы по-
3J = 7.0), 6.94 д (1Н, СНАr, 3J = 8.4), 7.39 д (1Н,
лучены на хромато-масс-спектрометре PolarisQ/
СНАr, 3J = 7.4), 7.63 с (1Н, СНАr), 7.68 с [1Н,
CH=C(CN)2]. Масс-спектр, m/z (Iотн, %): 228 (100).
TraceGCUltra. Динамическую вязкость каждой
из бинарных этанол(метанол)глицериновых сме-
Синтез 2-арил-1,1,2-трицианоэтанов 11-13.
сей измеряли с использованием вискозиметра
Соответствующий
2-арил-1,1-дицианоэтилен
Штабингера (SVM 3000, Anton Paar) с точностью
(10 ммоль) растворяли в 150 мл EtOH, добавляли
±0.35%. Растворение порфиразинов осуществляли
1.30 г (20 ммоль) KCN, предварительно раство-
механическим перемешиванием и обработкой рас-
ренного в 80 мл воды, затем в реакционную смесь
твора ультразвуком в течение не менее 15 мин.
добавляли 240 мл воды. Полученную смесь пере-
Все операции по синтезу и анализу соединений
мешивали в течение 45 мин при комнатной темпе-
проводили с использованием абсолютированных
ратуре. Далее добавляли 6 мл 37%-ной HCl. После
растворителей. 2-Метоксибензальдегид, 4-меток-
этого реакционную смесь охлаждали на ледяной
сибензальдегид, 3-метокси-4-этоксибензальдегид,
бане. Осадок отфильтровывали, тщательно про-
малонодинитрил, N-хлорсукцинимид - коммерче-
мывали водой и сушили при комнатной темпера-
ские продукты (Sigma Aldrich). Бис(инденил)ит-
туре и пониженном давлении.
тербий был синтезирован по методике [26].
2-(4-Метоксифенил)-1,1,2-трицианоэтан (11).
Синтез порфиразинов 1, 2, 4 и 7 проводи-
Выход 76%, белое вещество. ИК спектр, ν, cм-1:
ли методами, описанными ранее [14, 17, 20].
2250 (C≡N). Спектр ЯМР 1H (CDCl3), δ, м. д. (J,
Арилтрицианэтилены получали методом трехста-
Гц ): 7.42 д (2Н, 3J = 8.7), 7.01 д (2Н, 3J = 8.7), 4.42
дийного синтеза, используя в качестве стартового
д [1Н, CH(СN)-CH(CN)2, 3J = 5.9], 4.23 д [1Н,
соединения соответствующие замещенные бен-
CH(СN)-CH(CN)2, 3J = 5.9], 3.85 с (3Н, CH3О).
зальдегиды [27].
Масс-спектр, m/z (Iотн, %): 211 (5).
Синтез 2-арил-1,1-дицианоэтиленов 8-10. К
2-(2-Метоксифенил)-1,1,2-трицианоэтан
раствору 15 ммоль замещенного бензальдегида в
(12). Выход 83%, белое вещество. ИК спектр, ν,
100 мл EtOH добавляли 0.99 г (15 ммоль) мало-
cм-1: 2257 (C≡N). Спектр ЯМР 1H (CDCl3), δ, м. д.
нодинитрила и 2 капли пиперидина. Реакционную
(J, Гц ): 3.94 с (3Н, CH3О), 4.45 д [1Н, CH(СN)-
смесь перемешивали в течение 24 ч при комнатной
CH(CN)2, 3J = 5.8], 4.82 д [1Н, CH(СN)-CH(CN)2,
температуре. Осадок отфильтровывали, промыва-
3J = 5.8], 7.00 д (1Н, СНАr, 3J = 8.3), 7.50 т (1Н,
ли водой (4×80 мл) и сушили при комнатной тем-
СНАr, 3J = 7.9), 7.58 д (1Н, СНАr, 3J = 6.3). Масс-
пературе и пониженном давлении.
спектр, m/z (Iотн, %): 211 (8).
2-(4-Метоксифенил)-1,1-дицианоэтилен
(8).
2-(3-Метокси-4-этоксифенил)-1,1,2-три-
Выход 75%, желтое твердое вещество. ИК спектр,
цианоэтан (13). Выход 88%, белое вещество.
ν, cм-1: 2223 (C≡N). Спектр ЯМР 1H (CDCl3), δ, м. д.
ИК спектр, ν, cм-1: 2255 (C≡N). Спектр ЯМР 1H
(J, Гц ):
3.91 с (3Н, CH3О), 7.01 д (2Н, СНАr,
(CDCl3), δ, м. д. (J, Гц): 1.49 т (3Н, CH3CH2О, 3J =
3J = 8.9), 7.90 д (2Н, СНАr, 3J = 8.9), 7.65 с [1Н,
7.0), 3.92 с (3Н, CH3О), 4.21 к (2Н, CH3CH2О, 3J =
CH=C(CN)2]. Масс-спектр, m/z (Iотн, %): 184 (100).
7.0), 4.21 д [1Н, CH(СN)-CH(CN)2, 3J 5.8], 4.39 д
2-(2-Метоксифенил)-1,1-дицианоэтилен
(9).
[1Н, CH(СN)-CH(CN)2, 3J = 5.8], 6.91-7.05 м (3Н,
Выход
78%, светло-желтое твердое вещество.
СНАr). Масс-спектр, m/z (Iотн, %): 255 (10).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
280
ЛЕРМОНТОВА и др.
Синтез 1-арил-1,1,2-трицианоэтиленов 14-
вали при комнатной температуре в течение 30 мин.
16. К полученному 2-арил-1,1,2-трицианоэтану
Далее добавляли 30 мл воды, образовавшийся оса-
(6.4 ммоль), растворенному в 100 мл Et2O, до-
док центрифугировали и тщательно промывали
бавляли 1.20 г (9.0 ммоль) N-хлорсукцинимида.
водой до нейтральной среды. Продукт реакции
Реакционную смесь перемешивали, охлаждая
очищали с помощью колоночной хроматографии
колбу ледяной баней. Через 1 ч добавляли 150 мл
(силикагель 60, 40-60 мкм, элюент - ТГФ).
воды, отделяли органический слой и промывали
Тетра(4-метоксифенил)тетрацианопорфира-
его водой (3×150 мл). Растворитель удаляли при
зин (3). Выход 30%, черное твердое вещество. ИК
пониженном давлении. Продукт возгоняли при по-
спектр (KBr), ν, cм-1: 3406 (N-H), 2840 (O-CН3),
ниженном давлении.
2201 (С≡N), 1603 (C=N), 1512, 1497 (CAr-CAr);
2-(4-Метоксифенил)-1,1,2-трицианоэтилен
1255, 1217, 1043, 1028 (CAr-O-CAlk). УФ спектр
(14). Выход 69%, желтое твердое вещество. ИК
(Н2О), λmax, нм: 365 (полоса Соре), 576 (Q-полоса).
спектр, ν, cм-1: 2226 (C≡N). Спектр ЯМР 1H
Спектр ЯМР 1H (CDCl3), δ, м. д. (J, Гц): 3.87 с (12Н,
CH3О), 7.02 д (8Н, СНАr, 3J = 8.8), 7.44 д (8Н, СНАr,
(CDCl3), δ, м. д. (J, Гц): 3.96 с (3Н, CH3О), 7.08
3J = 8.8), 7.56 с (2Н, NH). Масс-спектр, m/z (Iотн,
д (2Н, СНАr, 3J = 9.1), 8.10 д (2Н, СНАr, 3J = 9.1).
%): 838 [M]+, 857 [M + Н2О]+, 808 [M - СН3О]+.
Масс-спектр, m/z (Iотн, %): 209 (100).
Тетра(2-метоксифенил)тетрацианопорфира-
2-(2-Метоксифенил)-1,1,2-трицианоэтилен
зин (5). Выход 28%, черное твердое вещество. ИК
(15). Выход 72%, желтое твердое вещество. ИК
спектр (KBr), ν, cм-1: 3435 (N-H), 3066 (CAr-Н),
спектр, ν, cм-1: 2240 (C≡N). Спектр ЯМР 1H
2838 (O-CН3), 2205 (С≡N), 1598 (C=N); 1504, 1493
(CDCl3), δ, м. д. (J, Гц): 3.99 с (3Н, CH3О), 7.07 т
(CAr-Car); 1253, 1216, 1043, 1023 (CAr-O-CAlk). УФ
(1Н, 3J = 8.3), 7.15 д (1Н, СНАr, 3J = 7.6), 7.55 д (1Н,
спектр (Н2О), λmax, нм: 312, 380 (полоса Соре),
СНАr, 3J = 6.6), 7.64 т (1Н, СНАr, 3J = 7.1). Масс-
586 (Q-полоса). Спектр ЯМР 1H (CDCl3), δ, м. д.
спектр, m/z (Iотн, %): 209 (100).
(J, Гц): 3.77 с (12Н, CH3О), 7.05 т (4H, СНАr, 3J =
2-(3-Метокси-4-этоксифенил)-1,1,2-три-
7.5), 7.15 д (8H, СНАr, 3J = 8.2), 7.52 т (4H, СНАr,
цианоэтилен (16). Выход 95%, оранжевое твер-
3J = 8.8), 8.47 с (2Н, NH). Масс-спектр, m/z (Iотн,
дое вещество. ИК спектр, ν, cм-1: 2220 (C≡N).
%): 838 [M]+, 824 [M - СН3]+, 808 [M - СН3О]+.
Спектр ЯМР 1H (CDCl3), δ, м. д. (J, Гц): 1.54 т (3Н,
Тетра(3-метокси-4-этоксифенил)тетрациа-
CH3CH2О, 3J = 7.0), 3.95 с (3Н, CH3О), 4.25 к (2Н,
нопорфиразин (6). Выход 34%, черное твердое
CH3CH2О, 3J = 7.0), 7.00 д (1Н, СНАr, 3J = 8.3),
вещество. ИК спектр (KBr), ν, cм-1: 3403 (N-H),
7.70-7.75 м (2Н, СНАr). Масс-спектр, m/z (Iотн, %):
2853 (O-CAlk), 2201 (С≡N), 1597 (C=N); 1515,
253 (50).
1500 (CAr-CAr); 1257, 1217, 1030 (CAr-O-CAlk).
Синтез комплексов иттербия 17-19. Раствор
УФ спектр (Н2О), λmax, нм: 383 (полоса Соре), 576
2.3 ммоль соответствующего
2-арил-1,1,2-три-
(Q-полоса). Спектр ЯМР 1H (CDCl3), δ, м. д. (J,
цианоэтилена 14-16 в предварительно дегази-
Гц): 1.42 т (12Н, CH3CH2О, 3J = 6.9), 3.76 с (12Н,
рованном TГФ (5 мл) в инертной атмосфере не-
CH3О), 4.13 к (8Н, CH3CH2О, 3J = 7.0), 6.97-7.09
большими порциями добавляли к раствору 0.25 г
м (12Н, СНАr), 7.50 с (2Н, NH). Масс-спектр, m/z
(0.46 ммоль) бисинденильного комплекса иттер-
(Iотн, %): 1014 [M]+.
бия(II) в 5 мл ТГФ. Через 1 сут раствор фильтро-
Измерение фотоиндуцированной IC50(light)
вали в вакууме. Для удаления из смеси не всту-
и темновой IC50(dark) цитотоксичности.
пившего в реакцию 2-арил-1,1,2-трицианэтилена
Жизнеспособность клеточной культуры оцени-
и его комплекса с иттербием полученный раствор
вали с помощью МТТ-теста [25]. Измерение оп-
промывали предварительно дегазированным толу-
тической плотности проводили на планшетном
олом до исчезновения окраски. Продукт реакции
спектрофотометре Synergy MX (BioTek, США) на
сушили при пониженном давлении.
длине волны 570 нм. Жизнеспособность клеток
Синтез порфиразинов
3,
5,
6. Раствор
оценивали по отношению величины оптической
0.14 ммоль соответствующего комплекса иттербия
плотности раствора формазана в каждой пробе к
17-19 в 2 мл трифторуксусной кислоты перемеши-
контролю (без облучения). В случае определения
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
НОВЫЕ ЦИАНОАРИЛПОРФИР
АЗИНЫ
281
темновой цитотоксичности облучения клеток не
ФОНДОВАЯ ПОДДЕРЖКА
проводили.
Работа выполнена при финансовой поддержке
Измерение среднего времени затухания
Президента РФ (грант МК-1469.2019.3, синтез и
флуоресценции соединений 3, 5 и 6. Серия
исследование свойств порфиразина 1) с исполь-
измерений времени затухания флуоресценции
зованием оборудования Аналитического центра
порфиразинов была проведена в пикосекундном
Института металлоорганической химии РАН в рам-
временном интервале с использованием техники
ках госзадания (№ АААА-А16-116122110055-5).
кореллированного по времени счета единичных
фотонов (Тime-correlated Single Photon Counting,
КОНФЛИКТ ИНТЕРЕСОВ
TCSPC). В измерительной схеме были применены
компоненты системы TCSPC производства
Авторы заявляют об отсутствии конфликта
компании «Becker & Hickl, GmbH». Окно времени
интересов.
снятия данных было установлено в диапазоне
СПИСОК ЛИТЕРАТУРЫ
0-50 нс с числом каналов 1024. Для возбуждения
использовали
пикосекундный
волоконный
1. Henderson B.W., Dougherty T.J. // Photochem.
лазер SC-450 (Fianium Ltd, Великобритания)
Photobiol. 1992. Vol. 55. P. 145. doi 10.1111/j.1751-
с настраиваемым спектральным фильтром
1097.1992.tb04222.x
выходного сигнала в диапазоне
580-595 нм
2. Berg K., Selbo P.K., Weyergang A., Dietze A.,
(Chroma Tech., США). Флуоресцентный сигнал
Prasmickaite L., Bonsted A., Engesaeter B.O., Angell-
детектировали в спектральном диапазоне
Petersen E., Warloe T., Frandsen N., Hogset A. // J.
640-700 нм. Экспоненциальный характер
Microsc. 2005. Vol. 218. P. 133. doi 10.1111/j.1365-
затухания сигнала флуоресценции обусловлен
2818.2005.01471.x
фундаментальными
свойствами
кинетики
3. Dolmans D.E., Fukumura D., Jain R.K. // Nat. Rev.
релаксации возбужденного состояния молекул
Cancer 2003. Vol. 3. P. 380. doi 10.1038/nrc1071
флуорофора. Анализ кривых затухания и подбор
наиболее адекватной мультиэкспоненциальной
4. Dougherty T.J., Gomer C.J., Henderson B.W., Jori G.,
модели выполняли с помощью программного
Kessel D., Korbelik M., Moan J., Peng Q. // J. Natl.
обеспечения SPCImage (Becker & Hickl, GmbH) с
Cancer Inst. 1998. Vol. 90. P. 889. doi 10.1093/
последующей обработкой данных в Excel. Времена
jnci/90.12.889
затухания (τav) рассчитывали как средние времена
5. Ferlay J., Soerjomataram I., Dikshit R., Eser S.,
жизни компонентов флуоресценции, взвешенные
Mathers C., Rebelo M., Parkin D.M., Forman D., Bray
на их интегральную интенсивность.
F. // Int. J. Cancer. 2015. Vol. 136. P. E359. doi 10.1002/
ijc.29210
ȈaiIJi2
i
(4)
6. Niedre M., Patterson M.S., Wilson B.C. // Photochem.
IJav =
ȈaiIJi
Photobiol. 2002. Vol. 75. n 4. P. 382. doi 10.1562/
i
0031-8655(2002)0750382DNILDO2.0.CO2
Здесь ai and τi - амплитуды и времена жизни
7. Hoorelbeke D., Decrock E., Van Haver V., De Bock M.,
временных компонент, полученные при
Leybaert L. // Biochim. Biophys. Acta. 2018. Vol. 1865.
аппроксимации экспериментальных кривых
P. 1805. doi 10.1016/j.bbamcr.2018.07.022
затухания флуоресценции в рамках выбранной
8. Benov L. // Med. Principles and Practice. 2015. Vol. 24.
мультиэкспоненциальной
модели.
Серию
Suppl. 1. P. 14. doi 10.1159/000362416
измерений скорости затухания проводили в
стандартных
96-луночных планшетах. Лабора-
9. Castano A.P., Demidova T.N., Hamblin M.R. //
торный термостат ThermoStat plus (Eppendorf,
Photodiagn. Photodyn. Ther. 2004. Vol. 1. P. 279. doi
GmbH) использовали для контроля и стабили-
10.1016/S1572-1000(05)00007-4
зации температуры измеряемых растворов
10. Hoorelbeke D., Decrock E., Van Haver V., De Bock M.,
цианоарилпорфиразинов в этанольно-глицери-
Leybaert L. // Biochim. Biophys. Acta. 2018. Vol. 1865.
новых смесях.
P. 1805. doi 10.1016/j.bbamcr.2018.07.022
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
282
ЛЕРМОНТОВА и др.
11. Vesper B.J., Lee S., Hammer N.D., Elseth K.M., Ba-
Боярский В.П. // ЖOX. 2017. Т. 87. Вып. 3. C. 474;
rrett A.G.M., Hoffman B.M., Radosevich J.A. // J. Photo-
Lermontova S.A., Grigor’ev I.S., Peskova N.N., Ladilina
chem. Photobiol. (B). 2006. Vol. 82. P. 180. doi
E.Y., Balalaeva I.V., Klapshina L.G., Boyarskii V.P. //
10.1016/j.jphotobiol.2005.11.006
Russ. J. Gen. Chem. 2017. Vol. 87. N 3. P. 479. doi
12. Trivedi E.R., Harney A.S., Olive M.B., Podgorski I.,
10.1134/s1070363217030173
Moin K., Sloane B.F., Hoffman B.M. // Proc. Nat.
20. Лермонтова C.A., Григорьев И.С., Шилягина М.Ю.,
Acad. Sci. 2010. Vol. 107. N 4. P. 1284. doi 10.1073/
Пескова Н.Н., Балалаева И.В., Ширманова М.В.,
pnas.0912811107
Клапшина Л.Г. // ЖOX. 2016. Т. 86. Вып. 6.
13. Michel S.L.J., Hoffman B.M., Baum S.M., Barrett A.G.M. //
C. 1000; Lermontova S.A., Grigorev I.S., Shilyagi-
Progr. Inorg. Chem. 2001. Vol. 50. P.473. doi
na N.Yu., Peskova N.N., Balalaeva I.V., Shirmano-
10.1002/0471227110
va M.V., Klapshina L.G. // Russ. J. Gen. Chem. 2016.
Vol. 86. N 6. P. 1330. doi 10.1134/S1070363216060189
14. Izquierdo M.A., Vysniauskas A., Lermontova S.A.,
Grigoryev I.S., Shilyagina N.Y., Balalaeva I.V.,
21. Haidekker M.A., Theodorakis E.A. // J. Biol. Eng. 2010.
Klapshina L.G., Kuimova M.K. // J. Mater. Chem. (B).
Vol. 4. P. 11. doi 10.1186/1754-1611-4-11
2015. Vol. 3. P. 1089. doi 10.1039/c4tb01678e
22. Kuimova M.K., Botchway S.W., Parker A.W., Balaz M.,
15. Yuzhakova D.V., Lermontova S.A., Grigoryev I.S.,
Collins H.A., Anderson H.L., Suhling K., Ogilby P.R. //
Muravieva M.S., Gavrina A.I., Shirmanova M.V.,
Nat. Chem. 2009. Vol. 1. P. 69. doi 10.1038/nchem.120
Balalaeva I.V., Klapshina L.G., Zagaynova E.V. //
23. Kuimova, M. K. // Chimia. 2012ю Vol. 66. N 4. P. 159.
Biochim. Biophys. Acta. 2017. Vol. 1861. N 12. P. 3120.
doi 10.2533/chimia.2012.159
doi 10.1016/j.bbagen.2017.09.004
24. Förster, T., Hoffmann, G. // Zeitschrift Für Physikalische
16. Shilyagina N.Yu., Peskova N.N., Lermontova S.A.,
Chemie. 1971. Vol. 75. N 1-2. P. 63. doi 10.1524/
Brilkina A.A., Vodeneev V.A., Yakimansky A.V.,
zpch.1971.75.1_2.063
Klapshina L.G., Balalaeva I.V. // J. Biophotonics. 2017.
25. Фрешни Р. Культура животных клеток. М.: Бином,
Vol. 10. N 9. P. 1189. doi 10.1002/jbio.201600212
2010. 691 с.
17. Yakimansky A.V., Meleshko T.K., Ilgach D.M., Bau-
26. Гудиленков И.Д., Фукин Г.К., Баранов Е.В., Три-
man M.A., Anan’eva T.D., Klapshina L.G., Lermonto-
фонов А.А. // Изв. АН. Сер. хим. 2008. № 1. С. 39;
va S.A., Balalaeva I.V., Douglas W.E., // J. Polym. Sci.
(A). 2013. Vol. 51. P. 4267. doi 10.1002/ pola.26846
Gudilenkov I.D., Fukin G.K., Baranov E.V., Trifonov
A.A. // Russ. Chem. Bull. 2008. Vol. 57. N 1. P. 40. doi
18. Лермонтова С.А., Григорьев И.С., Ладилина Е.Ю.,
10.1007/s11172-008-0006-y
Балалаева И.В., Шилягина Н.Ю., Клапшина Л.Г. //
Коорд. хим. 2018. Т. 44. № 2. С. 151; Lermontova S.A.,
27. Harvey M.D., Pace J.T., Yee G.T. // Polyhedron. 2007.
Grigor’ev, I.S., Ladilina E.Y., Balalaeva I.V., Shilyagina
Vol. 26. P. 2037. doi 10.1016/j.poly.2006.09.097
N.Y., Klapshina L.G. // Russ. J. Coord. Chem. 2018.
28. Шилягина Н.Ю., Плеханов В.И., Шкунов И.В., Ши-
Vol. 44. P. 301. doi 10.1134/s1070328418040061
лягин П.А., Дубасова Л.В., Брилкина А.А., Соколо-
19. Лермонтова С.А., Григорьев И.С., Пескова Н.Н.,
ва Е.А., Турчин И.В., Балалаева И.В. // Современные
Ладилина Е.Ю., Балалаева И.В., Клапшина Л.Г.,
технологии в медицине. 2014. Т. 6. № 2. С. 15.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020
НОВЫЕ ЦИАНОАРИЛПОРФИР
АЗИНЫ
283
New Cyanoarylporphyrazines with High Sensitivity
of Photophysical Parameters to Viscosity As Perspective Agents
for Photodynamic Therapy
S. A. Lermontovaa, T. S. Lyubovaa, E. Yu. Ladilinaa, V. I. Plekhanovb, I. V. Balalaevac,
V. P. Boyarskiid, and L. G. Klapshinaa,b,*
a Razuvaev Institute of Organometallic Chemistry of the Russian Academy of Sciences, Nizhny Novgorod, 603950 Russia
b Institute of Applied Physics of the Russian Academy of Sciences, Nizhny Novgorod, 603950 Russia
c Lobachevsky State University of Nizhny Novgorod, Nizhny Novgorod, 603950 Russia
d St. Petersburg State University, St. Petersburg, 198504 Russia
*e-mail: klarisa@iomc.ras.ru
Received June 24, 2019; revised June 24, 2019; accepted June 27, 2019
A series of cyanoarylporphyrazine pigments was analyzed from the point of view of their photophysical prop-
erties and photodynamic activity dependence on the nature of the substituents and their position in the aromatic
ring. Replacement of the fluorine atom in the para-position with the methoxy group leads to a significant in-
crease in the ratio of the dark and photo-induced cytotoxicities, i.e. potential therapeutic index of porphyrazine
as photosensitizer on photodynamic cancer therapy.
Keywords: cyanoarylporphyrazines, photosensitizers, photo-induced and dark cytotoxicity, fluorescent
molecular rotors, optical probes of intracellular viscosity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 2 2020