ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 3, с. 353-364
УДК 547.883:544.6.018.2:544.632
СИНТЕЗ И ЭЛЕКТРОХИМИЧЕСКИЕ СВОЙСТВА
2-(4-R1-ФЕНИЛ)-6-(4-R2-ФЕНИЛ)-4-ФЕНИЛ-
3,4-ДИГИДРО-1,2,4,5-ТЕТРАЗИН-1(2Н)-ИЛОВ
© 2020 г. С. Г. Кострюков*, А. В. Баландина, А. Ш. Козлов, Е. В. Крайнов,
М. К. Пряничникова, О. Ю. Черняева, А. А. Ахматова, Ю. И. Люкшина
Национальный исследовательский Мордовский государственный университет
имени Н. П. Огарёва, ул. Большевистская 68, Саранск, 430005 Россия
*e -mail: kostryukov_sg@mail.ru
Поступило в Редакцию 17 сентября 2019 г.
После доработки 17 сентября 2019 г.
Принято к печати 20 сентября 2019 г.
Описана новая методология создания электроактивных компонентов для органических аккумуляторов,
основанная на построении молекулярной платформы на основе стабильных 3,4-дигидро-1,2,4,5-тетра-
зин-1(2Н)-ильных радикалов. Получена серия 2-(4-R1-фенил)-6-(4-R2-фенил)-4-фенил-3,4-дигидро-
1,2,4,5-тетразин-1(2Н)-илов с заместителями различной природы. Показано, что заместители R1 аро-
матического кольца в положении 2 тетразинильного фрагмента, влияют на значение потенциала окис-
ления радикала, но не влияют на значение потенциалов восстановления, в то время как заместители R2
ароматического кольца в положении 6 влияют на значения потенциалов восстановления и практически
не влияют на значения потенциала окисления. На основе полученных электрохимических данных уста-
новлена корреляция структура-значение потенциала для катодного и анодного процесса, c помощью
которой были получены триарилзамещенные 3,4-дигидро-1,2,4,5-тетразин-1(2Н)-ильные радикалы с
высокими значениями электрохимической щели.
Ключевые слова: 3,4-дигидро-1,2,4,5-тетразин-1(2Н)-ил, электронодонорный заместитель, электроно-
акцепторный заместитель, электродный потенциал, электрохимическая щель
DOI: 10.31857/S0044460X2003004X
Тетразинильные радикалы (вердазилы), полу-
троксильных радикалов [3]. Подходящими свой-
чение которых впервые было описано в 1964 г. [1],
ствами вердазильных радикалов, обуславливаю-
относятся к «электроноамфотерным» [2], т. е. спо-
щих их возможность применения в органических
собным как окисляться, так и восстанавливаться,
радикальных батареях [4], является отсутствие
образуя при этом стабильные катионы и анионы
склонности к димеризации, а также воздухо- и во-
(схема 1).
достойкость [5].
Вердазилы являются единственным семей-
ством нейтральных радикалов, стабильность кото-
В настоящее время основными направлениями
рых конкурирует со стабильностью известных ни-
исследования вердазильных радикалов являет-
Схема 1.
5
4
N
N
N N
N
N
+e-
6
3
−e-
C
C
C
C
C
C
−e-
1
2
+e
-
−
+
N N
N
N
N N
353
354
КОСТРЮКОВ и др.
Схема 2.
(1) CH2O, KHSO4,
4
5
5
4
ДМФА-H2O, 20-40oC
N NH
N
N
(2) NaOH, O2, 20oC
3
6
2
3
R
R2
N N
N N
2
1
1
2
2a-c
R1
1a-c
R1
R1 = R2 = H (a); R1 = H, R2 = Me (б); R1 = H, R2 = OMe (в); R1 = H, R2 = NMe2 (г); R1 = H, R2 = NO2 (д);
R1 = H, R2 = СN (е); R1 = Me, R2 = H (ж); R1 = OMe, R2 = H (з); R1 = NMe2, R2 = H (и); R1 = NO2,
R2 = H (к); R1 = CN, R2 = H (л); R1 = CN, R2 = Ме (м); R1 = CN, R2 = ОМе (н); R1 = CN, R2 = NMe2 (о);
R1 = Me, R2 = CN (п); R1 = ОMe, R2 = CN (р); R1 = NMe2, R2 = CN (с).
ся изучение их магнитных свойств [6-10] и ком-
полимеров, обладающего перестраиваемыми элек-
плексообразования [11-15]. В то же время окис-
трохимическими свойствами, что подтверждает
лительно-восстановительные свойства радикалов
возможность их использования для изготовления
данного типа исследовались значительно меньше.
функциональных окислительно-восстановитель-
Например, в работе [16] было исследовано элек-
ных тонких пленок.
трохимическое поведение трифенилвердазильного
Уникальная структура тетразинильных ради-
радикала в ДМФА в присутствии карбоновых кис-
калов позволяет тонко регулировать редокс-свой-
лот. В работе [17] методом циклической вольтам-
ства путем варьирования природы заместителей у
перометрии были изучены окислительно-восста-
атома азота (положение 2) и углерода (положение
новительные свойства некоторых вердазильных
6)
3,4-дигидро-1,2,4,5-тетразинового фрагмен-
радикалов. Найдена корреляция между распреде-
та. В настоящей работе представлены данные по
лением спинов электронов и окислительно-вос-
синтезу вердазильных радикалов с заместителями
становительными свойствами. Показано, что гра-
различной природы, находящимся в пара-положе-
ничные орбитали, по которым протекают процес-
ниях бензольных колец. Показано, что заместите-
сы окисления и восстановления, локализованы на
ли, ароматического кольца в положении 6 3,4-ди-
разных участках молекулы: наибольший вклад в
гидро-1,2,4,5-тетразинового фрагмента, сильно
процесс окисления вносит ВЗМО атома азота в
влияют на значения потенциалов восстановления
положении 2, а наибольший вклад в процесс вос-
и практически не влияют на значения потенциала
становления - НСМО атома углерода в положении
окисления, тогда как заместители ароматического
6. В дальнейшем была исследована симметричная
кольца в положении 2, наоборот, сильно влияют
цельноорганическая неводная окислительно-вос-
на значение потенциала окисления, но не влия-
становительная батарея проточного типа с ис-
ют на значение потенциалов восстановления. На
пользованием в качестве материала для хранения
основе полученных электрохимических данных
заряда 3-фенил-1,5-ди-п-толилвердазила, который
установлена корреляция типа структура-значение
может быть обратимо окислен и восстановлен в
потенциала для катодного и анодного процесса,
одноэлектронных процессах [18]. О возможно-
c помощью которой были получены замещенные
сти использования вердазильных радикалов в ка-
триарилвердазильные радикалы с рекордными по-
честве материалов для хранения электроэнергии
казателями значения электрохимической щели. В
упоминается также в обзоре [19]. В работе [20]
качестве экспресс-метода оценки значений элек-
описан синтез 6-оксовердазильных радикальных
трохимической щели полученных вердазильных
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
СИНТЕЗ И ЭЛЕКТРОХИМИЧЕСКИЕ СВОЙСТВА 2-(4-R1-ФЕНИЛ)-6-(4-R2-ФЕНИЛ)-4-ФЕНИЛ...
355
Схема 3.
Ph
NH
O
N
R1
PhNHNH2
5
1
Ph
NH
N
4
2
R2
N
N
R2
ДМФА, Py
4a-e
3a-e
3
0-25oC
NH2
+N2
Cl-
NaNO2
HCl
R2
R1
R1
6a-e
5a-e
2a-c
R1, R2 = H (a), Me (б), MeO (в), NMe2 (г), NO2 (д), CN (е).
радикалов использовали метод циклической воль-
обычно низкие [17]. В работе [21] на примере син-
тамерометрии (ЦВА).
теза 1,5-дифенил-3-арилвердазилов было показа-
В качестве объектов исследования были выбра-
но, что выходы формазанов увеличиваются при
использовании в качестве растворителя системы
ны триарилвердазильные радикалы 1a-c, имею-
щие заместители различной природы в пара-по-
ДМФА-пиридин.
ложениях бензольных фрагментов в положениях
Гидразоны 3a-е получены конденсацией альде-
2 и
6
3,4-дигидро-1,2,4,5-тетразинового цикла.
гидов 4a-е с фенилгидразином с выходом 60–90%
Радикалы 1a-c получали по классической схе-
по литературным методикам, их константы соот-
ме исходя из соответствующих формазанов 2a-c
ветствуют литературным данным.
(схема 2).
Строение формазанов
2a-с подтверждено
Соединения 2a-c синтезировали по реакции
методами ИК, ЯМР 1Н, 13С спектроскопиии и
фенилгидразонов
3a-е замещенных бензальде-
масс-спектрометрии. Так, в ИК спектрах присут-
гидов 4a-е с солями арилдиазония 5a-е, синте-
ствуют полосы поглощения, характерные для свя-
зированных из пара-замещенных анилинов 6a-е.
зей C=N (1600-1590 см-1), N-H (3400-3300 см-1)
Формазаны 2a-с циклизовали по реакции с фор-
и N=N (1500-1480 см-1). Вердазильные радикалы
мальдегидом в присутствии KHSO4 (схема
3).
1a-с были охарактеризованы с использованием
Однако при наличии заместителей в ароматиче-
ИК, УФ, ЭПР спектроскопии и масс-спектроме-
ских кольцах формазанов 2б-с циклизация про-
трии. В целом, все 2,6-диарил-4-фенил-3,4-диги-
текает труднее, поэтому реакции проводили при
дро-1,2,4,5-тетразин-1(2Н)-илы
1a-с представ-
40°С. Полученные лейкооснования окисляли про-
ляют собой мелкокристаллические вещества
пусканием воздуха до радикалов 1a-с. Следует от-
зеленого или коричневого цвета. В ИК спектрах
метить, что при наличии заместителей последняя
присутствует данных соединений полоса колеба-
стадия окисления требовала большего времени.
ний в области ~1150-1160 нм, характеризующая
Данный способ получения вердазильных ради-
вердазильные радикалы. Для бензольных раство-
калов, широко применяется, хотя и с некоторыми
ров радикалов 1a-с регистрируются устойчивые
ограничениями, например, при наличии сильных
во времени типичные спектры ЭПР, содержащие
электроноакцепторных заместителей в аромати-
9 широких линий с отношением интенсивности
ческом кольце бензальдегида, выходы формазанов
1:4:10:16:19:16:10:4:1, обусловленным взаимодей-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
356
КОСТРЮКОВ и др.
Электрохимические характеристики
2-(4-R1-фенил)-6-(4-R2-фенил)-4-фенил-3,4-дигидро-1,2,4,5-тетразин-1(2Н)-
илов 1a-с
№
R1
R2
Eox, В
Ered, В
Eщели, В
№
R1
R2
Eox, В
Ered, В
Eщели, В
1a
H
H
0.31
-0.81
1.12
1к
NO2
H
0.32
-0.64
0.96
1б
H
Me
0.24
-0.81
1.01
1л
CN
H
0.34
-0.65
0.99
1в
H
OMe
0.20
-0.85
1.05
1м
CN
Me
0.23
-0.70
0.93
1г
H
NMe2
0.16
-0.86
1.02
1н
CN
OMe
0.20
-0.67
0.87
1д
H
NO2
0.41
-0.65
1.06
1о
CN
NMe2
0.17
-0.67
0.84
1е
H
CN
0.38
-0.67
1.05
1п
Me
CN
0.33
-0.86
1.19
1ж
Me
H
0.29
-0.82
1.11
1р
OMe
CN
0.36
-0.87
1.23
1з
OMe
H
0.26
-0.87
1.13
1с
NMe2
CN
0.38
-0.88
1.24
1и
NMe2
H
0.24
-0.88
1.12
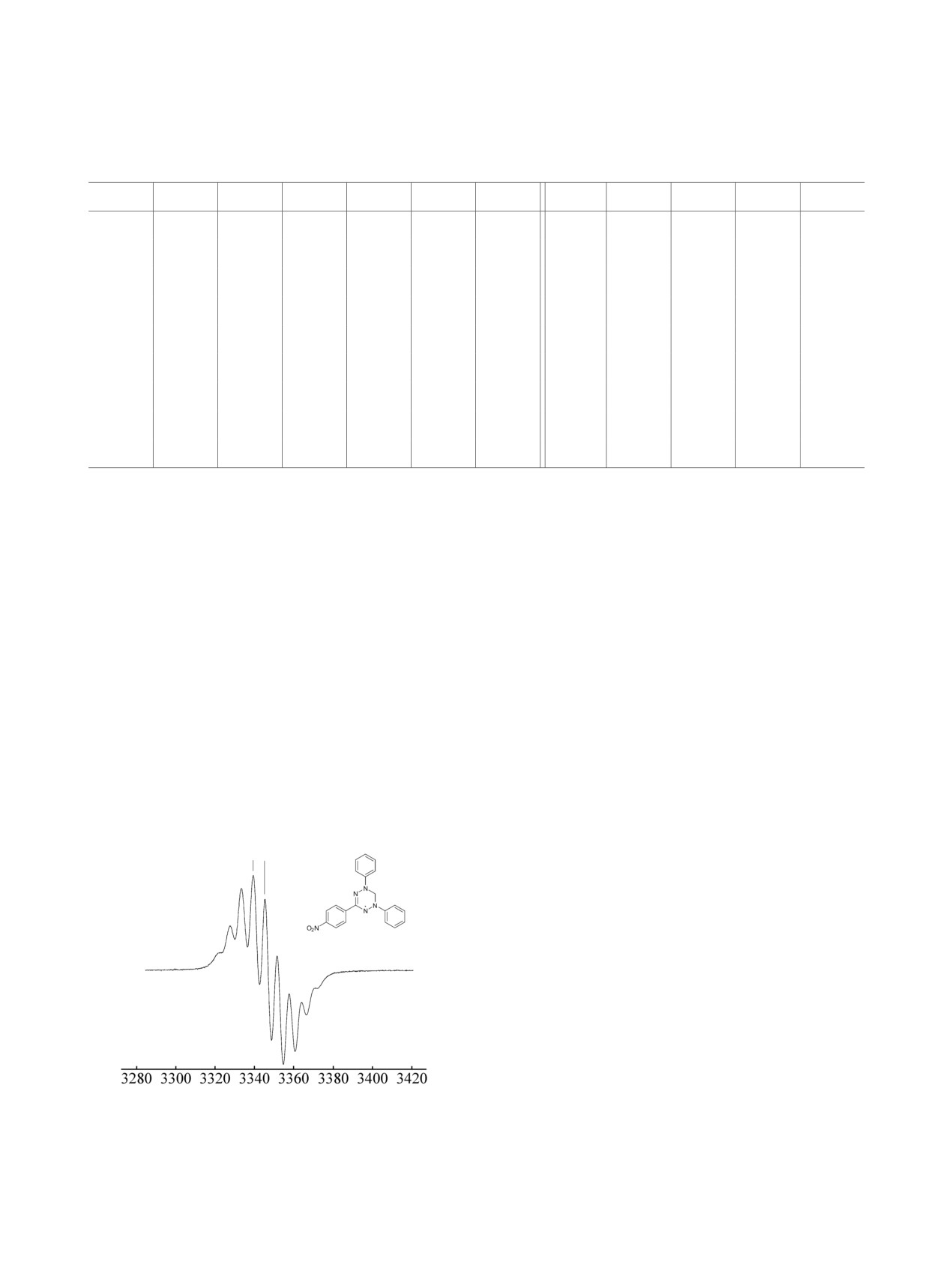
ствием неспаренного электрона с четырьмя спек-
дикалов происходит при отрицательных потенци-
трально эквивалентными атомами азота тетрази-
алах от -0.64 до -0.88 В (Ag/AgCl/KCl). В таблице
нового кольца. На рис. 1 представлен спектр ЭПР
приведены электрохимические характеристик сое-
вердазила 1г.
динений 1a-с.
Электрохимические свойства радикалов 1a-с
Как видно из таблицы, природа заместителя
исследовали методом циклической вольтамперо-
в пара-положении ароматического кольца поло-
метрии в растворе ацетонитрила с использова-
жения 2 сильнее влияет на процесс окисления и
нием в качестве фонового электролита Bu4NBF4.
значительно меньше - на процесс восстановления.
В качестве рабочего использовали стеклоугле-
Так, донорные заместители облегчают процесс
родный электрод, вспомогательным электродом
окисления, смещая Eox в катодную область [для
выступал платиновый, а электродом сравнения -
вердазила 1б (Me) на 0.07 В, радикала 1в (OМе) на
стандартный хлоридсеребряный. Практически все
0.11 В, вердазила 1г (NMe2) на 0.15 В по сравне-
радикалы, за исключением нитропроизводного 1д,
нию с радикалом 1а]. На процесс восстановление
демонстрируют полностью обратимые процессы
метильный радикал не влияет, метокси- и диме-
окисления и восстановления. Потенциалы окисле-
тиламиногруппы незначительно смещают Ered в
ния вердазилов 1a-с находятся в диапазоне от 0.17
анодную область на 0.04 и 0.05 В соответственно
до 0.41 В (Ag/AgCl/KCl). Восстановление этих ра-
по сравнению с вердазилом 1а. Акцепторные за-
местители облегчают процесс восстановления,
5.6 Гц
сдвигая Ered в катодную область [для вердазила 1д
(NO2) на 0.16 В и вердазила 1е (CN) на 0.14 В по
сравнению с радикалом 1а].
Заместитель ароматического кольца в положе-
нии 6 сильнее влияет на процесс восстановления и
значительно меньше - на процесс окисления. Так,
потенциал окисления (Eox) незначительно смеща-
ется в катодную область в случае соединений с ак-
цепторными заместителями 1к (NO2) и 1л (CN), а
в случае соединений с донорными заместителями
(Me, OMe, NMe2) - в анодную область. В то же
Магнитное поле, Гс
время наблюдается достаточно сильное влияние
на потенциал восстановления (Ered). Так, электро-
Рис. 1. ЭПР спектр вердазила 1д.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
СИНТЕЗ И ЭЛЕКТРОХИМИЧЕСКИЕ СВОЙСТВА 2-(4-R1-ФЕНИЛ)-6-(4-R2-ФЕНИЛ)-4-ФЕНИЛ...
357
ноакцепторные нитро- и цианогруппы смещают
величину Ered в катодную область относительно
соединения 1к (NO2) на 0.17 В, а для вердазила 1л
(CN) по сравнению с соединением 1а. Донорные
заместители незначительно влияют на потенциал
восстановления, смещая значение Ered в анодную
область: на 0.02 (1ж, Me), 0.05 (1з, OMe) и 0.07 В
(1и, NMe2) по сравнению с вердазилом 1а.
В целом для вердазильных радикалов 1б-л
величина электрохимической щели (Ещели
=
|Еox - Еred|) не сильно изменяется по сравнению с
Е, эВ
радикалом 1а.
При одновременном присутствии донорного
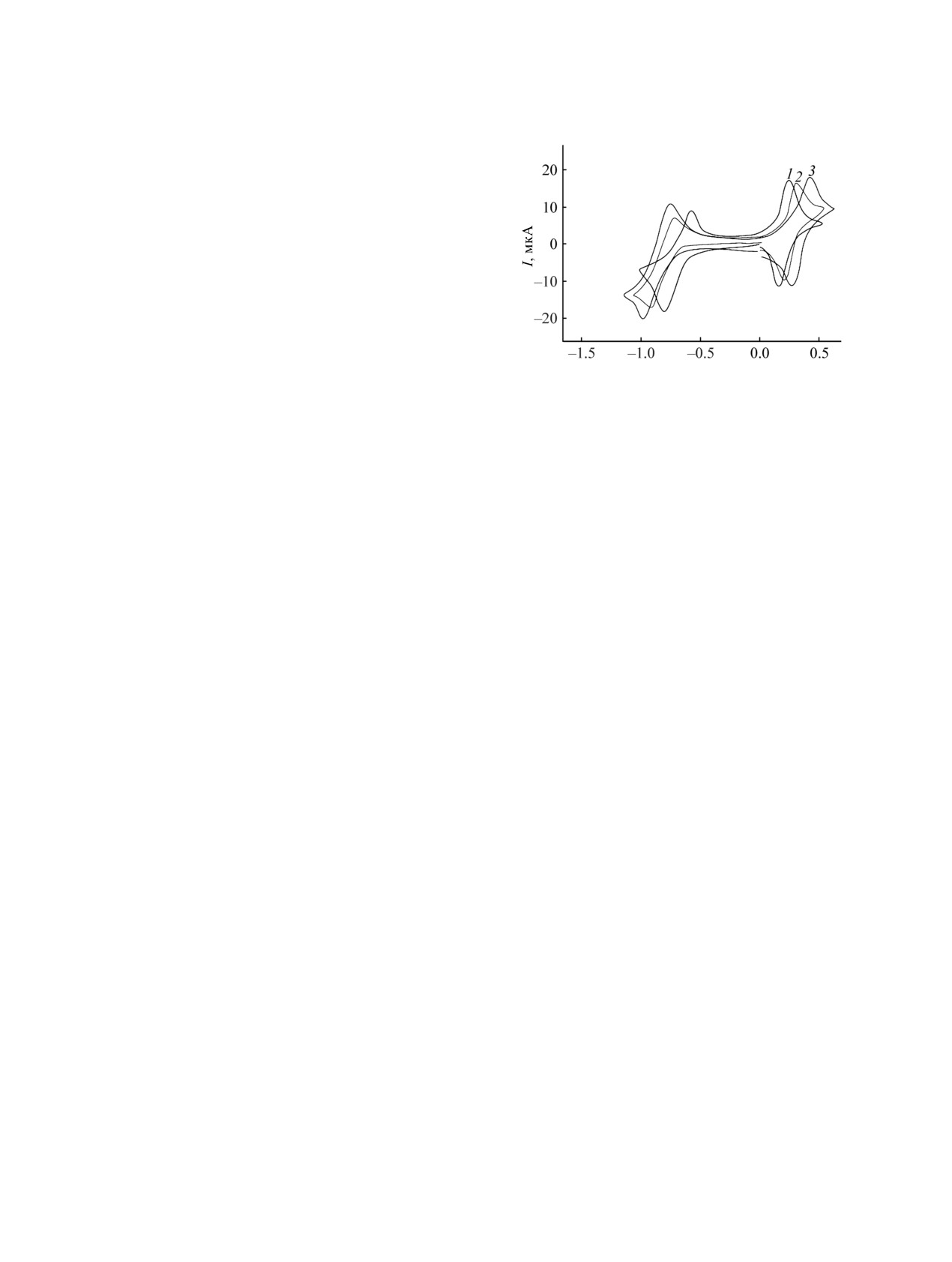
Рис. 2. Циклические вольтамперограммы соединений
1a, 1м и 1с.
(положение 2) и акцепторного (положение 6) за-
местителей (вердазильные радикалы 1п-с) наблю-
ты (Sigma Aldrich, Merk), были использованы без
дается более существенное увеличение значения
дополнительной очистки.
электрохимической щели. Это обусловлено тем,
Спектры ЯМР 1Н и 13С сняты на спектрометре
что электронодонорные группы в положении 2
JNM-ECX400 Jeol (400.1 и 100.6 MГц соответствен-
смещают значение Eox в катодную область, а элек-
троноакцепторная CN-группа в положении 6 сме-
но) для растворов веществ в CDCl3. ИК спектры
щает величину Eox в анодную область, тем самым
получены в таблетках KBr на Фурье-спектрометре
увеличивая разницу между пиковыми значениями
ИнфраЛЮМ ФТ-02. Элементный анализ выпол-
потенциалов окисления и восстановления.
нен на СHNS-анализаторе Vario MICRO. Условия
аналитической ТСХ: адсорбент - Silufol UV-245,
При обратном распределении заместителей
элюенты - бензол, метилен хлористый-этилаце-
(вердазилы 1м-о) наблюдается сужение электро-
тат (2:1), проявление в иодной камере. Для коло-
химической щели, так как акцепторная нитриль-
ночной хроматографии использовали силикагель
ная группа, находящаяся в положении 6 смещает
величину Eox в анодную область, а донорные груп-
L40/100μ; элюент - бензол. Температуры плавле-
пы смещают величину Eox в катодную область, тем
ния соединений определяли в запаянных стеклян-
самым уменьшая разницу между пиковыми значе-
ных капиллярах с использованием анализатора точ-
ниями потенциалов окисления и восстановления.
ки плавления МР-50 (Mettler Toledo, Швейцария).
Масс-спектры получены с помощью электрон-
На рис. 2 представлены ЦВА-кривые некото-
ной ионизации (70 эВ) на спектрометре KONIK
рых вердазильных радикалов, которые наилучшим
RBK-HRGC 5000B-MSQ12 (Испания) в режиме
образом показываются изменения в электрохими-
положительной ионизации. Электронные спек-
ческом поведении соединений 1a, 1о и 1с, обу-
тры в видимой области регистрировали на спек-
словленные влиянием заместителей.
трофотометре Shimadzu UV-2600. Спектры ЭПР
Величина электрохимической щели влияет
регистрировали с помощью ЭПР-спектрометра
на емкость аккумулятора на основе нейтральных
ESP 70-03XD/2. Электрохимические данные были
радикалов [22], поэтому использование в органи-
получены методом циклической вольтамероме-
ческих аккумуляторах радикалов, имеющих зна-
трии в растворе ацетонитрила (0.1 М. n-Bu4NBF4)
чительную разницу между электрохимическими
с использованием потенциостата Gamry (Канада)
потенциалами окисления и восстановления позво-
в электрохимической ячейке объемом 5 мл. В ка-
ляет значительно увеличить емкость устройства
честве рабочего электрода использовалb стекло-
хранения энергии.
углеродный электрод, S2 = 0.125 см2. Электрод
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
тщательно полировали и промывали перед изме-
Растворители перед использованием сушили и
рениями. Вспомогательным электродом выступал
перегоняли. Все реагенты - коммерческие продук-
платиновый, электродом сравнения - стандартный
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
358
КОСТРЮКОВ и др.
хлоридсеребряный электрод (E0 = 0.33 В в CH3CN
CH2Cl2 (3×20 мл). Объединенные органические
vs Fc/Fc+). Все растворы были полностью деаэри-
вытяжки промывали водой (3×10 мл), затем про-
рованы путем продувания через них аргона.
пускали через слой нейтрального Al2O3 и удаля-
ли растворитель в вакууме. Полученный продукт
Общая методика получения фенилгидразо-
растирали с метанолом.
нов 3a-е. К раствору 4.34 г (0.03 моль) солянокис-
лого фенилгидразина и 2.46 г безводного ацетата
1,3,5-Трифенилформазан (2a). Выход 1.97 г
натрия в 70 мл воды добавляли при постоянном
(65.6%), т. пл. 148–150°C (метанол). ИК спектр, ν,
перемешивании небольшими порциями раствор
см-1: 752.3 ср, 1018.3 с, 1234.5 с, 1493.1 с (N=N),
0.02 моль альдегида 4a-е в 25 мл диоксана. По
1511.9 с (N=N), 1597.2 с (C=N), 3353.2 сл (N-H).
окончании прибавления реакционную смесь пере-
Спектр ЯМР 1Н, δ, м. д.: 7.60-7.25 м (9H), 7.73 д.
д (4H, J = 8.0, 1.2 Гц), 8.15 д. т (2H, J = 8.0, 1.4 Гц),
мешивали при комнатной температуре ~20-60 мин.
15.38 с (1H, NH). Спектр ЯМР 13C, δС, м. д.: 119.3,
Осадок отфильтровывали и промывали на фильтре
122.7, 126.4, 128.1, 128.4, 129.0, 129.5, 129.6, 130.0,
водой, затем сушили на воздухе. Целевые продук-
130.4, 138.0, 141.7, 148.5. УФ спектр (CH2Cl2),
ты очищали перекристаллизацией. Температуры
λmax, нм (ε, М.·см-1): 270 (17250), 300 (22000), 488
плавления и спектральные характеристики совпа-
(14250). Mасс-спектр, m/z (Iотн, %): 300 (30) [M]+,
дают с литературными данными.
285 (25), 272 (33), 246 (34), 194 (100), 167 (40), 103
1-Бензилиден-2-фенилгидразон (3а). Выход
(40), 63 (50). Найдено, %: C 76.16; H 5.54; N 18.36.
4.19 г (72.6%), т. пл. 155-156°C (этанол).
C19H16N4. Вычислено, %: С 75.98; Н 5.37; N 18.65.
1-(4-Метилбензилиден)-2-фенилгидразон
3-(п-Толил)-1,5-дифенилформазан
(2б).
(3б). Выход 4.35 г (68.9%), т. пл. 113-114°C (этанол).
Выход 1.51 г (48.3%), т. пл. 156-157°C (метанол).
1-(4-Метоксибензилиден)-2-фенилгидразон
ИК спектр, ν, см-1: 812.3 ср, 1015.3 с, 1226.5 с,
(3в). Выход 4.42 г (65.2%), т. пл. 119-120°C (этанол).
1493.1 с (N=N), 1509.4 с (N=N), 1598.2 с (C=N),
1-(4-Диметиламинобензилиден)-2-фенил-
3353.2 сл (N-H). Спектр ЯМР 1Н, δ, м. д.: 2.22 с
гидразон (3г). Выход 3.90 г (54.3%), т. пл. 147-
(3Н, CH3), 7.20-7.30 м (4H), 7.34 т. т (1Н, J = 7.6,
148°C (этанол).
1.2 Гц), 7.42 д. д. д (2Н, J = 8.1, 7.6, 1.5 Гц), 7.51-
7.68 м (5H), 7.62 д. д (2Н, J = 8.0, 1.7 Гц), 15.36 с
1-(4-Нитробензилиден)-2-фенилгидразон
(1Н NH). Спектр ЯМР 13C, δС, м. д.: 21.3, 114.5,
(3д). Выход 5.43 г (75.1%), т. пл. 158-159°C (этанол).
122.2, 124.7, 125.5, 129.2, 129.4, 131.7, 139.7,
1-(4-Цианобензилиден)-2-фенилгидразон
145.4, 153.1, 154. 5. УФ спектр (CH2Cl2), λmax, нм
(3е). Выход 4.72 г (71.2%), т. пл. 177-178°C (этанол).
(ε, М.·см-1): 279 (18600), 306 (25500), 498 (17000).
Общая методика синтеза формазанов 2a–с.
Mасс-спектр, m/z (Iотн, %): 314 (14) [M]+, 299 (25),
Раствор 0.01 моль фенилгидразона 3a-е в смеси
286 (23), 222 (49), 209 (100), 63 (50). Найдено, %: С
5 мл пиридина и 10 мл ДМФА охлаждали до -10-
76.36; Н 5.74; N 17.96. C20H18N4. Вычислено, %: С
5°С. Отдельно готовили соль арендиазония 5a-е:
76.41; Н 5.77; N 17.82.
к 0.011 моль анилина 6a-е добавляли раствора
3-(4-Метоксифенил)-1,5-дифенилформазан
0.011 моль NaNO2 в 3 мл H2O, затем 3.5 мл концен-
(2в). Выход 1.48 г (45.0%), т. пл. 172-173°С (мета-
трированной соляной кислоты, поддерживая тем-
нол). ИК спектр, ν, см-1: 1172.3 с, 1226.0 с, 1250.2,
пературу в интервале 0-5°С. Полученную суспен-
1358.7, 1487.1 с (N=N), 1512.4 с (N=N), 1597.3 с
зию соответствующей соли арендиазония 5a-е при
(C=N), 3354.2 сл (N-H). Спектр ЯМР 1Н, δ, м. д.:
постоянном перемешивании добавляли небольши-
3.85 с (3Н, CH3O), 7.58-7.27 м (6H), 7.76 д (4Н, J =
ми порциями к раствору фенилгидразона 3a-е,
8.0 Гц), 8.02 д (2Н, J = 9.0 Гц), 8.31 д (2Н, J =
не допуская повышения температуры выше 5°С.
9.0 Гц), 15.45 с (1Н NH). Спектр ЯМР 13C, δС, м. д.:
При этом реакционная смесь приобретала интен-
55.8, 113.6, 120.4, 123.1, 124.8, 127.0, 128.3, 129.2,
сивную темно-вишневую окраску. Реакционную
129.9, 131.8, 145.4, 148.2, 154.1, 160.3. УФ спектр
смесь выдерживали в течение 3 ч при температу-
(CH2Cl2), λmax, нм (ε, М.·см-1): 279 (20700), 308
ре ~5°С и 12 ч при комнатной температуре, затем
(27400), 522 (15900). Mасс-спектр, m/z (Iотн, %):
разбавляли 20 мл воды. Формазан экстрагировали
330 (10) [M]+, 315 (37), 238 (40), 226 (58), 224 (55),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
СИНТЕЗ И ЭЛЕКТРОХИМИЧЕСКИЕ СВОЙСТВА 2-(4-R1-ФЕНИЛ)-6-(4-R2-ФЕНИЛ)-4-ФЕНИЛ...
359
93 (100), 65 (30). Найдено, %: С 72.36; Н 5.51; N
1-(п-Толил)-3,5-дифенилформазан
(2ж).
17.01. C20H18N4O. Вычислено, %: С 72.71; Н 5.49;
Выход 1.69 г (54.1%), т. пл. 153-154°C (метанол).
N 16.96.
ИК спектр, ν, см-1: 815.3 ср, 1017.3 с, 1228.5 с,
1494.1 с (N=N), 1510.4 с (N=N), 1599.2 с (C=N),
3-[4-(Диметиламино)фенил]-1,5-дифенил-
3352.2 сл (N-H). Спектр ЯМР 1Н, δ, м. д.: 2.15 с
формазан (2г). Выход 1.48 г (43.0%), т. пл. 207-
(3Н, CH3), 7.11 д. д (2Н, J = 8.0, 1.6 Гц), 7.22-7.30
209°С (метанол). ИК спектр, ν, см-1: 739.4 с, 1172.3
м (3H), 7.34 т. т (1H, J = 7.6, 1.2 Гц), 7.43–7.57 м
с, 1226.0 с, 1250.2, 1358.7, 1487.1 с (N=N), 1512.4 с
(4H), 7.63 д. д (2H, J = 8.1, 1.5 Гц), 8.26 д. т (2H,
(N=N), 1597.3 с (C=N), 2987.5 cр, 3354.2 сл (N-H).
J
= 8.5, 1.4 Гц), 15.33 с (1H). Спектр ЯМР 13C, δС,
Спектр ЯМР 1Н, δ, м. д.: 2.81 с [6Н, (СH3)2N], 6.60
м. д.: 21.2 (СН3), 114.5, 122.3, 124.7, 125.4, 128.9,
д. д (2Н, J = 8.2, 1.1 Гц), 7.26 д. т (2Н, J = 8.1, 1.2 Гц),
129.2, 131.7, 132.4, 145.4, 149.5, 154.1. УФ спектр
7.31-7.46 м (3H), 7.54 д. д. д (2Н, J = 8.1, 1.4, 1.3
Гц), 7.58-7.68 м (4H), 7.65 т. т (1Н, J = 7.7, 1.4 Гц),
(CH2Cl2), λmax, нм (ε, М.·см-1): 275 (16600), 310
15.45 с (1Н NH). Спектр ЯМР 13C, δC, м. д.: 40.31
(26700), 496 (16800). Mасс-спектр, m/z (Iотн, %):
[(СH3)2N], 113.8, 114.5, 122.2, 124.7, 126.2, 129.2,
314 (7), 286 (24), 207 (30), 195 (55), 105 (100).
129.2, 131.7, 145.4, 151.4, 153.1, 155.1. УФ спектр
Найдено, %: С 76.25; H 5.84; N 17.91. C20H18N4.
(CH2Cl2), λmax, нм (ε, М.·см-1): 276 (20200), 405
Вычислено, %: С 76.41; H 5.77; N 17.82.
(17000), 530 (21500). Mасс-спектр, m/z (Iотн, %):
1-(4-Метоксифенил)-3,5-дифенилформазан
343 (10) [M]+, 327 (20), 251 (35), 239 (55), 93 (100).
(2з). Выход 1.33 г (40.1%), т. пл. 119-120°С (мета-
Найдено, %: С 73.52; Н 6.20; N 20.51. C21H21N5.
нол). ИК спектр, ν, см-1: 1176.3 с, 1229.0 с, 1255.2,
Вычислено, %: С 73.44; Н 6.16; N 20.39.
1348.7, 1485.9 с (N=N), 1511.4 с (N=N), 1598.4 с
3-(4-Нитрофенил)-1,5-дифенилформазан
(C=N), 3355.1 сл (N-H). Спектр ЯМР 1H, δ, м. д:
(2д). Выход 1.52 г (44.0%), т. пл. 207-209°С (ме-
3.82 с (3Н, СН3О), 7.60-7.15 м (10H), 7.92 д (2H, J =
танол). ИК спектр, ν, см-1: 740.3 ср, 1242.5 с,
9.0 Гц), 8.15 д (2H, J = 8.0 Гц), 15.40 с (1H, NH).
1350.7 (NO2), 1493.1 с (N=N), 1527.1 (NO2), 1561.9
Спектр ЯМР 13C, δС, м. д.: 55.7 (СН3О), 113.6, 115.1,
с (N=N), 1597.2 с (C=N), 3353.2 сл (N-H). Спектр
122.1, 125.0, 128.0, 128.8, 129.6, 131.8, 135.4, 140.4,
ЯМР 1Н, δ, м. д.: 7.58-7.27 м (10H), 7.77 д (2Н, J =
144.2, 153.1, 160.6. УФ спектр (CH2Cl2), λmax, нм
8.0 Гц), 8.41 д (2Н, J = 9.0 Гц), 15.80 с (1H). Спектр
(ε, М.·см-1): 280 (20200), 310 (25100), 520 (14700).
ЯМР 13C, δС, м. д.: 113.6, 120.6, 122.8, 124.6, 127.5,
Mасс-спектр, m/z (Iотн, %): 330 (10) [M]+, 303 (25),
128.4, 129.8, 140.7, 144.4, 148.5, 152.3, 154.9. УФ
276 (20), 195 (55), 122 (100), 104 (51), 93 (70).
спектр (CH2Cl2), λmax, нм (ε, М.·см-1): 266 (20200),
Найдено, %: С 72.36; H 5.51; N 17.01. C20H18N4O.
419 (17000), 490 (20900). Mасс-спектр, m/z (Iотн, %):
Вычислено, %: С 72.71; H 5.49; N 16.96.
345 (56) [M]+, 328 (46), 299 (66), 241 (100), 105 (62).
1-(4-Диметиламинофенил)-3,5-дифенил-
Найдено, %: С 65.96; Н 4.41; N 20.21. C19H15N5O2.
формазан (2и). Выход 1.51 г (44.0%), т. пл. 147-
Вычислено, %: С 66.08; Н 4.38; N 20.28.
149°С (метанол). ИК спектр, ν, см-1: 740.4 с, 1171.5
3-(4-Цианофенил)-1,5-дифенилформазан
с, 1225.8 с, 1251.6, 1359.2, 1481.7 с (N=N), 1509.4 с
(2е). Выход 1.30 г (41.0%), т. пл. 177-178°С (мета-
(N=N), 1596.9 с (C=N), 2986.5 cр, 3355.2 сл (N-H).
нол). ИК спектр, ν, см-1: 741.3 ср, 1243.5 с, 1473.1
Спектр ЯМР 1H, δ, м. д.: 2.90 с [6H, (CH3)2N], 7.05
с (N=N), 1512.4 с (N=N), 1598.2 с (C=N), 2255.1
д. д (2H, J = 8.2, 2.0 Гц), 7.19-7.29 м (3H), 7.34 т. т
(CN), 3359.2 сл (N-H). Спектр ЯМР 1Н, δ, м. д.:
(1H, J = 7.6, 1.2 Гц), 7.42 д. д (2H, J = 8.2, 1.5 Гц),
7.58–7.27 м (10H), 7.65 д (2Н, J = 8.0 Гц), 8.37 д
7.52 д. д. д (2H, J = 8.5, 7.6, 1.3 Гц), 7.63 д. д. д (2H,
(2Н, J = 9.0 Гц), 15.78 с (1Н, NH). Спектр ЯМР
J = 8.1, 7.6, 1.5 Гц), 8.25 д. т (2H, J = 8.5, 1.4 Гц),
13C, δС, м. д.: 113.1, 118.6 (CN), 119.6, 120.8, 121.6,
15.40 с (1H, NH). Спектр ЯМР 13C, δС, м. д.: 40.4
123.4, 126.5, 127.8, 139.7, 141.4, 145.5, 148.3, 150.9.
[(CH3)2N], 111.6, 114.5, 124.7, 125.4, 125.5, 128.9,
УФ спектр (CH2Cl2), λmax, нм (ε, М.·см-1): 272
127.7, 129.2, 131.7, 145.4, 150.5, 153.0, 155.1. УФ
(30200), 338 (27000), 488 (21000). Mасс-спектр,
спектр (CH2Cl2), λmax, нм (ε, М.·см-1): 278 (17900),
m/z (Iотн, %): 325 (28) [M]+, 297 (31), 271 (22), 219
420 (20400), 520 (19800). Mасс-спектр, m/z (Iотн,
(100), 192 (40), 105 (40). Найдено, %: С 73.96; Н
%): 343 (9), 328 (59), 315 (37), 195 (94), 135 (100).
4.61; N 21.41. C20H15N5. Вычислено, %: С 73.83; Н
Найдено, %: С 73.48; H 6.20; N 20.31. C21H21N5.
4.65; N 21.52.
Вычислено, %: С 73.44; H 6.16; N 20.39.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
360
КОСТРЮКОВ и др.
1-(4-Нитрофенил)-3,5-дифенилформазан
142-144°С (метанол). ИК спектр, ν, см-1: 742.3 ср,
(2к). Выход 1.86 г (54.0%), т. пл. 197-198°С (ме-
1223.5 с, 1244.5 cр, 1470.1 с (N=N), 1510.4 с (N=N),
танол). ИК спектр, ν, см-1: 739.9 ср, 1241.5 с,
1598.2 с (C=N), 2255.1 (CN), 2996.1, ср, 3359.2 сл
1352.7 (NO2), 1492.1 с (N=N), 1526.7 (NO2), 1562.1
(N-H). Спектр ЯМР 1H, δ, м. д.: 3.80 с (3H, CH3O).
с (N=N), 1598.7 с (C=N), 3358.2 сл (N-H). Спектр
7.05 д. д (2H, J = 8.5, 1.2 Гц), 7.30–7.45 м (3H), 7.56
ЯМР 1H, δ, м. д.: 7.58-7.27 м (10H), 7.79 д (2H,
д. д (2H, J = 8.3, 1.8 Гц), 7.59-7.69 м (4H), 8.20 д.
J = 8.0 Гц), 8.33 д (2H, J = 9.0 Гц), 15.40 с (1H,
д (2H, J = 8.5, 1.6 Гц), 14.66 с (1H, NH). Спектр
NH). Спектр ЯМР 13C, δС, м. д.: 113.9. 122.4, 123.6,
ЯМР 13C, δС, м. д.: 55.5 (CH3O), 106.4, 114.0, 114.8,
124.7, 126.8, 127.9, 128.8, 130.1, 135.7, 144.2, 148.2,
118.6 (СN), 123.1, 124.7, 127.0, 129.3, 131.2, 133.5,
153.3, 155.8. УФ спектр (CH2Cl2), λmax, нм (ε,
145.3, 150.4, 155.1, 160.2. УФ спектр (CH2Cl2),
М.·см-1): 266 ( 20800), 424 ( 17100), 490 ( 20200).
λmax, нм (ε, М.·см-1): 272 (12900), 420 (10500),
Mасс-спектр, m/z (Iотн, %): 345 (10) [M]+, 317 (12),
492 (15800). Mасс-спектр, m/z (Iотн, %): 355 (12)
299 (14), 224 (19), 195 (100), 123 (12). Найдено, %:
[M]+, 340 (38), 327 (35), 250 (45), 238 (37), 226 (68),
С 65.96; H 4.41; N 20.21. C19H15N5O2. Вычислено,
118 (90), 93 (100). Найдено, %: С 70.88; H 4.89; N
%: С 66.08; H 4.38; N 20.28.
19.65. C21H17N5O. Вычислено, %: С 70.97; H 4.82;
1-(4-Цианофенил)-3,5-дифенилформазан
N 19.71.
(2л). Выход 1.79 г (55.0%), т. пл. 173-175°С (мета-
1-(4-Цианофенил)-3-(4-диметиламино-
нол). ИК спектр, ν, см-1: 741.3 ср, 1243.9 с, 1473.1
фенил)-5-фенилформазан
(2о). Выход
1.80 г
с (N=N), 1511.9 с (N=N), 1597.2 с (C=N), 2253.1
(49.0%), т. пл. 151-152°С (метанол). ИК спектр, ν,
(CN), 3359.2 сл. Спектр ЯМР 1H, δ, м. д.: 7.65-7.30
см-1: 741.2 ср, 1220.1 с, 1240.8 cр, 1469.2 с (N=N),
м (10H), 8.09 д. д (2H, J = 8.0, 1.5 Гц), 8.27 д. д
1508.4 с (N=N), 1596.9 с (C=N), 2254.1 (CN), 2995.8
(2H, J = 9.0, 1.5 Гц), 15.40 с (1H, NH). Спектр ЯМР
с, 3355.2 сл (N-H). Спектр ЯМР 1H, δ, м. д.: 2.82 с
13C, δС, м. д.: 106.3, 113.9, 118.4 (CN), 123.0, 124.1,
[6H, (CH3)2N], 6.61 д. д (2H, J = 8.2, 1.1 Гц), 7.35 т.
125.4, 127.3, 128.5, 129.1, 131.9, 136.2, 146.2, 150.3,
т (1H, J = 7.6, 1.3 Гц), 7.42 д. т (2H, J = 8.0, 1.3 Гц),
155.1. УФ спектр (CH2Cl2), λmax, нм (ε, М.·см-1):
7.59-7.70 м (6H), 8.19 д. д (2H, J = 8.3, 1.6 Гц),
273
(33400),
340
(26000),
489
(21500). Mасс-
14.66 с (1H, NH). Спектр ЯМР 13C, δС, м. д.: 40.3
спектр, m/z (Iотн, %): 325 (22) [M]+, 310 (30), 297
[(CH3)2N], 106.4, 113.8, 114.5, 118.6 (СN), 123.0,
(43), 271 (30), 220 (61), 194 (100), 167 (40), 130 (50).
124.7, 126.2, 129.2, 131.7, 133.4, 145.4, 150.5, 151.4,
Найдено, %: С 73.91; H 4.68; N 21.47. C20H15N5.
155.1. УФ спектр (CH2Cl2), λmax, нм (ε, М.·см-1):
Вычислено, %: С 73.83; H 4.65; N 21.52.
277 (14700), 436 (14500), 505 (20800). Mасс-спектр,
1-(4-Цианофенил)-3-(п-толил)-5-фенил-
m/z (Iотн, %): 368 (11) [M]+, 353 (65), 340 (39), 261
формазан (2м). Выход 1.46 г (43.0%), т. пл. 152-
(65), 238 (60), 118 (90), 93 (100). Найдено, %: С
153°С (метанол). ИК спектр, ν, см-1: 743.5 ср,
71.78; H 5.49; N 22.75. C22H20N6. Вычислено, %: С
1244.5 с, 1463.8 с (N=N), 1510.4 с (N=N), 1599.0 с
71.72; H 5.47; N 22.81.
(C=N), 2235.1 (CN), 2967.5, 3359.2 сл (NH). Спектр
1-(п-Толил)-3-(4-цианофенил)-5-фенилфор-
ЯМР 1H, δ, м. д.: 2.22 с (3H, CH3), 7.24 д. д (2H, J =
мазан (2п). Выход 1.46 г (43.0%), т. пл. 152-153°С
7.9, 1.2 Гц), 7.30-7.45 м (3H), 7.59-7.69 м (6H), 8.20
(метанол). ИК спектр, ν, см-1: 747.5 ср, 1249.5 с,
д. д (2H, J = 8.3, 1.6 Гц), 15.66 с (1H, NH). Спектр
1468.1 с (N=N), 1515.1 с (N=N), 1598.8 с (C=N),
ЯМР 13C, δС, м. д.: 21.3 (CH3), 106.3, 114.5, 118.5
2237.0 (CN), 2969.5, 3358.2 сл (NH). Спектр ЯМР
(CN), 123.1, 124.7, 125.5, 129.2, 129.3, 131.7, 133.4,
1H, δ, м. д.: 2.15 с (3H, CH3), 7.12 д. д (2H, J = 8.0,
139.7, 145.4, 150.5, 155.05. УФ спектр (CH2Cl2),
1.6, 0.5 Гц), 7.35 т. т (1H, J = 7.6, 1.3 Гц), 7.39-7.51
λmax, нм (ε, М.·см-1): 276 (14300), 428 (12500), 498
м (4H), 7.64 д. д. д (2H, J = 8.1, 7.6, 1.5 Гц), 7.87 д.
(16800). Mасс-спектр, m/z (Iотн, %): 325 (24), 297
д (2H, J = 8.6, 1.5 Гц), 8.01 д. д (2H, J = 8.3, 1.6 Гц),
(43), 220 (63), 194 (100), 130 (50), 91 (67). Найдено,
15.60 с (1H, NH). Спектр ЯМР 13C, δС, м. д.: 21.2
%: С 74.43; H 5.07; N 20.57. C21H17N5. Вычислено,
(CH3), 112.2, 114.5, 118.4 (CN), 122.2, 124.7, 127.1,
%: С 74.32; H 5.05; N 20.63.
128.9, 129.2, 131.7, 132.0, 132.4, 145.4, 150.5, 155.0.
1-(4-Цианофенил)-3-(4-метоксифенил)-5-
УФ спектр (CH2Cl2), λmax, нм (ε, М.·см-1): 275
фенилформазан (2н). Выход 1.53 г (43.1%), т. пл.
(15300), 426 (13500), 496 (15900). Mасс-спектр, m/z
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
СИНТЕЗ И ЭЛЕКТРОХИМИЧЕСКИЕ СВОЙСТВА 2-(4-R1-ФЕНИЛ)-6-(4-R2-ФЕНИЛ)-4-ФЕНИЛ...
361
(Iотн, %): 325 (24), 297 (43), 220 (63), 194 (100), 130
от исходного формазана от 0.5 ч до 24 ч при посто-
(50), 91 (67). Найдено, %: С 74.39; H 5.01; N 20.59.
янном пропускании воздуха, после чего реакцион-
C21H17N5. Вычислено, %: С 74.32; H 5.05; N 20.63.
ную смесь разбавляли 100 мл воды. Продукт экс-
1-(4-Метоксифенил)-3-(4-цианофенил)-5-
трагировали С6Н6 (3×50 мл). Объединенные ор-
фенилформазан (2р). Выход 1.10 г (31.0%), т. пл.
ганические вытяжки промывали водой (3×50 мл),
135-137°С (метанол). ИК спектр, ν, см-1: 742.0 ср,
затем сушили безводным MgSO4. Фильтровали
1222.9 с, 1243.8 cр, 1468.1 с (N=N), 1509.5 с (N=N),
через слой силикагеля и удаляли растворитель в
1597.8 с (C=N), 2250.9 (CN), 2996.1, ср, 3359.2 сл
вакууме. Полученный продукт кристаллизовали
(N-H). Спектр ЯМР 1H, δ, м. д.: 3.82 с (3H, CH3O),
из метанола.
6.99 д. д (2H, J = 8.3, 2.4 Гц), 7.35 т. т (1H, J = 7.6,
2,4,6-Трифенил-3,4-дигидро-1,2,4,5-тетра-
1.3 Гц), 7.42 д. т (2H, J = 8.1, 1.3 Гц), 7.59-7.69 м
зин-1(2Н)-ил (1a). Продолжительность окисления
(4H), 7.85 д. д (2H, J = 8.6, 1.7 Гц), 8.00 д. д (2H, J =
воздухом - 0.5 ч. Выход 0.173 г (55.2%), т. пл. 139-
8.6, 1.7 Гц), 14.65 с (1H, NH). Спектр ЯМР 13C, δС,
140°С (метанол). ИК спектр, ν, см-1: 752.5 с, 1145.6
м. д.: 55.2, 112.2, 114.5, 114.6, 118.5, 124.7, 125.5,
ср, 1207.3 ср, 1265.1 ср, 1323.0 ср, 1488.9 с, 1585.3 с.
127.1, 129.2, 131.7, 132.2, 145.4, 150.5, 154.9, 159.8.
УФ спектр (CH2Cl2), λmax, нм (ε, М.·см-1): 273
УФ спектр (CH2Cl2), λmax, нм (ε, М.·см-1): 273
(62300), 405 (7500), 716 (3600). Mасс-спектр, m/z
(12900), 424 (10500), 490 (15800). Mасс-спектр, m/z
(Iотн %): 313 [M]+ (32), 299 (15), 286 (16), 209 (60),
(Iотн, %): 355 (10) [M]+, 340 (22), 327 (25), 234 (49),
104 (100). Найдено %: С 76.92; H, 5.51; N 17.74.
220 (56), 129 (55), 121 (100), 93 (71). Найдено, %: С
C20H17N4. Вычислено, %: С 76.65; H, 5.47; N 17.88.
70.88; H, 4.89; N 19.65. C21H17N5O. Вычислено, %:
2,4-Дифенил-6-(п-толил)-3,4-дигидро-1,2,4,5-
С 70.97; H 4.82; N 19.71.
тетразин-1(2Н)-ил
(1б). Продолжительность
1-(4-Диметиламинофенил)-3-(4-цианофе-
окисления воздухом - 2 ч. Выход 0.17 г (52.0%),
нил)-5-фенилформазан (2с). Выход 1.18 (32.1%),
т. пл. 111-112°С (метанол). ИК спектр, ν, см-1:
т. пл. 144-145°С (метанол). ИК спектр, ν, см-1:
780.1 с, 820.1 ср, 1146.2 ср, 1208.7 ср, 1260.3 ср,
745.2 ср, 1224.1 с, 1242.1 cр, 1470.1 с (N=N), 1510.2
1385.1 ср, 1490.1 с, 1586.0 с, 2967.1 с. УФ спектр
с (N=N), 1598.1 с (C=N), 2255.3 (CN), 2996.1 с,
(CH2Cl2), λmax, нм (ε, М.·см-1): 245 (12300), 284
3353.8 сл (N-H). Спектр ЯМР 1H, δ, м. д.: 2.90 с
(19500), 325 (9500), 395 (6500), 720 (3900). Mасс-
[6H, (CH3)2N], 7.05 д. д (2H, J = 8.2, 1.5 Гц), 7.30-
спектр, m/z (Iотн, %): 327 (30) [M]+, 301 (80), 254
7.47 м (5H), 7.64 д. д. д (2H, J = 8.1, 7.6, 1.4 Гц),
(44), 223 (52), 133 (49), 120 (100). Найдено, %: С
7.84 д. д (2H, J = 8.6, 1.7 Гц), 8.00 д. д (2H, J = 8.6,
77.09; H 5.81; N 17.09. C21H19N4. Вычислено, %: С
1.7 Гц), 14.87 с (1H, NH). Спектр ЯМР 13C, δС, м. д.:
77.04; H 5.85; N 17.11.
40.7
[(CH3)2N), 111.6, 112.2, 114.5, 118.5 (СN),
2,4-Дифенил-6-(4-метоксифенил)-3,4-дигид-
124.7, 125.5, 127.1, 129.2, 131.7, 132.3, 145.4, 150.5,
ро-1,2,4,5-тетразин-1(2Н)-ил
(1в). Продолжи-
153.3, 159.5. УФ спектр (CH2Cl2), λmax, нм (ε,
тельность окисления воздухом - 3 ч. Выход 0.197 г
М.·см-1): 280 ( 15900), 440 ( 14500), 510 ( 19800).
Mасс-спектр, m/z (Iотн, %): 368 (8) [M]+, 353 (23),
(50.2%), т. пл. 71-72°С (метанол). ИК спектр,
ν, см-1: 825.5 c, 1105.6 cр, 1207.7 ср, 1233.6 ср,
340 (33), 234 (52), 220 (75), 134 (100), 93 (76).
Найдено, %: С 71.69; H 5.44; N 22.79. C22H20N6.
1399.5 с, 1488.8 с, 1589.1 с. УФ спектр (CH2Cl2),
Вычислено, %: С 71.72; H 5.47; N 22.81.
λmax, нм (ε, М.·см-1): 280 (28400), 319 (10500), 388
(7300), 730 (3200). Mасс-спектр, m/z (Iотн, %): 343
Общая методика получения вердазилом 1a-с.
(15) [M]+, 317 (100), 315 (50), 301 (60), 267 (50),
Смесь 0.001 моль одного из формазанов 2a-с,
242 (70), 151 (44), 136 (90). Найдено, %: С 73.51; H
50 мл ДМФА, 1.36 г (0.01 моль) KHSO4 и 1.5 г
5.51; N 16.29. C21H19N4O. Вычислено, %: С 73.45;
параформа перемешивали в течение 24 ч при ком-
H 5.58; N 16.32.
натной температуре, затем реакционную смесь
отфильтровывали. В фильтрат при перемешива-
2,4-Дифенил-6-(4-диметиламинофенил)-3,4-
нии последовательно добавляли по каплям 12 мл
дигидро-1,2,4,5-тетразин-1(2Н)-ил (1г). Продол-
37%-ный раствор формалина и 10 мл 2 н. раствора
жительность окисления воздухом - 5 ч. Выход
NaOH. Перемешивание продолжали в зависимости
0.135 г (38.0%), т. пл. 124-125°С (метанол). ИК
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
362
КОСТРЮКОВ и др.
спектр, ν, см-1: 765.9 с, 800.1 ср, 1126.2 ср, 1212.7
нм (ε, М.·см-1): 280 (28400), 319 (10500),
388
ср, 1270.9 ср, 1390.1 ср, 1491.9 с, 1592.1 с, 2969.1
(7300), 730 (3200). Mасс-спектр, m/z (Iотн, %): 343
с. УФ спектр (CH2Cl2), λmax, нм (ε, М.·см-1): 290
(15) [M]+, 317 (100), 315 (50), 301 (60), 267 (50),
(29400), 325 (11500), 405 (7300), 740 (4200). Mасс-
242 (70), 151 (44), 136 (90). Найдено, %: С 73.51; H
спектр, m/z (Iотн, %): 356 (23) [M]+, 342 (47), 330
5.51; N 16.29. C21H19N4O. Вычислено, %: С 73.45;
(80), 315 (44), 254 (78), 239 (60), 149 (100), 106 (83).
H 5.58; N 16.32.
Найдено, %: С 74.11; H 6.31; N 19.59. C22H22N5.
2-(4-Диметиламинофенил)-4,6-дифенил-
Вычислено, %: С 74.13; H 6.22; N 19.65.
3,4-дигидро-1,2,4,5-тетразин-1(2Н)-ил
(1и).
2,4-Дифенил-6-(4-нитрофенил)-3,4-дигид-
Продолжительность окисления воздухом - 3 ч.
ро-1,2,4,5-тетразин-1(2Н)-ил (1д). Продолжитель-
Выход 0.181 г (51.1%), т. пл. 95-96°С (метанол).
ность окисления воздухом - 10 ч. Выход 0.147 г
ИК спектр, ν, см-1: 770.9 с, 812.1 ср, 1131.2 ср,
(41.1%), т. пл. 120-122°С (метанол). ИК спектр, ν,
1227.0 ср, 1280.2 ср, 1395.2 ср, 1495.9 с, 1595.1 с,
см-1: 740.5 с, 1152.3 ср, 1208.9 ср, 1349.7 с (NO2),
2970.1 с. УФ спектр (CH2Cl2), λmax, нм (ε, М.·см-1):
1495.1 с, 1532.1 с (NO2), 1589.9 с УФ спектр
288 (28400), 320 (10600), 400 (6300), 736 (3200).
(CH2Cl2), λmax, нм (ε, М.·см-1): 293 (45300), 350
Mасс-спектр, m/z (Iотн, %): 356 (11) [M]+, 342 (36),
(14500), 738 (8400). Mасс-спектр, m/z (Iотн, %): 358
330 (80), 255 (65), 164 (50), 149 (65), 106 (100).
(21) [M]+, 334 (100), 308 (48), 275 (59), 261 (80), 257
Найдено, %: С 74.21; H 6.21; N 19.59. C21H19N4O.
(82), 151 (60), 106 (100). Найдено, %: С 67.11; H
Вычислено, %: С 74.13; H 6.22; N 19.65.
4.53; N 19.49. C20H16N5O2. Вычислено, %: С 67.03;
2-(4-Нитрофенил)-4,6-дифенил-3,4-ди-
H 4.50; N 19.54.
гидро-1,2,4,5-тетразин-1(2Н)-ил
(1к). Продол-
2,4-Дифенил-6-(4-цианофенил)-3,4-дигидро-
жительность окисления воздухом - 10 ч. Выход
1,2,4,5-тетразин-1(2Н)-ил
(1е). Продолжитель-
0.147 г (41.1%), т. пл. 120-122°С (метанол). ИК
ность окисления воздухом - 10 ч. Выход 0.121 г
спектр, ν, см-1: 755.5 c, 1161.3 ср, 1210.8 ср, 1350.7
(36.0%), т. пл. 117-119°С (метанол). ИК спектр, ν,
с (NO2), 1490.1 с, 1536.1 с (NO2), 1591.0 с УФ
см-1: 740.5 ср, 1152.3 ср, 1208.9 ср, 1495.1 с, 1589.9
спектр (CH2Cl2), λmax, нм (ε, М.·см-1): 290 (35300),
с, 2241.0 ср (CN). УФ спектр (CH2Cl2), λmax, нм
340 (12500), 735 (7400). Mасс-спектр, m/z (Iотн, %):
(ε, М.·см-1): 287 (34300), 334 (12500), 740 (9400).
358 (21) [M]+, 334 (100), 275 (56), 261 (83), 257 (85),
Mасс-спектр, m/z (Iотн, %): 338 (17) [M]+, 324 (80),
151 (62), 106 (100). Найдено, %: С 67.11; H 4.53; N
312 (86), 286 (35), 237 (74), 146 (48), 131 (85),
19.49. C20H16N5O2. Вычислено, %: С 67.03; H 4.50;
106 (100). Найдено %: С 74.48; H 4.73; N 20.59.
N 19.54.
C21H15N5. Вычислено, %: С 74.54; H 4.77; N 20.70.
2-(4-Цианофенил)-4,6-дифенил-3,4-ди-
2-(п-Толил)-4,6-дифенил-3,4-дигидро-
гидро-1,2,4,5-тетразин-1(2Н)-ил
(1л). Продол-
1,2,4,5-тетразин-1(2Н)-ил (1ж). Продолжитель-
жительность окисления воздухом - 10 ч. Выход
ность окисления воздухом 5 ч. Выход 0,104 г
0.122 г (36.0%), т. пл. 103-104°С (метанол). ИК
(32.0%), т. пл. 138-139°С (метанол). ИК спектр,
спектр, ν, см-1: 745.6 ср, 1160.3 ср, 1211.9 ср, 1489.1
ν, см-1: 746.1 с, 1143.2 с, 1205.7 ср, 1387.1 ср,
с, 1592.1 с, 2245.0 ср (CN). УФ спектр (CH2Cl2),
1494.1 с, 1590.0 с. УФ спектр (CH2Cl2), λmax, нм
λmax, нм (ε, М.·см-1): 290 (29300), 344 (10500), 756
(ε, М.·см-1): 246 (9900), 280 (22500), 320 (12400),
(7300). Mасс-спектр, m/z (Iотн, %): 338 (17) [M]+,
398 (7400), 721 (3400). Mасс-спектр, m/z (Iотн, %):
312 (90), 286 (35), 286 (35), 237 (80), 146 (48), 131
327 (17) [M]+, 301 (85), 251 (60), 224 (65), 120 (74),
(85), 106 (100). Найдено, %: С 74.48; H 4.73; N
106 (100). Найдено, %: С 77.08; H 5.91; N 17.16.
20.59. C21H15N5. Вычислено, %: С 74.54; H 4.77;
C21H19N4. Вычислено, %: С 77.04; H 5.85; N 17.11.
N 20.70.
2-(4-Метоксифенил)-4,6-дифенил-3,4-ди-
2-(4-Цианофенил)-6-(п-толил)-4-фенил-
гидро-1,2,4,5-тетразин-1(2Н)-ил
(1з). Продол-
3,4-дигидро-1,2,4,5-тетразин-1(2Н)-ил
(1м).
жительность окисления воздухом - 3 ч. Выход
Продолжительность окисления воздухом - 24 ч.
0.197 г (50.2%), т. пл. 71-72°С (метанол). ИК
Выход 0.117 (33.2%), т. пл. 125-126°С (метанол).
спектр, ν, см-1: 880.5 ср, 1120.7 ср, 1249.6 с, 1506.8
ИК спектр, ν, см-1: 740.6 ср, 856.1 c, 1165.3 ср,
с, 1609.1 ср, 1708.1 ср. УФ спектр (CH2Cl2), λmax,
1219.2 ср, 1490.4 с, 1596.0 с, 2245.6 ср (CN). УФ
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
СИНТЕЗ И ЭЛЕКТРОХИМИЧЕСКИЕ СВОЙСТВА 2-(4-R1-ФЕНИЛ)-6-(4-R2-ФЕНИЛ)-4-ФЕНИЛ...
363
спектр (CH2Cl2), λmax, нм (ε, М.·см-1): 292 (29800),
24 ч. Выход 0.141 г (41.0%), т. пл. 91-93°С (мета-
346 (11800), 760 (6300). Mасс-спектр, m/z (Iотн, %):
нол). ИК спектр, ν, см-1: 825.5 с, 1155.1 с, 1207.5
352 (17) [M]+, 326 (100), 300 (32), 276 (45), 237 (73),
ср, 1234.1 ср, 1400.5 ср, 1488.6 с, 1591.6 с, 2223.1
223 (47), 133 (60), 122 (90). Найдено, %: С 74.88; H
(CN). УФ спектр (CH2Cl2), λmax, нм (ε, М.·см-1):
5.13; N 19.79. C22H18N5. Вычислено, %: С 74.98; H
286 (37500), 330 (12500), 390 (7500), 730 (4200).
5.15; N 19.87.
Mасс-спектр, m/z (Iотн, %): 368 (14) [M]+, 342 (78),
2-(4-Цианофенил)-6-(4-метоксифенил)-4-
326 (51), 300 (38), 236 (69), 151 (49), 131 (100),
фенил-3,4-дигидро-1,2,4,5-тетразин-1(2Н)-ил
121 (84), 106 (89). Найдено, %: С 71.77; H 4.98; N
(1н). Продолжительность окисления воздухом -
19.08. C22H18N5O. Вычислено, %: С 71.72; H 4.92;
24 ч. Выход 0.1915 г (52.1%), т. пл. 83-84°С (ме-
N 19.01.
танол). ИК спектр, ν, см-1: 820.2 с, 1157.6 с, 1205.2
2-(4-Диметиламинофенил)-6-(4-циано-
ср, 1494.0 с, 1587.8 с, 2241.1 ср (CN). УФ спектр
фенил)-4-фенил-3,4-дигидро-1,2,4,5-тетразин-
(CH2Cl2), λmax, нм (ε, М.·см-1): 282 (48400), 330
1(2Н)-ил (1с). Продолжительность окисления воз-
(11500), 393 (8300), 742 (4000). Mасс-спектр, m/z
духом - 24 ч. Выход 0.171 г (45.0%), т. пл. 101-
(Iотн, %): 368 (14) [M]+, 344 (60), 342 (85), 340 (76),
102°С (метанол). ИК спектр, ν, см-1: 817.2 с, 1066
326 (54), 237 (74), 146 (63), 133 (86), 131 (100),
с, 1145.6 ср, 1200.9 ср, 1496.9 с, 1590.8 с, 2245.1 ср
106 (75). Найдено, %: С 71.81; H, 4.88; N 19.09.
(CN), 2989.6 ср. УФ спектр (CH2Cl2), λmax, нм (ε,
C22H18N5O. Вычислено, %: С 71.72; H 4.92; N
М.·см-1): 290 (35500), 335 (14500), 400 (8500), 735
19.01.
(3600). Mасс-спектр, m/z (Iотн, %): 381 (15) [M]+,
2-(4-Цианофенил)-6-(4-диметиламино-
367 (40), 355 (100), 326 (54), 277 (49), 255 (74), 236
фенил)-4-фенил-3,4-дигидро-1,2,4,5-тетразин-
(67), 149 (65), 106 (69). Найдено, %: С 72.35; H,
1(2Н)-ил (1о). Продолжительность окисления воз-
5.58; N 22.09. C23H21N6. Вычислено, %: С 72.42; H
духом - 24 ч. Выход 0.126 г (33.1%), т. пл. 122-
5.55; N 22.03.
123°С (метанол). ИК спектр, ν, см-1: 820.2 с, 1076
ФОНДОВАЯ ПОДДЕРЖКА
с, 1157.6 ср, 1205.2 ср, 1494.0 с, 1587.8 с, 2241.1
ср (CN), 2982.6 ср. УФ спектр (CH2Cl2), λmax, нм
Работа выполнена при финансовой поддержке
(ε, М.·см-1): 293 (38400), 356 (14500), 420 (9200),
Российского фонда фундаментальных исследова-
761 (4400). Mасс-спектр, m/z (Iотн, %): 381 (14)
ний (проект 18-43-130002).
[M]+, 355 (90), 262 (50), 254 (81), 237 (68), 149 (84),
КОНФЛИКТ ИНТЕРЕСОВ
133 (76), 106 (106). Найдено, %: С 72.35; H 5.58; N
Авторы заявляют об отсутствии конфликта
22.09. C23H21N6. Вычислено, %: С 72.42; H 5.55; N
интересов.
22.03.
2-(п-Толил)-6-(4-цианофенил)-4-фенил-3,4-
СПИСОК ЛИТЕРАТУРЫ
дигидро-1,2,4,5-тетразин-1(2Н)-ил (1п). Продол-
1. Kuhn R., Trischman H. // Monatsh. Chem. 1964.
жительность окисления воздухом - 24 ч. Выход
Vol. 95. N 2. P. 457. doi 10.1007/BF00901311
0.158 г (45.0%), т. пл. 130-131°С (метанол). ИК
2. Fabian J., Hartmann H. // J. Pr. Chem. 1984. Vol. 326.
спектр, ν, см-1: 755.1 ср, 862.7 c, 1196.3 ср, 1224.2
N 5. P. 443. doi 10.1002/prac.19843260313
ср, 1495.4 с, 1599.0 с, 2246.1 ср (CN). УФ спектр
3. Chemistnick V., Chambers D., Brook D.J.R. // J. Org.
(CH2Cl2), λmax, нм (ε, М.·см-1): 285 (42400), 335
Chem. 2009. Vol. 74. N 5. P. 1850. doi 10.1021/
(12500), 398 (7300), 750 (4000). Mасс-спектр, m/z
jo8019829
4. Nishide H., Iwasa S., Pu Y.-J., Suga T., Nakahara K.,
(Iотн, %): 352 (18) [M]+, 328 (70), 326 (100), 324
Satoh M. // Electrochim. Acta. 2004. Vol. 50. N 2-3.
(65), 249 (50), 228 (65), 121 (70), 106 (74), 79 (63).
P. 827. doi 10.1016/j.electacta.2004.02.052
Найдено, %: С 74.88; H 5.13; N 19.79. C22H18N5.
5. Липунова Г.Н., Федорченко Т.Г., Чупахин О.Н. //
Вычислено, %: С 74.98; H 5.15; N 19.87.
Усп. хим. 2013. Т. 82. № 8. C. 701; Lipunova G.N.,
2-(4-Метоксифенил)-6-(4-цианофенил)-4-
Fedorchenko T.G., Chupakhin O.N. // Russ. Chem.
фенил-3,4-дигидро-1,2,4,5-тетразин-1(2Н)-ил
Rev. 2013. Vol. 82. N 8. P. 701. doi 10.1070/
(1р). Продолжительность окисления воздухом -
RC2013v082n08ABEH004341
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
364
КОСТРЮКОВ и др.
6. Koivisto B.D., Hicks R.G. // Coord. Chem. Rev. 2005.
Trans. 2015. Vol. 44. N 12. P. 5364. doi 10.1039/
Vol. 249. N 23. P. 2612. doi 10.1016/j.ccr.2005.03.012
c4dt03354j
7. Miyamoto S., Iwasaki Y., Uemoto N., Hosokoshi Y.,
15. McKinnon S.D.J., Patrick B.O., Lever A.B.P., Hicks R.G. //
Fujiwara H., Shimono S., Yamaguchi H. // Phys. Rev.
Inorg. Chem. 2013. Vol. 52. N 14. P. 8053. doi 10.1021/
Mater. 2019. Vol. 3. N 6. P. 064410. doi 10.1103/
ic400704j
PhysRevMaterials.3.064410
16. Jaworski J.S., Krawczyk I. // Monat. Chem. 1992. Vol. 123.
8. Brook D.J.R., Fleming C., Chung D., Richardson C.,
N 1-2. P. 43. doi 10.1007/BF01045295
Ponce S., Das R., Srikanth H., Heindl R., Noll B.C. //
17. Gilroy J.B., McKinnon S.D.J., Koivisto B.D., Hicks R.G. //
Dalton Trans. 2018. Vol. 47. N 18. P. 6351. doi 10.1039/
Org. Lett. 2007. Vol. 9. N 9. P. 4837. doi 10.1021/
c8dt00805a
ol702163a
9. Solea A.B., Wohlhauser T., Abbasi P., Mongbanziama Y.,
18. Charlton G.D., Barbon S.M., Gilroy J.B., Dyker C.A. //
Crochet A., Fromm K.M., Novitchi G., Train C.,
Pilkington M., Mamul O. // Dalton Trans. 2018. Vol. 47.
J. Energy Chem. 2019. Vol. 34. P. 52. doi 10.1016/j.
N 14. P. 4785. doi 10.1039/c8dt00840j
jechem.2018.09.020
10. Iwase K., Yamaguchi H., Ono T., Shimokawa T., Na-
19. Nevers D.R., Brushett F.R., Wheeler D.R. // J. Power
kano H., Matsuo A., Kindo K., Nojiri H., Hosokoshi Y. //
Sources. 2017. Vol. 352. P. 226. doi 10.1016/j.
J. Phys. Soc. Japan. 2013. Vol. 82. N 7. P. 074719. doi
jpowsour.2017.03.077
10.7566/JPSJ.82.074719
20. Price J.T., Paquette J.A., Harrison C.S., Bauld R.,
11. Brook D.J.R. // Comm. Inorg. Chem. 2015. Vol. 35.
Fanchini G., Gilroy J.B. // Polym. Chem. 2014. Vol.5.
N 1. P. 1. doi 10.1080/02603594.2014.974805
P. 5223. doi 10.1039/c4py00829d
12. Kumar V., Shova S., Novitchi G., Train C. // Compt.
21. Цебулаева Ю.В., Пряничникова М.К., Танасей-
Rend. Chim. 2019. Vol. 22. N 6-7. P. 541. doi 10.1016/j.
чук Б.С. // Изв. вузов. Сер. хим. и хим. технол. 2018.
crci.2019.03.008
Т. 61. № 1. С. 23.
13. Sanz C.A., McKay Z.R., Maclean S.W.C., Patrick
B.O., Hicks R.G. // Dalton Trans. 2017. Vol. 46. N 33.
22. Wilcox D.A., Agarkar V., Mukherjee S., Boudouris B.W. //
P. 12674. doi 10.1039/c9dt02549a
Ann. Rev. Chem. Biomol. Eng. 2018. Vol. 9. P. 83. doi
14. Wang C., Lin S.-Y., Shi W., Cheng P., Tang J. // Dalton
10.1146/annurev-chembioeng-060817-083945
Synthesis and Electrochemical Properties of 2-(4-R1-Phenyl)-6-
(4-R2-phenyl)-4-phenyl-3,4-dihydro-1,2,4,5-tetrazin-1(2H)-yls
S. G. Kostryukov*, A.V. Balandina, A. Sh. Kozlov, E.V. Kraynov, M. K. Pryanichnikova,
O. Yu. Chernyaeva, A. A. Akhmatova, Yu. I. Lukshina
National Research Ogarev Mordovia State University, Saransk, 430005 Russia
*e -mail: kostryukov_sg@mail.ru
Received September 17, 2019; revised September 17, 2019; accepted September 20, 2019
A new methodology for creating electroactive components for organic batteries was described, based on the
construction of a molecular platform based on stable 3,4-dihydro-1,2,4,5-tetrazin-1(2H)-yl radicals. A series
of 2-(4-R1-phenyl)-6-(4-R2-phenyl)-4-phenyl-3,4-dihydro-1,2,4,5-tetrazin-1(2H)-yls with substituents was ob-
tained of various nature. It was shown that the substituents R1 in the aromatic ring at position 2 of the tetrazinyl
fragment affect the value of the oxidation potential in the radical, but do not affect the value of the reduction
potentials, while the substituent R2, of the aromatic ring at position 6 affect the values of the reduction potentials
and practically do not affect oxidation potential values. Based on the obtained electrochemical data, a correlation
structure-potential value was established for the cathodic and anodic process, with the help of which triarylsub-
stituted 3,4-dihydro-1,2,4,5-tetrazin-1(2H)-yl radicals with high values of the electrochemical gap were obtained.
Keywords: 3,4-dihydro-1,2,4,5-tetrazin-1(2H)-yl radicals, cyclic voltammetry, electron-donating substituent,
electron-withdrawing substituent, electrode potential, electrochemical gap
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020