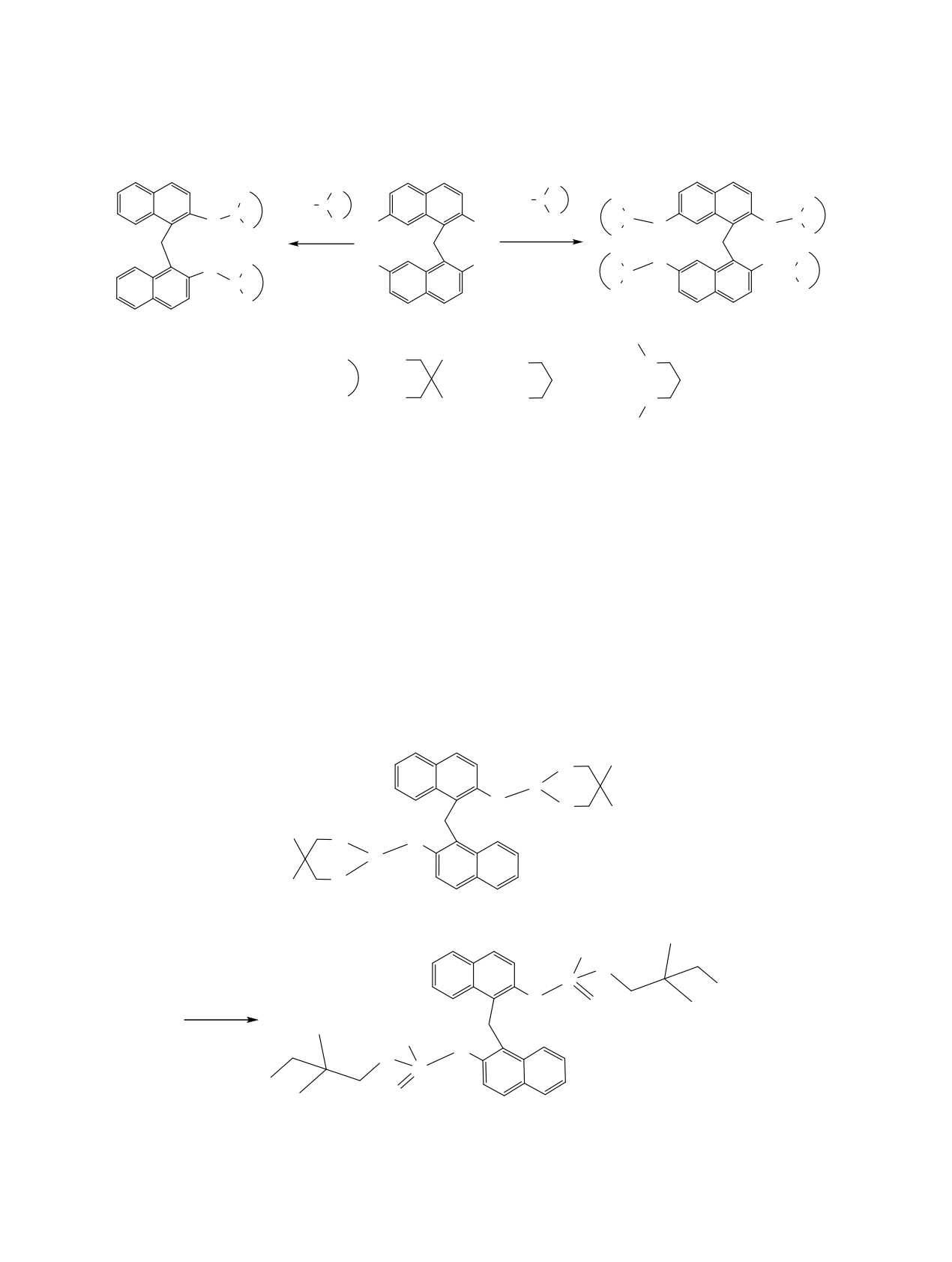ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 3, с. 382-397
УДК 547.661.4
АЛКИЛИРОВАНИЕ 1,3,2-ДИГЕТЕРОФОСФИНАНОВ,
КОНЪЮГИРОВАННЫХ С ДИНАФТИЛМЕТАНАМИ
© 2020 г. О. С. Серкова, В. В. Глушко, М. Р. Гусейнова, В. И. Масленникова*
Институт биологии и химии, Московский педагогический государственный университет,
ул. Кибальчича 6, Москва, 129164 Россия
*е-mail: vi.maslennikova@mpgu.su
Поступило в Редакцию 14 сентября 2019 г.
После доработки 14 сентября 2019 г.
Принято к печати 18 сентября 2019 г.
Изучены реакции алкилирования 2,2'-ди- и 2,2',7,7'-тетра-(1,3,2-дигетерофосфинанил)динафтилметанов
алкил(арилалкил)галогенидами и бромэтилацетатом. Установлены факторы, влияющие на хемоселек-
тивность реакции и выход конечных продуктов.
Ключевые слова: 1,3,2-дигетерофосфинаны, фосфодинафтилметаны, алкилирование, реакция
Михаэлиса-Арбузова, фосфонаты, квазифосфониевые соли
DOI: 10.31857/S0044460X20030075
Одним из активно развивающихся направлений
В настоящей работе рассмотрено алкилирова-
современной химии является дизайн олигофунк-
ние простейшими иодистыми алкилами, бромбен-
ционализированных ароматических соединений,
зилом и бромэтилацетатом ди- и тетра(дигетеро-
прикладные возможности которых определяются
фосфинанил)динафтилметанов 1-6, отличающих-
сочетанием свойств базовой платформы и вводи-
ся количеством и природой фосфинановых ци-
мых групп [1-5]. Особый интерес представляют
клов. 1,3,2-Дигетерофосфинанилдинафтилметаны
олигоароматические системы, содержащие сайты,
1-6 были получены фосфорилированием 2,2'-ди-
способные к последующей трансформации, что
гидроксо-1,1'-динафтилметана 7а и 2,2',7,7'-тетра-
может быть использовано для дизайна рецепто-
гидроксо-1,1'-динафтилметана
7б
2-диэтилами-
ров, сенсорных устройств, полимерных и дендри-
но-1,3,2-дигетерофосфинанами 8а-в (схема 1).
мерных конструкций [6-8]. К соединениям такого
Реакции осуществляли в ацетонитриле при
типа относятся фосфорилированные производные,
небольшом избытке фосфорилирующего реа-
в которых на олигоароматическом остове иммоби-
гента в атмосфере аргона при комнатной темпе-
лизовано несколько фосфитных или амидофос-
ратуре. Продукты фосфорилирования 1-3, 5, 6
фитных групп, обладающих высокой реакционной
самопроизвольно кристаллизовались из реакци-
способностью и легко вступающих в реакции,
онной смеси; тетрафосфинан 4 осаждали гекса-
приводящие к увеличению координационного чис-
ном. Выходы соединений 1-6 составляли 60-97%.
ла атома фосфора [9-12]. В частности, эффектив-
Олигофосфинанилдинафтилметаны 1-3 были описа-
ным методом создания олигоциклических систем,
содержащих фрагменты с Р-С связью является ре-
ны ранее [24, 25], соединения 4-6 получены впервые.
акция Михаэлиса-Арбузова [13, 14], приводящая к
Данные элементного анализа и масс-спектрометрии
образованию фосфонатов. Причем при использо-
подтверждают наличие 2 и 4 дигетерофосфинановых
вании в качестве объектов алкилирования фосфо-
фрагментов в составе фосфодинафтилметанов 5 и 4,
цикланов в зависимости от заместителей у атома
6 соответственно. В спектре ЯМР 31Р дифосфинана
фосфора возможна реализация двух маршрутов
5 фиксировали один синглетный сигнал, в спек-
реакции, протекающих с сохранением и раскрыти-
трах ЯМР 1Н и 13С - по одному набору сигналов
ем фосфорсодержащих циклов [15-23].
для всех групп атомов водорода и углерода ди-
382
АЛКИЛИРОВАНИЕ 1,3,2-ДИГЕТЕРОФОСФИНАНОВ
383
Схема 1.
5
4
X
X
9
3
6
X
Et2N
P
X
X
Et2N
P
2
P
7
X
P
P
O
X
X
10
OH
O
O
X
8
1
8
8
X
X
X
X
OH
O
O X
X
O
P
P
P
X
X
X
1, 3, 5
7а, б
2, 4, 6
X
O
O
N
=
X = H (7а), OH (7б);
(1, 2, 8a);
(3, 4, 8б);
(5, 6, 8в).
X
O
O
N
нафтилметанового остова и диазафосфинановых
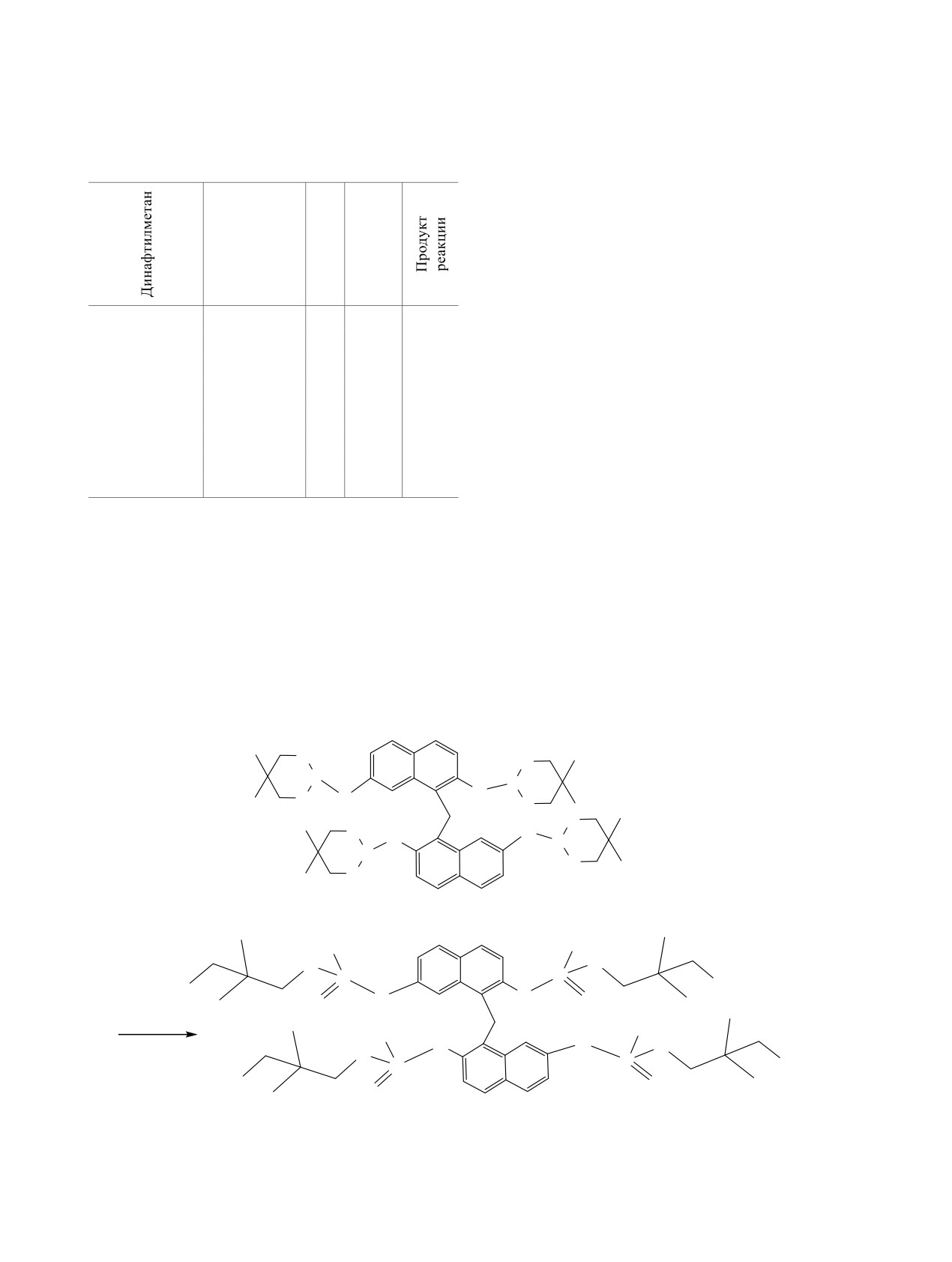
Подбор оптимальных условий взаимодей-
фрагментов. В спектрах ЯМР тетрафосфинанов 4,
ствия осуществляли на примере алкилирования
6 наблюдалось удвоение сигналов всех магнитных
2,2'-ди-(5,5-диметил-1,3,2-диоксафосфинанил)ди-
ядер фосфинановых фрагментов, обусловленное не-
нафтилметана 1 (схема 2). Установлено, что наибо-
эквивалентностью заместителей в положениях 2 и 7.
лее эффективно процесс происходит в микроволно-
вом реакторе в растворе 1,2-дихлорбензола (DCB)
В молекулах олигофосфинанилдинафтилмета-
при 100-110°С и соотношении субстрат:реагент =
нов 1-6 два нафталиновых кольца связаны мети-
1:5. Время реакции составляло 0.5-1 ч.
леновым мостиком и расположены относительно
друг друга под углом, величина которого может из-
Окончание реакции определяли по исчезнове-
меняться в зависимости от природы заместителей,
нию сигналов ядер трехкоординированного фосфора
что обусловливает возможность цис/транс-кон-
в области 114 м. д. в спектрах ЯМР 31Р реакцион-
формационных переходов в растворах [24, 25].
ных смесей. Во всех случаях реакция протекала
Схема 2.
O
2
P
O
O
O
O
P
2'
O
1
R
O
2
P
Hlg
O
5 RHlg
O
MW, DCB
R
O
O
P
2'
Hlg
O
9-12
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
384
СЕРКОВА и др.
Таблица 1. Условия алкилирования фосфодинафтилмета-
блюдалось по два пятна с близкими значениями
нов 1 и 2
Rf. В спектрах ЯМР 31Р фосфонатов 9-12 фикси-
ровали по два синглета с близкими химическими
сдвигами и равной интегральной интенсивностью
Т,
Время,
в области 18-32 м. д. (табл. 2). В спектрах ЯМР 1Н
RHlg
°С
ч
и 13С регистрировалось удвоение сигналов атомов
водорода и углерода алкильных заместителей у
атомов фосфора и метиленовых групп, связанных
1
MeI
100
0.5
9
с атомом иода (табл. 3).
EtI
1
10
В случае бисфосфонатов 9 с использованием
PhCH2Br
110
1
11
колоночной хроматографии нам удалось частично
BrCH2COOEt
1
12
разделить полученную смесь продуктов реакции и
2
MeI
100
1
13
выделить две фракции. Данные масс-спектроме-
EtI
100
2
14
трии до и после разделения на колонке показали,
что молекулярные массы полученных соединений
PhCH2Br
110
2
15
идентичны. В спектре ЯМР 31Р одной из фракций
BrCH2COOEt
110
2
16
фиксировали узкий синглет с химическим сдвигом
28.6 м. д. В спектре ЯМР 1Н присутствовал один
по механизму Михаэлиса-Арбузова с раскрытием
набор сигналов всех групп протонов, что позво-
диоксафосфинановых циклов и образованием ди-
ляло сделать вывод об индивидуальности выде-
нафтилметанов 9-12, содержащих линейные асим-
ленного соединения 9* (табл. 3). Спектры ЯМР
метрические фосфонатные фрагменты (табл. 1, 2).
31Р и 1Н второй фракции отличались от таковых
Независимо от природы алкилирующего реагента
исходной смеси только соотношением сигналов
взаимодействие приводило к образованию двух
ядер фосфонатного фрагмента. Причем сигналы с
стереоизомеров. На хроматографических пласти-
меньшей интенсивностью соответствовали сигна-
нах до и после выделения продуктов реакции на-
лам в спектрах индивидуального стереоизомера 9*.
Схема 3.
O
7
O
2
P
P
O
O
O
O
O
O
O
O
2'
7'
P
P
O
O
2
R
R
O
O
P
7
2
P
Hlg
Hlg
O
O
O
O
10 RHlg
R
R
MW, DCB
O
O
O
O
7'
P
P
2'
Hlg
Hlg
O
O
13-16
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
АЛКИЛИРОВАНИЕ 1,3,2-ДИГЕТЕРОФОСФИНАНОВ
385
Таблица 2. Выходы, данные спектроскопии ЯМР 31Р и масс-спектрометрии для фосфонатов 9-22
№
R
Hlg
Выход, %
δP, м. д.
m/z
9
Me
I
70
29.09, 29.14
848.4 [M]+
9*
Me
I
30
29.11
848.4 [M]+
10
Et
I
64
32.09 (уш. с)
876.9 [M]+
11
CH2Ph
Br
75
24.69, 24.61
906.9 [M]+
12
CH2CООEt
Br
70
18.24, 18.19
921.1 [M + Na]+
13
Me
I
74
28.95,28.71, 28.15, 28.04
1428.7 [M]+
14
Et
I
74
32.33, 31.39
1484.7 [M]+
15
CH2Ph
Br
81
24.91, 24.08
1566.9 [M + Na]+
16
CH2CООEt
Br
79
17.12, 18.29
1528.8 [М]+
17
Me
I
70, 87
29.41 29.36
792 [М]+
17*
Me
I
14
29.33
792 [М]+
18
Me
-
25
26.89
363 [М]+
19*
Et
I
19, 38
32.52
820 [М]+
20
Et
-
45
29.68
376 [М]+
21
CH2CООEt
Br
75
18.62, 18.53
843 [M]+
22
Me
I
74
29.57, 29.49 29.41, 29.30
1316 [М]+
Полученные данные позволяют предположить,
жащих заместителей в пространстве. В спектре
что бисфосфорилированные динафтилметаны
ЯМР 31Р соединения 13 фиксировали набор сиг-
9-12 представляют собой смесь стереоизомеров,
налов в области 30 м. д. (табл. 2), а в спектре ЯМР
содержащую рацемат (R/S,R/S) и R,S-диастереомер,
1Н - уширение сигналов всех групп протонов ме-
близость физико-химических и спектральных ха-
тилфосфонатных фрагментов.
рактеристик которых затрудняет их разделение и
При введении в реакцию алкилирующих реа-
идентификацию.
гентов с более объемными группами происходила
Алкилирование
2,2',7,7'-тетра(5,5-диметилди-
конформационная стабилизация молекул тетра-
оксафосфинанил)динафтилметана 2 протекало в
фосфорилированных продуктов 14-16, приводя-
указанных выше условиях по аналогичному марш-
щая к стереохимической гомотопности фосфонат-
руту, но стереоселективность реакции зависела от
ных групп, расположенных в одинаковых положе-
объема алкильного заместителя алкилирующего
ниях нафталиновых ядер (2,2' и 7,7'). В спектрах
реагента (схема 3, табл. 1). Так, использование ио-
ЯМР 31Р соединений 14-16 фиксировали по два
дистого метила приводило к образованию смеси
равных синглетных сигнала с близкими химиче-
тетрафосфонатов 13, различающихся взаимным
скими сдвигами (табл. 2). В спектрах ЯМР 13С и
расположением нафтильных ядер и фосфорсодер-
1Н налюдалось удвоение сигналов атомов водоро-
Таблица 3. Параметры спектров ЯМР 1Н и 13С соединений 9, 9*, 17, 17* и 18
δН, м. д. (J, Гц)
δС, м. д. (J, Гц)
№
P-СН3
OCH2
CH2I
P-СН3
OCH2
CH2I
С2
9
1.33 д (2JРН = 17.4)
3.61 м
3.04 м
10.5 д (1JРС = 145.7)
72.6
72.7
18.4
146.3
1.35 д (2JРН = 17.4)
3.74 м
3.07 м
11.8 д (1JРС = 147.3)
146.4
9*
1.33 д (2JРН = 17.4)
3.61 д. д
3.04 д
11.8 д (1JРС = 145.7)
72.7
18.4
146.4
3.74 д. д
3.06 д
17
1.30 д (2JРН = 17.4)
3.91 м
3.05 м
11.2 д (1JРС = 144.7)
65.9
66.0
1.21
146.4
1.35 д (2JРН = 17.8)
4.02 м
3.07 м
11.3 д (1JРС = 144.7)
1.24
146.5
17*
1.31 д (2JРН = 17.9)
3.91 м
3.07 м
11.5 д (1JРС = 144.7)
65.9
1.16
146.3
4.02 м
18
1.94 д (2JРН = 17.9)
-
-
12.7 д (1JРС = 146.6)
-
-
148.5
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
386
СЕРКОВА и др.
Схема 4.
O
2
P
O
O
O
O
P
2'
O
3
MW
ii
R
Hlg
O
P
O
O
O
RHlg
O
+
P
R
MW
R
O
i
O
O
Hlg
P
O
17, 19, 21
18, 20
R= Me, Hlg =I (17); R = Me (18); R= Et, Hlg =I (19);
R = Et (20); R= CH2COOEt, Hlg =Br (21);
да и углерода фосфонатных фрагментов, что обу-
фосфора и одного набора сигналов для всех групп
словлено их иммобилизацией в положениях 2,2' и
атомов водорода и углерода динафтилметанового
7,7' динафтиметанового остова.
остова и фосфонатных фрагментов (табл. 2) сви-
детельствует о том, что соединение 17*, также как
Алкилирование 2,2'-ди-(1,3,2-диоксафосфина-
нил)динафтилметана 3 (схема 4, i) происходило не
его неопентиленовый аналог 9*, является индиви-
столь однозначно как его более стерически затруд-
дуальным стереоизомером.
ненного неопентиленового аналога 1 (схема 2).
В спектре ЯМР 31Р второго выделенного сое-
Результат реакции зависел от природы алкилиру-
динения 18 также фиксировали синглет в области
ющего реагента и растворителя, а также от соот-
27 м. д. (табл. 2), однако в спектрах ЯМР 1Н и 13С
ношения реагирующих веществ. Так, при алкили-
отсутствовали сигналы протонов и атомов углеро-
ровании динафтилметана 3 метилиодидом в опти-
да всех метиленовых групп и наблюдались сигна-
мальных условиях с использованием колоночной
лы атомов водорода и углерода алкильных групп,
хроматографии из реакционной смеси было вы-
связанных с атомом фосфора (табл. 3). Дублет ду-
делено два соединения, одно из которых, по дан-
блетов протонов метиленового мостика подтверж-
ным элементного анализа, масс-спектрометрии,
дал циклическую структуру соединения 18, где
ИК и ЯМР спектроскопии, представляло собой
два нафталиновых ядра включены в диоксафос-
динафтилметан 17*, содержащий линейные фос-
фоциновый цикл [26]. Об этом же свидетельство-
фонатные фрагменты (табл. 3). Наличие в спектре
вали данные масс-спектрометрии и элементного
ЯМР 31Р одного узкого синглетного сигнала ядер
анализа.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
АЛКИЛИРОВАНИЕ 1,3,2-ДИГЕТЕРОФОСФИНАНОВ
387
Схема 5.
O
O
7
P
2
P
O
O
O
O
O
O
O
O
2'
7'
P
P
O
O
4
Me
Me
O
O
P
7
2
P
I
I
O
O
O
O
MeI
Me
Me
O
O
O
диоксан,
O
7'
P
MW, 85°C
P
2'
I
I
O
O
22
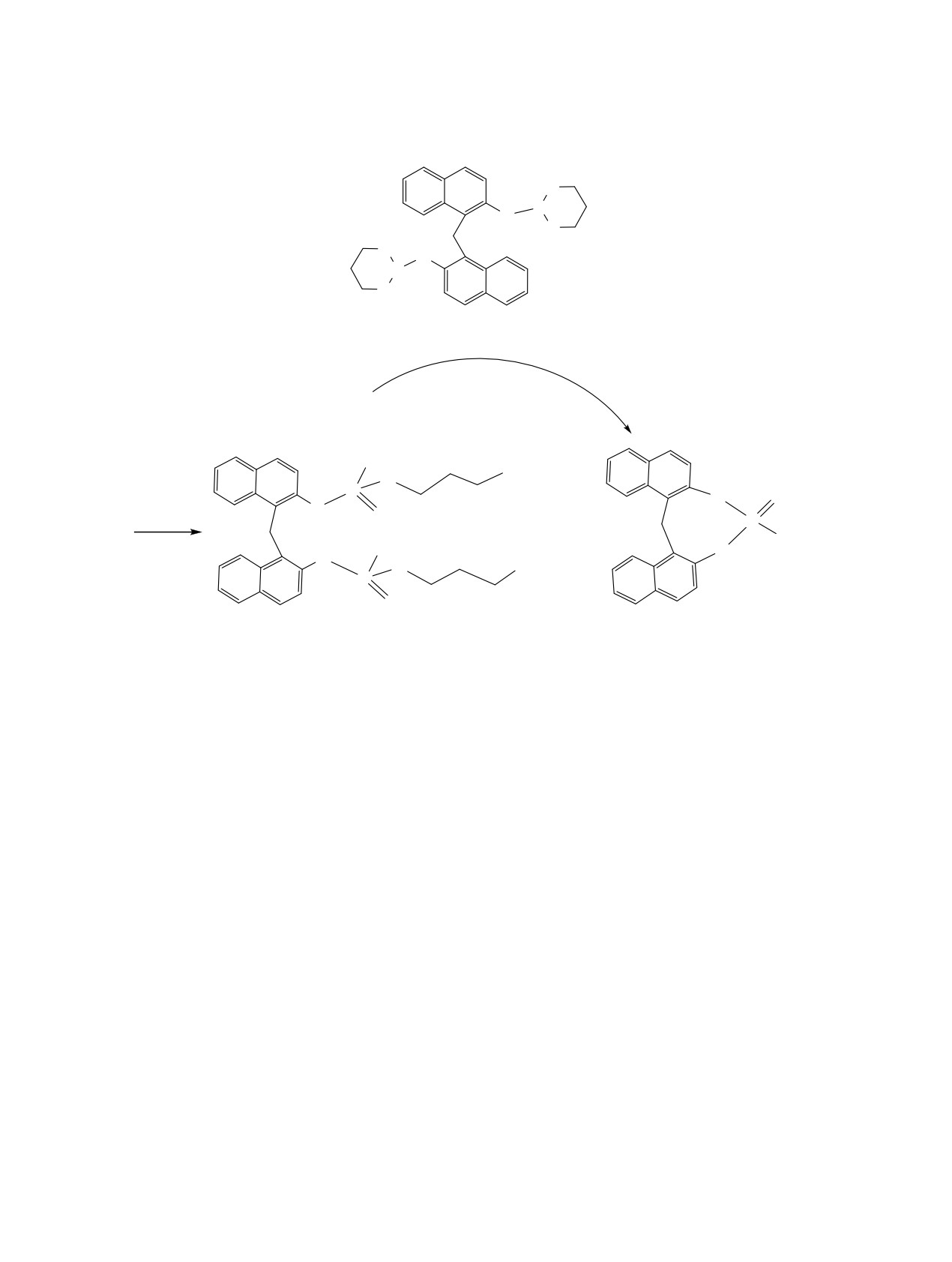
При увеличении в 2 раза количества иодистого
сировался в реакционной смеси даже при соотно-
метила в реакционной смеси (3:МеI =1:10, DCB)
шении 3:EtI = 1:20.
образования фосфоцинового производного 18 не
Следует отметить, что использование в каче-
происходило и единственными продуктами были
стве алкилирующего реагента бромэтилацетата,
стереоизомерные линейные фосфонаты 17. В ди-
так же как и в случае иодистого метила, при со-
оксане взаимодействие фосфодинафтилметана 3 с
отношении субстрат:реагент = 1:10 направленно
иодистым метилом уже при соотношении реагиру-
приводило к образованию двух стереоизомерных
ющих веществ 3:MeI = 1:5 протекало селективно с
линейных фосфонатов 21, выделенных с выходом
образованием только фосфонатов 17, выделенных
75%.
из реакционной смеси осаждением гексаном с вы-
С целью изучения предполагаемого пути об-
ходом 87%. Данные спектроскопии ЯМР для сое-
разования циклофосфонатов 18, 20 мы провели
динений 17 аналогичны таковым для фосфонатов
дополнительный эксперимент. Раствор стереои-
9 (табл. 2, 3), что указывает на образование двух
зомерных фосфонатов 17 выдерживали в дихлор-
стереоизомеров в равных количествах.
бензоле в условиях алкилирования (схема 4, ii,
Аналогично происходило алкилирование со-
MW, 100°С). Через 2 ч в спектрах ЯМР 31Р отсут-
единения 3 иодистым этилом. При соотношении
ствовали сигналы фосфонатов 17, и фиксировался
3:EtI = 1:5 с использованием колоночной хрома-
синглет циклического продукта 18. Спектральные
тографии из реакционной смеси было выделено
характеристики и физико-химические параметры
два соединения: индивидуальный стереоизомер
соединения 18 полностью соответствовали тако-
динафтилметана 19*, содержащий линейные фос-
вым, полученным ранее. Исходя из этих данных,
фонатные фрагменты, и фосфоциновое производ-
мы можем предположить, что образование фосфо-
ное 20 (табл. 3). По данным спектроскопии ЯМР
циновых производных 18, 20 происходит за счет
31Р, увеличение количества иодистого этила в ре-
внутримолекулярной фосфоциклизации линейных
акционной смеси способствовало повышению со-
фосфонатных групп.
держания в продуктах реакции стереоизомерных
Алкилирование иодистым метилом более
фосфонатов 19, однако сигнал соединения 20 фик-
сложного по структуре, чем соединение 3, тетра-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
388
СЕРКОВА и др.
Таблица 4. Условия синтеза, выходы, данные спектроскопии ЯМР 31Р и масс-спектрометрии для соединений 23 и 24
Условия реакции
№
Выход, %
m/z
δР, м. д.
T,°С
растворитель
время
23
20-25
CHCl3
8 сут
82
50.38
717 [M - I]+
50-55
30 ч
80
20-25
1,2-Дихлорбензол
15 сут
57
50-55
30 ч
55
20-25
Бензол
15 сут
94
24
20-25
Бензол
15 сут
85
52.47,
1453 [M]+
52.29,
20-25
CHCl3
8 сут
60
51.62,
51.48
(1,3,2-диоксафосфинанил)динафтилметана
4 в
обусловлена диастереотопностью фосфонатных
1,2-дихлорбензоле (MW, 100°С) приводило к об-
фрагментов, иммобилизованных на динафтилме-
разованию трудноразделимой смеси продуктов.
тановой матрице.
Провести процесс селективно удалось в диоксане
Алкилирование иодистым метилом ди- и тетра-
при 85°С: через 1,5 ч наблюдалась полная конвер-
диазафосфинанилдинафтилметанов 5 и 6, осу-
сия исходного тетрафосфита 4 в фосфонатное про-
ществляемое в микроволновом реакторе, приво-
изводное 22 (схема 5).
дило к деструкции гетероциклов уже при 50°С.
В спектре ЯМР 31Р реакционной смеси отсут-
Однако при проведении реакции в отсутствие ми-
ствовал сигнал в области, характерной для тре-
кроволновой активации в интервале температур
хвалентного фосфора, и фиксировались сигналы
20-55°С процесс протекал селективно и завершал-
фосфонатного производного 22 (табл. 3), которое
ся образованием квазифосфониевых солей 23 и 24
было выделено с выходом 70%. Данные элемент-
(схема 6, табл. 4).
ного анализа и масс-спектрометрии подтвержда-
Варьирование условий реакции (растворитель,
ли наличие в нем 4 фосфонатных фрагментов. В
температура, длительность процесса) влияло толь-
спектрах ЯМР 31Р соединения 22 фиксировали
ко на выход продуктов, причем максимальное вли-
4 синглетных сигнала с близкими химическими
яние на результативность реакции оказывал рас-
сдвигами и равной интегральной интенсивностью.
творитель (табл. 4).
В спектрах ЯМР 1Н и 13С наблюдалось удвоение
сигналов атомов водорода и углерода метилфос-
Наличие двух и четырех квазифосфониевых
фонатных групп. Такая спектральная картина
фрагментов в соединениях 23 и 24 подтверждалось
Схема 6.
N
Me
N
P
P+
X
O
MeI
N
X
O
I-
N
N
O
X
I-
N
P
O
X
P+
N
N Me
5, 6
23, 24
N
Me
N
X = H (5, 23),
O P
(6);
O P+
(24).
N
N
I-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
АЛКИЛИРОВАНИЕ 1,3,2-ДИГЕТЕРОФОСФИНАНОВ
389
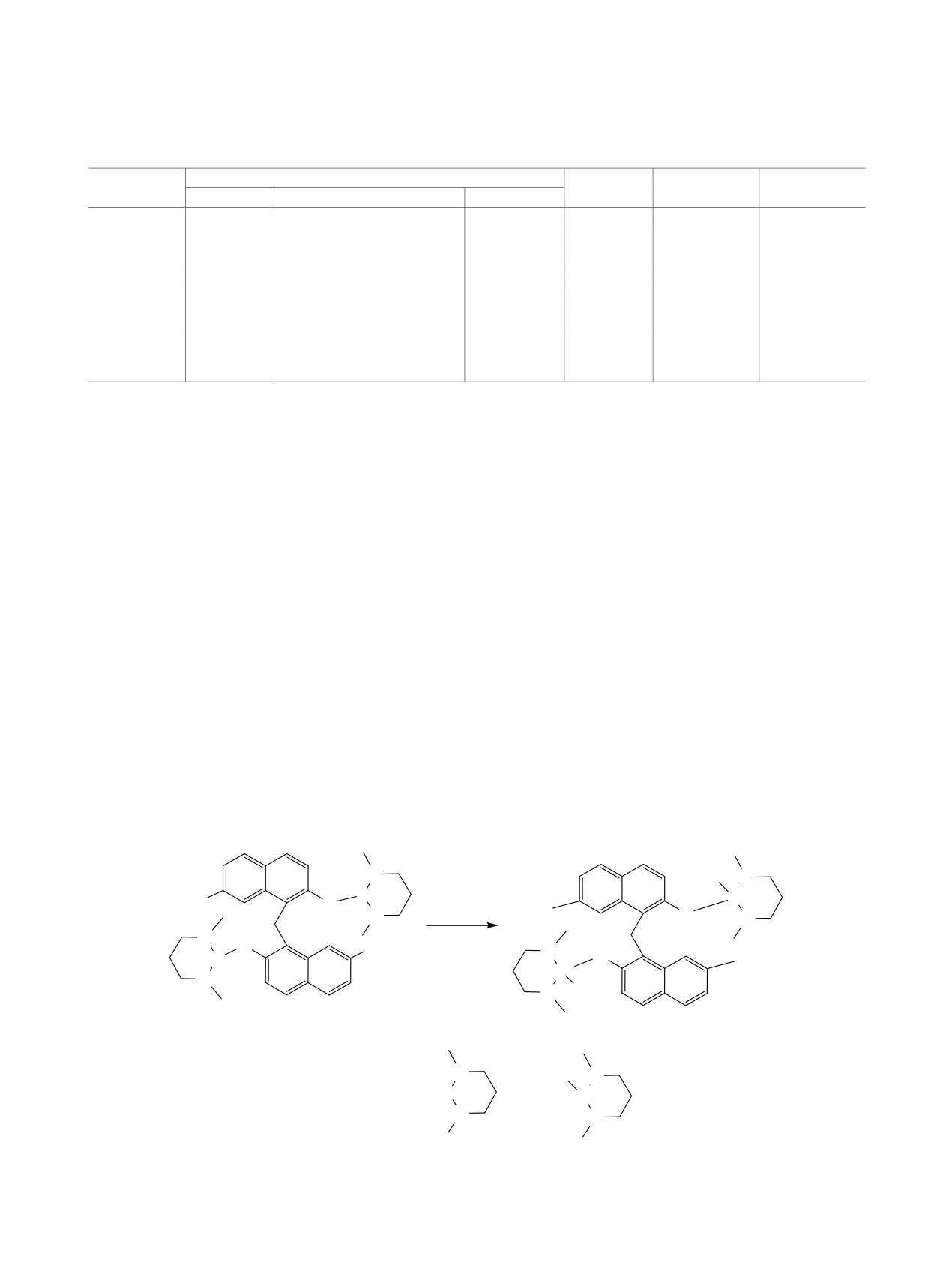
данными масс-спектрометрии (табл. 2). В спектре
1,3,2-дигетерофосфинаны 8, а также фосфодинаф-
ЯМР 31Р соединения 23 фиксировали синглетный
тилметаны 1 и 2 были получены по известным ме-
сигнал с химическим сдвигом 50 м. д., в спектре
тодикам [27-29, 24,25].
соединения 24 регистрировали 4 синглетных по-
Общая методика синтеза фосфодинафтил-
парно сдвоенных сигнала в этой же области, что
метанов 3-6. Раствор 0.5 ммоль динафтилметана
обусловлено неэквивалентностью всех квазифос-
7а/7б и 1.5/3.0 ммоль 2-диэтиламидо-1,3,2-дигето-
фониевых заместителей за счет их различного рас-
фосфинана 8б/8в в 2 мл ацетонитрила выдержи-
положения в пространстве. В спектрах ЯМР 1Н и
вали 48 ч при 20°С. Кристаллы отфильтровывали,
13С производных 23 и 24, помимо сигналов атомов
промывали ацетонитрилом и сушили при 70-75°С
водорода и углерода динафтилметанового остова
(1 мм рт. ст.). Для выделения динафтилметана 4
и диазафосфинановых циклов с немного изменен-
реакционную смесь полностью упаривали, до-
ными химическими сдвигами по сравнению с ис-
бавляли к остатку 0.5 мл хлороформа и осаждали
ходными диамидофосфитами 5 и 6, фиксировали
продукт 15 мл гексана. Осадок отфильтровыва-
дублетные сигналы атомов водорода и углерода
ли, промывали гексаном и сушили при 70-75°С
метильных групп, связанных с атомами фосфора,
(1 мм рт. ст.).
что подтверждало сохранение циклической струк-
2,2'-Ди-(1,3,2-диоксафосфинанил)динафтил-
туры фосфорсодержащих фрагментов.
метан (3). Выход 93%, бесцветные кристаллы,
Таким образом, в результате алкилирования ди-
т. пл. 156-158°С (CH3CN) {т. пл. 156-158°С (диок-
гетерофосфинановых групп, иммобилизованных
сан) [25]}. Спектр ЯМР 1Н (СDCl3), δ, м. д.: 1.62
на динафтилметановой платформе, синтезирована
м (2Н, СН2, 3JНН = 2.2, 2JНН = 14.2, 4JРН = 4.4 Гц),
серия новых соединений, содержащих Р-С связь и
2.53 м (2Н, СН2, 3JНН = 4.6, 2JНН = 13.7 Гц), 3.88 м
различающихся количеством, природой и структу-
(4Н, ОСН2, 3JРН = 1.8, 3JНН = 4.6, 2JНН = 11.5 Гц),
рой фосфорсодержащих фрагментов.
4.63 м (4Н, ОСН2, 3JНН = 1.8, 2JНН = 12.4, 3JРН =
5.0 Гц), 5.06 с (2Н, CН2), 7.31 м (4H, H6,7, 3JНН =
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
6.9, 3JНН = 9.6 Гц), 7.43 д (2H, H3, 3JНН = 9.1 Гц),
Все эксперименты проводили в абсолютиро-
7.69 д (2H, H4, 3JНН = 8.7 Гц), 7.73 д (2H, H8, 3JНН =
ванных обескислороженных растворителях в ат-
7.8 Гц), 8.26 д (2H, H5, 3JНН = 8.2 Гц). Спектр ЯМР
мосфере аргона. Эксперименты с использованием
13С (CDCl3), δС, м. д.: 23.6 (СH2), 28.5 д (СН2,
микроволнового облучения проводили в реакторе
3JСР = 5.7 Гц), 60.3 (ОСН2), 119.9 д (С3, 3JСР =
CEM Discover (Focused MicrowaveTM Synthesis
13.4 Гц), 124.1 (С6), 124.5 (С5), 125.8 (С1), 126.7
System Discover) (50-150 Вт, 2455 МГц). Спектры
(С7), 128.3 (С4), 128.5 (С8), 130.8 (С10), 133.9 (С9),
ЯМР 1Н, 13С (внутренний стандарт - ТМС) и 31Р
148.31 д (C2OP, 2JСР = 6.7 Гц). Спектр ЯМР 31Р
(внешний стандарт - 85% Н3РО4) для всех соеди-
(CDCl3): δР 124.36 м. д. Масс-спектр, m/z: 509.1 [M]+.
нений записывали на спектрометре Jeol ECX-400
2,2',7,7'-Тетра-(1,3,2-диоксафосфинанил)ди-
(с рабочей частотой для ядер 13С 100.5 МГц, для
нафтилметан (4). Выход 60%, белый порошок,
ядер 31Р 161.8 МГц). Для точного отнесения сиг-
т. пл. 140-141°С. Спектр ЯМР1 Н (СDCl3), δ, м. д.:
налов синтезированных соединений использовали
1.58 д. д (2Н, СН2, 4JРН = 1.9, 2JНН =14.3 Гц), 1.64 д.
1Н-1Н гомоядерный двойной резонанс и 1H-13C
д (2Н, СН2, 4JРН = 1.9, 2JНН = 14.1 Гц), 2.51 м (4Н,
2D-корреляцию. Масс-спектры регистрирова-
СН2, 3JНН = 4.9, 3JНН = 14.2 Гц), 3.78 м (4Н, ОСН2,
ли на приборе Bruker Ultraflex TOF/TOF (Bruker
3JНН = 4.1, 3JНН = 7.8, 3JРН = 11.0 Гц), 3.89 м (4Н,
Daltonics GmbH), матрица - 1,8,9-тригидроксиан-
ОСН2, 3JНН = 4.1, 3JНН = 7.8, 3JРН = 10.5 Гц), 4.48
трацен. Элементный анализ проводили на CHN
м (4Н, ОСН2, 3JНН = 11.9 Гц), 4.74 м (4Н, ОСН2,
анализаторе Thermo Flash EA112. ИК спектры
3JНН = 11.5 Гц), 4.96 с (2Н, CН2), 7.07 д. д (2H, H3,
регистрировали на спектрометре Nicolete
380
3JНН = 8.7, 4JРН = 1.8 Гц), 7.32 д (2H, H6, 3JНН = 8.7
Thermo в режиме отражения в диапазоне 4000-
Гц), 7.61 д (2H, H4, 3JНН = 9.1 Гц), 7.66 д (2H, H5,
500 см-1 на ZnSe стекле.
3JНН = 8.7 Гц), 7.83 с (2H, H8). Спектр ЯМР 13С
2,2'-Дигидроксидинафтилметан 7а, 2,2',7,7'-те-
(CDCl3), δС, м. д.: 23.4 (СН2), 28.4 д (СН2, 3JСР =
трагидроксидинафтилметан
7б,
2-диэтиламидо-
5.8 Гц), 28.5 д (СН2, 3JСР = 4.8 Гц), 59.9 (ОСН2),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
390
СЕРКОВА и др.
60.4 (ОСН2), 112.8 д (С8, 3JСР = 8.6 Гц), 118.8 (С6),
спектр, m/z: 852 [M]+. Найдено, %: С 57.78; H 7.13;
118.9 д (С3, 3JСР = 3.8 Гц), 125.1 (С1), 127.5 (С9),
N 13.10. C41H60O4P4N8. Вычислено, %: С 57.74; Н
127.9 (С4), 130.3 (С5), 135.1 (С10), 148.9 д (C2, 2JСР =
7.09; N 13.14.
6.7 Гц), 151.08 д (C7, 2JСР = 6.7 Гц). Спектр ЯМР
Общая методика алкилирования соедине-
31Р (CDCl3), δР, м. д.: 124.5, 123.77. Масс-спектр,
ний 1, 2. В ампулу помещали раствор 0.06 ммоль
m/z: 748 [M + H]+. Найдено, %: C 56.98; H 6.42;
фосфодинафтилметана 1/2 в 2 мл 1,2-дихлорбензола
P 14.26. C41H52O12P4. Вычислено, %: C 57.21; H
и 0.3/0.6 ммоль алкилирующего реагента. Ампулу
6.09; P 14.3.
помещали в микроволновой реактор и выдержива-
2,2'-Ди-(N,N'-диметил-1,3,2-диазафосфина-
ли в условиях, указанных в табл. 1. Для выделения
нил)динафтилметан (5). Выход 85%, бесцвет-
фосфонатов 9-13 реакционные смеси медленно вы-
ные кристаллы, т. пл. 158-159°С. Спектр ЯМР 1Н
ливали в 50 мл охлажденного до 0°С гексана. Гексан
(СDCl3), δ, м. д.: 1.83 уш. м (4Н, CH2), 2.15 уш. м
декантировали, масляный слой промывали холодным
(4Н, CH2), 2.79 уш. д (16Н, NCH3, NCH2, 3JРН =
гексаном (3×5 мл) и сушили в вакууме (1 мм рт. ст.)
11.0 Гц), 3.42 уш. м (8Н, NCH2), 5.01 c (2H, CH2),
при 70-75°С. Тетрафосфонаты 14-16 выделяли с по-
7.21 м (4H, H6,7, 3JНН = 7.8 Гц), 7.48 д (2H, H3,
мощью колоночной хроматографии. В качестве элю-
3JНН = 8.7 Гц), 7.63 м (4H, H4,5, 3JНН = 7.8 Гц), 8.38
ента использовали гексан (15-20 мл), который затем
д (2H, H8, 3JНН = 8.2 Гц). Спектр ЯМР 13С (CDCl3),
заменяли на смесь бензол:диоксан = 3:2 (14), 5:2 (15),
δС, м. д.: 22.3 (CH2), 25.8 (СH2), 40.5 д (NCH3,
3:1 (16). Растворители полностью упаривали, остаток
3JСР = 31.6 Гц), 45.1 д (NCH2, 3JСР = 5.8 Гц), 120.2
сушили в вакууме (1 мм рт. ст.) при 70-75°С.
д (С3, 3JСР = 16.3 Гц), 123.3 (С6/7), 124.9 (С8),
2,2'-Ди-(3-иод-2,2-диметилпропокси-
125.5 (С1), 125.9 (С6/7), 127.9 (С4/5), 128.2 (С4/5),
метилфосфонато)-1,1-динафтилметан (9). Выход
130.0 (С10), 134.2 (С9), 150.8 (С2). Спектр ЯМР
70%, светло-коричневое масло, Rf 0.5, 0.6 (бензол:-
31Р (CDCl3): δР 126.64 м. д. Масс-спектр, m/z:
диоксан = 5:1). ИК спектр, ν, см-1: 1267.0 (Р=О),
560 [M]+. Найдено, %: С 66.51; H 6.85; N 10.00.
1208.9 (Р=О), 1127.3 (Р-О), 1033.7 (Р-О). Спектр
C31H38O2P2N4. Вычислено, %: С 66.42; Н 6.83; N
ЯМР 1Н (CDCl3), δ, м. д.: 0.91 с [3Н, С(СН3)2], 0.92
9.99.
с [3Н, С(СН3)2], 0.96 с [3Н, С(СН3)2], 0.97 с [3Н,
2,2',7,7'-Тетра-(N,N'-диметил-1,3,2-
С(СН3)2], 1.33 д (3Н, РСН3, 2JРH = 17.4 Гц), 1.35 д
диазафосфинанил)динафтилметан
(6). Выход
(3Н, РСН3, 2JРH = 17.4 Гц), 3.04 м (2Н, СН2I, 2JНH =
97%, мелко-кристаллический порошок белого цве-
7.3 Гц), 3.06 м (2Н, СН2I, 2JНH = 6.0 Гц), 3.61 м (2Н,
та, т. пл. 168-170°С. Спектр ЯМР 1Н (СDCl3), δ,
СН2О, 3JРH = 9.7, 3JHH = 5.5 Гц), 3.74 м (4Н, СН2О,
м. д.: 1.70 уш. м (2Н, CH2), 1.77 уш. м (2Н, CH2),
3JРH = 9.6, 3JHH = 5.5 Гц), 4.94 с (2H, Naph-CH2-
1.99 уш. м (2H, СН2), 2.10 уш. м (2H, СН2), 2.20
Naph), 7.38 д. д (4H, H3,7, 3JHH = 5.5, 3JHH = 7.8 Гц),
д (6H, NCH3, 3JРН = 42.4 Гц), 2.35 д (6H, NCH3,
7.69 д. д (4H, H4,6, 3JHH = 5.5, 3JHH = 9.2 Гц), 7.78
3JРН = 42.4 Гц), 2.47 уш. м (4Н, NCH2), 2.53 уш.
д. д (2Н, H8, 3JHH = 6.4, 3JHH = 9.1 Гц), 8.11 д. д
м (4H, NCH2), 2.73 д (6H, NCH3, 3JРН = 42.4 Гц),
(2H, H5, 3JHH = 6.9, 3JHH = 7.3 Гц). Спектр ЯМР 13C
2.80 д (6H, NCH3, 3JРН = 42.4 Гц), 3.06 уш. м (4H,
(CDCl3), δC, м. д.: 10.5 д (РСН3, 1JСР = 145.7 Гц), 11.8
NCH2), 3.38 уш. м (4H, NCH2), 4.93 c (2H, CH2),
д (РСН3, 1JСР = 147.3 Гц), 18.4 (СН2I), 23.7 (СCH3),
6.92 д (2H, H3, 3JНН = 8.4 Гц), 7.25 д (2H, H6,
23.8 (СCH3), 24.1 (CH2), 35.0 д (СCH3, 3JСР =
3JНН = 8.4 Гц), 7.53 м (4H, H4,5, 3JНН = 6.9, 3JНН =
7.7 Гц), 72.6 д (СН2О, 2JСР = 6.7 Гц), 72.7 д (СН2О,
2JСР = 6.7 Гц), 120.3 (C8), 124.3 (C3), 125.1 (C7),
8.2 Гц), 7.55 с (2Н, Н8). Спектр ЯМР 13С (CDCl3),
126.9 (C6), 128.5 (C4), 128.8 (C5,1), 131.4 (C10), 133.3
δС, м. д.: 23.1 (СH2), 25.9 (СН2), 26.0 (CH2), 40.0
д (NCH3, 2JСР = 30.7 Гц), 40.4 д (NCH3, 2JСР =
(C9), 146.3 д (C2, 2JCP = 8.6 Гц), 146.4 д (C2, 2JCP =
31.6 Гц), 44.5 д (NCH2, 2JСР = 42.2 Гц), 44.9 д
8.6 Гц). Спектр ЯМР 31Р (CDCl3), δР, м. д.: 29.14,
29.09. Масс-спектр, m/z: 848.4 [М]+. Найдено, %:
(NCH3, 2JСР = 45.0 Гц), 113.4 д (С8, 3JСР = 7.7 Гц),
C 46.83; H 4.98. C33H40I2O6P2. Вычислено, %: C
118.8 д (С3, 3JСР = 15.3 Гц), 119.1 д (С6, 3JСР =
46.71; H 4.75.
7.7 Гц), 124.7 (С1), 126.3 (С10), 127.3 (С4), 129.4
(С5), 135.3 (С9), 151.2 (С2), 154.2 (С7). Спектр
2,2'-Ди-(3-иод-2,2-диметилпропокси-
ЯМР 31Р (CDCl3), δР, м. д.: 127.71, 126.99. Масс-
метилфосфонато)-1,1-динафтилметан (9*) выде-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
АЛКИЛИРОВАНИЕ 1,3,2-ДИГЕТЕРОФОСФИНАНОВ
391
лен из смеси метилфосфонатов 9 с помощью ко-
2,2'-Ди-(3-бром-2,2-диметилпропокси-
лоночной хроматографии (бензол:диоксан = 5:1).
бензилфосфонато)-1,1-динафтилметан
(11).
Выход 30%, бесцветное масло, Rf 0.5 (бензол:диок-
Выход 75%, зеленое масло, Rf 0.41, 0.56 (гексан:эти-
сан = 5:1). ИК спектр, ν, см-1: 1267.0 (Р=О), 1208.9
лацетат = 1:1). ИК спектр, ν, см-1: 1245.3 (Р=О),
(Р=О), 1127.3 (Р-О), 1033.7 (Р-О). Спектр ЯМР 1Н
1209.8 (Р=О),
1035.7 (Р-О). Спектр ЯМР
1Н
(CDCl3), δ, м. д.: 0.91 с [6Н, С(СН3)2], 0.97 с [6Н,
(СDС13), δ, м. д.: 0.79 с [3Н, С(СН3)2], 0.81 с [3Н,
С(СН3)2], 1.33 д (6Н, РСН3, 2JРH = 17.4 Гц), 3.04 д
С(СН3)2], 0.82 с [3Н, С(СН3)2], 0.83 с [3Н, С(СН3)2],
(2Н, СН2I, 2JНH = 10.8 Гц), 3.06 д (2Н, СН2I, 2JНH =
2.95 м (4Н, РСН2), 3.08 уш. с (4Н, СН2Br), 3.67 м (2Н,
9.64 Гц), 3.61 д. д (2Н, СН2О, 3JРH = 10.8, 3JHH =
СН2О, 3JРH = 10.6, 2JHH = 5.48 Гц), 4.75 с (2H, CH2),
4.56 Гц), 3.74 д. д (2Н, СН2О, 3JHH = 9.6, 3JHH =
7.19 уш. с (10Н, Ph), 7.39 м (2H, H7, 3JHH = 5.5, 3JHH =
5.5 Гц), 4.94 с (2H, CH2), 7.38 д. д (4H, H3,7, 3JHH =
7.8 Гц), 7.70 м (4H, H3,4, 3JHH = 8.7 Гц), 7.70 м (2H,
4.2, 3JHH = 7.4 Гц), 7.69 м (4H, H4,6, 3JHH = 5.5,
H6, 3JHH = 7.8, 3JHH = 5.6 Гц), 7.78 м (4Н, H8,5, 3JHH =
3JHH = 9.2 Гц), 7.78 д (2Н, H8, 3JHH = 8.7 Гц), 8.11 д
5.9, 3JHH = 9.6 Гц). Спектр ЯМР 13C (CDCl3), δС,
(2H, H5, 3JHH = 6.9 Гц). Спектр ЯМР 13C (CDCl3),
м. д.: 22.7 (СCH3), 23.8 (CH2), 33.4 д (РСН2, 1JСР =
δС, м. д.: 11.8 д (РСН3, 1JРС = 145.7 Гц), 18.5 (СН2I),
138.9 Гц), 36.2 д (СCH3, 3JСР = 6.7 Гц), 41.8 (СН2Br),
23.7 (СCH3), 23.8 (СCH3), 24.2 (CH2), 35.0 д (СCH3,
72.2 д (ОСН2, 2JСР =7.6 Гц), 120.4 (C6), 124.5 (C5),
3JРС = 7.7 Гц), 72.7 д (ОСН2, 2JСР = 6.7 Гц), 120.3
125.2 (C7), 126.0 д (C3, 3JСР = 4.8 Гц), 126.8 (Ph),
(C8), 124.3 (C3), 125.1 (C7), 126.9 (C6), 128.5 (C4),
127.3 (Ph), 128.6 (C4), 128.8 (C8), 130.0 (Ph), 130.6
128.8 (C5,1), 131.4 (C10), 133.3 (C9), 146.36 д (C2,
(Ph), 131.5 (C10), 133.4 (C9), 146.3 д (C2, 2JСР =
2JСР = 8.6 Гц). Спектр ЯМР 31Р (CDCl3): δР 29.11
9.5 Гц), 146.4 д (C2, 2JСР = 8.6 Гц). Спектр ЯМР 31Р
м. д. Масс-спектр, m/z: 848.4 [М]+. Найдено, %:
(CDCl3), δР, м. д.: 24.69, 24.61. Масс-спектр, m/z:
C 46.83; H 4.98. C33H40I2O6P2. Вычислено, %: C
906.9 [M]+, 928.9 [М + Na]+. Найдено, %: C 59.20;
46.71; H 4.75.
H 5.68. C45H48Br2O6P2. Вычислено, %: C 59.62; H
2,2'-Ди-(3-иод-2,2-диметилпропокси-
5.34.
этилфосфонато)-1,1-динафтилметан (10). Выход
2,2'-Ди-(3-бром-2,2-диметилпропокси-
64%, темно-желтое масло, Rf 0.55, 0.63 (бензол:диок-
этилацетатофосфонато)-1,1-динафтилметан
сан = 6:1). ИК спектр, ν, cm-1: 1254.2 (Р=О), 1048.8
(12). Выход 70%, темно-желтое масло, Rf 0.92 (гек-
(Р-О). Спектр ЯМР 1Н (CDCl3), δ, м. д.: 0.90 с [3Н,
сан:этилацетат = 10:1). ИК спектр, ν, см-1: 1737.3
С(СН3)2], 0.93 с [3Н, С(СН3)2], 0.96 с [3Н, С(СН3)2],
(С=О), 1279.7 (Р=О), 1210.3 (Р=О), 1031.1 (Р-О),
0.97 с [3Н, С(СН3)2], 1.33 м (3Н, РСН2СН3, 3JРH =
1002.5 (Р-О). Спектр ЯМР 1Н (CDCl3), δ, м. д.:
14.2, 3JНH = 7.3 Гц), 1.35 м (3Н, РСН2СН3, 3JРH =
0.90 с [3Н, С(СН3)2], 0.92 с [3Н, С(СН3)2], 0.95
14.2, 3JНH = 6.4 Гц), 1.75 м (4Н, РСН2СН3, 2JРH =
с [3Н, С(СН3)2], 0.97 с [3Н, С(СН3)2], 1.16 т (3Н,
14.2, 3JНH = 7.3 Гц), 3.04 м (2Н, СН2I, 2JНH = 9.6 Гц),
ОСН2СН3, 3JНH = 7.3 Гц,), 1.35 т (3Н, ОСН2СН3,
3.07 м (2Н, СН2I, 2JНH = 10.0 Гц), 3.67 м (2Н, СН2О,
3JНH = 6.4 Гц), 2.96 м (4Н, РСН2, 3JРH = 14.2,
3JРH = 10.0, 2JHH = 5.5 Гц), 3.81 м (2Н, СН2О, 3JРH =
3JНH = 7.3 Гц), 3.04 с (2Н, СН2Br), 3.07 с (2Н, СН2Br),
9.6, 2JHH = 5.5 Гц), 4.94 с (2H, CH2), 7.34 м (4H,
3.67 м (2Н, СН2О, 3JРH = 10.0, 3JHH = 5.5 Гц), 3.81
H3,7, 3JHH = 6.4, 3JHH = 9.6 Гц), 7.70 м (4H, H4,6,
м (2Н, СН2О, 3JHH = 9.6, 3JHH = 5.5 Гц), 4.09 к (4Н,
3JHH = 6.8, 3JHH = 9.6 Гц), 8.09 м (4Н, H8,5, 3JHH =
ОСН2СН3, 3JНH = 6.8 Гц), 4.94 с (2H, CH2), 7.34 м
6.4, 3JHH = 9.4 Гц). Спектр ЯМР 13C (CDCl3), δС,
м. д.: 6.7 д (РСН2СН3, 2JСР = 6.7 Гц), 18.4 (СН2I),
(4H, H3,7, 3JHH = 6.4, 3JHH = 9.6 Гц), 7.70 м (4H, H4,6,
19.1 д (РСН2СН3, 1JСР = 141.9 Гц), 23.8 (СCH3), 23.9
3JHH = 6.8, 3JHH = 9.6 Гц), 8.09 м (4Н, H8,5, 3JHH =
(CH2), 35.1 д (СCH3, 3JСР = 7.1 Гц), 72.73 д (СН2О,
6.4, 3JHH = 9.4 Гц). Спектр ЯМР 13C (CDCl3), δС,
2JРС = 6.7 Гц), 120.37 (C8), 124.37 (C3),
125.04
м. д.: 14.1 (ОСН2СН3), 22.7 (СCH3), 22.8 (СCH3),
(C7), 125.8 (C1), 126.75 (C6), 128.63 (C4), 128.73
23.8 (CH2), 34.1 д (РСН2, 1JСР = 137.1 Гц), 35.5 д
(C5),131.42 (C10), 133.36 (C9), 146.2 д (C2, 2JСР =
(РСН2, 1JСР = 135.2 Гц), 36.2 (СCH3), 42.7 (СН2Br),
9.6 Гц), 146.3 д (C2, 2JСР = 9.6 Гц). Спектр ЯМР
62.1 (ОСН2СН3), 72.7 д (ОСН2, 2JСР = 6.7 Гц),
31Р (CDCl3): δР 32.09 м. д. Масс-спектр, m/z: 876.9
120.2 (C6), 124.4 (C5), 125.3(C7), 126.0 д (C3, 3JСР =
[М]+. Найдено, %: C 47.83; H 4.98. C35H44I2O6P2.
4.8 Гц), 128.5 (C4), 128.8 (C8), 131.6 (C10), 133.3
Вычислено, %: C 47.96; H 5.06.
(C9),
146.4 д (C2, 2JСР = 8.6 Гц), 165.1 д (С=О,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
392
СЕРКОВА и др.
2JСР = 5.8 Гц), 165.2 (С=О). Спектр ЯМР 31Р (CDCl3),
128.9 (C1,5), 130.7 (C10), 134.2 (C9), 147.0 д (C2,
δР, м. д.: 18.24, 18.19. Масс-спектр, m/z: 921.1 [М +
2JСР = 8.6 Гц), 149.2 д (C7, 2JСР = 7.6 Гц). Спектр
Na]+. Найдено, %: C 52.20; H 5.18. C39H48Br2O10P2.
ЯМР 31Р (CDCl3), δР, м. д.: 31.33, 31.39. Масс-
Вычислено, %: C 52.13; H 5.38.
спектр, m/z: 1484.7 [М]+. Найдено, %: C 39.91; H
4.98. C49H72I4O12P4. Вычислено, %: C 39.64; H 4.89.
2,2',7,7'-Тетра-(3-иод-2,2-диметилпропокси-
метилфосфонато)-1,1-динафтилметан
(13).
2,2',7,7'-Тетра-(3-бром-2,2-диметилпропокси-
Выход 74%, бесцветное масло, Rf 0.35, 0.50, 0.57
бензилфосфонато)-1,1-динафтилметан
(15).
(бензол:диоксан = 3:2). ИК спектр, ν, см-1: 1255.9
Выход 81%, темно-вишневое масло, Rf 0.79 (бензо-
(P=O), 1207.6 (P=O), 1037.7 (P-O). Спектр ЯМР
л:диоксан = 5:2). ИК спектр, ν, см-1: 1247.2 (Р=О),
1Н (CDCl3), δ, м. д.: 0.93 с [6Н, С(СН3)2], 0.94 с
1203.2 (Р=О), 1028.7 (Р-О), 1014.2 (Р-О). Спектр
[6Н, С(СН3)2], 1.00 с [6Н, С(СН3)2], 1.04 с [6Н,
ЯМР 1Н (СDС13), δ, м. д.: 0.80 с [12Н, С(СН3)2],
С(СН3)2], 1.45 уш. д (6Н, РСН3, 2JРH = 18.3 Гц), 1.52
0.82 с [12Н, С(СН3)2], 3.14 уш. с (16Н, РСН2,
уш. д (3Н, РСН3, 2JРH = 17.9 Гц), 3.05 м (4Н, СН2I,
СН2Br), 3.75 уш. м (8Н, СН2О), 4.63 с (2H, CH2),
2JНH = 10.1 Гц), 3.11 м (2Н, СН2I, 2JНH = 9.1 Гц), 3.63
7.21 уш. с (26Н, Ph, Н3), 7.62 м (4H, Н4,6), 7.72 м
уш. м (2Н, СН2О), 3.80 уш. м (4Н, СН2О), 3.90 уш. м
(4H, Н5,8). Спектр ЯМР 13C (CDCl3), δС, м. д.: 22.7
(2Н, СН2О), 4.84 с (2H, CH2), 7.33 д (2H, H3, 3JHH =
(СCH3), 24.0 (CH2), 33.4 д (РСН2, 1JРС = 134.2 Гц),
8.7 Гц), 7.63 д (4H, H4/6, 3JHH = 9.2 Гц), 7.70 д (4H,
36.2 (СCH3, 3JСР = 5.8 Гц), 41.8 (СН2Br), 71.6 д
H4/6, 3JHH = 8.7 Гц), 7.78 д (2Н, H5,8, 3JHH = 8.7 Гц).
(ОСН2, 2JСР = 6.7 Гц), 72.3 (ОСН2), 114.4(C8), 120.1
Спектр ЯМР 13C (CDCl3), δС, м. д.: 10.9 д (РСН3,
(C6), 125.3 (C3), 127.3 (Ph), 128.5(C4), 128.8(C1),
1JСР = 145.7 Гц), 11.1 д (РСН3, 1JСР = 147.6 Гц),
128.9 (C5), 129.9 (Ph), 130.0 (Ph), 130.6 (Ph), 130.8
11.2 д (РСН3, 1JРС = 145.7 Гц), 11.3 д (РСН3, 1JСР =
(C10), 134.1 (C9), 147.1 (C2), 149.2 д (C7, 2JСР =
145.7 Гц), 18.5 (СН2I), 23.8 (СCH3), 23.9 (СCH3),
6.7 Гц). Спектр ЯМР 31Р (CDCl3), δР, м. д.: 24.91,
24.3 (CH), 35.0 д (СCH3, 3JСР = 6.7 Гц), 35.1 д (СCH3,
24.08. Масс-спектр, m/z: 1566.9 [М + Na]+. Найдено,
3JСР = 6.7 Гц), 72.3 (СН2О), 72.8 д (ОСН2, 2JСР =
%: C 53.40; H 4.98. C45H64Br4O12P4. Вычислено, %:
7.7 Гц), 114.3 (C8), 119.9 (C6), 125.1 (C3,4), 128.5
C 53.64; H 5.22.
(C1), 128.9 (C5), 130.9 (C10), 134.1 (C9), 147.2 д (C2,
2,2',7,7'-Тетра-(3-бром-2,2-диметилпропокси-
2JСР = 8.6 Гц), 149.1 д (C7, 2JСР = 8.6 Гц). Спектр
этилацетатофосфонато)-1,1-динафтилметан
ЯМР 31Р (CDCl3), δР, м. д.: 28.55, 28.66, 29.35,
(16). Выход 79%, темно-желтое масло, Rf 0.49 (бен-
29.46. Масс-спектр, m/z: 1428.7 [М]+. Найдено, %:
зол:диоксан = 3:1). ИК спектр, ν, см-1:
1732.9
C 37.91; H 4.98. C45H64I4O12P4. Вычислено, %: C
(С=О), 1265.9 (Р=О), 1200.8 (Р=О), 1027.4 (Р-О).
37.84; H 4.52.
Спектр ЯМР 1Н (СDС13), δ, м. д.: 0.96 уш. с [24Н,
2,2',7,7'-Тетра-(3-иод-2,2-диметилпропокси-
С(СН3)2], 1.19 м (12Н, ОСН2СН3), 2.98 м (8Н, РСН2),
этилфосфонато)-1,1-динафтилметан (14). Выход
3.24 уш. с (8Н, СН2Br), 3.86 м (4Н, СН2О), 3.98 м (4Н,
74%, темно-желтое масло, Rf 0.52 (бензол:диоксан =
СН2О), 4.09 м (8Н, ОСН2СН3), 4.90 с (2H, CH2),
3:2). ИК спектр, ν, см-1: 1248.1 (P=O), 1209.3 (P=O),
7.33 м (2H, Н3), 7.68-7.83 м (8H, Н4-6,8). Спектр
1029.0 (P-O). Спектр ЯМР 1Н (CDCl3), δ, м. д.:
ЯМР 13C (CDCl3), δС, м. д.: 14.1 (ОСН2СН3), 14.2
0.91-1.01 [24Н, С(СН3)2], 1.45 м (12Н, РСН2СН3),
(ОСН2СН3), 22.7 (СCH3), 22.8 (СCH3), 24.0 (CH2),
1.70-1.89 м (8Н, РСН2СН3), 3.04 уш. с (4Н, СН2I),
33.86 д (РСН2, 1JСР = 136.1 Гц), 34.14 д (РСН2,
3.08 уш. с (4Н, СН2I), 3.65 уш. м (2Н, СН2О), 3.78
1JСР = 138.9 Гц), 36.2 д (СCH3, 3JСР = 6.7 Гц),
уш. м (4Н, СН2О), 3.88 уш. м (2Н, СН2О), 4.84 с (2H,
41.8 (СН2Br), 61.8 (ОСН2СН3), 61.9 (ОСН2СН3),
CH2), 7.34 д (2H, H3, 3JHH = 8.3 Гц), 7.68-7.75 м
72.2 д (ОСН2, 2JСР =6.7 Гц), 72.8 д (ОСН2, 2JСР =
(8H, H4-6,8). Спектр ЯМР 13C (CDCl3), δС, м. д.:
6.7 Гц), 114.6 (C8), 120.2 (C6), 125.4 (C3), 128.4 (C4),
6.7 (РСН2СН3), 6.8 (РСН2СН3), 18.4 (СН2I), 18.8
128.6 (C1), 129.2 (C5), 130.8 (C10), 134.0 (C9), 146.8
д (РСН2СН3, 1JСР = 140.9 Гц), 18.9 д (РСН2СН3,
д (C2, 2JРС = 6.7 Гц), 148.8 д (C7, 2JРС = 6.7 Гц), 165.1
1JСР = 140.9 Гц), 23.8 (СCH3), 24.0 (CH2), 35.1 д
(С=О). Спектр ЯМР 31Р (CDCl3), δР, м. д.: 17.12,
(СCH3, 3JСР = 6.7 Гц), 35.2 д (СCH3, 3JСР = 6.7 Гц),
18.29. Масс-спектр, m/z: 1528.8 [М]+, 1550.9 [М +
72.1 д (СН2О, 2JСР = 6.7 Гц), 72.8 д (СН2О, 2JСР =
Na]+. Найдено, %: C 44.52; H 5.30. C45H64Br4O12P4.
6.7 Гц), 114.3 (C8), 120.1 (C6), 125.1 (C3), 128.5 (C4),
Вычислено, %: C 44.78; H 5.27.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
АЛКИЛИРОВАНИЕ 1,3,2-ДИГЕТЕРОФОСФИНАНОВ
393
Алкилирование 2,2'-ди-1,3,2-диоксафосфин-
120.2 (С3), 124.3 (С8), 125.1 (С7), 125.8 д (С1, 2JСР =
анилдинафтилметана 3. а. Смесь 0.2 ммоль фос-
6.7 Гц), 126.9 (С6), 128.6 (С4), 128.8 (С5), 131.4 (С10),
фодинафтилметана 3 и 1 ммоль алкилирующего ре-
133.3 (С9), 146.3 д (C2, 2JСР = 8.6 Гц). Спектр ЯМР
агента (MeI, EtI) в 2 мл 1,2-дихлорбензола выдержи-
31Р (CDCl3): δР 29.33 м. д. Масс-спектр, m/z: 792
вали в микроволновом реакторе 30 мин при 100°С.
[М]+. Найдено, %: C 43.83; H 4.18. C29H32I2O6P2.
Продукты реакции (17* и 18; 19* и 20) выделяли с
Вычислено, %: C 43.96; H 4.07.
помощью колоночной хроматографии. В качестве
2,2'-Ди-(3-иодпропоксиметилфосфонато)-1,1-
элюента использовали смесь бензол:диоксан = 5:1.
динафтилметан (смесь изомеров) (17). Выход
После удаления растворителей остаток сушили в ва-
70% (метод б), 87% (метод в), бесцветное масло, Rf
кууме (1 мм рт. ст.) при 70-75°С.
0.2, 0.18. ИК спектр, ν, см-1: 1242.6 (Р=О), 1207.4
б. Смесь
0.2 ммоль фосфодинафтилметана
(Р=О), 1182.7 (Р-О), 1028.5 (Р-О). Спектр ЯМР 1Н
3 и 2 ммоль алкилирующего реагента (MeI, EtI,
(СDCl3), δ, м. д.: 1.30 д (3Н, РСН3, 1JРН = 17.4 Гц),
BrCH2COOEt) в 2 мл 1,2-дихлорбензола выдержи-
1.35 д (3Н, РСН3, 1JРН = 17.8 Гц), 1.95 м (4Н, СН2,
вали в микроволновом реакторе 30 мин при 100°С.
3JНН = 2.7, 3JНН = 6.4 Гц), 3.05 м (2Н, СН2I, 2JНН =
Для выделения соединений 17, 21 реакционные сме-
1.9, 3JНН = 5.1 Гц), 3.07 м (2Н, СН2I, 2JНН = 2.3,
си охлаждали до комнатной температуры и медлен-
3JНН = 5.0 Гц), 3.91 м (2Н, СН2О, 3JРН = 10.1, 3JНН =
но выливали в 50 мл охлажденного до 0°С гексана.
5.9 Гц), 4.02 м (2Н, СН2О, 3JРН = 9.2, 3JНН = 6.0 Гц),
Растворитель декантировали, остаток трижды про-
4.92 с (2Н, CH2), 7.40 м (4Н, Н6,7, 3JНН = 6.9, 3JНН =
мывали гексаном (5 мл) и сушили в вакууме (1 мм
7.8 Гц), 7.69 д (2Н, Н3, 3JНН = 8.7 Гц), 7.78 м (2Н,
рт. ст.) при 70-75°С. Соединения 19* и 20 выделяли
Н4,5, 3JНН = 6.4, 3JНН = 8.7 Гц), 8.10 д (2Н, Н8, 3JНН =
с помощью колоночной хроматографии, используя в
7.8 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.: 1.21
качестве элюента смесь бензол:диоксан = 5:1. После
(СН2I), 1.24 (СН2I), 11.2 д (РСН3, 1JСР = 144.7 Гц),
удаления растворителей остаток сушили в вакууме
11.3 д (РСН3, 1JСР = 144.7 Гц), 24.1 (CH2), 33.7 д
(1 мм рт. ст.) при 70-75°С.
(СH2, 3JСР = 5.7 Гц), 33.8 д (СH2, 3JСР = 5.7 Гц), 65.9
д (СН2О, 2JСР = 6.7 Гц), 66.0 д (СН2О, 2JСР = 6.7 Гц),
в. Смесь 0.2 ммоль фосфодинафтилметана 3 и
120.2 (С3), 124.3 (С8), 125.2 (С7), 125.8 (С1, 3JСР =
1 ммоль алкилирующего реагента (MeI, EtI) в 2 мл
6.7 Гц), 126.9 (С6), 128.6 (С4), 128.8 (С5), 131.4
диоксана выдерживали 1 (MeI) или 3 ч (EtI) при
100°С в микроволновом реакторе. Для выделения со-
(С10), 133.3 (С9), 146.40 д (C2, 2JСР = 8.6 Гц) 146.44 д
единений 17 реакционную смесь охлаждали до ком-
(C2, 2JСР = 8.6 Гц). Спектр ЯМР 31Р (CDCl3), δР, м. д.:
29.41, 29.36. Масс-спектр, m/z: 792 [М]+. Найдено,
натной температуры и медленно выливали в 50 мл
%: C 43.85; H 4.16. C29H32I2O6P2. Вычислено, %: C
охлажденного до 0°С гексана. Растворитель деканти-
43.96; H 4.07.
ровали, остаток трижды промывали гексаном (5 мл) и
сушили в вакууме (1 мм рт. ст.) при 70-75°С.
2,2'-Ди-(3-иодпропоксиэтилфосфонато)-1,1-
2,2'-Ди-(3-иодпропоксиметилфосфонато)-1,1-
динафтилметан (19*). Выход 19% (метод а), 38%
динафтилметан (17*). Выход 14% (метод а), бес-
(метод б), бесцветное масло, Rf 0.36. ИК спектр,
ν, см-1: 1264.6 (Р=О), 1210.4 (Р=О), 1182.7 (Р-О),
цветное масло, Rf 0.2. ИК спектр, ν, см-1: 1242.5
1060.2 (Р-О). Спектр ЯМР 1Н (СDCl3), δ, м. д.: 1.13
(Р=О), 1208.2 (Р=О), 1181.9 (Р-О), 1030.1 (Р-О).
м (6Н, РСН2СН3, 3JРН = 20.6, 3JНН = 7.8 Гц), 1.75
Спектр ЯМР 1Н (СDCl3), δ, м. д.: 1.31 д (6Н, РСН3,
2JРН = 17.9 Гц), 1.97 м (4Н, СН2, 3JНН = 2.1, 3JНН =
м (4Н, РСН2СН3, 2JРН = 18.3, 3JНН = 7.8 Гц), 1.98
6.4 Гц), 3.07 м (4Н, СН2I, 2JНН = 1.9, 3JНН = 6.9 Гц),
м (4Н, СН2, 3JНН = 8.3, 3JНН = 5.9 Гц), 3.04 м (4Н,
СН2I, 2JНН = 6.8, 3JНН = 7.4 Гц), 3.95 м (2Н, СН2О,
3.91 м (2Н, СН2О, 3JРН = 10.1, 3JНН = 6.4 Гц), 4.02 м
3JНН = 10.5, 2JНН = 6.4, 3JРН = 2.8 Гц), 4.07 м (2Н,
(2Н, СН2О, 3JРН = 10.6, 3JНН = 5.9 Гц), 4.92 с (2Н,
СН2О, 3JНН = 8.2, 2JНН = 6.4, 3JРН = 2.3 Гц), 4.94
CH2), 7.40 м (4Н, Н6,7, 3JНН = 9.1, 3JНН = 7.8 Гц),
7.69 м (4Н, Н3,4, 3JНН = 8.7 Гц), 7.79 д (2Н, Н5,
с (2Н, CH2), 7.36 м (4Н, Н3,6, 3JНН = 6.9, 3JНН =
3JНН = 9.2 Гц), 8.10 д (2Н, Н8, 3JНН = 7.4 Гц).
9.6 Гц), 7.77 м (4Н, Н4,7, 3JНН = 7.8, 3JНН = 9.6 Гц),
8.09 м (4Н, Н5,8, 3JНН = 6.9, 3JНН = 9.4 Гц). Спектр
Спектр ЯМР 13С (CDCl3), δС, м. д.: 1.2 (СН2I),
ЯМР 13С (CDCl3), δС, м. д.: 1.1 (СН2I), 6.7 д
11.5 д (РСН3, 1JСР = 144.7 Гц), 24.2 (CH2), 33.8 д
(РСН2СН3, 2JСР = 7.8 Гц), 19.2 д (РСН2СН3, 1JСР =
(СH2, 3JСР = 6.7 Гц), 65.9 д (СН2О, 2JСР = 6.7 Гц),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
394
СЕРКОВА и др.
142.8 Гц,), 23.9 (CH2), 34.0 д (CH2, 3JСР = 5.8 Гц),
129.2 (С5), 131.9 (С10), 132.9 (С9), 148.50 д (С2, 2JСР =
66.14 д (СН2О, 2JСР = 6.7 Гц), 120.2 (С3), 124.3 (С8),
10.6 Гц). Спектр ЯМР 31Р (CDCl3): δР 26.89 м. д.
125.1 (С6), 125.84 д (С1, 3JСР = 5.8 Гц), 126.8 (С7),
Масс-спектр, m/z: 363 [М]+. Найдено, %: C 73.73;
128.6 (С4), 128.7 (С5), 131.4 (С10), 133.4 (С9), 146.3
H 4.98. C22H17O3P. Вычислено, %: C 73.33; H 4.76.
д (C2, 2JСР = 9.6 Гц). Спектр ЯМР 31Р (CDCl3): δР
8-Этил-16H-динафто[2,1-d:1',2'-g][1,3,2]ди-
32.52 м. д. Масс-спектр, m/z: 820 [М]+. Найдено,
оксафосфоцин-8-оксид (20). Выход 19% (метод
%: C 45.53; H 4.38. C31H36I2O6P2. Вычислено, %:
а), 13% (метод б), 45% (метод в), белый поро-
C 45.39; H 4.42.
шок, т. пл. 183-185°С, Rf 0.49. ИК спектр, ν, см-1:
2,2'-Ди-(3-иодпропоксиэтилацетато-
1264.6 (Р=О), 1211.2 (Р=О), 1161.3 (Р-О), 1059.8
фосфонато)-1,1-динафтилметан (смесь изоме-
(Р-О). Спектр ЯМР 1Н (СDCl3), δ, м. д.: 1.45 м (6Н,
ров) (21). Выход 75% (метод б), бесцветное мас-
РСН2СН3, 3JНН = 7.8, 2JРН = 21.5 Гц), 2.21 м (4Н,
ло, Rf 0.36, 0.32. ИК спектр, ν, см-1: 1731.7 (С=О),
СН2СН3, 3JНН = 7.8, 2JРН = 18.8 Гц), 5.02 д. д (2H,
1261.9 (Р=О), 1203.1 (Р=О), 1112.5 (Р-О). Спектр
CH2, 3JНН = 16.0 Гц), 7.20 д (2H, Н3, 3JНН = 8.7 Гц),
ЯМР 1Н (СDCl3), δ, м. д.: 1.17 т (3Н, ОСН2СН3, 3JНН =
7.45 д. д (2H, Н6/7, 3JНН = 7.3, 3JНН = 7.3 Гц), 7.55
6.9 Гц), 1.18 т (3Н, ОСН2СН3, 3JНН = 6.2 Гц), 2.06
д. д (2Н, Н6/7, 3JНН = 7.3, 3JНН = 6.9 Гц), 7.75 д (2Н,
уш. с (4Н, СН2), 2.90 м (4Н, РСН2, 2JНН = 10.8, 2JРН =
Н4, 3JНН = 9.2 Гц), 7.84 д (2Н, Н5, 3JНН = 7.8 Гц),
15.6 Гц), 3.33 м (4Н, ОСН2СН3, 3JНН = 6.2 Гц), 4.08
8.26 д (2H, Н8, 3JНН = 8.7 Гц). Спектр ЯМР 13С
м (6Н, СН2О, СН2Br, 3JРН = 12.4, 3JНН = 5.5 Гц), 4.24
(CDCl3), δС, м. д.: 6.6 д (РСН2СН3, 2JСР = 7.7 Гц),
м (2Н, СН2О, 3JРН = 11.4, 3JНН = 5.9 Гц), 4.95 с (2Н,
19.9 д (РСН2СН3, 1JСР = 142.8 Гц), 24.3 (CH2), 120.3
CH2), 7.38 м (4H, Н3,6, 3JНН = 6.9 Гц), 7.74 м (6Н,
д (С3, 3JСР = 4.8 Гц), 123.6 (С8), 124.3 д (С1, 3JСР =
Н4,5,7, 3JНН = 8.2, 3JНН = 9.6 Гц), 8.06 уш. д (2Н,
4.8 Гц), 125.3 (С6/7), 127.4 (С6/7), 129.0 (С4), 129.2
Н8, 3JНН = 8.1 Гц). Спектр ЯМР 13С (CDCl3), δС,
(С5), 131.8 (С10), 132.9 (С9), 148.7 д (С2, 2JСР =
м. д.: 14.1 (СН2СН3), 23.8 (CH2), 28.8 (СН2СН3), 28.9
11.5 Гц). Спектр ЯМР 31Р (CDCl3): δР 29.68 м. д.
(СН2СН3), 33.2 д (СН2, 3JСР = 6.7 Гц), 34.7 д (РСН2,
Масс-спектр, m/z: 375 [М]+. Найдено, %: C 73.75;
1JСР = 138.0 Гц), 62.0 (CH2Br), 65.4 д (СН2О, 2JСР =
H 4.98. C22H17O3P. Вычислено, %: C 73.79; H 5.12.
6.7 Гц), 65.4 д (СН2О, 2JСР = 5.8 Гц), 120.1 (С3),
Фосфоциклизация
2,2'-ди-(3-иодпропокси-
124.3 (С8), 125.3 (С6), 126.05 д (С1, 3JСР = 4.8 Гц),
метилфосфонато)-1,1-динафтилметана
17.
126.9 (С7), 128.8 (С4), 128.8 (С5), 131.1 (С10), 133.3
Раствор 0.34 ммоль фосфодинафтилметана 17 в 2 мл
(С9), 146.0 д (C2, 2JСР = 8.6 Гц), 165.1 д (С=О, 2JСР =
1,2-дихлорбензола выдерживали в микроволновом
4.8 Гц), 165.2 д (С=О, 3JСР = 4.8 Гц). Спектр ЯМР
реакторе 2 ч при 100°С, затем реакционную смесь
31Р (CDCl3), δР, м. д.: 18.62, 18.53. Масс-спектр,
охлаждали до комнатной температуры и разделяли
m/z: 843 [M]+, 865 [М + Na]+. Найдено, %: C 49.53;
с помощью колоночной хроматографии. В качестве
H 4.38. C35H40Br2O10P2. Вычислено, %: C 49.90; H
элюента использовали смесь бензол:диоксан = 5:1.
4.79.
После удаления растворителя соединение 18 сушили
8-Метил-16H-динафто[2,1-d:1',2'-g][1,3,2]ди-
в вакууме (1 мм рт. ст.) при 70–75°С. Выход 64%, бе-
оксафосфоцин-8-оксид (18). Выход 25% (метод
лый порошок, т. пл. 188-190°С, Rf 0.45. Спектр ЯМР
а), белый порошок, т. пл. 188-190°С, Rf 0.45. ИК
31Р (CDCl3): δР 26.89 м. д.
спектр, ν, см-1: 1263.0 (Р=О), 1210.8 (Р=О), 1059.3
2,2',7,7'-Тетра-(3-иодпропоксиметил-
(Р-О). Спектр ЯМР 1Н (СDCl3), δ, м. д.: 1.94 д (3Н,
фосфонато)-1,1-динафтилметан
(22).
Смесь
РСН3, 2JРН = 17.9 Гц), 4.92 д. д (2H, CH2, 2JНН =
0.121 ммоль фосфодинафтилметана 4 и 2.43 ммоль
16.0 Гц), 7.21 д (2H, Н3, 3JНН = 8.7 Гц), 7.45 д. д
иодистого метила в 2 мл диоксана выдерживали в
(2H, Н6/7, 3JНН = 6.9, 3JНН = 7.8 Гц), 7.55 д. д (2Н,
микроволновом реакторе при 85°С 1.5 ч, затем ре-
Н6/7, 3JНН = 7.8, 3JНН = 6.9 Гц), 7.55 д (2Н, Н4,
акционную смесь частично упаривали и медлен-
3JНН = 8.7 Гц), 7.4 д (2Н, Н5, 3JНН = 8.3 Гц), 8.25 д
но выливали в 20 мл охлажденного до 0°С гексана.
(2H, Н8, 3JНН = 8.2 Гц). Спектр ЯМР 13С (CDCl3),
Гексан декантировали, масляный слой промывали
δС, м. д.: 12.7 д (РСН3, 1JСР = 146.6 Гц), 24.3 (CH2),
холодным гексаном (3×5 мл) и сушили в вакууме
120.4 д (С3, 3JСР = 4.8 Гц), 123.6 (С8), 124.3 д (С1,
(1 мм рт. ст.) при 70-75°С. Выход 74%, масло, Rf
3JСР = 4.8 Гц), 125.4 (С6/7), 127.5 (С6/7), 129.1 (С4),
0.28, 0.46 (бензол:диоксан = 3:2). ИК спектр, ν, см-1:
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
АЛКИЛИРОВАНИЕ 1,3,2-ДИГЕТЕРОФОСФИНАНОВ
395
1255.9 (P=O), 1207.6 (P=O), 1037.7 (P-O). Спектр
46.92; H 5.27; N 6.59. C33H44O2P2N4I2. Вычислено,
ЯМР 1Н (СDCl3), δ, м. д.: 1.39 д (3Н, РСН3, 2JРН =
%: С 46.93; Н 5.25; N 6.63.
17.9 Гц), 1.45 д (3Н, РСН3, 2JРН = 17.4 Гц), 1.47 д
б. К раствору 0.094 ммоль фосфодинафтилме-
(3Н, РСН3, 2JРН = 17.4 Гц), 1.50 д (3Н, РСН3, 2JРН =
тана 5 в 1 мл растворителя (CHCl3, 1,2-дихлор-
17.4 Гц), 1.99 уш. м (8Н, СН2), 3.05 м (4Н, СН2I,
бензол) добавляли 1.97 ммоль иодистого метила
3JНН = 5.9 Гц), 3.11 м (4Н, СН2I, 3JНН = 5.5 Гц), 3.90
и выдерживали полученную смесь при 50-55°С
уш. м (2Н, СН2О), 4.06 уш. м (4Н, СН2О), 4.31 уш. м
30 ч. Осадок отфильтровывали и промывали
(2Н, СН2О), 4.84 с (2Н, CH2), 7.27 д (2Н, Н3, 3JНН =
растворителем. Остаток сушили в вакууме
(1
8.7 Гц), 7.61 д (2Н, H4, 3JHH = 8.7 Гц), 7.68 д (2Н, Н6,
мм рт. ст.) при 75°С. Выход 80% (CHCl3), 55%
3JHH = 7.4 Гц), 7.76 уш. д (4Н, H5,8, 3JHH = 8.7 Гц).
(1,2-дихлорбензол).
Спектр ЯМР 13С (CDCl3), δС, м. д.: 1.3 (СН2I), 1.4
2,2',7,7'-Тетра-(2-метил-N,N'-диметил-1,3,2-
(СН2I), 11.1 д (РСН3, 1JСР = 142.8 Гц), 11.2 д (РСН3,
диазафосфинанил)динафтилметантетраиодид
1JСР = 143.8 Гц), 11.3 д (РСН3, 1JСР = 144.7 Гц), 11.4 д
(24). К раствору 0.086 ммоль фосфодинафтилме-
(РСН3, 1JСР = 143.8 Гц), 24.2 (CH2), 33.8 (CH2), 33.9
тана 6 в 1 мл растворителя (CHCl3, C6H6) добав-
(CH2), 65.7 д (СН2О, 2JСР = 5.8 Гц), 66.2 д (ОСН2,
ляли 1.72 ммоль иодистого метила. Реакционную
2JСР = 5.8 Гц), 114.3 (C8), 119.8 (C6), 120.0 (C3),
смесь перемешивали в течение 8 (CHCl3) или
125.1 (C1), 128.6 (С4), 129.1 (C5), 130.9 (C10), 134.1
15 сут (C6H6) при 20-25°С. Осадок отфильтровы-
(C9), 147.2 д (C2, 2JСР = 7.7 Гц), 149.1 д (C7, 2JСР =
вали и сушили в вакууме (1 мм рт. ст.) при 75°С.
8.6 Гц). Спектр ЯМР 31Р (CDCl3), δР, м. д.: 29.57,
Выход 60% (CHCl3), 85% (C6H6), белый порошок,
29.49, 29.41, 29.30 м. д. Масс-спектр, m/z: 1316
т. пл. 215-217°С. Спектр ЯМР 1Н (ДМСО-d6), δ,
[М]+. Найдено, %: C 33.91; H 3.98. C37H48I4O12P4.
м. д.: 1.71 уш. м (4Н, CH2), 1.86 уш. м (4Н, СН2),
Вычислено, %: C 33.76; H 3.68.
2.23 д (6Н, РCH3, 2JРН = 22.0 Гц), 2.29 д (6Н, РCH3,
2JРН = 21.9 Гц), 2.30 д (6Н, РCH3, 2JРН = 22.3 Гц),
2,2'-Ди-(2-метил-N,N'-диметил-1,3,2-
2.35 д (6Н, РCH3, 2JРН = 22.2 Гц), 2.45 д (6Н, NCH3,
диазафосфинанил)динафтилметандииодид (23).
3JРН = 10.5 Гц), 2.46 д (6Н, NCH3, 3JРН = 11.0 Гц),
а. К раствору 0.09 ммоль фосфодинафтилметана
2.65 уш. м (8Н, NCH2), 2.75 уш. м. (8Н, NCH2),
5 в 1 мл растворителя (CHCl3, 1,2-дихлорбензол,
2.87 уш. м (8Н, NCH2), 3.06 уш. м (8Н, NCH2),
C6H6) добавляли 0.9 ммоль иодистого метила и
4.78 с (2Н, CH2), 7.35 уш. м (2Н, H6, 3JНН = 8.7 Гц),
выдерживали полученную смесь при
20-25°С
7.77 уш. м (2Н, Н3, 3JНН = 8.2 Гц), 8.13 уш. м (4Н,
8 (CHCl3) или 15 сут (1,2-дихлорбензол, C6H6).
Н4,5, 3JНН = 8.6 Гц), 8.24 уш. с (2Н, Н8). Спектр
Осадок отфильтровывали и промывали раствори-
ЯМР 13С (ДМСО-d6), δС, м. д.: 9.2 д (РСН3, 1JСР =
телем. Остаток сушили в вакууме (1 мм рт. ст.) при
139.8 Гц), 10.9 д (РСН3, 1JСР = 138.9 Гц), 22.8
75°С. Выход 82% (CHCl3), 57%, (1,2-дихлорбен-
(СH2), 24.5 (СН2), 24.6 (CH2), 33.1 (NCH3), 35.6
зол), 94% (C6H6), белый порошок, т. пл 160-162°С.
(NCH2), 45.9 (NCH3), 49.3 (NCH2), 52.9 (NCH2),
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 1.64 уш. м
115.7 (С3), 119.2 (С8), 120.8 (С6), 126.3 (С1), 128.8
(2Н, CH2), 1.86 уш. м (2Н, CH2), 2.35 д (6Н, РCH3,
(С4), 129.2 (С5), 130.0 (С10), 133.9 (С9), 147.1 (С2),
2JРН = 16.9 Гц), 2.78 д (12Н, NCH3, 3JРН = 11.0 Гц),
147.7 (С7). Спектр ЯМР 31Р (ДМСО-d6), δР, м. д.:
3.14 уш. м (4Н, NCH2), 3.25 уш. м (4Н, NCH2), 4.97
51.48,
51.62,
52.29,
52.47. Масс-спектр, m/z:
c (2Н, CH2), 7.31 д (2Н, H3, 3JНН = 9.2 Гц), 7.44 м
1423 [M]+. Найдено, %: С 38.10; H 5.15; N 7.92.
(4Н, Н6,7, 3JНН = 9.2, 3JНН = 6.4 Гц), 7.95 м (4Н, Н4,5,
C45H72O4P4N8I4. Вычислено, %: С 38.05; Н 5.11; N
3JНН = 9.2, 3JНН = 6.4 Гц), 8.04 д (2Н, Н8, J = 9.6 Гц).
7.89.
Спектр ЯМР 13С (ДМСО-d6), δС, м. д.: 9.9 д (РСН3,
ФОНДОВАЯ ПОДДЕРЖКА
1JСР = 127.5 Гц), 23.7 (СH2), 24.6 д (CH2, 2JСР = 5.8
Работа выполнена при финансовой поддержке
Гц), 35.4 д (NCH3, 2JСР = 5.7 Гц), 49.7 (NCH2), 118.8
Российского фонда фундаментальных исследова-
д (С3, 3JСР = 3.8 Гц), 124.8 (С8), 126.5 (С6/7), 126.9
ний (проект 18-03-00347a).
(С1, 3JСР= 5.8 Гц), 127.9 (С6/7), 129.4 (С5), 130.3
КОНФЛИКТ ИНТЕРЕСОВ
(С4), 131.8 (С10), 133.1 (С9), 144.80 д (С2, 2JСР =
11.5 Гц). Спектр ЯМР 31Р (ДМСО-d6): δР 50.38 м. д.
Авторы заявляют об отсутствии конфликта ин-
Масс-спектр, m/z: 717 [M - I]+. Найдено, %: С
тересов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
396
СЕРКОВА и др.
СПИСОК ЛИТЕРАТУРЫ
16.
Sing G. // J. Org. Chem. 1979. Vol. 44. P. 1060. doi
10.1021/jo01321a007
1.
Pinalli R., Pedrini A., Dalcanale E. // Chem. Soc. Rev.
17.
Denmark S.E., Kim J.-H. // J. Org. Chem. 1995. Vol. 60.
2018. Vol. 47. P. 7006. doi 10.1039/C8CS00271A
P. 7535. doi 10.1021/jo00128a028
2.
Jie K., Zhou Y., Yao Y., Huang F. // Chem. Soc. Rev.
18.
Denmark S.E., Chien-Tien Chen // J. Org. Chem. 1994.
2015. Vol. 44. P. 3568. doi 10.1039/C4CS00390J
Vol. 59. P. 2922. doi 10.1021/jo00090a004
3.
Raynal М., Ballester P., Vidal-Ferrana A., van Leeu-
19.
Afarinkia K., Binch H.M., De Pascale. E. // Synlett.
wen P. W. N. M. // Chem. Soc. Rev. 2014. Vol. 43.
2000. Vol. 12. P. 1769. doi 10.1055/s-2000-8695
P. 1734. doi 10.1039/C3CS60037H
20.
Afarinkia K., De Pascale E. // Synlett. 2002. Vol. 6.
4.
Deraedt C., Astruc D. // Coord. Chem. Rev. 2016.
P. 990. doi 10.1055/s-2002-31895
Vol. 324. P. 106. doi doi 10.1016/j.ccr.2016.07.007
21.
Shipov A.E., Genkina G.K., Petrovskii P.V., Lyssen-
5.
Gokel G.W., Negin S. // Adv. Drug Del. Rev. 2012.
ko K.A., Mastryukova T.A. // Phosphorus, Sulfur,
Vol. 64. P. 784. doi 10.1016/j.addr.2012.01.011
Silicon, Relat. Elem. 2008. Vol. 183. P. 646. doi
6.
Leoncini A., Huskens J., Verboom W. // Chem. Soc. Rev.
10.1080/10426500701795910
2017. Vol. 46. P. 7229. doi 10.1039/C7CS00574A
22.
Shipov A.E., Genkina, G.K., Petrovskii P.V.,
7.
Burilov V.A., Mironova D.A., Ibragimova R.R., So-
Goryunov E.I., Makarov M.V. // Phosphorus, Sulfur,
lovieva S.E., Konig B., Antipin I.S. // RSC Adv.
Silicon, Relat. Elem. 2011. Vol. 186. P. 945. doi
2015. Vol. 5. P. 101177. doi 10.1039/C5RA18294H
10.1080/10426507.2010.520281
8.
Hooley R.J., Rebek J., Jr. // Chemistry&Biology. 2009.
23.
Serkova O.S., Glushko V.V., Egorova M.A., Maslen-
Vol. 16. P. 255. doi 10.1016/j.chembiol.2008.09.015
nikova V.I. // Tetrahedron Lett. 2018. Vol. 59. P. 2586.
doi 10.1016/j.tetlet.2018.05.062
9.
Sémeril D., Matt D. // Coord. Chem. Rev. 2014.
Vol. 279. P. 58. doi 10.1016/j.ccr.2014.06.019
24.
Maslennikova V.I., Sotova T. Yu., Vasyanina L.K.,
Lyssenko K.A., Antipin M.Yu., Adamson S.O., Demen-
10.
Cherenok S., Kalchenko V. // Top Heterocycl. Chem.
tyev A.I., Habicher W.D., Nifantyev E.E. // Tetrahedron.
2009. Vol. 20. P. 229. doi 10.1007/7081_2008_12
2007. Vol. 63. P. 4162. doi 10.1016/j.tet.2007.02.095
11.
Nifantiev E.E., Maslennikova V.I., Merkulov R.V. //
25.
Баталова Т.А., Расадкина Е.Н., Васянина Л.К.,
Acc. Chem. Res. 2005. Vol. 38. P. 108. doi 10.1021/
Бельский В.К., Нифантьев Э.Е. // ЖОХ. 1997. Т. 67.
ar0401810
С. 1497; Batalova T.A., Rasadkina E.N., Vasyani-
12.
Антипин И.С., Казакова Э.Х., Хабихер В.Д., Конова-
na L.K., Belsky V.K., Nifantyev E.E. // Russ. J. Gen.
лов А.И. // Усп. хим. 1998. Т. 67. № 11. С. 995; Anti-
Chem. 1997. Vol. 67. P. 1406.
pin I.S., Kazakova E.Kh., Habicher W.D., Konovalov
26.
Kasthuraiah M., Ravi Sankar A.U., Kumar B.S.,
A.I. // Russ. Chem. Rev. 1998. Vol. 67. N. 11. P. 905. doi
Reddy C.S., Raju C.N. // S. Afr. J. Chem. 2007.
10.1070/RC1998v067n11ABEH000472
Vol. 60. P. 62.
13.
Bhatacharya A.K., Thyagarman G. // Сhem. Rev. 1981.
27.
Wolff W. // Chem. Ber. 1893. Vol. 26. P. 85. doi 10.1002/
Vol. 81. P. 415. doi 10.1021/cr00044a004
cber.18930260118
14.
Babu B.H., Prasad G.S., Raju C.N., Raoe M.V.B. // Curr.
28.
Нифантьев Э.Е., Сорокина С.Ф., Борисенко А.А. //
Org. Synth. 2017. Vol. 14. N 6. P. 883. doi 10.2174/157
ЖОХ. 1985. Т. 55. C. 1665.
0179414666161230144455
29.
Нифантьев Э.Е., Завалишина А.И., Сорокина С.Ф.,
15.
Maier L. // Syn. React. Inorg. Metal-Org. Chem. 1976.
Борисенко А.А., Смирнова Е.И., Курочкин В.В., Мо-
Vol. 6. N 2. P. 133. doi 10.1080/00945717608057350
исеева Л.И. // ЖОХ. 1979. Т. 49. С. 64.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
АЛКИЛИРОВАНИЕ 1,3,2-ДИГЕТЕРОФОСФИНАНОВ
397
Alkylation of 1,3,2-Diheterophosphinanes Conjugated
with Dinaphthylmethanes
O. S. Serkova, V. V. Glushko, M. R. Guseinova, and V. I. Maslennikova*
Institute of Biology and Chemistry, Moscow Pedagogical State University, Moscow, 129164 Russia
*e-mail: vi.maslennikova@mpgu.su
Received September 14, 2019; revised September 14, 2019; accepted September 18, 2019.
The alkylation reactions of 2,2’-di- and 2,2’,7,7’-tetra-(1,3,2-diheterophosphinanyl)dinaphthylmethanes with
alkyl (arylalkyl) halides and bromoethyl acetate were studied. The factors affecting the chemoselectivity of the
reaction and the yield of final products were revealed.
Keywords: 1,3,2-diheterophosphinanes, phosphodinaphthylmethanes, alkylation, Michaelis-Arbuzov reaction,
phosphonates, quasiphosphonium salts
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020