ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 3, с. 398-402
УДК 547.496.2;539.26
СИНТЕЗ И КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА
ДИКАЛИЕВЫХ СОЛЕЙ
N-АЛКИЛ-N-{[О-АЛКОКСИ(ГИДРОКСИ)ФОСФОРИЛ]-
МЕТИЛ}ДИТИОКАРБАМИНОВЫХ КИСЛОТ
© 2020 г. И. И. Мирзаяновa,*, А. Р. Гарифзяновa, Д. Р. Исламовb, В. Г. Штырлинa
a Химический институт имени А. М. Бутлерова Казанского федерального университета,
ул. Кремлевская 18, Казань, 420008 Россия
b Институт органической и физической химии имени А. Е. Арбузова, Федеральный исследовательский центр
«Казанский научный центр Российской академии наук», Казань, 420088 Россия
*e-mail: ildar4016@mail.ru
Поступило в Редакцию 31 июля 2019 г.
После доработки 31 июля 2019 г.
Принято к печати 6 августа 2019 г.
Разработана однореакторная методика получения дикалиевых солей N-алкил-N-{[О-алкокси(гидрокси)-
фосфорил]метил}дитиокарбаминовых кислот. Синтезированы и выделены в индивидуальном виде
дикалиевые соли N-изопропил-, N-бутил- и N-циклогексил-N-{[гидрокси(О-этокси)фосфорил]метил}-
дитиокарбаминовых кислот и N-{[О-бутокси(гидрокси)фосфорил]метил}-N-(2-метоксиэтил)дитиокарба-
миновой кислоты. Для последнего соединения установлена кристаллическая и молекулярная структура.
Ключевые слова: дитиокарбаматы, аминофосфоновые кислоты, кристаллическая структура
DOI: 10.31857/S0044460X20030084
Соединения с дитиокарбаматной группой
фоновой кислоты 3а в среде водного этанола в
NC(S)SH в молекуле широко используются в ана-
присутствии эквимольного количества гидроксида
литической химии как реагенты для экстракцион-
калия на холоду реагирует с сероуглеродом и с вы-
ного разделения и фотометрического определения
соким выходом образует соль 4а.
халькофильных элементов, а также в качестве
Так как аминофосфоновые кислоты коммерче-
вулканизаторов каучука, инсектофунгицидов [1].
ски недоступны, более рационально синтезиро-
Комплексы дитиокарбаматов природных амино-
вать соединения 4 четырехстадийным способом
кислот с катионами Mn(II), Cu(II), Fe(II), Au(III),
из первичных аминов, параформальдегида, диал-
Sn(IV), Pd(II) проявляют канцеростатические и
килфосфита и сероуглерода без выделения интер-
бактерицидные свойства, а также используются
медиатов 1-3 (схема 1). Тщательное соблюдение
при исследовании биохимических процессов с
стехиометрических соотношений, температурных
участием оксида азота [2-8].
режимов, контроль полноты протекания отдель-
Из соответствующих аминов и диалкилфосфи-
ных стадий по данным ЯМР 31Р позволяет полу-
тов через интермедиаты 1-3 нами синтезированы
чать неочищенные продукты реакции 4 с выходом
фосфорорганические производные дитиокарбама-
более 92%. Потери при перекристаллизации не
тов - дикалия алкил{[N-алкил-N-(карбодитиоато)-
превышают 20%.
амино]метил}фосфонаты 4а-г с целью исследова-
Синтезированные соли 4a-г представляют со-
ния их комплексообразующих свойств [9].
бой белые кристаллические вещества, хорошо
Предварительно было установлено, что кали-
растворимые в воде, метаноле, этаноле. С катио-
евая соль [(изопропиламино)метил](O-этил)фос-
нами меди(II) они образуют окрашенные водорас-
398
СИНТЕЗ И КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА ДИКАЛИЕВЫХ СОЛЕЙ
399
Схема 1.
R1
CH2O,
толуол
O
45-110°C
N
(R2O)2P(O)H
OR2
R1
NH2
NH
P
−H
2O
N N
R1
R1
R1
OR2
1а-г
2а-г
CS2
R1
O
O
KOH
KOH
O-K+
O-K+
80°C
10°C
+K-S
N
P
NH
P
–R2OH
C
R1
2
OR
OR2
S
3а-г
4а-г
R2 = Et, R1 = i-Pr (a), Bu (б), cyclo-Hex (в); R1 = CH2CH2OMe, R2 = Bu (г).
творимые координационные соединения [CuL2]2-,
Ранее подобные структуры комплексов ио-
в электронных спектрах поглощения которых на-
нов K+, Rb+ и Cs+ с анионом N-карбодитиоато-L-
блюдается интенсивная полоса переноса заряда
пролина были охарактеризованы методом РСА в
(λ = 436 нм, lgε = 4.10 для комплекса с соединени-
работе [10].
ем 4б).
Таким образом, предложенная нами однореак-
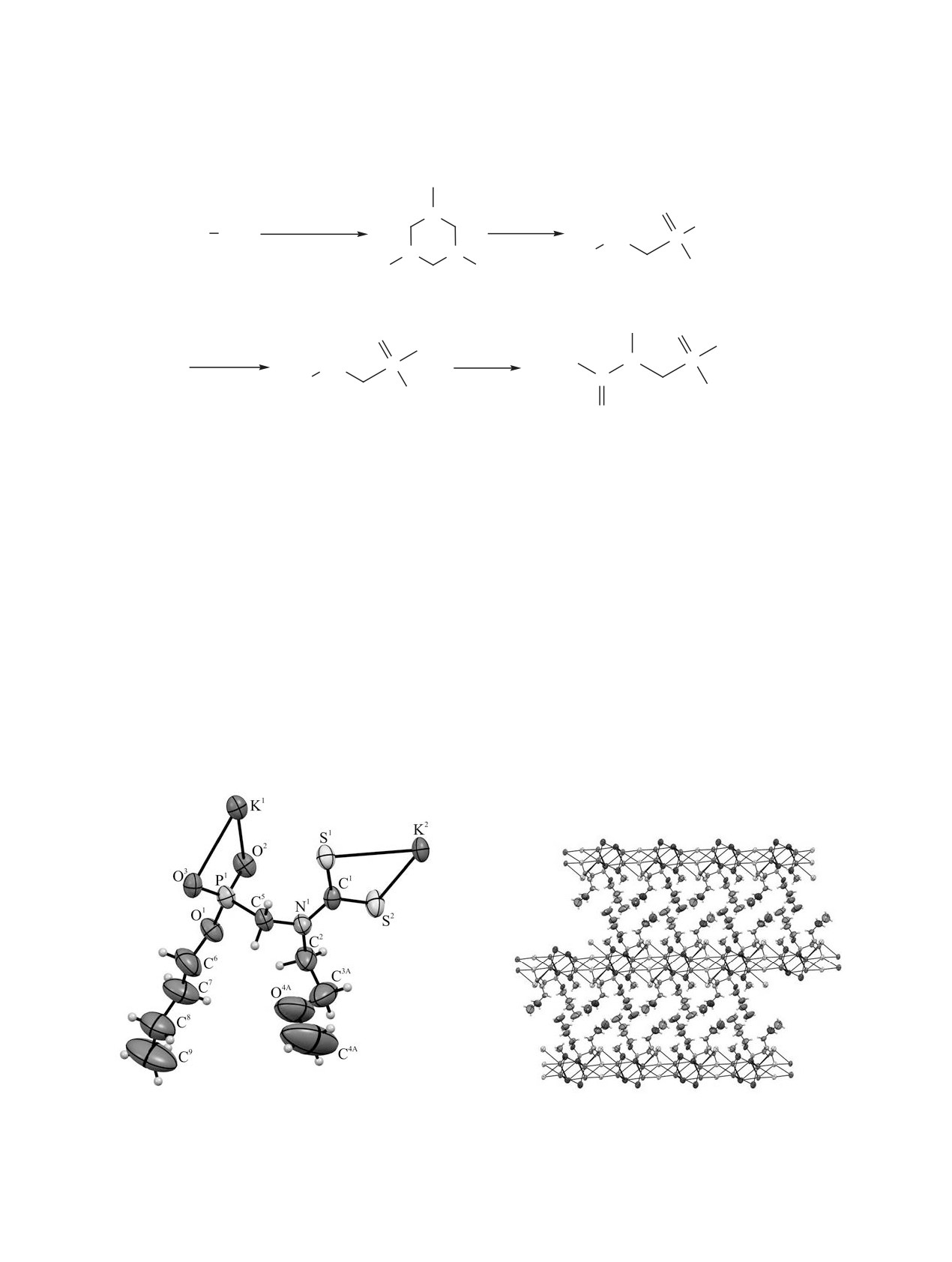
Структура соединения 4г в кристалле была
торная методика синтеза позволяет получать ней-
установлена методом рентгеноструктурного ана-
тральные соли N-алкил-N-{[О-алкокси(гидрокси)-
лиза (рис. 1, 2). Кристаллическая упаковка сое-
фосфорил]метил}дитиокарбаминовых кислот из
динения 4г представляет собой слои (0bc), обра-
доступных исходных реагентов. Комплексы ме-
зованные ионными взаимодействиями. Слои свя-
заны между собой взаимодействиями С-H∙∙∙H-С.
ди(II) с подобными лигандами - предмет наших
Метоксигруппа разупорядочена по двум положе-
дальнейших исследований, включая оценку их
ниям и уточнена с заселенностями 0.84 и 0.16.
противоопухолевой активности.
Рис. 1. Общий вид молекулы соединения 4г в кри-
Рис. 2. Фрагмент кристаллической упаковки соедине-
сталле.
ния 4г (вид вдоль оси b).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
400
МИРЗАЯНОВ и др.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(диоксан-этанол). Спектр ЯМР 1H (D2O), δ, м. д.
= 6.9 Гц), 0.93 м
(J, Гц): 0.91 д (6H, CH3CH, 3JHH
Спектры ЯМР 1H и 13С и 31P зарегистрирова-
(3H, CH3CH2O), 3.67 д. т (2H, OCH2CH3, 3JHP =
ны на приборе Bruker AVANCE III 400 с рабочими
14.0, 3JHH = 7.1 Гц), 4.14 д (2H, PCH2N, 2JHP =
частотами 400, 100 и 162 МГц соответственно в
13.4 Гц), 5.53 септет (1H, CH3CH, 3JHH = 6.7 Гц).
дейтероацетонитриле CD3CN и дейтерированной
Спектр ЯМР 13С{1H} (D2O), δС, м. д. (J, Гц): 16.0 д
воде D2O. Рентгеноструктурное исследование
(СH3CH2O, 3JCP = 6.3 Гц), 19.2 (СH3CH), 46.3 д
кристалла C10H20K2NO5PS2 4г проведено на диф-
(PCH2N, 1JCP = 148.7 Гц), 55.0 (CH3СH), 60.9 д
рактометре Bruker Kappa APEX II c рентгеновским
(POCH2, 2JCP = 5.9 Гц), 208.9 (CSSK). Спектр ЯМР
излучением MoKα (λ = 0.71073 Å) при 296(2) K.
31Р{1H} (D2O): δР 18.3 м. д. Найдено K, %: 23.53.
Использовали программы APEX3 [11], SAINT
C7H14K2NO3PS2. Вычислено K, %: 23.45.
[12], SADABS (учет поглощения) [13], SHELXT
Дикалия этил{[бутил(карбодитиоато)ами-
(расшифровка структуры) [14]; структуру уточня-
но]метил}фосфонат (4б). Выход 26.76 г (77%),
ли методом наименьших квадратов SHELXL [15] в
белое кристаллическое вещество, т. разл. 195°С
пакете программ Olex2 [16].
(диоксан-этанол). Спектр ЯМР 1H (D2O), δ, м. д.
Дикалиевые соли N-алкил-N-{[О-алкокси-
(J, Гц): 0.83 т (3H, CH3CH2CH2, 3JHH = 7.4 Гц),
(гидрокси)фосфорил]метил}дитиокарбамино-
1.15 т (3H, CH3CH2O, 3JHH = 7.1 Гц), 1.18-1.27 м
вых кислот. Смесь 0.1 моль соответствующего
(2H, CH3CH2CH2), 1.56-1.64 м (2H, CH3CH2CH2),
первичного амина и 3.06 г (0.102 моль) парафор-
3.83-3.90 м (2H, OCH2CH3), 4.09 т (2H, CH2CH2N,
мальдегида в 50 мл смеси толуол-гексан (5:1)
3JHH = 7.1 Гц), 4.53 д (2H, PCH2N, 2JHP = 12.3 Гц).
перемешивали при 50°C 1 ч до растворения пара-
Спектр ЯМР 13С{1H} (D2O), δС, м. д. (J, Гц): 13.2
формальдегида, затем кипятили с насадкой Дина-
(СH3CH2CH2), 16.2 д (СH3CH2O, 3JCP = 5.8 Гц),
Старка до прекращения выделения воды (1.8 мл).
19.5 (CH3СH2CH2), 27.5 (CH3CH2СH2), 59.3 д
К полученному раствору триазинана 1 добавляли
(PCH2N, 1JCP = 144.6 Гц), 53.7 (CH2СH2N), 61.6 д
0.1 моль соответствующего диалкилфосфита и
(OСH2CH3, 2JCP = 5.7 Гц), 208.9 (CSSK). Спектр
кипятили смесь до исчезновения в спектре ЯМР
ЯМР 31Р{1H} (D2O): δР 17.5 м. д. Найдено K, %:
31Р реакционной смеси сигнала диалкилфосфита
22.41. C8H16K2NO3PS2. Вычислено K, %: 22.50.
в области 7 м. д. Растворитель удаляли в вакууме,
Дикалия этил{[(карбодитиоато)циклогек-
полученный алкиламинометилфосфонат 2 раство-
силамино]метил}фосфонат (4в). Выход 31.37 г
ряли в 20 мл этанола, добавляли 6.0 г гидроксида
(84%), белое кристаллическое вещество, т. разл.
калия, 2 мл воды и кипятили 4 ч до завершения
213°С (этанол). Спектр ЯМР 1H (D2O), δ, м. д. (J,
реакции гидролиза (исчезновение в спектре ЯМР
Гц): 0.78-1.06 м (5H, CHaHe), 0.92 т (3H, CH3CH2O,
31Р сигнала алкиламинометилфосфоната 2 при 18-
3JHH = 7.1 Гц), 1.16-1.58 м (5H, CHaHe), 3.65 д. т
20 м. д.), затем удаляли этанол в вакууме. Смесь
(2H, OCH2CH3, 3JHP = 14.2, 3JHH = 7.0 Гц), 4.17 д
охлаждали с помощью ледяной бани, добавляли
(2H, PCH2N, 2JHP = 10.8 Гц), 5.14 м (1H, cyclo-
6.0 г KOH, 40 мл воды, при температуре не выше
C1H). Спектр ЯМР 13С{1H} (D2O), δС, м. д. (J, Гц):
10°C и перемешивании в течение 1 ч, затем добав-
16.1 д (СH3CH2O, 3JCP = 6.1 Гц), 25.0 (cyclo-C2H2,
ляли 6.54 мл (0.11 моль) свежеперегнанного серо-
cyclo-C6H2), 25.5 (cyclo-C3H2, cyclo-C5H2),
29.9
углерода и перемешивали еще 4 ч при комнатной
(cyclo-C4H2), 47.2 д (PCH2N, 1JCP = 148.4 Гц), 60.9 д
температуре. Воду и легколетучие вещества уда-
(POCH2, 2JCP = 5.7 Гц), 63.5 (cyclo-C1H), 208.7
ляли при пониженном давлении, остаток суши-
(CSSK). Спектр ЯМР 31Р{1H} (D2O): δР 18.2 м. д.
ли в вакуум-эксикаторе над прокаленным CaCl2.
Найдено K, %: 20.82. C10H18K2NO3PS2. Вычислено
Продукт перекристаллизовывали из смеси 1,4-ди-
K, %: 20.93.
оксан-этанол (4а, б, г) или этанола (4в) и сушили в
Дикалия бутил{[(карбодитиоато)(2-метокси-
вакуумном сушильном шкафу при 60°C (5 мм рт. ст.)
этил)амино]метил}фосфонат (4г). Выход 28.31 г
Дикалия этил{[изопропил(карбодитиоато)-
(75%), белое кристаллическое вещество, т. разл.
амино]метил}фосфонат (4а). Выход 27.01 г (81%),
177°С (диоксан-этанол). Спектр ЯМР 1H (CD3CN),
белое кристаллическое вещество, т. разл. 197°С
δ, м. д.: 0.89 м (СH3CH2CH2), 1.34 м (CH3СH2CH2),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
СИНТЕЗ И КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА ДИКАЛИЕВЫХ СОЛЕЙ
401
1.56 м (CH3CH2СH2), 3.38 с (CH3O), 3.82 м (POCH2),
2σ(I)], максимальная остаточная электронная плот-
4.37 м (OCH2СH2N), 4.65 м (OСH2CH2N), 4.75 м
ность
0.25
(-0.36) e/Å3. Кристаллографические
(PCH2N). Спектр ЯМР 13С{1H} (CD3CN), δС, м. д.
данные депонированы в Кембриджский банк рент-
(J, Гц): 13.6 (СH3CH2CH2), 19.1 (CH3СH2CH2),
геноструктурных данных (CCDC 1942246).
33.1 с (CH3CH2СH2),
51.7 д (PCH2N, 1JCP =
ФОНДОВАЯ ПОДДЕРЖКА
143.4 Гц), 52.3 (OCH2СH2N), 58.5 (OСH2CH2N),
64.6 д (POCH2, 2JCP = 6.2 Гц), 69.9 (CH3O),
Работа выполнена при финансовой поддержке
212.5 (CSSK). Спектр ЯМР 31Р{1H} (CD3CN): δР
Российского фонда фундаментальных исследова-
16.8 м. д. Найдено K, %: 20.80. C10H18K2NO3PS2.
ний (проект 18-33-20072).
Вычислено K, %: 20.71.
Диэтил[(изопропиламино)метил]фосфонат
КОНФЛИКТ ИНТЕРЕСОВ
(2а) cинтезировали по методике [17]. Выход 19.04 г
Авторы заявляют об отсутствии конфликта ин-
(91%) бесцветная маслянистая жидкость, т. кип.
тересов.
57°С (3.7×10-3 мм рт. ст.), nD20 1.4321. ЯМР 1H
(CDCl3), δ, м. д. (J, Гц): 0.94 д (6H, CH3CH, 3JHH =
СПИСОК ЛИТЕРАТУРЫ
6.5 Гц), 1.27 т (6H, CH3CH2O, 3JHH = 7.0 Гц), 2.95
1.
Бырько В. М. Дитиокарбаматы. М.: Наука, 1984.
д (2H, PCH2N, 2JHP = 11.3 Гц), 3.44 септет (1H,
342 с.
CH3CH, 3JHH = 6.5 Гц), 4.10 д. т (1H, CH3CH, 3JHP =
12.1, 3JHH = 7.0 Гц). Спектр ЯМР 13С{1H} (CDCl3),
2.
Bai Z., Zhang J., Zhang Q., Zhang T., Li J., Zhao Q.,
δС, м. д. (J, Гц): 16.4 д (СH3CH2O, 3JCP = 6.2 Гц),
Wang Z. , He D., Cheng J., Zhang J., Liu B. // Eur.
17.4 (СH3CH), 46.2 д (PCH2N, 1JCP = 165.4 Гц), 52.0
J. Med. Chem. 2018. Vol. 159. P. 339. doi 10.1016/j.
д (POCH2, 2JCP = 11.3 Гц), 62.0 д (CH3СH, 3JCP =
ejmech.2018.10.004
6.7 Гц). Спектр ЯМР 31Р{1H} (CDCl3): δР 25.2 м. д.
3.
Criado J. J., Lopez-Arias J. A., Macias B., Fernandez-
Калия этил[(изопропиламино)метил]фосфо-
Lago L. R., Salas J. M. // Inorg. Chim. Acta. 1992.
нат (3а). Выход 17.56 г (88%), белый гигроскопич-
Vol. 193. N 2. P. 229. doi 10.1016/s0020-1693(00)80357-6
ный порошок. Спектр ЯМР 1H (D2O), δ, м. д. (J,
4.
Pustelny K., Bielanska J., Plonka P.M., Rosen G.M.,
Гц): 0.97 д (6H, CH3CH, 3JHH = 6.4 Гц), 1.18 т (3H,
Elas M. // Nitric Oxide. 2007. Vol. 16. N 2. P. 202. doi
CH3CH2O, 3JHH = 7.1 Гц), 2.68 д (2H, PCH2N, 2JHP =
10.1016/j.niox.2006.10.002
13.4 Гц), 2.80 септепт (1H, CH3CH, 3JHH = 6.3 Гц),
5.
Dennis K.E., Valentine W.M. // Chem. Res. Toxicol.
3.84 д. т (2H, OCH2CH3, 3JHP = 14.2, 3JHH = 7.1 Гц).
2015. Vol. 28. N 4. P. 682. doi 10.1021/tx500450x
Спектр ЯМР 13С{1H} (D2O), δС, м. д. (J, Гц): 15.9 д
6.
Valentine H.L., Viquez O.M., Amarnath K., Amarnath V.,
(СH3CH2O, 3JCP = 5.9 Гц), 20.9 (СH3CH), 42.0 д
Zyskowski J., Kassa E.N., Valentine W.M. // Chem.
(PCH2N, 1JCP = 142.8 Гц), 49.4 д (POCH2, 2JCP =
Res. Toxicol. 2009. Vol. 22. N 1. P. 218. doi 10.1021/
12.8 Гц), 60.8 (CH3СH). Спектр ЯМР 31Р{1H} (D2O):
tx8003714
δР 22.4 м. д. Найдено K, %: 18.08. C6H15KNO3P.
Вычислено K, %: 17.83.
7.
Srivastava A. K. // J. Indian Chem. Soc. 2009. Vol. 86.
N 3. P. 281.
Рентгеноструктурное исследование кристал-
8.
Giovagnini L., Sitran S., Montopoli M., Caparrotta L.,
ла соединения 4г. Кристаллы соединения 4г мо-
ноклинные, C10H22K2NO5PS2, размер кристалла
Corsini M., Rosani C., Zanello P., Dou Q.P., Fregona D. //
Inorg. Chem. 2008. Vol. 47. N 14. P. 6336. doi 10.1021/
0.388 × 0.253 × 0.162 мм3, M 409.57 г/моль, про-
ic800404e
странственная группа P21/с, Z = 4, a = 16.973(2) Å,
b = 7.5769(8) Å, c = 16.6439(19) Å, β = 113.976(6)°,
9.
Аксенин Н.С., Бухаров М.С., Гарифзянов А.Р., Се-
V = 1955.8(4) Å3, dвыч = 1.391 г/cм3, μ = 0.795 мм-1,
ров Н.Ю., Гилязетдинов Э.М., Мирзаянов И.И.,
собрано отражений 24196 (-21 ≤ h ≤ 21, -9 ≤ k ≤
Штырлин В.Г. // Сб. матер. XIII Всероссийской мо-
9, -20 ≤ l ≤ 20), в пределах 2θ от 4.916 до 52.892°,
лодежной научно-инновационной школы «Матема-
4001 независимое отражение (Rint 0.1002), 205 па-
тика и математическое моделирование». Саров, 2019.
раметров уточнения, R1 = 0.0509, wR2 = 0.1211 [I ≥
С. 239.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
402
МИРЗАЯНОВ и др.
10.
Tlahuext H., Rosas-Valdéz E., López-Cardoso M.,
14. Sheldrick G.M. // Acta Crystallogr. (A). 2015. Vol. 71.
Román-Bravo P., Vargas-Pineda G., Montiel-Palma V.,
P. 3. doi 10.1107/S2053273314026370
Cotero-Villegas A.M., Pérez-Redondo M.C., Cea-
15. Sheldrick G.M. // Acta Crystallogr. (A). 2008. Vol. 64.
Olivares R. // J. Mol. Struct. 2018. Vol. 1169. P. 68. doi
P. 112. doi 10.1107/S0108767307043930
10.1016/j.molstruc.2018.05.029
16. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
11.
Bruker. APEX3 Crystallography software Suite, Bruker
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
AXS, Inc., Madison, WI, USA, 2016.
Vol. 42. P. 339. doi 10.1107/S0021889808042726
17. Захаров С.В., Нуриазданова Г.К., Гарифзянов А.Р.,
12.
Bruker. SAINT. Crystallography software Suite, Bruker
Галкин В.И., Черкасов Р.А. // ЖОХ. 2004. Т. 74. Вып. 6.
AXS, Inc., Madison, WI, USA, 2016.
С. 873; Zakharov S.V., Nuriazdanova G.Kh., Gari-
13.
Krause L., Herbst-Irmer R., Sheldrick G.M., Stalk D.J. //
fzyanov A.R., Galkin V. I., and Cherkasov R.A. //
Appl. Crystallogr. 2015. Vol. 48. P. 3. doi 10.1107/
Russ. J. Gen. Chem. 2004. Vol. 74. N 6. P. 873. doi
S1600576714022985
10.1023/B:RUGC.0000042422.61124.b3
Synthesis and Crystal Structure of Dipotassium Salts
of N-Alkyl-N-{[O-alkoxy(hydroxy)phosphoryl]methyl}-
ditiocarbamic Acids
I. I. Mirzayanova,*, A. R. Garifzyanova, D. R. Islamovb, and V. G. Shtyrlina
aA.M. Butlerov Institute of Chemistry, Kazan Federal University, Kazan, 420008 Russia
bA.E. Arbuzov Institute of Organic and Physical Chemistry, Federal Research Center
“Kazan Scientific Center of the Russian Academy of Sciences”, Kazan, 420088 Russia
*e-mail: ildar4016@mail.ru
Received July 31, 2019; revised July 31, 2019; accepted August 6, 2019
A one-pot method was developed for the synthesis of dipotassium salts of N-alkyl-N-{[O-alkoxy(hydroxy)-
phosphoryl]methyl}dithiocarbamic acids. Dipotassium salts of N-isopropyl-, N-butyl- and N-cyclo-
hexyl-N-{[hydroxy(O-ethoxy)phosphoryl]methyl}dithiocarbamic acids and N-{[O-butoxy(hydroxy)phosphoryl]-
methyl}-N-(2-methoxyethyl)dithiocarbamic acid were synthesized and isolated individually. A crystalline and
molecular structure was established for the latter compound.
Keywords: dithiocarbamates, aminophosphonic acids, crystal structure
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020