ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 3, с. 418-424
УДК 544.77.051;615.2;544.723
ХЕМОСОРБЦИЯ ГЛИЦИДИНОВОГО СПЕЙСЕРА
НА ПОВЕРХНОСТИ МАГНИТНЫХ НАНОЧАСТИЦ И
ИММОБИЛИЗАЦИЯ АЛЬБУМИНА И КВИНАКРИНА
© 2020 г. Д. В. Королевa,b, В. Н. Постновa,c, Т. Н. Романоваd, В. Н. Зоринd,
Г. А. Шульмейстерa,*, Е. Б. Наумышеваa,c, Н. В. Евреиноваa,e, И. В. Муринc
a Национальный медицинский исследовательский центр имени
В. А. Алмазова Министерства здравоохранения России, ул. Аккуратова 2, Санкт-Петербург, 197341 Россия
b Первый Санкт-Петербургский государственный медицинский университет имени академика И. П. Павлова,
Санкт-Петербург, 197022 Россия
c Санкт-Петербургский государственный университет, Санкт-Петербург, 199034 Россия
d Санкт-Петербургский государственный электротехнический университет «ЛЭТИ»
имени В. И. Ульянова (Ленина), Санкт-Петербург, 197376 Россия
e Санкт-Петербургский государственный технологический институт (технический университет),
Санкт-Петербург, 190013 Россия
*e-mail: g.schulmeister@yandex.ru
Поступило в Редакцию 13 сентября 2019 г.
После доработки 13 сентября 2019 г.
Принято к печати 18 сентября 2019 г.
В работе проведена хемосорбция на поверхности магнитных наночастиц глицидинового спейсера из
трех различных растворителей. Показано, что наибольшей эффективностью обладают образцы, полу-
ченные из бензола. Проведена иммобилизация человеческого альбумина и фармацевтического препарата
квинакрина на глицидиновый спейсер. Предложен механизм взаимодействия альбумина и квинакрина
с глицидиновой группой.
Ключевые слова: магнитные наночастицы, спейсер, глицидиновая группа, альбумин, квинакрин, им-
мобилизация
DOI: 10.31857/S0044460X20030114
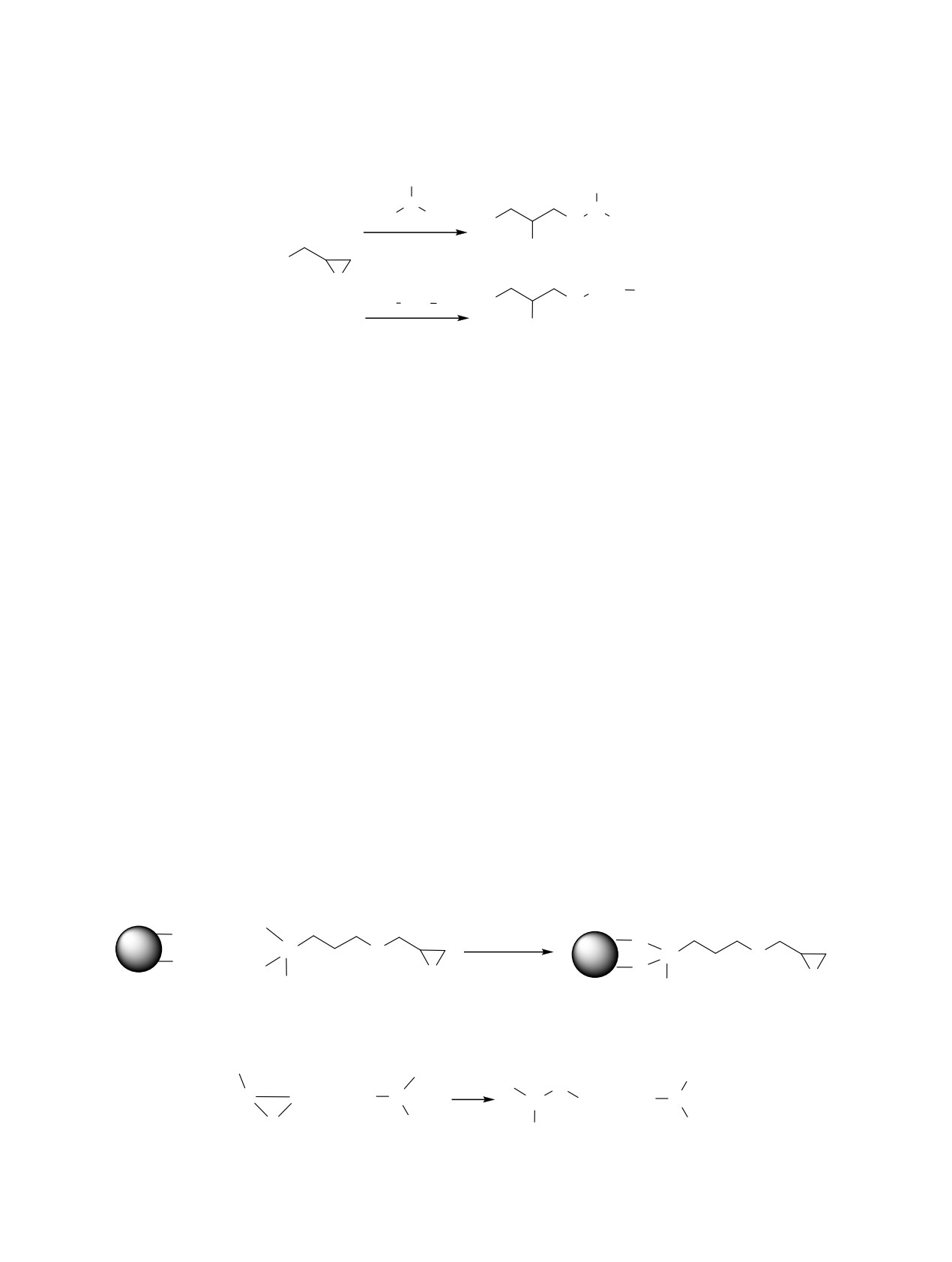
Реакция глицидиновой группы с аминами [1]
7 сут. Ферментативно-функционализированные
используется для сшивки различных, в основном
наночастицы диоксида кремния были получены
полимерных, материалов [2, 3]. Она проходит с рас-
путем иммобилизации антител HRP и альфа-фето-
крытием цикла. Имеются различные способы син-
протеинов на поверхности наночастиц кремнезема
теза аминоспейсера (схема 1) [3]. При этом на гли-
с помощью линкования соединения 1 [5].
цидиновый спейсер можно иммобилизовать любой
В настоящей работе работе для хемосорбции
препарат, имеющий аминогруппу, либо синтезиро-
глицидинового спейсера на магнитных наноча-
вать соответствующий конъюгат. Так, в работе [4]
стицах был использован (3-глицидилоксипропил)-
синтезированы наночастицы конъюгата желатина
триметоксисилан. Взаимодействие его с гидрок-
и (3-глицидилоксипропил)триметоксисилана (сое-
силированной поверхностью магнитных наноча-
динение 1) диаметром 200 нм. Наночастицы были
стиц идет по механизму реакции этерификации
модифицированы S-нитрозотиолом. В результате
(схема 2). В качестве растворителя в данной ре-
этого был получен препарат эффективной достав-
акции использовали бензол, толуол и циклогек-
ки NO для регуляции сосудистых клеток, высво-
сан. Для определения содержания глицидиновых
бождающий 0.12 ммоль/мг оксида азота в течение
групп в образцах, полученных из трех разных рас-
418
ХЕМОСОРБЦИЯ ГЛИЦИДИНОВОГО СПЕЙСЕРА
419
Схема 1.
NH2
NH2
N
N
H2N
NH
2
R
N
NH2
H
OH
R
O
PEG
NH2
H N PEG2 NH2
R
N
H
OH
творителей, использовали метод, основанный на
Поскольку белок крови альбумин состоит в
взаимодействии с триметиламином (схема 3).
основном из аминокислот, оказалось интересным
сшить их при помощи глицидинового спейсера на
Результаты определения количества глициди-
поверхности наночастиц. Так как альбумин явля-
новых групп по кремнию приведены в табл. 1.
ется транспортным белком, то иммобилизация его
Наибольшее содержание глицидиновых групп на-
на поверхности магнитных наночастиц, возможно,
блюдается в образце, полученном при использо-
будет способствовать хемосорбции лекарственных
вании в качестве растворителя циклогексана. При
препаратов. Вероятно, реакция идет с раскрытием
этом величина удельной поверхности у этого об-
кольца и взаимодействием образовавшегося ради-
разца самая низкая. По-видимому, это говорит об
кала с первичной боковой аминогруппой. На схеме
образовании толстой полимерной оболочки, вклю-
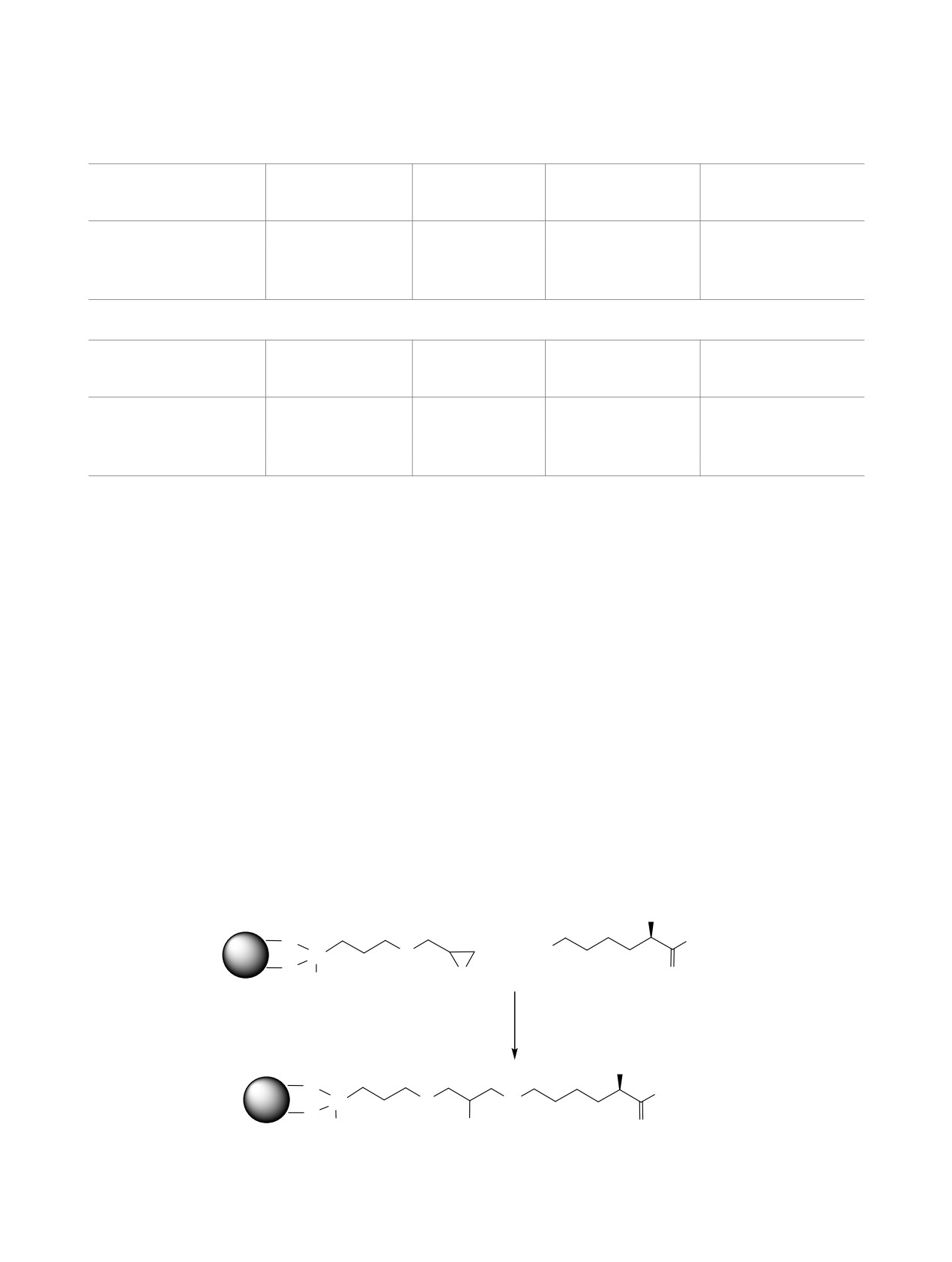
4 для примера представлено взаимодействие спей-
чающей агломераты наночастиц. Несмотря на
сера с алифатической аминокислотой лизином.
большую формальную плотность прививки, сле-
Нами проведена иммобилизация на глициди-
дует ожидать низкую эффективность при иммоби-
новую группу (RS)-2-метокси-6-хлор-9-(1-метил-
лизации препаратов на этот образец. При исполь-
1-диэтиламинобутиламино)акридина дигидрох-
зовании бензола в качестве растворителя при хе-
лорида
2 (мепакрин, квиакрин или акрихин).
мосорбции полученный образец обладает высокой
Квинакрин был синтезирован в 30-х годах ХХ
удельной поверхностью и большим содержанием
века как флуоресцентный краситель. Вскоре была
спейсера (по сравнению с образцом, полученным
обнаружена его противомалярийная и антипараз-
из толуола). Для этого образца следует ожидать
итарная активность [6]. В последние несколько
высокой эффективности при иммобилизации пре-
десятилетий было показано влияние мепакрина
паратов.
на постишемическое восстановление миокарда
Результаты определения количества глициди-
[7, 8]. Конъюгаты квинакрина с наночастицами
новых групп по углероду (табл. 2) хорошо согла-
различной природы были получены ранее [9-11].
суются с результатами определения по кремнию.
Авторами предпринята попытка использовать
Схема 2.
H3CO
OH
Solvent, 80°C
O
Fe3O4
+
Si
O
Fe3O4
Si
O
OH
-2CH3OH
H3CO
O
O
O
OCH3
OCH3
1
Схема 3.
R
CH3
H2
HCl
CH3
R
H
C
HC
CH2 +
H3C
N
+
N
C
Cl
H3C
O
CH3
CH3
OH
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
420
КОРОЛЕВ и др.
Таблица 1. Результаты определения количества глицидиновых групп по кремнию
Концентрация на
Удельная
Содержание
Концентрация,
Образец
единицу поверхности,
поверхность, м2/г
кремния, мкг
ммоль/г
мкмоль/м2
Fe3O4 исходный
63
-
-
-
Fe3O4-1 из бензола
70
9.714
0.35
4.9
Fe3O4-1 из толуола
77
4.000
0.14
1.8
Fe3O4-1 из циклогексана
42
35.429
1.26
30.0
Таблица 2. Результаты определения количества глицидиновых групп по углероду
Концентрация на
Удельная
Содержание
Концентрация,
Образец
единицу поверхности,
поверхность, м2/г
кремния, мкг
ммоль/г
мкмоль/м2
Fe3O4 исходный
63
-
-
-
Fe3O4-1 из бензола
70
2.4
0.3
4.9
Fe3O4-1 из толуола
77
2.6
0.4
4.8
Fe3O4-1 из циклогексана
42
7.4
1.1
25.2
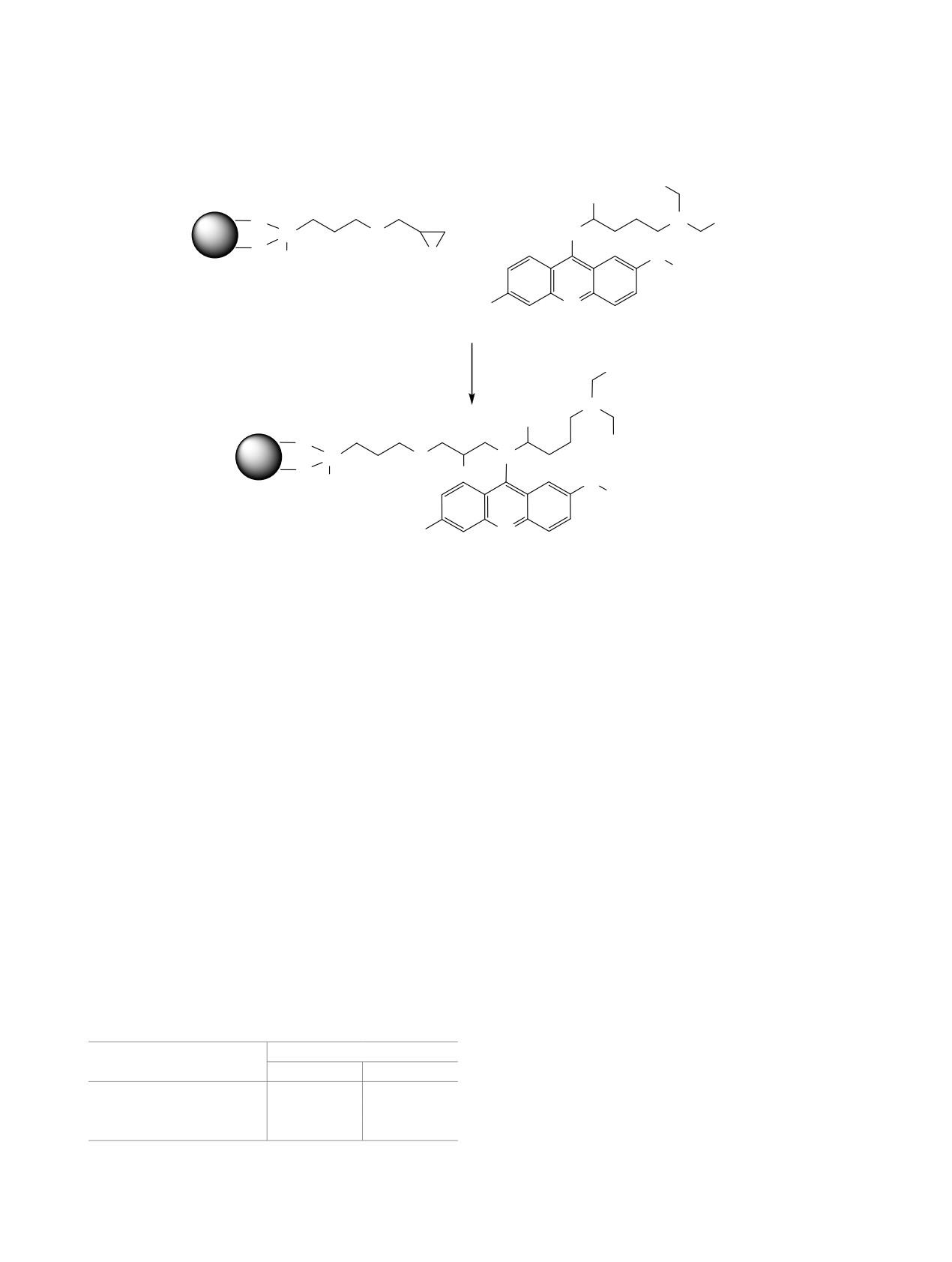
вторичную аминогруппу квинакрина для иммо-
образцов с иммобилизованным альбумином пока-
билизации его на глицидиновый спейсер, приви-
заны на рисунке (г-е). Как видно из термограмм,
тый на магнитные наночастицы. Иммобилизация
при иммобилизации альбумина в низкотемпера-
квинакрина показана на схеме 5. Предполагается,
турной области разрушения полимерной оболочки
что образовавшийся при раскрытии кольца ради-
добавляется еще одна стадия. По-видимому, она
кал взаимодействует со вторичной аминогруппой
соответствует денатурации белка - альбумина. Это
квинакрина.
соответствует литературным данным [12]: весь бе-
лок денатурирует при температурах ниже 100°С. В
Полученные образцы до и после иммобилиза-
дальнейшем идет двухстадийное выгорание про-
ции были исследованы методом термогравиметрии.
дуктов денатурации, которое может продолжаться
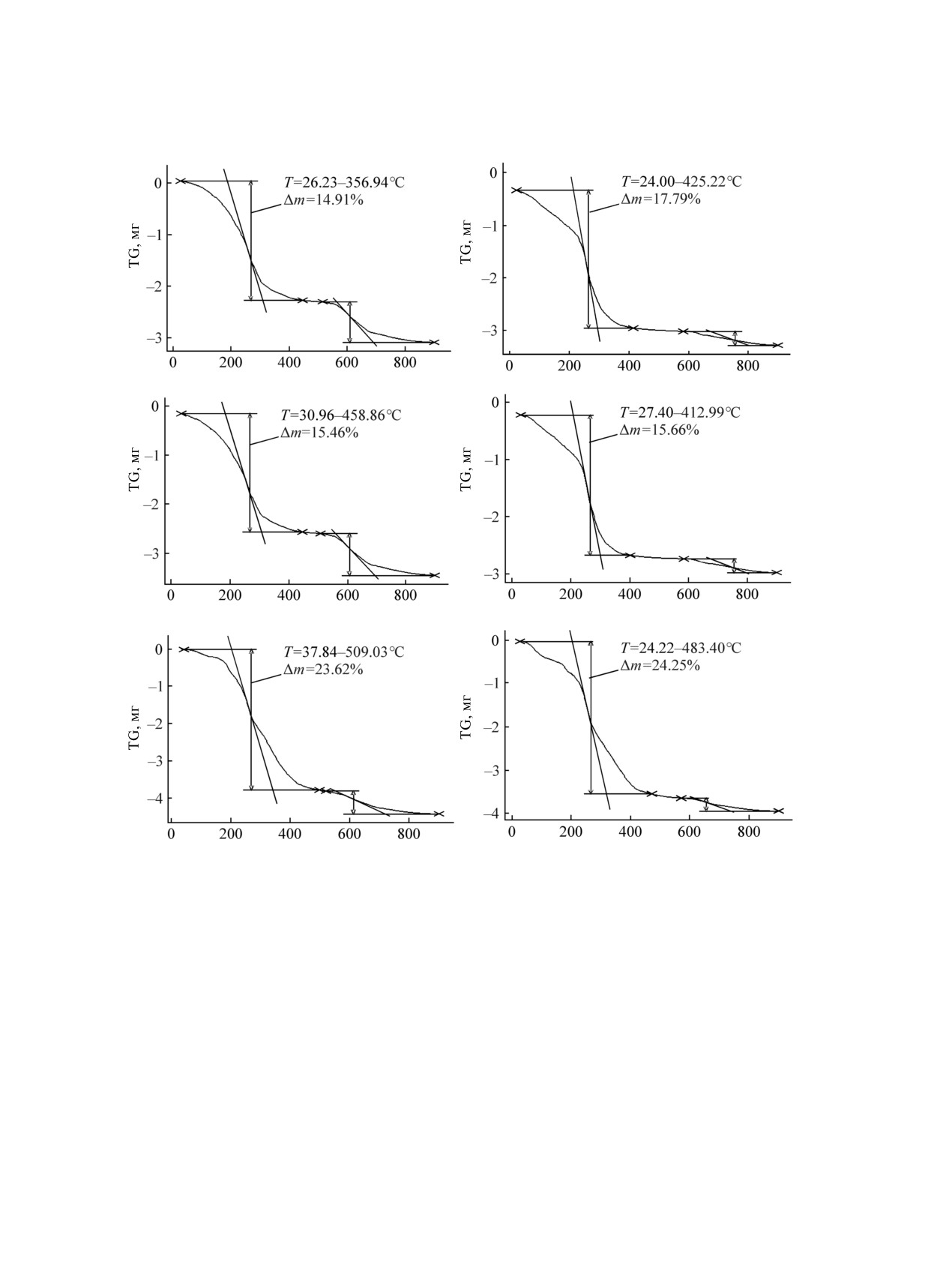
Результаты термогравиметрического анализа об-
вплоть до 450°С [13].
разцов, полученных из разных растворителей, по-
казаны на рисунке (а-в). На термограммах имеют-
К сожалению, количество альбумина, иммоби-
ся два участка. Один из них, низкотемпературный,
лизованное на глицидиновый спейсер невелико
соответствует выгоранию органической оболочки,
по массе. Среднее значение содержания альбу-
содержащей глицидиновый спейсер; второй, вы-
мина колеблется от 0.5 до 3%. Количество иммо-
сокотемпературный, соответствует доокислению
билизованного квинакрина составило от 3.7 до
магнетита до высшего оксида. Результаты анализа
5.5 мг/г. Наибольшее количество квинакрина, как
Схема 4.
NH2
OH
O
Fe3O4
O
H2N
Si
+
O
O
O
OCH3
ДМСО
NH2
O
OH
Fe3O4
Si
O
N
O
H
OCH3
OH
O
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
ХЕМОСОРБЦИЯ ГЛИЦИДИНОВОГО СПЕЙСЕРА
421
(а)
(б)
T, °С
T, °С
(в)
(г)
T, °С
T, °С
(д)
(е)
T, °С
T, °С
Результаты термогравиметрического анализа образцов с глицидиновым спейсером, полученных с использованием в качестве
растворителя бензола (а, г), толуола (б, д) и циклогексана (в, е) до (а-в) и после иммобилизации альбумина (г-е).
и ожидалось, хемосорбируется на образец, полу-
Таким образом, проведена хемосорбция гли-
ченный при использовании бензола (табл. 3). Это
цидинового спейсера с использованием трех раз-
подтверждает предположение о том, что отно-
личных растворителей. Показано, что наибольшей
сительно большое количество спейсера в случае
эффективностью обладают образцы, полученные с
образца, полученного при использовании цикло-
использованием бензола. Проведена иммобилиза-
гексана, определенное методами анализа по крем-
ция человеческого альбумина и фармацевтическо-
нию и углероду, связано с образованием толстой
го препарата квинакрина на глицидиновую группу
полимерной пленки на поверхности наночастиц. В
спейсера. Предложен механизм взаимодействия
таком случае доступными остаются только глици-
альбумина и квинакрина с глицидиновым спейсе-
диновые группы, оставшиеся на поверхности.
ром. Предложенная модель может быть использо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
422
КОРОЛЕВ и др.
Схема 5.
H3C
CH3
O
+
N CH3
Fe3O4
Si
O
HN
O
O
O
OCH
3
CH
3
Cl
N
2
ДМСО
CH3
N
CH
3
O
CH3
Fe3O4
Si
O
N
O
OH
OCH3
O
CH3
Cl
N
вана для пассивной либо магнитоуправляемой на-
солютном давлении (3 Па) в лиофильной сушке
правленной доставки лекарственных препаратов в
VaCo 2 (ZirBus, Germany).
зону ишемии биологических тканей.
Определение количества глицидиновых
групп титрованием в неводной среде. Метод
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
определения количества глицидиновых групп
В работе использовали магнитные наночасти-
[15] основан на реакции с гидрохлоридом три-
цы, синтезированные по методу, описанному в ра-
метиламина. Этот же метод указан для определе-
боте [14]. Для получения глицидинового спейсера
ния функциональных групп при получении гелей
использовали
(3-глицидилоксипропил)триметок-
для доставки лекарств на основе глицидинового
сисилан (Sigma Aldrich). В работе использовали
спейсера [16]. К суспензии 100 мг исследуемого
человеческий альбумин (Вакстер АГ, Австрия).
образца в 20 мл уксусного ангидрида добавляли
Хемосорбция глицидинового спейсера.
эквивалентное количество гидрохлорида триме-
Смесь 2 г лиофилизированных магнитных наноча-
тиламина. Полученную смесь выдерживали при
стиц, 23.75 мл соответствующего растворителя и
комнатной температуре 2 ч. Количество высво-
1.25 мл
(3-глицидилоксипропил)триметоксиси-
божденного амина определяли методом ацидиме-
лана термостатировали при 80°С в течение 2 ч
трического неводного титрования 0.1 н. хлорной
при перемешивании. В качестве растворителя
кислотой в ледяной уксусной кислоте в присут-
использовали бензол, толуол или циклогексан.
ствии индикатора кристаллического фиолетового.
Полученный продукт 5 раз промывали циклогек-
В среде протогенного растворителя (СН3СООН)
саном, затем лиофилизировали при -50°С и аб-
усиливаются основные свойства слабого основа-
ния, и он количественно титруется хлорной кис-
лотой. Этому процессу предшествует образование
Таблица 3. Результаты определения содержания квина-
ацелоний- и перхлорат-ионов. Степень замещения
крина
глицидиновых групп х рассчитывали по формуле (1).
Содержание квинакрина
Образец
моль/г
мг/г
A = m/M·x,
(1)
Fe3O4-1 из бензола
0.014
5.5
где M - молекулярная масса спейсера; A - коли-
Fe3O4-1 из толуола
0.006
2.2
чество HClO4, израсходованного для титрования,
Fe3O4-1 из циклогексана
0.009
3.7
моль; m - масса образца, г.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
ХЕМОСОРБЦИЯ ГЛИЦИДИНОВОГО СПЕЙСЕРА
423
Раствор хлорной кислоты в уксусной кислоте
(Unico Sys, США) при λ = 430 нм. Полученную
готовили по методике, описанной в работе [17].
после иммобилизации квинакрина суспензию в
ДМСО центрифугировали и анализировали содер-
Определение количества глицидиновых
жание квинакрина в надосадочной жидкости. По
групп по содержанию кремния. Навеску (50 мг)
этой величине судили о количестве сорбированно-
исследуемого образца подвергали минерализации
го вещества.
методом мокрого озоления кипячением в растворе
азотной кислоты, полученном разбавлением 20 мл
Работа выполнена с применением оборудования
концентрированной кислоты дистиллированной
ресурсных центров «Оптические и лазерные мето-
водой в соотношении 1:1, до полного растворения.
ды исследования вещества» и «Инновационные
технологии композитных наноматериалов» Санкт-
После охлаждения объем минерализата доводили
Петербургского государственного университета.
до 100 мл дистиллированной водой. Полученный
таким образом минерализат анализировали на со-
КОНФЛИКТ ИНТЕРЕСОВ
держание силикат-иона методом молибденовой
Авторы заявляют об отсутствии конфликта ин-
сини с использованием спектрофотометрии [18].
тересов.
Определение количества глицидиновых
групп по содержания углерода. Исследуемый об-
СПИСОК ЛИТЕРАТУРЫ
разец сжигали в тонкой кварцевой трубке в атмос-
1.
Shechter L., Wynstra J., Kurkjy R.P. // Ind. Eng. Chem.
фере кислорода по методу Прегля [19]. Количество
1956. Vol. 48. N 1. P. 94. doi 10.1021/ie50553a029
выделившегося углекислого газа определяли во-
2.
Fryauf K., Strehmel V., Fedtke M. // Polymer. 1993.
люмометрически при помощи газометра.
Vol. 34. N 2. P. 323. doi 10.1016/0032-3861(93)90084-N
3.
Kimmins S.D., Wyman P., Cameron N.R. // Polymer.
Иммобилизация альбумина. Иммобилизацию
2014. Vol. 55. P. 416. doi 10.1016/j.polymer.2013.09.019
альбумина проводили на перемешивающем
4.
Zhang Q.Y., Wang Z.Y., Wen F., Ren L., Li J., Teoh S.H.,
устройстве LS-220 при частоте 300 мин–1. Навеску
Thian E.S. // J. Biomed. Mater. Res. (A). 2015. Vol. 103.
образца (50 мг) и 2 мл 20%-ного водного раствора
P. 929. doi 10.1002/jbm.a.35239
альбумина подвергали иммобилизации в течение
5.
Wu Y., Chen C., Liu S. // Anal Chem. 2009. Vol. 81. N 4.
2 ч при 25°С. После сорбции полученный препа-
P. 1600. doi 10.1021/ac802345z
рат 5 раз промывали дистилированной водой с ис-
6.
Машковский М.Д. Лекарственные средства. М.: ООО
«Новая волна», 2002. Т. 2. С. 608.
пользованием магнитной сепарации.
7.
Otani H., Engelman R.M., Breyer R.H., Rousou J.A.,
Определение количества глицидиновых
Lemeshow S., Das D.K. // J. Thorac. Cardiovasc. Surg.
групп и содержание иммобилизованного аль-
1986. Vol. 92. N 2. P. 247.
бумина термогравиметрическим методом.
8.
van Bilsen M., van der Vusse G.J., Willemsen P.H.,
Исследование проводили при нагреве до 900°С
Coumans W.A., Roemen T.H., Reneman R.S. // J. Mol.
в воздушной среде со скоростью 10 град/мин на
Cell. Cardiol. 1990. Vol. 22. N 2. P. 155-163. doi
приборе Setaram Setsys Evolution.
10.1016/0022-2828(90)91112-K.
9.
Satapathy S.R., Nayak A., Siddharth S., Das S., Nayak D.,
Иммобилизация квинакрина. Иммобили-
Kundu C.N. // Nanomedicine. 2018. Vol. 14. N 3. P. 883.
зацию квинакрина проводили выдерживанием
doi 10.1016/j.nano.2018.01.007
смеси 50 мг образца и 2 мл 0.1%-ного раствора
10.
Satapathy S.R., Siddharth S., Das D., Nayak A.,
квинакрина в безводном диметилсульфоксиде
Kundu C.N. // Mol. Pharm. 2015. Vol. 12. N 11. P. 4011.
при перемешивании (частота 300 мин-1) в течение
doi 10.1021/acs.molpharmaceut.5b00461
30 мин. Безводный ДМСО получали выморажива-
11.
Sun M.G., Shi J.F., Li X.Y., Zhao Y., Ju R.J.,
нием. После сорбции полученный препарат 5 раз
Mu L.M., Yan Y., Li X.T., Zeng F., Lu W.L. // J. Biomed.
Nanotechnol. 2015. Vol. 11. N 8. P. 1339. doi 10.1166/
промывали дистилированной водой с использова-
jbn.2015.2079
нием магнитной сепарации.
12.
Kulikova G.A., Ryabinina I.V., Guseynov S.S., Parfe-
Определение количества иммобилизованно-
nyuk E.V. // Thermochim. Acta. 2010. Vol. 503-504.
го квинакрина. Количество иммобилизованного
P. 65. doi 10.1016/j.tca.2010.03.009
квинакрина определяли методом спектрофотоме-
13.
Parfenyuk E.V., Kulikova G.A., Ryabinina I.V. // J.
трии при помощи спектрофотометра Unico 2802S
Therm. Anal. Calorim. 2010. Vol. 100. N 4. P. 987. doi
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
424
КОРОЛЕВ и др.
10.1007/s10973-009-0604-4
Publishing Company, Inc. 1993. P. 93.
14. Toropova Y.G., Golovkin A.S., Malashicheva A.B.,
17. ГОСТ 25794.3-83. Реактивы. Методы приготовления
Gorshkov A.N., Gareev K.G., Afonin M.V., Korolev D.V.,
титрованных растворов для титрования осаждением,
Galagudza M.M. // Int. J. Nanomed. 2017. Vol. 12.
неводного титрования и других методов. М.: Стан-
P. 593. doi 10.2147/IJN.S122580
дартинформ, 2006. 11 с.
15. Kondo T., Ishizu A., Nakano J. // J. Appl. Polym. Sci.
18. Уильямс У.Дж. Определение анионов. М.: Химия,
1989. N 37. P. 3003. doi 10.1002/app.1989.070371017
1982. С. 199.
16. Park K., Shalaby W.S.W., Park H. Biodegradable
19. Pregl F. Die Quantitative Organische Mikroanalyse.
hydrogels for drug delivery. Lancaster-Base: Technomic
Berlin: Springer, 1917. P. 189.
Chemisorption of Glycidine Spacer on Magnetic Nanoparticles
Surface and Immobilization of Albumin and Quinacrine
D. V. Koroleva,b, V. N. Postnova,c, T. N. Romanovad, V. N. Zorind, G. A. Shulmeystera,*,
E. B. Naumyshevaa,c, N. V. Evreinovaa,e, and I. V. Murinc
a V. A. Almazov National Medical Research Center of the Ministry of Health of Russia, St. Petersburg, 197341 Rusia
b I. P. Pavlov The First St. Petersburg State Medical University, St. Petersburg, 197022 Russia
cSt. Petersburg State University, St. Petersburg, 199034 Russia
d V. I. Ulyanov (Lenin) St. Petersburg State Electrotechnical University “LETI”, St. Petersburg, 197376 Russia
e St. Petersburg State Institute of Technology (Technical University), St. Petersburg, 190013 Russia
*e-mail: g.schulmeister@yandex.ru
Received September 13, 2019; revised September 13, 2019; accepted September 18, 2019
Chemisorption on the surface of magnetic nanoparticles of a glycidine spacer from three different solvents was
performed. It was shown that the samples obtained from benzene are most effective. The human albumin and
the pharmaceutical preparation quinacrine were immobilized on a glycidine spacer. A mechanism is proposed
for the interaction of albumin and quinacrine with a glycidine group.
Keywords: magnetic nanoparticles, spacer, glycidine groups, albumin, quinacrine, immobilization
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020