ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 3, с. 425-431
УДК 541.49:546.562:543.554.2
ГЕТЕРОЛИГАНДНЫЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
МЕДИ(II) С ДИГИДРАЗИДАМИ МАЛОНОВОЙ,
АДИПИНОВОЙ КИСЛОТ И L-ГИСТИДИНОМ
© 2020 г. Н. В. Трошанин*, Э. М. Гилязетдинов, Т. И. Бычкова, В. Г. Штырлин
Казанский (Приволжский) федеральный университет, ул. Кремлевская 18, Казань, 420008 Россия
*e-mail: nikita-vt@mail.ru
Поступило в Редакцию 28 июля 2019 г.
После доработки 28 июля 2019 г.
Принято к печати 5 августа 2019 г.
Методом рН-метрии с привлечением математического моделирования исследовано комплексообразова-
ние в тройных системах медь(II)-гидразид малоновой (L)/адипиновой кислоты (L')-L-гистидин (HisH) в
водной среде на фоне 1.0 М. раствора KNO3 при 25.0°С. Определены константы устойчивости гетероли-
гандных комплексов (1:1:1). Выполнены квантово-химические расчеты структур гетеролигандных ком-
плексов. Выявлено, что комплексы Cu(His)(L)+ и Cu(His)(L')+ существуют преимущественно в цис-форме.
Ключевые слова: рН-метрия, медь(II), гетеролигандное комплексообразование, устойчивость
DOI: 10.31857/S0044460X20030126
Комплексные соединения жизненно важных
глутаминовая кислота) приводит к образованию
металлов с N,O-донорными лигандами (аминокис-
гетеролигандных комплексов [MA2L], [MAL]+ и
лотами, гидразидами, дигидразидами и др.) могут
[MAL2]2+, где А - аминокислота в депротониро-
использоваться как модели биологических систем,
ванной форме, L - гидразид карбоновой кисло-
например соединений белков с металлами, и для
ты [1, 2]. В отличие от никеля(II), кобальт(II) и
получения фармакологических субстратов. К на-
цинк(II) не образуют в заметных количествах ком-
стоящему времени накоплен обширный материал
плексных соединений [MA2L] и [MAL2]2+.
о структуре кристаллов гомолигандных комплек-
В системе никель(II)-гидразид бензойной/п-ме-
сов 3d-металлов с гидразидами кислот и амино-
токсибензойной кислоты-L-гистидин-вода-KNO3
кислотами, а также об их устойчивости в водных и
(0.1 моль/л)
[5] обнаружены гетеролигандные
водно-органических растворах. Гетеролигандные
комплексы 1:1:1, включающие нейтральную фор-
(смешанно-лигандные) комплексы с указанными
му гидразида и L-гистидин в цвиттер-ионной или
органическими лигандами изучены преимуще-
анионной форме. Из сопоставления рассчитанных
ственно в твердой фазе в заметно меньшей сте-
констант сопропорционирования для гетероли-
пени. Препаративно выделенные из различных
гандных комплексов с их статистическими вели-
растворителей, такие комплексы обычно имеют
чинами был сделан вывод о проявлении специфи-
состав 1:1:1 [1-4]. Только немногие тройные си-
ческого межлигандного взаимодействия, стабили-
стемы металл-гидразид-аминокислота исследова-
зирующего комплексы.
ны в водных растворах [1, 2, 5, 6].
В системе медь(II)-гидразид изоникотино-
Комплексообразование никеля(II) с гидразида-
вой кислоты (L)-глицин (GlyH) [6] определены
ми и дигидразидами карбоновых кислот (ацетил-
устойчивость и лабильность образующихся в кис-
гидразин, бензоилгидразин, дигидразиды щавеле-
лой среде гетеролигандных комплексов состава
вой, малоновой, янтарной и адипиновой кислот)
Cu(Gly)L+ и Cu(Gly)L2+. Низкое значение констан-
и аминокислотами (глицин, серин, метионин,
ты присоединения к комплексу Cu(Gly)L+ второй
425
426
ТРОШАНИН и др.
Таблица
1. Константы диссоциации дигидразидов
Таблица 2. Константы устойчивости гомолигандных
малоновой (L), адипиновой (L') кислот и L-гистидина
комплексных соединений меди(II) с дигидразидами ма-
(HisH) в водной среде на фоне 1.0 М. раствора KNO3
лоновой (L), адипиновой (L’) кислот и L-гистидином
при 25.0°Ca
(HisH) в водной среде на фоне 1.0 М. KNO3 при 25.0°C
Равновесие
pKа1
рKа2
рKа3
Равновесие
lgβа
LH22+ →← LH+ + H+
2.342(1)
LH+ →← L + H+
3.267(1)
Cu2+ + LН+ →← Cu(LН)3+
3.447(1)
L'H22+ →← L'H+ + H+
3.066(1)
Cu2+ + L →← CuL2+
4.406(1)
L'H+ →← L' + H+
3.759(1)
Cu2+ + 2LН+ →← Cu(LН)24+
5.684(5)
1.21
HisH32+ →← HisH2+ + H+
1.986 [7]
Cu2+ + L + LН+ →← Cu(LН)L3+
6.927(2)
HisH2+ →← HisH + H+
6.265 [7]
Cu2+ + 2L →← CuL22+
7.601(2)
1.21
HisH →← His- + H+
9.200 [7]
2Cu2+ + L →← Cu2L4+
6.553(2)
a В скобках даны стандартные отклонения в последней знача-
щей цифре.
2Cu2+ + 2L →← Cu2L24+
10.06(3)
Cu2+ + L'Н+ →← Cu(L'Н)3+
4.277(1)
молекулы гидразида обусловлено необходимостью
раскрытия хелатного цикла первого лиганда L,
Cu2+ + L' →← Cu(L')2+
5.217(2)
связанного бидентатно, при вхождении второй мо-
Cu2+ + L' →← Cu(L'H-1)+ + H+
0.89(2)
лекулы. В дестабилизацию комплекса Cu(Gly)L2+
Cu2+ + 2L'Н+ →← Cu(L'Н)24+
7.366(8)
1.19
вносит вклад и стерический фактор.
Cu2+ + L' + L'Н+ →← Cu(L'Н)(L')3+
8.661(6)
Методом рН-метрии нами исследовано ком-
плексообразование в бинарных системах медь(II)-
Cu2+ + 2L' →← Cu(L')22+
9.18(1)
1.25
дигидразид малоновой (L)/адипиновой (L') кисло-
2Cu2+ + L' →← Cu2(L')4+
7.841(5)
ты и в тройных системах медь(II)-дигидразид ма-
2Cu2+ + 2L' →← Cu2(L')24+
14.089(1)
лоновой/адипиновой кислоты-L-гистидин (HisH)
в водной среде на фоне 1.0 М. раствора нитрата ка-
Cu2+ + HisH →← Cu(HisH)2+
5.252
лия при 25.0°C, а также выполнены квантово-хи-
[7]
мические расчеты структур гетеролигандных ком-
Cu2+ + His- →← Cu(His)+
10.056
плексов.
[7]
Предварительно методом рН-метрического ти-
Cu2+ + 2HisH →← Cu(HisH)22+
9.502
1.00
трования на фоне 1.0 М. KNO3 определены кон-
[7]
станты протолитических равновесий для дигидра-
Cu2+ + His- + HisH →← Cu(HisH)(His)+
14.875
зидов. Полученные, а также известные константы
[7]
диссоциации различных форм L-гистидина [7]
Cu2+ + 2His- →← Cu(His)2
17.985
2.13
представлены в табл. 1. Константы pKа1, рKа2 для
[7]
дигидразидов кислот характеризуют отщепле-
a В скобках даны стандартные отклонения в последней знача-
ние ионов водорода от двух групп С(О)NHNH3+.
щей цифре.
Константы pKа1, рKа2 и рKа3 для гистидина соот-
ветствуют диссоциации карбоксигруппы, прото-
фоне 1.0 М. KNO3 при различных соотношениях
нированного атома азота имидазольного кольца и
металл-лиганд (2:1, 1:1, 1:2). Гомолигандное ком-
аммонийной группы соответственно.
плексообразование в этих системах исследовано
Следующим этапом работы являлось рН-ме-
ранее без фонового электролита [8, 9]. Бинарная
трическое титрование растворов меди(II) c ди-
система медь(II)-L-гистидин на том же солевом
гидразидом малоновой/адипиновой кислоты на
фоне была изучена ранее [7]. В табл. 2 приведены
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
ГЕТЕРОЛИГАНДНЫЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ МЕДИ(II)
427
рассчитанные составы и константы устойчивости
A
комплексов, существующих в гомолигандных си-
стемах при рН = 1.5-5.5.
Полидентатная природа дигидразидов кислот
проявляется в формировании протонированных
и димерных комплексов Cu(LН)3+, Cu(L'Н)3+,
Cu2L4+, Cu2(L')4+, Cu2L24+, Cu2(L')24+, Cu(LН)L3+ и
Cu(L'Н)(L')3+. В бинарной системе с дигидразидом
адипиновой кислоты выявлено депротонирование
комплекса Cu(L')2+, в результате чего образует-
ся форма Cu(L'H-1)+; при концентрациях сCu(II) =
λ, нм
4.92×10-3, c'L = 5.01×10-3 моль/л накапливается
Рис. 1. Электронные спектры поглощения водных рас-
~7% этой формы при рН = 5.8. Вследствие депро-
творов меди(II) с дигидразидом малоновой кислоты
тонирования гидразидных комплексов и образова-
(L) при рН = 3.55 (1), 3.62 (2), 3.76 (3). сCu(II) = 5.02×
ния нейтральных форм Cu(LH-1)2 и Cu(L'H-1)2, ве-
10-3 моль/л, cL = 5.07×10-3 моль/л, 25.0°С.
роятно, происходит помутнение кислых растворов
Комплексообразование в гетеролигандных
меди(II) c дигидразидами малоновой (при рН ~3.6)
системах медь(II)-гидразид малоновой/адипи-
и адипиновой кислот (при рН ~5.5). Образование
новой кислоты-L-гистидин исследовано при со-
этих комплексов подтверждено спектрофотоме-
отношениях металл-дигидразид-гистидин
1:1:1
трическим экспериментом: в спектрах растворов
и 2:1:2. Кривые титрования в виде зависимостей
меди(II) с дигидразидом малоновой кислоты при
функции Бьеррума (n) от рН в этих системах до
рН = 3.55-3.76, когда растворы начинают опалес-
областей образования осадков приведены на
цировать, максимум полосы поглощения меди(II)
рис. 2. Рассчитанные из них стехиометрические
существенно смещается в сторону коротких длин
параметры и константы образования комплексов
волн (рис. 1).
представлены в табл. 3. Примеры долевого распре-
Как видно из табл. 2, устойчивость комплексов
деления комплексных форм показаны на рис. 3, 4.
1:1, 1:2 и 2:2 с протонированной и молекулярной
Из табл. 3 следует, что устойчивость гетероли-
формами дигидразида адипиновой кислоты замет-
гандных комплексов одинакового состава Cu(HisH)
но выше, чем с дигидразидом малоновой кислоты,
L2+ и Cu(HisH)(L')2+ увеличивается при переходе
что объясняется как увеличением электронной
от дигидразида малоновой кислоты к дигидразиду
плотности на донорных атомах азота, так и умень-
адипиновой кислоты, как и в случае гомолиганд-
шением стерических препятствий для одновре-
ных комплексов, что согласуется с повышенными
менной координации обоих гидразидных фраг-
электронодонорными свойствами дигидразида
ментов к металлу при удлинении углеводородной
адипиновой кислоты. Отсутствие в кислых рас-
цепи. В частности, логарифмы констант димериза-
ции комплексов CuL2+ и Cu(L')2+ составляют 1.248
Таблица 3. Константы устойчивости гетеролигандных
и 3.655 соответственно.
комплексных соединений меди(II) с дигидразидами ма-
Из сопоставления данных (табл. 2) следует,
лоновой (L), адипиновой (L') кислот и L-гистидином
что отношения логарифмов ступенчатых констант
(HisH) в водной среде на фоне 1.0 М. KNO3 при 25.0°С
устойчивости моно- и бискомплексов меди(II),
Равновесие
lgβа
ΔlgK
lg(K1/K2), с монопротонированными формами ди-
гидразидов малоновой и адипиновой кислот равны
Cu2+ + HisH + L →← Cu(HisH)L2+
8.90(1)
-0.750
соответственно 1.21 и 1.19, а c депротонированны-
Cu2+ + HisH + L' →← Cu(HisH)(L')2+
9.49(2)
-0.980
ми формами дигидразидов - соответственно 1.21 и
1.25, что близко к статистически ожидаемым зна-
Cu2+ + His- + L' →← Cu(His)(L')+
14.770(4)
-0.503
чениям при бидентатной координации лигандов
a В скобках даны стандартные отклонения в последней знача-
щей цифре.
{lg(K1/K2)стат = 1.2-1.4 [10, 11]}.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
428
ТРОШАНИН и др.
n
α
pH
Рис. 2. Зависимости функции Бьеррума (n) от pH для
систем медь(II)-дигидразид малоновой кислоты (L)-L-
гистидин (HisH)-вода-1.0 М. KNO3 (1, 2) и медь(II)-
дигидразид адипиновой кислоты (L')-L-гистидин
pH
(HisH)-вода-1.0 М. KNO3 (3, 4). 1 - сCu(II) = 5.02×
10-3 моль/л, cL = 5.07×10-3 моль/л, cHisH = 5.17×
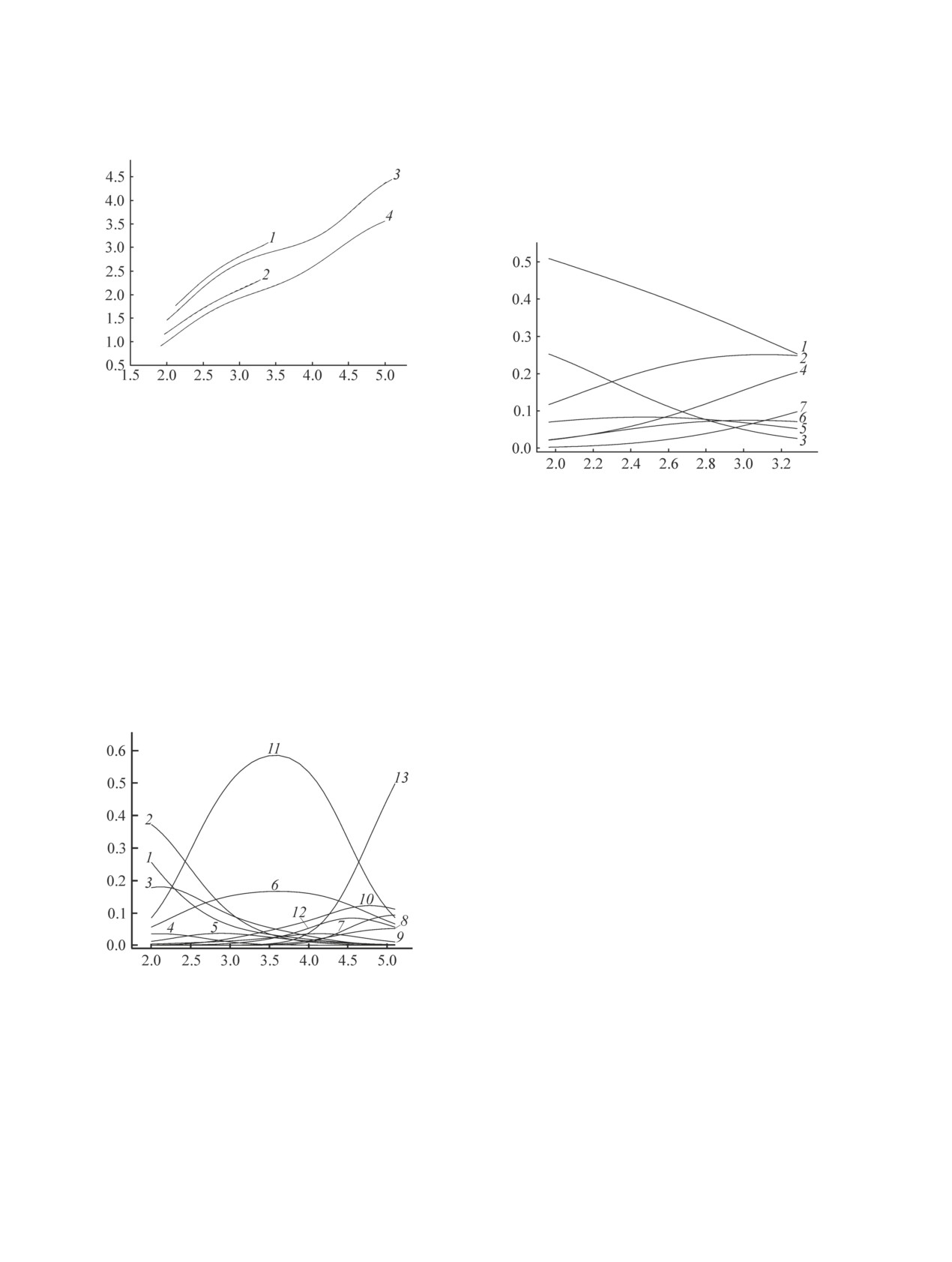
Рис. 3. Диаграмма долевого распределения комплекс-
10-3 моль/л; 2 - cCu(II) = 9.76×10-3 моль/л, сL = 4.93×
ных форм в системе медь(II)-дигидразид малоновой
10-3 моль/л, сHisH = 9.88×10-3 моль/л; 3 - сCu(II) =
кислоты (L)-L-гистидин (HisH)-вода-1.0 М. KNO3;
2.99×10-3 моль/л, c'L = 3.08×10-3 моль/л, cHisH =
сCu(II) = 9.76×10-3, сL = 4.93×10-3 моль/л, сHisH =
3.08×10-3 моль/л; 4 - сCu(II) = 2.99×10-3 моль/л, c'L =
9.88×10-3 моль/л. 1 - Cu2+, 2 - CuL2+, 3 - Cu(LH)3+,
1.56×10-3 моль/л, cHisH = 3.08×10-3 моль/л, 25.0°C.
4 - Cu(HisH)2+, 5 - Cu2L4+, 6 - Cu2L24+, 7 - Cu(HisH)L2+.
творах заметных количеств гетеролигандной ча-
констант устойчивости гетеро- и двух соответству-
стицы Cu(His)(L)+ объясняется ограниченностью
ющих гомолигандных комплексов (ΔlgK = lgβMAB -
доступного для исследования диапазона рН ≤ 3.4.
lgβMA - lgβMB) близки к ожидаемым на осно-
ве статистических соображений (ΔlgKстат
=
Для гетеролигандных комплексов Cu(HisH)L2+
–0.90 [11, 12]), в то время как для соединения
и Cu(HisH)(L')2+ разности между логарифмами
Cu(His)(L')+ наблюдается некоторая экстрастаби-
α
лизация (ΔlgK = -0.503).
Квантово-химические расчеты структур гетеро-
лигандных комплексов выполнены с учетом уста-
новленной ранее пентакоординации соединений
меди(II) в растворах [13-15]. В первую координа-
ционную сферу каждого комплекса была включе-
на только одна молекула воды, а эффект осталь-
ных молекул растворителя учтен в рамках конти-
нуальной модели C-PCM [16]. Как показали рас-
четы (рис. 5), в комплексах Cu(HisH)(L)2+·H2O и
Cu(HisH)(L')2+·H2O реализуется цепь водородных
pH
связей между протонированной имидазольной
Рис. 4. Диаграмма долевого распределения комплекс-
группой гистидина и атомом кислорода гидразид-
ных форм в системе медь(II)-дигидразид адипиновой
ного фрагмента через аксиально координирован-
кислоты (L')-L-гистидин (HisH)-вода-1.0 М. KNO3.
ную молекулу воды.
сCu(II) = 2.99×10-3 моль/л, с'L = 3.08×10-3 моль/л, сHisH =
(L')4+,
3.08×10-3 моль/л. 1 - Cu2+, 2 - Cu(L'Н)3+, 3 - Cu2
Из рис. 5 следует, что цис-структуры гетероли-
4+, 5 - Cu(L'H)(L')3+, 6 - Cu(L')2+, 7 -
4 - Cu(L'H)2
гандных комплексов Cu(His)(L)+·H2O и Cu(His)(L')+·
Cu(HisH)(His)+, 8 - Cu(His)+, 9 - Cu(HisH)2+, 10 -
H2O, в которых молекула воды несколько смещена
Cu(L')22+, 11 - Cu2(L')24+, 12 - Cu(HisH)(L')2+, 13 -
Cu(His)(L')+.
из аксиального положения, энергетически более
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
ГЕТЕРОЛИГАНДНЫЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ МЕДИ(II)
429
cis-Cu(HisH)(L)2+∙H2O
cis-Cu(HisH)(L')2+∙H2O
cis-Cu(HisH)(L)+∙H2O
E = -2754.17417 а.е.
E = -2872.09450 а.е.
E = -2753.74331 а.е.
cis-Cu(HisH)(L')+∙H2O
trans-Cu(HisH)(L)+∙H2O
trans-Cu(HisH)(L')+∙H2O
E = -2871.65134 а.е.
E = -2753.74012 а.е.
E = -2871.65079 а.е.
Рис. 5. Структуры и энергии изомеров гетеролигандных комплексов меди(II) с L-гистидином и дигидразидами малоновой
(L) и адипиновой (L') кислот, оптимизированные в расчетах методом DFT по программе GAMESS на уровне CAM-B3LYP/
TZVP с учетом эффекта растворителя в модели C-PCM.
выгодны, чем соответствующие транс-структуры.
KNO3 задавали по их точным навескам. Солевой
Это объясняется проявлением транс-влияния в
фон создавали введением перекристаллизованно-
комплексах меди(II), при котором наиболее силь-
го из водного раствора нитрата калия марки ХЧ.
ные транс-лигандные фрагменты (группы NH2)
Этот фон поддерживали как в титруемых, так и в
не располагаются на одной координате. Такой
титрующих растворах. Для удаления следов кар-
эффект был установлен ранее для гомолиганд-
бонатов исходные свежие насыщенные растворы
ных комплексов меди(II) c L/DL-гистидином [7].
KОН очищали декантацией и выдерживали в ат-
Проявление трансвлияния в гетеролигандных ком-
мосфере аргона. Титрующие и титруемые раство-
плексах меди(II) с гистидином и гидразидами ди-
ры продували аргоном в течение всей процедуры
карбоновых кислот установлено впервые.
титрования. Применяли только свежеприготовлен-
ные растворы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Титрование выполняли на автоматических ти-
В работе использованы нитрат меди(II) марки
траторах Basic Titrino 794 (Metrohm) со стеклян-
ХЧ, L-гистидин фирмы «Reanal», дигидразид ади-
ными электродами Metrohm 6.0228.000 и
907
пиновой кислоты марки ХЧ. Дигидразид малоно-
Titrando (Metrohm) со стеклянными электродами
вой кислоты синтезировали по реакции Курциуса
Metrohm 6.0258.010 в условиях термостатирова-
действием диэтилового эфира малоновой кислоты
ния (25.0±0.1°С). Точность измерений pH была
на гидразингидрат по стандартной методике [17] с
проверена в специальных экспериментах и со-
последующей перекристаллизацией из воды и эта-
ставляла в среднем ±0.001 лог. ед. Тангенс угла
нола и высушиванием при 60°С; чистоту продук-
наклона калибровочной зависимости составлял
та реакции проверяли по температуре плавления.
1.000±0.001. О воспроизводимости результатов
Перед применением все соединения очищали пе-
судили по полному соответствию рН стандартных
рекристаллизацией из водно-спиртового раствора.
буферных растворов до и после титрования.
Концентрацию меди(II) определяли иодоме-
Электронные спектры растворов регистриро-
трически, концентрации лигандов и фоновой соли
вали на спектрофотометре PerkinElmer Lambda
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
430
ТРОШАНИН и др.
EZ-210 в кювете толщиной 1.0 см. Оптическую
8.
Афанасьева Г.В., Бычкова Т.И., Штырлин В.Г., Ша-
кирова А.Р., Захаров А.В. // ЖОХ. 2006. Т. 76. № 5.
плотность растворов определяли при 25.0°С (тер-
С. 794; Afanas’eva G.V., Bychkova T.I., Shtyrlin V.G.,
мостатирование) с точностью 0.001 лог. ед. по от-
Shakirova A.R., Zakharov A.V. // Russ. J. Gen. Chem.
ношению к раствору в отсутствие меди(II).
2006. Vol. 76. N 5. P. 757. doi 10.1134/S1070363206050185
Обработка экспериментальных данных выпол-
9.
Бычкова Т.И., Афанасьева Г.В., Ижболдина Э.В. //
нена по программе STALABS [18, 19], c помощью
Уч. записки Казанск. унив. Сер. Естеств. науки.2009.
которой рассчитаны параметры равновесий обра-
Т. 151. Кн. 4. С. 39.
зующихся комплексов.
10.
Яцимирский К.Б., Крисс Е.Е., Гвяздовская В.Л. Кон-
станты устойчивости комплексов металлов с биоли-
Структуры изомеров ряда гетеролигандных
гандами. Киев: Наукова думка, 1979. 228 с.
комплексов были оптимизированы в расчетах
11.
Sigel H. // IUPAC Coord. Chem. 20. Invit. Lect. 20th Int.
методом теории функционала плотности (DFT)
Conf. Coord. Chem. Calcutta, 1979. Oxford; New York:
[20] по программе GAMESS (US) [21] с помощью
Pergamon Press, 1980. P. 27.
трехпараметрического обменного функционала
12.
Бек М., Надьпал И. Исследование комплексообразо-
Becke [22] и корреляционного функционала Lee-
вания новейшими методами. М.: Мир, 1989. 413 с.
13.
Bukharov M.S., Shtyrlin V.G., Mukhtarov A.Sh., Ma-
Yang-Parr [23] в известной модификации CAM-
min G.V., Stapf S., Mattea C., Krutikov A.A., Il’in A.N.,
B3LYP [24], а также полноэлектронного базисного
Serov N.Yu. // Phys. Chem. Chem. Phys. 2014. Vol. 16.
набора Schäfer и др. [25], TZVP. Для учета эффек-
N 20. P. 9411. doi 10.1039/c4cp00255e
тов растворителя была использована модель по-
14.
Bukharov M.S., Shtyrlin V.G., Mamin G.V., Stapf S.,
ляризуемого континуума (С-PCM) [16]. Во всех
Mattea C., Mukhtarov A.Sh., Serov N.Yu., Gilyazetdi-
расчетах критерий толерантности при оптимиза-
nov E.M. // Inorg. Chem. 2015. Vol. 54. N 20. P. 9777.
ции энергии составлял 10-5 Хартри. Расчеты вы-
doi 10.1021/acs.inorgchem.5b01467
15.
Bukharov M.S., Shtyrlin V.G., Gilyazetdinov E.M.,
полнены с использованием кластеров Казанского
Serov N.Y., Madzhidov T.I. // J. Comput. Chem. 2018.
федерального университета и Межведомственного
Vol. 39. N 14. P. 821. doi 10.1002/jcc.25154
суперкомпьютерного центра РАН.
16.
Cossi M., Rega N., Scalmani G., Barone V. // J. Comput.
КОНФЛИКТ ИНТЕРЕСОВ
Chem. 2003. Vol. 24. N 6. P. 669. doi 10.1002/jcc.10189
17.
Смит П.А.С. Органические реакции. М.: ИЛ, 1951.
Авторы заявляют об отсутствии конфликта
Ч. 3. С. 322.
интересов.
18.
Krutikov A.A., Shtyrlin V.G., Spiridonov A.O.,
Serov N.Yu., Il’yin A.N., Bukharov M.S., Gilyazetdi-
СПИСОК ЛИТЕРАТУРЫ
nov E.M. // J. Phys. 2012. Vol. 394. Р. 012031. doi
1. Фридман Я.Д., Сванидзе О.П., Долгашова Н.В., Го-
10.1088/1742-6596/394/1/012031
горишвили П.В. // Изв. АН Киргиз. ССР. 1973. № 6.
19.
Shtyrlin V.G., Gilyazetdinov E.M., Serov N.Yu., Pyreu D.F.,
С. 54.
Bukharov M.S., Krutikov A.A., Aksenin N.S., Gizatul-
2. Фридман Я.Д., Сванидзе О.П., Долгашова Н.В., Го-
lin A.I., Zakharov A.V. // Inorg. Chim. Acta. 2018.
горишвили П.В. // ЖНХ. 1974. Т. 19. № 12. С. 3304.
Vol. 477. P. 135. doi 10.1016/j.ica.2018.02.018
3. Каркарашвили М.В., Бешкенадзе И.А. // Иссл. в обл.
20.
Kohn W., Becke A.D., Parr R.G. // J. Phys. Chem. 1996.
химии компл. и простых соед. некоторых переход-
Vol. 100. N 31. P. 12974. doi 10.1021/jp960669l
ных и редких металлов. 1978. Вып. 3. С. 32.
21.
Schmidt M.W., Baldridge K.K., Boatz J.A., Elbert S.T.,
4. Каркарашвили М.В., Бешкенадзе И.А. // Иссл. в обл.
Gordon M.S., Jensen J.H., Koseki S., Matsunaga N.,
химии компл. и простых соед. некоторых переход-
Nguyen K.A., Su S.J., Windus T.L., Dupuis M.,
ных и редких металлов. 1978. Вып. 3. С. 44.
Montgomery J.A. // J. Comput. Chem. 1993. Vol. 14.
5. Трошанин Н.В., Разрывина А.А., Гилязетдинов Э.М.,
N 11. P. 1347. doi 10.1002/jcc.540141112
Бычкова Т.И., Штырлин В.Г. // Уч. записки Казанск.
22.
Becke A.D. // J. Chem. Phys. 1993. Vol. 98. N 7. P. 5648.
унив. Сер. Естеств. науки. 2017. Т. 159. Кн. 1. С. 40.
doi 10.1063/1.464913
6. Бычкова Т.И., Штырлин В.Г., Захаров А.В. // ЖНХ.
23.
Lee C.T., Yang W.T., Parr R.G. // Phys. Rev. (B). 1988.
1989. Т. 34. № 11. С. 2820.
Vol. 37. N 2. P. 785. doi 10.1103/PhysRevB.37.785
7. Shtyrlin V.G., Zyavkina Yu.I., Gilyazetdinov E.M.,
24.
Yanai T., Tew D.P., Handy N.C. // Chem. Phys. Lett.
Bukharov M.S., Krutikov A.A., Garipov R.R., Mukhta-
2004. Vol. 393. P. 51. doi 10.1016/j.cplett.2004.06.011
rov A.S., Zakharov A.V. // Dalton Trans. 2012. Vol. 41.
25.
Schäfer A., Huber C., Ahlrichs R. // J. Chem. Phys.
P. 1216. doi 10.1039/c1dt11309g
1994. Vol. 100. N 8. P. 5829. doi 10.1063/1.467146
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
ГЕТЕРОЛИГАНДНЫЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ МЕДИ(II)
431
Heteroligand Complexes of Copper(II)
with Malonic and Adipic Acids Dihydrazides and L-Histidine
N. V. Troshanin*, E. M. Gilyazetdinov, T. I. Bychkova, and V. G. Shtyrlin
Kazan (Volga Region) Federal University, Kazan, 420008 Russia
* e-mail: nikita-vt@mail.ru
Received July 28, 2019; revised July 28, 2019; accepted August 5, 2019
Using the methods of pH metry and mathematical modeling, we studied the complexation in copper(II)-malonic
(L)/adipic acid (L')-L-histidine (HisH) ternary systems in an aqueous medium against a 1.0 M. KNO3 solution
at 25.0°C. The stability constants of heteroligand complexes (1:1:1) were determined. Quantum chemical cal-
culations of the structures of heteroligand complexes were performed. It was revealed that the Cu(His)(L)+ and
Cu(His)(L')+ complexes exist predominantly in a cis-form.
Keywords: pH-metry, copper(II), heteroligand complexes, complex stability
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020