ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 3, с. 432-440
УДК 541.49;547.556.93;544.18
СИНТЕЗ И ФИЗИКО-ХИМИЧЕСКОЕ
ИССЛЕДОВАНИЕ ФТАЛАЗИНИЛГИДРАЗОНА
2-АМИНОПИРИДИН-3-КАРБАЛЬДЕГИДА И
КОМПЛЕКСОВ МЕТАЛЛОВ НА ЕГО ОСНОВЕ
© 2020 г. Л. Д. Поповa,*, Е. А. Распоповаa, С. А. Бородкинa, Ю. П. Туполоваa,
С. И. Левченковa,b, И. Н. Щербаковa
a Южный федеральный университет, ул. Зорге 7, Ростов-на-Дону, 344090 Россия
b Федеральный исследовательский центр «Южный научный центр Российской академии наук»,
Ростов-на-Дону, 344006 Россия
*e-mail: ldpopov@mail.ru
Поступило в Редакцию 2 августа 2019 г.
После доработки 2 августа 2019 г.
Принято к печати 6 августа 2019 г.
Конденсацией 2-аминопиридин-3-карбальдегида с 1-гидразинофталазином получен новый гетарилги-
дразон и изучена его комплексообразующая способность по отношению к ионам некоторых металлов. В
зависимости от природы металла и кислотного остатка образуются комплексные соединения различного
состава и строения.
Ключевые слова: гетарилгидразоны, 1-гидразинофталазин, квантово-химические расчеты, металло-
комплексы, магнетохимия
DOI: 10.31857/S0044460X20030138
Гетарилгидразоны
- продукты конденсации
ного состава и строения [11-20]. Описаны немно-
гетероциклических гидразинов и карбонильных
гочисленные примеры гидразонов 2-аминопири-
соединений - обладают выраженной и разноо-
дин-3-карбальдегида, главным образом семи(тио-
бразной биологической активностью [1, 2], вы-
семи)карбазоны и их металлокомплексы [21-25],
сокой комплексообразующей способностью [3],
обладающие антибактериальной активностью.
фотохромными свойствами [4, 5], электропрово-
Гидразон 1 получен конденсацией 2-аминопи-
дностью [6], используются как эффективные ана-
ридин-3-карбальдегида с гидрохлоридом 1-гидра-
литические реагенты на ионы металлов [2, 7, 8] и
зинофталазина в этаноле в присутствии ацетата
т. д. Присутствие в лиганде гетероароматического
натрия (схема 1) и идентифицирован на основании
фрагмента существенно влияет как на строение
данных элементного анализа, ИК, ЯМР 1Н и элек-
комплексных соединений, так и на их магнитные,
тронной спектроскопии.
спектральные и другие свойства.
В спектре ЯМР 1Н соединения 1 в ДМСО-d6
Для синтеза нового гетарилгидразона нами
наблюдаются синглет группы NH2 пиридиново-
использован
2-аминопиридин-3-карбальдегид и
го фрагмента в области 7.22 м. д., несколько сиг-
1-гидразинофталазин. Для 1-гидразинофталазина
налов ароматических протонов в области 7.65-
(гидралазина) и его производных характерна вы-
8.27 м. д., синглет протона азометиновой группи-
раженная гипотензивная и противовоспалитель-
ровки в области 8.54 м. д. и синглет протона группы
ная активность [9-12]. Гидразоны гидралазина
NH гидразинного фрагмента в области 12.13 м. д.
образуют устойчивые металлокомплексы различ-
Интенсивность сигналов при 7.22 и 12.13 м. д.
432
СИНТЕЗ И ФИЗИКО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ ФТАЛАЗИНИЛГИДРАЗОНА
433
Схема 1.
H
H2N
N
N
CHO
C N
N
N
C2H5OH, ∆
HN
+
HN
CH3COONa
HCl
N NH2
N NH2
1 (H3L)
при добавлении D2О значительно уменьшается,
интенсивной из которых является полоса при λ =
что свидетельствует об их обменном характере
391 нм (lgε = 4.61) (рис. 2). При добавлении в рас-
и способности замещаться на ионы металла, что
твор соляной кислоты происходит гипсохромный
подтверждает их отнесение к группам NH2 и NH.
сдвиг длинноволновой полосы, сопровождающий-
В ИК спектре соединения 1 в вазелиновом масле
ся гиперхромным эффектом, и появляются две
полосы при 364 и 380 нм, что свидетельствует о
наблюдаются полосы валентных колебаний свя-
протонировании атомов азота молекулы. На наш
зей в группе NH2 в области 3435 и 3377 см-1 и в
взгляд, протонирование происходит по атому азо-
группах гидразинометинового фрагмента NH при
та фталазинового фрагмента. В коротковолновой
3274 см-1 и CH=N при 1627см-1. Полосы валент-
части спектра также наблюдаются изменения: ис-
ных колебаний связей C=C и CH=N гетероцикли-
чезает полоса при 269 нм и появляются две новых
ческих фрагментов находятся в области 1500-
полосы при 256 и 309 нм.
1600 см-1.
В сильнощелочной среде в сравнении с нейтраль-
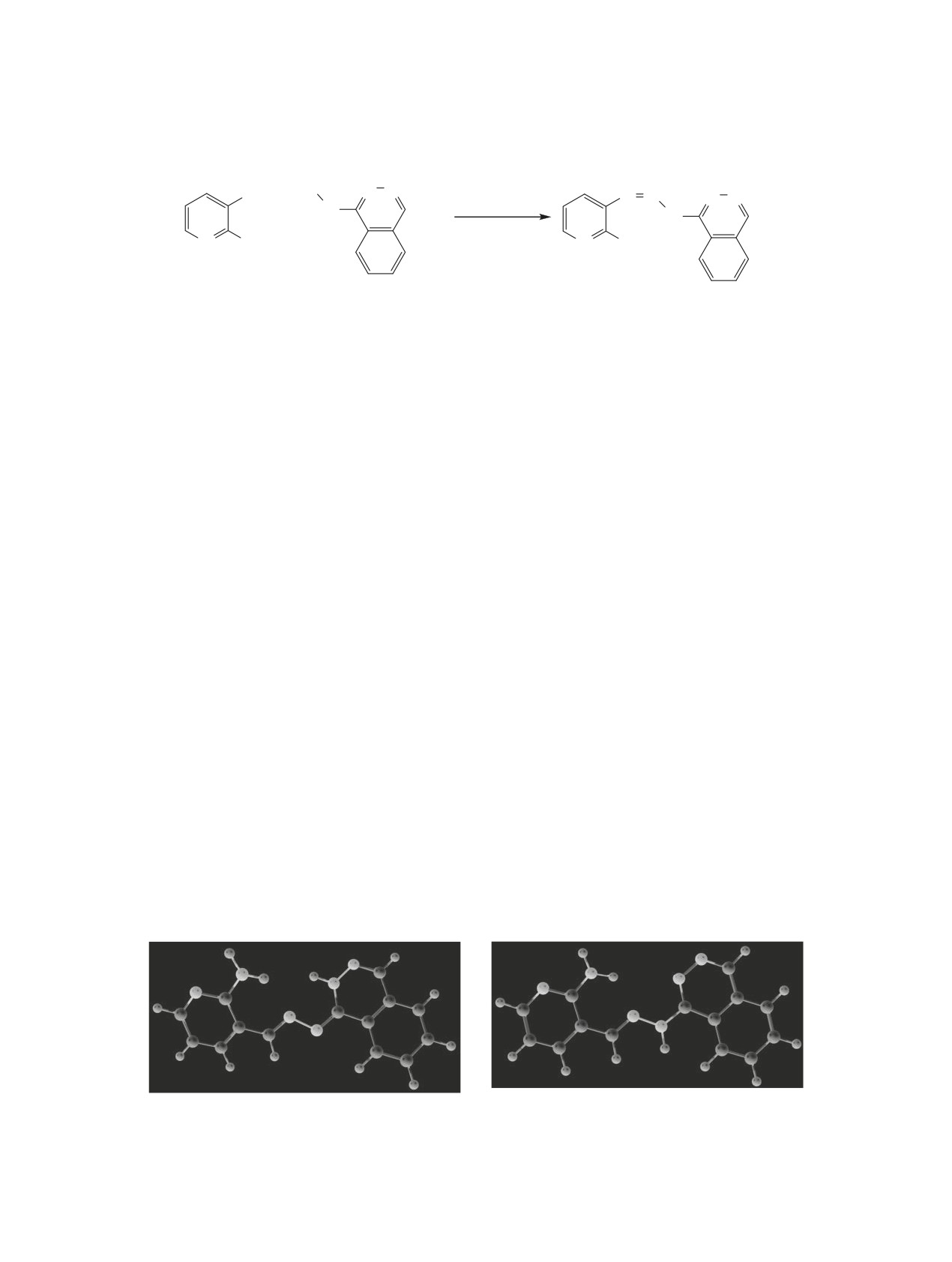
Для гидразона возможна реализация несколь-
ной средой не наблюдается существенных изме-
ких таутомерных форм, наиболее предпочтитель-
нений спектра, лишь появляется небольшое плечо
ными из которых представляются формы 1а и 1б, в
в длинноволновой области при 430 нм, что свиде-
которых образуется внутримолекулярная водород-
тельствует о слабом депротонировании гидразона.
ная связь (рис. 1).
Для интерпретации ЭСП был выполнен кван-
Согласно данным квантово-химических рас-
тово-химический расчет спектров наиболее устой-
четов, наиболее стабильна фталазонная форма 1а
чивых таутомеров. Данные расчетов удовлетвори-
как в газовой фазе, так и в этаноле (см. таблицу).
тельно совпадают с экспериментальными данны-
Энергетическое преимущество формы 1а дости-
ми, что подтверждает существование полученного
гается за счет образования внутримолекулярных
соединения 1 в этанольном растворе в форме 1а.
водородных связей групп NH и NH2 с азометино-
Самая высокоинтенсивная длинноволновая поло-
выми атомами азота. Молекула имеет практиче-
са поглощения, отвечающая π-π-переходам в гете-
ски плоское строение. Преобладание фталазонной
роциклических фрагментах, по данным расчетов,
формы по сравнению с другими характерно и для
должна находиться при 389 нм. В эксперименталь-
большинства других фталазинилгидразонов [17].
ных спектрах она находится при 391 нм.
В электронном спектре поглощении гидразона
Многие гидразоны обладают сольватохромией,
1 в этаноле наблюдается серия полос, наиболее
поэтому нами были сняты ЭСП в растворителях с
1а
1б
Рис. 1. Общий вид наиболее устойчивых конформеров соединения 1 по данным расчетов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
434
ПОПОВ и др.
Полная энергия и относительная устойчивость таутомерных форм соединения 1 в вакууме и в этаноле
E, a.e.
ΔE, ккал/моль
Форма
вакуум
этанол
вакуум
этанол
1a
-869.4200213
-869.4429378
0.00
0.00
1б
-869.4034041
-869.437028
10.43
3.71
различной полярностью (рис. 3). Как видно, наи-
растворе как минимум двух форм, скорее всего ли-
большее влияние на ЭСП гидразона 1 оказывают
ганда и комплекса (рис. 4).
ДМСО и формамид, имеющие наибольшую диэ-
Иная картина наблюдается при добавлении
лектрическую проницаемость. Это связано с воз-
перхлората меди(II) (рис. 5). В данном случае изо-
можным π-π-взаимодействием между молекулами
бестических точек в ЭСП не наблюдается, что сви-
гидразона 1 и растворителя.
детельствует о более сложном равновесии в рас-
Наличие в молекуле гидразона 1 нескольких
творах (три и более форм).
донорных центров, подвижных протонов, свя-
Мы попытались установить состав образующе-
занных системой сопряженных связей, позволяет
гося в этаноле комплекса на примере соли нике-
предположить образование устойчивых металло-
ля(II) методом изомолярных серий. Максимальное
комплексов. Комплексообразующая способность
поглощение в ЭСП имеет комплекс состава М:Н3L =
соединения 1 была изучена как в растворах, так и
1:2, что позволяет предположить участие в коор-
в конденсированном состоянии.
динации лиганда к иону металла в монодепрото-
нированной форме.
При добавлении солей двухвалентных металлов
к спиртовом раствору гидразона 1 (Н3L) в разных
Препаративно выделен ряд комплексов гидра-
соотношениях М:Н3L, мы наблюдали смещение
зона 1 с медью(II), никелем(II), кобальтом(II) и
полос в ЭСП и образование новых. В присутствии
цинком(II) разного состава (схема 2).
перхлората кобальта(II), никеля(II) и железа(II)
При взаимодействии гидразона 1 и ацетата
наблюдаются две изобестические точки в области
меди в соотношении 1:1 выделен комплекс 2, эле-
420 и 320 нм, что свидетельствует о равновесии в
ментный анализ которого соответствует формуле
D
D
λ, нм
λ, нм
Рис. 2. Электронные спектры поглощения раствора
Рис. 3. Электронные спектры поглощения гетарил-
гидразона 1 (с = 2×10-5 моль/л) в водно-спиртовом
гидразона 1 в растворителях различной полярности.
растворе в кислой (1), щелочной (2) и нейтральной
1 - ДМСО, 2 - 1,1,2,2-тетрахлорэтан, 3 - формамид,
(3) средах.
4 - этанол, 5 - ацетонитрил, 6 - 1,4-диоксан.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
СИНТЕЗ И ФИЗИКО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ ФТАЛАЗИНИЛГИДРАЗОНА
435
Схема 2.
Схема 3.
[CuHL]2
M(H2L)2
2
3, 4
N
H
C N
N N
H
N
N
Cu
Cu
N N
H
H3L
N
N
N C
1
H
N
2
Комплекс 2 парамагнитен; в расчете на 1 ион
Co(H2L)2ClO4
MH2LX
меди величина эффективного магнитного момента
8
5-7
μэфф = 1.23 М. Б. (298 K) понижается до 0.55 М. Б.
M(II) = Cu (3, 6, 6), Zn (4), Ni (7);
при 77.4 K. Рассчитанная величина обменного
X = Cl (5), ClO4 (6, 7).
параметра 2J = -401 см-1 (g = 2.15, мольная доля
парамагнитной примеси f = 0.07) свидетельству-
CuHL (HL - дважды депротонированная форма
ет о сильном антиферромагнитном взаимодей-
лиганда). В ИК спектре комплекса 2 в области
ствии между ионами меди в биядерной молекуле.
3100-3450 см-1, в отличие от ИК спектра гидра-
Величина 2J в комплексе 2 близка к величинам
зона 1, наблюдается лишь одна полоса, а не три.
обменного параметра в комплексах меди(II) с фта-
Полосы поглощения связи C=N гидразонного
лазинилгидразонами производных салицилового
и фталазинного фрагментов смещаются на 10-
альдегида, в которых димеризация осуществляет-
20 см-1 в низкочастотную область. Это свидетель-
ся через атомы фталазинового фрагмента с обра-
ствует о том, что эти группы участвуют в коорди-
зованием шестичленного цикла Cu-N-N'(N''-N''')-
нации с ионом металла.
Cu (схема 3) [18].
D
D
λ, нм
λ, нм
Рис. 4. Спектр поглощения гидразона 1 в присутствии
Рис. 5. Спектр поглощения гидразона 1 в присутствии
перхлората кобальта(II) при разных соотношениях
перхлората меди(II) при разных соотношениях М:Н3L.
М:Н3L. 1 - гидразон 1, 2 - 1:2, 3 - 1:1, 4 - 1.5:1.
1 - гидразон 1, 2 - 1:2, 3 - 1:1, 4 - 1.5:1, 5 - 2:1.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
436
ПОПОВ и др.
Схема 4.
Схема 5.
H
H
N
N
H
H
C N
N N
C N
N N
M
M/2
N N
N N
H
H
X
3, 4
5_7
M = Cu (3), Zn (4).
(6);
M = Cu, X = Cl (5); M = Cu, X = ClO4
При взаимодействии ацетатов меди(II) и цин-
M = Ni, X = ClO4 (7).
ка(II) с гидразоном 1 в соотношении 1:2 были
выделены комплексы M(H2L)2 3 и 4 (схема 4). В
О наличии перхлорат-иона в составе комплексов
ИК спектрах комплексов 3 и 4 наблюдаются две
свидетельствует появление широкой высокоин-
широких полосы поглощения групп NH в области
тенсивной полосы поглощения в области 1090-
3250-3450 см-1 и понижение частоты валентных
1120 см-1.
колебаний азометиновой связи на 15-30 см-1.
Магнетохимические измерения показали, что
Медный комплекс 3 парамагнитен; величи-
медный комплекс 6 парамагнитен, μэфф = 1.97 М. Б.
на эффективного магнитного момента 2.02 М. Б.
(298 K) не изменяется при понижении температу-
(298 K) не изменяется при понижении температу-
ры до 77.4 K, что свидетельствует об образовании
ры, что свидетельствует о моноядерном строении
моноядерного комплекса. Комплекс никеля 7 ди-
металлохелата.
амагнитен, что доказывает образование металло-
Спектр ЯМР цинкового комплекса 4 снять не
комплекса с плоским строением хелатного узла.
удалось, поскольку он практически нерастворим в
Спектр ЯМР никелевого комплекса снять не уда-
большинстве органических растворителей, вклю-
лость, так как он практически нерастворим в боль-
чая ДМСО.
шинстве органических растворителей, включая
ДМСО. На основании приведенных выше данных
При взаимодействии гидразона 1 с хлоридом
комплексам 5-7 можно приписать предположи-
меди(II) в соотношении 1:1 выделен комплекс
тельно следующее строение (схема 5).
CuН2LCl 5. В ИК спектре комплекса 5 наблюда-
ются две полосы поглощения валентных колеба-
При взаимодействии гидразона 1 с перхлора-
ний групп NH в области 3264 и 3229 см-1. Полоса
том кобальта неожиданно был выделен комплекс
поглощения группы CH=N смещается в коротко-
Co(H2L)2ClO4 8, в котором в процессе комплек-
волновую область на 10 см-1, а частота одной из
сообразования произошло окисление Co(II) до
полос циклической группы C=N увеличивается
Co(III), скорее всего, кислородом воздуха. Это
на 10 см-1 по сравнению со спектром гидразона
предположение подтверждается данными магнето-
1. Магнетохимическое измерение показало, что
химических измерений. Комплекс 8 диамагнитен,
комплекс парамагнитен, μэфф = 1.93 М. Б. (298 K)
что однозначно свидетельствует об образовании
практически не изменяется при понижении темпе-
металлохелата с ионом трехвалентного кобальта.
ратуры до 77.4 K, что свидетельствует об отсут-
В спектре ЯМР 1Н комплекса 8 в ДМСО-d6 на-
ствии магнитного обменного взаимодействия и o
блюдается синглет протона группы NH гидразин-
моноядерном строении комплекса.
ного фрагмента в области 11.46 м. д., в области
При взаимодействии гидразона 1 с перхлората-
5.88 м. д. наблюдается синглет группы NH, связан-
ми меди(II) и никеля(II) в соотношении 1:2 были
ной с пиридиновым фрагментом. Оба сигнала ис-
выделены комплексы M(H2L)ClO4 6 и 7. В ИК
чезают при добавлении D2О вследствие их обмен-
спектрах комплексов 6 и 7 наблюдаются аналогич-
ного характера. Сигнал протона группы CH=N, по
ные изменения, как и в ИК спектре комплекса 5.
сравнению со спектром гидразона 1, смещается
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
СИНТЕЗ И ФИЗИКО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ ФТАЛАЗИНИЛГИДРАЗОНА
437
ным методом Фарадея в интервале температур
Схема 6.
77.4-300 K при напряженности магнитного поля
9000 Э. Установку калибровали по комплексу
Hg[Co(CNS)4]. Температурную зависимость маг-
H
нитной восприимчивости комплексов интерпре-
N
H
тировали в рамках модели изолированного об-
C N
N N
менного кластера Гейзенберга-Дирака-Ван Флека
ClO4
[27, 28]. Параметр 2J антиферромагнитного об-
Co/2
N N
менного взаимодействия рассчитывали с помощью
H
модифицированного уравнения Блини-Бауэрса (1)
[29], учитывающего присутствие в комплексе не-
8
которой доли парамагнитной примеси.
2
2
на 0.3 м. д. в слабое поле и проявляется в области
2N
A
g
β
χ'
=
M
8.85 м. д. Сигналы ароматических протонов (8Н)
3kT
−1
регистрируются в области 6.3-8.3 м. д.
1
-2J
⋅(1−
f
)
1+
exp
+
f ⋅S(S
+1)+
N
(1)
Низкоспиновое состояние кобальта в ком-
3
kT
α
плексе 8 подтверждают две полосы поглощения
Здесь χ'M - молярная магнитная восприимчивость,
в спектре диффузного отражения в области 530 и
исправленная на диамагнетизм атомов по аддитив-
1427 нм, соответствующие переходам 1А1g→1Т1g
ной схеме Паскаля [27]; f - мольная доля парамаг-
и 1А1g→1Т2g, которые характерны для иона Со3+,
нитной примеси; Nα - температурно-независимый
находящегося в сильном поле лиганда [26].
парамагнетизм.
С учетом вышеизложенного, координацион-
Расчетные методы. Квантово-химический
ный полиэдр иона кобальта(II) представляет собой
расчет проводили в рамках теории функционала
искаженный октаэдр, и такому комплексу можно
плотности с использованием гибридного обмен-
приписать строение 8 (схема 6).
но-корреляционного функционала B3LYP [30] в
Таким образом, синтезированы новый гетарил-
валентно-расщепленном базисе гауссовых функ-
гидразон и металлокомплексы на его основе.
ций, расширенного поляризационными d-функци-
Показано, что в зависимости от условий синтеза
ями на тяжелых атомах 6-311G(d). Использовали
образуются как моноядерные, так и биядерные
программу Gaussian’09 [31]. Оптимизацию геоме-
металлохелаты. Моноядерные комплексы меди
трии проводили без ограничения по симметрии,
и никеля имеют, предположительно, плоское
минимумы поверхности потенциально энергии
строение хелатного узла, а кобальта - октаэдри-
характеризовали отсутствием мнимых частот
ческое, причем в процессе комплексообразования
рассчитанных нормальных колебаний. Влияние
происходит окисление Co(II) до Со(III).
среды учитывали в рамках модели непрерывной
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
поляризуемой среды (PCM) [32] с использовани-
ем параметров для растворителя (ДМСО), приня-
Элементный анализ выполнен на приборе
тых в программе Gaussian’09 по умолчанию. Для
PerkinElmer 240C в Лаборатории микроанализа
подготовки данных, презентационной графики,
Южного федерального университета. Спектры
визуализации результатов расчетов использовали
ЯМР
1Н получены на спектрометре Bruker
программу Chemcraft [33].
(300 МГц). ИК спектры зарегистрированы на
приборе Varian Scimitar 1000 FT-IR для образцов
Для синтеза гидразона 1 использовали коммер-
в вазелиновом масле в области 400-4000 см-1.
чески доступные гидрохлорид 1-гидразинофтала-
Электронные спектры сняты на приборе Varian
зина (Alfa Aesar) и 2-аминопиридин-3-карбальде-
Cary 5000 в области 200-800 нм.
гид (Aldrich).
Магнитную восприимчивость поликристал-
Фталазинилгидразон
2-аминопиридин-3-
лических образцов определяли относитель-
карбальдегида (1). К горячей суспензии 0.88 г
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
438
ПОПОВ и др.
(4.5 ммоль) гидрохлорида
1-гидразинофтала-
Комплекс Ni(H2L)ClO4 (7). Выход 68%, крас-
зина в 15 мл этанола добавляли раствор 0.55 г
ный аморфный порошок, т. пл. >300°С (разл.).
(4.5 ммоль) 2-аминопиридин-3-карбальдегида в
ИК спектр, ν, см-1: 3312 (NH), 3267 (NH), 1634
5 мл этанола. Смесь нагревали 10 мин и добавля-
(CH=N), 1599 (C=N), 1542, 1504, 1342, 1258, 1129,
ли 0.41 г (4.5 ммоль) безводного ацетата натрия.
1098 (ClO4), 1048, 954, 894, 759, 666, 624, 578.
Полученную смесь кипятили 5 ч, затем выливали
Найдено, %: С 39.5; H 2.8; Cl 8.3; N 19.5; Ni 14.3.
в 50 мл дистиллированной воды. Желтый осадок
C14H11ClN6NiO4. Вычислено, %: С 39.72; H 2.63;
отфильтровывали, промывали водой и этано-
Cl 8.41; N 19.94; Ni 13.93.
лом, затем перекристаллизовывали из бутан-1-
Комплексы состава 1:2 были получены анало-
ола. Выход 0.93 г (78%), желтые кристаллы, т. пл.
гично при соотношении М:1 = 1:2.
232°С. ИК спектр (вазелин), ν, см-1: 3435 (NH2),
Комплекс Cu(H2L)2 (3). Выход 64%, коричне-
3377 (NH2), 3274 (NH), 1627 (CH=N), 1577 (C=N),
вый аморфный порошок, т. пл. >300°С. ИК спектр,
1527, 1333, 1252, 1142, 753, 659, 612, 467. Спектр
ν, см-1: 3405(NH), 3327 (NH), 1600 (CH=N), 1538,
ЯМР 1Н (ДМСО-d6), δ, м. д. (J, Гц): 7.22 с (2Н,
1492, 1329, 1281, 1240, 1160, 1090, 1034, 943, 749,
NH2), 7.65-7.78 м (5H), 7.97 д (1Н, 4JНН = 3.6), 8.07
667, 597. Найдено, %: С 57.5; Н 4.1; N 28.9; Cu
c (1Н), 8.27 д (1Н, 3JНН = 7.8), 8.54 с (1Н, СH=N),
11.2. C28H22CuN12. Вычислено, %: С 57.01; H 3.73;
12.13 c (1Н, NH). Найдено, %: С 63.90; Н 4.0; N
N 28.48; Cu 10.77.
32.4. C14H12N6. Вычислено, %: С 63.66; H 4.54; N
31.80.
Комплекс Zn(H2L)2 (4). Выход 55%, оранже-
Общая методика синтеза комплексов состава
вый аморфный порошок, т. пл. >300°С. ИК спектр,
1:1. К кипящей суспензии гидразона
1
0.1 г
ν, см-1: 3392 (NH), 3338 (NH), 1614 (CH=N),
(0.4 ммоль) в 5 мл метанола добавляли раствор
1546, 1488, 1336, 1254, 1093, 1017, 948, 760, 603,
соответствующей соли металла в 5 мл метанола
574. Найдено, %: С 56.5; Н 4.1; N 28.6; Zn 11.3.
(0.4 ммоль). Смесь кипятили 5 ч. Осадок отделя-
C28H22N12Zn. Вычислено, %: С 56.83; H 3.72; N
ли, промывали кипящим метанолом и сушили в
28.39; Zn 11.05.
вакууме.
Комплекс Co(H2L)2ClO4 (8). Выход 63%, крас-
Комплекс CuHL (2). Выход 89%, зеленый
ный аморфный порошок, т. пл. >300°С (разл.). ИК
аморфный порошок, т. пл. >300°С. ИК спектр, ν,
спектр, ν, см-1: 3602 (NH), 3546 (NH), 3068, 1633
см-1: 3460 (NH), 1605 (CH=N), 1566 (C=N), 1506,
(CH=N), 1596 (C=N), 1493, 1258, 1239, 1099 (ClO4),
1339, 1243, 1146, 756, 664, 607, 458. Найдено,
1043, 890, 785, 747, 687, 622, 599. Спектр ЯМР 1Н
%: С 42.5; Н 3.2; Cu 19.9; N 26.0. C28H20Cu2N12.
(ДМСО-d6), δ, м. д. (J, Гц): 5.88 c (1Н, NH), 6.39 т
Вычислено, %: С 42.99; H 3.07; Cu 19.51; N 25.79.
(1Н, 3JНН = 6.6), 7.51 д (1Н, 3JНН = 6.6), 7.62 д. д
Комплекс CuН2LCl (5). Выход 59%, зеленый
(1Н, 3JНН = 6.9, 4JНН 2.4,), 7.71-7.75 м (2H), 8.02 д
аморфный порошок, т. пл. >300°С. ИК спектр, ν,
(1Н, 3JНН = 6.9), 8.14 c (1Н), 8.27 д. д (1Н, 3JНН =
см-1: 3264 (NH), 3229 (NH), 1638 (CH=N), 1587
6.3, 4JНН = 2.7), 8.85 c (1Н, CH=N), 11.46 c (1Н,
(C=N), 1490, 1465, 1353, 1328, 1262, 1212, 1095,
NH). Найдено, %: С 49.3; H 3.0; Cl 5.0; Co 8.3; N
1021, 748, 690, 575. Найдено, %: С 46.7; H 2.9; Cl
24.9. C28H22ClCoN12O4. Вычислено, %: С 49.10; H
9.9; Cu 17.0; N 23.4. C14H11ClCuN6. Вычислено, %:
3.24; Cl 5.18; Co 8.60; N 24.54.
С 46.41; H 3.06; Cl 9.79; Cu 17.54; N 23.20.
Исследование выполнено с использовани-
Комплекс Cu(H2L)ClO4 (6). Выход 53%, тем-
ем оборудования Центров коллективного поль-
но-зеленый мелкокристаллический порошок, т. пл.
зования
«Молекулярная спектроскопия» и
>300°С (разл.). ИК спектр, ν, см-1: 3321 (NH), 3277
«Высокопроизводительные вычисления» Южного
(NH), 1642 (CH=N), 1598 (C=N), 1554, 1409, 1237,
федерального университета.
1118, 1100 (ClO4), 1063, 1040, 926, 875, 777, 759,
ФОНДОВАЯ ПОДДЕРЖКА
664, 621, 574. Найдено, %: С 39.2; H 2.8; Cl 8.0;
Cu 14.5; N 20.1. C14H11ClCuN6O4. Вычислено, %:
Работа выполнена при финансовой поддержке
С 39.45; H 2.60; Cl 8.32; Cu 14.91; N 19.71.
Южного федерального университета.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
СИНТЕЗ И ФИЗИКО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ ФТАЛАЗИНИЛГИДРАЗОНА
439
КОНФЛИКТ ИНТЕРЕСОВ
Meszaros Szecsenyi K.M. // Polyhedron. 2014. Vol. 80.
P. 142. doi 10.1016/j-poly.2014.03.007
Авторы заявляют об отсутствии конфликта
15.
Nfor E.N., Husian A., Majoumo-Mbe F., Njan I.N.,
интересов.
Offiong O.E., Bourne S.A. // Polyhedron. 2013. Vol. 63.
P. 207. doi 10.1016/j. poly.2013.07.028
СПИСОК ЛИТЕРАТУРЫ
16.
Попов Л.Д., Левченков С.И., Щербаков И.Н.,
1.
Popp F.D. // Eur. J. Med. Chem. 1989. Vol. 24. N 3.
Александров Г.Г., Cтарикова З.А., Луков В.В.,
P. 313. doi 10.1016/0223-5234(89)90016-0
Коган В.А. // ЖСХ. 2015. Т. 56. № 1. С. 109; Po-
2.
Suvarapu L.N., Seo Y.K., Baek S.O., Ammireddy V.R. //
pov L.D., Levchenkov S.I., Shcherbakov I.N.,
E-Journal of Chemistry. 2012. Vol. 9. P.1288.
Aleksandrov G.G., Starikova Z.A., Lukov V.V., Ko-
gan V.A. // J. Struct. Chem. 2015. Vol. 56. N 1. P. 102.
3.
Попов Л.Д., Морозов А.Н., Щербаков И.Н., Туполо-
doi 10.1134/S002247661501012X
ва Ю.П., Луков В.В., Коган В.А. // Усп. хим. 2009.
17.
Попов Л.Д., Щербаков И.Н., Левченков С.И., Ту-
Т. 78. № 7. С. 697; Popov L.D., Morozov A.N.,
полова Ю.П., Бурлов А.С., Александров Г.Г., Лу-
Shcherbakov I.N., Tupolova Yu.P., Lukov V.V., Kogan
ков В.В., Коган В.А. // Коорд. хим. 2011. Т. 37.
V.A. // Russ. Chem. Rev. 2009. Vol. 78. N 7. P. 643. doi
№ 7. С. 483; Popov L.D., Shcherbakov I.N., Levchen-
10.1070/RC2009v078n07ABEH003890
kov S.I., Tupolova Yu.P., Burlov A.S., Aleksandrov G.G.,
4.
Первова И.Г., Мелкозеров С.А., Слепухин П.А., Липу-
Lukov V.V., Kogan V.A. // Russ. J. Coord. Chem. 2011.
нова Н.Г., Барачевский В.А., Липунов И.Н. // ЖОХ.
Vol. 37. N 7. P. 483. doi 10.1134/S1070328411060078
2010. Т. 80. Вып. 5. С. 817; Pervova I.G., Melkoze-
18.
Левченков С.И., Попов Л.Д., Щербаков И.Н.,
rov S.A., Slepukhin P.A., Lipunova N.G., Barachev-
skii V.A., Lipunov I.N. // Russ. J. Gen. Chem. 2010.
Власенко В.Г., Цатурян А.А., Белобородов С.С.,
Vol. 80. N 5. P. 987. doi 10/1134/S1070363210050221
Ионов А.М., Коган В.А. // ЖОХ. 2014. Т. 84. Вып. 10.
С. 1693; Levchenkov S.I., Popov L.D., Shcherbakov
5.
Bren V.A., Minkin V.I., Shepelenko E.N., Dubo-
I.N., Vlasenko V.G., Tsatutyan A.A., Beloborodov S.S.,
nosov A.D., Bushkov A.Ya. // Mendeleev Commun.
Ionov A.M., Kogan V.A. // Russ. J. Gen. Chem. 2014.
1991. Vol.
1. N
2. P.
72. doi
10.1070/
Vol. 84. N 10. P. 1970. doi 10.1134/S1070363214100193
MC1991v001n02ABEH000044.
19.
Попов Л.Д., Левченков С.И., Щербаков И.Н., Ми-
6.
Lygaitis R., Getantis V., Grazulevicins J.V. // Chem. Soc.
Rev. 2008. Vol. 37. N 4. P. 770. doi 10.1039/B702406C
нин В.В., Каймакан Э.Б., Туполова Ю.П., Ко-
7.
Usegi K., Sik L.J., Nishioka H., Kumagai T., Nagahiro T. //
ган В.А. // ЖОХ. 2010. Т. 80. Вып. 12. С. 2040; P-
Microchem J. 1994. Vol. 50. N 1. P. 88. doi 10.1006/
opov L.D., Levchenkov S.I., Shcherbakov I.N.,
mchj.1994.1062
Minin V.V., Kaimakan E.B., Tupolova Yu.P., Kogan V.A. //
8.
Singh R.B., Jain P., Singh R.P. // Talanta. 1982. Vol. 29.
Russ. J. Gen. Chem. 2010. Vol. 80. N 12. P. 2501. doi
N 2. P. 77. doi 10.1016/0039-9140(82)80024-6
10.1134/S1070363210120170
9.
Reece P.A. // Med. Res. Rev. 1981. Vol. 1. N 1. P. 73. doi
20.
Попов Л.Д., Левченков С.И., Щербаков И.Н., Ту-
10.1002/med.2610010105
полова Ю.П., Зубенко А.А., Мелкозерова И.Е., Лу-
10.
Arce C., Segura-Pacheco B., Perez-Cardanes E., Taja-
ков В.В., Коган В.А. // ЖОХ. 2010. Т. 80. Вып. 9.
Chayeb L., Candelaria M., Duecnas-Gonzalez A. // J.
С. 1535; Popov L.D., Levchenkov S.I., Shcherba-
Transl. Med. 2006. Vol. 4. N 1. P. 10. doi 10.1186/1479-
kov I.N., Tupolova Yu.P., Zubenko A.A., Melkozerova
5876-4-10
I.E., Lukov V.V., Kogan V.A. // Russ. J. Gen. Chem. 2010.
11.
Коган В.А., Левченков С.И., Попов Л.Д., Щерба-
Vol. 80. N 9. P. 1853. doi 10.1134/S1070363210090239
ков И.Н. // Рос. хим. ж. 2009. Т. 53. Вып. 1. С. 86;
21.
Chary M.R., Padmaja N., Ravinder M., Srihari. S. //
Kogan V.A., Levchenkov S.I., Popov L.D., Shcherba-
Orient. J. Chem. 2010. Vol. 26. N 3. P. 1159.
kov I.N. // Russ. J. Gen. Chem. 2009. Vol. 79. N 12.
22.
Ramachary M., Padmaja N., Ravinder M., Srihari S. //
P. 2767. doi 10.1134/S1070363209120354
J. Pharm. Chem. 2009. Vol. 3. N 3. P. 75.
12.
El-Sherif A.A., Shoukry M.M., Abd-Elgawad M.M.A. //
23.
Swamy J.R., Swamy B. // Orient. J. Chem. 1993. Vol. 9.
Spectrochim. Acta (A). 2012. Vol. 98. P. 307. doi
N 1. P. 38.
10.1016/j.saa.2012.08.034
24.
Swamy B., Swamy J.R. // Orient. J. Chem. 1990. Vol. 6.
13.
Bakale R.P., Ganesh N.N., Mangannavar C.V.,
N 2. P. 95.
Muchchandi I.S., Shcherbakov I.N., Frampton Ch.,
25.
Rao G.R., Chary M.T., Mogilaiah K., Swamy B.,
Gudasi K.B. // Eur. J. Med. Chem. 2014. Vol. 73. P. 38.
Sreenivasulu // J. Indian Chem. Soc. 1989. 66. N 1 P. 61.
doi 10.1016/j.ejmech.2013.11.037
26.
Ливер Э. Электронная спектроскопия неорганиче-
14.
Hollo B., Magyari J., Zivkovic-Radovanovic V.,
ских соединений. Т. 2. М.: Мир, 1987. С. 154.
Vuckovic G., Tomic Z.D., Szilagyi I.M., Pokol G.,
27.
Ракитин Ю.В., Калинников В.Т. Современная магне-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
440
ПОПОВ и др.
тохимия. СПб: Наука, 1994. 276 с.
Ogliaro F., Bearpark M., Heyd J.J., Brothers E., Ku-
28. Ракитин Ю.В. // Итоги науки и техники. Строение
din K.N., Staroverov V.N., Kobayashi R., Normand J.,
молекул и химическая связь. М.: ВИНИТИ, 1986.
Raghavachari K., Rendell A., Burant J.C., Iyengar S.S.,
Т. 10. С. 132.
Tomasi J., Cossi M., Rega N., Millam J.M., Klene M.,
29. Bleaney B., Bowers K.D. // Proc. R. Soc. London
Knox J.E., Cross J.B., Bakken V., Adamo C., Jaramillo J.,
(A). 1952. Vol. 214. N 1119. P. 451. doi 10.1098/
Gomperts R., Stratmann R.E., Yazyev O., Austin A.J.,
rspa.1952.0181
Cammi R., Pomelli C., Ochterski J.W., Martin R.L.,
30. Becke A.D. // J. Chem. Phys. 1993. Vol. 98. N 7. P. 5648.
Morokuma K., Zakrzewski V.G., Voth G.A., Salvador P.,
doi 10.1063/1.464913
Dannenberg J.J., Dapprich S., Daniels A.D., Farkas O.,
31. Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
Foresman J.B., Ortiz J.V., Cioslowski J., Fox D.J.
Robb M.A., Cheeseman J.R., G. Scalmani V.B.,
Gaussian 09, Revision A.02. 2009.
Mennucci B., Petersson G.A., Nakatsuji H., Caricato M.,
32. Tomasi J., Mennucci B., Cammi R. // Chem. Rev. 2005.
Li X., Hratchian H.P., A.F. Izmaylov, Bloino J., Zheng G.,
Sonnenberg J.L., Hada M., Ehara M., Toyota K., Fuku-
Vol. 105. N 8. P. 2999. doi 10.1021/cr9904009
da R., Hasegawa J., Ishida M., Nakajima T., Honda Y.,
33. Zhurko G.A., Zhurko D.A. Chemcraft ver. 1.6 (build
Nakai H., Vreven T., Montgomery J.A., Peralta J.E.,
Synthesis and Some Physical-Chemical Properties
of 2-Aminopyridine-3-carbaldehyde and Metal Complexes
with Phalazinyl Hydrazone
L. D. Popova,*, E. A. Raspopovaa, S. A. Borodkina, Yu. P. Tupolovaa,
S. I. Levchenkova,b, and I. N. Shcherbakova
a Southern Federal University, Rostov-on-Don, 344090 Russia
b Federal Research Center “Southern Scientific Center of the Russian Academy of Sciences”,
Rostov-on-Don, 344006 Russia
*e-mail: ldpopov@mail.ru
Received August 2, 2019; revised August 2, 2019; accepted August 6, 2019
A new hetarylhydrazone was obtained by condensation of 2-aminopyridine-3-carbaldehyde with
1-hydrazinophthalazine and its complexing ability with respect to ions of certain metals was studied. Depending
on the nature of the metal and the acid residue, complex compounds of various compositions and structures
were formed.
Keywords: hetarylhydrazones, 1-hydrazinophthalazine, quantum chemical calculations, metal complexes,
magnetochemistry
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020