ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 3, с. 441-448
УДК 541.49;544.18;539.27
СИНТЕЗ, СТРУКТУРНОЕ И ФИЗИКО-ХИМИЧЕСКОЕ
ИССЛЕДОВАНИЕ КОМПЛЕКСОВ ПЕРЕХОДНЫХ
МЕТАЛЛОВ С ОСНОВАНИЕМ ШИФФА - ПРОДУКТОМ
КОНДЕНСАЦИИ 2-N-ТОЗИЛАМИНОБЕНЗАЛЬДЕГИДА
И ТРИПТАМИНА
© 2020 г. В. А. Четвериковаa, Л. Д. Поповa,*, С. И. Левченковa,b, А. С. Бурловa,
В. А. Лазаренкоc, Я. В. Зубавичусc, И. Н. Щербаковa
a Южный федеральный университет, ул. Зорге 7, Ростов-на-Дону, 344090 Россия
b Федеральный исследовательский центр «Южный научный центр Российской академии наук»,
Ростов-на-Дону, 344022 Россия
с Национальный исследовательский центр «Курчатовский институт», Москва, 123182 Россия
*e-mail: shcherbakov@sfedu.ru
Поступило в Редакцию 1 сентября 2019 г.
После доработки 1 сентября 2019 г.
Принято к печати 5 сентября 2019 г.
Синтезировано и исследовано новое основание Шиффа - продукт конденсации 2-N-тозиламинобензаль-
дегида и триптамина. Выполнено физико-химическое исследование и квантово-химическое моделирова-
ние таутомерии азометина. Получены и исследованы его комплексы с Zn(II), Cu(II), Ni(II), Co(II) и Fe(III).
Ключевые слова: основания Шиффа, рентгеноструктурный анализ, теория функционала плотности,
комплексные соединения
DOI: 10.31857/S0044460X2003014X
Основания Шиффа (азометины) используются
дукт конденсации 2-N-тозиламинобензальдегида
в различных областях науки и техники: бионеор-
и триптамина - и ряд комплексов на его основе.
ганической химии, координационной химии, три-
Синтез соединения 1 осуществляли взаимодей-
бохимии, фармацевтической химии, фотохимии,
ствием 2-N-тозиламинобензальдегида с триптами-
супромолекулярной химии и т. д. [1-5]. Комплексы
ном в толуоле при кипячении (схема 1).
с азометинами проявляют магнитные [6-8], фото-
Состав и строение соединения 1 установлены
активные [9-10], каталитические [11, 12], биоак-
методами элементного анализа, ИК и ЯМР спек-
тивные [13-16] свойства. В литературе описаны
троскопии. Известно, что азометины и гидразоны
многочисленные металлхелаты азометинов на ос-
на основе 2-N-тозиламинобензальдегида находят-
нове о-тозиламинобензальдегида, проявляющие
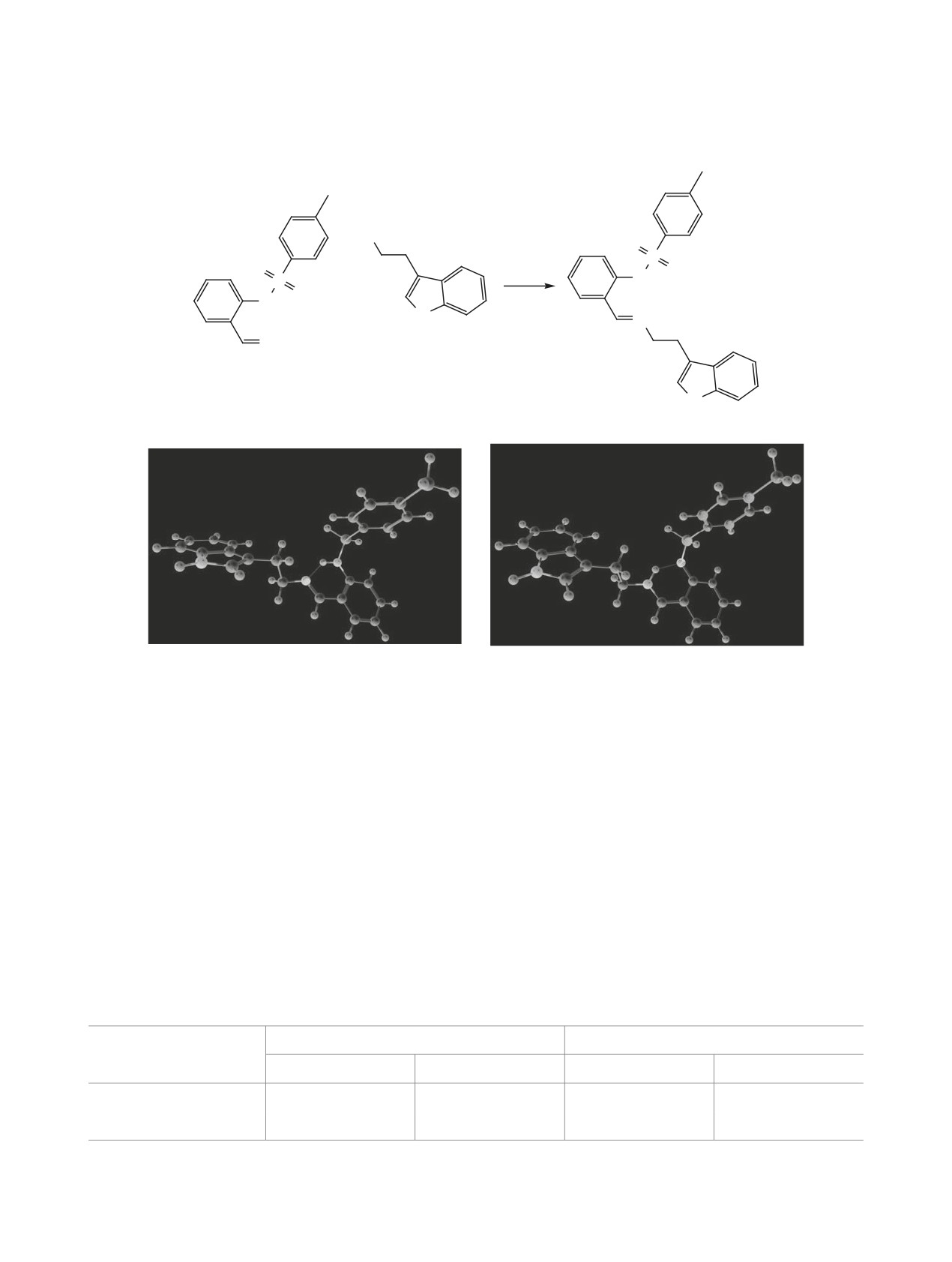
ся в аминной таутомерной форме. Соединение 1 не
выраженные люминесцентные свойства [17-20].
является исключением; согласно данным выпол-
Описан ряд азометинов на основе триптамина,
ненных квантово-химических расчетов методом
главным образом, производных салицилового аль-
DFT/B3LYP/6-311G(d), полная энергия аминного
дегида [21-30].
таутомера А ниже энергии иминного таутомера Б
на 6.9 ккал/моль в вакууме и на 10.2 ккал/моль в
В продолжение исследований по изучению ком-
плексообразующих свойств азометинов и гидразо-
этанольном растворе (табл. 1, рис. 1).
нов 2-N-тозиламинобензальдегида нами синтези-
Взаимодействием азометина 1 (HL) с ацетата-
ровано и исследовано основание Шиффа 1 - про-
ми цинка(II), меди(II), никеля(II) и кобальта(II)
441
442
ЧЕТВЕРИКОВА и др.
Схема 1.
H2N
O
S
O
O
S
NH
O
NH
N
N
H
O
N
H
1 (HL)
(а)
(б)
Рис. 1. Общий вид наиболее устойчивых конформеров таутомерных форм (a) А и (б) Б соединения 1 по данным расчетов.
либо хлоридом железа(III) в метаноле получены
заметным уменьшением относительной интенсив-
комплексы 2-5 состава ML2 (M = Zn, Cu, Ni, Co) и
ности; незначительное смещение в высокочастот-
комплекс 6 FeL2Cl. Состав и строение комплексов
ную область претерпевают также полосы симме-
установлено методами элементного анализа, ИК и
тричных и асимметричных валентных колебаний
ЯМР 1Н спектроскопии, магнетохимии и РСА (для
групп S=O.
сольвата комплекса кобальта 5).
В спектре ЯМР 1Н цинкового комплекса 2 отме-
В ИК спектрах комплексов по сравнению со
чено исчезновение сигнала аминного протона при
спектром исходного азометина отмечено низкоча-
сохранении сигнала протона группы NH индоль-
стотное смещение (на 10-25 см-1) полосы погло-
ного фрагмента.
щения ν(C=N), что указывает на участие в коор-
Величины эффективных магнитных моментов
динации азометинового атома азота. Узкая полоса
комплексов 3-6 находятся в области обычных зна-
ν(N-H), проявляющаяся в спектре азометина 1 при
чений для соответствующих ионов в высокоспи-
3391 см-1, смещается в область 3456-3460 см-1 с
новом состоянии. Существенно завышенные по
Tаблица 1. Полная энергия и относительная устойчивость таутомерных форм A и Б соединения 1 в вакууме и в
этаноле
E, a. e.
ΔE, ккал/моль
Форма
вакуум
этанол
вакуум
этанол
А
-2331.1496941
-2331.1669446
0.00
0.00
Б
-2331.1395389
-2331.1551575
6.37
7.40
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
СИНТЕЗ, СТРУКТУРНОЕ И ФИЗИКО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ КОМПЛЕКСОВ
443
Схема 2.
NH
HN
N
N
HN
N
N
Ts
Ts
M
Fe
Cl
N
Ts N
N
NH
N
Ts
М = Zn (2), Cu (3), Ni (4), Co (5).
Таблица 2. Избранные межатомные расстояния и валентные углы в координационных полиэдрах атомов кобальта в
молекуле сольвата комплекса 5
Связь
d, Å
Связь
d, Å
Угол
α, град
Угол
α, град
Co1-N1
2.0069(16)
Co1-N3
1.9887(18)
N3Co1N1
132.77(7)
N2Co1N1
94.14(7)
Co1-N2
2.0067(18)
Co1-N4
2.0060(18)
N3Co1N2
112.24(7)
N4Co1N1
115.22(7)
N3Co1N4
94.18(8)
N4Co1N2
107.21(7)
сравнению с чисто спиновым значением величины
таллоцикла, строение которых близко к плоскому
μэфф медного (3) и никелевого (4) комплексов (2.29
вследствие сопряжения с соответствующим бензо-
и 3.28 М. Б. соответственно при 293 K) позволяют
льным кольцом.
предположить, что ионы Cu(II) и Ni(II) находятся
В монокристалле сольвата комплекса 5 группы
в тетраэдрическом окружении [31].
NH каждого лиганда образуют межмолекулярные
Совокупность имеющихся данных указывает
водородные связи N-H···O с атомами O1 сульфо-
на бидентатную координацию лиганда к ионам ме-
групп соседних молекул, в результате чего обра-
талла в монодепротонированной форме и позволя-
зуются двойные бесконечные цепи молекул, вытя-
ет приписать комплексам Zn, Cu, Ni, Co строение
нутые вдоль кристаллографической оси b (рис. 3).
2-5, а комплексу Fe - структуру 6 (схема 2).
Параметры водородных связей приведены в табл. 3.
Строение сольвата кобальтового комплекса 5,
Молекула 1,2-дихлорэтана занимает пустоты в
полученного медленной кристаллизацией ком-
плекса из раствора в 1,2-дихлорэтане, было уста-
новлено методом РСА. Молекулярное строение
сольватированного комплекса 5 показано на рис. 2,
длины связей и валентные углы в координацион-
ных многогранниках металлов приведены в табл. 2.
В комплексных молекулах CoL2 каждый из ор-
ганических лигандов координирует ион металла
бидентатно-хелатно азометиновым и аминным
атомами азота. Координационный многогранник
иона кобальта может быть описан как искажен-
ный тетраэдр (значение дескрипторов Аддисона
τ4 = 0.79, τ4ʹ = 0.74) [32]. Двугранный угол между
плоскими фрагментами N1Co1N2 и N3Co1N4 равен
Рис. 2. Общий вид молекулы сольватированного ком-
87.7°. При координации органических лигандов к
плекса 5 (молекула 1,2-дихлорэтана и атомы водорода
иону металла образуются два шестичленных ме-
не показаны).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
444
ЧЕТВЕРИКОВА и др.
Рис. 3. Упаковка молекул в монокристалле сольвата комплекса 5 (вид вдоль кристаллографической оси a).
кристаллической решетке; метиленовые группы
в виде суспензии в вазелиновом масле. Спектры
разупорядочены по двум кристаллографическим
ЯМР 1Н регистрировали в ДМСО-d6 на спектро-
положениям с равной заселенностью.
метре Varian Unity 300 (300 МГц) в импульсном
Фурье-режиме; внутренний стандарт - ГМДС.
Структура сольвата комплекса 5 существенно
Удельную магнитную восприимчивость определя-
отличается от структуры комплекса кобальта(II) с
ли относительным методом Фарадея в интервале
азометином на основе триптамина и салицилового
77.4-300 K; в качестве эталона для калибровки ис-
альдегида (CCDC refcode ATEFOW) [30], который,
пользовали Hg[Co(CNS)4].
как и другие комплексы с данным лигандом, имеет
группу симметрии C2. Понижение симметрии ком-
Монокристалл сольвата комплекса 5 для РСА
получен при медленном охлаждении раствора ком-
плексной молекулы в случае сольвата комплекса 5
обусловлено, по-видимому, стерическим влиянием
плекса 5 в 1,2-дихлорэтане. Бесцветные призмати-
ческие кристаллы (М 990.89) триклинные при 293 K;
тозильных заместителей; можно предположить,
параметры элементарной ячейки: a = 13.214(3) Å,
что в сольвате существует слабое π-стекинг-взаи-
b = 13.484(3) Å, с = 14.457(3) Å, α = 79.18(3)°, β =
модействие между бензольными кольцами тозиль-
71.39(3)°, γ = 71.37(3)°, V = 2302.7(10) Å3, про-
ных групп (межцентроидное расстояние 4.067 Å,
странственная группа P-1, Z = 2, dвыч = 1.429 г/cм3,
угол между средними плоскостями 30.6°).
μ = 0.835. Параметры элементарной ячейки и ин-
Такимобразом,на основенового азометина -про-
тенсивности 34657 отражений измеряли на диф-
дукта конденсации 2-N-тозиламинобензальдегида
рактометре Rayonix SX165 CCD (синхротронное
и триптамина - получены комплексы с ионами
излучение, λ = 0.80246 Å), ω-сканирование, 2θmax =
Zn(II), Cu(II), Ni(II), Co(II) и Fe(III).
61.7°) для монокристаллического образца разме-
ром 0.30×0.20×0.10 мм3. Обработку исходного
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
массива измеренных интенсивностей проводили с
Элементный анализ выполнен на приборе
помощью программы Olex2 1.2 [33, 34]. Структура
PerkinElmer 240C в Лаборатории микроанализа
расшифрована прямым методом и уточнена пол-
Южного федерального университета. ИК спектры
номатричным МНК в анизотропном приближении
регистрировали на приборе Varian Scimitar 1000
для неводородных атомов по F2hkl. Атомы водорода
FT-IR в области 400-4000 см-1; образцы готовили
помещали в геометрически рассчитанные положе-
Таблица 3. Параметры межмолекулярных водородных связей N-H···O в кристаллической структуре сольвата ком-
плекса 5
D-H···A
D-H, Å
H···A, Å
D···A, Å
Угол DHA, град
N5-H···O1a
0.860
2.273
2.972(2)
138
N6-H···O1б
0.860
2.221
2.974(2)
146
Операции симметрии: а x, 1+y, z. б 1-x, -y, 1-z.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
СИНТЕЗ, СТРУКТУРНОЕ И ФИЗИКО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ КОМПЛЕКСОВ
445
ния и уточняли с использованием модели наездника
Смесь кипятили 1 ч и оставляли на ночь. Осадок
[Uiso(H) = nUeq(C), где n = 1.5 для атомов углеро-
отфильтровывали и перекристаллизовывали из
да метильных групп, n = 1.2 для остальных атомов
CCl4. Выход 65%, желтый кристаллический поро-
C]. Окончательные факторы расходимости: R1 =
шок, т. пл. 178°C. ИК спектр, ν, см-1: 3391 (N-H),
0.0463 и wR2 = 0.1234 для 9181 независимых от-
1640 (C=N), 1292 (асимм. SO2), 1161 (симм. SO2).
ражений с I > 2σ(I), R1 = 0.0490 и wR2 = 0.1254 для
Спектр 1Н ЯМР (ДМСО-d6), δ, м. д.: 13.33 уш. с
всех 9974 независимых отражений, 607 уточняе-
(1Н, NH), 10.82 с (1Н, NHиндол), 8.40 с (CH=N),
мых параметров, GOOF 1.071. Все расчеты прове-
7.58 д (1Н, CHAr, J = 7.8 Гц), 7.54 д (2Н, CHAr, J =
дены с использованием программного комплекса
8.2 Гц), 7.44 д (1Н, CHAr, J = 8.2 Гц), 7.40 д. д (1Н,
SHELXL-2018/3 [35]. Для анализа структуры ис-
CHAr, J1 = 7.8, J2 = 1.5 Гц), 7.33 м (2Н, CHAr), 7.17
пользовали программу PLATON [36]. Избранные
м (3Н, CHAr), 7.05 т. д (1Н, CHAr, J1 = 7.8, J2 =
межатомные расстояния и валентные углы приве-
1.0 Гц), 7.02 т. д (1Н, CHAr, J1 = 7.8, J2 = 1.0 Гц),
дены в табл. 2. Координаты атомов и температур-
6.97 т. д (1Н, CHAr, J1 = 7.8, J2 = 1.0 Гц), 3.94 т
ные факторы депонированы в Кембриджском бан-
(2Н, СН2, J = 6.9 Гц), 3.10 т (2Н, СН2, J = 6.9 Гц),
ке структурных данных (CCDC 1942958).
2.27 с (3Н, СН3). Найдено, %: С 69.7; Н 5.61; N
10.5. C24H23N3O2S. Вычислено, %: С 69.0; Н 5.55;
Квантово-химические расчеты выполнены на
кластере WSD Центра коллективного пользования
N 10.1.
«Высокопроизводительные вычисления» Южно-
Общая методика синтеза комплексов 2-6. К
Российского регионального центра информатиза-
горячему раствору 1 ммоль азометина 1 в 10 мл
ции Южного федерального университета с помо-
метанола приливали горячий раствор 0.5 ммоль
щью программы Gaussian’03 [37]. Для подготов-
ацетата цинка(II), меди(II), никеля(II), кобаль-
ки данных и визуализации результатов расчетов
та(II) либо хлорида железа(III) в 10 мл метанола.
использовали программу Chemcraft [38]. Расчеты
Реакционную смесь кипятили 1 ч. Осадок отфиль-
электронного и пространственного строения сое-
тровывали, промывали метанолом и сушили в ва-
динений проводили в рамках теории функциона-
кууме. Перекристаллизовывали из смеси этанол-
ла плотности (DFT) в газовой фазе и в растворе.
дихлоэтан.
Учет влияния растворителя производили в рамках
Комплекс ZnL2 (2). Желтый кристаллический
приближения непрерывной поляризуемой среды
порошок, т. пл. >250°C. ИК спектр, ν, см-1: 3456
(PCM) [39]. Применяли гибридный обменно-кор-
(N-H), 1632 (C=N), 1264 (асимм. SO2), 1133 (симм.
реляционный функционал B3LYP [40-42]. В ка-
SO2). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 10.72 с
честве базисного набора использовали расши-
(1Н, NHиндол), 8.67 с (CH=N), 7.99 д (2Н, CHAr, J =
ренный валентно-расщепленный базис 6-311G(d).
8.3 Гц), 7.54 д. д (1Н, CHAr, J1 = 7.8, J2 = 1.5 Гц),
Геометрическую структуру рассмотренных моле-
7.40 д (1Н, CHAr, J = 8.2 Гц), 7.31 т. д (1Н, CHAr,
кул предварительно оптимизировали по всем есте-
J
= 7.3, J2 = 1.5 Гц), 7.25 д (1Н, CHAr, J = 8.2 Гц),
1
ственным переменным без ограничений на симме-
7.15 д (2Н, CHAr, J = 8.2 Гц), 7.10 д (1Н, CHAr, J =
трию. Минимумы на поверхности потенциальной
8.0 Гц), 6.99 т. д (1Н, CHAr, J1 = 8.3, J2 = 0.9 Гц),
энергии идентифицировали для каждой структуры
6.93 т. д (1Н, CHAr, J1 = 8.3, J2 = 0.9 Гц), 6.79 м (2Н,
расчетом матрицы силовых постоянных и частот
CHAr), 3.74 т (2Н, СН2, J = 6.9 Гц), 2.84 т (2Н, СН2,
нормальных колебаний.
J = 6.9 Гц), 2.25 с (3Н, СН3). Найдено, %: С 64.2;
Для синтеза азометина 1 использовали коммер-
Н 4.94; N 9.4. C48H44N6O4S2Zn. вычислено, %: С
чески доступный триптамин и 2-(N-тозиламино)-
65.1; Н 4.95; N 9.1.
бензальдегид, полученный по методике [43].
Комплекс CuL2 (3). Красный кристалличе-
N-{2-[(E)-{[2-(1H-Индол-3-ил)этил]имино}-
ский порошок, т. пл. >250°C. ИК спектр, ν, см-1:
метил]фенил}-4-метилбензолсульфонамид
(1).
3460 (N-H), 1627 (C=N), 1259 (асимм. SO2), 1136
К горячему раствору 3 ммоль 2-(N-тозиламино)
(симм. SO2). μэфф, М. Б.: 2.29 (293 K), 2.24 (77.4 K).
бензальдегида в 10 мл толуола добавляли горя-
Найдено, %: С 64.9; Н 4.90; N 9.7. C48H44CuN6O4S2.
чий раствор 3 ммоль триптамина в 5 мл толуола.
Вычислено, %: С 64.3; Н 4.95; N 9.4.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
446
ЧЕТВЕРИКОВА и др.
Комплекс NiL2
(4). Зеленый кристалличе-
Shcherbakov I.N., Popov L.D. // Russ. J. Coord.
ский порошок, т. пл. >250°C. ИК спектр, ν, см-1:
Chem. 2015. Vol. 41. N 1. P. 1. doi 10.1134/
3459 (N-H), 1625 (C=N), 1254 (асимм. SO2), 1128
S1070328415010054
(симм. SO2). μэфф, М. Б.: 3.28 (293 K), 3.24 (77.4 K).
8.
Луков В.В., Щербаков И.Н., Левченков С.И., По-
Найдено, %: С 65.1; Н 5.02; N 9.8. C48H44N6NiO4S2.
пов Л.Д., Панков И.В. // Коорд. хим. 2017. Т. 43. № 1.
Вычислено, %: С 64.6; Н 4.97; N 9.4.
С. 3; Lukov V.V., Shcherbakov I.N., Levchenkov S.I.,
Popov L.D., Pankov I.N. // Russ. J. Coord. Chem. 2017.
Комплекс CoL2 (5). Красный кристалличе-
Vol. 43. N 1. P. 1. doi 10.1134/S1070328417010055
ский порошок, т. пл. >250°C. ИК спектр, ν, см-1:
9.
Метелица А.В., Бурлов А., Безуглый С.О., Бородки-
3456 (N-H), 1621 (C=N), 1262 (асимм. SO2), 1132
на И.Г., Брень В.А., Чарновский А.Р., Минкин В.И. //
(симм. SO2). μэфф, М. Б.: 4.51 (293 K), 4.14 (77.4 K).
Коорд. химия. 2006. Т. 32. № 12. С. 894; Metelitsa A.V.,
Найдено, %: С 64.1; Н 4.91; N 9.1. C48H44CoN6O4S2.
Burlov A.S., Bezuglyi S.O., Borodkina I.G., Bren V.A.,
Вычислено, %: С 64.6; Н 4.97; N 9.4.
Garnovskii A.D., Minkin V.I. // Russ. J. Coord.
Комплекс FeL2Cl (6). Коричневый кристал-
Chem. 2006. Vol. 32. N 12. P. 858. doi 10.1134/
лический порошок, т. пл. >250°C. ИК спектр,
S1070328406120025
ν, см-1: 3459 (NH), 1615 (C=N), 1253 (асимм.
10.
Zhang J., Xu L, Wong W.Y. // Coord. Chem. Rev. 2018.
SO2), 1128 (симм. SO2). μэфф, М. Б.: 5.92 (293 K),
Vol. 355. P. 180. doi 10.1016/j.ccr.2017.08.007
5.90 (77.4 K). Найдено, %: С 62.1; Н 4.67; N 8.9.
11.
Kleij A.W. // Chem. Eur. J. 2008. Vol. 14. N 34. P. 10520.
C48H44ClFeN6O4S2. Вычислено, %: С 62.4; Н 4.80;
doi 10.1002/chem.200801149
N 9.1.
12.
Liu X., Manzur C., Novoa N., Celedon S., Carrillo
D., Hamon J.R. // Coord. Chem. Rev. 2018. Vol. 357.
ФОНДОВАЯ ПОДДЕРЖКА
P. 144. doi 10.1016/j.ccr.2017.11.030
Работа выполнена при финансовой поддержке
13.
Sarkar S., Dey K. // Spectrochim. Acta. (A). 2010.
Vol. 77. N 4. P. 740. doi 10.1016/j.saa.2010.06.041
Южного федерального университета.
14.
Josephus R.S., Nair M.S. // Arab. J. Chem. 2009.
КОНФЛИКТ ИНТЕРЕСОВ
Vol. 62. P. 319. doi 10.1016/j.arabjc.2010.05.001
15.
Holm R.H., Solomon E.I. // Chem. Rev. 2004. Vol. 104.
Авторы заявляют об отсутствии конфликта ин-
N 2. P. 347. doi 10.1021/cr0206364
тересов.
16.
Da Silva C.M., Da Silva D.L., Modolo L.V., Alves R.B.,
СПИСОК ЛИТЕРАТУРЫ
De Resende M.A., Martins C.V.B., De Fatima A. //
J. Adv. Res. 2011. Vol. 2. N 1. P. 1. doi 10.1016/j.
1. Минбаев В.У. Шиффовы основания. Алма-Ата:
jare.2010.05.004
Наука, 1989. 140 с.
17.
Kovalenko A., Rublev P.O., Tcelykh L.O., Golovesh-
2. Гарновский А.Д., Васильченко И.С. // Усп. хим. 2002.
kin A.S., Lepnev L.S., Burlov A.S., Vashchenko A.A.,
Т. 71. № 11. С. 1064; Garnovskii A.D., Vasil’chenko I.S. //
Marciniak L., Magerramov A.M., Shikhaliyev N.G.,
Russ. Chem. Rev. Vol. 71. N 11. P. 943. doi 10.1070/
Vatsadze S.Z., Utochnikova V.V. // Chem. Mater.
RC2002v071n11ABEH000759
2019. Vol. 31. N 3. P. 759. doi 10.1021/acs.
3. Minkin V.I., Tsukanov A.V., Dubonosov A.D., Bren V.A. //
chemmater.8b03675
J. Mol. Struсt. 2011. Vol. 998. N 1-3. P. 179. doi
18.
Burlov A.S., Koshchienko Yu.V., Vlasenko V.G., Dmitri-
ev A.V., Mal’tsev E.I., Lypenko D.A., Pozin S.I.,
10.1016/j.molstruc.2011.05.029
Levchenkov S.I., Makarova N.I., Tsivadze A.Yu., Min-
4. Segura J.L., Mancheno M.J., Zamora F. // Chem.
kin V.I. // Inorg. Chim. Acta. 2018. Vol. 482. P. 863. doi
Soc. Rev. 2016. Vol. 45. N 20. P. 5635. doi 10.1039/
10.1016/j.ica.2018.07.037
C5CS00878F
19.
Burlov A.S., Vlasenko V.G., Koshchienko Yu.V.,
5. Borisova N.E., Reshetova M.D., Ustynyuk Y.A. // Chem.
Makarova N.I., Zubenko A.A., Drobin Yu.D., Feti-
Rev. 2007. Vol. 107. N 1. P. 46. doi 10.1021/cr0683616
sov L.N., Kolodina A.A., Zubavichus Ya.V., Trigub A.L.,
6. Garnovski A.D., Nivorozhkin A.L., Minkin V.I. //
Levchenkov S.I., Garnovskii D.A. // Polyhedron. 2018.
Coord. Chem. Rev. 1993. Vol. 126. № 1-2. P. 1. doi
Vol. 154. P. 65. doi 10.1016/j.poly.2018.07.034
10.1016/0010-8545(93)85032-Y
20.
Лифинцева Т.В., Бурлов А.С., Власенко В.Г., Кощи-
7. Луков В.В., Коган В.А., Левченков С.И., Щерба-
енко Ю.В., Мальцев Е.И., Дмитриев А.В., Лыпен-
ков И.Н., Попов Л.Д. // Коорд. хим. 2015. Т. 41.
ко Д.А., Тригуб А.Л., Гарновский Д.А. // ЖОХ. 2018.
№ 1. С. 3; Lukov V.V., Kogan V.A., Levchenkov S.I.,
Т. 88. № 10. С. 1677; Lifintseva T.V., Burlo, A.S.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
СИНТЕЗ, СТРУКТУРНОЕ И ФИЗИКО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ КОМПЛЕКСОВ
447
Vlasenk, V.G., Koshchienko Yu.V., Mal’tsev E.I., Dmitri-
S2053273314022207
ev A.V., Lypenko D.A., Trigub A.L., Garnovskii D.A. //
34.
Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
Russ. J. Gen. Chem. 2018. Vol. 88. N 100. P. 2125. doi
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
10.1134/S107036321810016X
Vol. 42. N 2. P. 339. doi 10.1107/S0021889808042726
21.
Gili P., Palacios M.S., Martin-Reyes M.G., Martin-
35.
Sheldrick G.M. // Acta Crystallogr. (A). 2008. Vol. 64.
Zarza P., Ruiz-Perez C., Rodriguez-Romero F.V., La-
N 1. P. 112. doi 10.1107/S0108767307043930
hoz F.V. // Polyhedron. 1992. Vol. 11. N 17. P. 2171. doi
36.
Spek A.L. // J. Appl. Cryst. 2003. Vol. 36. P. 7. doi
10.1016/S0277-5387(00)83692-X
10.1107/S0021889802022112
22.
Mustafa I.M., Hapipah M.A., Abdulla M.A., Ward T.R. //
37.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
Polyhedron. 2009. Vol. 28. N 18. P. 3993. doi 10.1016/j.
Robb M.A., Cheeseman J.R., Montgomery J.A., Jr.,
poly.2009.10.004
Vreven T., Kudin K.N., Burant J.C., Millam J.M., Iyen-
23.
Ali H.M., Mustafa M.I.M., Rizal M.R., Ng S.W. // Asta
gar S.S., Tomasi J., Barone V., Mennucci B., Cossi M.,
Crystallogr. (E). 2008. Vol. 64. N 3. P. m787. doi
Scalmani G., Rega N., Petersson G.A., Nakatsuji H.,
10.1107/S1600536808012968
Hada M., Ehara M., Toyota K., Fukuda R., Hasegawa J.,
24.
Ali H.M., Mustafa M.I.M., Rizal M.R., Ng S.W. // Asta
Ishida M., Nakajima T., Honda Y., Kitao O., Nakai H.,
Crystallogr. (E). 2008. Vol. 64. N 2. P. m421. doi
Klene M., Li X., Knox J.E., Hratchian H.P., Cross J.B.,
10.1107/S1600536808002213
Bakken V., Adamo C., Jaramillo J., Gomperts R.,
25.
Garcia-Raso A., Fiol J.J., Badenas F., Lago E., Molins E. //
Stratmann R.E., Yazyev O., Austin A.J., Cammi R.,
Polyhedron. 2001. Vol. 20. N 22-23. P. 2877. doi
Pomelli C., Ochterski J.W., Ayala P.Y., Morokuma K.,
10.1016/S0277-5387(01)00900-7
Voth G.A., Salvador P., Dannenberg J.J., Zakrzewski V.G.,
26.
Ishida T., Hatta K.I., Yamashita S., Doi M., Iroue M. //
Dapprich S., Daniels A.D., Strain M.C., Farkas O.,
Chem. Pharm. Bull. 1986. Vol. 34. N 9. P. 3553. doi
Malick D.K., Rabuck A.D., Raghavachari K., Fores-
10.1248/cpb.34.3553
man J.B., Ortiz J.V., Cui Q., Baboul A.G., Clifford S.,
27.
Gulli P., Zarza P.M., Nunez P., Medina A., Diaz M.C.,
Cioslowski J., Stefanov B.B., Liu G., Liashenko A.,
Martin M.G., Arrieta J.M., Vlassi M., Germain G.,
Piskorz P., Komaromi I., Martin R.L., Fox D.J., Keith T.,
Vermeire M., Dupont L. // J. Coord. Chem. 1989. Vol. 20.
Al-Laham M.A., Peng C.Y., Nanayakkara A.,
N 3. P. 273. doi 10.1080/00958978909408169
Challacombe M., Gill P.M.W., Johnson B., Chen W.,
28.
Yang S., Zhu X., Zhou S., Wang S., Feng Z., Wei Y.,
Wong M.W., Gonzalez C., Pople J.A. Gaussian 03,
Miao H., Guo L., Wang F., Zhang G., Gu X., Mu X. //
Revision D.01. Gaussian, Inc., Wallingford CT, 2004.
Dalton Trans. 2014. Vol. 43. N 6. P. 2521. doi 10.1039/
38.
Zhurko G.A., Zhurko G.A. Chemcraft ver. 1.6 (build
C3DT51107C
29.
Faizi M.S.H., Sharkina N.O., Davydenko Y.M. // Acta
39.
Cammi R., Mennucci B., Tomasi J. // J. Phys. Chem. (A).
Crystallogr. (E). 2015. Vol. 71. P. m31. doi 10.1107/
2000. Vol. 104. N 23. P. 5631. doi 10.1021/jp000156l
S2056989015000778
40.
Stephens P.J., Devlin F.J., Chabalowski C.F., Frisch M.J. //
30.
Liu C., Niu J.-F., Li Y., Xu J.-G., Liu X.-H. // Chin. J.
Struct. Chem. 2016. Vol. 35. P. 1002. doi 10.14102/j.
J. Phys. Chem. 1994. Vol. 98. N 45. P. 11623. doi
cnki.0254-5861.2011-1049
10.1021/j100096a001
31.
Kahn O. Molecular Magnetism. New York: VCH
41.
Becke A.D. // J. Chem. Phys. 1993. Vol. 98. N 7. P. 5648.
Publishers, 1993. 396 p.
doi 10.1063/1.464913
32.
Addison A.W., Rao N.T., Reedijk J., Van Rijn J.,
42.
Lee C., Yang W., Parr R.G. // Phys. Rev. (B). 1988. Vol. 37.
Verschoor G.C. // J. Chem. Soc. Dalton Trans. 1984.
N 2. P. 785. doi 10.1103/PhysRevB.37.785
N 7. P. 1349. doi 10.1039/DT9840001349
43.
Mahia J., Maestro M., Vazquez M., Bermejo M.R.,
33.
Bourhis L.J., Dolomanov O.V., Gildea R.J., Ho-
Gonzalez A.M., Maneiro M. // Acta Crystallogr.
ward J.A.K., Puschmann H. // Acta Crystallogr.
(C). 1999. Vol. 55. N 12. P. 2158. doi 10.1107/
(A). 2015. Vol. 71. N 1. P. 59. doi 10.1107/
S0108270199011580
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
448
ЧЕТВЕРИКОВА и др.
Synthesis, Structural, and Physico-Chemical Studies
of Transition Metal Complexes with Schiff Base - A Product
of Condensation of 2-N-Tosylaminobenzaldehyde
and Tryptamine
V. A. Chetverikovaa, L. D. Popova,*, S. I. Levchenkova,b, A. S. Burlova, V. A. Lazarenkoc,
Y. V. Zubavichusc, and I. N. Shcherbakova
a Southern Federal University, Rostov-on-Don, 344090 Russia
b Federal Research Center “Southern Scientific Center of the Russian Academy of Science”,
Rostov-on-Don, 344006 Russia
c National Research Center “Kurchatov Institute”, Moscow, 123182 Russia
Received September 1, 2019; revised September 1, 2019; accepted September 5, 2019
A new Schiff base, the condensation product of 2-N-tosylaminobenzaldehyde and tryptamine, was synthesized
and investigated. A physico-chemical study and quantum chemical modeling of the tautomerism of azomethine
were performed. Its complexes with Zn(II), Cu(II), Ni(II), Co(II) and Fe(III) were obtained and studied.
Keywords: Schiff bases, X-ray diffraction, density functional theory, coordination compounds
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020