ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 3, с. 459-470
УДК 544.341.2:544.431.24:546.655.4:547.461
ОТНОСИТЕЛЬНАЯ КИНЕТИЧЕСКАЯ
УСТОЙЧИВОСТЬ КОМПЛЕКСОВ ЦЕРИЯ(IV)
С НЕКОТОРЫМИ ОРГАНИЧЕСКИМИ
СОЕДИНЕНИЯМИ АЛИФАТИЧЕСКОГО РЯДА
© 2020 г. О. О. Воскресенскаяa,*, Н. А. Скорикb
a Объединенный институт ядерных исследований, ул. Жолио-Кюри 6, Дубна, 141980 Россия
b Томский государственный университет, Томск, 634050 Россия
*e-mail: voskr@jinr.ru
Поступило в Редакцию 29 июля 2019 г.
После доработки 12 сентября 2019 г.
Принято к печати 16 сентября 2019 г.
На основе сравнительного анализа полученных значений констант устойчивости β1уn и констант скоро-
сти kn=1 внутримолекулярного редокс-распада комплексов церия(IV) [CeHyLn]4+y-nk с рядом алифатиче-
ских органических соединений L = HkR, R(OH)k в сульфатной и нитратной средах, а также установлен-
ных корреляционнных соотношений между lgkn=1 и lgβ1yn предложен критерий количественной оценки
кинетической стабилизациии неустойчивых состояний окисления металлов при комплексообразовании.
Данный критерий представляет собой величину относительной кинетической устойчивости комплексов
к внутрикомплексному редокс-распаду -lg(kn=1/k0n=1), определяемую найденными корреляционными
соотношениями. Установлена связь последних с уравнением Нернста для редокс-потенциала.
Ключевые слова: термодинамика, кинетика реакций, координационные соединения церия, корреля-
ционный анализ
DOI: 10.31857/S0044460X20030163
Соединения церия(IV) находят широкое приме-
Решение многих технологических задач [7-
нение в различных областях химии и технологии
14, 20] тесно связано с проблемой стабилизации
[1-4]. Изучение термодинамических характери-
неустойчивых состояний окисления элементов.
стик образования и кинетических характеристик
Однако тогда как многочисленные эксперимен-
редокс-распада комплексов церия(IV) c органи-
тальные и теоретические подходы к изучению
ческими лигандами, а также связанных с ними
термодинамической стабилизации состояний
закономерностей, представляет теоретический
окисления металлов при комплексообразовании
и практический интерес. Их исследование имеет
известны, как и критерии термодинамической
существенное значение в связи с проблемой ста-
стабилизации [6, 22], подходы и критерии для
билизации неустойчивых состояний окисления
изучения кинетической стабилизации состояний
металлов, применением исследуемых в работе
окисления [23] на данный момент еще не разрабо-
систем как источника радикалов в процессах ра-
таны. Отчасти это связано с тем, что кинетическая
дикальной полимеризации виниловых мономеров,
стабилизации состояний окисления более трудна
при разделении смеси редкоземельных элементов,
для описания, так как требует учета механизма
разработке инновационных технологий [5-14], в
органическом и неорганическом синтезе, аналити-
редокс-взаимодействия лиганд-металл [6]. Тем не
ческой практике, технике, фармакологии [15-18], а
менее, разработка указанных критериев важна, так
также для решения широкого спектра задач нано-,
как использование одних критериев термодинами-
биотехнологии и медицины [19-21].
ческой стабилизации дает лишь приблизительный
459
460
ВОСКРЕСЕНСКАЯ, СКОРИК
ориентир при решении стабилизационных задач
деления констант скоростей kn
, c-1,1 в рамках
C=1
[12].
обобщенных на случай ненулевой скорости вну-
трикомплексного редокс-распада методов иссле-
Базисные аспекты проблемы стабилизации со-
дования состава и устойчивости комплексов ме-
стояний окисления при координации и ее совре-
таллов в неустойчивом состоянии окисления [5,
менное состояние проанализированы в работах [6,
25, 27]. Указанные обобщения классических мето-
22], частные аспекты отражены в работах [23, 24].
дов исследования комплексообразования, наряду
Сформулированы прямая задача эксперименталь-
с определением констант устойчивости lgβ1yn и
ного или расчетного нахождения критериев ста-
констант скорости lgkn=1 редокс-распада комплек-
билизации состояний окисления и обратная зада-
сов [MHyLn]q+y-nk с органическими лигандами L =
ча применения указанных критериев для анализа
HkR, R(OH)k, позволили также исследовать кине-
стабильности валентных форм. Показано значение
тику и механизм протекающего в системах окис-
природы лигандов, центрального иона и соотно-
лительно-восстановительного процесса.
шения их свойств для стабилизации неустойчивых
В настоящей работе, представляющей со-
состояний окисления при комплексообразовании.
бой развитие данного подхода, проведено срав-
Последнее продемонстрировано на примере ре-
нительное изучение систем Ce4+-SO42-(NO3-)-
зультатов работ [8-11], систематизированных в
Lz-, где Lz- - анионы дикарбоновых кислот
обзоре [12], где для систем, содержащих катион
(CH2)r(COOH)2: щавелевой (r = 0, H2Oxal), малоно-
металла переменной валентности и органический
вой (r = 2, H2Mal), янтарной (r = 3, H2Succ), глутаро-
лиганд, определены с учетом протекающего в си-
вой (r = 4, H2Glut); оксикарбоновых кислот: хинной
стемах редокс-процесса константы устойчивости
(H2Quin), молочной (H2Lact), лимонной (H4Citr),
образующихся комплексов и исследовано влияние
винной (H4Tart), а также предельных многоатом-
их величин, восстановительных свойств лиган-
ных спиртов: глицерина (Glyc), ксилита (Csyl) и
дов и других факторов на скорость указанного ре-
сорбита (Sorb). Установлена однотипность меха-
докс-процесса. Однако решение обратной задачи
низма протекающего в системах редокс-процесса,
стабильности состояний окисления на основе ско-
что является необходимым условием существова-
рости редокс-взаимодействия в системах в данных
ния линейных корреляций между их характеристи-
пионерских работах можно рассматривать лишь
ками. Выявлена линейная корреляционная зависи-
как первое приближение к решению данной зада-
мость между lgkn=1 и lgβ1yn (I = 2, T = 295.15 K).
чи с использованием соответствующих констант
Рассмотрены различные формы корреляцион-
скоростей.
ных соотношений для указанной зависимости,
В работах [5, 25] по аналогии с понятием ки-
введено понятие относительной кинетической
нетической устойчивости комплексов, измеряе-
устойчивости комплекса к внутримолекулярному
мой величиной обратной константы скорости их
редокс-распаду. Проанализирована возможность
диссоциации [26], было введено понятие кинети-
введения количественного критерия кинетической
стабилизации неустойчивого состояний окисления
ческой устойчивости комплексных соединений к
металла на основе разных типов корреляционных
внутримолекулярному окислительно-восстанови-
соотношений, указаны предпочтительные области
тельному распаду, которая измеряется величиной
применения данного критерия.
обратной константы скорости внутрикомплексно-
го редокс-распада 1/kn=1 (или значением -lgkn=1) (1).
Диаграммы свойство-состав показывают, что
1 Под kn
, c-1, мы понимаем константы скорости внутри-
C=1
комплексного редокс-распада первого концентрационного
(1)
порядка по комплексу, сохраняющие постоянство значения
в пределах экспериментальных серий (табл. 1), в отличие от
Величина kn=1, c-1, показывает, какая доля ком-
псевдоконстант скорости первого временнòго порядка, ко-
плексных частиц исчезает за единицу времени в
торые являются функциями переменных параметров этих
процессе его окислительно-восстановительного
серий. Здесь и далее мы используем сокращение kn
=1
= kn=1,
C
распада. Был также разработан ряд методик опре-
c-1.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
ОТНОСИТЕЛЬНАЯ КИНЕТИЧЕСКАЯ УСТОЙЧИВОСТЬ КОМПЛЕКСОВ ЦЕРИЯ(IV)
461
Таблица 1. Kонстанты скорости редокс-распада комплексов [CeOHOxal]+ (1), [CeOHMaln]+ (2), [CeOHQuin]+ (3) и
·
·
[CeOHSorb]+ (4) в сульфатной среде, определенные методами D0,D0-pH и D0,D0-cL/cMа
CeOH3+-Oxal2--SO42-
CeOH3+-Maln2--SO42-
CeOH3+-Quin2--SO42-
CeOH3+-Sorb2-- SO42-
pH
lgβ101
lgkn
pH
lgβ101
lgkn
pH
lgβ131
lgkn
-lgcL
lgβ141
lgkn
C
=1
C
=1
C
=1
C
=1
0.10
7.71
-1.73
1.25
9.25
-1.88
2.25
14.94
-2.70
0.73
22.68
-3.74
0.18
7.63
-1.72
1.31
9.23
-1.87
2.32
14.86
-2.71
0.78
22.62
-3.74
0.24
7.66
-1.67
1.35
9.20
-1.88
2.42
14.82
-2.70
0.84
22.65
-3.79
0.31
7.58
-1.68
1.40
9.21
-1.87
2.68
14.86
-2.67
0.90
22.69
-3.65
0.39
7.79
-1.72
1.46
9.22
-1.87
2.79
14.87
-2.67
1.08
22.74
-3.74
0.55
7.54
-1.73
1.50
9.21
-1.86
2.80
14.91
-2.70
1.21
22.74
-3.76
0.63
7.57
-1.75
1.52
9.25
-1.87
2.97
14.95
-2.68
1.30
22.69
-3.77
0.71
7.73
-1.76
1.58
9.25
-1.87
3.04
14.97
-2.69
1.38
22.72
-3.74
а При I = 2, T = 295.15 K и значениях cM = 2.98×10-3, cL = 1.65×10-3 моль/л, D∞0 = 0.430, λ = 400 нм (1); cM = cL = 2.37×10-3 моль/л,
D∞0 = 0.415, λ = 440 нм (2); cM = 1.26×10-3, cL = 3.75×10-3 моль/л, D∞0 = 0.530, λ = 400 нм (3); cM = 2.24×10-3 моль/л, pH = 2.25,
D∞0 = 0.400, λ = 400 нм (4). lgβ101 = 7.65±0.09, -lgkn
= 1.72±0.03 (1), lgβ101 = 9.23±0.03,
-lgkn
= 1.87±0.01 (2), lgβ131 =
C=1
C=1
14.90±0.05, -lgkn
= 2.69±0.10 (3), lgβ141 = 22.69±0.04, -lgkn
= 3.74±0.04 (4).
C=1
C=1
во всех системах, за исключением Ce4+-NO3--
основных равновесий и доминировании в систе-
Citrz-, в начальный момент времени в интервалах
мах одного комплекса.
pH = 0-2.3 сульфатной и 0-3 нитратной сред обра-
Анализ зависимости начальной скорости на-
зуются комплексы с мольным соотношением M:L =
блюдаемого в системах редокс-процесса (- ·D0) от
1:1 (рис. 1) [5, 25] общей формулы [MHyL]q+y-k ≡
[MH-zL]q-z (Mq+ = Ce4+, CeOH3+ в сульфатной, Mq+ =
Ce4+ в нитратной средах). В системе Ce4+-
NO3--Citrz- установлено образование комплекса
[Ce(H-zCitr)2]4-2z с соотношением M:L = 1:2.
Результаты определения числа (z) протонов,
вытесненных из молекул L = HkR, R(OH)k ка-
тионом Mq+ при установлении предравновесия
(2) cвидетельствуют о том, что при образовании
всех комплексов, за исключением [CeH-zTart]4-z,
[Ce(H-zCitr)2]4-2z (z = 4) в нитратной среде, ион
церия(IV) вытесняет из молекул лигандов по два
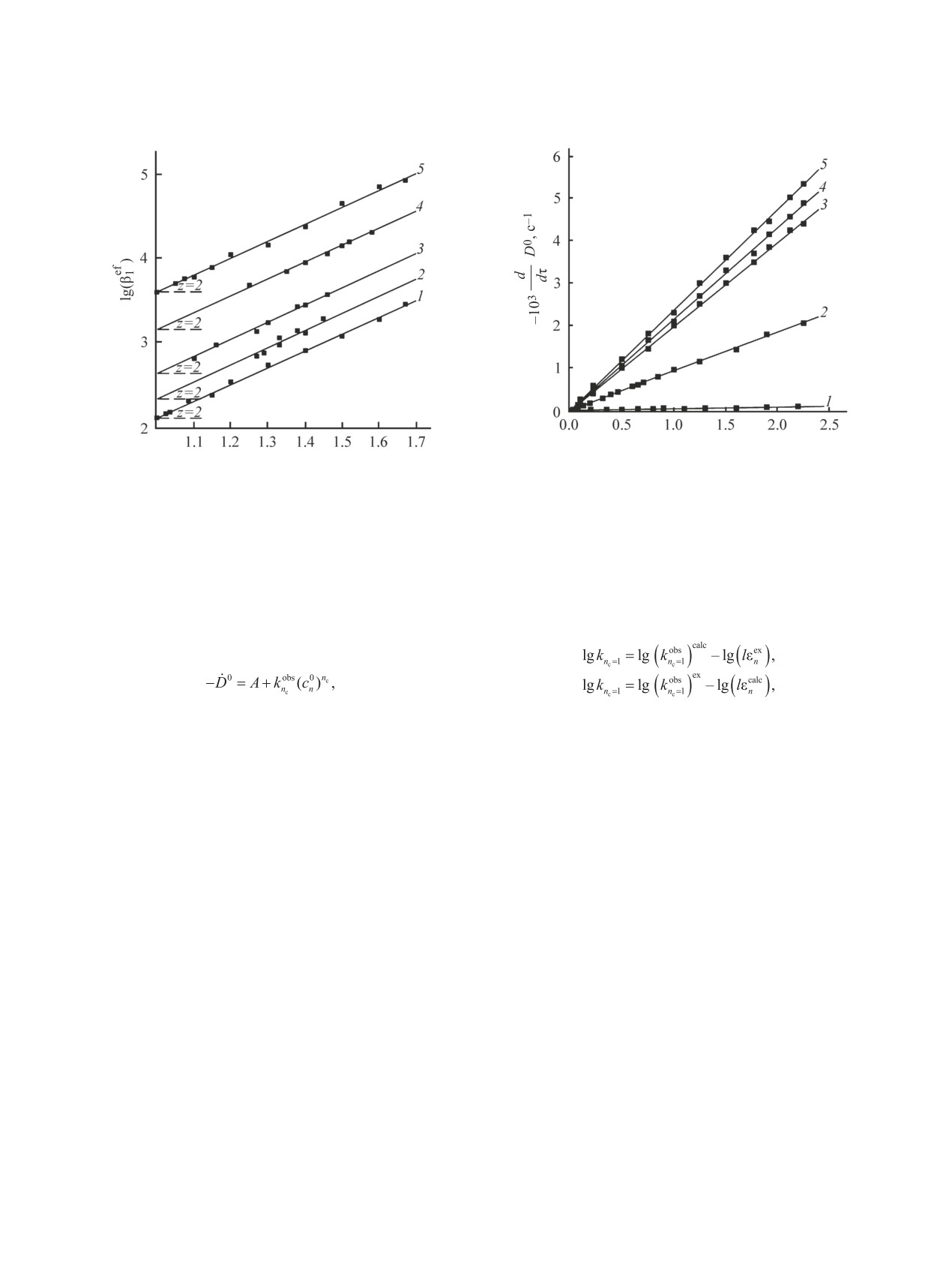
протона, z = 2 (рис. 2).
(2)
cL/cM
(3)
Рис. 1. Определение мольного соотношения металл:
лиганд = 1:n в комплексах [M(H-zL)n]q-nz при L =
Значения lgβ1уn (y = k - z) комплексов [MH-2L]q-2,
H2Glut, pH = 1.33, cM = 2.36×10-3 моль/л (1); L = H2Lact,
определенные по зависимостям D0-pH и D0-cL/cM
pH = 1.63, cM = 2.5×10-3 моль/л (2); L = H4Tart, pH =
для
2.44-2.93, cM = 1.21×10-3 моль/л (3); L = H2Succ, pH =
в сульфатной среде, а также величин lgβ1уn
1.35, cM = 2.29×10-3 моль/л (4); L = H2Maln, pH = 0.88,
[Ce(H-zL)n]4-nz (n = 1, 2; z = 2, 4) для нитратной
cM = 2.27×10-3 моль/л (5); L = H2Oxal, pH = 1.04, cM =
среды, приведены в табл. 1, 2. Постоянство значе-
2.98×10-3 моль/л (6) методом молярных отношений в
(см.,
сульфатной среде (1, 4-6) и его кинетическим аналогом
ний lgβ1уn в пределах серий D0-pH, D0-cL/cM
в нитратной среде (2, 3).
например, табл. 1) свидетельствует о верном учете
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
462
ВОСКРЕСЕНСКАЯ, СКОРИК
0
, моль/л
103c1
pH
Рис. 3. Исследование кинетики редокс-процесса в
Рис. 2. Определение числа z вытесненных из моле-
системах Ce4+-SO42--Lz- на основе зависимости его
кулы лиганда протонов при образовании комплексов
начальной скорости от начальной концентрации ком-
[MH-zL]q-z. 1 - L= H2Lact, cM = cL = 6.0×10-3 моль/л
плекса: L = Sorb, pH = 2.25, cM = 2.24×10-3 моль/л (1);
(NO3-); 2 - L = H2Maln, cM = cL = 2.34×10-3 моль/л (SO42-);
L = H2Quin, cM = 2.8×10-3, cL = 8.5×10-3 моль/л (2);
3 - L= H2Succ, cM = cL = 2.29×10-3 моль/л (SO42-); 4 -
L = H2Glut, cM = cL = 2.37×10-3 (3); L = H2Succ, cM =
L= H2Glut, cM = cL = 2.37×10-3 моль/л (SO42-); 5 - L=
cL = 2.29×10-3 моль/л (4); L = H2Maln, cM = cL = 2.34×
H2Quin, cM = 5.0×10-4, cL = 6.0×10-4 моль/л (NO3-).
10-3 моль/л (5).
начальной равновесной концентрации комплекса
(6)
(cn0, n = 1, 2)
(7)
где nC - концентрационный порядок редокс-про-
цесса по отношению к комплексу, konbs, c-1, - на-
где εex = D∞0/cM (cM ≤ cL), εncalc = ΔD∞0/cn0 + εM, с
C
блюдаемая константа скорости его редокс-распа-
последующим усреднением значений lgkn
по
C=1
да, рассчитанная по уравнениям (4) и (5) [5, 25],
данным экспериментальных серий.
позволяет сделать вывод о том, что вклад бимоле-
Соответствие наблюдаемого в системах ре-
кулярного механизма в изучаемый редокс-процесс
докс-процесса уравнению Ардона (частный слу-
практически отсутствует, так как графики данной
чай уравнения Бриггса-Холдейна, описывающего
зависимости имеют нулевой интерсепт; их линей-
кинетику Михаэлиса-Ментен при быстро уста-
ность соответствует значению nC = 1 (рис. 3).
навливающемся предравновесии) подтверждает
calc
obs
0
0
lg
(
k
n
=1
)
=
log
(
–D
)
– lgc
n
,
(4)
его интермедиатный механизм с образованием в
c
ex
большинстве систем промежуточного комплекса
obs
0
lg
k
=
lg
–
D
– lgc
,
(
n
c
=
1
)
(
∞
)
M
(5)
состава 1:1 (рис. 4).
c
≤
c
M
L
Редокс-распад указанного комплекса, лимити-
Постоянство значений lgkn
, рассчитанных с
рующий скорость редокс-процесса в системах, с
C=1
использованием уравнений (6) и (7) [5, 25], в рам-
учетом комплексообразования церия(IV) c аниона-
ках экспериментальных серий (табл. 1) является
ми фона [28] для всех изученных на сульфатном
признаком единственности промежуточного ком-
фоне систем Ce4+-SO42--Lz- (Lz- = Oxal2-, Maln2-,
плекса в изучаемом редокс-процессе. Усредненные
Succ2-, Glut2-, Quin2-, Citr2-, Glyc2-, Csyl2-, Sorb2-)
по данным разных методов значения констант ско-
может быть описан кинетическим уравнением (8),
ростей внутрикомплексного редокс-распада lgkn=1
преобразуемым к виду (9), учитывающему все ос-
приведены в табл. 2.
новные равновесия в системах.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
ОТНОСИТЕЛЬНАЯ КИНЕТИЧЕСКАЯ УСТОЙЧИВОСТЬ КОМПЛЕКСОВ ЦЕРИЯ(IV)
463
Таблица 2. Относительная кинетическая устойчивость комплексов [Ce(H-zL)n]4-nk к внутримолекулярному ре-
докс-распаду при I = 2, T = 293.15 Kа
[CeH-2L]2+
lgβ1y1
ρlgβ1y1
-lgkn=1
-lg(kn=1/k0n=1)
–lgk0n=1 = -0.75, ρ = 0.14 в сульфатной среде
[CeH-2Oxal]2+
17.12±0.09
2.40±0.09
1.68±0.07
2.43±0.07
[CeH-2Maln]2+
18.68±0.03
2.61±0.03
1.87±0.01
2.61±0.01
[CeH-2Succ]2+
19.30±0.02
2.70±0.02
2.02±0.05
2.77±0.05
[CeH-2Glut]2+
19.38±0.05
2.71±0.05
2.06±0.03
2.81±0.03
[CeH-2Quin]2+
24.38±0.10
3.41±0.10
2.69±0.10
3.44±0.10
[CeH-2Citr] 2+
24.42±0.13
3.42±0.13
2.60±0.05
3.35±0.05
[CeH-2Glyc]2+
31.86±0.05
4.46±0.05
3.72±0.10
4.47±0.10
[CeH-2Csyl]2+
31.91±0.04
4.47±0.04
3.74±0.09
4.49±0.09
[CeH-2Sorb]2+
31.95±0.04
4.47±0.04
3.81±0.08
4.56±0.08
–lgk0n=1 = -3.20, ρ = 0.14 в нитратной среде
[CeH-2Quin]2+
24.81±0.17
3.47±0.17
0.42±0.01
3.62±0.01
[CeH-2Lact]2+
26.61±0.28
3.73±0.28
0.48±0.03
3.68±0.03
[CeH-4Tart]0
34.77±0.31
4.87±0.31
2.03±0.08
5.23±0.08
[Ce(H-4Citr)2]4-
45.84±0.24
6.41±0.24
3.06±0.01
6.26±0.01
а Значения -lg(kn=1/k0n=1), оцененные на основе уравнения (21).
5-
∂[CeOH(SO
4
)
3
L
]
3−
2−
(15)
-
=
k
β
[CeOH(SO
)
][L
],
(8)
1
1
4
3
∂τ
(16)
5−
∂
[CeOH(SO
)
L
]
β
1h
4
3
2-
-
3-
-
[Ce(SO
)
]
+ OH
[CeOH(SO
)
]
,
(17)
4
3
4
3
∂τ
3
κ
κ
κ
β
K
[H
O]
c
1SO
4
2SO
4
3SO
4
1h
w
2
SO
4
=
k
β
⋅
(9)
1
1
2
(1
+
B
[H]+
B
[H]
)[H]
1+
B
[H]
1
2
1SO
4
4+
[Ce
][H
2
L].
Кинетическому уравнению (9) для систем Ce4+-
SO42--L2- соответствует общая модель (механизм)
(10)-(19) указанного процесса c параметрами
pKw
=
15.74, lgB1SO
=
1.00, lgB1SO
=
4.54,
4
4
lgκ2SO
,=2.30, lgκ3SO
= 1.33 [7], lgβ1h =13.90 [28],
4
4
использованными в расчетах значениями lgBi
(i = 1, 2) [5, 7] и полученными значениями lgβ1yn,
lgkn=1 (табл. 2, 3).
K
w
-
(10)
H
OH++OH
,
2
B
10-3cL, л/моль
1so4
2-
-
SO
+
H+HSO
,
(11)
4
4
Рис. 4. Исследование кинетики редокс-процесса в
B
1
2-
L
+
H+ HL
-,
(12)
системах Ce4+-SO42--Lz- с помощью метода Ардо-
B
2
на. L = H2Oxal, pH = 1.14, cM = 2.98×10-3 моль/л (1);
2-
+
L
+
2H
H
L,
(13)
L = H2Maln, pH = 0.88, cM = 2.27×10-3 моль/л (2);
2
L = H2Succ, pH = 1.35, cM = 2.29×10-3 моль/л (3); L =
(14)
H2Glut, pH = 1.33, cM = 2.36×10-3 моль/л (4).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
464
ВОСКРЕСЕНСКАЯ, СКОРИК
иона и других факторов (рис. 5, 1-3). Линейность
(20) является признаком того, что величина
lgkn=1 характеризует элементарную стадию, опре-
1
деляющую скорость реакции; факт выполнения
3
уравнения (20) означает неизменность механизма
реакций в пределах реакционной серии [29].
Корреляционное соотношение (20) позволяет
оценивать по известным значениям lgβ1yn неиз-
вестные значения -lgkn=1, которыми измеряется
кинетическая устойчивость к редокс-распаду каж-
lg(β1yn)
дого отдельного комплекса. Однако при сравни-
тельном изучении стабилизирующих свойств ор-
Рис. 5. Корреляционные зависимости между логариф-
и кон-
мами констант скорости редокс-распада lgkn=1
ганических лигандов на его основе, помимо зави-
]q+y-nk
стант устойчивости lgβ1yn комплексов [MHyLn
симости -lgkn=1 от структуры и свойств лигандов,
(1-3) и между логарифмами относительных констант
выявляется зависимость этой величины от при-
скоростей lg(kn=1/k0n=1) и lgβ1yn (4). 1, 2 - L = H2Oxal,
H2Maln, H2Succ, H2Glut, H2Quin, H4Citr, Glyc, Csyl,
роды ионного фона (рис. 5, 1, 3), формы присут-
Sorb в сульфатной среде: 1 - Mq+ = Ce4+, 2 - Mq+ =
ствия катиона металла в комплексе (рис. 5, 1, 2) и
-); 4
CeOH3+), 3 - H2Quin, H2Lact, H4Tart, H4Citr (NO3
других факторов, что побуждает к анализу других
2-);
- L = H2Oxal, H2Maln, H2Succ, H2Glut, H2Quin (SO4
форм соотношения (20). В связи с тем, что стаби-
H2Quin (NO3-); H4Citr (SO42-); H4Lact (NO3-); Glyc, Csyl,
лизация состояний окисления +q металла означает
Sorb (SO42-); H4Tart, H4Citr (NO3-).
увеличение времени существования его окислен-
ной формы по сравнению с эталоном [6], реше-
(18)
ние обратной задачи кинетической стабилизация
состояний окисления металла при координации
(19)
целесообразно провести с использованием отно-
Общий механизм наблюдаемого в системах
сительной кинетической устойчивости комплекса
редокс-процесса позволяет установить между ве-
к редокс-распаду -lg(kn=1/k0n=1), определяемой той
личинами lgkn=1 и lgβ1yn прежде всего корреляци-
или иной формой уравнения (20), в качестве соот-
онное соотношение в форме уравнения Бренстеда
ветствующего критерия.3
(20) [29, 30].
Преобразование уравнения (20) к виду (21),
(20)
сохраняющее значение параметров ρ и k0n=1, за
где ρ и lgk0n=1 - постоянные реакционной серии2:
исключением k0n=1 = 0, и введение величины
константа реакционной серии ρ определяет чув-
ξ ≡ -lg(kn=1/k0n=1), k0n=1 ≠ 0, которая может быть рас-
ствительность -lgkn=1 к структурным изменениям
считана как на основе правой, так и левой частей
лиганда, величина -lgk0n=1 является стандартным
уравнения (21), устраняет влияние среды на значе-
значением -lgkn=1, соответствующим lgβ1yn = 0.
ния kn=1 и k0n=1 в их отношении kn=1/k0n=1, приводя
Выбор стандарта, вообще говоря, неоднозна-
к слиянию линий 1 и 3 в кривую 4 (рис. 5) и неза-
чен и зависит от целей исследования. Одну и ту
висимости величины ξ от природы ионного фона.
же реакционную серию могут характеризовать
Однако способ оценки параметра ξ на основе
[31], ко-
несколько стандартных значений -lgk0n=1
уравнения (21) оставляет его зависимым от ана-
торые могут соответствовать как реальным, так и
гипотетическим реакциям [32]. Значения -lgk0n=1
3 Дополнительным аргументом в пользу выбора указанного
зависят от природы ионного фона, центрального
критерия является тот факт, что в органической химии в
качестве количественной характеристики реакционной спо-
собности органических соединений в рамках эмпирического
2 Под реакционной серией понимают ряд однотипных реак-
подхода принят логарифм относительной константы скоро-
ций, реализующихся посредством общего механизма и под-
сти (отношения константы скорости изучаемой и стандарт-
чиняющихся общему корреляционному соотношению. Пра-
ной реакции) lg(k/k0), т. е. логарифм величины, соответству-
вильно составленная реакционная серия должна исключать
ющей обратной относительной кинетической устойчивости
изменение в ней реакционного механизма.
комплексов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
ОТНОСИТЕЛЬНАЯ КИНЕТИЧЕСКАЯ УСТОЙЧИВОСТЬ КОМПЛЕКСОВ ЦЕРИЯ(IV)
465
Таблица 3. Относительная кинетическая устойчивость комплексов [M(H-zL)n]q-nz (Mq+ = Ce4+, CeOH3+) к редокс-
распаду при I = 2, T = 293.15 K в сульфатной среде
[CeOHH-2L]+
lgβ1y1
ρlgβ1y1
-lg(kn=1/k0n=1)
–lgk0n=1 = 0.61, ρ = 0.14а
[CeOHH-2Oxal]+
7.67±0.09
1.08±0.09
1.07±0.07
[CeOHH-2Maln]+
9.23±0.03
1.23±0.03
1.26±0.01
[CeOHH-2Succ]+
9.85±0.02
1.38±0.02
1.41±0.05
[CeOHH-2Glut] +
9.93±0.05
1.39±0.05
1.45±0.03
[CeOHH-2Quin]+
14.93±0.05
2.09±0.05
2.08±0.10
[CeOHH-2Citr] +
14.97±0.13
2.10±0.13
2.03±0.05
[CeOHH-2Glyc]+
22.41±0.05
3.13±0.05
3.11±0.10
[CeOHH-2Csyl]+
22.46±0.03
3.14±0.03
3.13±0.09
[CeOHH-2Sorb]+
22.50±0.04
3.15±0.04
3.20±0.08
[M(H-zL)n]q-nk
lg(β1yn/β01yn)
ρlg(β1yn/β01yn)
-lg(kn=1/k0n=1)
–lgk0n=1 = 1.68, ρ = 0.14б
[MH-2Oxal]q-2
0.00±0.18
0.00±0.18
0.00±0.14
[MH-2Maln]q-2
1.56±0.12
0.22±0.12
0.19±0.08
[MH-2Succ]q-2
2.18±0.11
0.31±0.11
0.34±0.12
[MH-2Glut]q-2
2.26±0.14
0.32±0.14
0.38±0.10
[MH-2Quin]q-2
7.26±0.14
1.01±0.14
1.01±0.17
[MH-2Citr]q-2
7.30±0.22
1.02±0.22
0.96±0.12
[MH-2Glyc]q-2
14.74±0.14
2.06±0.14
2.04±0.17
[MH-2Csyl]q-2
14.79±0.12
2.07±0.12
2.06±0.16
[MH-2Sorb]q-2
14.83±0.13
2.08±0.13
2.13±0.15
а Значения -lg(kn=1/k0n=1), оцененные на основе уравнения (21). б Значения -lg(kn=1/k0n=1), оцененные на основе уравнения (22).
литического выражения и, как следствие, от зна-
в качестве стандарта сравнения, а также введение
чения lgβ1yn при разных формах присутствия ме-
наряду с величиной -lg(kn=1/k0n=1) относительной
талла в комплексе. Так, если принять доминиро-
термодинамической устойчивости lg(β1yn/β01yn)
комплексов [M(H-zL)n]q-nz, Mq+ = Ce4+, CeOH3+
(21)
(табл. 3), устраняет последнюю из указанных за-
висимостей, делая уравнение инвариантным к
вание на сульфатном фоне при pH = 1-2 частицы
изменению выражения lgβ1yn вследствие сокраще-
[CeOH(SO4)3]3- [28], выражение для lgβ1y1 ком-
ния функции ω в отношении β1yn/β01yn.
плексов [CeOHH-2L]+ примет вид:
(22)
Линии 1-3 на рис. 5 преобразуются при этом
Тогда как для иона Ce4+ и комплексов
в одну прямую, параметр ξ принимает значения
ef-
[CeH-2L]2+ оно приобретает форму: lgβ1y1 = lg(β
3
0-2.13 для сульфатной и 0-2.64 для нитратной сред
f2ω), где ω = 1 + Kh1[H]-1 + Kh2[H]-2 + ΣβiSO4, βiSO4 -
(табл. 3). Заметим, что монодентатная уксусная
i=1
константы устойчивости сульфатных комплек-
кислота не может быть включена в данную серию,
сов катиона Ce4+, что ведет к изменению значе-
так как ее окисление не подчиняется рассмотрен-
ний ξ: 1.07-3.20 для [CeOHH-2L]+ и 2.43-4.56 для
ным корреляционным соотношениям. Отметим
[CeH-2L]2+ (табл. 2, 3).
также тот факт, что уравнение (22) является более
И, наконец, преобразование соотношений (20)
общим по сравнению с выражением (21) и сводит-
и (21) к форме уравнения Гаммета (22) [29, 33] и
ся к нему при β01yn = 1. Однако точность уравнения
выбор первой реакции реакционной серии (с наи-
(22) ниже точности уравнения (21), как и в случае
менее устойчивым промежуточным комплексом)
уравнений Гаммета-Тафта и Бренстеда [29].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
466
ВОСКРЕСЕНСКАЯ, СКОРИК
Можно установить связь уравнений (21) и (22)
при одном и том же центральном ионе предпочти-
с уравнением Нернста (23) для редокс-потенциала
тельно проводить с использованием корреляцион-
E[CeH-zL]4-z/[CeH-zL]3-z процесса [CeH-zL]4-z + e =
ного соотношения (21) на основе шкалы с более
[CeH-zL]3-z.
широким диапазоном значений ξ. Исследовать же
влияние соотношения свойств центрального иона
E
4-z
3-z
[
CeH
–
z
L
]
/
[
CeH
-
z
L
]
и лигандов, а также ионного фона, на стабилиза-
β
4-z
цию состояний окисления наиболее удобно на ос-
0
RT
[
CeH
L
]
-z
(23)
=
E
4+
3+
- 2.303
lg
Ce
/Ce
F
β
3-z
нове уравнения (20) с последующей оценкой зна-
[
CeH
-z
L
]
чения -lg(kn=1/k0n=1).
Здесь F - число Фарадея, R - газовая постоянная,
Предварительный анализ показывает примени-
T - абсолютная температура, 2.303RT/F ≈ 0.059,
мость полученных корреляционных соотношений
E0Ce4+/Ce3+
- стандартный потенциал пары Ce4+/
(20)-(22) для изучения комплексов церия(IV) не
Ce3+. Редокс-потенциалы принимают в качестве
только с алифатическими органическими лиган-
основного критерия термодинамической стабили-
дами, координированными через атомы кислорода
зации состояний окисления металла в растворе.
(дикарбоновыми, оксикарбоновыми кислотами и
Так как уравнение (23) может быть представ-
многоатомными спиртами), но также с алифати-
лено в виде (24), а разность редокс-потенциалов
ческими и гетероциклическими соединениями,
E[CeH-zL]4-z/[CeH-zL]3-z - E[CeH-zL]
4-z
3-z ≡ ΔE
/[CeH-zL]
координированными одновременно через атомы
произвольного и стандартного к0мплексов0реакци-
кислорода и азота (аминополиуксусными кис-
онной серии, определяемых уравнением (23), дает
лотами
[34], производными
8-оксихинолина и
),
выражение (25) между величиной ξ = -lg(kn=1/k0n=1
5-пиразолона [18]). Так как химические свойства
соответствующей корреляционным соотношени-
церия(IV) близки к свойствам плутония(IV) и то-
ям (21) и (22), и разностями редокс-потенциалов
рия(IV), можно предполагать возможность при-
из выражений (24) и (25) также могут быть уста-
менения разрабатываемых методов также в химии
новлены линейные корреляционные зависимости
этих элементов (и некоторых других актиноидов).
(26), (27).
Общим условием применимости подхода является
быстрое (за время смешения реагентов) установ-
lgβ
4-
z
=
lgβ
3-z
[
CeH
-
z
L
]
[
CeH
-
z
L
]
ление предравновесия комплексообразования в
1
0
-
(
E
4-
z
3-
z
–
E
4+
3+
,
системах металл-органический лиганд (28).
[
CeH
–
z
L
]
/
[
CeH
-
z
L
]
Ce
/Ce
(24)
0.059
lg(β
4-
z
/β
4-
z
)
[
CeH
–
z
L
]
[
CeH
-
z
L
]
0
(28)
1
=
lg(β
3-z
/β
3-
z
-
∆E,
(25)
ef
[
CeH
L
]
[
CeH
L
]
)
где β
= k+1/k-1. Данное условие предполагает
–z
-
z
0
0.059
0
выполнение неравенства kn=1 << k-1, и кинетики
– lg (
k
n
=1
/
k
n
=
1
)
=
ρ lgβ
z
[
CeH
-
z
L
]3-
(псевдо)первого порядка по отношению к проме-
ρ
0
-
E
4-
z
3-
z
–
E
4+
3+
,
(26)
жуточному комплексу, обеспечивающей линейную
(
[
CeH
–
z
L
]
/
[
CeH
-
z
L
]
Ce
/Ce
)
0.059
экстраполяции кинетических кривых к моменту
0
– lg (
k
/
k
)
τ = 0 для получения начальных значений характе-
n
=
1
n
=
1
ристик систем.
ρ
=
ρ lg(β
3-z
/β
3-z
-
∆E
[
CeH
L
]
[
CeH
L
]
)
(27)
–
z
-
z
0
0.059
Условию быстрого установления равновесия и
И, наконец, заметим, что при решении стаби-
кинетики псевдопервого порядка, удовлетворяют,
как указано в работе [12], практически все систе-
лизационных задач корреляционное соотношение
мы металл-органический лиганд, изученные в ра-
(22) целесообразно использовать для изучения
ботах [8-12], где в качестве металла в неустойчи-
влияния свойств лигандов на стабилизацию состо-
вой состояний окисления рассматривались Ce(IV),
яний окисления металла при координации лиган-
Tl(III), Mn(III), V(V). Исключением явились систе-
дов отдельной серии. Сравнение стабилизирующе-
мы Ti(III)-комплексон, где равновесие комплексо-
го эффекта органических лигандов разных серий
образования устанавливается во времени [11]. Ему
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
ОТНОСИТЕЛЬНАЯ КИНЕТИЧЕСКАЯ УСТОЙЧИВОСТЬ КОМПЛЕКСОВ ЦЕРИЯ(IV)
467
подчиняются также системы Fe(III) c гетероцикли-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ческим соединениями [37], для которых получе-
В качестве исходных веществ использовали
но корреляционное соотношение типа (20) [38].
дикарбоновые (глутаровая, янтарная, малоновая,
Кроме того, в работе [36] показано, что реакции
катионов металлов V(V), Mn(III), Ce(IV), Fe(III),
щавелевая) и оксикарбоновые (хинная, молочная,
Сo(III) с полярными органическими соединения-
лимонная, яблочная, винная) кислоты марки ХЧ,
ми (спиртами, кетонами, карбоновыми, оксикар-
а также предельные многоатомные спирты (глице-
боновыми кислотами) протекают в соответствии
рин марки ЧДА, ксилит и сорбит - ГОСТ 20710-
с выражением (28), а также приведены оцененные
75). Применяли тетрагидрат сульфата церия(IV) и
в кинетических работах значения lgkn=1 и lgβ
ef.
гексанитроцереат аммония квалификации ЧДА. В
Таким образом, можно полагать, что развиваемый
сульфатной и нитратной средах ионную силу I = 2
подход применим к указанной группе катионов.
растворов создавали сульфатом и нитратом аммо-
Более широкий спектр реакций типа (28) и уча-
ния (ЧДА) соответственно. Концентрацию раство-
ствующих в них катионов переходных металлов
ров кислот уточняли pH-метрическим титровани-
рассмотрен в работе [39]. Заметим, что поскольку
ем раствором NaΟΗ, не содержащим иона CO32-.
указанное выше условие применимости разраба-
Содержание церия(IV) в свежеприготовленном
тываемых методов допускает экспериментальную
растворе определяли обратным титрованием со-
проверку, его выполнение должно проверяться пе-
лью Мора в присутствии ферроина перед началом
ред началом исследования.
эксперимента и по его окончании.
Таким образом, в работе предпринято решение
Регистрацию оптической плотности во време-
прямой задачи кинетической стабилизации состо-
яний окисления металла при комплексообразова-
ни осуществляли с помощью спектрофотометра
нии. Предложен метод количественной оценки
Specord UV VIS, оснащенного термостатируемым
кинетической стабилизации неустойчивых состо-
кюветным держателем для прямоугольных квар-
яний окисления металла при координации; введен
цевых кювет с длиной оптического пути l = 1 см
критерий кинетической стабилизации состояний
и фотоэлектроколориметра типа KF-5 с регистри-
окисления, представляющий собой величину отно-
рующим устройством МЭА-4 и термостатиру-
сительной кинетической устойчивости комплекса
емой ячейкой для стандартных кювет с l = 1 см.
к редокс-распаду ξ ≡ -lg(kn=1/k0n=1), определяемую
Временем начала реакции τ = 0 считали момент
корреляционными соотношениями (20)-(22).
переворачивания сосуда-смесителя, в который по-
Корреляционный анализ в химии, целью кото-
мещали исходные компоненты реакционной сме-
рого является анализ форм корреляционных соот-
си. Кинетические измерения проводили на длинах
ношений и нахождение областей их применений,
волн 440 (H2Glut, H2Suc, H2Mal) и 400 нм [H2Ox,
первоначально примененный к изучению орга-
нических реакций, получает все более широкие
H2Quin, H2Lact, H4Citr, H4Tart, R(OH)3, R(OH)5,
приложения (в биохимии, элементоорганической
R(OH)6], где наблюдалось наибольшее увеличение
химии, биологии) [29, 40]. Данная работа демон-
разности ΔD0 = D0 - DM (D0 и DM - оптические
стрирует возможность его применения в коорди-
плотности реакционной смеси и иона металла в
национной химии4 для количественного описания
момент τ = 0) с ростом pH. Измерение pH реакци-
окислительно-восстановительных реакций ком-
онной смеси проводили с помощью прецизионно-
плексов металлов в неустойчивом состояний окис-
го pH-метра DATA METER.
ления с органическими соединениями на основе
корреляционных соотношений между константа-
Мольное соотношение металл-лиганд (1:n)
ми скорости внутримолекулярного редокс-распада
в комплексе, образующемся в момент смешения
указанных комплексов и их константами устойчи-
растворов, устанавливали по кривым насыщения
вости.
на основе диаграмм ΔD0-cL/cM, ·D0-cL/cM [cM и cL -
исходные концентрации церия(IV) и органическо-
·
4 Другим примером применения корреляционного анализа
го лиганда в реакционной смеси,
D0 - начальная
для описания реакций комплексных соединений являются
скорость изменения оптической плотности во вре-
ранние работы по определению констант скоростей диссо-
мени]. Форму присутствия органических лигандов
циации комплексов металлов в устойчивом СО на основе
уравнения Гаммета [41].
L = HkR, R(OH)k в комплексах [MHyLn]q+y-nk, y =
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
468
ВОСКРЕСЕНСКАЯ, СКОРИК
n(k - z), и их константы устойчивости определяли
D0-cL/cM. Доверительный
по зависимостям D0-pH, ·D0-pH [5, 25]. Число про-
интервал для усредненных значений термодина-
тонов (z), вытесненных из молекул лигандов ио-
мических и кинетических величин рассчитыва-
ном церия(IV) при установлении равновесия (29)
ли при объеме выборки N = 32-36 с доверитель-
оценивали по тангенсу угла наклона графика зави-
ной вероятностью
0.95, используя программу
симости (30) в результате сопоставления данных
СТАТОБРАБОТКА [42].
двух-четырех экспериментальных серий.
Константы скорости внутримолекулярного ре-
докс-распада комплекса (knc=1, c-1) и концентраци-
(29)
онного порядка реакции (nc) определяли обобщен-
(30)
ными термодинамическими методами D0, ·D0-pH,
·
где K1yn = β
nef [H+]nz.
D0,
D0-cL/cM [25] и их кинетическими аналогами
·
·
Эффективные константы устойчивости βef рас-
D0,D0-pH,
D0,D0-cL/cM [5, 27]. Согласно работе
считывали по уравнению (31) для каждого из зна-
[25], серии D0-pH, D0-cL/cM дополняли сериями
·
чений pH серий D0-pH, ·D0-pH или по восходящей
D0 ≡ ∂D0/∂τ, c-1, нахо-
части кривых насыщения D0-cL/cM, ·D0 -cL/cM.
дили методом начальных скоростей (33).
·
-D0 = (D0 - Di)/(τ0 - τi) = const.
(33)
(31)
Анализ функциональных зависимостей - ·D0 =
f(pH), - ·D0 = f(cL/cM) дополняли анализом зависи-
Начальную равновесную концентрацию cn0,
мостей - ·D0 = φ(cn0) типа (34).
моль/л, комплекса [MHyLn]q+y-nk находили соглас-
(34)
но формуле cn0 = αn0cM (cM ≤ cL), где αn0 = (D0 - DM)/
D0M) - выход
При A = 0, nc = 1 наблюдаемые (зависящие от
комплекса в момент времени τ = 0, найденный
коэффициента экстинкции комплекса εn, л/моль,
методом D0-pH (D0-cL/cM) и его кинетическим
и толщины поглощающего слоя раствора l, см)
D0-cL/cM) соответственно; ·D0M -
константы скорости редокс-распада первого кон-
начальная скорость изменения оптической плот-
центрационного порядка по комплексу (konbs, c-1) в
C
·
ности раствора церия(IV) ( ·D0M ≈ 0); D∞0 иD0∞ -
случае использования обобщенных термодинами-
максимальные значения начальных оптической
ческих методов определяли в соответствии с урав-
плотности и скорости ее изменения при αn0 = 1.
нением (4), при использовании обобщенных ки-
Значения D∞0 ( ·D∞0) определяли методами D0-cL/cM
нетических методов использовали уравнение (5).
D0-pH) или же обобщенным
Соответствующие константы скорости kn
, с-1,
C=1
методом Бенеши-Хильдебранда [5, 25].
не зависящие от l, εn, рассчитывали c помощью тех
же методов на основе уравнений (6) и (7).
Для равновесия комплексообразования (2) кон-
центрационные константы устойчивости β1уn (3)
Для комплексов состава 1:1 величины lgkn=1
рассчитывали для каждой точки зависимости (32).
оценивали также с помощью комбинированного
метода Бенеши-Хильдебранда-Ардона (35) [5, 21]
lgβ1уn = lgβnef + lgfznω,
(32)
z
где fz = 1 + ΣBi[H]i - функция протонизации, Bi -
i=1
общие константы протонизации анионов Lz- [5, 25,
z
35], ω = 1 + Kh1[H]-1 + Kh2[H]-2 + ΣβiA[A]i c кон-
(35)
i=1
стантами гидролиза церия(IV) по двум ступеням
(Kh1 и Kh2) константами устойчивости комплек-
где Δε = ε1 - εM, εM - коэффициент экстинкции
сов церия(IV) с анионами фона (βiA) [25, 27]. На
иона металла. Полученные разными методами
сульфатном фоне рассчитывали также константы
значения lgkn=1 хорошо согласуются между собой
устойчивости вида lgβ1y1 = lgβef + lgfz, принимая
(см., например, [7]).
в соответствии с работой [28] доминирование ча-
КОНФЛИКТ ИНТЕРЕСОВ
стицы
[CeOH(SO4)3]3- (сокращенное обозначе-
ние [CeOH]3+) в интервале pH = 1-2. Полученные
Авторы заявляют об отсутствии конфликта
значения lgβ1y1 усредняли по данным серий D0-
интересов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
ОТНОСИТЕЛЬНАЯ КИНЕТИЧЕСКАЯ УСТОЙЧИВОСТЬ КОМПЛЕКСОВ ЦЕРИЯ(IV)
469
СПИСОК ЛИТЕРАТУРЫ
ko A.V., Tretyakov Yu.D., Spivak N.Ya. // Biotechnol.
Acta. 2011. Vol. 4. P. 9.
1.
Cerium: Molecular Structure, Technological Applica-
21.
Milenković I., Rabotić K., Matović B., Prekajski M.,
tions and Health Effects / Eds. A. Izyumov, G. Plaksin.
Živković L., Jakovljević D., Gojgić-Cvijović G., Beškos-
New York: Nova Science Publishers, Inc, 2013. 235 p.
ki V. // J. Serb. Chem. Soc. 2018. Vol. 83. N 6. P. 745.
2.
Solola L.A., Zabula A.V., Dorfner W.L., Manor B.C.,
doi 10.2298/JSC171205031M
Carroll P.J., Schelter E.J. // J. Am. Chem. Soc. 2016.
22.
Киселев Ю.М. Проблема стабилизации состояний
Vol. 138. P. 6928. doi 10.1021/jacs.6b03293
окисления. Saarbrücken: Lambert Academic Publish-
3.
Szymański J.K., Temprano-Coleto F., Pérez-Mercader J. //
ing, 2011. 160 с.
Phys. Chem. Chem. Phys. 2015. Vol. 17. P. 6713. doi
23.
Яцимирский К.Б. // ЖНХ. 1991. Т. 36. С. 2010.
10.1039/c4cp05693k
24.
Parry R.V. // ACS Symp. Ser. 1994. N. 565. P. 320. doi
4.
Tandom P.K., Khanam S.C., Singh S.B. // J. Open Catal.
10.1021/bk-1994-0565.ch027
2012. Vol. 5. P. 1. doi 10.2174/1876214X01205010001
25.
Воскресенская O.О., Скорик Н.А. Термодинамиче-
5.
Voskresenskaya O. Kinetic and Thermodynamic
ские и кинетические аспекты образоования и ре-
Stability of Cerium(IV) Complexes with a Series
докс-распада комплексов церия(IV) с рядом гидрок-
of Aliphatic Organic Compounds. New York: Nova
силсодержащих органических соединений. Томск:
Science Publishers, Inc., 2013. 171 p.
НТЛ, 2011. 220 c.
6.
Киселев Ю.М. Химия координационных соединений.
26.
Березин Б.Д. // ТЭХ. 1991. Т. 27. С. 270.
М.: Юрайт, 2019. Ч. 2. 229 с.
27.
Воскресенская O.O., Скорик H.A., Соковикова Н.И. //
7.
Воскресенская O.O., Скорик H.A., Южакова Ю.В. //
ЖНХ. 2019. Т. 64. № 10. С. 1095; Voskresen-
ЖОХ. 2018. Т. 88. № 4. С. 640; Voskresenska-
skaya O.O., Skorik N.A., Sokovikova N.I. // Russ. J.
ya O.O., Skorik N.A., Yuzhakova Yu.V. // Russ. J.
Inorg. Chem. 2019. Vol. 64. N 10. P. 1288. doi 10.1134/
Gen. Chem. 2018. Vol. 88. N 4. P. 721. doi 10.1134/
S0036023619100176
S1070363218040163
28.
Трубачева Л.В., Печурова Н.И. // ЖНХ. 1981. Т. 26.
8.
Малинина Е.А. Автореф. дис
канд. хим. наук. М.,
С. 3254.
1969. 10 с.
29.
Жданов Ю.А., Минкин В.И. Корреляционный ана-
9.
Яковлева Э.Г. Автореф. дис
канд. хим. наук. М.,
лиз в органической химии. Ростов-на-Дону: Изд.
1974. 18 с.
Ростовск. унив, 1966. 470 с.
10.
Вахрамова Г.П. Автореф. дис
канд. хим. наук.
30.
Brønsted J.N. Pedersen K.J. // Z. Phys. Chem. 1924.
М., 1976. 18 с.
Bd 108. S. 185.
11.
Трубачева Л.В. Автореф. дис
канд. хим. наук. М.,
31.
Пальм В.А. Основы количественной теории органи-
1983. 16 с.
ческих реакций. Л.: Химия, 1977.
12.
Координационная химия редкоземельных элементов /
32.
Tratnyek P.G. In: Perspectives in Environmental Chem-
Под ред. В.И. Спицына, Л.И. Мартыненко. М.: МГУ,
istry / Ed. D.L. Macalady. New York: Oxford, 1998.
1979. 254 с.
P. 167.
13.
Piro N.A., Robinson J.R., Walsh P.J., Schelter E.J. //
33.
Hammet L. P. // Chem. Rev. 1935. Vol. 17. P. 125. doi
Coord. Chem. Rev. 2014. Vol. 260. P. 21. doi 10.1016/j.
10.1021/cr60056a010
ccr.2013.08.034
14.
Пат. РФ 0002576763 (2016).
34.
Воскресенская O.O., Скорик H.A., Степанова H.В. //
15.
Pat. CA 2775962C(en) (2017).
ЖПХ. 2016. Т. 89. C. 1375; Voskresenskaya O.O., Sko-
16.
Kovacheva P., Todorovsky D., Mirchev N. // Machines.
rik N.A., Stepanova N.V. // Russ. J. Appl. Chem. 2016.
Technologies. Materials. 2018. Vol. 12. P. 37.
Vol. 89. P. 1747. doi 10.1134/S1070427216110033
17.
Пат. РФ 0002601763 (2016).
35.
Martell A.E., Smith R.M., Motekaitis R.J. NIST Criti-
18.
Воскресенская O.O., Скорик H.A., Наприенко E.H. //
cally Selected Stability Constants of Metal Complexes.
ЖНХ. 2019. Т. 64. № 4. C. 405; Voskresenskaya O.O.,
Database: Version 8.0. National Inst of Standards and
Skorik N.A., Naprienko E.N. // Russ. J. Inorg. Chem.
Technology, Gaithersburg, 2004.
2019. Vol.
64. N
4. P.
511. doi
10.1134/
36.
Денисов Е.Т. Константы скорости гомолитических
S003602361904020X
жидкофазных реакций. М.: Наука, 1971. 711 с.
19.
Hancock M. L., Grulke E.A., Yokel R. // Proc. 2018 AI-
37.
Наприенко Е.Н. Автореф. дис… канд. хим. наук.
ChE Annual Meeting. Pittsburg, 2018. P. 405a.
Томск, 2001. 20 с.
20.
Щербаков А.Б., Жолобак Н.М., Иванов В.К., Тре-
38.
Voskresenskaya O.O., Skorik N.A., Naprienko E.N. //
тьяков Ю.Д., Спивак Н.Я. // Биотехнология. 2011.
Book of Abstracts Int. Heterocyclic Congress
Т. 4. С. 9; Shcherbakov A.B., Zholobak N.M., Usaten-
KOST-2015, Moscow, 2015. P. 410.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
470
ВОСКРЕСЕНСКАЯ, СКОРИК
39. Candlin J.P., Taylor K.A., Thompson D.T. Reactions
41. Moore P., Wilkins R.J. // J. Chem. Soc. 1964. P. 3454.
of Transition Metal-Complexes. Amsterdam; London;
doi 10.1039/JR9640003454
New York: Elsevier Publishing Company, 1968. 483 p.
42. Скорик Н.А., Чернов Е.Б. Расчеты с использованием
40. Chapman N. Correlation Analysis in Chemistry: Recent
персональных компьютеров в химии комплексных
Advances. New York: Springer Science&Business Me-
dia, 2012. 548 с.
соединений. Томск: Изд. ТГУ, 2009. 92 с.
Relative Kinetic Stability of Cerium(IV) Complexes
with Some Organic Compounds of Aliphatic Series
O. O. Voskresenskayaa,* and N. A. Skorikb
a Joint Institute for Nuclear Research, ul. Joliot-Curie 6, Dubna, 141980 Russia
b Tomsk State University, Tomsk, 634050 Russia
*e-mail: voskr@jinr.ru
Received July 29, 2019; revised September 12, 2019; accepted September 16, 2019
Based on a comparative analysis of the obtained stability constants β1уn and rate constants kn=1 of intramolecular
redox decomposition of cerium(IV) complexes [CeHyLn]4+y-nk with a number of aliphatic organic compounds
L = HkR, R(OH)k in sulfate and nitrate media, as well as established correlation ratios between lgkn=1 and lgβ1yn,
a criterion is proposed for the quantitative assessment of kinetic stabilization aof unstable metal oxidation states
during complexation. This criterion represents the value of the relative kinetic stability of the complexes to the
intracomplex redox decay -lg(kn=1/k0n=1) determined by the found correlation relations. The connection of the
latter with the Nernst equation for the redox potential is established.
Keywords: thermodynamics, reaction kinetics, cerium coordination compounds, correlation analysis
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020