ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 3, с. 483-489
УДК 538.915
Si-ДОПИРОВАННЫЕ ОДНОСТЕННЫЕ УГЛЕРОДНЫЕ
НАНОТРУБКИ КАК ПОТЕНЦИАЛЬНЫЕ
КАТАЛИЗАТОРЫ РЕАКЦИИ ВОССТАНОВЛЕНИЯ
КИСЛОРОДА
© 2020 г. А. В. Ващенко, А. В. Кузьмин, Б. А. Шаинян*
Иркутский институт химии имени А. Е. Фаворского Сибирского отделения Российской академии наук,
ул. Фаворского 1, Иркутск, 664033 Россия
*е-mail: bagrat@irioch.irk.ru
Поступило в Редакцию 5 декабря 2019 г.
После доработки 5 декабря 2019 г.
Принято к печати 7 декабря 2019 г.
Методом DFT wB97XD/6-31G* выполнены расчеты одностенных углеродных нанотрубок различного
диаметра, SiC119 (NT-1) и SiC83 (NT-2), допированных атомом кремния. Исследована адсорбция кислорода
на атоме кремния и реакция восстановления кислорода путем присоединения протона с дальнейшим
восстановлением на катоде в рамках двух- и четырехэлектронного механизма реакции восстановления
кислорода. Получены диаграммы свободной энергии в кислой и щелочной среде.
Ключевые слова: одностенные нанотрубки, Si-допирование, реакция восстановления кислорода, ка-
тализаторы, DFT-расчеты
DOI: 10.31857/S0044460X20030199
Перспективным направлением исследования
объектам. Графены, фуллерены и, в меньшей сте-
новых источников энергии являются топливные
пени, нанотрубки были исследованы эксперимен-
элементы на основе электрохимической реакции
тально во многих работах [12-17]. В значительно
восстановления кислорода (ORR, oxygen reduction
меньшей степени исследовано строение интерме-
reaction) с использованием различных катализато-
диатов реакции восстановления кислорода и ее
ров. Наиболее эффективные, но и одновременно
термодинамические аспекты, во многом возмож-
дорогие, недолговечные и подверженные отравле-
ные только теоретическими методами [18, 19]. В
нию катализаторы - это платиновые катализаторы
связи с этим, а также в продолжение нашего не-
[1-3]. Попытка уйти от дорогих катализаторов на
давнего теоретического анализа допированных
основе платины привела исследователей к угле-
углеродных наноматериалов (графена) [19], в на-
родным наноматериалам, таким как графены, фул-
стоящем сообщении теоретически рассмотрены
лерены и нанотрубки, допированные различными
одностенные нанотрубки разного диаметра, допи-
гетероатомами [4-6]. Каталитическая активность
рованные атомом кремния, состава SiC83 и SiC119,
некоторых представителей этих материалов срав-
их взаимодействие с кислородом, строение интер-
медиатов 2- и 4-электронной реакции восстанов-
нима с таковой у Pt/C, а зачастую превосходит
его, в том числе по стабильности и цене [7-11].
ления кислорода с их участием и термодинамика
этих реакций.
Коммерческая доступность углеродных наномате-
риалов, производимых в настоящее время в круп-
В качестве объектов исследования были выбра-
нотоннажном масштабе, существенно облегчила
ны две нанотрубки разного диаметра NT-1 и NT-2
доступ и повысила интерес исследователей к этим
(схема 1). Различный диаметр нанотрубок был
483
484
ВАЩЕНКО и др.
Схема 1.
Si
Si
NT-1, SiC119, d ~8.15 Å
NT-2, SiC83, d ~4.4 Å
выбран как для исследования реакции восстанов-
ответствует большей величине η атома кремния
ления кислорода, так и в целях проверки влияния
(рис. 1). Расстояние от атома Si до плоскости,
пирамидальности атома кремния на его реакцион-
определяемой тремя ближайшими атомами угле-
ную способность и как следствие, на активность
рода, составляет 0.695 Å (NT-1) и 1.005 Å (NT-2)
катализатора в реакции восстановления кислорода.
(рис. 1). Такие геометрические параметры свиде-
тельствуют о сильном нарушении ароматичности
Расчеты выполнены методом wB97XD в базисе
вокруг атома кремния в обеих нанотрубках, в то
6-31G* с использование пакета программ Gaussian
время как оставшиеся атомы углерода остаются
09 [20]. Пирамидальность атома кремния в нано-
ароматическими. Энергия образования нанотру-
трубках NT-1 и NT-2 можно определить как η =
бок Ef, согласно работе [21], определяется по урав-
360 - ΣSi, где ΣSi - сумма трех углов CSiC у ато-
нению (1).
ма кремния. Для плоской конфигурации η = 0, для
Ef = (ESi-NT - ENT) - (ESi - EC),
(1)
тетраэдрической η = 31.5°, тогда как для NT-1 η =
~56°, а для NT-2 η = ~80°, т. е. в обоих случаях
где ESi-NT, ENT, ESi и EC - полные энергии Si-
пирамидальность атома кремния заметно выше
допированной нанотрубки, исходной углеродной
тетраэдрической, указывая на бóльшую долю
нанотрубки, и атомов кремния и углерода соответ-
р-характера орбиталей Si-C связей. Для узкой
ственно.
нанотрубки NT-2 величина η близка к таковой у
Большее напряжение Si-допированной нано-
вершины куба (90°). Три связи Si-C находятся в
трубки NT-2 соответствует ее меньшей энергии
пределах 1.74-1.80 Å (NT-1) и 1.82-1.93 Å (NT-2).
образования (-5.23 эВ) в сравнении с нанотруб-
Бóльшая кривизна стенок нанотрубки NT-2 со-
кой NT-1 (-9.98 эВ), а бóльшая пирамидальность
NT-1
NT-2
Рис. 1. Зависимость пирамидальности атома кремния от диаметра трубки.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
Si-ДОПИРОВАННЫЕ ОДНОСТЕННЫЕ УГЛЕРОДНЫЕ НАНОТРУБКИ
485
NT-1
NT-2
Рис. 2. Карта перераспределения зарядовой плотности (CDD) между первым синглетным электронно-возбужденным и ос-
новным состояниями модельных нанотрубок. Светло-серым цветом отмечено накопление заряда, темно-серым - уменьшение.
(а)
(б)
Рис. 3. Оптимизированная структура адсорбатов [О2*-NT-1] (а) и [О2*-NT-2] (б).
атома кремния делает его более оксофильным. В
Примечательно прямо противоположное изме-
результате, присоединение молекулы О2 к нано-
нение геометрии фрагмента SiC3 в нанотрубках
трубке NT-2 более экзотермично (Еадс = -4.51 эВ),
при адсорбции молекулы О2. Пирамидальность
чем к менее пирамидальному атому кремния в на-
атома кремния η возрастает от 56° в случае NT-1
нотрубке NT-1 (Еадс = -2.86 эВ). Данное предпо-
до 74° в [О2*-NT-1], и снижается от 80° в случае
ложение согласуется с результатами перераспреде-
NT-2 до 43° в аддукте [О2*-NT-2]. Длины связей
ления зарядовой плотности (CDD - charge density
Si-С в узле SiC3 суммарно удлиняются на ~0.18 Å
distribution) вблизи атома кремния в модельных
нанотрубках (рис. 2).
в случае [О2*-NT-1] и укорачиваются на ~0.13 Å в
аддукте [О2*-NT-2]. Очевидно, все это происходит
Существенно отличаются и структуры аддук-
тов: в случае [О2*-NT-1] оба кислорода молекулы
в результате вытягивания атома кремния из осто-
О2 взаимодействуют с атомом кремния, образуя
ва нанотрубки NT-1 под действием двух атомов
несимметричную силадиоксирановую структу-
кислорода в аддукте [О2*-NT-1] и втягивания его
ру со связью O-O 1.550 Å и связями Si-O 1.663
в результате образования связи О-С в случае [О2*-
и 1.720 Å (рис. 3а), тогда как в случае [О2*-NT-2]
NT-2].
образуется 1-сила-2,3-диоксетан со связями Si-O
В таблице представлены относительные энер-
1.703, O-O 1.495, O-C 1.463 и Si-C 1.820 Å вслед-
гии адсорбции и свободные энергии Гиббса основ-
ствие аккумуляции значительного положительно-
го заряда на соседнем с кремнием атоме углерода
ных кислородсодержащих интермедиатов на нано-
(рис. 2б, 3б).
трубках NT-1 и NT-2.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
486
ВАЩЕНКО и др.
Энергии адсорбции и свободные энергии Гиббса клю-
Окончательно, диаграммы свободных энергий
чевых кислородсодержащих интермедиатов реакции
для 2e-- и 4e--механизмов реакции восстановле-
восстановления кислорода на нанотрубках NT-1 и NT-2
ния кислорода были построены по методике, пред-
NT-1
NT-2
ложенной в работе [22] по уравнению (18).
Интермедиат
ΔG = ΔE + ΔZPE - TΔS + ΔGU + ΔGpH,
(18)
Eадс,
ΔG,
Eадс,
ΔG,
эВа
эВб
эВа
эВб
где ΔE это разница энергий между продукта-
ми и реагирующими веществами [уравнения (2)-
*
-
0.00
-
0.00
(17)]; ΔZPE и ΔS - поправка на энергию нулевых
O2
-2.86
-1.80
-4.51
-3.25
колебаний и энтропию; T - температура (298.15 K);
HOO*
-3.16
-2.08
-3.98
-3.01
ΔGU = -neU, где n - число электронов в реакции,
e - заряд электрона и U - потенциал на элект-
O*
-7.38
-2.16
-8.40
-3.13
роде; ΔGpH = kBTln10·pH, где kB - постоянная
HO*
-4.76
-2.94
-5.60
-3.88
Больцмана. Для симуляции свойств кислой или
а Eадс = EX*-NT - (EX + ENT), где X = O2, HOO, O, HO.
щелочной среды были выбраны значения pH = 0
б Свободные энергии Гиббса рассчитаны при потенциале пе-
(ΔGpH = 0 эВ) и pH = 13 (ΔGpH = 0.77 эВ). Полная
ренапряжения U = 1.23 В, соответствующем равновесию в
энергия и энтропия H2O рассчитана в газовой фазе
системе 4[H+ + e-] + O2 = 2H2O в кислой среде [см. уравне-
при давлении 0.035 бар (равновесное давление
ние (18)].
пара H2O при 298.15 K). Свободная энергия мо-
Нами был рассмотрен двух- и четырехэлек-
лекулы O2 вычислена из свободной энергии реак-
тронный механизм восстановления кислорода,
ции (19) и равна -4.92 эВ.
предложенный в работе [22].
O2 + 2H2 → 2H2O.
(19)
Для
2e--механизма реакции восстановления
Свободная энергия молекулы H2O2 рассчитана
кислорода в кислой среде:
из реакции (20) и равна -1.39 эВ. Свободная энер-
O2 + * + 2[H+ + e-] → O2* + 2[H+ + e-],
(2)
гия [H+ + e-] в растворе была оценена как энергия
O2* + 2[H+ + e-] → HOO* + [H+ + e-],
(3)
1/2H2 при нормальных условиях. Свободная энер-
гия HO- рассчитана из равновесной реакции (21) в
HOO* + [H+ + e-] → H2O2.
(4)
водном растворе и составляет -0.03 эВ. Энтропии
Суммарно: O2 + 2[H+ + e-] → H2O2,
(5)
и частоты нормальных колебаний молекул в газо-
Для
4e--механизма реакции восстановления
вой фазе взяты из базы данных NIST [23].
кислорода в кислой среде:
O2 + H2 → H2O2,
(20)
O2 + * + 4[H+ + e-] → O2* + 4[H+ + e-],
(6)
H3O+ + HO- = 2H2O.
(21)
O2* + 4[H+ + e-] → HOO* + 3[H+ + e-],
(7)
Формирование адсорбатов разной структуры в
HOO* + 3[H+ + e-] → O* + H2O + 2[H+ + e-],
(8)
нанотрубках NT-1 и NT-2 (рис. 3) приводит к раз-
O* + 2[H+ + e-] → HO* +H2O + [H+ + e-],
(9)
личным энергетическим характеристикам реакции
восстановления кислорода . Энергию адсорбции
HO* + H2O + [H+ + e-] → 2H2O + *,
(10)
оценивали по уравнению (22) по методике, приве-
Суммарно: O2 + 4[H+ + e-] → 2H2O.
(11)
денной в статье [10].
Для 4e- механизма реакции восстановления
Eадс = Eадсорбат*Si-NT - Eадсорбат - ESi-NT,
(22)
кислорода в щелочной среде:
где Eадсорбат*Si-NT, Eадсорбат и ESi-NT - полные энер-
O2 + * + 2H2O +4e- → O2* + 2H2O + 4e-,
(12)
гии адсорбата вместе с Si-допированным катализа-
O2* + 2H2O +4e- → HOO* + H2O + HO- + 3e-,
(13)
тором, невзаимодействующих адсорбата и катали-
затора соответственно. Отрицательные значения
HOO* + H2O + HO- + 3e- → O* + 2HO- + 2e-,
(14)
Eадс указывают на эффективность процесса адсо-
O* + 2HO- + 2e- → HO* + 3HO- + e-,
(15)
рбции. Присоединение молекулы O2 к нанотруб-
HO* + 3HO- + e- → 4HO- + *,
(16)
ке NT-2 энергетически выгодно (Eадс = -4.51 эВ).
Суммарно: O2 + 2H2O +4e- → 4HO-.
(17)
Аналогичный процесс с нанотрубкой NT-1 дает
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
Si-ДОПИРОВАННЫЕ ОДНОСТЕННЫЕ УГЛЕРОДНЫЕ НАНОТРУБКИ
487
(а)
(б)
(в)
(г)
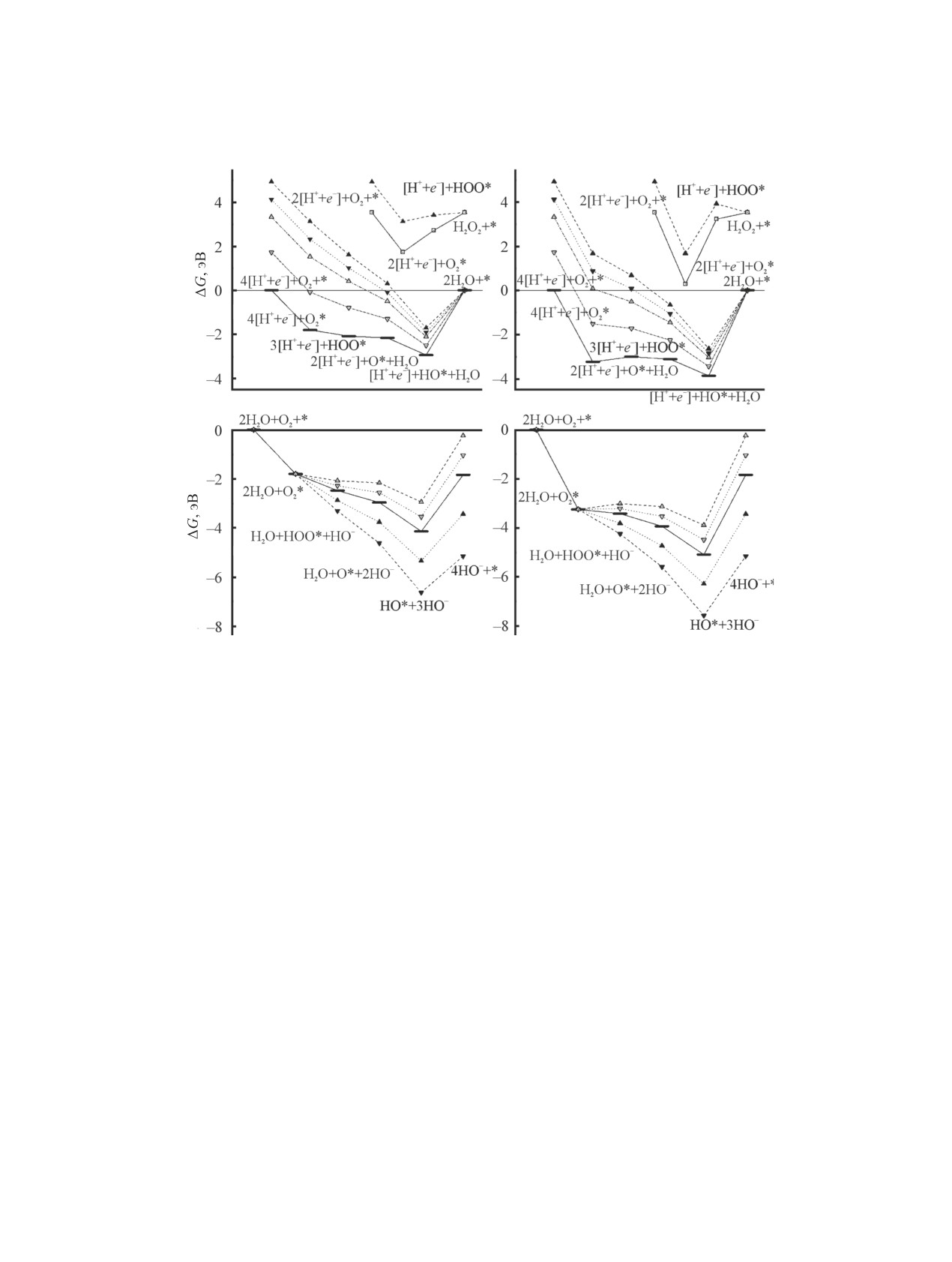
Рис. 4. Диаграммы свободной энергии процесса реакции восстановления кислорода при различных потенциалах электрода
U на Si-допированных нанотрубках SiC119 и SiC83 в кислой (а, б) и щелочной (в, г) средах, рассчитанные в приближении
wB97XD/6-31G*. ▲ - U = 0 В,▼- U = 0.2 В,
- U = 0.4 В, Δ - 0.8 В, - - 1.23 В (а, б); ▼ - U = -0.83 В, ▲ - U = -0.4 В, - -
0 В;
- U = 0.2 В, Δ - 0.4 В (в, г).
баланс в -2.86 эВ. Детальная диаграмма четырех-
ных электронов. Увеличение потенциала вплоть
электронного процесса реакции восстановления
до его равновесного значения U = 1.23 В приводит
кислорода представлена на рис. 4.
к еще большему понижению свободной энергии
данного интермедиата до -2.94 эВ. Таким образом,
Процесс восстановления кислорода на Si-
финальный перенос четвертого e-, приводящий к
допированных нанотрубках может протекать
образованию второй молекулы H2O, становит-
как в кислой, так и щелочной средах, будучи не-
ся термодинамически невыгодным. Аналогичная
сколько предпочтительнее в последнем случае.
термодинамическая картина наблюдается и для
Зависимость реакции восстановления кислорода
нанотрубки NT-2 (рис. 4б), однако по сравнению
от внешнего потенциала на электроде предпола-
с нанотрубкой NT-1 интермедиаты 4e--реакции
гает подбор оптимальных условий для кислой и
восстановления кислорода имеют еще более глу-
щелочной сред. Значение потенциала U варьиро-
бокие значения ΔG. Так, например, ΔG[HО*-NT-2] =
валось от 0 до 1.23 В в кислой среде и от -0.83 до
-3.88 эВ при U = 1.23 В, что на 0.94 эВ ниже, чем
0.4 В в щелочной среде. Четырехэлектронное вос-
становление кислорода на Si-допированном ката-
для [HО*-NT-2].
лизаторе NT-1 в кислой среде в отсутствие потен-
Стоит отметить, что 2e--маршрут реакции вос-
циала приводит к монотонному понижению сво-
становления кислорода в кислой среде на катали-
бодной энергии до -1.70 эВ которому соответству-
заторе NT-1 (а также NT-2) практически невозмо-
ет интермедиат [HО*-NT-1] (рис. 4а) и, соответ-
жен, поскольку сопряжен с преодолением энерге-
ственно, переносу только трех из четырех возмож-
тического барьера ΔΔG2e- = ΔGH2O2 - ΔGO2*, кото-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
488
ВАЩЕНКО и др.
рый составляет от 0.41 до 1.80 эВ в случае NT-1 и
КОНФЛИКТ ИНТЕРЕСОВ
от 2.25 до 3.25 эВ для NT-2; значение U изменяется
Авторы заявляют об отсутствии конфликта
от 0 до 0.695 В соответственно.
интересов.
Замена кислой среды на щелочную не приво-
дит к значительным изменениям в термодинамике
СПИСОК ЛИТЕРАТУРЫ
4e--реакции восстановления кислорода (рис. 4в, г),
1.
Song C., Zhang J. In: PEM Fuel Cell Electrocatalysts
а интермедиат HO* остается наиболее термоди-
and Catalyst Layers / Ed. J. Zhang. London: Springer,
намически предпочтительным при всех значени-
2008. P. 89. doi 10.1007/978-1-84800-936-3_2
ях U. Примечательно, что понижение потенциала
2.
Gasteiger H.A., Kocha S.S., Sompalli B., Wagner F.T. //
U вплоть до -0.83 В приводит к незначительному
Appl. Catal. (B). 2005. Vol. 56. N 1. P. 9. doi 10.1016/j.
apcatb.2004.06.021
уменьшению барьера переноса четвертого элек-
3.
Zhang Y., Zhang X., Liu M., Liu Y., Huang H., Lin S. //
трона, ΔΔG = ΔGHO- - ΔGHO*, который составля-
J. Solid State Electrochem. 2018. Vol. 22. N 7. P. 2159.
ет 1.48 эВ (NT-1) и 2.42 эВ (NT-2). Тем не менее,
doi 10.1007/s10008-018-3902-6
перенос четвертого электрона в щелочной среде
4.
Higgins D., Zamani P., Yu A., Chen Z. // Energy Environ.
все же возможен, поскольку свободная энергия
Sci. 2016. Vol. 9. N 2. P. 357. doi 10.1039/C5EE02474A
продукта реакции (4HO-) зависит исключительно
5.
Wang D.-W., Su D. // Energy Environ. Sci. 2014. Vol. 7.
от потенциала U и всегда ниже, чем для исходной
N 2. P. 576. doi 10.1039/C3EE43463J
6.
Chen N., Huang X., Qu L. // Phys. Chem. Chem.
системы вплоть до равновесного для щелочной
Phys. 2015. Vol. 17. N 48. P. 32077. doi 10.1039/
среды потенциала U = 0.4 В.
C5CP04391C
Изучение профилей свободной энергии с ис-
7.
Inagaki M., Toyoda M., Soneda Y., Morishita T. //
пользованием наиболее стабильных интерме-
Carbon. 2018. Vol. 132. P. 104. doi 10.1016/j.
диатов указывает на то, что как в кислой, так и
carbon.2018.02.024
8.
Kim S., Kato S., Ishizaki T., Li O.L., Kang J. //
щелочной средах четырехэлектронная реакция
Nanomaterials 2019. Vol. 9. N 5. P. e742. doi 10.3390/
восстановления кислорода на Si-допированной
nano9050742
нанотрубке SiC119 доходит до глобального мини-
9.
Osmieri L. // Chem. Eng. 2019. Vol. 3. N 1. 16. doi
мума при всех потенциалах на катоде, при этом
10.3390/chemengineering3010016
оптимальным является потенциал, близкий к ну-
10.
Zhang J., Wang Z., Zhu Z., Wang Q. // J.
левому (кислая среда) или максимально возмож-
Electrochem. Soc. 2015. Vol. 162. N 7. P. f796. doi
10.1149/2.0041508jes
ный отрицательный (щелочная среда). Протекание
11.
Liu K., Kattel S., Mao V., Wang G. // J. Phys. Chem. C.
двухэлектронного маршрута восстановления кис-
2016. Vol. 120. N 3. P. 1586-1596. DOI: 10.1021/acs.
лорода является маловероятным вследствие на-
jpcc.5b10334
личия высоких энергетических барьеров между
12.
Wang X., Sun G., Routh P., Kim D.-H., Huang W.,
интермедиатами и продуктом такой реакции, мо-
Chen P. // Chem. Soc. Rev. 2014. Vol. 43. N 20. P. 7067.
лекулой H2O2. Также стоит отметить значительное
doi 10.1039/C4CS00141A
влияние диаметра углеродной нанотрубки (кри-
13.
Zhu C., Dong S. // Nanoscale. 2013. N 5. P. 1753. doi
визна ее стенки) на термодинамические характе-
10.1039/c2nr33839d
14.
Shao Y., Sui J., Yin G., Gao Y. // Appl. Catal. (B). 2008.
ристики процесса восстановления кислорода. Так,
Vol. 79. N 1. P. 89. doi 10.1016/j.apcatb.2007.09.047
Si-допированные нанотрубки большого диаметра
15.
Wang Y., Jiao M., Song W., Wu Z. // Carbon. 2017.
более предпочтительны, чем таковые малого диа-
Vol. 114. P. 393. doi 10.1016/j.carbon.2016.12.028
метра при катализе реакции восстановления кис-
16.
Campos-Delgado J., Maciel I.O., Cullen D.A.,
лорода.
Smith D.J., Jorio A., Pimenta M.A., Terrones H.,
Terrones M. // ACS Nano. 2010. Vol. 4. N 3. P. 1696.
ФОНДОВАЯ ПОДДЕРЖКА
doi 10.1021/nn901599g
17.
Liu Z., Fu X., Li M., Wang F., Wang Q., Kang G., Peng F. //
Работа выполнена при финансовой поддержке
J. Mater. Chem. (A). 2015. Vol. 3. N 7. P. 3289. doi
Российского фонда фундаментальных исследова-
10.1039/c4ta05937a
ний (грант № 18-53-76004).
18.
Kaukonen M., Krasheninnikov A.V., Kauppinen E.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020
Si-ДОПИРОВАННЫЕ ОДНОСТЕННЫЕ УГЛЕРОДНЫЕ НАНОТРУБКИ
489
Nieminen R.M. // ACS Catal. 2013. Vol. 3. N 2. P. 159.
Klene M., Knox J.E., Cross J.B., Bakken V., Adamo C.,
doi 10.1021/cs300605t
Jaramillo J., Gomperts R., Stratmann R.E., Yazyev O.,
19. Villemson K.M., Kaare K., Raudsepp R., Käämbre T.,
Austin A.J., Cammi R., Pomelli C., Ochterski J.W.,
Šmits K., Wang P., Kuzmin A.V., Šutka A., Shainyan B.A.,
Martin R.L., Morokuma K., Zakrzewski V.G., Voth G.A.,
Kruusenberg I. // J. Phys. Chem. (C). 2019. Vol. 123.
Salvador P., Dannenberg J.J., Dapprich S., Da-
P. 16065. doi 10.1021/acs.jpcc.9b00117
niels A.D., Farkas O., Foresman J.B., Ortiz J.V.,
20. Frisch M.J., Trucks G.W., Schlegel H.B, Scuseria G.E.,
Cioslowski J., Fox D.J. Gaussian 09, Revision C.01.
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
Gaussian, Inc., Wallingford, CT, 2009.
Mennucci B., Petersson G.A., Nakatsuji H., Caricato M.,
21. Liu Y.Q., Sun X.B., Gahungu G., Qu X.C., Wang Y.,
Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G.,
Wu Z.J. // J. Mater. Chem. (C). 2013. Vol. 1. N 23.
Sonnenberg J.L., Hada M., Ehara M., Toyota K.,
P. 3700. doi 10.1039/c3tc30206g
Fukuda R., Hasegawa J., Ishida M., Nakajima T.,
22. Nørskov J.K., Rossmeisl J., Logadottir A., Lindqvist L.,
Honda Y., Kitao O., Nakai H., Vreven T., Montgomery J.A.,
Kitchin J.R., Bligaard T., Jonsson H. // J. Phys. Chem.
Jr., Peralta J.E., Ogliaro F., Bearpark M., Heyd J.J.,
(B). 2004. Vol. 108. N 46. P. 17886. doi 10.1021/
Brothers E., Kudin K.N., Staroverov V.N., Kobayashi R.,
jp047349j
Normand J., Raghavachari K., Rendell A., Burant J.C.,
23. NIST Standard Reference Database Number 69. doi
Iyengar S.S., Tomasi J., Cossi M., Rega N., Millam J.M.,
10.18434/T4D303
Si-Doped Single-Walled Carbon Nanotubes as Potential
Catalysts for Oxygen Reduction Reactions
A. V. Vashchenko, A. V. Kuzmin, and B. A. Shainyan*
A.E. Favorsky Irkutsk Institute of Chemistry of the Siberian Branch of the Russian Academy of Sciences,
Irkutsk, 664033 Russia
*e-mail: bagrat@irioch.irk.ru
Received December 5, 2019; revised December 5, 2019; accepted December 7, 2019
The DFT wB97XD/6-31G* method was used to calculate Si-doped single-walled carbon nanotubes of various
diameters, SiC119 (NT-1) and SiC83 (NT-2). The oxygen adsorption on the silicon atom and the oxygen reduc-
tion reaction by attaching a proton with further reduction at the cathode were studied as a part of a two- and
four-electron mechanism of the oxygen reduction reaction. The diagrams of free energy in an acidic and alkaline
medium were constructed.
Keywords: single-walled nanotubes, Si doping, oxygen reduction reaction, catalysts, DFT calculations
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 3 2020