ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 4, с. 495-500
УДК 547.269.1:547.284.3:66.095.32
ОСОБЕННОСТИ КОНДЕНСАЦИИ ПРОПАН-2-ОНА С
ФОРМАЛЬДЕГИДОМ И ПРОПАН-2-ТИОЛОМ
© 2020 г. Л. А. Баева*, Р. М. Нугуманов, Л. Ф. Бикташева, Р. Л. Сафиуллин
Уфимский институт химии Уфимского федерального исследовательского центра
Российской академии наук, пр. Октября 69, Уфа, 450054 Россия
*e-mail: sulfur@anrb.ru
Поступило в Редакцию 31 октября 2019 г.
После доработки 31 октября 2019 г.
Принято к печати 7 ноября 2019 г.
Трехкомпонентная конденсация пропан-2-она с формальдегидом и пропан-2-тиолом в присутствии
гидроксида натрия приводит к 3-[(2-пропилсульфанил)метил]бут-3-ен-2-ону или 1,1-бис[(2-пропил-
сульфанил)метил]пропан-2-ону в зависимости от количества используемого основания. Образование
1,1-бис[(2-пропилсульфанил)метил]пропан-2-она из 6-метил-5-тиагептан-2-она протекает через стадии
его альдольной конденсации с формальдегидом и последующего нуклеофильного присоединения тиола
к двойной связи промежуточного 3-[(2-пропилсульфанил)метил]бут-3-ен-2-она в присутствии гидрок-
сида натрия.
Ключевые слова: тиол, формальдегид, γ-кетосульфид, β-меркаптокетон, трехкомпонентная конденсация,
тиа-реакция Михаэля
DOI: 10.31857/S0044460X20040010
В последнее время в органическом синтезе ши-
панон) взаимодействуют с формальдегидом и тио-
роко используются мультикомпонентные реакции,
лами с образованием моно(алкилсульфанилметил)
удовлетворяющие принципам «зеленой» химии. К
замещенных кетонов [19, 20]. В тех же условиях
ним относятся трехкомпонентные конденсации ке-
реакции с участием метилкетонов (пропан-2-он,
тонов и дикетонов с альдегидами и аминами [1-4]
1-фенилэтанон) приводят к ди(алкилсульфанилме-
или тиолами [5-10]. При взаимодействии кетонов
тил)замещенным продуктам. Выходы монозаме-
с альдегидами и тиолами образуются полифункци-
щенных соединений не превышают 31%. С целью
ональные γ-кетосульфиды (β-меркаптокетоны), об-
выявления оптимальных условий синтеза γ-ке-
ладающие свойствами экстрагентов благородных
тосульфидов различного строения исследованы
металлов [11, 12], флотореагентов сульфидных зо-
закономерности взаимодействия доступного про-
лотосодержащих руд [13], ингибиторов сероводо-
пан-2-она с формальдегидом и пропан-2-тиолом в
родной коррозии [14], синтонов для медицинской,
щелочной среде.
экстракционной, сельскохозяйственной и гетеро-
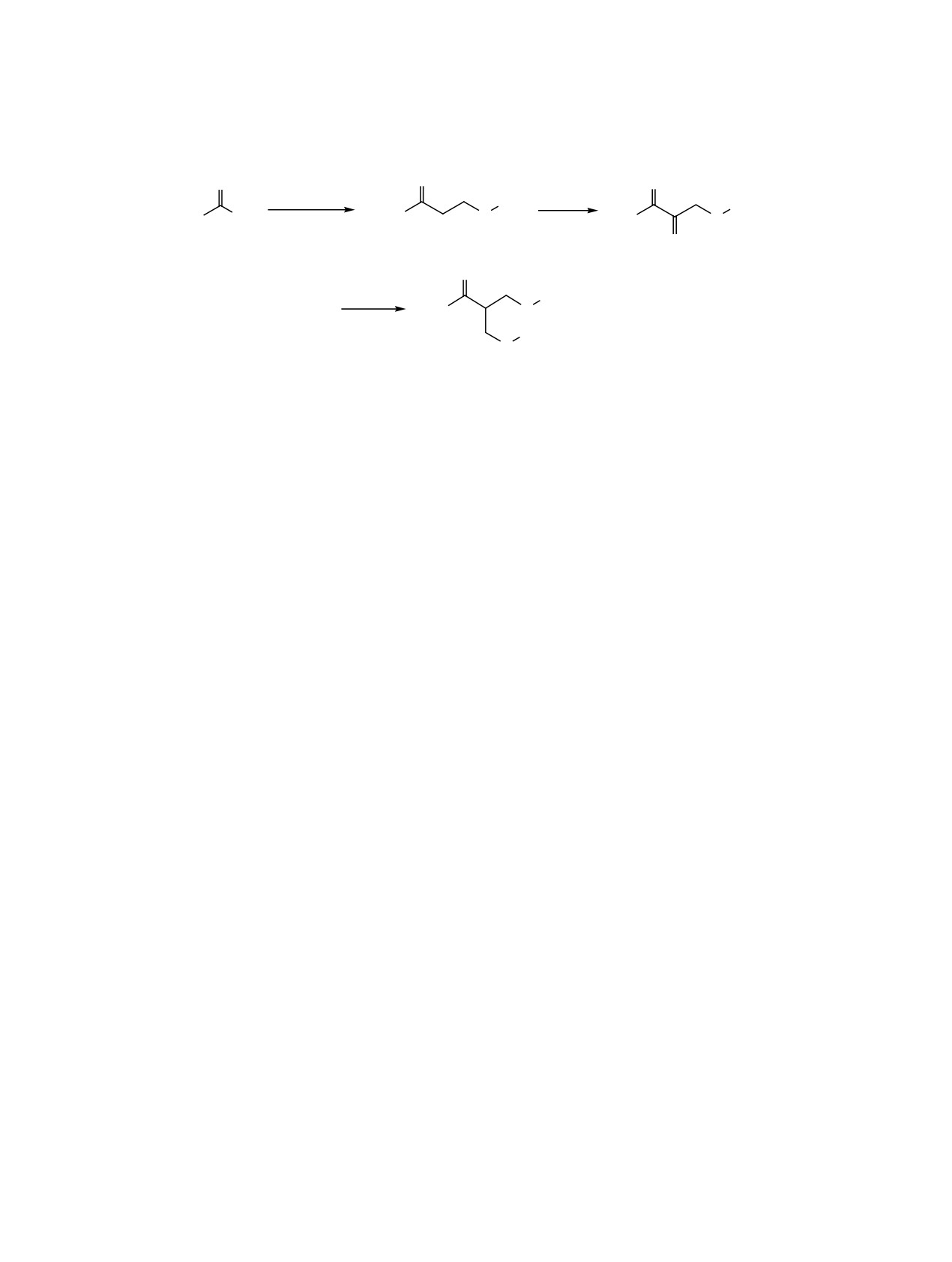
Трехкомпонентная конденсация пропан-2-она
циклической химии [8, 10, 15-18]. Возможность
с эквимолярными количествами формальдегида и
осуществления реакции в присутствии основания
пропан-2-тиола в присутствии 0.03-1.25 экв. ги-
позволяет использовать в качестве источника ти-
дроксида натрия при 20°С приводит к образованию
олов сульфидно-щелочные растворы, образую-
смеси 6-метил-5-тиагептан-2-она 1, ранее неиз-
щиеся при щелочной очистке газоконденсатов и
вестного
3-[(2-пропилсульфанил)метил]бут-3-ен-
нефтепродуктов от серосодержащих соединений
2-она
2 и
1,1-бис[(2-пропилсульфанил)метил]-
[19].
пропан-2-она 3 (схема 1).
Кетоны с метиленовой компонентой при
Кетосульфиды 1 и 3 являются продуктами по-
карбонильной группе (бутан-2-он, 1-фенил-1-про-
следовательного введения алкилсульфанилметиль-
495
496
БАЕВА и др.
Схема 1.
O
Me Me
+ CH2O + i-PrSH
O
O
O
NaOH
Pr-i
Pr-i
Pr-i
+
+
Me
S
Me
S
Me
S
20qC
CH
2
Pr-i
S
1
2
3
ной группы в молекулу пропан-2-она. Соединение
ные характеристики соединений 1 и 3 хорошо со-
2 образуется в результате альдольной конденсации
гласуются с опубликованными ранее в работах [21,
6-метил-5-тиагептан-2-она 1 с формальдегидом.
22].
Состав и строение соединений 1-3, выделен-
По данным функционального анализа реакци-
ных с помощью вакуумной перегонки (соединение
онной смеси и исследования продуктов реакции
3) и колоночной хроматографии (соединения 1 и
методом газожидкостной хроматографии конвер-
2), установлены на основании данных элементно-
сия пропан-2-тиола и соотношение образующихся
го анализа и спектральных характеристик. Образо-
соединений 1-3 зависит от количества гидроксида
вание кетоаллилсульфида 2 подтверждается при-
натрия.
сутствием в спектре ЯМР 1H синглетных сигналов
При молярном соотношении кетон:CН2O:
неэквивалентных олефиновых протонов при 5.94
2-PrSH:NaOH = 1:1:1:0.03 конверсия тиола не
и 6.08 м. д., которые не наблюдаются в спектре
превышает 47% (1 ч). Через 5 мин в реакцион-
исходного кетосульфида 1, а также наличием ха-
ной смеси содержится преимущественно 6-ме-
рактерных сигналов атомов С3 (145.6 м. д.) и С4
тил-5-тиагептан-2-он 1, образование продуктов
(125.9 м. д.) в спектре ЯМР 13С. В ИК спектре со-
2 и 3 в заметных количествах не наблюдается
единения 2 присутствуют полосы поглощения ва-
(рис. 1а). С увеличением времени реакции до
лентных колебаний связей С=O, С=С и =С-H при
10 мин содержание кетосульфида 1 уменьшается
1681, 1626 и 3096 см-1 соответственно. Спектраль-
за счет его превращения в соединения 2 и 3, выхо-
ɚ
ɛ
IJ ɦɢɧ
IJ ɦɢɧ
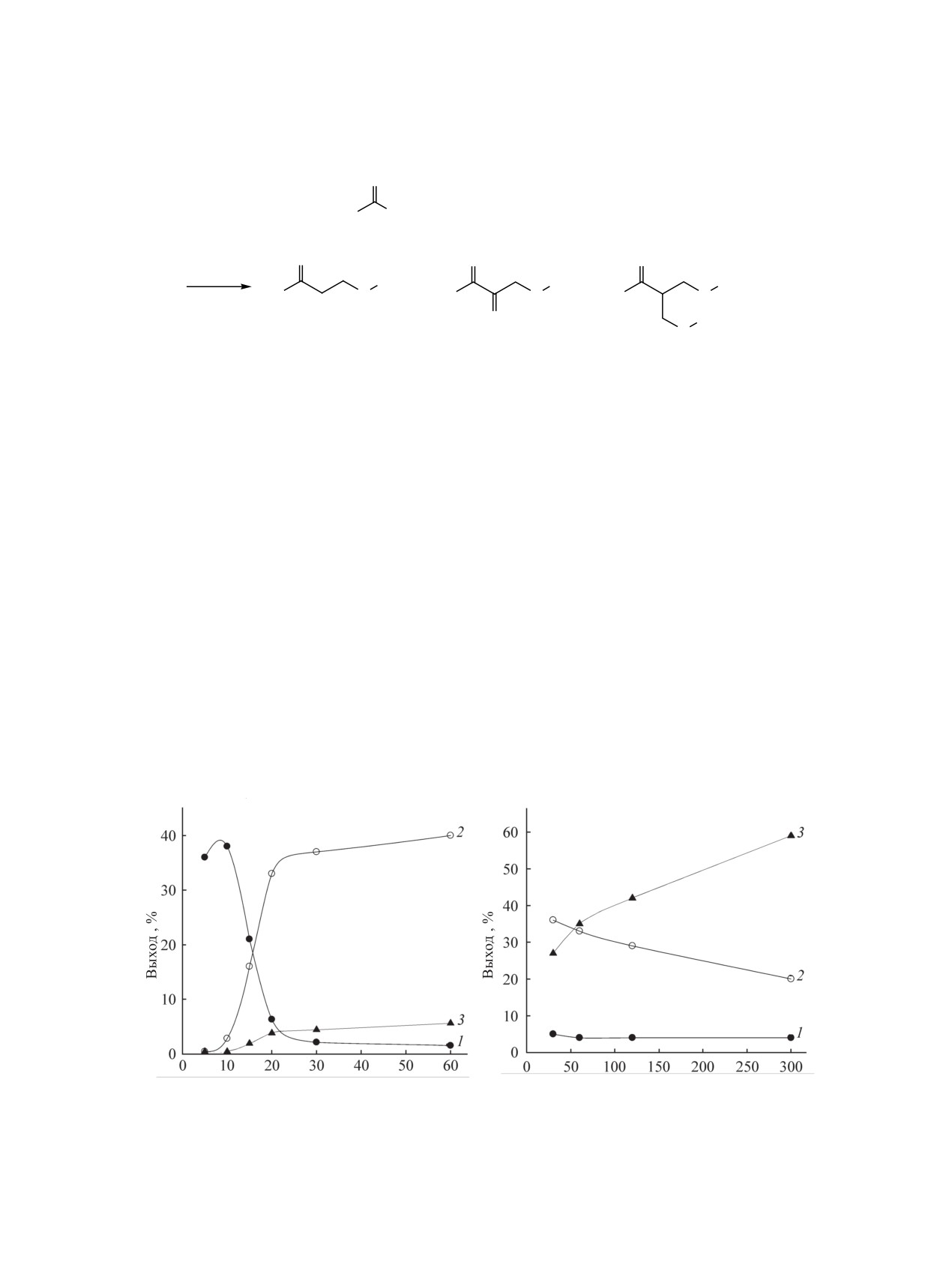
Рис. 1. Зависимость выходов соединений 1-3 (1-3) от продолжительности взаимодействия пропан-2-тиола с формальдеги-
дом и пропан-2-оном при молярном соотношении кетон:CH2O:тиол:NaOH = 1:1:1:0.03 (а) и 1:1:1:0.4 (б) при 20°С.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
ОСОБЕННОСТИ КОНДЕНСАЦИИ ПРОПАН-2-ОНА
497
Выходы продуктов конденсации пропан-2-она с формальдегидом и пропан-2-тиолом в присутствии гидроксида на-
трия (20°С)a
№
Молярное соотношение
Конверсия
Выход, %б
τ, мин
опыта
кетон:CH2O:тиол:NaOH
2-PrSH, %
1
2
3
1
1:1:1:0.13
56
60
4
34
18
2
1: 2:1:0.13
73
60
-
67
5
3
1:1:1:1
99
15
8
12
65
5
1:1:1:1.25
99
15
6
11
67
6 в
1:1.25:1:1
95
30
-
3
86
7 г
1:2:1:1
99
15
2
40
49
8
1:2:2:2
99
15
2
17
60
9
5:1:1:0.75
97
15
34
2
57
10
10:1:1:0.75
97
15
72
1
6
a Обнаружен 2-PrSSPr-2 c выходом 2-4 (оп. № 3-7, 9) и 12% (оп. № 8, 10). б В расчете на 2-PrSH. в В среде EtOH. г Сопровождается
образованием полимерного продукта.
ды которых возрастают и через 30 мин составляют
сульфанил)метил]бут-3-ен-2-он 2 (60 мин). Выход
37 и 5% (на взятый тиол) соответственно. В после-
соединения 2 составляет 40% (на взятый тиол) и
дующее время выходы соединений 2 и 3 изменя-
81% (на формальдегид), а конверсия формальдеги-
ются незначительно.
да к этому времени достигает 87%. Для получения
1,1-бис[(2-пропилсульфанил)метил]пропан-2-она
Увеличение количества гидроксида натрия до
3 необходимо ввести дополнительное количество
0.13 моль приводит к повышению конверсии тиола
гидроксида натрия и увеличить продолжитель-
до 58% (2 ч). Через 1 ч выходы соединений 1, 2 и 3
ность реакции (0.4 экв. NaOH, 5 ч). Выходы соеди-
составляют 4, 34 и 18%, через 2 часа - 5, 30 и 23%
нения 3 и скорость его образования возрастают с
(на взятый тиол) соответственно и затем практиче-
увеличением количества щелочи (рис. 1б) и умень-
ски не изменяются.
шаются при использовании избытка формальдеги-
При молярном соотношении кетон:CН2O:
да (таблица, оп. № 2, 7).
2-PrSH:NaOH
=
1:1:1:0.4 достигается макси-
Наблюдаемые закономерности согласуется с
мальная конверсия тиола 99% (5 ч), а преобла-
вероятным образованием кетобиссульфида 3 из
дающим продуктом является 1,1-бис[(2-пропил-
соединения 1 по схеме 2: первоначально происхо-
сульфанил)метил]пропан-2-он 3 (рис. 2). Через
1 ч выход кетоаллилсульфида 2 составляет 33%, а
кетобиссульфида 3 - 35%. При дальнейшем увели-
чении продолжительности реакции количество со-
единения 2 уменьшается за счет его превращения
в соединение 3.
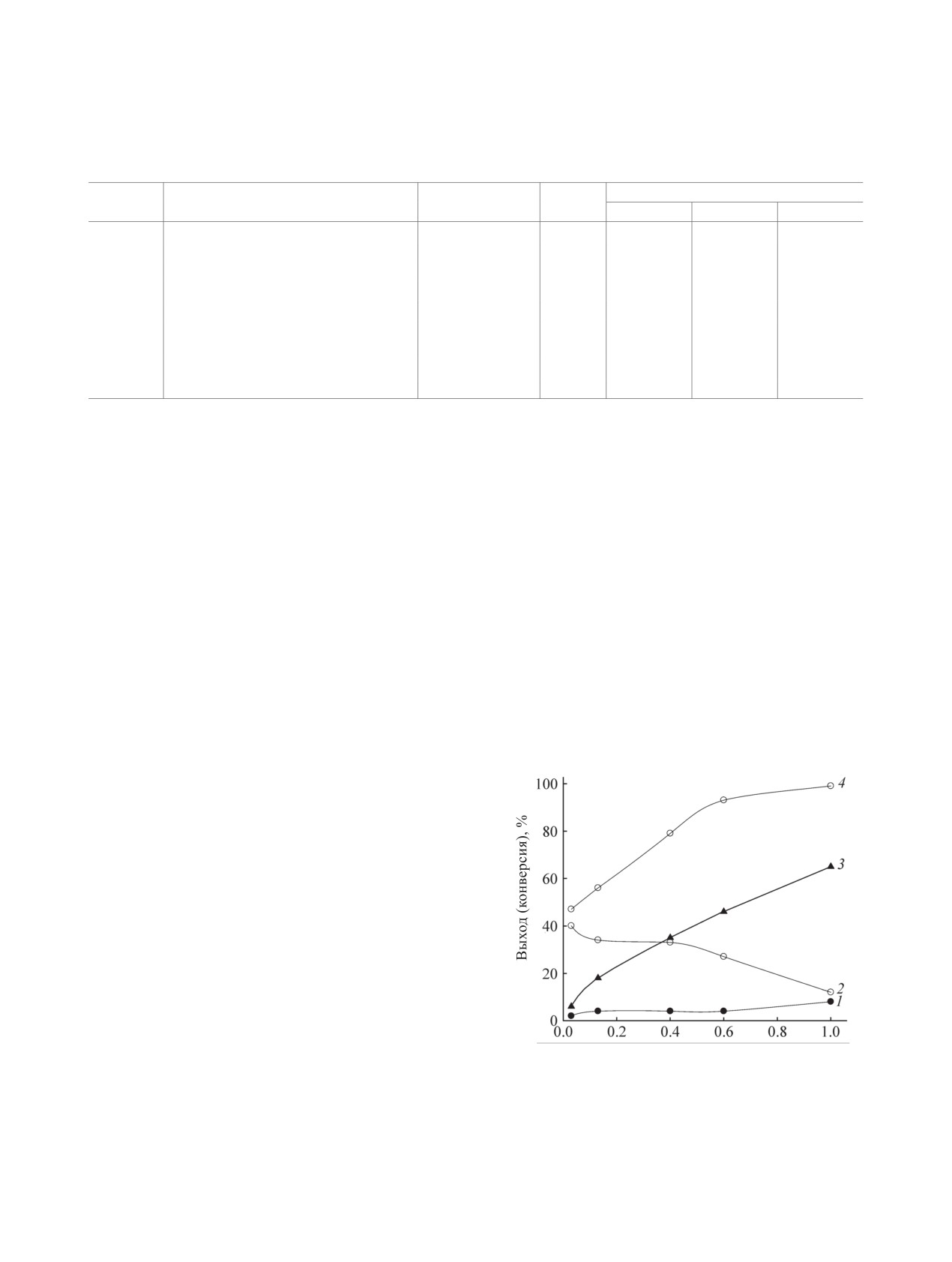
В присутствии эквимолярного количества ги-
дроксида натрия практически полное превращение
тиола и максимальный выход 1,1-бис[(2-пропил-
сульфанил)метил]пропан-2-она 3 (65%) достига-
ется уже через 15 мин (см. таблицу, оп. № 3).
Из полученных данных следует, что пропан-2-
он взаимодействует с эквимолярными количества-
ми формальдегида и пропан-2-тиола в присутствии
nNaOH ɦɨɥɶ
0.03 экв. щелочи в течение 5 мин с образованием
Рис. 2. Зависимость выходов соединений 1-3 (1-3)
в качестве первичного молекулярного продукта
и конверсии 2-PrSH 4 (4) от количества гидроксида
6-метил-5-тиагептан-2-она 1, который далее прак-
натрия. Время реакции - 1 ч, молярное соотношение
кетон:CH2O:тиол = 1:1:1, 20°С.
тически полностью превращается в 3-[(2-пропил-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
498
БАЕВА и др.
Схема 2.
O
O
O
CH2O, i-PrSH
CH2O
Pr-i
Pr-i
Me Me
Me
S
Me
S
NaOH
NaOH
1
CH2
2
O
i-PrSH
Pr-i
Me
S
NaOH
Pr-i
3
S
дит конденсация пропан-2-она с формальдегидом
лина (ГОСТ 1625-2016), пропан-2-он, гидроксид
и пропан-2-тиолом с образованием 6-метил-5-ти-
натрия и хлороформ (ЧДА).
агептан-2-она
1, последующее взаимодействие
ИК спектры регистрировали на спектрометре
которого с формальдегидом приводит к 3-[(2-про-
Shimadzu IR Prestige-21 в тонкой пленке. Спектры
пилсульфанил)метил]бут-3-ен-2-ону 2. На послед-
ЯМР 13С и 1Н снимали на спектрометре Bruker
ней стадии протекает нуклеофильное присоеди-
Avance III при 125.76 и 500.13 МГц в СDСl3, вну-
нение тиола к двойной связи α,β-ненасыщенного
тренний стандарт - остаточные сигналы раство-
карбонильного соединения 2 в присутствии осно-
рителя. ГЖХ-Анализ проводили на хроматографе
вания (тиа-реакция Михаэля).
Сhrom 5, колонка 2.4 м × 3 мм, неподвижная фаза
На основе результатов проведенных исследова-
SE-30 (5%) на хроматоне N-AW-DMCS (0.16-
ний подобраны оптимальные условия синтеза со-
0.20 мм), рабочая температура 50-300°С, детектор
единений 1-3. Применение двукратного избытка
пламенно-ионизационный, газ-носитель - гелий.
формальдегида в присутствии 0.13 экв. гидрокси-
Для определения содержания соединений 1-3 ис-
да натрия позволяет получить преимущественно
пользовали метод внутреннего стандарта (гексаде-
кетоаллилсульфид 2, а 10-кратного избытка кето-
кан). Калибровочный коэффициент определяли в
на в присутствии 0.75 экв. щелочи - кетосульфид
условиях анализа по искусственным смесям сое-
1 (см. таблицу, оп. №2, 10 соответственно). Для
динений 1-3 и внутреннего стандарта. Масс-спек-
получения соединения 3 с выходом 86% синтез
тры регистрировали на приборе Thermo Finnigan
необходимо проводить в среде этанола при мо-
MAT 95 XP c прямым вводом вещества при энер-
лярном соотношении кетон:CН2O:2-PrSH:NaOH =
гии ионизации 70 эВ. Хроматографическое разде-
1:1.25:1:1 (см. таблицу, оп. № 6).
ление проводили на колонке с силикагелем MN
Kieselgel 60 (0.063-0.2 мкм). Контроль протека-
Таким образом, установлена зависимость соста-
ния реакции осуществляли методом определения
ва продуктов трехкомпонентной конденсации про-
содержания серы меркаптанной потенциометри-
пан-2-она с формальдегидом и пропан-2-тиолом
ческим титрованием аммиакатом азотнокислого
от количества гидроксида натрия. Выявлена по-
серебра [23]. Спектральные и аналитические ре-
следовательность образования 3-[(2-пропилсуль-
зультаты получали на оборудовании Центра кол-
фанил)метил]бут-3-ен-2-она из 6-метил-5-тиагеп-
лективного пользования «Химия» Уфимского ин-
тан-2-она в результате альдольной конденсации с
ститута химии РАН.
формальдегидом, а 1,1-бис[(2-пропилсульфанил)-
метил]пропан-2-она - из 3-[(2-пропилсульфанил)-
Конденсация пропан-2-она с формальде-
метил]бут-3-ен-2-она, к которому присоединяется
гидом и пропан-2-тиолом. Реакцию проводили
тиол.
при 20°С в термостатируемом стеклянном реак-
торе, снабженном магнитной мешалкой. К 1.23 мл
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(13 ммоль) пропан-2-тиола при перемешивании до-
В работе использовали свежеперегнанный про-
бавляли 0.30 мл (0.39 ммоль) 5%-ного водного рас-
пан-2-тиол (Ч), 32%-ный водный раствор форма-
твора NaOH. Через 15 мин последовательно при-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
ОСОБЕННОСТИ КОНДЕНСАЦИИ ПРОПАН-2-ОНА
499
бавляли 0.97 мл (13 ммоль) пропан-2-она, 1.13 мл
2,2-Дитиодипропан (ди-2-пропилдисульфид)
(13 ммоль) 32%-ного раствора формальдегида и
идентифицировали сравнением с известным об-
перемешивали необходимое время (5 мин-5 ч).
разцом.
Далее в реакционную смесь добавляли насыщен-
ФОНДОВАЯ ПОДДЕРЖКА
ный раствор NaCl (1:1) и отделяли органический
Работа выполнена при поддержке Министер-
слой, который промывали водой (2 мл), сушили
MgSO4 и анализировали с помощью ГЖХ, хрома-
ства образования и науки в рамках госзадания
(№ АААА-А19-119011790021-4).
тографировали на колонке с силикагелем (элюент
EtOAc-гексан, 1:15) или перегоняли в вакууме.
КОНФЛИКТ ИНТЕРЕСОВ
При использовании эквимолярного и большего
Авторы заявляют об отсутствии конфликта ин-
количества NaOH реакционную смесь обрабаты-
тересов.
вали другим способом: после завершения реакции
отделяли органический слой, а водно-щелочной
СПИСОК ЛИТЕРАТУРЫ
слой разбавляли водой (1:1) и экстрагировали хло-
1. Guan Z., Song J., Xue Y., Yang D.-C., He Y.-H. // J.
роформом (2×5 мл). Экстракты, объединенные с
Mol. Catal. (B). 2015. Vol. 111. P. 16. doi 10.1016/j.
ранее выделенным органическим слоем, промыва-
molcatb.2014.11.007
ли 10%-ным раствором НСl (4 мл), водой (2×4 мл)
2. Abaee M.S., Mojtahedi M.M., Akbari A., Mehraki E.,
и сушили MgSO4. Растворитель отгоняли, остаток
Mesbah A.W., Harms K. // J. Heterocycl. Chem. 2012.
Vol. 49. P. 1346. doi 10.1002/jhet.976
анализировали, как описано выше.
3. Yong F.-F., Teo Y.-C. // Synth. Commun. 2011. Vol. 41.
Мольное отношение кетон-формальдегид-
P. 1293. doi 10.1080/00397911.2010.481750
пропан-2-тиол-гидроксид натрия варьировали в
4. Wang S.-L., Hao W.-J., Tu S.-J., Zhang X.-H., Cao X.-D.,
пределах (0.5-10):(1-2):(1-2):(0.03-2).
Yan S., Wu S.-S., Han Z.-G., Shi F. // J. Heterocycl.
6-Метил-5-тиагептан-2-он (1). Масс-спектр,
Chem. 2009. Vol. 46. P. 664. doi 10.1002/jhet.132
5. Li L., Liu B., Wu Q., Lin X. // Chin J. Chem. 2011.
m/z (Iотн, %): 146 (62) [M]+·, 131 (2) [M - CH3]+,
Vol. 29. P. 1856. doi 10.1002/cjoc.201180324
113 (2) [M - SH]+, 103 (12) [M - C3H7]+, 89 (8), 75
6. Parnes R., Narute S., Pappo D. // Org. Lett. 2014.
(40) [SC3H7]+, 71 (46) [C4H7O]+, 61 (32), 43 (100)
Vol. 16. P. 5922. doi 10.1021/ol502937n
[C2H3O]+, [C3H7]+. Данные ИК и ЯМР 1H, 13C спек-
7. Abaee M.S., Cheraghi S., Navidipoor S., Mojtahedi M.M.,
троскопии идентичны опубликованным в работе
Forghani S. // Tetrahedron Lett. 2012. Vol. 53. P. 4405.
[21].
doi 10.1016/j.tetlet.2012.06.040
3-[(2-Пропилсульфанил)метил]бут-3-ен-2-
8. Dar A.A., Enjamuri N., Shadab Md., Ali N., Khan A.T. //
ACS Comb. Sci. 2015. Vol. 17. P. 671. doi 10.1021/
он (2). ИК спектр, ν, см-1: 3096 cл (=CH), 1681 c
acscombsci.5b00044
(С=O), 1626 сл (C=С), 883 сл (С=С-H). Спектр
9. Баева Л.А., Бикташева Л.Ф., Фатыхов А.А., Ляпи-
ЯМР 1H (СDCl3), δ, м. д.: 1.25 д [6H, SCH(CH3)2,
на Н.К. // ЖОрХ. 2013. Т. 49. С. 1300; Baeva L.А.,
3J = 6.7 Гц], 2.36 c (3H, C1H3), 2.84 септет [1H,
Biktasheva L.F., Fatykhov А.А., Lyapina N.K. // Russ.
SCH(CH3)2, 3J = 6.7 Гц], 3.39 c (2H, CH2S), 5.94
J. Org. Chem. 2013. Vol. 49. P. 1283. doi 10.1134/
c (1H, C4H'), 6.08 c (1H, C4H''). Спектр ЯМР 13С
S1070428013090078
(СDCl3), δC, м. д.: 23.1 [SCH(CH3)2], 26.0 (C1), 29.9
10. Ахметова В.Р., Ахмадиев Н.С., Галимзянова Н.Ф.,
(CH2S), 34.9 [SCH(CH3)2], 125.9 (C4), 145.6 (C3),
Ибрагимов А.Г., Джемилев У.М. Пат. 2654851 (2017) //
198.5 (C2). Найдено, %: C 60.78; H 8.97; S 20.31.
Б. И. 2017. № 9.
С8Н14OS. Вычислено, %: C 60.71; H 8.92; S 20.26.
11. Муринов Ю.И., Майстренко В.Н., Афзалетдино-
ва Н.Г. Экстракция металлов S,N-органическими
Масс-спектр соединения 2 аналогичен описанно-
соединениями. М.: Наука, 1993. 190 с.
му в работе [24].
12. Голубятникова Л.Г., Хисамутдинов Р.А., Баева Л.А.,
1,1-Бис[(2-пропилсульфанил)метил]пропан-
Муринов Ю.И. // ЖОХ. 2018. Т. 88. № 12. С. 2006;
2-он (3). nD20 1.4956, d420 0.994. Данные ИК и ЯМР
Golubyatnikova L.G., Khisamutdinov R.A., Baeva L.A.,
1H, 13C спектроскопии идентичны опубликован-
Murinov Yu.I. // Russ. J. Gen. Chem. 2018. Vol. 88.
ным в работе [22].
N 12. P. 2524. doi 10.1134/S1070363218120113
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
500
БАЕВА и др.
13. Алгебраистова Н.К., Гудкова Н.В., Алексеева Е.А.,
va A.D., Baeva L.A., Valiullin O.R., Nikitina T.S.,
Баева Л.А., Улендеева А.Д., Ляпина Н.К. Пат.
Arslaniva D.D., Spirikhin L.V., Lyapina N.K. //
2185249 (2002) // Б. И. 2002. № 20.
Petroleum Chem. 2006. Vol. 46. P. 122. doi 10.1134/
14. Гафаров Н.А., Кушнаренко В.М., Бугай Д.Е., Гон-
S0965544106020101
чаров А.А., Гетманский М.Д., Рахманкулов Д.Л.,
20. Дронов В.И., Никитин Ю.Е. // Усп. хим. 1985.
Чирков Ю.А., Габитов А.И. Ингибиторы коррозии.
Т. 54. С. 941; Dronov V.I., Nikitin Yu.E. // Russ.
М.: Химия, 2002. Т. 2. 367 с.
Chem. Rev. 1985. Vol. 54. P. 554. doi 10.1070/
15. Inomata K., Barragué M., Paquette L.A. // J. Org. Chem.
RC1985v054n06ABEH003088
2005. Vol. 70. P. 533. doi 10.1021/jo0486084
21. Firouzabadi H., Iranpoor N., Abbasi M. // Tetrahedron
16. Guha C., Mondal R., Pal R., Mallik A. // J. Chem. Sci.
2013. Vol. 125. P. 1463. doi 10.1007/s12039-013-0513-8
2009. Vol. 65. P. 5293. doi 10.1016/j.tet.2009.04.079
17. Ahari-Mostafavi M.M., Sharifi A., Mirzaei M., Aman-
22. Баева Л.А., Бикташева Л.Ф., Никитина Т.С., Фа-
lou M. // J. Iran. Chem. Soc. 2014. Vol. 11. P. 1113. doi
тыхов А.А., Ляпина Н.К. // ХГС. 2012. Т. 48. С. 646;
10.1007/s13738-013-0379-1
Baeva L.A., Biktasheva L.F., Nikitina T.S., Fatykhov A.A.,
18. Анпилогова Г.Р., Баева Л.А., Нугуманов Р.М., Фа-
Lyapina N.K. // Chem. Heterocycl. Compd. 2012.
тыхов А.А., Муринов Ю.Ю. // ЖНХ. 2018. Т.63.
Vol. 48. P. 601. doi 10.1007/s10593-012-1032-0
№ 8. С. 1065; Anpilogova G.R., Baeva L.A.,
23. Методы анализа органических соединений нефти,
Nugumanov R.M., Fatykhov А.А., Murinov Yu.I. // Russ.
их смесей и производных / Под ред. Г.Д. Гальперна.
J. Inorg. Chem. 2018. Vol. 63. N 8. P. 1100. doi 10.1134/
М.: Изд. АН СССР, 1960. Сб. 1. С. 74.
S0036023618080028
19. Улендеева А.Д., Баева Л.А., Валиуллин О.Р., Никити-
24. Баева Л.А., Улендеева А.Д., Галкин Е.Г., Ерастов А.С.,
на Т.С., Арсланова Д.Д., Спирихин Л.В., Ляпина Н.К. //
Филимонов С.Н., Ляпина Н.К. // Баш. хим. ж. 2009.
Нефтехимия. 2006. Т. 46. № 2. С. 139; Ulendee-
Т. 16. № 4. С. 32.
Features of Condensation of Propan-2-one with Formaldehyde
and Propane-2-thiol
L. A. Baeva*, R. M. Nugumanov, L. F. Biktasheva, and R. L. Safiullin
Ufa Institute of Chemistry, Ufa Federal Research Center of the Russian Academy of Sciences, Ufa, 450054 Russia
*e-mail: sulfur@anrb.ru
Received October 31, 2019; revised October 31, 2019; accepted November 7, 2019
Three-component condensation of propan-2-one with formaldehyde and propane-2-thiol in the presence of
sodium hydroxide resultеd in 3-[(2-propylsulfanyl)methyl]but-3-en-2-one or 1,1-bis[(2-propylsulfanyl)methyl]-
propan-2-one depending on the amount of alkali. The formation of 1,1-bis[(2-propylsulfanyl)methyl]propan-2-
one from 6-methyl-5-thiaheptan-2-one proceeded through the stages of its aldol condensation with formaldehyde
and the subsequent nucleophilic addition of the thiol to the double bond of the intermediate 3-[(2-propylsulfanyl)
methyl]but-3-en-2-one in the presence of sodium hydroxide.
Keywords: thiol, formaldehyde, γ-ketosulfide, β-mercaptoketone, three-component condensation, thia-Michael
reaction
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020