ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 4, с. 501-507
УДК 547.751:547.435.4
ТРЕХКОМПОНЕНТНАЯ РЕАКЦИЯ
1-(ОКСИРАН-2-ИЛМЕТИЛ)-1H-ИНДОЛ-3-КАРБАЛЬДЕГИДА,
МЕТИЛЕНАКТИВНЫХ СОЕДИНЕНИЙ И АМИНОВ
© 2020 г. К. Ф. Суздалев*, Н. И. Викрищук, С. А. Цирюльник
Южный федеральный университет, ул. Зорге 7, Ростов-на-Дону, 344090 Россия
*е-mail: konsuz@gmail.com
Поступило в Редакцию 10 октября 2019 г.
После доработки 10 октября 2019 г.
Принято к печати 15 октября 2019 г.
Осуществлен однореакторный синтез 3-винилзамещенных индолов, содержащих остаток 1,2-аминоспир-
та при атоме азота, которые являются продуктами реакций 1-(оксиран-2-илметил)-1H-индол-3-карбальде-
гида по карбонильной группе с метиленактивными соединениями и по оксирановому кольцу с аминами.
Ключевые слова: индол, 1,2-аминоспирт, амины, 1,3-диметилбарбитуровая кислота, индолин-2-он,
динитрил малоновой кислоты
DOI: 10.31857/S0044460X20040022
Производные индола, содержащие остаток
противоопухолевые препараты [4]. Известно, что
аминоспирта, являются привлекательными объек-
аминоспирты ряда индола с остатками непредель-
тами для медицинской химии, поскольку облада-
ных кетонов в положении 3 перспективны для ле-
ют многими видами биологической активности. В
чения температурной дисрегуляции, депрессии и
таких соединениях общим структурным мотивом
болевых расстройств, таких как фибромиалгия и
является наличие индольного ядра, замещенно-
боль в пояснице [5]. Вещества ряда индолилпро-
го у атома азота 3-амино-2-гидроксипропильной
панамида являются препаратами для андрогенной
группой. Их биологическая активность определя-
депривационной терапии рака предстательной
ется видом заместителей в индольном фрагменте.
железы [6]. Ранее нами была обнаружена местно-
Так, производные тетрагидрокарбазола проявляют
анестезирующая и антиаритмическая активность
антиприонную активность, что важно для борьбы
подобных аминоспиртов, более высокая, чем у
с нейродегенеративными расстройствами, харак-
известных препаратов - новокаина, лидокаина и
теризующимися наличием энцифалопатии, таки-
маркаина [7]. Кроме этого выявлено антиагрегант-
ми как болезнь Крейтцфельдте-Якоба и синдром
ное действие индольного аминоспирта, содержа-
Герстманн-Стрюсслера-Шейнкера [1]. Известна
щего фрагмент тиофена, превышающее аналогич-
также перспективность использования амино-
ный эффект препаратов сравнения - аспирина и
спиртов ряда индола и карбазола для борьбы с
клопидогрела [8].
болезнью Альцгеймеера [2]. Индолы, содержащие
Разнообразная биологическая активность индо-
остатки аминоспирта и 1-арил-1H-пиразол-5(4H)-
лов, содержащих в положении 1 остаток 1,2-ами-
она, проявляют активность по отношению к вирусу
носпирта, делает актуальным поиск простых ме-
гепатита С [3]. Производные индолилкарбоновых
тодов их синтеза. В последние годы многокомпо-
кислот с 3-амино-2-гидроксипропильной группой
нентные реакции часто используются для синтеза
при атоме азота являются ингибиторами полопо-
биологически активных соединений, например,
добных киназ-лекарственных мишеней, стиму-
опубликован обзор по использованию соединений
лирующих онкогенез, и могут использоваться как
ряда индола в мультикомпонентных процессах [9].
501
502
СУЗДАЛЕВ и др.
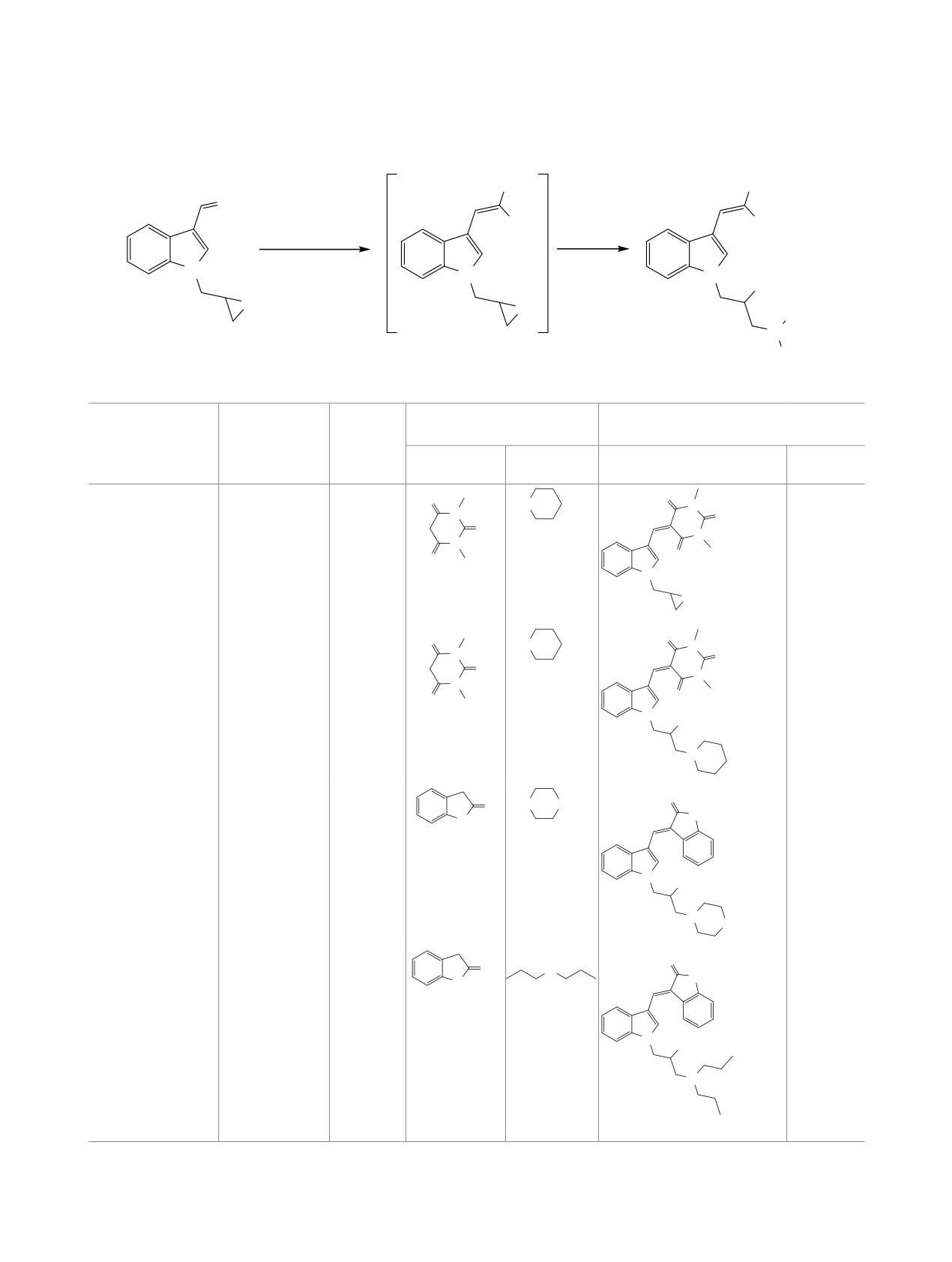
Схема 1.
X
X
O
Y
Y
XCH2Y, HNR1R2
HNR1R2
N
N
N
OH
O
O
R2
1
N
R1
2a-ɥ
3a-ɥ
Условия реакции 1-(оксиран-2-илметил)-1H-индол-3-карбальдегида 1 с метиленактивными соединениями и аминами
Исходные вещества
Продукт реакции
№ опыта
Растворитель
Время, ч
выход,
XCH2Y
HNR1R2
формула
%a
1
Пропанол-2
1
O
O
60
HN
N
N
O
O
N
N
O
O
N
O
2a
2
Пропанол-2
4
O
O
36
HN
N
N
O
O
N
N
O
O
N
OH
N
3a
3
Бутанол-1
4
O
50
O
HN
O
NH
N
H
N
OH
N
O
ɛ
4
Пропанол-2
3
H
O
36
O
N
NH
N
H
N
OH
N
ɜ
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
ТРЕХКОМПОНЕНТНАЯ РЕАКЦИЯ
503
Таблица (продолжение)
Исходные вещества
Продукт реакции
№ опыта
Растворитель
Время, ч
выход,
XCH2Y
HNR1R2
формула
%a
5
Пропанол-2
4
50
O
O
HN
NH
N
H
N
OH
N
ɝ
6
Пропанол-2
4
60
O
O
HN
N
NH
H
N
OH
N
ɞ
7
Бутанол-1
8
31
H
O
O
Ph
N Ph
N
NH
H
N
OH
Ph
N
Ph
ɟ
8
Пропанол-2
4
O
31
O
HN
NH
N
H
N
OH
N
ɠ
9
Пропанол-2
4
43
H
O
O
N
NH
N
H
N
OH
N
ɡ
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
504
СУЗДАЛЕВ и др.
Таблица (продолжение)
Исходные вещества
Продукт реакции
№ опыта
Растворитель
Время, ч
выход,
XCH2Y
HNR1R2
формула
%a
10
Бутанол-1
4
H
O
64
O
N
NH
N
H
N
OH
N
ɢ
11
Бутанол-1
5
O
17
O
H
NH
2N
N
H
N
OH
N
H
ɤ
12
Бутанол-1
5
H
H
CN
44
H2N
C C
CN
N
N
N
OH
N
H
ɥ
а Выходы приведены в расчете на перекристаллизованные вещества.
Основное преимущество такого подхода состоит
ми соединениями альдегид 1 реагирует по карбо-
в его одностадийности - исходные вещества сме-
нильной группе c образованием соединений типа
шиваются в одной колбе, и нужный продукт обра-
2 (схема 1), при этом оксирановый цикл остается
зуется сразу. Очевидно, что не всякие соединения
незатронутым [12]. Было также изучено последо-
могут быть получены таким путем из-за возмож-
вательное взаимодействие реагента 1 с 1,3-индан-
ности протекания перекрестных и побочных про-
дионом и аминами [11].
цессов.
Целью данной работы является однореактор-
Ранее нами был разработан синтез 1-(окси-
ный синтез комбинированных структур, которые
ран-2-илметил)-1H-индол-3-карбальдегида 1 - ре-
являются продуктами реакции и по карбонильной
агента, содержащего два реакционноспособных
группе, и по оксирановому кольцу (схема 1).
заместителя: альдегидную группу и оксирановый
Однореакторный вариант в данном случае яв-
цикл [10, 11]. Обе функциональные группы мо-
ляется подходящим, поскольку известно, что реак-
гут реагировать отдельно или последовательно.
ция с метиленактивными соединениями походит за
С аминами реакции проходят преимущественно
время от 5 мин до 1 ч с образованием соединений
по оксирановому кольцу с образованием произво-
типа 2 [12], а оксирановый цикл раскрывается за
дных 1,2-аминоспиртов [10]. C метиленактивны-
4-8 ч [10]. Таким образом, указанные реакции мо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
ТРЕХКОМПОНЕНТНАЯ РЕАКЦИЯ
505
гут проходить последовательно и приводить к же-
дол-3-карбальдегид 1 синтезирован по известной
лаемым продуктам 3. На примере взаимодействия
методике [11].
альдегида 1 с диметилбарбитуровой кислотой и
Спектры ЯМР
1Н сняты на спектрометре
пиперидином методом ЯМР 1Н нами был проведен
Bruker DPX-250. Элементный анализ проведен
мониторинг состава реакционной смеси и найдены
на CHNS-анализаторе Elementar Vario Micro cube.
оптимальные условия проведения процесса (см.
Температуры плавления определены в откры-
таблицу). Как и предполагалось, для реакции аль-
том капилляре на аппарате Химлабприбор ПТП.
дегида, барбитуровой кислоты и пиперидина при
Чистоту соединений контролировали методом
кипячении изопропиловом спирте в течение 1 ч
ТСХ на пластиках Silufol UV-254 в хлороформе.
был выделен продукт реакции только по карбо-
Спектры ЯМР снимали в Учебно-научной лабора-
нильной группе 2а, описанный ранее в работе [12].
тории резонансной спектроскопии кафедры химии
При увеличении времени реакции до 4 ч получен
природных и высокомолекулярных соединений
целевой продукт реакции 3а, соответствующий
Южного федерального университета.
взаимодействию обеих функциональных групп.
Общая методика синтеза соединений 3a-и.
Для получения остальных производных 3б-л вре-
Смесь 0.002 моль альдегида 1, 0.004 моль амина,
мя проведения процесса составляет от 3 до 8 ч в
0.002 моль метиленактивного соединения и 3 мл
зависимости от природы амина. В качестве мети-
растворителя кипятили в течение 1-8 ч. Время
ленактивных соединений использованы диметил-
проведения реакции, растворитель и выход указа-
барбитуровая кислота, индолин-2-он и динитрил
ны в таблице. После охлаждения смеси образуют-
малоновой кислоты. В качестве реагентов для рас-
ся кристаллы желтого или оранжевого цвета, кото-
крытия оксиранового кольца применяли в основ-
рые отфильтровывали и перекристаллизовывали.
ном вторичные алифатические амины, как цикли-
5-{[1-(2-Гидрокси-3-пиперидин-1-илпро-
ческие, так и нециклические (см. таблицу, оп.
пил)-1H-индол-3-ил]метилен}-1,3-диметил-
№ 1-10). 1-Аминоадамантан дает худшие выходы
пиримидин-2,4,6(1H,3H,5H)-трион (3а). Т. пл.
(17-44%, см. таблицу, оп. № 11, 12). Умеренные
197-200○С (толуол). Спектр ЯМР 1H (CDCl3), δ,
выходы продуктов объясняются возможными пе-
м. д.: 1.34-1.62 м [6Н, (СН2)3], 2.23-2.47 м [4Н,
рекрестными реакциями, однако выделение целе-
N(СН2)2], 2.47-2.68 м (2Н, NСН2), 3.41 с (6Н,
вых веществ не представляет трудностей, посколь-
NСН3), 4.05-4.21 м (1Н, СН), 4.21-4.37 м (2Н,
ку они хорошо кристаллизуются при охлаждении
NIndСН2), 7.30-7.41 м (2Н, 5-Н + 6-НInd), 7.43-7.57
реакционной смеси.
м (1Н, 7-НInd), 7.92-8.02 м (1Н, 4-НInd), 8.99 с (1Н,
Строение всех продуктов реакции доказано ме-
2-НInd), 9.61 с (1Н, СН=). Найдено, %: С 65.14; Н
тодом спектроскопии ЯМР 1Н. В спектрах продук-
6.74; N 13.01. C23H28N4O4. Вычислено, %: C 65.08;
тов реакции присутствуют сигналы, характерные
H 6.65; N 13.20.
для фрагментов исходного соединения 1, аминов и
2-{[1-(2-Гидрокси-3-морфолинопропил)ин-
метиленактивных соединений, присоединяющих-
дол-3-ил]метилен}индолин-3-он (3б). Т. пл. 197-
ся к исходному альдегиду.
200○С (ацетонитрил). Спектр ЯМР 1H (CDCl3),
δ, м. д.: 2.36-2.54 м [4Н, NMorph(CH2)2], 2.62-2.80
Таким образом, разработан однореакторный
м (2Н, NMorphCH2), 3.58-3.86 м [4Н, O(CH2)2],
синтез
1,2-аминоспиртов ряда
3-винилиндола,
4.09-4.44 м (3Н, NIndCH2 + CH), 6.84-7.89 м (9Н,
содержащих фрагменты 1,3-барбитуровой кисло-
НAr + NIndН), 7.92 с (1Н, 2-НInd), 9.43 с (1Н, СН=).
ты, оксиндола и малонодинитрила. В дальнейшем
Найдено, %: С 71.14; Н 6.44; N 10.21. C24H25N3O3.
будут проведены биологические испытания полу-
Вычислено, %: C 71.44; H 6.25; N 10.41.
ченных соединений.
2-{[1-[3-(Дипропиламино)-2-гидрокси-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
пропил]-3-ил]метилен}индолин-3-он (3в). Т. пл.
Амины, индолин-2-он и малонодинитрил фир-
190-193○С (ацетонитрил). Спектр ЯМР 1H (CDCl3),
мы Alfa-Aesar использованы без предварительной
δ, м. д.: 0.82 т [6Н, (CH3)2, J = 7.3 Гц], 1.30-1.56 м
очистки. Исходный 1-(оксиран-2-илметил)-1H-ин-
[4Н, (СН2)2], 2.27-2.63 м [6Н, N(CH2)3], 4.01-4.19
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
506
СУЗДАЛЕВ и др.
м (1Н, СН), 4.19-4.37 м (2Н, NIndCH2), 6.85-7.91
с (1Н, 2-НInd), 9.46 с (1Н, СН=). Найдено, %: С
м (9Н, НAr + NIndН), 7.95 с (1Н, 2-НInd), 9.45 с
74.24; Н 6.82; N 10.66. C24H27N3O2. Вычислено, %:
(1Н, СН=). Найдено, %: С 74.64; Н 7.54; N 10.21.
C 74.01; H 6.99; N 10.79.
C26H31N3O2. Вычислено, %: C 74.79; H 7.48; N
2-({1-[3-(Диизопентиламино)-2-гидрокси-
10.06.
пропил]индол-3-ил}метилен)индолин-3-он (3и).
2-{[1-[2-Гидрокси-3-(пиперидин-1-ил)про-
Т. пл. 200–205○С (толуол). Спектр ЯМР 1H (CDCl3),
пил]индол-3-ил]метилен}индолин-3-он
(3г).
δ, м. д.: 0.83 д (6Н, СН3, J = 6.8 Гц), 0.87 д (6Н, СН3,
Т. пл. 179-182○С (ацетонитрил). Спектр ЯМР 1H
J = 6.4 Гц), 1.59-1.82 м [6Н, N(СН2)3], 1.97-2.26
(CDCl3), δ, м. д.: 1.29-1.68 м [6Н, (СН2)3], 2.17-
м [4Н, (СН2)2], 2.26-2.55 м [2Н, (СН)2], 3.73 уш. с
2.46 м [4Н, N(CH2)2], 4.07-4.22 м (1Н, СН), 4.22-
(1Н, ОН), 3.92-4.15 м (1Н, СН), 4.15-4.32 м (2Н,
4.40 м (2Н, NIndCH2), 6.84-7.90 м (9Н, НAr+ NIndН),
NIndCH2), 6.84-7.92 м (9Н, НAr + NIndН), 7.96 с (1Н,
7.94 с (1Н, 2-НInd), 9.46 с (1Н, СН=). Найдено, %: С
2-НInd), 9.46 с (1Н, СН=). Найдено, %: С 76.23; Н
74.63; Н 6.50; N 10.21. C25H27N3O2. Вычислено, %:
8.42; N 8.63. C30H39N3O2. Вычислено, %: C 76.07;
C 74.79; H 6.78; N 10.47.
H 8.30; N 8.87.
2-{[[1-[3-(Азепан-1-ил)-2-гидроксипропил]
Общая методика синтеза соединений 3к, л.
индол-3-ил]метилен}индолин-3-он (3д). Т. пл.
К 0.046 г (0.001 моль) гидрида натрия прибавля-
193-195○С (толуол). Спектр ЯМР 1H (CDCl3), δ,
ли 3 мл бутан-1-ола, после выделения водорода
м. д.: 1.37-1.82 м [8Н, (СН2)4], 2.25-2.81 м [7Н,
добавляли 0.302 г (0.002 моль) хлорида 1-ада-
(СН2)3 + ОН], 4.97-4.16 м (1Н, CH), 4.16-4.36 м
мантиламония. Смесь выдерживали 10 мин, за-
(2Н, NIndCH2), 6.84-7.91 м (9Н, НAr + NIndН), 7.94
тем добавляли 0.402 г (0.002 моль) альдегида 1,
с (1Н, 2-НInd), 9.46 с (1Н, СН=). Найдено, %: С
(0.002 моль) метиленактивного соединения и 3 мл
75.23; Н 6.81; N 10.32. C26H29N3O2. Вычислено, %:
бутан-1-ола. Полученную смесь кипятили в тече-
C 75.15; H 7.03; N 10.11.
ние 5 ч. Осадок отфильтровывали иперекристал-
2-{[1-[3-(Дибензиламино)-2-гидрокси-
лизовывали. Время проведения реакции, раство-
пропил]индол-3-ил]метилен}индолин-3-он (3е).
ритель и выходы указаны в таблице.
Т. пл. 185-187○С (толуол). Спектр ЯМР 1H (CDCl3),
2-({1-[3-(1-Адамантиламино)-2-гидрокси-
δ, м. д.: 2.46-2.62 м (2Н, NCH2), 3.43 д и 3.75 д (2Н,
пропил]индол-3-ил}метилен)индолил-3-он (3к).
СН2Ph, J = 13.5 Гц), 4.01-4.23 м (3Н, NIndCH2 +
Т. пл. 233-235○С (нитрометан). Спектр ЯМР 1H
СН), 6.83-7.87 м (19Н, НAr + NIndН), 7.91 с (1Н,
(пиридин-d5), δ, м. д.: 1.42-1.56 м [6Н, (СН2)3],
2-НInd), 9.38 с (1Н, СН=). Найдено, %: С 79.43; Н
1.67-1.79 м [6Н, (СН2)3], 1.84-1.94 м [3Н, (СН)3],
6.01; N 8.32. C34H31N3O2. Вычислено, %: C 79.51;
H 6.08; N 8.18.
2.91-3.14 м (2Н, NСН2), 4.42-4.75 м (3Н, NIndСН2 +
СН), 7.05-8.18 м (8Н, НAr), 8.31 с (1Н, 2-Н), 10.16 с
2-{[1-(2-Гидрокси-3-пирролидин-1-илпро-
(1Н, СН=), 11.73 уш. с (1Н, NIndН). Найдено, %: С
пил)индол-3-ил]метилен}индолин-3-он
(3ж).
76.87; Н 7.31; N 8.63. C30H33N3O2. Вычислено, %:
Т. пл. 219-221○С (толуол). Спектр ЯМР 1H (CDCl3),
C 77.06; H 7.11; N 8.99.
δ, м. д.: 2.82-2.06 м [4Н, (СН2)2], 2.39-2.81 м [6Н,
(СН2)3], 4.09-4.25 м (1Н, СН), 4.25-4.38 м (2Н,
2-({1-[3-(1-Адамантиламино)-2-гидрокси-
NIndCH2), 6.84-7.90 м (9Н, НAr + NIndН), 7.93 с (1Н,
пропил]индол-3-ил}метилен)пропандинитрил
2-НInd), 9.43 с (1Н, СН=). Найдено, %: С 74.33; Н
(3л). Т. пл. 233-235○С (бутан-1-ол). Спектр ЯМР
6. 32; N 10.91. C34H31N3O2. Вычислено, %: C 74.39;
1H (пиридин-d5), δ, м. д.: 1.83-1.93 м [6Н, (СН2)3],
H 6.50; N 10.84.
1.93-2.07 м [6Н, (СН2)3], 2.18-2.43 м [3Н, (СН)3],
2-({1-[3-(Диэтиламино)-2-гидроксипропил]-
3.11-3.40 м (2Н, СН2), 4.60-4.75 м (1Н, СН), 4.75-
индол-3-ил}метилен)индолин-3-он (3з). Т. пл.
5.08 м (2Н, NIndСН2), 7.64-7.80 м (2Н, 5-Н + 6-Н),
160-165○С (толуол). Спектр ЯМР 1H (CDCl3), δ,
8.03-8.19 м (1Н, 7-Н), 8.25-8.37 м (1Н, 4-Н), 8.80 с
м. д.: 0.97 т [6Н, (СН3)2, J = 7.1 Гц], 2.25-2.72 м
(1Н, 2-Н), 9.20 с (1Н, СН=). Найдено, %: С 74.75; Н
[7Н, (СН2)3 + ОН], 3.93-4.15 м (1Н, СН), 4.15-4.34
7.21; N 13.73. C25H28N4O. Вычислено, %: C 74.97;
м (2Н, NIndСН2), 6.83-7.90 м (9Н, НAr + NIndН), 7.94
H 7.05; N 13.99.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
ТРЕХКОМПОНЕНТНАЯ РЕАКЦИЯ
507
ФОНДОВАЯ ПОДДЕРЖКА
Bioorg. Med. Chem. Lett. 2009. Vol. 19. P. 5029. doi
10.1016/j.bmcl.2009.07.053
Работа выполнена при финансовой поддержке
6. Hwang D.-J., He Y., Ponnusamy S., Mohler M.L.,
Южного федерального университета.
Thiyagarajan T., McEwan I.J., Narayanan R., Mil-
КОНФЛИКТ ИНТЕРЕСОВ
ler D.D. // J. Med. Chem. 2019. Vol. 62. P. 491. doi
10.1021/acs.jmedchem.8b00973
Авторы заявляют об отсутствии конфликта ин-
тересов.
7. Пат. 2408592 (2011) РФ // C. A. 2011. Vol. 154.
125248.
СПИСОК ЛИТЕРАТУРЫ
8. Kucheryavenko A.F., Spasov A.A., Tian M., Suzda-
1. Kimura T., Hosokawa-Mutoa J., Asamib K., Muraib T.,
lev K.F. // Bull. Exp. Biol. Med. 2017. Vol. 162. N 6.
Kuwata K. // Eur. J. Med. Chem. 2011. Vol. 46. P 5675.
P. 758. doi 10.1007/s10517-017-3706-1
doi 10.1016/j.ejmech.2011.08.039
9. Shiri M. // Chem. Rev. 2012. Vol. 112. N 6. P. 3508. doi
2. MacMillan K.S., Naidoo J., Liang J., Melito L., Willi-
10.1021/cr2003954
ams N.S., Morlock L., Huntington P.J., Estill S.J.,
10. Suzdalev K.F., Den’kina S.V., Starikova A.A., Dvure-
Longgood J., Becker G.L., McKnight S.L., Pieper A.A.,
chensky V.V., Kletsky M.E., Burov O.N. // Mendeleev
De Brabander J.K., Ready J.M. // J. Am. Chem. Soc.
Commun. 2011. Vol. 21. N 4. P. 231. doi 10.1016/j.
2011. Vol. 133. P 1428. doi 10.1021/ja108211m
mencom.2011.07.021
3. Han Z., Liang X., Wang Y., Qing J., Cao L., Shang L.,
11. Попов Л.Д., Суздалев К.Ф. // ЖОрХ. 2016. Т. 52.
Yin Z. // Eur. J. Med. Chem. 2016. Vol. 116. P. 147. doi
Вып. 6. С. 858; Popov L.D., Suzdalev K.F. // Russ. J.
10.1016/j.ejmech.2016.03.062
Org. Chem. 2016. Vol. 52. N 6. P. 844. doi 10.1134/
4. Liu M., Huang J., Chen D.-X., Jiang C. // Bioorg.
S1070428016060142
Med. Chem. Lett. 2015. Vol. 25. P. 431. doi 10.1016/j.
12. Суздалев К.Ф., Денькина С.В. // ХГС. 2011. № 9.
bmcl.2014.12.060
C. 1321; Suzdalev K.F., Den’kina S.V. Chem.
5. Kim C.Y., Mahaney P.E., McConnell O., Zhang Y.,
Heterocycl. Compd. 2011. N 9. P. 1085. doi 10.1007/
Manas E., Ho D.M., Deecher D.C., Trybulski E.J. //
s10593-011-0878-x
Three Component Reaction
of 1-(Oxyran-2-ylmethyl)-1H-indole-3-carbaldehyde
with CH-Acids, and Amines
K. F. Suzdalev*, N. I. Vikrishchuk, and S. A. Tsiryulnik
Southern Federal University, Rostov-on-Don, 344090 Russia
*e-mail: konsuz@gmail.com
Received October 10, 2019; revised October 10, 2019; accepted October 15, 2019
The one-pot synthesis of 3-vinyl substituted indoles containing 1,2-amino alcohol fragment at the nitrogen atom
was performed by the reactions of 1-(oxiran-2-ylmethyl)-1H-indole-3-carbaldehyde with methylene-active
compounds and amines.
Keywords: indole, 1,2-aminoalcohol, amines, 1,3-dimethylbarbituric acid, indolin-2-one, malonic acid dinitrile
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020