ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 4, с. 522-529
УДК 547.825:547.876
ВЗАИМОДЕЙСТВИЕ ЭТОКСИМЕТИЛЕНМАЛОНАТА
С ЦИАНОТИОАЦЕТАМИДОМ В ПРИСУТСТВИИ
ТРИЭТИЛАМИНА: ОБРАЗОВАНИЕ 1,5-ДИАМИНО-
2,4-ДИЦИАНО-5-ТИОКСОПЕНТА-1,3-ДИЕН-
1-ТИОЛАТА И НЕОЖИДАННЫЙ РЕЗУЛЬТАТ
АМИНОМЕТИЛИРОВАНИЯ
© 2020 г. В. В. Доценкоa,b,*, С. Г. Кривоколыскоa, E. A. Чигоринаc
a Кубанский государственный университет, ул. Ставропольская 149, Краснодар, 350040 Россия
b Северо-Кавказский федеральный университет, Ставрополь, 355009 Россия
c Институт химических реактивов и особо чистых химических веществ Национального исследовательского
центра «Курчатовский институт», Москва, 107076 Россия
*e-mail: victor_dotsenko_@mail.ru
Поступило в Редакцию 12 ноября 2019 г.
После доработки 12 ноября 2019 г.
Принято к печати 14 ноября 2019 г.
Взаимодействие цианотиоацетамида с этоксиметиленмалоновым эфиром и триэтиламином в этаноле
при нагревании протекает неселективно и ведет к образованию смеси 1,5-диамино-2,4-дициано-5-тиок-
сопента-1,3-диен-1-тиолата триэтиламмония и 6-оксо-3-циано-5-этоксикарбонил-1Н-пиридин-2-тиолата
триэтиламмония с преобладанием последнего. Продукт реакции при обработке первичными аминами и
37%-ным формалином в кипящем водном спирте дает только производные 4-(1,3,5-тиадиазинан-2-или-
ден)-2-(3,4-дигидро-2H-1,3,5-тиадиазин-6-ил)пент-2-ендинитрила вместо ожидаемых производных пи-
ридо[2,1-b][1,3,5]тиадиазина. 6-Оксо-3-циано-5-этоксикарбонил-1Н-пиридин-2-тиолат триэтиламмония
в данных условиях в реакцию не вступает.
Ключевые слова: цианотиоацетамид, диэтилэтоксиметиленмалонат, аминометилирование, реакция
Манниха, 1,3,5-тиадиазины
DOI: 10.31857/S0044460X20040058
Реакция Манниха является эффективным ин-
ческой активности и практически важных свойств
струментом построения связей С-С-N и X-C-N
[4, 5, 16, 17]; в числе наиболее важных представи-
(где X = гетероатом N, O, S, Se, P и др.) и в связи
телей данного класса стоит упомянуть фунгицид
с этим весьма часто используется для конструиро-
дазомет 1 (Dazomet) [18, 19], высокоэффективный
вания самых разнообразных гетероциклических
инсектицид бупрофезин 2 (Buprofezin) [17], про-
систем (основные обзорные работы по различ-
тивогрибковый препарат сульбентин (дибензти-
ным модификациям реакции Манниха см. [1-13]).
он) 3 [20] (схема 1). Тиадиазин 4 (NIP-200) явля-
1,3,5-Тиадиазины являются одним из важных клас-
ется активатором 7α-холестерин-гидроксилазы с
сов гетероциклических соединений, синтез кото-
сильным гипогликемическим и антиатерогенным
рых успешно реализуется на основе подходов, ба-
действием [21], а соединения 5 обнаруживают ин-
зирующихся на аминометилировании по Манниху
сектицидное и нейроблокирующее действие [22].
[1-5, 14-16]. 1,3,5-Тиадиазины также представля-
Пиридо[2,1-b][1,3,5]тиадиазины общей формулы 6
ют интерес в связи с широким спектром биологи-
являются эффективными ингибиторами реплика-
522
ВЗАИМОДЕЙСТВИЕ ЭТОКСИМЕТИЛЕНМАЛОНАТА С ЦИАНОТИОАЦЕТАМИДОМ
523
Схема 1.
Схема 2.
ции клещевых флавивирусов [23], обладают про-
ностью [4, 5]. Природа катиона триалкиламмония
тивовоспалительной активностью [24] при отсут-
в реакциях аминометилирования, как правило, не
ствии токсических эффектов [25, 26], анальгетиче-
влияет существенным образом на выходы и на-
ским [27], аналептическим и антидепрессантным
правление процесса [5], поэтому с целью увели-
действием [28].
чения выхода исходного тиолата мы решили заме-
В связи с интересом к получению конден-
нить N-метилморфолин на более основный триэ-
сированных производных пиридо[2,1-b][1,3,5]
тиламин [39].
тиадиазина в условиях аминометилирования
Для получения тиолата 7 цианотиоацетамид
2-меркапто(тиоксо)пиридинов [29-37] мы реши-
вводили в реакцию с этоксиметиленмалоновым
ли изучить поведение новых циклических произ-
эфиром в присутствии 1.5-кратного избытка Et3N
водных цианотиоацетамида в реакции Манниха с
при медленном нагревании реакционной смеси
первичными аминами и формальдегидом. Выбор
до температуры кипения. Продукт реакции без
был остановлен на 6-оксо-3-циано-5-этоксикар-
дополнительной очистки вводился в реакцию с
бонил-1Н-пиридин-2-тиолате
триэтиламмония
первичными аминами и избытком 37%-ного фор-
7. Синтез N-метилморфолинового аналога 8 этой
малина, при этом продукты аминометилирования
соли в аналитически чистом виде, но с умеренным
кристаллизовались из кипящего раствора в ходе
выходом (52%), был описан в работе [38] (схема 2).
реакции. К нашему удивлению, в ИК спектрах
Благодаря наличию нуклеофильных центров
синтезированных соединений с предполагае-
(эндоциклического атома азота и атома серы), ти-
мой структурой пиридо[2,1-b][1,3,5]тиадиазинов
олаты 7 и 8 представляются перспективными суб-
9 отсутствовали полосы валентных колебаний
стратами для проведения аминометилирования с
сложноэфирной С=О группы и присутствовали
выходом на производные пиридо[2,1-b][1,3,5]ти-
полосы поглощения, соответствующие валент-
адиазина с потенциальной биологической актив-
ным колебаниям N-H связи (ν ~3350-3400 см-1).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
524
ДОЦЕНКО и др.
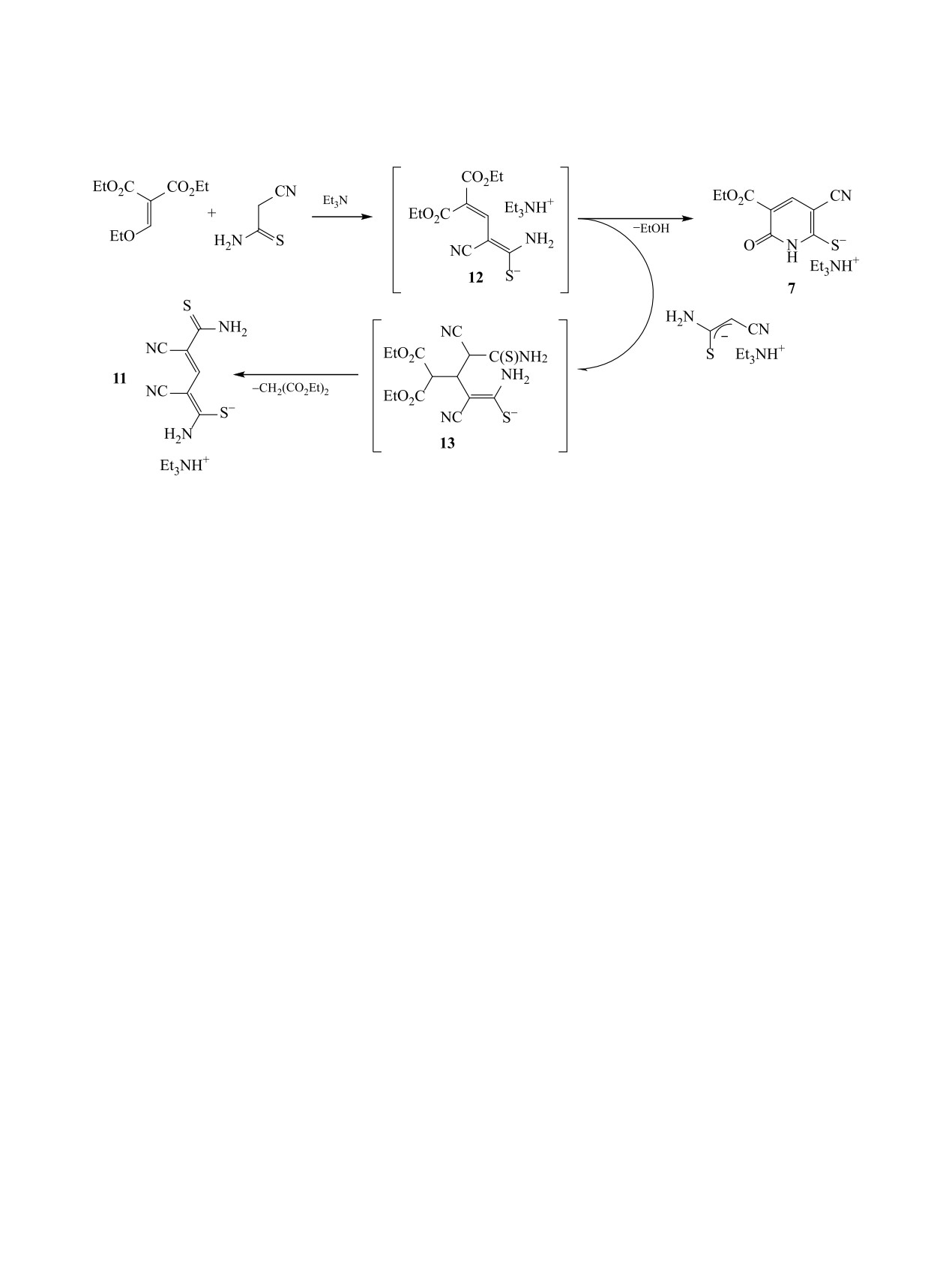
Схема 3.
В спектрах ЯМР 1Н синтезированных соединений
документировано в литературе [43-47]. Основным
присутствуют уширенный синглет протона NH в
путем трансформации интермедиата 12 является
области слабого поля (11.86-12.06 м. д.), два на-
внутримолекулярная 6-экзо-триг-циклизация с об-
бора сигналов протонов от первичных аминов и
разованием пиридин-2-тиолата 7. Альтернативный
четыре неэквивалентных сигнала протонов X-
путь, ведущий к минорному продукту 11, пред-
CH2-N в характерной области (4.5-6.0 м. д.), а
полагает атаку анионом цианотиоацетамида по
также узкий синглет протона при 7.63-7.85 м. д.
активированной кратной связи интермедиата 12.
При этом характерные сигналы протонов этокси-
Последующий распад образовавшегося аддукта
карбонильной группы в спектре отсутствовали.
Михаэля
13 сопровождается элиминированием
Анализ спектральных данных, результатов эле-
малонового эфира и ведет к пентадиен-1-тиолату
ментного анализа, а также данных ВЭЖХ-МС
11. Реализация подобного направления реакции
позволил приписать полученным продуктам стро-
наблюдалась ранее при взаимодействии цианоаце-
ение
4-(1,3,5-тиадиазинан-2-илиден)-2-(3,4-диги-
танилидов с этоксиметиленмалонатом [47].
дро-2H-1,3,5-тиадиазин-6-ил)пент-2-ендинитри-
Дальнейшее исследование взаимодействия
лов 10 (схема 3). Детальный анализ спектральных
цианотиоацетамида с этоксиметиленмалоно-
данных исходного тиолата 7 выявил, что в отличие
вым эфиром в присутствии триэтиламина и
от тиолата 8, полученного по известному методу
N-метилморфолина в различных условиях позво-
[38], синтезированный нами образец представля-
лило установить следующее. В случае использо-
ет собой смесь 1,5-диамино-2,4-дициано-5-тиок-
вания N-метилморфолина в условиях, описанных
сопента-1,3-диен-1-тиолата триэтиламмония
11
ранее [38], соединения типа пентадиентиолата 11
(минорный продукт) и 6-оксо-3-циано-5-этокси-
не были выделены. Образованию соединения 11
карбонил-1Н-пиридин-2-тиолата триэтиламмония
способствует замена N-метилморфолина на триэ-
7 (основной продукт) (схема 3).
тиламин с кратковременным нагреванием смеси.
Образование соединения
11 можно объяс-
Содержание продукта 11 в смеси в целом невелико
нить механизмом, представленным на схеме 4.
и не превышает 10-15 мол% (по данным ЯМР 1Н).
Предположительно, первоначально имеет место
Аналитически чистый
6-оксо-3-циано-5-этокси-
реакция винильного нуклеофильного замещения
карбонил-1Н-пиридин-2-тиолат триэтиламмония
SNVin [40-42] с формированием интермедиата -
7 может быть получен при проведении реакции в
активированного диена 12. Образование подобных
ацетоне при комнатной температуре. Более дли-
ациклических продуктов конденсации в SNVin ре-
тельное нагревание не способствует образованию
акциях замещенных виниловых эфиров с метиле-
соединения 11, не дает увеличения выходов тио-
нактивными соединениями хорошо известно и за-
латов 7 или 8, но приводит к заметному осмоле-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
ВЗАИМОДЕЙСТВИЕ ЭТОКСИМЕТИЛЕНМАЛОНАТА С ЦИАНОТИОАЦЕТАМИДОМ
525
Схема 4.
нию реакционной смеси, возможно вследствие
вания соединения 1,5-диамино-2,4-дициано-5-ти-
дальнейшей внутримолекулярной циклизации со-
оксопента-1,3-диен-1-тиолата триэтиламмония.
единений типа 11 или 13, или же самоконденсации
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
цианотиоацетамида, которая может иметь место в
ИК спектры получали на приборе ИКС-29 в
основной среде [48, 49].
вазелиновом масле. Спектры ЯМР 1Н записаны
Вопреки ожиданиям, ни чистый тиолат 7, ни
на приборе Bruker DPX-400 (400 МГц) (10а, 11)
тиолат 8 в реакцию Манниха в указанных услови-
и Varian Gemini (200 МГц) (10б, в) в ДМСО-d6.
ях не вступают, в ходе синтеза наблюдалось замет-
ВЭЖХ-МС анализ проведен на жидкостном
ное осмоление реакционной массы. Данные ТСХ
хроматографе Shimadzu LC-10AD с детектора-
и ЯМР смолистого остатка после удаления раство-
ми Shimadzu SP D-10A UV-Vis (254 нм) и Sedex
рителя показывают наличие исходного тиолата,
75 ELSD, совмещенном с PE SCIEX API 150EX
наряду со сложной смесью продуктов взаимодей-
масс-спектрометром, метод ионизации - ES-API.
ствия аминов, НСНО и растворителя. По нашему
Элементный анализ проведен на приборе Carlo
мнению, это можно объяснить пониженной N/S-
Erba 1106 Elemental Analyzer. Контроль за чисто-
нуклеофильностью тиолатов 7 и 8, обусловленной
той полученных соединений осуществляли с по-
наличием двух сильных электроноакцепторных
мощью ТСХ на пластинах Silufol UV 254, элюент
групп (СN, COOEt) в пиридиновом кольце.
ацетон-гексан, 1:1, проявитель - пары иода, УФ
Таким образом, нам не удалось осуществить
облучение.
синтез новых пиридо[2,1-b][1,3,5]тиадиазинов
Цианотиоацетамид был получен пропу-
реакцией
6-оксо-3-циано-5-этоксикарбонил-1Н-
сканием сероводорода через раствор малоно-
пиридин-2-тиолата триэтиламмония с форма-
нитрила в EtOH по известной методике [50].
лином и первичными аминами. Вместо этого
Этоксиметиленмалоновый эфир является коммер-
неожиданно были выделены ранее неописан-
чески доступным реагентом (Acros).
ные
4-(1,3,5-тиадиазинан-2-илиден)-2-(3,4-диги-
Взаимодействие этоксиметиленмалоново-
дро-2H-1,3,5-тиадиазин-6-ил)пент-2-ендинитри-
го эфира и цианотиоацетамида в присутствии
лы - продукты аминометилирования побочного
триэтиламина при нагревании. К смеси 10.0 мл
продукта реакции,
1,5-диамино-2,4-дициано-5-
(4.99 ммоль) этоксиметиленмалонового эфира,
тиоксопента-1,3-диен-1-тиолата триэтиламмония,
4.99 г (4.99 ммоль) цианотиоацетамида в 30 мл
образование которого также было зафиксировано
EtOH при 20°С при перемешивании добавляли в
впервые. Предложен вероятный механизм образо-
один прием 10.4 мл (7.47 ммоль, 1.5 экв.) Et3N.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
526
ДОЦЕНКО и др.
Полученный желтый раствор перемешивают
динитрилы
(10а-в). Смесь тиолатов
7 и
11
5 мин, при этом наблюдалось покраснение реак-
(1.00 г), полученную нагреванием цианотиоацета-
ционной массы. Смесь при перемешивании по-
мида с этоксиметиленмалоновым эфиром в при-
степенно (5-10 мин) доводили до кипения, затем
сутствии Et3N, растворяли при нагревании в 10-
оставляли охлаждаться. После остывания рас-
12 мл 80%-ного EtOH. Полученный раствор филь-
твора происходила кристаллизация продукта во
тровали через бумажный фильтр. Фильтрат до-
всем объеме реакционной массы. Осадок отфиль-
бавляли к раствору первичного амина (3 ммоль),
тровывали, промывали EtOH и ацетоном, затем
избытка (5.0 мл) 37%-ного формалина, свободного
петролейным эфиром. Получали 10.07 г кирпич-
от примеси параформа, в 5 мл EtOH. Смесь кипя-
но-красного мелкокристаллического порошка. По
тили при перемешивании 1-2 минуты, при этом
данным ЯМР, продукт представляет собой смесь
происходило образование кристаллического осад-
~90 мол%
6-оксо-3-циано-5-этоксикарбонил-
ка. Продукт отфильтровывали, промывали EtOH и
1Н-пиридин-2-тиолата триэтиламмония 7 (выход
сушили.
~56%) и ~10 мол% 1,5-диамино-2,4-дициано-5-
4-(5-Бензил-1,3,5-тиадиазинан-2-илиден)-2-
тиоксопента-1,3-диен-1-тиолата триэтиламмония
(3-бензил-3,4-дигидро-2H-1,3,5-тиадиазин-6-ил)-
11 (выход ~12.5%, в расчете на цианотиоацета-
пент-2-ендинитрил (10а). Выход 0.18 г, желтый
мид). ИК спектр, ν, см-1: 3300-3260 (N-H), 2220
мелкокристаллический порошок. ИК спектр, ν,
с (CN), 1730 с (C=O). Спектр ЯМР 1Н (ДМСО-d6),
см-1: 3360 (N-H), 2217 (C≡N). Спектр ЯМР 1Н
δ, м. д.: тиолат 7, 1.16-1.28 м [12Н, CH3CH2O +
(ДМСО-d6), δ, м. д.: 3.80 уш. с (2Н, NCH2Ph), 3.93
(CH3CH2)3NH+], 3.10 к [6Н, (CH3CH2)3NH+, 3J =
уш. с (2Н, NCH2Ph), 4.49 уш. с (2Н, NCH2NH), 4.73
7.3 Гц], 4.09 к (2Н, CH3CH2О, 3J = 7.0 Гц), 7.82 с
уш. с (2Н, NCH2S), 4.75 уш. с (2Н, NCH2S), 5.45 уш.
(1Н, Н4, Py), 11.13 уш. с. (1Н, NH); тиолат 11, 8.05
с (2Н, NCH2N), 7.26-7.38 м (10Н, Ph), 7.84 с (1Н,
уш. с и 8.18 уш. с (2Н, NH2), 8.48 с (1Н, СН=), 9.31
СН=), 11.85 уш. с (1Н, NH). Масс-спектр (ESI), m/z:
уш. с и 9.60 уш. с [2H, C(S)NH2]. Сигнал протонов
947.0 [2М + H]+, 826.5 [2M + H - PhCH2N=CH2]+,
NH+ не наблюдается, очевидно, вследствие дейте-
473.5 [M + H]+, 354.5 [M - PhCH2N=CH2 + H]+,
рообмена.
235.1 [M - 2PhCH2N=CH2 + H]+. Найдено, %: С
6-Оксо-3-циано-5-этоксикарбонил-1Н-
63.64; H 5.22; N 17.72. C25H24N6S2 (M = 472.63).
пиридин-2-тиолат триэтиламмония (7). К рас-
Вычислено, %: С 63.53; H 5.12; N 17.78.
твору 2.80 г (2.78 ммоль) цианотиоацетамида и
4-[5-(4-Этоксифенил)-1,3,5-тиадиазинан-2-
5.6 мл (2.8 ммоль) этоксиметиленмалонового эфи-
илиден]-2-[3-(4-этоксифенил)-3,4-дигидро-2H-
ра в 15 мл ацетона по каплям при перемешивании
1,3,5-тиадиазин-6-ил]пент-2-ендинитрил
(10б).
добавляли 5.85 мл (4.2 ммоль, 1.5 экв.) триэтил-
Выход 0.09 г, ярко-желтый мелкокристалличе-
амина. Смесь перемешивали при комнатной тем-
ский порошок. ИК спектр, ν, см-1: 3345 (N-H),
пературе 3 ч и оставляли на 72 ч. Осадок отмывали
2216 (C≡N). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
холодным ацетоном, затем петролейным эфиром.
1.30-1.38 м (6Н, CH3CH2O), 3.88-4.00 м (4Н,
Выход 3.44 г (38%), темно-желтые кристаллы.
CH3CH2O), 5.08 уш. с (2Н, NCH2NH), 5.17 уш. с
ИК спектр, ν, см-1: 3300-3260 (N-H), 2220 (C≡N),
(2Н, NCH2S), 5.20 уш. с (2Н, NCH2S), 5.99 уш. с
1730 (C=O). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
(2Н, NCH2N), 6.75 д (2Н, H-Ar, 3J = 8.8 Гц), 6.78
1.16 т [9Н, (CH3CH2)3NH+, 3J = 7.3 Гц], 1.20 т (3Н,
д (2Н, H-Ar, 3J = 8.8 Гц), 6.90 д (2Н, H-Ar, 3J =
CH3CH2O, 3J = 7.1 Гц), 3.09 к [6Н, (CH3CH2)3NH+,
8.8 Гц), 7.03 д (2Н, H-Ar, 3J = 8.8 Гц), 7.63 с (1Н,
3J = 7.3 Гц], 4.07 к (2Н, CH3CH2О, 3J = 7.1 Гц), 7.80
СН=), 12.04 уш. с (1Н, NH). Найдено, %: С 60.84;
с (1Н, Н4, Py), 8.83* уш. с (1Н, NH+), 11.12 уш. с
H 5.42; N 15.75. C27H28N6O2S2 (M = 532.68).
(1Н, NH). *Частично в дейтерообмене. Найдено,
Вычислено, %: С 60.88; H 5.30; N 15.78.
%: С 55.24; H 7.25; N 12.85. C15H23N3O3S (M
4-[5-(4-Этилфенил)-1,3,5-тиадиазинан-2-
325.43). Вычислено, %: С 55.36; H 7.12; N 12.91.
илиден]-2-[3-(4-этилфенил)-3,4-дигидро-2H-
4-(5-R-1,3,5-Тиадиазинан-2-илиден)-2-(3-R-
1,3,5-тиадиазин-6-ил]пент-2-ендинитрил (10в).
3,4-дигидро-2H-1,3,5-тиадиазин-6-ил)пент-2-ен-
Выход 0.12 г, темно-желтый мелкокристалличе-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
ВЗАИМОДЕЙСТВИЕ ЭТОКСИМЕТИЛЕНМАЛОНАТА С ЦИАНОТИОАЦЕТАМИДОМ
527
ский порошок. ИК-спектр, ν, см-1: 3365 (N-H),
7. Subramaniapillai S. G. // J. Chem. Sci. 2013. Vol. 125.
2220 (C≡N). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
N 3. P. 467. doi 10.1007/s12039-013-0405-y
1.13-1.22 м
(6Н, CH3CH2),
2.49-2.56 м
(4Н,
8. Bur S.K., Martin S.F. // Tetrahedron. 2001. Vol. 57.
CH3CH2), 5.14 уш. с (2Н, NCH2NH), 5.25-5.26 м
N 16. P. 3221. doi 10.1016/S0040-4020(01)00035-7
(4Н, NCH2S), 6.05 уш. с (2Н, NCH2N), 6.91 д (2Н,
9. Tramontini M. // Synthesis. 1973. N 12. P. 703. doi
H-Ar, 3J = 8.5 Гц), 7.04-7.11 м (6Н, H-Ar), 7.61 с
10.1055/s-1973-22294
(1Н, СН=), 12.06 уш. с (1Н, NH). Найдено, %: С
10. Tramontini M., Angiolini L. // Tetrahedron. 1990. Vol. 46.
64.74; H 5.72; N 16.75. C27H28N6S2 (M = 500.68).
N 6. P. 1791. doi 10.1016/S0040-4020(01)89752-0
Вычислено, %: С 64.77; H 5.64; N 16.79.
11. Roselló M.S., del Pozo C., Fustero S. // Synthesis. 2016.
ФОНДОВАЯ ПОДДЕРЖКА
Vol. 48. N 16. P. 2553. doi 10.1055/s-0035-1561650
Работа выполнена при финансовой поддерж-
12. Karimi B., Enders D., Jafari E. // Synthesis. 2013. Vol. 45.
ке Министерства образования и науки Российской
N 20. P. 2769. doi 10.1055/s-0033-1339479
Федерации (проект МОН
№ 0795-2020-0010,
13. Roman G. // Eur. J. Med. Chem. 2015. Vol. 89. P. 743.
В.В. Доценко).
doi 10.1016/j.ejmech.2014.10.076
КОНФЛИКТ ИНТЕРЕСОВ
14. Bermello J.C., Piñeiro R.P., Fidalgo L.M., Cabrera H.R.,
Navarro M.S. // The Open Med. Chem. J. 2011. Vol. 5.
Авторы заявляют об отсутствии конфликта
P. 51. doi 10.2174/1874104501105010051
интересов.
15. Rodríguez H., Suárez M., Albericio F. // Molecules.
СПИСОК ЛИТЕРАТУРЫ
2012. Vol. 17. N 7. P. 7612. doi 10.3390/
1. Ахметова В.Р., Надыргулова Г.Р., Ниатшина З.Т.,
molecules17077612
Джемилев У.М. // ХГС. 2009. № 10. С. 1443;
16. Shobana N., Farid P. In: Comprehensive Heterocyclic
Akhmetova V.R., Nadyrgulova G.R., Niatshina Z.T.,
Chemistry III. Oxford: Elsevier, 2008. Vol. 9. P. 457. doi
Dzhemilev U.M. // Chem. Heterocycl. Compd. 2009.
10.1016/B978-008044992-0.00809-9
Vol. 45. N 10. P. 1155. doi 10.1007/s10593-010-0403-7
17. Kanno H. // Pure Appl. Chem. 1987. Vol. 59. N 8.
2. Ахметова В.Р., Рахимова Е.Б. // ЖОрХ. 2014. Т. 50.
P. 1027. doi 10.1351/pac198759081027
№ 12. С. 1727; Akhmetova V.R., Rakhimova E.B. //
18. Fu C.H., Hu B.Y., Chang T.T., Hsueh K.L., Hsu W.T. //
Russ. J. Org. Chem. 2014. Vol. 50. N 12. P. 1711. doi
10.1134/S107042801412001X
Pest Manag. Sci. 2012. Vol. 68. N 7. P. 959. doi 10.1002/
ps.3303
3. Akhmetova V.R., Rakhimova E.B., Galimzyanova N.F.,
Ibragimov A.G. In: Bioactive heterocycles: synthesis
19. Barnard A.J., Hornby D. // J. Agric. Sci. 1982. Vol. 98.
and biological evaluation. Hauppauge: Nova Science
N 1. P. 7. doi 10.1017/S0021859600041046
Pub., 2012. Ch. 5. P. 98.
20. Hänel H., Raether W., Dittmar W. // Ann. New York
4. Доценко В.В., Фролов К.А., Кривоколыско С.Г. //
Acad. Sci. 1988, Vol. 544. P. 329. doi 10.1111/j.1749-
ХГС. 2015. Т. 51. № 2. С. 109; Dotsenko V.V., Fro-
6632.1988.tb40417.x
lov K.A., Krivokolysko S.G. // Chem. Heterocycl.
21. Sakashita M., Toyoda K., Kitahara M., Tsuruzoe N.,
Compd. 2015. Vol. 51. N 2. P. 109. doi 10.1007/s10593-
Nakayama S., Oguchi K. // Jpn. J. Pharmacol. 1993.
015-1668-7
Vol. 62. N 1. P. 87. doi 10.1254/jjp.62.87
5. Доценко В.В., Фролов К.А., Чигорина Е.А., Хруста-
22. Kagabu S., Murata N., Hibino R., Hanzawa M.,
лева А.Н., Бибик Е.Ю., Кривоколыско С.Г. // Изв.
Nishimura K. // J. Pestic. Sci. 2005. Vol. 30. N 2.
АН. Сер. хим. 2019. № 4. С. 691; Dotsenko V.V., Fro-
P. 111. doi 10.1584/jpestics.30.111
lov K.A., Chigorina E.A., Khrustaleva A.N., Bibik E.Yu.,
Krivokolysko S.G. // Russ. Chem. Bull. 2019. Vol. 68.
23. Osolodkin D.I., Kozlovskaya L.I., Dueva E.V., Dotsen-
N 4. P. 691. doi 10.1007/s11172-019-2476-5
ko V.V., Rogova Yu.V., Frolov K.A., Krivokolysko S.G.,
6. Arend M., Westermann B., Risch N. // Angew. Chem.
Romanova E.G., Morozov A.S., Karganova G.G.,
Int. Ed. 1998. Vol. 37. N 8. P. 1044. doi 10.1002/
Palyulin V.A., Pentkovski V.M., Zefirov N.S. // ACS Med.
(SICI)1521-3773(19980504)37:8<1044::AID-
Chem. Lett. 2013. Vol. 4. N 9. P. 869. doi 10.1021/
ANIE1044>3.0.CO;2-E
ml400226s
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
528
ДОЦЕНКО и др.
24. Бибик Е.Ю., Ярошевская О.Г., Девдера А.В., Демен-
Chem. Heterocycl. Compd. 2012. Vol. 48. N 7. P. 1117.
ко А.В., Захаров В.В., Фролов К.А., Доценко В.В.,
doi 10.1007/s10593-012-1109-9
Кривоколыско С.Г. // Хим.-фарм. ж. 2017. Т. 51.
34. Dotsenko V.V., Frolov K.A., Pekhtereva T.M., Papai-
№ 8. С. 16. doi 10.30906/0023-1134-2017-51-8-16-
anina O.S., Suikov S.Yu., Krivokolysko S.G. // ACS
19; Bibik E.Yu., Yaroshevskaya O.G., Devdera A.V.,
Comb. Sci. 2014. Vol. 16. N 10. P. 543. doi 10.1021/
Demenko A.V., Zakharov V.V., Frolov K.A., Dotsen-
co5000807
ko V.V., Krivokolysko S.G. // Pharm. Chem. J. 2017.
35. Dotsenko V.V., Chigorina E.A., Papaianina E.S., Fro-
Vol. 51. N 8. P. 648. doi 10.1007/s11094-017-1669-1
lov K.A., Krivokolysko S.G. // Macroheterocycles. 2015.
25. Бибик Е.Ю., Ярошевская О.Г., Деменко А.В., Фро-
Vol. 8. N 3. P. 310. doi 10.6060/mhc150870d
лов К.А., Доценко В.В., Кривоколыско С.Г. // Экс-
36. Чигорина Е.А., Фролов К.А., Доценко В.В., Головеш-
пер. клин. фармакол. 2018. Т. 81. № 10. С. 20. doi
кин А.С., Бушмаринов И.С., Кривоколыско С.Г. //
10.30906/0869-2092-2018-81-10-20-23; Bibik E.Yu.,
Изв. АН. Сер. хим. 2016. № 9. С. 2260; Chigorina
Yaroshevskaya O.G., Demenko A.V., Fro-
E.A., Frolov K.A., Dotsenko V.V., Goloveshkin A.S.,
lov K.A., Dotsenko V.V., Krivokolysko S.G. // Res.
Bushmarinov I.S., Krivokolysko S.G. // Russ. Chem.
Result: Pharmacol. Clin. Pharmacol. 2018. N 4 (2).
Bull. Int. Ed. 2016. Vol. 65. N 9. P. 2260. doi 10.1007/
P. 77. doi 10.3897/rrpharmacology.4.28305
s11172-016-1576-8
26. Бибик Е.Ю., Ярошевская О.Г., Девдера А.В., Демен-
37. Доценко В.В., Фролов К.А., Кривоколыско С.Г., Чиго-
ко А.В., Фролов К.А., Доценко В.В., Кривоколыс-
рина Е.А., Пехтерева Т.М., Суйков С.Ю., Папаяни-
ко С.Г. // Соврем. медицина: акт. вопр. 2016. № 7
на Е.С., Дмитриенко А.О., Бушмаринов И.С. // ХГС.
(49). С. 60.
2016. Т. 52. № 2. C. 116-127; Dotsenko V.V., Frolov K.A.,
27. Бибик Е.Ю., Фролов К.А., Ярошевская О.Г., Демен-
Krivokolysko S.G., Chigorina E.A., Pekhtereva T.M.,
ко А.В., Девдера А.В., Доценко В.В., Кривоколыс-
Suykov S.Yu., Papayanina E.S., Dmitrienko A.O.,
ко С.Г. // Науч. ведом. Белгород. гос. унив. Сер. Ме-
Bushmarinov I.S. // Chem. Heterocycl. Compd. 2016.
дицина Фармация. № 5 (226). Вып. 33. C. 135.
Vol. 52. N 2. P. 116. doi 10.1007/s10593-016-1843-5
28. Бибик Е.Ю., Некраса И.А., Деменко А.В., Фро-
38. Якунин Я.Ю., Дяченко В.Д., Литвинов В.П. // Изв.
лов К.А., Доценко В.В., Кривоколыско С.Г. // Бюлл.
АН. Сер. хим. 1999. № 1. С. 196; Yakunin Ya.Yu.,
Сиб. мед. 2019. Т. 18. № 3. С. 21. doi 10.20538/1682-
Dyachenko V.D., Litvinov V.P. // Russ. Chem. Bull. Int.
0363-2019-3-21-28
Ed. 1999. Vol. 48. N 1. P. 195. doi 10.1007/BF02494427
29. Dotsenko V.V., Krivokolysko S.G., Litvinov V.P. //
39. Rayer A.V., Sumon K.Z., Jaffari L., Henni A. // J. Chem.
Monatsh. Chem. 2008. Vol. 139. N 3. P. 271. doi
Eng. Data. 2014. Vol. 59. N 11. P. 3805. doi 10.1021/
10.1007/s00706-007-0784-1
je500680q
30. Dotsenko V.V., Krivokolysko S.G., Litvinov V.P. //
40. Кудякова Ю.С., Бажин Д.Н., Горяева М.В., Бур-
Monatsh. Chem. 2008. Vol. 139, N 6. P. 657. doi
гарт Я.В., Салоутин В.И. // Усп. хим. 2014. Т. 83.
10.1007/s00706-007-0809-9
№ 2. С. 120; Kudyakova Y.S., Bazhin D.N., Gorya-
31. Доценко В.В., Фролов К.А., Кривоколыско С.Г.,
eva M.V., Burgart Y.V., Saloutin V.I. // Russ. Chem.
Литвинов В.П. // Изв. АН. Сер. хим. 2009. № 7.
Rev. 2014. Vol. 83. N 2. P. 120. doi 10.1070/
RC2014v083n02ABEH004388
С. 1436; Dotsenko V.V., Frolov K.A., Krivokolysko S.G.,
Litvinov V.P. // Russ. Chem. Bull. Int. Ed. 2009. Vol. 58.
41. Дяченко В.Д., Ткачев Р.П. // ЖОрХ. 2003. Т. 39. № 6.
N 7. P. 1479. doi 10.1007/s11172-009-0199-8
С. 807; Dyachenko V.D., Tkachiov R.P. // Russ. J. Org.
Chem. 2003. Vol. 39. N 6. P. 757. doi 10.1023/B:RU
32. Доценко В.В., Кривоколыско С.Г., Литвинов В.П. //
Изв. АН. Сер. хим. 2012. № 1. С. 129; Dotsenko V.V.,
JO.0000003153.20325.22
Krivokolysko S.G., Litvinov V.P. // Russ. Chem. Bull.
42. Дяченко В.Д., Ткачев Р.П. // ЖОрХ. 2006. Т. 42.
Int. Ed. 2012. Vol. 61. N 1. P. 131. doi 10.1007/s11172-
№ 2. С. 167; Dyachenko V.D., Tkachiov R.P. // Russ.
012-0018-5
J. Org. Chem. 2006. Vol. 42. N 2. P. 149. doi 10.1134/
33. Фролов К.А., Доценко В.В., Кривоколыско С.Г.,
S1070428002120011
Литвинов В.П. // ХГС. 2012. № 7. C. 1197; Frolov
43. Дяченко В.Д., Ткачев Р.П. // ЖОрХ. 2003. Т. 39.
K.A., Dotsenko V.V., Krivokolysko S.G., Litvinov V.P. //
№ 8. С. 1245; Dyachenko V.D., Tkachiov R.P. //
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
ВЗАИМОДЕЙСТВИЕ ЭТОКСИМЕТИЛЕНМАЛОНАТА С ЦИАНОТИОАЦЕТАМИДОМ
529
Russ. J. Org. Chem. 2003. Vol. 39. N 8. P. 1174. doi
S1070363207010161
10.1023/B:RUJO.0000010189.83376.ca
47. Tkachova V.P., Gorobets N.Y., Tkachov R.P., Dyachen-
ko O.D., Rusanov E.B., Dyachenko V.D. // Arkivoc.
44. Дяченко В.Д., Ткачев Р.П., Чернега А.Н. // ХГС. 2005.
№ 4. С. 589; Dyachenko V.D., Tkachev R.P., Cher-
2010. Vol. 11. P. 254. doi 10.3998/ark.5550190.0011.b21
nega A.N. // Chem. Heterocycl. Compd. 2005. Vol. 41.
48. Fahmy S.M., Mohareb R.M. // Tetrahedron. 1986.
N 4. P. 503. doi 10.1007/s10593-005-0179-3
Vol. 42. N 2. P. 687. doi 10.1016/S0040-4020(01)87471-8
45. Schmidt H.W., Junek H. // Monatsh. Chem. 1977.
49. Mohareb R.M., Fahmy S.M. // Z. Naturforsch. (B). 1986.
Vol. 108. N 4. P. 859. doi 10.1007/BF00898055
Vol. 41. N 1. P. 105. doi 10.1515/znb-1986-0122
46. Ткачев Р.П., Битюкова О.С., Дяченко В.Д., Тка-
50. Доценко В.В., Кривоколыско С.Г., Половинко В.В.,
чева В.П., Дяченко А.Д. // ЖОХ. 2007. Т. 77. № 1.
Литвинов В.П. // ХГС. 2012. № 2. С. 328; Dotsen-
С. 125; Tkachev R.P., Bityukova O.S.. Dyachenko V.D.,
ko V.V., Krivokolysko S.G., Polovinko V.V., Litvinov V.P. //
Tkacheva V.P., Dyachenko A.D. // Russ. J. Gen.
Chem. Heterocycl. Compd. 2012. Vol. 48. P. 309. doi
Chem. 2007. Vol. 77. N 1. P. 116. doi 10.1134/
10.1007/s10593-012-0991-5
Reaction of Ethoxymethylenemalononate
with Cyanothioacetamide in the Presence of Triethylamine:
Formation of 1,5-Diamino-2,4-dicyano-5-thioxopenta-
1,3-diene-1-thiolate and Unexpected Aminomethylation Result
V. V. Dotsenkoa,b,*, S. G. Krivokolyskoa, and E. A. Chigorinac
a Kuban State University, Krasnodar, 350040 Russia
b North Caucasus Federal University, Stavropol, 355009 Russia
c Institute of Chemical Reagents and High Purity Chemical Substances of National Research Centre “Kurchatov Institute”,
Moscow, 107076 Russia
*e-mail: victor_dotsenko_@mail.ru
Received November 12, 2019; revised November 12, 2019; accepted November 14, 2019
The reaction of cyanothioacetamide with ethoxymethylenemalonate and triethylamine in ethanol when heated
is non-selective and leads to the formation of a mixture of triethylammonium 1,5-diamino-2,4-dicyano-5-
thioxopenta-1,3-diene-1-thiolate and triethylammonium 6-oxo-3 -cyano-5-ethoxycarbonyl-1H-pyridin-2-thiolate
with a predominance of the latter. The reaction product when treated with primary amines and 37% formalin
in boiling aqueous alcohol gives only 4-(1,3,5-thiadiazinan-2-ylidene)-2-(3,4-dihydro-2H-1,3,5-thiadiazin-6-
yl)pent-2-enedinitrile instead of the expected pyrido[2,1-b][1,3,5]thiadiazine derivatives. Triethylammonium
6-oxo-3-cyano-5-ethoxycarbonyl-1H-pyridin-2-thiolate does not react under these conditions.
Keywords: cyanothioacetamide, diethyl ethoxymethylenemalonate, aminomethylation, Mannich reaction,
1,3,5-thiadiazines
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020