ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 4, с. 536-545
УДК 547.587.51;547.304.2;667.287.4
СИНТЕЗ И ПРИРОДА ЭЛЕКТРОННЫХ ПЕРЕХОДОВ
КРАСИТЕЛЯ НА ОСНОВЕ 1-{2-[4-(3-ГИДРОКСИ-
2-ОКСО-2Н-ХРОМЕН-4-ИЛ)ФЕНИЛ]-2-ОКСОЭТИЛ}-
4-МЕТИЛПИРИДИНИЙБРОМИДА
© 2020 г. О. В. Скрипскаяa, Р. З. Лытвынb, О. В. Руснакa, Д. О. Мельникc,
Х. Е. Питковычb, П. И. Ягодинецa, М. Д. Обушакb,*
a Черновицкий национальный университет имени Ю. Федьковича, Черновцы, 58012 Украина
b Львовский национальный университет имени И. Франко, ул. Кирилла и Мефодия 6, Львов, 79005 Украина
c Ивано-Франковский национальный медицинский университет, Ивано-Франковск, 76018 Украина
*e-mail: mykola.obushak@lnu.edu.ua
Поступило в Редакцию 24 октября 2019 г.
После доработки 24 октября 2019 г.
Принято к печати 27 октября 2019 г.
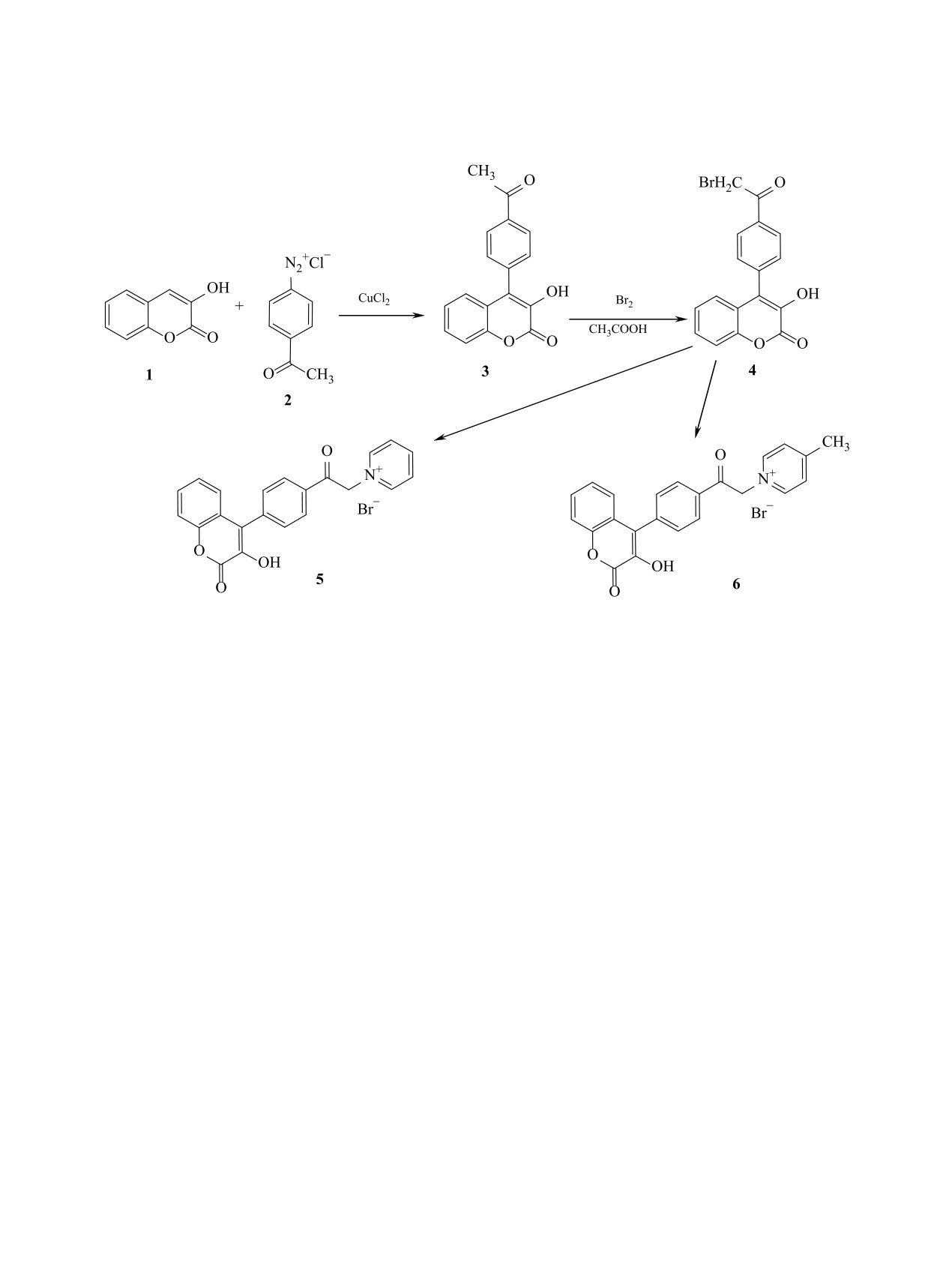
Взаимодействие 4-[4-(2-бромацетил)фенил]-3-гидрокси-2Н-хромен-2-она с пиридином и 4-метилпири-
дином приводит к соответствующим четвертичным солям. Конденсацией 1-{2-[4-(3-гидрокси-2-оксо-
2Н-хромен-4-ил)фенил]-2-оксоэтил}-4-метилпиридинийбромида с 4-(диметиламино)бензальдегидом
получен новый бисцианиновый краситель, спектр которого характеризуется двумя максимумами погло-
щения, что обусловлено взаимодействием хромофоров. Проведен квантово-химический анализ природы
электронных переходов.
Ключевые слова: цианиновые красители, пиридиниевые соли, производные кумарина, арилирование,
квантово-химические расчеты
DOI: 10.31857/S0044460X20040071
Химия цианиновых красителей активно раз-
кванты, то, находясь в сопряжении, они влияют
вивается, что обусловлено применением этих
друг на друга, и частота поглощения одного повы-
красителей в различных областях техники, фар-
шается, а другого - снижается, т. е. полосы погло-
макологии и медицине [1-3]. Четвертичные соли
щения раздвигаются [12, 13].
метилпроизводных пиридина, хинолина, тиазо-
Четвертичные соли 4-метилхинолиния (пири-
ла и бензотиазола часто используют для получе-
диния) с арил- или кумаринилкарбонилметилено-
ния цианиновых красителей. Цианины с двумя
выми фрагментами у четвертичного атома азота
хромофорами - удобные объекты для исследова-
вступают в конденсацию как по метильной, так и
ния взаимодействия хромофорных групп [4, 5].
по метиленовой группе [14-17]. Пространственное
Закономерности такого взаимодействия приведе-
расположение хромофоров в бисцианиновом кра-
ны в работах [6-11]. Взаимное влияние двух со-
сителе установлено по результатам анализа спек-
пряженных хромофоров можно объяснить в рам-
тров поглощения и квантово-химических расчетов
ках теории возмущения [10]. Если в молекуле ци-
[18]. Введение между кумариновым и пиридино-
анина присутствуют два сопряженных хромофора,
вым фрагментами кроме карбонилметиленовой
каждый из которых в отдельности поглощает энер-
группы бензольного цикла, увеличивающего цепь
гетически различные кванты света, то такие хро-
сопряжения, изменяет свойства красителя. Нами
мофоры мало влияют друг на друга. Если каждый
синтезирован такой бисцианин 7 на основе четвер-
из двух хромофоров поглощает близкие по частоте
тичной соли 6. Соль 6 получали в результате пре-
536
СИНТЕЗ И ПРИРОДА ЭЛЕКТРОННЫХ ПЕРЕХОДОВ КР
АСИТЕЛЯ
537
Схема 1.
вращений 1→3→4→6 (схема 1). При взаимодей-
другая - в виде перегиба при 505 нм (lgε = 3.51).
ствии 3-гидроксикумарина 1 с 4-ацетилбензолди-
Максимумы полос поглощения в спектрах краси-
азонийхлоридом 2 в условиях реакции Меервейна
теля 7 и полученного ранее бисцианина на основе
образуется замещенный кумарин 3, бромировани-
1-{2-оксо-2-[4-(кумарин-3-ил)фенил]этил}-4-ме-
ем которого в уксусной кислоте получено соедине-
тилпиридинийбромида [12] близки и смещены в
ние 4. Взаимодействие бромкетона 4 с пиридином
коротковолновую область по сравнению с анало-
гичным бисцианином, не содержащим бензольно-
или 4-метилпиридином в толуоле приводит к чет-
го цикла между карбонильной группой и фрагмен-
вертичным солям 5 и 6.
том 2Н-хромен-2-она [17].
В ИК спектрах солей 5 и 6 полоса поглощения
Такое смещение обусловлено как простран-
карбонильной группы фрагмента СОСН2 проявля-
ственным взаимодействием между бензольным
ется при ~1675 см-1, а полоса карбонильной груп-
кольцом и хромофором, находящимся у атома
пы хроменового цикла - при 1715 см-1. Полоса
азота пиридина, так и, возможно, вращением ку-
поглощения гидроксильной группы находится при
маринового фрагмента относительно бензольного
3350 см-1.
кольца.
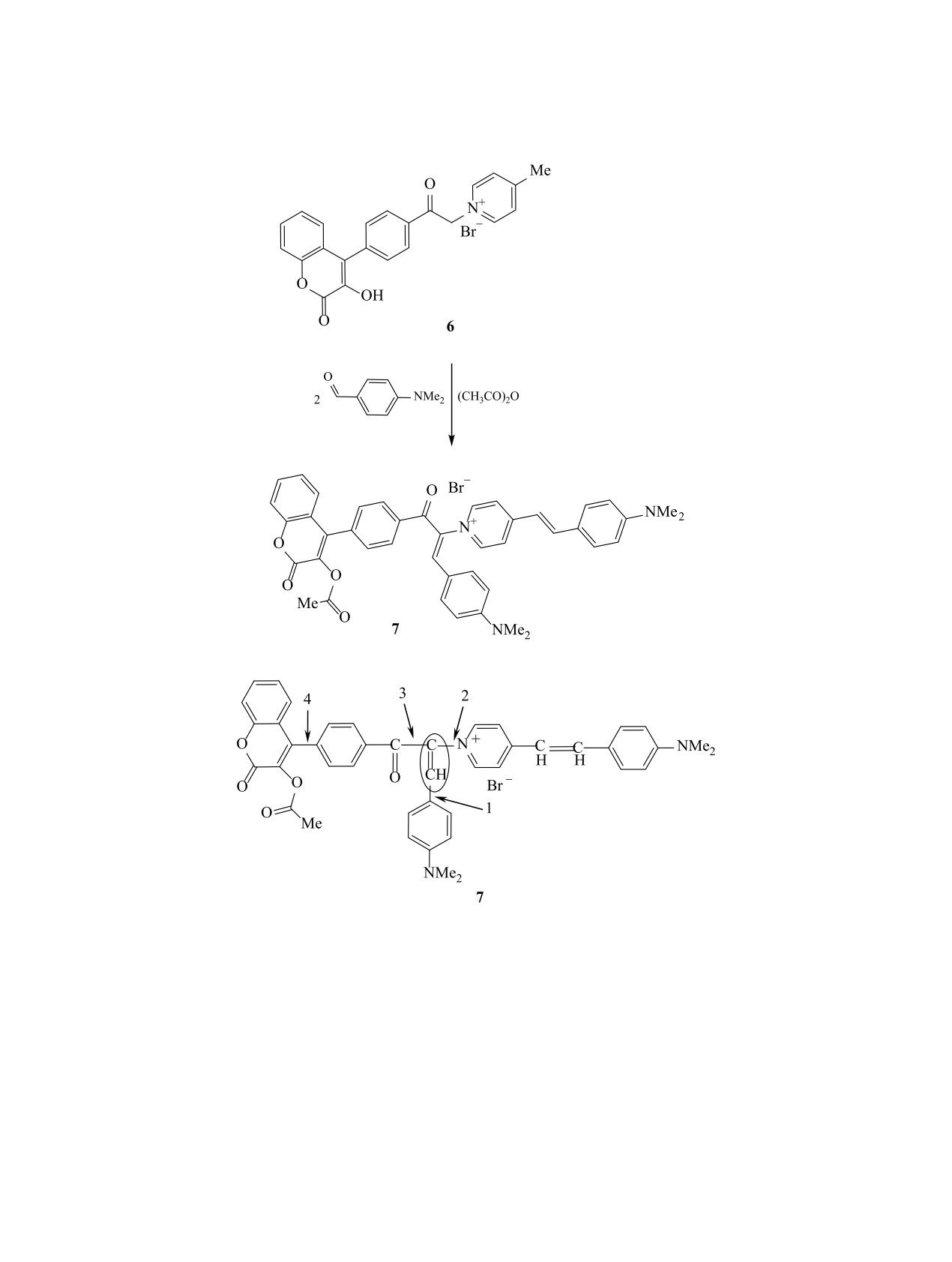
Соединение 6 вступает в цианиновую конден-
Из-за пространственного взаимодействия уве-
сацию с 4-(диметиламино)бензальдегидом в среде
личивается энергия возбужденного состояния
уксусного ангидрида как по метильной, так и по
по сравнению с основным состоянием, и полосы
метиленовой группам с образованием бисциани-
поглощения смещаются гипсохромно. Это под-
нового красителя 7 (схема 2). Кроме того, в усло-
тверждается квантово-химическими расчетами,
виях реакции происходит ацилирование гидрок-
выполненным полуэмпирическим методом АМ1,
сильной группы.
согласно которым энергия возбужденного состо-
В электронном спектре поглощения бисциани-
яния составляет 914 кДж/моль, а основного со-
на 7 присутствуют две полосы: одна, более интен-
стояния - 864 кДж/моль. Разница этих значений
сивная, коротковолновая при 432 нм (lgε = 3.72),
(50 кДж/моль) характеризует энергию вращения
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
538
СКРИПСКАЯ и др.
Схема 2.
Схема 3.
фрагмента 3-гидрокси-2Н-хромен-2-она относи-
Для выяснения связи между появлением двух
тельно бензольного ядра. Учитывая непланарное
полос в спектре поглощения бисцианина и взаи-
модействием хромофоров мы получили два моно-
расположение ароматических фрагментов в краси-
цианина на основе солей пиридиния, содержащих
теле 7, мы провели расчет торсионных углов меж-
либо метиленовую, либо метильную группу. Соль
ду этими фрагментами относительно связи С=СН
5 при конденсации с 4-(диметиламино)бензальде-
(схема 3).
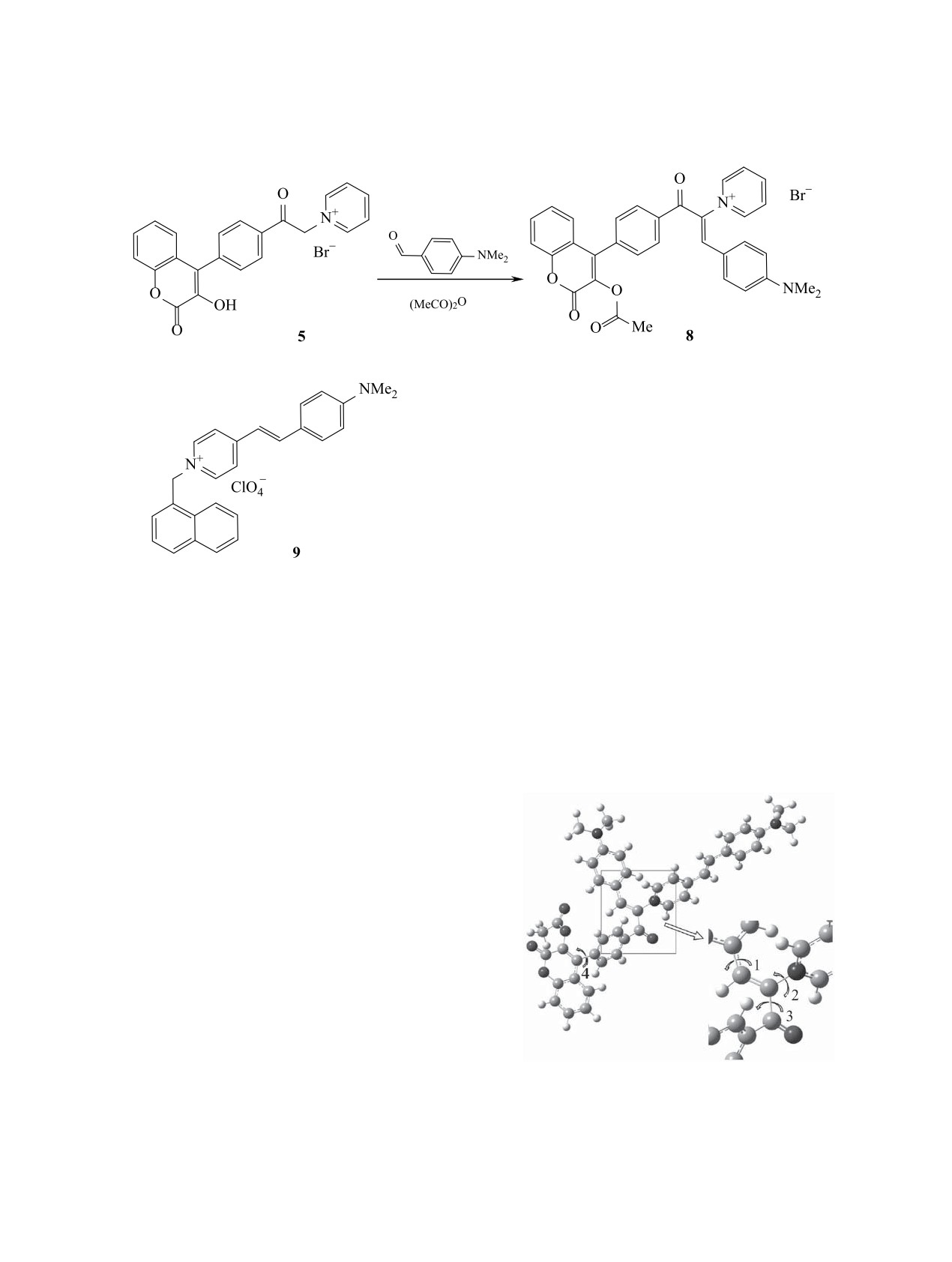
гидом образует моноцианин 8 (схема 4), спектр
Расчеты методом АМ1 показали, что для фраг-
которого характеризуется максимумом полосы по-
ментов С=СН-С6Н4N(СН3)2-4 (1), пиридин-С=СН
глощения при 436 нм.
(2), С6Н4С(О)-С=СН (3), кумарин-С6Н4 (4) углы
При конденсации четвертичной соли, получен-
составляют 38.8, 48, 50.4, 53.4° соответственно.
ной из 1-хлорметилнафталина и 4-метилпириди-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
СИНТЕЗ И ПРИРОДА ЭЛЕКТРОННЫХ ПЕРЕХОДОВ КР
АСИТЕЛЯ
539
Схема 4.
молекулу красителя, в том числе и раздвижение
Схема 5.
полос, можно рассматривать исходя из теории воз-
мущений и ее применения к электронным спек-
трам.
На основе соотношения интенсивностей длин-
новолновой и коротковолновой полос по методу,
разработанному ранее [11], мы определили, что
угол между плоскостями хромофоров составляет
82°. Степень взаимодействия хромофоров опреде-
лена по разности Δ2-Δ1 [7], где Δ2 - разность мак-
на, с 4-(диметиламино)бензальдегидом образуется
симумов двух полос поглощения бисцианинового
моноцианин 9 (схема 5), спектр которого характе-
красителя 7, а Δ1 - разность максимумов поглоще-
ризуется максимумом поглощения при 492 нм [17].
ния красителей 8 и 9.
Выбор соединения 9 обусловлен тем, что для
Нами выполнены квантово-химические расче-
получения моноцианина, включающего, как в со-
ты равновесной геометрии и электронного строения
единении 7, остаток кумарина, необходим трудно-
возможных изомеров бисцианинового красителя 7.
доступный
4-[4-(хлорметил)фенил]-3-гидрокси-
Оптимизация молекулярной геометрии выполнена
2Н-хромен-2-он. Учитывая изолирующее действие
методом DFT/6-31G(d,p), характеристики электрон-
метиленовой группы при передаче электронных
ных переходов - методом TD DFT с тем же базисом
эффектов [19], можно полагать, что максимумы
(пакет GAUSSIАN 03 [20]).
полос поглощения красителей, содержащих наф-
талиновый или кумариновый фрагменты, близки.
Максимумы полос поглощения бискрасителя 7
смещены соответственно гипсохромно на 4 нм и
батохромно на 13 нм по сравнению с максимума-
ми в спектрах красителей 8 и 9, в молекулах кото-
рых присутствует только один хромофор. Большее
смещение максимума длинноволновой полосы по
сравнению с коротковолновой объясняется разли-
чием в степени делокализации π-электронов в хро-
мофорах красителей 8 и 9 [12, 13]. Известно, что
чем длиннее цепь π-связей, тем больше делокали-
зированы эти электроны и тем сильнее взаимодей-
ствие с другим хромофором [7].
Рис. 1. Оптимизированная геометрия молекулы кра-
Как уже отмечалось, физическую природу вза-
сителя 7 (увеличена область возле центрального фраг-
мента PhCH=CH).
имодействия хромофорных систем, входящих в
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
540
СКРИПСКАЯ и др.
Рис. 2. Схема низших электронных переходов в
Рис. 3. Схема низших электронных переходов в
красителе 7. Пунктирными стрелками обозначены
молекуле красителе 8. Пунктирными стрелками
низкоинтенсивные переходы (с небольшими значе-
обозначены низкоинтенсивные переходы (с неболь-
ниями сил осциллятора).
шими значениями сил осциллятора).
По данным расчетов, наиболее стабилен изомер,
в большей степени на центральном фрагменте
представленный на рис. 1. Теоретический спектр это-
PhCH=CH.
го изомера наиболее близок к экспериментальному
Разветвление общего хромофора красителя 7 на
электронному спектру поглощения. Из рис. 1 видно,
три фрагмента усложняет картину электронных пере-
что в молекуле существуют три фрагмента, плоскости
ходов по сравнению с классической схемой взаимо-
которых образуют между собой значительные углы.
действия хромофоров [7, 11], которая предполагает
Расчет показывает, что между фрагментами прояв-
равномерную локализацию орбиталей по всей моле-
ляется некоторое взаимодействие и можно предполо-
куле. В табл. 1 приведены характеристики переходов,
жить, что молекула красителя имеет общую π-систему.
вычисленные методом TD DFT с тем же базисом, с
Неплоское строение влияет на степень делока-
указанием вклада наиболее весомой конфигурации
лизации граничных и близких к ним молекулярных
Фi→j, количественно оцениваемого коэффициентом
орбиталей. На рис. 2 представлена форма орбиталей,
Tp,i→j в разложении функции р-того возбужденного
участвующих в низших электронных переходах, кото-
состояния Ψp в методе конфигурационного взаимо-
рые можно наблюдать экспериментально в электрон-
действия Ψp = ΣTp,i→jФi→j, где суммирование прово-
ном спектре поглощения. Как видно из рис. 2, ВЗМО
дится по всем конфигурациям, а индексы i и j указы-
и ВЗМО-3 локализированы преимущественно на ку-
вают на орбитали, участвующие в переходе [20, 21].
Наиболее важные конфигурации для всех приведен-
мариновом фрагменте. ВЗМО-1, ВЗМО-2, НВМО и
НВМО+1 делокализированы на обоих фрагментах
ных переходов изображены на рис. 2.
PhCH=CH и пиридиновом кольце, ВЗМО-1 и НВМО -
Анализ данных табл. 1 показывает, что интенсив-
в большей степени на фрагменте PhCH=CH, связан-
ной полосе поглощения (432 нм) соответствует рас-
нoм с пиридиновым кольцом, а ВЗМО-2 и НВМО+1 -
считанный переход S0→S2 со значительной силой ос-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
СИНТЕЗ И ПРИРОДА ЭЛЕКТРОННЫХ ПЕРЕХОДОВ КР
АСИТЕЛЯ
541
Таблица 1. Вычисленные характеристики электронных переходов в молекуле 1-{1-[4-(3-ацетилокси-2-оксо-2Н-хро-
мен-4-ил)бензоил]-2-[4-(диметиламино)фенил]этенил}-4-{2-[4-(диметиламино)фенил]этенил}пиридинийбромида
7а
Переход
λ, нм
f
Вклад конфигурации, Tp,i→j
S0→S1
603.5
0.215
|S1>= 0.862|ВЗМО→НВМО>
0.499|ВЗМО-1→НВМО>
S0→S2
496.2
1.023
|S2>= 0.827|ВЗМО-1→НВМО>
-0.499|ВЗМО→НВМО>
S0→S3
441.4
0.004
|S3>= -0.993|ВЗМО-2→НВМО>
S0→S4
428.5
0.349
|S4>= 0.934|ВЗМО→НВМО+1>
S0→S5
410.9
0.093
|S5>= 0.96|ВЗМО-1→НВМО+1>
S0→S6
379.1
0.051
|S6>= 0.697|ВЗМО→НВМО+3>
0.525|ВЗМО-3→НВМО>
0.442|ВЗМО→НВМО+2>
S0→S7
378.5
0.001
|S7>= 0.809|ВЗМО-3→НВМО>
-0.555|ВЗМО→НВМО+3>
S0→S8
373.5
0.183
|S8>= 0.821|ВЗМО→НВМО+2>
-0.419|ВЗМО→НВМО+3>
а λ - длина волны перехода; f - сила осциллятора; Tp,i→j - коэффициент вклада конфигурации.
циллятора f2 = 1.023 с участием ВЗМО-1 → НВМО>
спектральной области еще четыре перехода S0→S3,
(обе орбитали локализованы на фрагменте пиридиния).
S0→S5, S0→S6, и S0→S7, однако из-за малых сил ос-
Электронный переход S0→S1 (рассчитано 603.5 нм)
цилляторов (низких интенсивностей) они в спектре
с меньшей силой осциллятора f5 = 0.215 проявля-
не проявляются как отдельные полосы и находятся
ется в виде плеча (511 нм) в длинноволновой об-
под спектральными кривыми высокоинтенсивных пе-
ласти спектра. Эти два рассчитанные перехода об-
реходов.
разуют одну полосу поглощения с теоретическим
Таким образом, на основе анализа рассчитанных
максимумом около 496.2 нм, которая на 64 нм
и экспериментальных данных можно предположить,
сдвинута в длинноволновую область по сравнению
что наблюдаемый спектр поглощения соответствует
с реальным спектром. В видимой области присут-
изомеру, представленному на рис. 1.
ствуют два менее интенсивных перехода S0→S4 и
Нами выполнены квантово-химические рас-
S0→S8, которые не проявляются в виде отдельных
четы моноцианинового красителя 8, результаты
максимумов, но могут несколько уширять полосу
которых представлены на рис. 3, где приведены
поглощения. Кроме этих сравнительно высокоинтен-
формы граничных и близких к ним орбиталей,
сивных переходов, расчеты предсказывают для этой
участвующих в низших электронных переходах,
Таблица 2. Вычисленные характеристики электронных переходов в молекуле красителя 8а
Перехoд
λ, нм
f
Конфигурация, Tp,i→j
S0→S1
644.91
0.073
|S1>= 0.987|ВЗМО→НВМО>
S0→S2
539.81
0.000
|S2>= -0.998|ВЗМО-1→НВМО>
S0→S3
446.73
0.000
|S3>= 0.996|ВЗМО-2→НВМО>
S0→S4
417.12
0.006
|S4>= 0.992|ВЗМО→НВМО+2>
S0→S5
400.21
0.152
|S5>= 0.599|ВЗМО-3→НВМО>
0.532|ВЗМО→НВМО+1>
-0.494|ВЗМО-4→НВМО>
S0→S6
390.42
0.346
|S6>= 0.758|ВЗМО→НВМО+1>
-0.479|ВЗМО-3→НВМО>
0.334|ВЗМО-4→НВМО>
а λ - длина волны перехода; f - сила осциллятора; Tp,i→j - коэффициент вклада конфигурации; для остальных конфигураций
Тр,i-j < 0.3.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
542
СКРИПСКАЯ и др.
спектр поглощения красителя 8 соответствует изо-
меру, приведенному на рис. 4.
При моделировании геометрии молекулы мо-
ноцианинового красителя
8 установлено, что
фрагменты молекулы находятся в разных пло-
скостях относительно связи С=СН центрального
фрагмента PhCH=CH. Расчеты показали, что для
фрагментов С=СН-С6Н4N(СН3)2-4 (1), пиридин-
С=СН (2), С6Н4С(О)-С=СН (3), кумарин-С6Н4 (4)
величины углов составляют 14.6, 61.5, 39.5, 52.4°
соответственно.
Таким образом, модификация хромофора бис-
Рис 4. Оптимизированная геометрия молекуле кра-
цианинового красителя усложняет схему элек-
сителя 8; увеличенная область возле центрального
тронных переходов, хотя две интенсивные полосы,
фрагмента PhCH=CH.
характерные для классических бисцианиновых
красителей, все же проявляются в спектре и оста-
а также наиболее важные конфигурации для всех
ются чувствительными к изменению химического
электронных переходов.
строения молекулы красителя.
Анализ полученных данных (табл. 2) показыва-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ет, что интенсивной полосе поглощения (436 нм)
ИК спектры записаны на спектрометре Specord
соответствуют два рассчитанных перехода: S0→S6
IR-75 в таблетках KBr. Спектры поглощения сняты
с большей силой осциллятора f6 = 0.346 с основ-
на спектрофотометре СФ-46 в этаноле (с = 2·10-5
ным вкладом ВЗМО→НВМО+1 (обе орбитали
моль/л). Спектры ЯМР 1H записаны на спектроме-
локализованы на фрагменте PhCH=CH) и S0→S5 с
тре Varian Mercury 400 (400 MHz) в ДМСО-d6, вну-
меньшей силой осциллятора f5 = 0.152. Эти два пе-
тренний стандарт - ТМС. Элементный анализ вы-
рехода из-за близости расположения и небольших
полнен на приборе Carlo Erba 1106. Температуры
значений сил осциллятора образуют одну полосу
плавления определены на приборе Boёtius.
поглощения с теоретическим максимумом около
390 нм, которая на 46 нм смещена в коротковолно-
4-Ацетилбензолдиазонийхлорид 2 получали по
вую область по сравнению с реальным спектром.
методике, описанной в работе [12].
Пространственные затруднения в молекуле краси-
4-(4-Ацетилфенил)-3-гидрокси-2Н-хромен-
теля увеличивают энергию основного состояния в
2-он (3). К смеси 6.5 г (40 ммоль) 3-гидрок-
большей степени, чем возбужденного, и краситель
си-2Н-хромен-2-она 1, 0.34 г (2 ммоль) СuС12·2Н2O
поглощает свет меньшей частоты, то есть полоса
и 35 мл ацетона при перемешивании прибавляли
поглощения смещается в длинноволновую область
по каплям охлажденный раствор 4-ацетилбензол-
(батохромный сдвиг).
диазонийхлорида 2, приготовленный диазотирова-
Кроме этих сравнительно высокоинтенсивных
нием 3.8 г (28 ммоль) 4-аминоацетофенона. После
переходов расчеты прогнозируют еще четыре пе-
окончания выделения азота (~2 ч) маслообразный
рехода S0→S1, S0→S2, S0→S3, S0→S4, однако из-за
продукт реакции отделяли, промывали водой, при-
малых сил осцилляторов (низких интенсивностей)
бавляли 20 мл этанола. Образовавшийся осадок
они в спектре не обнаруживаются. Вычислена
отфильтровывали, промывали водой, сушили и
энергия вращения фрагмента 3-ацилокси-2Н-хро-
перекристаллизовывали из смеси этанол-ДМФА.
мен-2-она относительно бензольного ядра, кото-
Выход 5.0 г (45%), т.пл. 234-236°С (возг.). Спектр
рая составляет 50.58 кДж/моль (а в случае бисци-
ЯМР 1H, δ, м. д.: 2.65 c (3H, CH3), 7.05 д (1H, ку-
анинового красителя 7 - 50 кДж/моль). На основе
марин, J = 7.9 Гц), 7.23-7.26 м (1H, кумарин),
анализа рассчитанных и экспериментальных дан-
7.44-7.48 м (2H, кумарин), 7.56 д (2H, С6Н4, J =
ных можно утверждать, что экспериментальный
7.0 Гц), 8.10 д (2H, С6Н4, J = 7.0 Гц), 10.20 с (1H,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
СИНТЕЗ И ПРИРОДА ЭЛЕКТРОННЫХ ПЕРЕХОДОВ КР
АСИТЕЛЯ
543
ОН). Найдено, %: С 72.73; Н 4.25. С17Н12О4.
соли 6 и 0.15 г (1 ммоль) 4-(диметиламино)бен-
Вычислено, %: С 72.85; Н 4.31.
зальдегида в 10 мл уксусного ангидрида кипятили
1 ч. После охлаждения реакционную смесь обра-
4-[4-(2-Бромацетил)фенил]-3-гидрокси-2Н-
батывали эфиром. Выпавший в осадок краситель
хромен-2-он (4). К раствору 1.40 г (5 ммоль) ке-
растирали в гексане до получения твердой фазы.
тона 3 в 40 мл уксусной кислоты при 90-95°С
Очищали осаждением эфиром из изопропилового
прибавляли по каплям 0.25 мл (5 ммоль) брома.
спирта. Выход 0.35 г (92%), т. пл. 237°С (разл.).
Раствор охлаждали, образовавшийся осадок от-
Спектр ЯМР 1Н, δ, м. д.: 2.16 с (3H, COСН3), 3.03
фильтровывали, промывали водой, сушили и пе-
уш. с (12H, NМе2), 6.67 д (2H, С6Н4NMe2, J =
рекристаллизовывали из этанола. Выход 1.26 г
8.7 Гц), 6.71 д (2H, С6Н4NMe2, J = 8.7 Гц), 6.83-
(70%), т. пл. 222-224°С. Спектр ЯМР 1H, δ, м. д.:
6.87 м (2Н, Ar), 7.35 д (1H, кумарин, J = 7.2 Гц),
5.01 с (2H, СН2), 7.04 д (1H, кумарин, J = 7.8 Гц),
7.40 т (1H, кумарин, J = 7.2 Гц), 7.52-7.77 м (8Н,
7.24-7.26 м (1H, кумарин), 7.43-7.47 м (2H, кума-
Ar + 2СН=), 7.88 с (1H, СН=), 8.05 д (2H, С6Н4, J =
рин), 7.59 д (2H, С6Н4, J = 7.2 Гц), 8.16 д (2H, С6Н4,
8.1 Гц), 8.31 д (2H, пиридиний, J = 6.2 Гц), 9.14 д
J = 7.2 Гц), 10.26 с (1H, ОН). Найдено, %: С 56.96;
(2H, пиридиний, J = 6.2 Гц). Найдено, %: С 68.42;
Н 3.20. C17H11BrO4. Вычислено, %: С 56.85; Н 3.08.
Н 5.22; N 5.31. С43Н38ВrN3О5. Вычислено, %: С
Пиридиниевые соли 5, 6. Смесь эквимоляр-
68.25; Н 5.06; N 5.55.
ных количеств (1 ммоль) бромкетона 4 и пиридина
1-{1-[4-(3-Ацетокси-2-оксо-2Н-хромен-4-ил)-
или 4-метилпиридина кипятили в 20 мл безводного
бензоил]-2-[4-(диметиламино)фенил]этенил}-
толуола 0.5-1 ч. Образовавшиеся осадки солей 5,
пиридинийбромид (8). Смесь 0.22 г (0.5 ммоль)
6 отфильтровывали, промывали эфиром и сушили.
соли 5 и 0.075 г (0.5 ммоль) 4-(диметиламино)
1-{2-[4-(3-Гидрокси-2-оксо-2Н-хромен-4-
бензальдегида в 10 мл уксусного ангидрида кипя-
ил)фенил]-2-оксоэтил}пиридинийбромид
(5).
тили на протяжении 1 ч. После охлаждения реак-
Выход 0.32 г (73%), т.пл. 258-260°С (осаждение
ционную смесь обрабатывали эфиром. Выпавший
эфиром из ДМФА). Спектр ЯМР 1Н, δ, м. д.: 6.58
в осадок краситель растирали в гексане до об-
с (2H, СН2), 7.02 д (1H, кумарин, J = 7.4 Гц), 7.27-
разования твердой фазы. Очищали осаждением
7.29 м (1H, кумарин), 7.46-7.50 м (2H, кумарин),
эфиром из изопропилового спирта. Выход 0.25
7.70 д (2H, С6Н4, J = 7.1 Гц), 8.23 д (2H, С6Н4, J =
г (83%), т. пл. 220°С (разл.). Спектр ЯМР 1Н, δ,
6.8 Гц), 8.29-8.33 м (2H, пиридин), 8.77 т (1H, пи-
м. д.: 2.17 с (3H, COСН3), 2.99 с (6H, NМе2), 6.65 д
ридин, J = 7.7 Гц), 9.04 д (2H, пиридин, J = 3.5 Гц),
(2H, С6Н4NMe2, J = 9.0 Гц), 6.70 д (2H, С6Н4NMe2,
10.32 с (1H, ОН). Найдено, %: С 60.42; Н 3.72; N
J = 9.0 Гц), 7.35 д (1H, кумарин, J = 7.9 Гц), 7.42 т
3.36. С22Н16ВrNО4. Вычислено, %: С 60.29; Н 3.68;
(1H, кумарин, J = 7.7 Гц), 7.60-7.64 м (3H, Ar), 7.73
N 3.20.
т (1H, кумарин, J = 7.9 Гц), 7.91 с (1H, СН=), 8.07
1-{2-[4-(3-Гидрокси-2-оксо-2Н-хромен-4-ил)-
д (2H, С6Н4, J = 7.9 Гц), 8.50 т (2H, пиридиний, J =
фенил]-2-оксоэтил}-4-метилпиридинийбромид
7.1 Гц), 8.97 т (1H, пиридиний, J = 7.8 Гц), 9.33 д
(6). Выход 0.35 г (78%), т. пл. 192-194°С (AcОН).
(2H, пиридиний, J = 6.0 Гц). Найдено, %: С 64.95;
Спектр ЯМР 1Н, δ, м. д.: 2.70 c (3H, CH3), 6.51 с
Н 4.52; N 4.41. С33Н27ВrN2О5. Вычислено, %: С
(2H, СН2), 7.03 д (1H, кумарин, J = 7.7 Гц), 7.27-
64.82; Н 4.45; N 4.58.
7.29 м (1H, кумарин), 7.46-7.50 м (2H, кумарин),
КОНФЛИКТ ИНТЕРЕСОВ
7.70 д (2H, С6Н4, J = 7.4 Гц), 8.12 д (2H, пиридин,
J = 5.6 Гц), 8.22 д (2H, С6Н4, J = 7.4 Гц), 8.88 д (2H,
Авторы заявляют об отсутствии конфликта
интересов.
пиридин, J = 5.6 Гц), 10.32 с (1H, ОН). Найдено, %:
С 61.17; Н 4.19; N 3.15. С23Н18ВrNО4. Вычислено,
СПИСОК ЛИТЕРАТУРЫ
%: С 61.08; Н 4.01; N 3.10.
1. Panigrahi M., Dash S., Patel S., Mishra B.K. //
1-{1-[4-(3-Ацетилокси-2-оксо-2Н-хромен-4-
Tetrahedron. 2012. Vol. 68. N 3. P. 781. doi 10.1016/j.
ил)бензоил]-2-[4-(диметиламино)фенил]эте-
tet.2011.10.069
нил}-4-{2-[4-(диметиламино)фенил]этенил}-
2. Shindy H.A. // Dyes Pigm. 2017. Vol. 145. P. 505. doi
пиридинийбромид (7). Смесь 0.23 г (0.5 ммоль)
10.1016/j.dyepig.2017.06.029
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
544
СКРИПСКАЯ и др.
3. Shindy H.A. // Mini-Rev. Org. Chem. 2012. Vol. 9. N 2.
nets P.I., Pridan V.E. // Russ. J. Gen. Chem. 1997.
P. 209. doi 10.2174/157019312800604652
Vol. 67. N 3. P. 427.
4. Киприанов А.И. Цвет и строение цианиновых краси-
15. Ягодинец П.И. // ЖОрХ. 1998. Т. 34. Вып. 1. С. 151;
телей. Киев: Наукова думка, 1979. С. 303-497.
Yagodinets P.I. // Russ. J. Org. Chem. 1998. Vol. 34.
5. Качковский А.Д. Строение и цвет полиметиновых
N 1. P. 137.
красителей. Киев: Наукова думка, 1989. 232 с.
16. Ягодинец П.И. // ЖОХ. 1997. Т. 67. Вып. 9. С. 1576;
6. Мушкало И.Л., Шедов И.Ф. // ХГС. 1974. № 11.
Yagodinets P.I. // Russ. J. Gen. Chem. 1997. Vol. 67.
С. 1489; Mushkalo I.L., Shedov I.F. // Chem. Heterocycl.
N 9. P. 1482.
Compd. 1974. Vol. 10. N 11. P. 1309. doi 10.1007/
17. Ягодинец П.И. // ЖОХ. 1998. Т. 68. Вып. 8. С. 1315;
BF01175085
Yagodinets P.I. // Russ. J. Gen. Chem. 1998. Vol. 68.
7. Киприанов А.И. // Усп. хим. 1971. Т. 40. № 7. С. 1283;
N 8. P. 1252.
Kiprianov A.I. // Russ. Chem. Rev. 1971. Vol. 40. N 7. P.
18. Ягодинець П.І., Качковський О.Д., Скрипська О.В. //
594. doi 10.1070/RC1971v040n07ABEH001942
Ж. орг. фарм. хім. 2005. Т. 3. Вип. 2. С. 55.
8. Чернюк И.Н., Ягодинець П.И., Шевчук М.И. // ЖОХ.
19. Придан В.Е., Чернюк И.Н., Роговик Л.И., Бука-
1982. Т. 52. Вып. 3. С. 716.
чук О.М. // ЖОрХ. 1980. Т. 16. Вып. 9. С. 1973.
9. Ягодинец П.И. // ЖОХ. 1998. Т. 68. Вып. 8. С. 1318;
20. Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
Yagodinets P.I. // Russ. J. Gen. Chem. 1998. Vol. 68.
Robb M.A., Cheeseman J.R., Montgomery, Jr. J.A., Vre-
N 8. P. 1256.
ven T., Kudin K.N., Burant J.C., Millam J.M., Iyen-
10. Киприанов А.И., Мушкало И.Л. // ЖОрХ. 1965. Т. 1.
gar S.S., Tomasi J., Barone V., Mennucci B., Cossi M.,
Вып. 4. С. 744.
Scalmani G., Rega N., Petersson G.A., Nakatsuji H.,
11. Киприанов А.И., Дядюша Г.Г. // Укр. хим. ж. 1969.
Hada M., Ehara M., Toyota K., Fukuda R., Hasegawa J.,
Т. 35. № 6. С. 608.
Ishida M., Nakajima T., Honda Y., Kitao O., Nakai H.,
12. Еленич О.В., Скрипская О.В., Лытвын Р.З., Неща-
Klene M., Li X., Knox J.E., Hratchian H.P., Cross J.B.,
дин А.О.,Обушак М.Д., Качковский А.Д., Ягоди-
Bakken V., Adamo C., Jaramillo J., Gomperts R.,
нец П.И. // ЖОХ. 2014. Т. 84. Вып. 11. С. 1817;
Stratmann R.E., Yazyev O., Austin A.J., Cammi R.,
Yelenich O.V., Skrypska O.V., Lytvyn R.Z., Neshcha-
Pomelli C., Ochterski J.W., Ayala, P.Y., Morokuma K.,
din A.O., Obushak M.D., Kachkovskii A.D., Yagodi-
Voth G.A., Salvador P., Dannenberg J.J., Zakrzew-
nets P.I. // Russ. J. Gen. Chem. 2014. Vol. 84. N 11.
ski V.G., Dapprich S., Daniels A.D., Strain M.C., Far-
P. 2114. doi 10.1134/S1070363214110127
kas O., Malick D.K., Rabuck A.D., Raghavachari K.,
Foresman J.B., Ortiz J.V., Cui Q., Baboul A.G., Clif-
13. Еленич О.В., Лытвын Р.З., Скрипская О.В., Пит-
ковыч Х.Е., Качковский А.Д., Обушак М.Д., Ягоди-
ford S., Cioslowski J., Stefanov B.B., Liu G., Liashenko A.,
нец П.И. // ЖОХ. 2016. Т. 86. Вып. 8. С. 1299;
Piskorz P., Komaromi I., Martin R.L., Fox D.J., Keith T.,
Yelenich O.V., Lytvyn R.Z., Skrypska O.V., Pitko-
Al-Laham M.A., Peng C.Y., Nanayakkara A.,
vych Kh.Ye., Kachkovskii A.D., Obushak M.D.,
Challacombe M., Gill P.M.W., Johnson B., Chen W.,
Yagodinets P.I. // Russ. J. Gen. Chem. 2016. Vol. 86.
Wong M.W., Gonzalez C., Pople J.A. GAUSSIAN 03,
N 8. P. 1838. doi 10.1134/S1070363214110127
Revision B.03, Pittsburgh, Gaussian 2003.
14. Чернюк И.Н., Ягодинец П.И., Придан В.Е. // ЖОХ.
21. Хедвиг П. Прикладная квантовая химия. М.: Мир,
1997. Т. 67. Вып. 3. С. 459; Chernyuk I.N., Yagodi-
1977. 595 с.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
СИНТЕЗ И ПРИРОДА ЭЛЕКТРОННЫХ ПЕРЕХОДОВ КР
АСИТЕЛЯ
545
Synthesis and Nature of Electron Transitions of the Dye Based
on 1-{2-[4-(3-Hydroxy-2-oxo-2H-chromen-4-yl)phenyl]-
2-oxoethyl}-4-methylpyridinium Bromide
O. V. Skrypskaa, R. Z. Lytvynb, О. V. Rusnaka, D. O. Melnykc, Kh. Ye. Pitkovychb,
P. I. Yagodinetsa, and M. D. Obushakb,*
a Yu. Fedkovych Chernivtsi National University, Chernivtsi, 58012 Ukraine
b Ivan Franko National University of Lviv, Lviv, 79005 Ukraine
c Ivano-Frankivsk National Medical University, Ivano-Frankivsk, 76018 Ukraine
*e-mail: mykola.obushak@lnu.edu.ua
Received October 24, 2019; revised October 24, 2019; accepted October 27, 2019
By the reactions of 4-[4-(2-bromoacetyl)phenyl]-3-hydroxy-2H-chromen-2-one with pyridine and 4-meth-
ylpyridine an appropriate quaternary salts was prepared. A new biscyanine dye was obtained by condensation
of 1-{2-[4-(3-hydroxy-2-oxo-2H-chromen-4-yl)phenyl]-2-oxoethyl}-4-methylpyridinium bromide with 4-di-
methylaminobenzaldehyde. The spectrum of this compounds were characterized by two absorption maxima,
which were caused by the interaction of chromophores. Quantum-chemical analysis of the nature of electronic
transitions has been carried out.
Keywords: cyanine dyes, pyridinium salts, coumarin derivatives, arylation, quantum chemical calculations
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020