ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 4, с. 546-550
УДК 547.1
ВЗАИМОДЕЙСТВИЕ 1-ИОДАЦЕТИЛЕНОВ
С МЕТАЛЛИЧЕСКИМ ОЛОВОМ: НОВЫЙ ПОДХОД
К СОЗДАНИЮ СВЯЗИ Sn-Csp
© 2020 г. А. Р. Чикава, А. С. Левашов*, В. В. Коншин
Кубанский государственный университет, ул. Ставропольская 149, Краснодар, 350040 Россия
*e-mail: aslevashov@mail.ru
Поступило в Редакцию 2 октября 2019 г.
После доработки 2 октября 2019 г.
Принято к печати 7 октября 2019 г.
Реакцией 1-иодацетиленов с оловом получены иодалкинилиды олова. Изучены условия протекания
реакции и состав получаемых смесей. Образование иодалкинилидов олова подтверждено встречным
синтезом по реакции диспропорционирования тетра(фенилэтинил)олова с тетраиодидом олова. Полу-
ченные соединения охарактеризованы данными спектроскопии ЯМР 119Sn.
Ключевые слова: иодалкинилиды олова, тетраалкинилиды олова, иодацетилены
DOI: 10.31857/S0044460X20040083
Оловоацетилены находят широкое применение
1а в среде ароматических растворителей при 130-
в органическом синтезе. Они являются исходными
140°С со стружкой металлического олова фракци-
реагентами для получения алкенов [1] и сопряжен-
ей 0.2-0.5 мм привело к ее растворению и окраши-
ных ненасыщенных соединений [2], построения
ванию реакционной смеси. При этом, по данным
карбо- и гетероциклов [3, 4], в том числе биологи-
ЯМР 119Sn, образуется смесь тетра(фенилэтинил)-
чески активных веществ [5]. Реакция Стилле с уча-
олова 2а, иодалкинилидов олова различной степени
стием алкинилидов олова стала надежным инстру-
замещения 3а-5а и тетраиодида олова 6 (схема 1).
ментом для построения соединений с высокой мо-
Состав смеси продуктов зависит от используемого
лекулярной сложностью [6], самоорганизующихся
растворителя, что может быть объяснено различ-
ацетиленовых структур [7]. Оловоацетилены, со-
ной растворимостью SnI4, влияющей на равно-
держащие четыре ацетиленовых фрагмента могут
весие между образующимися иодалкинилидами
использоваться как атом-экономные реагенты при
олова.
синтезе арилацетиленов [8] и ацетиленовых кето-
В то же время реакция протекает очень мед-
нов [9-11]. Таким образом, широкое применение
ленно и для ее завершения требуется около 150 ч.
оловоацетиленов обуславливает поиск новых пу-
Увеличения скорости протекания реакции удалось
тей их синтеза, что находит отражение в ряде не-
добиться при применении сплава олова, содержа-
давних публикаций [12-14].
щего 1.5% цинка, что позволило сократить время
Несмотря на большое количество исследова-
реакции до 8 ч. Более активно реакция протекает
ний, посвященных прямому синтезу оловооргани-
с коммерчески доступным мелкодисперсным по-
ческих соединений [15-19], к настоящему време-
рошком олова (размер частиц 10 мкм), позволяя
ни отсутствовали сведения о возможности созда-
снизить температуру взаимодействия до 100°С.
ния связи Sn-Csp таким методом.
Нами проведено изучение влияния растворителя
Мы предположили, что 1-иодацетилены могут
на время протекания реакции и состав смсесей
быть активны в реакции с металлическим оловом.
образующихся продуктов (табл. 1). За ходом реак-
Действительно, нагревание (иодэтинил)бензола
ции следили методом ГХ/МС по расходу (иодэти-
546
ВЗАИМОДЕЙСТВИЕ 1-ИОДАЦЕТИЛЕНОВ С МЕТАЛЛИЧЕСКИМ ОЛОВОМ
547
Схема 1.
нил)бензола 1а, используя в качестве внутреннего
нил)-4-хлорбензол 1б полностью реагирует с ме-
стандарта гексадекан. Наиболее быстро реакция
таллическим оловом в 1,4-диоксане при 100°С за
протекает в полярных растворителях, таких как
4 ч. При этом соотношение продуктов реакции со-
1,4-диоксан и 1,2-диметоксиэтан, при этом увели-
ставляет 2б:3б:4б:5б:6 = 5:35:33:23:4. Более реак-
чение концентрации реагирующих веществ с 25
ционноспособным оказался 1-(иодэтинил)-4-ме-
до 40% приводит к незначительному увеличению
тилбензол 1в, полностью расходующийся за 2 ч.
скорости реакции. Во всех случаях наблюдается
При этом соотношение продуктов реакции состав-
индукционный период, после которого основное
ляет 2в:3в:4в:5в:6 = 3:22:38:33:4. Данные по хи-
взаимодействие протекает примерно в течение 1 ч.
мическим сдвигам 119Sn соединений 2-5, 6 в раз-
Наиболее существенное изменение состава обра-
личных растворителях приведены в табл. 2.
зующихся продуктов зафиксировано при исполь-
Проведение встречного синтеза иодалкини-
зовании толуола, что обусловлено малой раство-
лидов олова реакцией диспропорционирования
римостью в нем SnI4. Это способствует смещению
тетра(фенилэтинил)олова 2a с тетраиодидом оло-
равновесия между соединениями 2а-5а и при-
ва 6 в среде 1,4-диоксана показало, что образует-
водит к отсутствию сигнала SnI4 в спектре ЯМР
ся смесь с преобладанием некоторых продуктов
119Sn.
Схема 2.
Аналогичная картина наблюдается и при вза-
имодействии 1-иодацетиленов, содержащих за-
местители в бензольном кольце. Так, 1-(иодэти-
Таблица 1. Влияние различных условий на время реакции соединения 1а с металлическим оловом и состав образу-
ющейся смеси
Время
Содержание, %
№
Растворитель
t, °С
реакции, ча
2а
3а
4а
5а
6
1
1,4-Диоксан
100
3
3
34
35
23
6
2
1,4-Диоксанб
100
2.5
3
32
35
23
7
3
Толуол
100
>20
-
-
-
-
-
4
Толуол
120
6
21
39
28
12
0
5
1,2-Дихлорэтан
100
5
6
23
33
30
8
6
1,2-Диметоксиэтан
100
3
4
29
33
28
6
7
1,2-Диметоксиэтанб
100
2
5
28
31
29
7
а Указано время реакции до полного расходования соединения 1а. б Концентрация реагирующих веществ увеличена с 25 до 40%.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
548
ЧИКАВА и др.
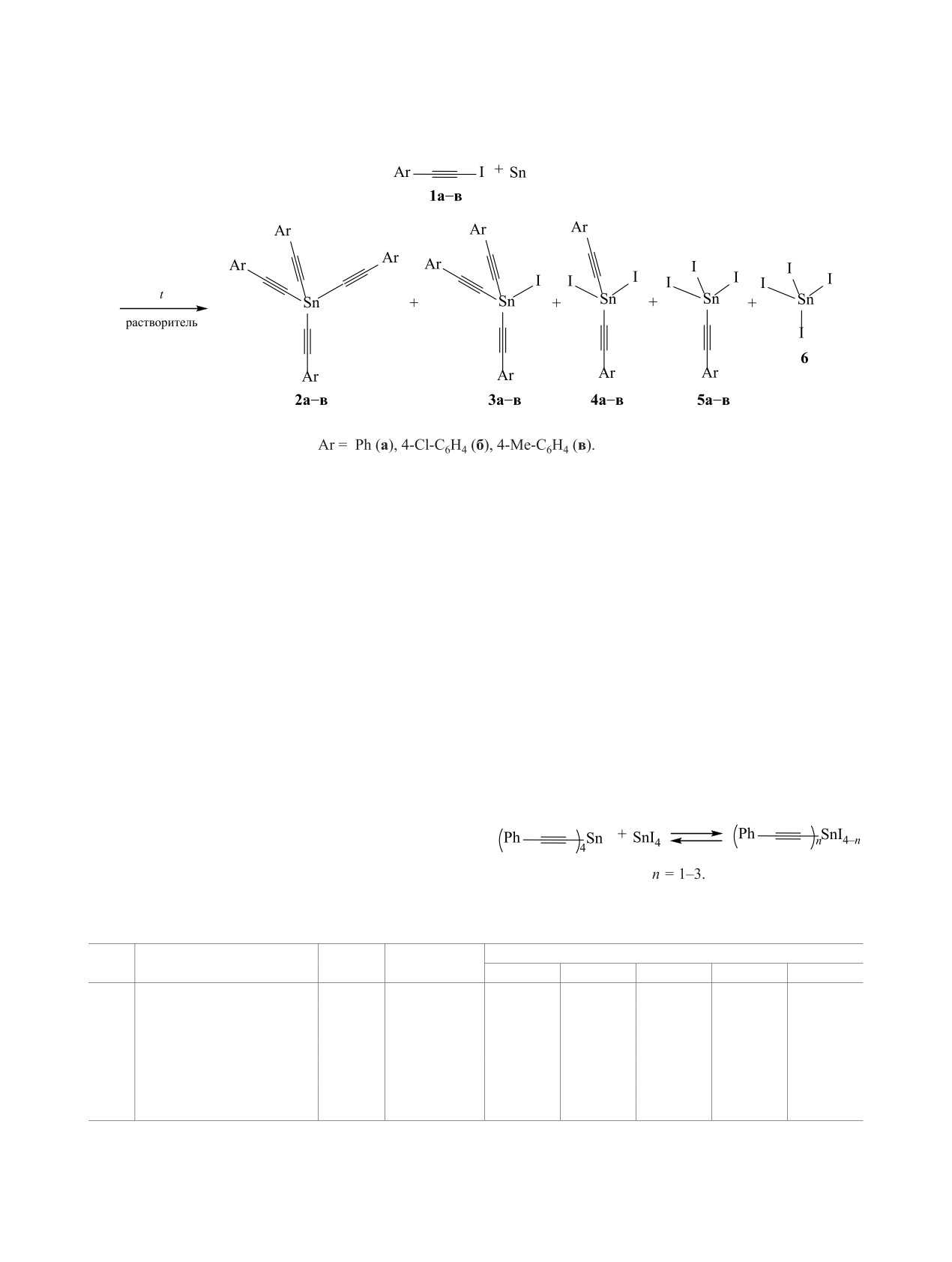
įSn ɦ ɞ
Спектры ЯМР 119Sn реакционной смеси тетра(фенилэтинил)олова с тетраиодидом олова в 1,4-диоксане при соотношении
реагентов 3:1 (1), 1:1 (2), 1:3 (3).
в зависимости от соотношения реагентов (см.
Таким образом, нами показана возможность по-
рисунок).
лучения иодалкинилидов олова как прямым синте-
зом, так и реакцией диспропорционирования.
Реакция протекает аналогично диспропорци-
онированию тетраалкинилидов олова с тетрахло-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ридом олова [20]. Следует отметить, что сум-
В работе использовали порошок металлическо-
марная константа экранирования заместителей
го олова производства Aldrich с размером частиц
(ArC≡C)nSnI4-n экспоненциально зависит от числа
10 мкм тетра(фенилэтинил)олово, полученное по
n. Таким образом, в шкале Ln(δ)-n наблюдается ли-
методике [14]. (Иодэтинил)бензол 1а, 1-(иодэти-
нейная зависимость, что позволяет прогнозировать
нил)-4-хлорбензол 1б, 1-(иодэтинил)-4-метилбен-
химические сдвиги ядер 119Sn для подобного типа
зол 1в получали аналогично методике, описанной
оловоорганических соединений. Аналогичная за-
в работе [21].
висимость наблюдается и в данных, приведенных
Спектры ЯМР 119Sn регистрировали на при-
для (RC≡C)nSnCl4-n при n = 1-4 [20].
боре JEOL ECA400. Контроль за ходом реакций
Таблица 2. Химические сдвиги 119Sn (ArC≡C)nSnI4-n в различных растворителях
δSn, м. д.
№
Реагент
Растворитель
n = 4
n = 3
n = 2
n = 1
n = 0
1
1a
1,4-Диоксан
-351.2
-502.9
-792.6
-1225.0
-1777.5
2
1a
1,2-Диметоксиэтан
-337.6
-489.3
-767.5
-1204.3
-1789.8
3
1a
1,2-Дихлорэтан
-335.3
-473.2
-739.9
-1169.4
-1744.6
4
1a
Толуол
-332.0
-472.9
-743.5
-1177.5
-
5
1б
1,4-Диоксан
-355.3
-508.8
-797.7
-1225.3
-1777.5
6
1в
1,4-Диоксан
-352.4
-503.9
-793.1
-1225.2
-1777.3
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
ВЗАИМОДЕЙСТВИЕ 1-ИОДАЦЕТИЛЕНОВ С МЕТАЛЛИЧЕСКИМ ОЛОВОМ
549
осуществляли хромато-масс-спектрометрически
Диспропорционирование тетра(фенилэти-
с использованием прибора Shimadzu GC-2010 c
нил)олова 2a с тетраиодидом олова 6. К смеси
масс-селективным детектором Shimadzu QP-2010:
тетра(фенилэтинил)олова 2a и тетраиодида олова
колонка Supelko 28064U, 30 м, программируемый
6, взятых в мольных соотношениях 3:1, 1:1 и 1:3,
нагрев от 60 до 260°С со скоростью 30 град/мин.
добавляли 1 мл 1,4-диоксана. Полученную смесь
нагревали при 100°С при перемешивании в тече-
1-(Иодэтинил)-4-хлорбензол
(1б).
Смесь
ние 3 ч. Состав реакционной смеси анализировали
310 мг (2.3 ммоль) 4-хлорфенилацетилена, 7 мл
методом ЯМР 119Sn.
безводного ацетона,
570 мг
(2,53 ммоль)
N-иодсукцинимида и 34 мг (0.2 ммоль) нитрата
ФОНДОВАЯ ПОДДЕРЖКА
серебра перемешивали при комнатной темпера-
Работа выполнена при финансовой поддержке
туре 2 ч. К реакционной смеси добавляли 20 мл
Российского фонда фундаментальных исследова-
гексана и 15 мл воды. Органический слой отделя-
ний (грант № р_а 19-43-230009) и Администрации
ли, водный слой экстрагировали смесью диэтило-
Краснодарского края с использованием оборудова-
вый эфир-гексан (1:1) (2×10 мл). Объединенные
ния Научно-образовательного центра «Диагностика
органические слои сушили сульфатом магния,
структуры и свойств наноматериалов».
затем упаривали. Остаток хроматографировали
(элюент - гексан-этилацетат, 90:10, с добавлени-
КОНФЛИКТ ИНТЕРЕСОВ
ем 1% триэтиламина). Выход 555 мг (92%), свет-
Авторы заявляют об отсутствии конфликта ин-
ло-желтые кристаллы. Масс-спектр (ЭУ, 70 эВ),
тересов.
m/z (Iотн, %): 264 (17) [M]+, 262 (100), 135 (23), 100
СПИСОК ЛИТЕРАТУРЫ
(16), 99 (84), 98 (12), 74 (77), 50 (18).
1. Piers E., Walker S.D., Armbrust R. // J. Chem. Soc.
Спектральные данные соответствуют опубли-
Perkin Trans. 1. 2000. N 5. P. 635. doi 10.1039/
кованным в работе [22].
A909922K
1-(Иодэтинил)-4-метилбензол
(1в) получа-
2. Shirakawa E., Yoshida H., Kurahashi T., Nakao Y.,
ли аналогично из 0.32 мл (2.5 ммоль) 4-метилфе-
Hiyama T. // J. Am. Chem. Soc. 1998. Vol. 120. N 12.
нилацетилена, 7 мл безводного ацетона, 620 мг
P. 2975. doi 10.1021/ja974206k
(2.75 ммоль) N-иодсукцинимида и
34 мг
3. Jousseaume B.,Villeneuve P. // Tetrahedron. 1989.
Vol. 45. N 4. P. 1145. doi 10.1016/0040-4020(89)80023-7
(0.2 ммоль) нитрата серебра. Выход 546 мг (90%),
4. Kondo Y., Uchiyama D., Sakamoto T., Yamanaka H. //
желтая жидкость. Масс-спектр (ЭУ, 70 эВ), m/z
Tetrahedron Lett. 1989. Vol. 30. N 32. P. 4249. doi
(Iотн, %): 242 (83) [M]+, 115 (100), 114 (17), 89 (23),
10.1016/s0040-4039(01)80702-4
74 (10), 65 (11), 63 (21), 62 (12).
5. Genady A.R., Janzen N., Banevicius L., El-Gamal M.,
Спектральные данные соответствуют опубли-
El-Zaria M.E., Valliant J.F. // J. Med. Chem. 2016.
кованным в работе [22].
Vol.
59. N
6. P.
2660. doi
10.1021/acs.
jmedchem.5b01881
Взаимодействие (иодэтинил)бензола
1а с
6. Cordovilla C., Bartolome C., Mart M., Espinet P. //
оловом. Смесь 55 мг (0.463 ммоль) металлическо-
ACS Catal. 2015. Vol 5. N 5. P. 3040. doi 10.1021/
го олова, 191.5 мг (0.84 ммоль) (иодэтинил)бен-
acscatal.5b00448
зола, 600 мкл абсолютированного растворителя
7. Kato S.I., Kano H., Irisawa K.I., Yoshikawa N.,
(300 мкл при увеличении концентрации реагиру-
Yamamoto R., Kitamura C., Nara D., Yamanobe T.,
ющих веществ) и 5 мкл гексадекана в качестве
Uehara H., Nakamura Y. // Org. Lett. 2018. Vol. 20.
внутреннего стандарта нагревали при перемеши-
N 23. P. 7530. doi 10.1021/acs.orglett.8b03290
вании, отбирая пробы через 20, 40, 60, 90, 120 мин
8. Levashov A.S., Buryi D.S., Goncharova O.V., Kon-
shin V.V., Dotsenko V.V., Andreev A.A. // New J. Chem.
и далее через каждый час до полного расходования
2017. Vol. 41. P. 2910. doi 10.1039/C6NJ03905G
2-иод-1-фенилацетилена.
9. Левашов А.С., Бурый Д.С., Коншин В.В., Доцен-
Взаимодействие
1-(иодэтинил)-4-хлорбензола
ко В.В., Аксенов Н.А., Аксенова И.В. // ЖOX. 2017.
1б и 1-(иодэтинил)-4-метилбензола 1в с оловом
Т. 87. № 7. С. 1200; Levashov A.S., Buryi D.S., Kon-
проводили аналогично.
shin V.V., Dotsenko V.V., Aksenov N.A., Aksenova I.V. //
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
550
ЧИКАВА и др.
Russ. J. Gen. Chem. 2017. Vol. 87. N 7. P. 1627. doi
10.1016/j.jorganchem.2004.03.027
10.1134/S1070363217070295
16. Shaikh N.S., Parkin S., Lehmler H., About M., Article T. //
10. Levashov A.S., Aksenov N.A., Aksenova I.V., Kon-
Organometallics. 2006. Vol. 25. N 17. P.4207. doi
shin V.V. // New J. Chem. 2017. Vol. 41. P. 8297. doi
10.1002/chin.200651178
10.1039/C7NJ01376K
17. Nicholson J.W., Douek J.A. // J. Organometal. Chem.
11. Levashov A.S., Buryi D.S. // Tetrahedron Lett. 2017.
1982. Vol. 233. N 2. P. 169. doi 10.1016/S0022-
Vol. 58. N 47. P. 4476. doi 10.1016/j.tetlet.2017.10.035
328X(00)82696-0
12. Kai Y., Oku S., Tani T., Sakurai K., Tsuchimoto T. // Adv.
18. Klabunde K.J., Murdock T.O. // J. Org. Chem. 1979.
Synth. Catal. 2019. doi 10.1002/adsc.201900540
Vol. 44. N 22. P. 3901. doi 10.1021/jo01336a030
13. Левашов А.С., Андреев А.А., Бурый Д.С., Кон-
19. Zakharkin L.I., Okhlobystin O.Y. // Russ. Chem. Bull.
шин В.В. // Изв. АН. Сер. хим. 2014. № 3. С. 775;
1963. Vol. 12. N 12. P. 2027. doi 10.1007/bf00844003
Levashov A.S., Andreev A.A., Buryi D.S., Konshin V.V. //
20. Wrackmeyer B., Kehr G. // Main. Group Met. Chem.
Russ. Chem. Bull. 2014. Vol. 63. P. 775. doi 10.1007/
1993. Vol. 16. N 5. P. 305.
s11172-014-0508-8
21. Gallagher W.P., Terstiege I., Maleczka R.E. // J. Am.
14. Levashov A.S., Andreev A.A., Konshin V.V. // Tetrahedron
Lett. 2015. Vol. 56. N 14. P. 1870. doi 10.1016/j.
Chem. Soc. 2001. Vol. 123. N 14. P. 3194. doi 10.1021/
tetlet.2015.02.095
ja0035295
15. Thoonen S.H.L., Deelman B.J., Koten G. van // J.
22. Liu X., Chen G., Li C., Liu P. // Synlett. 2018. Vol. 29.
Organometal. Chem. 2004. Vol. 689. N 13. P. 2145. doi
N 15. P. 2051. doi 10.1055/s-0037-1610259
Reaction of 1-Iodoalkynes with Metal Tin: A New Approach
to the Sn-Csp Bond Formation
A. R. Chikava, A. S. Levashov*, and V. V. Konshin
Kuban State University, ul. Stavropolskaya 149, Krasnodar, 350040 Russia
*e-mail: aslevashov@mail.ru
Received October 2, 2019; revised October 2, 2019; accepted October 7, 2019
Tin iodoalkynilides were prepared by reaction of 1-iodoacetylenes with tin metal. The scope of reaction and
the composition of resulting mixtures were studied. The formation of tin iodoalkynylides was confirmed by
counter synthesis by the disproportionation reaction of tetra(phenylethinyl)tin with tin tetraiodide. The prepared
compounds were characterized by means of 119Sn NMR spectroscopy.
Keywords: tin iodoalkynylides, tin tetraalkynylides, iodoacetylenes
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020