ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 4, с. 570-580
УДК 541.49:546.562:546.723:546.742:548.736:547.574
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ
АКТИВНОСТЬ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ
МЕДИ, НИКЕЛЯ, КОБАЛЬТА И ЖЕЛЕЗА С
ЭТИЛ-N'-(2-ГИДРОКСИБЕНЗИЛИДЕН)-N-(ПРОП-
2-ЕН-1-ИЛ)КАРБАМОГИДРАЗОНОТИОАТОМ
© 2020 г. А. П. Гуляa, И. С. Усатаяa, В. О. Граурa,*, Ю. М. Чумаковb,c, П. А. Петренкоb,
Г. Г. Бэланd, О. С. Бурдунюкd,e, В. И. Цапковa, В. Ф. Рудикf
a Молдавский государственный университет, ул. Матеевича 60, Кишинев, 2009 Республика Молдова
b Институт прикладной физики, Кишинев, 2001 Республика Молдова
c Технический университет г. Гебзе, Гебзе, 41400 Турция
d Государственный университет медицины и фармации имени Н. Тестемицану, Кишинев, 2001 Республика Молдова
e Национальное агентство общественного здоровья, Кишинев, 2028 Республика Молдова
fИнститут микробиологии и биотехнологии Академии наук Республики Молдова,
Кишинев, 2028 Республика Молдова
*e-mail: vgraur@gmail.com
Поступило в Редакцию 26 сентября 2019 г.
После доработки 26 сентября 2019 г.
Принято к печати 3 октября 2019 г.
Взаимодействием N-(проп-2-ен-1-ил)гидразинкарботиоамида с иодэтаном и 2-гидроксибензальде-
гидом образуется гидроиодид этил-N'-(2-гидроксибензилиден)-N-(проп-2-ен-1-ил)карбамогидразо-
нотиоата (HL·HI). При взаимодействии лиганда HL или гидроиодида HL·HI c солями меди, никеля,
кобальта и железа получены координационные соединения Cu(L)Х·nH2O [X = Cl-, Br-, NO3-; n = 0, 1],
Ni(L)2·HI·CH3OH, Сo(L)2X [X = I-, NO3-] и Fe(L)2NO3. Строение комплексов установлено методом РСА.
В интервале концентраций 30-500 мкг/мл комплексы проявляют селективную противомикробную и
противогрибковую активность в отношении серии стандартных микроорганизмов и грибов. Комплексы
никеля и железа селективно ингибируют рост и размножение раковых клеток, практически не оказывая
негативного влияния на пролиферацию нормальных клеток.
Ключевые слова: координационные соединения, карбамогидразонотиоаты, противомикробная актив-
ность, противораковая активность
DOI: 10.31857/S0044460X20040125
Производные тиосемикарбазидов могут ис-
Нами получены координационные соединения
пользоваться для синтеза лекарственных препа-
меди, никеля, кобальта и железа с этил-N'-(2-ги-
ратов [1-4]. Карбамогидразонотиоаты проявляют
дроксибензилиден)-N-(проп-2-ен-1-ил)карбамо-
различные способы координации к ионам метал-
гидразонотиоатом (HL), установлены их состав,
лов и обладают противомикробной, противогриб-
строение, исследованы физико-химические и био-
ковой, противораковой и другими видами биоло-
логические свойства.
гической активности [5-12]. В связи с этим пред-
Этил-N'-(2-гидроксибензилиден)-N-(проп-2-ен-
ставляются перспективными синтез и изучение
1-ил)карбамогидразонотиоат получен взаимодей-
свойств карбамогидразонотиоатов и их координа-
ствием N-(проп-2-ен-1-ил)гидразинкарботиоами-
ционных соединений.
да с иодэтаном в метаноле с последующим введе-
570
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ
571
Схема 1.
OH
OH
S
S
N
N
N
N
N
N
H
H
Ⱥ
Ȼ
нием в реакционную смесь 2-гидроксибензальде-
мы в диэтиловом эфире, мало растворимы в воде,
гида в молярном соотношении 1:1.
лучше - в спиртах, хорошо растворимы в ДМФА,
Методом спектроскопии ЯМР установлено
ДМСО.
строение соединения HL. Все сигналы в спек-
При перекристаллизации комплексов 3, 7 из
тре удвоены [13]. Это указывает на присутствие
этанола и комплекса 4 из метанола получены мо-
таутомерных форм А и Б карбамогидразонотио-
нокристаллы, структура которых была установле-
ата в растворе. Соотношение интегральных ин-
на методом рентгеноструктурного анализа (табл. 2,
тенсивностей сигналов форм А и Б равно 1:0.4.
рис. 1-3). В кристаллической структуре коорди-
Присутствие таутомерных форм может быть вызва-
национного соединения 4 во внешней сфере нахо-
но син/анти-изомерией двойной связи C=N1 и цис/
дятся иодид-ион и молекула метанола, а во внеш-
транс-изомерией двойной связи C=N4 (схема 1)
ней сфере комплекса 7 - нитрат-ион. В каждом
[5, 14].
комплексе атом металла координирует карбамоги-
При взаимодействии горячих (50-55°С) эта-
дразонотиоат HL с образованием 5- и 6-членных
нольных растворов солей меди, кобальта и же-
металлоциклов. В комплексах 3, 4 и 7 пяти- и ше-
леза с карбамогидразонотиоатом HL в мольном
стичленные хелатные циклы лежат практически в
соотношении 1:1 с солями меди и 1:2 с солями
одной плоскости, двугранные углы между ними
кобальта и железа получены мелкокристалли-
не превышают 8.5°, а углы между плоскостями
ческие соединения 1-3, 6, 7, для которых на ос-
шестичленных металлоциклов и бензольных ко-
новании данных элементного анализа (табл. 1)
лец салицилиденовых фрагментов не превышают
предложен состав Cu(L)Х·nH2O (1-3) [X = Cl-
5.8°. В координационном соединении величина 3
(1), Br- (2), NO3- (3); n = 0-1], Me(L)2NO3 [Me =
двугранного угла между пятичленным металлоци-
Co3+ (6), Fe3+ (7)]. Координационные соединения
клом и фрагментом S1C5C6 2.9°, а двугранного угла
4, 5 получены при взаимодействии HL·HI с аце-
между шестичленным металлоциклом и фрагмен-
татами никеля и кобальта в метанольном раство-
ре в мольном соотношении 2:1. Согласно данным
том С2C3C4 - 70.86°, тогда как для комплексов 4
элементного анализа, их состав соответствует
и 7 аналогичные углы в молекулах обоих лиган-
формулам Ni(L)2·HI·CH3OH (4) и Co(L)2I
(5).
дов составляют 23.5 (88.26), 80.08 (85.91) и 77.78
Координационные соединения 1-7 нераствори-
(87.29), 65.4 (68.07)° соответственно.
Таблица 1. Физико-химические характеристики координационных соединений 1-7
a
Выход,
μэф,a
æ,
Найдено, %
Вычислено, %
Комплекс
Формула
%
М. Б.
Ом-1· см2·моль-1
Mб
N
S
Mб
N
S
1
82
1.75
103
17.45
11.47
8.81
C13H16ClCuN3OS
17.59
11.63
8.87
2
79
1.78
108
15.61
10.27
7.79
C13H16BrCuN3OS
15.66
10.35
7.90
3
81
1.83
112
15.58
13.71
7.81
C13H18CuN4O5S
15.65
13.80
7.90
4
76
2.85
85
7.78
11.17
8.45
C27H37IN6NiO3S2
7.90
11.31
8.63
в
5
84
90
8.20
11.72
8.96
C26H32CoIN6O2S2
8.29
11.83
9.03
в
6
86
86
9.02
15.11
9.79
C26H32CoN7O5S2
9.13
15.19
9.93
7
75
5.93
105
8.59
15.19
9.87
C26H32FeN7O5S2
8.69
15.26
9.98
а При 294 K. б М - металл. в Диамагнитен.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
572
ГУЛЯ и др.
Таблица 2. Кристаллографические характеристики, данные эксперимента и уточнение структуры соединений 3, 4, 7
Значение
Параметр
3
4
7
Химическая формула
C13H18CuN4O5S
C26.89H32IN6NiO2.89S2
C26H32FeN7O5S2
М
405.91
735.30
642.56
Сингония
Триклинная
Моноклинная
Моноклинная
Пространственная группа
P-1
C2/c
P21/c
Z
2
8
4
a , Å
7.4464(9)
18.3136(8)
8.2137(8)
b, Å
9.9324(7)
18.9679(10)
16.1962(7)
c, Å
12.1455(9)
20.1004(8)
22.5614(11)
α, град
92.397(6)
90
90
β, град
101.133(8)
99.982(5)
94.714(5)
γ, град
105.318(8)
90
90
V, Å 3
845.98(13)
6876.6(6)
2991.2(3)
dвыч, г/см3
1.594
1.420
1.427
λ, Å
0.71073
0.71073
0.71073
μ, см-1
1.445
1.618
0.692
Т, K
293(2)
293(2)
293(2)
Размеры образца, мм
0.40×0.22×0.04
0.50×0.35×0.20
0.36×0.181×0.003
Пределы h, k, l
-8≤ h ≤ 8
-22 ≤ h ≤ 22
-6 ≤ h ≤ 9
-8 ≤ k ≤ 11
-22 ≤ k ≤ 17
-19 ≤ k ≤ 12
-14 ≤ l ≤ 13
-24 ≤ l ≤ 14
-26 ≤ l ≤ 19
Число отражений измеренных/независимых
4510
11301
10057
[R(int) = 0.0217]/2974
[R(int) = 0.0238]/6321
[R(int) = 0.0829]/5233
Число параметров
226
390
378
R1/wR2 по N1
0.0542/0.0989
0.0828/0.1460
0.1993/0.1167
R1/wR2 по N2
0.0413/0.0916
0.0510/0.1286
0.0780/0.0889
S
1.034
0.986
0.897
Δr
0.687/-0.381
0.525/-0.277
0.391/-0.495
Координационные связи атома меди в комплек-
ми O1W-H∙∙∙O1, C5-H∙∙∙O1N (табл. 4, рис. 4). В сло-
се 3 образуют тетрагональную пирамиду. В осно-
ях наблюдается π-π-стекинг-взаимодействие меж-
вании пирамиды находятся атомы O1, N1, N3 орга-
ду 5- и 6-членными металлоциклами. Расстояние
нического лиганда и атом кислорода O1W молеку-
между центроидами соответствующих циклов
лы воды (табл. 3). Смещения указанных донорных
равно 3.861 Å, угол β = 26.1°.
атомов от средней плоскости основания пирамиды
Координационные многогранники атомов нике-
равны -0.019, -0.02, 0.021 и 0.018 Å соответствен-
ля и железа в комплексах 4 и 7 представляют собой
но. Отклонение атома меди от основания пирами-
искаженные октаэдры (рис. 2, 3). Октаэдрические
ды составляет 0.116 Å в сторону атома кислорода
объемы указанных атомов равны 11.435 и 10.918 Å3
O1N нитратной группы, занимающего аксиальную
соответственно. В кристалле комплекса 4 между
позицию с расстоянием Cu1-O1N 2.457(3) Å. В
молекулами осуществляется лишь ван-дер-вааль-
кристалле комплекса 3 нитратные группы объе-
сово взаимодействие (рис. 5), тогда как в кристал-
диняют комплексы в центросимметричные диме-
лической структуре комплекса 7 нитратные груп-
ры посредством водородных связей N2-H∙∙∙O1N,
пы за счет водородных связей объединяют молеку-
C5-H∙∙∙O2N и C7-H∙∙∙O3N. Димеры связаны между
лы в цепи вдоль оси с. Такие цепи связаны между
собой водородными связями O1W-H∙∙∙O3N в цепи,
собой водородными связями C5A-H∙∙∙O1N (табл. 4,
образующие слои, параллельные плоскости (001),
рис. 6). В комплексе 7 возникает π-π-стекинг-вза-
внутри которых они связаны водородными связя-
имодействие между бензольными кольцами, на-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ
573
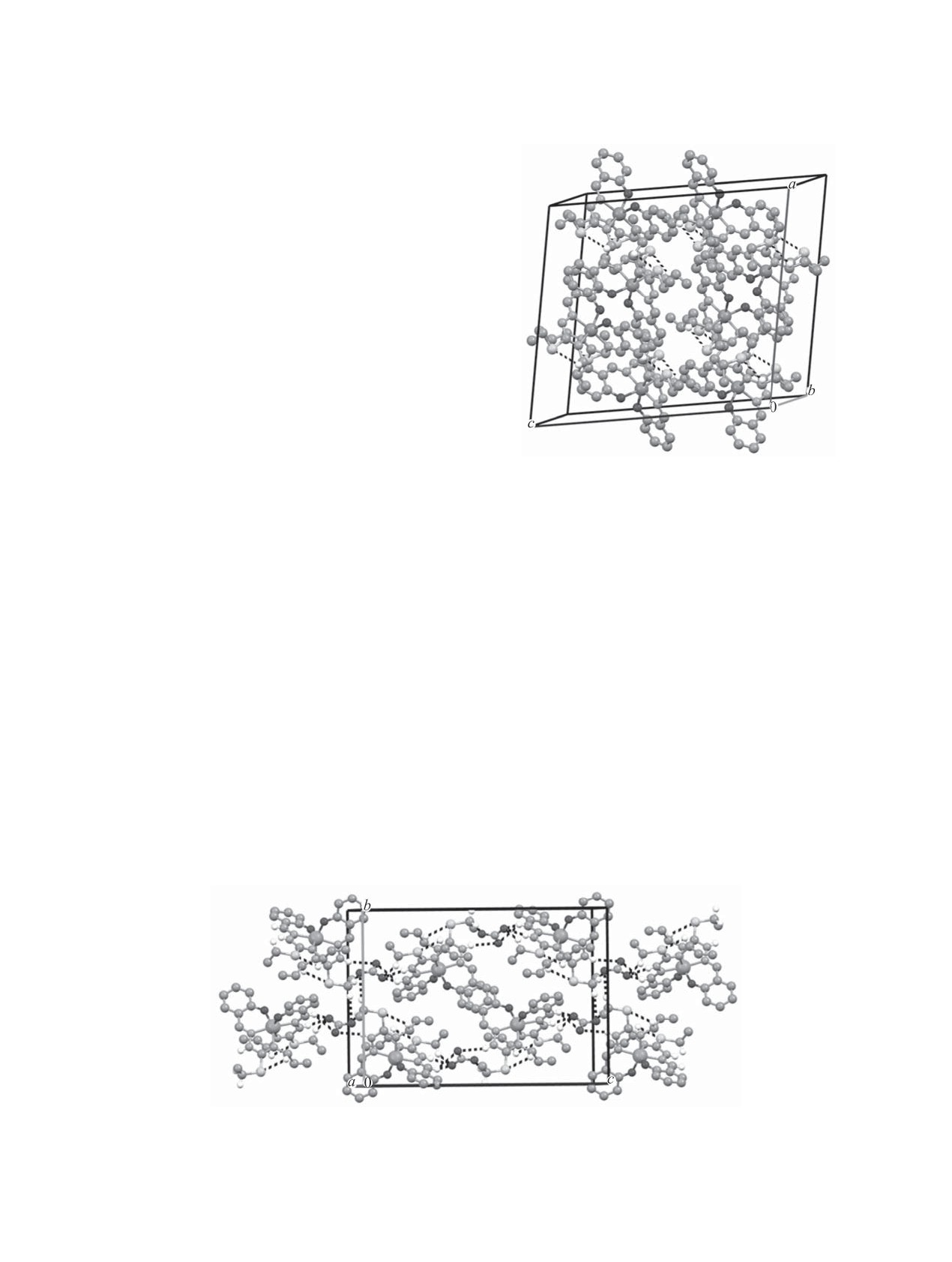
Рис. 2. Общий вид молекулы комплекса 4 в кристалле
Рис. 1. Общий вид молекулы комплекса 3 в кристалле.
(атомы водородов опущены).
ходящимися в разных цепях. Расстояние между
Полученные данные указывают на среднюю силу
центроидами соответствующих циклов составляет
поля лиганда.
3.777 Å, угол β = 27.4°. В комплексах 3, 4 и 7 об-
С целью определения способа координации
разуются внутримолекулярные водородные связи
карбамогидразонотиоата HL к центральным ато-
C-H∙∙∙S.
мам металлов проведен сравнительный анализ ИК
Для установления состава и строения осталь-
спектров комплексов 1-7 и лиганда. B ИК спек-
ных комплексов были использованы методы эле-
трах присутствуют полосы поглощения в областях
ментного анализа, молярной электропроводности,
3400-3100, 1660-1580, 700-600 см-1, которые ха-
магнетохимии и ИК спектроскопии. На основании
рактеризуют валентные колебания координиро-
данных, полученных при определении молярной
ванных молекул карбамогидразонотиоата HL. В
электропроводности (æ) в метаноле, установлено,
области 3400-3100 см-1 ИК спектров всех ком-
что комплексы 1-7 - бинарные электролиты (æ =
плексов исчезает полоса поглощения ν(O-Hфенол),
85-112 Ом-1·см2·моль-1).
что указывает на депротонирование фенольной
Магнетохимическое исследование комплексов
ОН-группы в молекулах лиганда. Такой же вы-
1-7 при комнатной температуре (294 K) показало
(табл. 1), что кобальтовые комплексы 5 и 6 диамаг-
нитны. Это указывает на степень окисления ато-
мов кобальта +3 в псевдооктаэдрическом лиганд-
ном окружении. Для соединений меди величины
эффективных магнитных моментов соответствуют
одному неспаренному электрону. Эти эксперимен-
тальные данные дают основание предположить
для них мономерное строение. Комплекс нике-
ля обладает октаэдричеким строением с эффек-
тивным магнитным моментом μэф = 2.85 М. Б.,
характерным для двух неспаренных электронов.
Комплекс железа парамагнитен, его значение μэф =
5.93 М. Б. соответствует высокоспиновому состоя-
нию атома металла, в то время как атом кобальта в
Рис. 3. Общий вид молекулы комплекса 7 в кристалле
(атомы водородов опущены).
комплексе находится в низкоспиновом состоянии.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
574
ГУЛЯ и др.
Таблица 3. Некоторые межатомные расстояния и валентные углы в молекулах комплексов 3, 4, 7
d, Å
Связь
3
4
7
Cu1[Ni1]{Fe1}-O1
1.893(3)
2.083(2)
1.923(4)
Ni1{Fe1}-O1A
2.090(2)
1.905(4)
Cu1[Ni1]{Fe1}-N1
1.959(3)
2.076(3)
2.109(5)
Ni1{Fe1}-N1A
2.082(3)
2.119(4)
Cu1[Ni1]{Fe1}-N3
1.941(3)
2.025(3)
2.120(4)
Ni1{Fe1}-N3A
2.018(3)
2.116(4)
Cu1-O1N
2.457(3)
Cu1-O1W
1.975(3)
S1-C1
1.744(4)
1.788(4)
1.754(6)
S1-C5
1.807(4)
1.802(8)
1.828(8)
O1-C13
1.325(5)
1.346(4)
1.309(6)
N1-C1
1.289(5)
1.266(5)
1.286(6)
N2-C1
1.363(5)
1.364(5)
1.358(7)
N2-N3
1.389(4)
1.378(4)
1.377(6)
N3-C7
1.285(5)
1.278(4)
1.307(6)
C2-C3
1.503(8)
1.520(7)
1.497(7)
C3-C4
1.221(8)
1.284(10)
1.284(10)
C5-C6
1.514(6)
1.472(12)
1.465(9)
C7-C8
1.435(5)
1.437(5)
1.429(7)
Угол
ω, град
O1Cu1[Ni1]{Fe1}N3
92.29(12)
85.75(11)
83.67(18)
N3ANi1Fe1}O1
96.70(11)
104.65(17)
O1Cu1[Ni1]{Fe1}N1
171.56(12)
163.15(11)
155.64(18)
N1ANi1{Fe1}O1
91.77(11)
90.31(18)
N3ANi1{Fe1}O1A
86.01(11)
84.13(18)
N3Cu1[Ni1]{Fe1}N1
81.14(13)
79.41(12)
73.80(19)
N3ANi1{Fe1}N1
98.73(12)
97.41(19)
N1Ni1{Fe1}N1A
97.74(13)
86.05(18)
N3Ni1{Fe1}O1A
98.59(11)
98.39(17)
N1Ni1{Fe1}O1A
89.44(12)
95.05(18)
N3ANi1{Fe1}N3
174.99(13)
171.00(19)
N3Ni1{Fe1}N1A
96.49(12)
103.26(18)
N3ANi1{Fe1}N1A
79.10(13)
73.66(18)
N1ANi1{Fe1)}O1A
164.27(11)
157.71(18)
O1Ni1{Fe1}O1A
84.91(10)
97.32(17)
O1Cu1O1W
91.60(13)
N3Cu1O1W
170.95(14)
N1Cu1O1W
94.16(13)
O1Cu1[Ni1]O1N
94.68(12)
N3Cu1[Ni1]O1N
80.91(12)
N1Cu1[Ni1]O1N
89.55(12)
O1WCu1O1N
106.91(14)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ
575
ɚ
ɛ
ɜ
Рис. 4. Общий вид димера (a), цепи (б) и фрагмента упаковки (в) молекул в кристалле комплекса 3.
вод можно сделать по положению полосы ν(C-O),
происходит смещение полосы ν(С=N) в низкоча-
которая в спектре соединения HL наблюдается в
стотную область на 20-30 см-1. Все это указывает
диапазоне 1230-1250 см-1, а в спектрах комплек-
на координацию соединения HL к атомам металла
сов смещается на 40-50 см-1 в низкочастотную
депротонированным фенольным атомом кисло-
область. Существенное изменение претерпевает
рода, азометиновым и тиокарбамидным атомами
полоса в области 3000-3400 см-1, относящаяся к
азота. На такую координацию карбамогидразоно-
валентным колебаниям ν(N4-H) в молекуле соеди-
тиоата HL указывает и то, что в ИК спектрах всех
нения HL. В спектрах комплексных соединений
комплексов появляется ряд новых полос в обла-
полоса сдвигается в высокочастотную область на
сти 530-405 см-1, обусловленных колебаниями
50-70 см-1. Кроме того, в спектрах комплексов
ν(M-N) и ν(M-O) (М - металл). В ИК спектре сое-
Таблица 4. Геометрические параметры водородных связей в комплексах 3, 4, 7
Расстояние, Å
Угол DHA,
Связь D-H...A
Координаты атома A
D-H
H...A
D...A
град
3
O1W-H1WA∙∙∙O1
0.86
1.83
2.6886
174
1-x, 1-y, -z
N2-H2∙∙∙O1N
0.86
2.17
2.8752
139
2-x, 2-y, -z
O1W-H1WB∙∙∙O3N
0.72
2.11
2.7186
143
-1+x, y, z
C2-H2A∙∙∙S1
0.97
2.55
2.9778
107
x, y, z
C5-H5A∙∙∙O2N
0.97
2.52
3.2026
127
x, 1+y, z
C5-H5B∙∙∙O1N
0.97
2.48
3.2692
139
2-x, 2-y, -z
C7-H7∙∙∙O3N
0.93
2.47
3.3217
153
2-x, 2-y, -z
4
C2A-H2AA∙∙∙S1A
0.97
2.54
3.0016
109
x, y, z
C2-H2B∙∙∙S1
0.97
2.57
3.1022
115
x, y, z
7
N2-H2∙∙∙O3N
0.86
2.09
2.9163
162
1-x, -1/2+y, 1/2-z
N2A-H2A∙∙∙O1N
0.86
2.38
2.8483
115
1-x, 1-y, -z
C2A-H2AB∙∙∙S1A
0.97
2.61
2.9880
103
x, y, z
C2-H2B∙∙∙S1
0.97
2.57
2.9557
104
x, y, z
C5A-H5AA∙∙∙O1N
0.97
2.55
3.4892
162
x, y, z
C5A-H5AB∙∙∙N2A
0.97
2.60
2.9726
103
x, y, z
C5A-H5AB∙∙∙O1N
0.97
2.58
3.4848
155
1-x, 1-y, -z
C5-H5A∙∙∙O3N
0.97
2.47
3.2257
134
1-x, -1/2+y, 1/2-z
C7-H7∙∙∙O3N
0.93
2.54
3.3447
134
1-x, -1/2+y, 1/2-z
C7A-H7A∙∙∙O2N
0.93
2.56
3.430
155
1-x, 1-y, -z
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
576
ГУЛЯ и др.
динения HL полоса поглощения ν(C=S) отсутству-
ет, поскольку атом серы алкилирован иодэтаном, и
появляется новая полоса поглощения при 682 см-1,
соответствующая колебаниям ν(C-S) [12]. Эта по-
лоса не смещается при комплексообразовании,
следовательно, атом серы не участвует в коорди-
нации с ионом металла.
Полученные физико-химические данные по-
зволяют представить распределение химических
связей [В (1, 2) и Г (5, 6)] в комплексах (схема 2).
Комплексы биометаллов с метил-N'-(2-гидрок-
сибензилиден)-N-(проп-2-ен-1-ил)карбамоги-
дразонотиоатом избирательно подавляют рост и
размножение некоторых видов раковых клеток и
некоторых видов микроорганизмов [12]. В связи
с этим in vitro изучена противомикробная и про-
Рис. 5. Фрагмент упаковки молекул в кристалле ком-
тивогрибковая активность координационных сое-
плекса 4.
динений 1-7 по отношению к серии стандартных
штаммов грамположительных (Staphylococcus
Наиболее активен в отношении грамположитель-
aureus), грамотрицательных бактерий (Escherichia
ных микроорганизмов комплекс 7, а в отношении
coli и Klebsiella pneumonae) и представителя дрож-
грамотрицательных микроорганизмов - комплекс
жеподобных грибов Candida albicans. Полученные
4. Близость значений МПК и МБК для многих сое-
экспериментальные данные приведены в табл. 5,
динений указывает на бактерицидный характер их
из которой видно, что все исходные соли меди, ни-
действия.
келя, кобальта, железа и карбамогидразонотиоат
Изучение антипролиферативной активности
HL не проявляют противомикробной активности
комплексов 1-7 в отношении клеток рака шейки
в отношении вышеуказанных микроорганизмов.
матки HeLa, поджелудочной железы BxPC-3, мы-
Комплексы 1, 3-7 проявляют селективную как бак-
шечной ткани RD показалo, что, как и комплексы
териостатическую, так и бактерицидную актив-
3d-металлов с метил-N'-(2-гидроксибензилиден)-
ность в диапазоне концентраций 30-500 мкг/мл
N-(проп-2-ен-1-ил)карбамогидразонотиоатом
в отношении микробов и 30-60 мкг/мл в отноше-
нии Candida albicans. Hа минимальную подавля-
[12], соединения
1-7 проявляют противорако-
ющую (МПК) и минимальную бактерицидную
вую активность в интервале концентраций 0.1-
(МБК) концентрации комплексов 1, 3-7 основное
100 мкмоль/л. В табл. 6 представлены концентра-
влияние оказывает природа центрального атома.
ции полумаксимального ингибирования (IC50), яв-
Рис. 6. Фрагмент упаковки молекул в кристалле комплекса 7.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ
577
Схема 2.
S
N
N
NH
O
X
Co
X
H
O
O Cu
N
HN
N
N
N
S
N
S
ȼ
Ƚ
X = Cl, Br (ȼ); NO3, I (Ƚ).
ляющегося показателем эффективности ингибиру-
вораковым препаратом доксорубицином, применя-
щего действия исследуемых веществ в отношении
емым в медицинской практике.
упомянутых клеток. Экспериментальные данные
Для определения селективности антипроли-
феративного действия карбамогидразонотиоата
указывают на то, что комплекс 7 проявляет более
HL и комплексов 1-7 определена их ингибирующая
высокую противораковую активность в отноше-
активность в отношении модельной линии
нии клеток HeLa и BxPC-3 по сравнению с проти-
нормальных клеток млекопитающих MDCK.
Таблица 5. Минимальные подавляющие (МПК) и бактерицидные (МБК) концентрации координационных соедине-
ний 1, 3-7 по отношению к тест-микробам (мкг/мл)
Staphylococcus aureus,
Escherichia coli,
Candida albicans
Klebsiella pneumonae
ATCC 25923
ATCC 25922
ATCC 90028
Соединение
МПК
МБК
МПК
МБК
МПК
МБК
МПК
МБК
Исходные солиа
˃1000
˃1000
˃1000
˃1000
˃1000
˃1000
˃1000
˃1000
HL
˃1000
˃1000
˃1000
˃1000
˃1000
˃1000
˃1000
˃1000
1
30
60
500
500
500
500
60
60
3
30
60
500
500
500
500
60
60
4
30
60
120
120
120
120
30
30
5
30
60
500
500
500
500
60
60
6
30
60
500
500
500
500
30
30
7
30
30
500
500
250
500
30
30
а CuCl2·2H2O, CuBr2, Cu(NO3)2·3H2O, Ni(CH3COO)2·4H2O, Co(CH3COO)2·4H2O, Co(NO3)2·6H2O, Fe(NO3)3·6H2O.
Таблица 6. Полумаксимальное ингибирование роста клеток HeLa, BxPC-3, RD и MDCK соединениями 1-7
а
IC50, мкмол/л а
IC50, мкмол/л
Соединение
Соединение
HeLa
BxPC-3
RD
MDCK
HeLa
BxPC-3
RD
MDCK
HL
>100
88
>100
>100
5
>100
19
37
29
1
14
>100
13
12
6
>100
>100
>100
>100
2
37
22
12
33
7
2.2
1.3
>100
>100
3
13
1.1
5.5
1.6
Доксорубицин
10
3.7
16
7.1
4
83
69
57
>100
а Стандартная ошибка среднего (SEM) < ±4%. Значения IC50 были вычислены с использованием статистического
программного обеспечения.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
578
ГУЛЯ и др.
Как видно из данных табл.
6, комплекс
7,
менты соединений 1-7 определяли методом Гуи.
обладая высокой противораковой активностью в
Расчет молярной магнитной восприимчивости с
отношении клеток HeLa и BxPC-3, практически
поправкой на диамагнетизм проводили исходя из
не оказывает негативного влияния на рост и
теоретических значений магнитной восприимчи-
размножение нормальных клеток MDCK.
вости органических соединений.
Полученные экспериментальные данные ука-
Противомикробную, противогрибковую и про-
зывают на перспективность дальнейшего поиска
тивораковую активности изучали по стандартным
противомикробных, противогрибковых и проти-
методикам [19].
вораковых веществ среди координационных сое-
Этил-N'-(2-гидроксибензилиден)-N-(проп-
динений биометаллов с биолигандами на основе
2-ен-1-ил)карбамогидразонотиоат (HL). К ме-
арбамогидразонотиоатов.
танольному раствору 1.31 г (10 ммоль) N-(проп-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2-ен-1-ил)гидразинкарботиоамида
добавляли
1.71 г (11 ммоль) иодэтана. Полученный раствор
Для выполнения РСА комплексов 3, 4 и 7 ис-
перемешивали 7 ч при постоянном нагревании
пользовали дифрактометр Oxford Diffraction [15].
до 60°С, затем добавляли 1.22 г (10 ммоль) 2-ги-
Структуры решены прямыми методами и уточне-
дроксибензальдегида. Раствор перемешивали при
ны МНК в анизотропном приближении для нево-
нагревании 30 мин. Полученный гидроиодид кар-
дородных атомов по программам SHELX-97 [16].
бамогидразонотиоата нейтрализовали карбонатом
Атомы водорода включены в уточнение в геоме-
натрия до слабощелочной среды (рН = 7-8). Затем
трически рассчитанных позициях, а их темпера-
проводили жидкостную экстракцию хлорофор-
турные факторы UH приняты в 1.2 раза большими,
мом. Полученное желтое вещество сушили на воз-
чем у связанных с ними атомов углерода, азота и
духе. Форма А. Спектр ЯМР 1H (CDCl3), δ, м. д.:
кислорода. Уточнение положения молекул CH3OH
1.38 т (3H, CH3, J = 7.3 Гц), 2.90 к (2H, SCH2, J
и HI в комплексе 4 проведено с учетом их разу-
= 7.3 Гц), 4.09 т (2H, CH2N, J = 5.6 Гц), 4.49 уш.
порядочения. Основные параметры эксперимента,
с (1H, NH), 5.24 м (2H, CH2=C), 5.98 м (1HAllyl),
решение и уточнение структур приведены в табл.
6.88 т (1H, CHAr, J = 7.5 Гц), 6.99 д (1H, CHAr, J =
2, некоторые межатомные расстояния, валентные
7.5 Гц), 7.25 т (1H, CHAr, J = 7.5 Гц), 7.26 д (1H,
углы и водородные связи - в табл. 3, 4. Координаты
CHAr, J = 7.5 Гц), 8.40 с (1H, CH=N), 11.85 уш. с
базисных атомов исследованных структур депо-
(1H, OH). Спектр ЯМР 13C (CDCl3), δС, м. д.: 14.56
нированы в Кембриджский банк данных (CCDC
(CH3), 17.26 (CH2=), 24.75 (SCH2), 45.94 (CH2N);
1944047-1944049).
116.59, 118.88, 119.07, 130.75, 130.80 (CAr), 133.89
Анализ геометрических параметров исследо-
(CHAllyl), 158.77 (CS), 160.54 (CAr). Форма Б.
ванных соединений выполняли с помощью про-
Спектр ЯМР 1H (CDCl3), δ, м. д.: 1.38 т (3H, CH3,
граммы Platon [17], наблюдаемые π-π-стекинг-вза-
J = 7.3 Гц), 3.11 к (2H, SCH2, J = 7.3 Гц), 3.92 т (2H,
имодействия между циклами оценивали согласно
CH2N, J = 5.8 Гц), 5.23 м (2H, CH2=C), 5.65 уш.
критерию, предложенному в данной программе
с (1H, NH), 5.87 м (1H, CHAllyl), 6.91 т (1H, CHAr,
(CgI…CgJ < 6.0 Å, β < 60.0°, где β - угол между
J = 7.4 Гц), 6.97 д (1H, CHAr, J = 7.4 Гц), 7.24 т (1H,
вектором CgICgJ и нормалью к ароматическому
CHAr, J = 7.4 Гц), 7.29 д (1H, CHAr, J = 7.4 Гц), 8.43
циклу CgI). Геометрические расчеты и рисунки
с (1H, CH=N), 11.41 уш. с (1H, OH). Спектр ЯМР
выполнены с помощью программы Mercury [18],
13C (CDCl3), δС, м. д.: 14.52 (CH3), 24.79 (SCH2),
для представления упаковок структур оставлены
45.80 (CH2N), 116.32 (CAr), 116.81 (CH2=), 118.79,
только те атомы водорода, которые участвуют в
119.50, 131.14, 131.23 (CAr); 134.07 (CHAllyl), 156.84
водородных связях.
(CH=N), 158.50 (CS). 161.32 (CAr).
Сопротивление растворов комплексов 1-7 в
Хлоро[2-({[(этилсульфанил)(проп-2-ен-1-и-
метаноле (20°С, с = 0.001 моль/л) измеряли с по-
ламино)метилиден]гидразинилиден}метил)-
мощью реохордного моста Р-38. ИК спектры ре-
фенолято]медь
(1). К этанольному раствору
гистрировали на спектрофотометре Bruker ALPHA
10 ммоль этил-N'-(2-гидроксибензилиден)-N-
(4000-400 см-1). Эффективные магнитные мо-
(проп-2-ен-1-ил)карбамогидразонотиоата
при
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
СИНТЕЗ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ
579
непрерывном перемешивании и нагревании
4. Turk S.R., Shipman C., Drach J.C. // J. Gen. Virology.
(50-55°С) прибавляли 10 ммоль дигидрата хлори-
1986. Vol. 67. N 8. P. 1625. doi 10.1099/0022-1317-
да меди(II). После охлаждения до комнатной тем-
67-8-1625
5. Yamazaki C. // Canad. J. Chem. 1975. Vol. 53. N. 4.
пературы реакционной смеси наблюдалось обра-
P. 610. doi 10.1139/v75-085
зование мелкокристаллического осадка, который
6. Ботошанский М.М., Боурош П.Н., Ревенко М.Д.
отфильтровывали на стеклянном фильтре, промы-
, Коржа И.Д., Симонов Ю.А., Панфилие Т. //
вали небольшим количеством спирта, эфира и су-
ЖCХ. 2009. Т. 50. № 1. С. 188; Botoshanskii M.,
шили на воздухе до постоянной массы.
Bourosh P.N., Revenko M.D., Korzha I.D., Simonov Y.A.,
Аналогично, используя в качестве исходных
Panfilie T. // J. Struct. Chem. 2009. Vol. 50. N 1. P. 181.
веществ бромид меди(II) и гидраты нитратов ме-
doi 10.1007/s10947-009-0026-y
ди(II), кобальта(II) и железа(III), взятые в мольном
7. Leovac V.M., Češljević V.I., Vojinović-Ješić L.S.,
отношении 1:1 и 1:2, синтезировали соединения 2,
Divjaković V., Jovanović L.S., Szécsényi K.M.,
3, 6, 7.
Rodić M.V. // Polyhedron. 2009. Vol. 28. N 16. P. 3570.
doi 10.1016/j.poly.2009.07.045
Иодид бис[2-({[(этилсульфанил)(проп-2-ен-
8. Rodić M.V., Leovac V.M., Jovanović L.S., Vojinović-
1-иламино)метилиден]-гидразинилиден}ме-
Ješić L.S., Divjaković V., Češljević V.I. // Polyhedron.
тил)фенолято]кобальта(III) (5). К метанольному
2012. Vol. 46. N 1. P. 124. doi 10.1016/j.
раствору 20 ммоль гидроиодида этил-N'-(2-гидрок-
poly.2012.08.011
сибензилиден)-N-(проп-2-ен-1-ил)карбамогидра-
9. Petrovic D.M., Petrovic A.F., Leovac V.M., Lukic S.R. //
зонотиоата при непрерывном перемешивании и
J. Thermal Analysis. 1994. Vol. 41. N 5. P. 1165. doi
нагревании (50-55оС) прибавляли 10 ммоль тетра-
10.1007/bf02547205
гидрата ацетата кобальта(II). После охлаждения
10. Malik M., Phillips D. // Austral. J. Chem. 1974. Vol. 27.
до комнатной температуры реакционной смеси
N 5. P. 1133. doi 10.1071/ch9741133
наблюдалось образование мелкокристаллическо-
11. Takjoo R., Mague J. T., Akbari A., Ahmadi M. //
го осадка, который отфильтровывали на стеклян-
J. Coord. Chem. 2013. Vol. 66. N 22. P. 3915. doi
ном фильтре, промывали небольшим количеством
10.1080/00958972.2013.856420
спирта, эфира и сушили на воздухе до постоянной
12. Pahontu E., Usataia I., Graur V., Chumakov Yu.,
Petrenko P., Gudumac V., Gulea A. // Appl.
массы.
Organometal. Chem. 2018. Vol. 32. N 12. P. e4544. doi
Аналогично, используя в качестве исходных
10.1002/aoc.4544
веществ тетрагидрат ацетата никеля(II) и HL·HI,
13. Türkkan B., Sarıboğa B., Sarıboğa N. // Transition
взятые в мольном отношении 1:2, синтезировали
Metal Chem. 2011. Vol. 36. N 6. P. 679. doi 10.1007/
комплекс 4.
s11243-011-9518-7
Авторы выражают благодарность О.С. Гарбуз
14. Şahin M., Bal-Demirci T., Pozan-Soylu G., Ülküseven B. //
за помощь при проведении биологических испы-
Inorg. Chim. Acta. 2009. Vol. 362. N 7. P. 2407. doi
таний синтезированных веществ.
10.1016/j.ica.2008.10.036
15. CrysAlisPro, Version 1.171.33.52 (release 06-11-2009
КОНФЛИКТ ИНТЕРЕСОВ
CrysAlis171.NET). Oxford Diffraction Ltd.
16. Sheldrick G.M. // Acta Crystallogr. (A). 2007. Vol. 64.
Авторы заявляют об отсутствии конфликта
N 1. P. 112. doi 10.1107/s0108767307043930
интересов.
17. Spek A.L. // J. Appl. Crystallogr. 2003. Vol. 36. N 1.
СПИСОК ЛИТЕРАТУРЫ
P. 7. doi 10.1107/s0021889802022112
18. Macrae C.F., Edgington P.R., McCabe P., Pidcock E.,
1. Beraldo H., Gambino D. // Mini Rev. Med. Chem. 2004.
Vol. 4. N 1. P. 31. doi 10.2174/1389557043487484
Shields G.P., Taylor R., Van De Streek J. // J. Appl.
2. Saryan L.A., Ankel E., Krishnamurti C., Petering D.H.,
Crystallogr. Vol. 39. N 3. P. 453. doi 10.1107/
Elford, H. // J. Med. Chem. 1979. Vol. 22. N 10. P. 1218.
s002188980600731x
doi 10.1021/jm00196a013
19. Gulea A., Poirier D., Roy J., Stavila V., Bulimestru I.,
3. Pahontu E., Fala V., Gulea A., Poirier D., Tapcov V.,
Tapcov V., Popovschi L. // J. Enzyme Inhibition Med.
Rosu, T. // Molecules. 2013. Vol. 18. N 8. P. 8812. doi
Chem. 2008. Vol. 23. N 6. P. 806. doi 10.1080/
10.3390/molecules18088812
14756360701743002
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
580
ГУЛЯ и др.
Synthesis, Structure and Biological Activity of Coordination
Compounds of Copper, Nickel, Cobalt and Iron
with Ethyl N'-(2-Hydroxybenzylidene)-N-prop-2-en-
1-ylcarbamohydrazonothioate
А. P. Guleaa, I. S. Usataiaa, V. О. Graura,*, Yu. M. Chumakovb,c,
P. A. Petrenkob, G. G. Baland, O. S. Burduniucd,e, V. I. Tsapkova, and V. F. Rudicf
a State University of Moldova, Chisinau, 2009 Moldova
b Institute of Applied Physics, Chisinau, 2001 Moldova
c Gebze Institute of Technology, Cayirova, Kocaeli, 41400 Turkey
d State University of Medicine and Pharmacy „Nicolae Testemitanu”, Chisinau, 2001 Moldova
e National Agency of Public Health, Chisinau, 2028 Moldova
f Institute of Microbiology and Biotechnology of Academy of Sciences of Moldova, Chisinau, 2028 Moldova
*e-mail: vgraur@gmail.com
Received September 26, 2019; revised September 26, 2019; accepted October 3, 2019
N-(Prop-2-en-1-yl)hydrazonocarbothioamide reacts with iodoethane in methanol with further addition of
2-hydroxybenzaldehyde to form hydroiodide of carbamohydrazonothioate (HL·HI). The coordination com-
pounds were obtained by interaction of HL or HL·HI with copper, nickel, cobalt and iron salts CuLХ·nH2O
[X = Cl-, Br-, NO3-; n = 0-1], Ni(L)2·HI·CH3OH, Сo(L)2X [X = I-, NO3-] and Fe(L)2NO3. The structures of
three complexes were established by single crystal X-ray analysis. The synthesized complexes exhibit selective
antimicrobial and antifungal activity against a series of standard microorganisms and fungi in the concentration
range of 30-500 μg/mL. In addition, nickel and iron complexes selectively inhibit the growth and proliferation
of cancer cells and do not adversely affect normal cells.
Keywords: coordination compounds, carbamohydrazonothioates, antimicrobial activity, anticancer activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020