ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 4, с. 591-598
УДК 546.922;547-304.7;54.03
СИНТЕЗ ЦИКЛОМЕТАЛЛИРОВАННОГО
КОМПЛЕКСА ПЛАТИНЫ(II) С
АЛКИНИЛЗАМЕЩЕННЫМ ИЗОЦИАНИДНЫМ
ЛИГАНДОМ, ЕГО СТРУКТУРА И ФОТОФИЗИЧЕСКИЕ
ХАРАКТЕРИСТИКИ
© 2020 г. С. А. Каткова*, А. А. Лещев, А. С. Михердов, М. А. Кинжалов
Санкт-Петербургский государственный университет,
Университетская наб. 7-9, Санкт-Петербург, 199034 Россия
*e-mail: sa_katkova@mail.ru
Поступило в Редакцию 17 октября 2019 г.
После доработки 17 октября 2019 г.
Принято к печати 21 октября 2019 г.
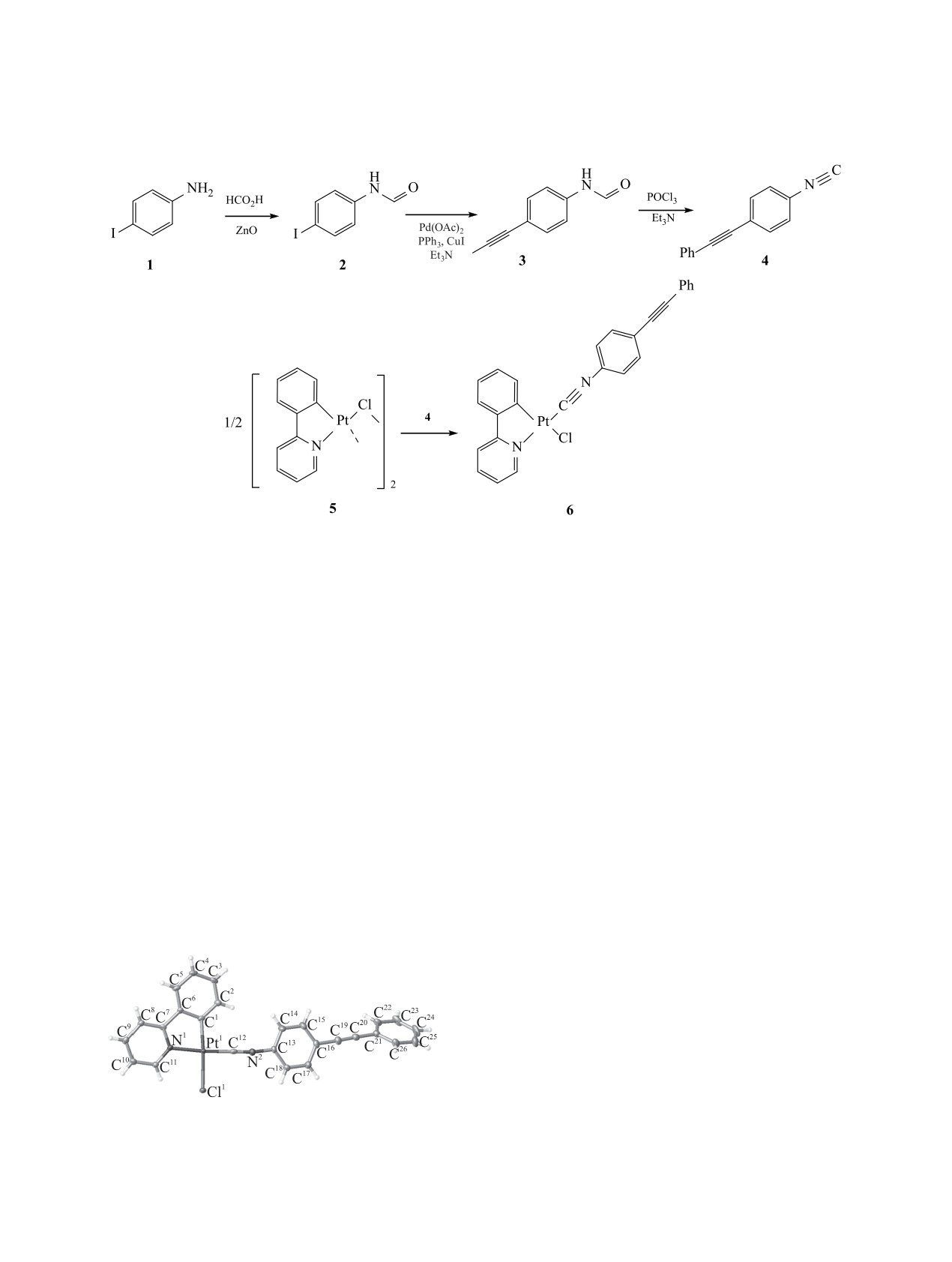
Циклометаллированый комплекс платины(II) [Pt(ppy)Cl(CNC6H4CCPh)] с фенилпиридиновым и [4-(2-фенил-
этинил)фенил]изоцианидным лигандами синтезирован из димера [Pt(ppy)Cl]2 и изоцианида CNC6H4CCPh
с выходом 90%. Соединение охарактеризовано с помощью данным масс-спектрометрии, ИК и ЯМР
спектроскопии, а также рентгеноструктурного анализа. Изучены фотофизические параметры комплекса
в твердой фазе.
Ключевые слова: комплексы платины, изоцианиды, люминесценция
DOI: 10.31857/S0044460X20040149
C,N-Циклометаллированные комплексы плати-
нию разницы энергий между ВЗМО и НСМО ком-
ны(II) являются одними из наиболее перспектив-
плекса, гипсохромно сдвигая максимум эмиссии
ных металлоорганических люминофоров благода-
в синюю область, и позволяет получать фосфо-
ря способности люминесцировать при комнатной
ресцирующие с высокими квантовыми выходами
температуре во всем видимом диапазоне [1-3].
люминофоры [3]. Линейная геометрия изоцианида
Они характеризуются высокой эффективностью
и отсутствии стерических затруднений не препят-
фотофизических процессов интеркомбинацион-
ствуют образованию металлофильных взаимодей-
ной конверсии синглетного возбужденного состо-
ствий Pt···Pt и π-π-стекингу, которые повышают
яния в низшее по энергии триплетное состояние,
структурную жесткость молекул, тем самым сни-
что приводит к эффективной фосфоресценции
жая безызлучательное рассеивание энергии [4, 5].
комплексов [2]. Наиболее интересными являются
В литературе описаны некоторые циклометаллиро-
люминофоры на основе гетеролептических C,N-
ванные комплексы платины(II) с изоцианидными
циклометаллированных комплексов платины(II)
лигандами, проявляющие многообещающие фото-
[Pt(C^N)(L,L')]Z - они способны люминесцировать
физические [1, 6-8] и фотокаталитические [9-11]
во всем видимом диапазоне, при этом настройка
свойства, но спектр используемых в этих работах
длины волны эмиссии осуществляется варьиро-
изоцианидных лигандов ограничен. Отдельно от-
ванием циклометаллирующих (C^N) и вспомога-
метим, что C,N-циклометаллированные комплек-
тельных (L, L') лигандов [1-3]. Внедрение в моле-
сы платины(II), содержащие в качестве вспомо-
кулу люминофора сильных σ-донорных лигандов -
гательных лигандов один галогенидный и один
в частности, изоцианидов - приводит к увеличе-
изоцианидный лиганды, крайне редки [5, 12-15]
591
592
КАТКОВА и др.
Схема 1.
и таких комплексов для циклометаллированного
в две стадии, включающие образование форма-
2-фенилпиридина ранее не описано.
мида 2 и его кросс-сочетание Соногаширы с фе-
нилацетиленом. Добавление эквимолярного ко-
Помимо этого, изоцианидные лиганды сами
личества 4 к суспензии хлормостикового димера
способны участвовать в нековалентных взаимо-
5 в 1,2-дихлорэтане и дальнейшее кипячение в
действиях [9-22], что также позволяет управлять
течении 2 ч приводит к образованию комплекса
фотофизическими параметрами люменисцентных
[Pt(ppy)Cl(CNC6H4CCPh)] 6 с хорошим препара-
материаллов. Небольшая энергия этих взаимодей-
тивным выходом 90%.
ствий делает процессы с их участием обратимы-
ми, быстрыми и легко настраиваемыми [23-26].
Комплекс 6 выделен в виде светло-желтого
С этой точки зрения, ключевым критерием при
твердого кристаллического вещества c т. разл.
171°С и охарактеризован с помощью методов
выборе изоцианидного лиганда является нали-
масс-спектрометрии, ИК и ЯМР спектроскопии.
чие протяженной системы сопряженных связей
Его структура в твердой фазе установлена мето-
и отсутствие объемных заместителей в молекуле
дом РСА (рис. 1).
изоцианида. В данной работе мы изучили возмож-
ность получения подобных комплексов на приме-
Масс-спектр комплекса
6 содержит макси-
ре комплекса 6, содержащего 4-(фенилэтинил)фе-
мальный пик, соответствующий иону [M - Cl]+ с
нильный заместитель (схема 1).
характерным изотопным распределением. В ИК
спектре комплекса наблюдается интенсивная по-
Синтез изоцианида
4 проводили согласно
лоса валентных колебаний связи C≡N в области
схеме 1. Формамид 3 получен из 4-иоданилина 1
2176 см-1, что хорошо согласуется с литературны-
ми данными для изоцианидных комплексов плати-
ны [27-29]. Также наблюдаются полосы колебаний
ароматических фрагментов: валентные колебания
связей С-H (3054 см-1), скелетные колебания цик-
ла C-C (1604, 1502 см-1), плоскостные колебания
С-H (1066 см-1) и внеплоскостные колебания С-H
(841, 756, 689 см-1).
Рис. 1. Общий вид молекулы комплекса 6 в кристалле
В спектре ЯМР 1H комплекса 6 наблюдается
(CCDC 1956173).
набор сигналов в ароматической области, соответ-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
СИНТЕЗ ЦИКЛОМЕТАЛЛИРОВАННОГО КОМПЛЕКСА ПЛАТИНЫ(II)
593
Избранные значения длин связей и углов в комплексе 6
Длина связи
d, Å
Угол
φ, град
Pt1-Cl1
2.388(1)
C1Pt1N1
80.97(15)
Pt1-N1
2.055(3)
C12Pt1Cl1
89.85[34]
Pt1-C1
1.997(4)
C12N2C13
169.5(4)
Pt1-C12
1.888(4)
N2C12Pt1
179.1(4)
N2-C12
1.150(5)
C19C20C21
176.6(5)
C20-C19
1.203(6)
C20C19C16
176.9(5)
ствующих атомам водорода ppy и изоцианидного
анидных комплексах платины(II) и палладия(II)
фрагментов. Отличительным сигналом являет-
[27, 32, 33].
ся высокочастотный пик при 9.58 м. д., соответ-
В структуре комплекса 6 не наблюдается ме-
ствующий протону H11 (нумерация дана согласно
таллофильных взаимодействий Pt···Pt, характер-
рис. 1) фрагмента ppy, высокочастотное смещение
ных для бисизоцианидных комплексов плати-
которого вызвано сильным дезэкранированием
ны(II) [35]. Для того чтобы понять, какие именно
атомом азота [30, 31]. Мультиплетность сигнала
межатомные контакты дают наибольший вклад в
обусловлена расщеплением от ядра 195Pt [30, 31].
кристаллическую упаковку, мы провели анализ
В спектре ЯМР 13С сигналы наиболее близко рас-
поверхности Хиршфельда для структуры 6 [36].
положенных к атому платины атомов углерода (С1,
Были обнаружены следующие долевые вклады ме-
С7, С11) также расщепляются от ядра 195Pt. Сигнал
жатомных контактов, %: C-H 37.4, H-H 35.9, Cl-H
углерода изоцианидной группы при 131.1 м. д. в
9.0, C-C 7.1, N-H 3.4, Pt-H 2.3, C-N 1.8, C-Cl 1.4,
спектре ЯМР 13С имеет низкую интенсивность,
Pt-C 1.0, N-Cl 0.7. Таким образом, анализ поверх-
что характерно для таких комплексов [27, 32, 33].
ности Хиршфельда для структуры 6 показал, что
Кроме того, в спектре ЯМР 13С сигналы при 87.8 и
наибольший вклад в кристаллическую упаковку
93.0 м. д. соответствуют атомам углерода тройной
данного соединения вносят межатомные взаи-
связи С≡С. Сигнал атома платины в спектре ЯМР
модействия c участием атомов водорода. Однако
на ядрах 195Pt комплекса 6 расположен при -3880
стоит отметить наличие контактов между атома-
м. д., что является характерным для изоцианидных
ми углерода и атомами углерода и азота, отвеча-
комплексов платины(II) [27, 32, 33].
ющими за π-π-взаимодействия, а также контактов
Для доказательства структуры комплекса 6 в
с атомом платины, которые могут влиять на фото-
твердой фазе использован метод РСА (рис. 1).
физические свойства комплекса.
Значения наиболее важных длин связей и валент-
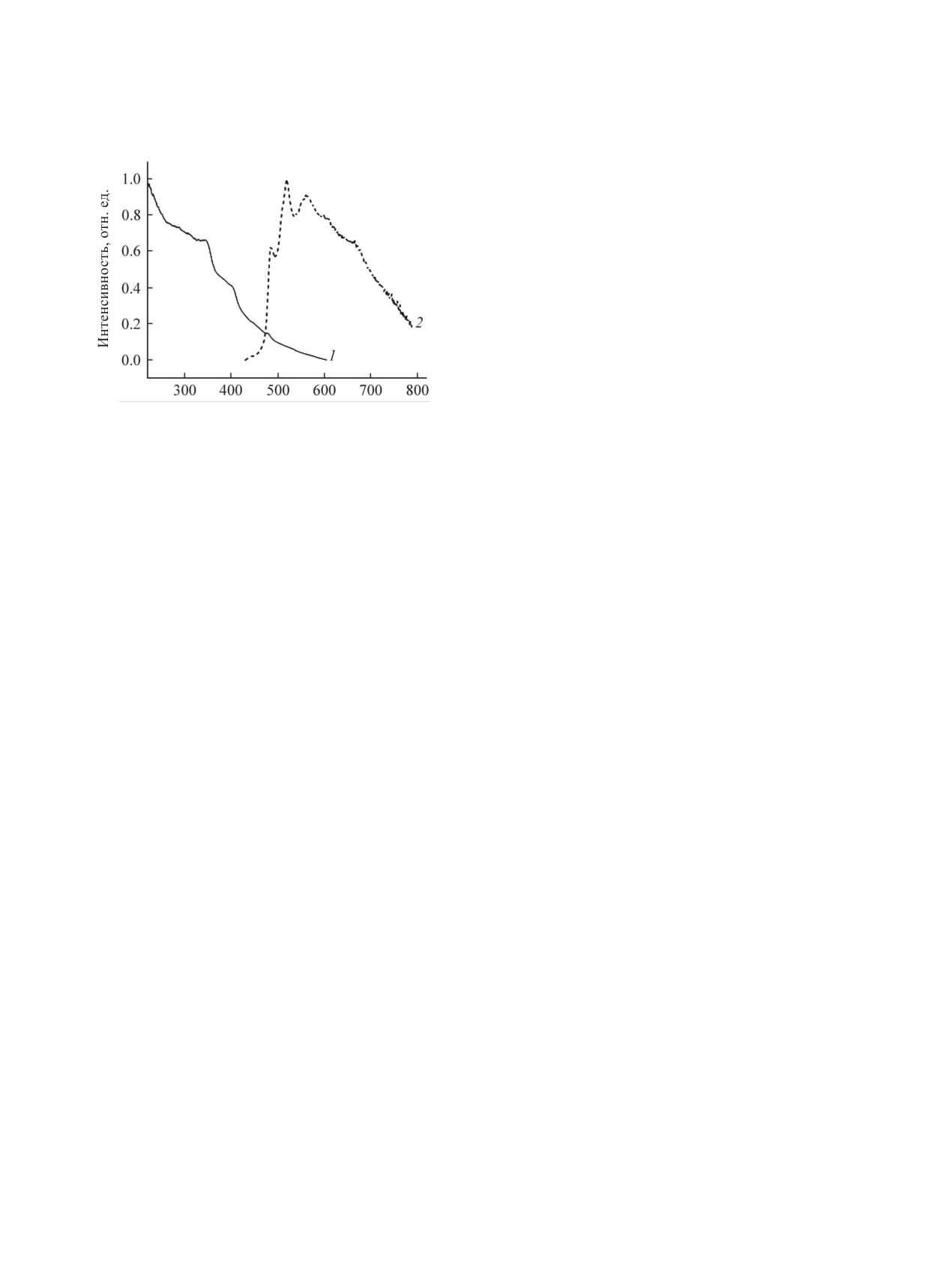
Были изучены фотофизические свойства синте-
ных углов в комплексах приведены в таблице.
зированного комплекса 6 в твердой фазе (рис. 2).
Кристаллографически независимая часть
Были зарегистрированы спектры поглощения и
структуры 6 представлена oдной молекулой ком-
спектры эмиссии, а также определено время жиз-
ни возбужденного состояния люминесценции.
плекса [Pt(ppy)Cl(CNC6H4CCPh)] (рис. 1). В ком-
плекс 6 в твердой фазе координированные к пла-
В спектре поглощения (рис. 2) комплекса 6
тине(II) атомы углерода фенилпиридинового и
наблюдается интенсивное поглощение в области
изоцианидного фрагментов находятся в цис-по-
λ = 350 нм, которое можно отнести к внутрили-
ложении. Связь платина-углерод с изоцианид-
гандным π-π*-переходам. Более слабые полосы
ным фрагментом примерно на 0.1 Å короче, чем
λ = 410 нм, вероятно, связаны с внутрилиганд-
с углеродом циклометаллированного лиганда. Все
ным переносом заряда (1ILCT) [ppy, π→π*], пе-
прочие длины связей хорошо согласуются со зна-
реносом заряда с лиганда на лиганд [1LL0CT
чениями межатомных расстояний в других изоци-
(L = ppy, L0 = CNC6H4CCPh)] и с металла на лиганд
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
594
КАТКОВА и др.
Значение времени жизни возбужденного состо-
яния комплекса 6 находится в микросекундном ин-
тервале (0.8 мкс), что свидетельствует о триплет-
ной природе возбужденного состояния [5, 37].
Таким образом, на примере комплекса [Pt(ppy)
Cl(CNC6H4CCPh)] продемонстрирована возмож-
ность получения циклометаллированных комплек-
сов платины(II), содержащих в качестве одного из
вспомогательных лигандов арилизоцианид с уве-
личенной цепочкой сопряжения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные вещества и растворители исполь-
Ȝ ɧɦ
зовали коммерческие (Aldrich) без дополнитель-
Рис. 2. Спектры поглощения (1) и эмиссии (2) комплек-
ной очистки, кроме
1,2-дихлорэтана, CH2Cl2,
са 6 в твердой фазе (293 K).
ТГФ и Et2O. 1,2-Дихлорэтан и CH2Cl2 перегоня-
ли над P2O5, ТГФ - над CaO, Et2O - над метал-
(1MLCT) [dσ*(Pt)→(π*, ppy)], а также со смешан-
лическим натрием в присутствии бензофенонa.
но-лигандным переносом заряда 1MLCT/1ML0CT.
Хлормостиковый комплекс 5 синтезировали из
Полученные данные практически совпадают с
K2[PtCl4] по методике [30].
положением соответствующих полос поглощения
Масс-спектрометрический анализ проводи-
для других аналогичных моноизоцианидных ком-
ли на спектрометре Bruker micrOTOF (Bruker
плексов [M(C^N)Cl(CNR)] [5-7, 12].
Daltonics) с ионизацией электрораспылением
В красной области спектра появляется по-
(ESI). Растворитель - метанол. Значения m/z при-
глощение низкой интенсивности с максимумом
ведены для сигналов изотопологов c наибольшим
при λ = 480 нм, которое может быть отнесено к
содержанием. Инфракрасные спектры записаны на
спин-разрешенному переходу переноса заряда
спектрометре Shimadzu FTIR-спектр 8400S (4000-
со связи металл-металл-лиганд (1MMLCT), обу-
400 см-1, образцы таблетированы с KBr). Спектры
словленными переносами [dσ*(Pt)2→(π*, ppy)] и
ЯМР 1H, 13С{1H} и 195Pt{1H} регистрировали в рас-
[σ*(π, ppy)→σ(π*, ppy) [7, 8, 37]. Таким образом,
творе на спектрометре Bruker Avance II+ [400.13
наличие данной полосы указывает на присутствие
(1Н), 100.61 (13C), 86 МГц (195Pt)] при комнатной
взаимодействий с атомом платины и π-π-взаимо-
температуре, растворитель - СDCl3. Спектры по-
действий.
глощения зарегистрированы на спектрофотометре
Спектр эмиссии комплекса
6 колебательно
UV-1800. Спектры возбуждения, эмиссии и время
структурирован и имеет несколько полос с раз-
жизни получены с помощью спектрофлуориметра
ной интенсивностью максимумов эмиссии, что
Fluorolog-3 (Horiba Jobin Yvon).
согласуется с литературными данными для мо-
N-(4-Иодфенил)формамид (2) [39]. К 45 мл
ноизоцианидных комплексов
[M(C^N)Cl(CNR)]
85%-ной муравьиной кислоты (54.9 г, 1.2 моль)
[7, 15, 38]. Полосы при λ = 485 нм, 519 нм и 560
порциями добавляли ZnO (2.754 г, 0.034 моль)
нм, обусловлены вкладами переносов непосред-
при охлаждении. Полученную суспензию переме-
ственно циклометаллированного лиганда ppy
шивали в течение 15 мин, затем прибавляли 4-ио-
(3IL и 3ILCT), а также смешанно-лигандного, обу-
данилин (15 г, 68 ммоль). Смесь нагревали при
словленного переносом 3MLCT/3ML0CT (L = ppy,
75°С в течение 2 ч до полной конверсии исходного
L0 = CNC6H4CCPh). Вклад переносов 3MMLCT
анилина, которую контролировали методом ТСХ.
приводит к появлению в спектре люминесценции
После завершения реакции смесь охлаждали до
дополнительной полосы при λ = 650 нм и смеще-
комнатной температуры, разбавляли 100 мл CH2Cl
нию спектра в длинноволновую область.
и фильтровали от ZnO. Фильтрат промывали насы-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
СИНТЕЗ ЦИКЛОМЕТАЛЛИРОВАННОГО КОМПЛЕКСА ПЛАТИНЫ(II)
595
щенным раствором гидрокарбоната натрия до ней-
92.20, 87.31 (C≡C); 132.56, 131.70, 128.88, 128.47,
тральной среды. Органический слой сушили без-
124.82, 122.49 (CAr).
водным MgSO4, концентрировали в вакууме, оста-
Комплекс [Pt(ppy)Cl(CNC6H4CCPh)] (6). К
ток подвергали хроматографическому разделению
суспензии [Pt(ppy)Cl]2 (100 мг, 0.13 ммоль) в 20 мл
на силикагеле [элюент - гексан-этилацетат (1:1)].
1,2-дихлорэтана при перемешивании и нагревании
Выход: 13.4 г (80%). Спектр ЯМР 1H (СDCl3), δ,
до 50°С прибавляли по каплям раствор изоциани-
м. д.: 6.85 д (1H, ArH, 3JHH = 8.6 Гц), 7.33 м (1H,
да 4 (53 мг, 0.26 ммоль) в 10 мл 1,2-дихлорэтана
ArH), 7.63-7.68 м (2H, ArH), 8.39 с (1H, NH), 8.65-
в течение 1 ч. Полученную смесь перемешивали
8.70 м (1H, HCO).
при 80°С в течение 2 ч, затем упаривали до мини-
мального объема и добавляли 10 мл Et2O. Осадок
N-{4-[(2-Фенил)этинил]фенил}формамид (3)
отделяли и очищали перекристаллизацией из сме-
[40]. Смсесь 47 мг (0.21 ммоль) Pd(OAc)2, 118 мг
си CH2Cl2-Et2O (2:1). Выход 138 мг (90%), т. разл.
(0.45 ммоль) PPh3, 44 мг (0.73 ммоль) CuI и
171°С. ИК спектр, ν, см-1: 2176 (N≡C). Спектр ЯМР
10 мл тетрагидрофурана перемешивали в течение
1H (СDCl3), δ, м. д.: 7.13 т. д (1H, H3, ppy, 3JHH =
30 мин в атмосфере аргона, затем последователь-
6.7, 1.3 Гц), 7.19 т. д (1H, H4, ppy, 3JHH = 7.4,
но добавляли 1.15 г (4.7 ммоль) N-(4-иодфенил)-
0.9 Гц), 7.31 т (1H, H10, ppy, 3JHH = 6.1 Гц), 7.37-7.39 м
формамида 2, 0.51 г (5 ммоль) фенилацетилена и
(3H, C≡СC6H4), 7.59-7.52 м (5.5H, C6H4C≡СC6H4 +
0.10 г (10 ммоль) триэтиламина. Реакционную
H2 + H5, ppy), 7.61-7.3 м (2H, C≡NC6H4), 7.73-7.77
смесь перемешивали при 60°С в течение 4-6 ч.
м (1H, H8, ppy), 7.90 т. д (1H, H9, ppy, 3JHH = 7.8,
После окончания реакции смесь охлаждали до
1.3 Гц), 9.58 д (1H, H11, ppy, 3JHH = 5.0, 3JPtH =
комнатной температуры, фильтровали через целит
28.5 Гц). Спектр ЯМР 13С (СDCl3), δС, м. д.: 87.78,
и промывали CH2Cl2 (3×50 мл). После упаривания
92.96 (C≡С), 118.57 (C8, ppy), 122.26 (C10, ppy),
растворителя продукт выделяли перекристаллиза-
122.42 (C6H4C≡СC6H4), 124.24 (C5), 124.77 (C4),
цией из метанола и сушили в вакууме. Выход 0.61 г
125.56, 126.56, 128.50, 128.99 (C6H4C≡СC6H4),
(59%). Спектр ЯМР 1H (СDCl3), δ, м. д.: 7.06 д (1H,
131.14 (C≡N), 131.50 (C3, ppy), 131.75 и 132.83
ArH, 3JHH = 8.5 Гц), 7.33-7.38 м (3H, ArH), 7.50-
(C6H4C≡СC6H4), 136.16 (С2, ppy), 140.31 (C9, ppy),
7.56 м (5H, ArH), 8.40 с (1H, NH), 8.75 д (1H, HCO,
141.39 (С1, ppy), 144.02 (C6, ppy), 148.99 (C11, ppy),
3JHH = 11.3 Гц) 8.39 уш. с (1H, NH), 8.65-8.67 м
166.39 (C7, ppy). Спектр ЯМР 195Pt{1H} (СDCl3):
(1H, HCO).
δPt -3880 м. д. Масс-спектр, m/z: 552.0992 [M - Cl]+
1-Изоциано-4-[(2-фенил)этинил]бензол
(4)
(вычислено для C26H17N2Pt+: 552.1036).
[40]. Смесь 0.3 г (1.36 моль) формамида 3 в 10 мл
Рентгеноструктурный анализ комплекса
свежеперегнанного CH2Cl2 охлаждали до -10°С и
6 выполняли на дифрактометре Xcalibur, Eos.
перемешивали в течение 15 мин в атмосфере арго-
Измерения проводили при 100 K с использова-
на, затем добавляли 0.62 мл (0.4 г, 11.9 ммоль) три-
нием монохроматического MoKα-излучения (λ =
этиламина и прибавляли по каплям в течение часа
0.71073 нм). Параметры элементарной ячей-
0.14 мл (230 мг, 1.5 ммоль) POCl3. Полученную
ки уточнены методом наименьших квадратов на
смесь перемешивали 2 ч при температуре -10-0°С,
основе 35525 рефлексов с 2θ в пределах 5.186-
после чего добавляли раствор гидрокарбоната на-
54.996°. Структура решена прямыми методами и
трия и перемешивали при комнатной температуре
уточнена до R1 = 0.0271 (wR2 = 0.0669) для 4652
в течение 10 мин. Органический слой отделяли и
независимых рефлексов с |Fo| ≥ 4σF с использо-
промывали CH2Cl2 (3×50 мл), сушили безводным
ванием программы SHELX [41, 42] встроенной в
MgSO4,. После упаривания растворителя в ва-
комплекс OLEX2[43]. Поправка на поглощение
кууме остаток подвергали хроматографическому
введена в программном комплексе CrysAlisPro эм-
разделению на силикагеле [элюент - гексан-эти-
пирически с помощью сферических гармоник, ре-
лацетат (5:1)]. Выход 194 мг (70%). ИК спектр, ν,
ализованных в алгоритме шкалирования SCALE3
см-1: 2125 (N≡C). Спектр ЯМР 1H (СDCl3), δ, м. д.:
ABSPACK[44].
7.35-7.38 м (4Н, ArH), 7.52-7.55 м (5Н, ArH).
Комплекс 6. C26H17ClN2Pt, M = 587.95, син-
Спектр ЯМР 13С (СDCl3), δC, м. д.: 126.46 (C≡N),
гония моноклинная, пространственная группа
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
596
КАТКОВА и др.
P21/c, a = 18. 3454(4) Å, b = 5. 34210(10) Å, c = 22.
Vol. 46. P. 3895. doi 10.1039/c7dt00349h
22.1852(4) Å, β = 110.499(2)°, V = 2036.54[38] Å3,
6. Diez A., Fornies J., Fuertes S., Lalinde E., Larraz C.,
Z = 4, dвыч = 1.918 г/см3, μ = 7.037 мм-1, незави-
Lopez J.A., Martin A., Moreno M.T., Sicilia V. //
симых отражений c I>2σ(I) 4652, R1(|Fo| ≥ 4σF)/R1
Organometallics. 2009. Vol. 28. P. 1705. doi 10.1021/
(все данные) = 0.0271/0.0313, wR2 (|Fo| ≥ 4σF)/wR2
om800845c
(все данные) = 0.0669/0.0699, S = 1.054, ρmin/ρmax =
7. Fornies J., Sicilia V., Borja P., Casas J.M., Diez A.,
1.39/-1.63 e/Å3.
Lalinde E., Larraz C., Martin A., Moreno M.T. //
Анализ поверхностей Хиршфельда для кри-
Chem. Asian J. 2012. Vol. 7. P. 2813. doi 10.1002/
сталлической структуры 6 проведен в рамках
asia.201200585
формализма нормализованных длин контактов
8. Shahsavari H.R., Aghakhanpour R.B., Hossein-Abadi M.,
(dnorm) [42], основанного на ван-дер-ваальсовых
Haghighi M.G., Notash B., Fereidoonnezhad M. //
радиусах по Бонди [45] с помощью программы
New J. Chem. 2017. Vol. 41. P. 15347. doi 10.1039/
CrystalExplorer 3.1.
c7nj03110f
ФОНДОВАЯ ПОДДЕРЖКА
9. Li Z., Han Y., Gao Z., Wang F.// ACS Catal. 2017.
Vol. 7. N 7. P. 4676. doi 10.1021/acscatal.7b00709
Работа выполнена при финансовой поддержке
10. Mahmudov K.T., Kukushkin V.Y., Gurbanov A.V.,
Российского фонда фундаментальных исследова-
Kinzhalov M.A., Boyarskiy, V.P., da Silva M.F.C.G.,
ний (грант № 18-03-00119, синтез изоцианидного
Pombeiro A.J.L. // Coord. Chem. Rev. 2019. Vol. 384.
лиганда) и Совета по науке при Президенте РФ
P. 65. doi 10.1016/j.ccr.2019.01.002
(грант МК-1476.2019.3, синтез комплекса платины
и изучение его фотофизических свойств) с исполь-
11. Gee J.C., Fuller B.A., Lockett H.-M., Sedghi G.,
зованием оборудования ресурсных центров Санкт-
Robertson C. M., Luzyanin K.V. // Chem. Comm. 2018.
Петербургского государственного университета
Vol. 54. P. 9450. doi 10.1039/c8cc04287j
«Магнитно-резонансные методы исследования»,
12. Diez A., Fornies J., Larraz C., Lalinde E., Lopez J.A.,
«Рентгенодифракционные методы исследования»,
Martin A., Moreno M.T., Sicilia V. // Inorg. Chem. 2010.
«Методы анализа состава вещества», «Оптические
Vol. 49. P. 3239. doi 10.1021/ic902094c
и лазерные методы исследования вещества», а
13. Forniés J., Sicilia V., Larraz C., Camerano J.A., Martín
также Образовательного центра по направлению
A., Casas J.M., Tsipis A.C. // Organometallics. 2010.
«Химия».
Vol. 29. P. 1396. doi 10.1021/om901032v
КОНФЛИКТ ИНТЕРЕСОВ
14. Sicilia V., Fuertes S., Martín A., Palacios A. // Organo-
metallics. 2013. Vol. 32. P. 4092. doi 10.1021/
Авторы заявляют об отсутствии конфликта ин-
om400159g
тересов.
15. Tritto E., Chico R., Ortega J., Folcia C.L., Etxebarria J.,
СПИСОК ЛИТЕРАТУРЫ
Coco S., Espinet P. // J. Mater. Chem. (C). 2015. Vol. 3.
1. Chen Y., Lu W., Che C.M. // Organometallics. 2013.
P. 9385. doi 10.1039/c5tc01802a
Vol. 32. P. 350. doi 10.1021/om300965b
16. Wang H., Bisoyi H.K., Wang L., Urbas A.M., Bunning T.J.,
2. Li K., Tong G.S.M., Wan Q.Y., Cheng G., Tong W.Y.,
Li Q. // Angew. Chem. Int. Ed. 2018. Vol. 57. P. 1627.
Ang W.H., Kwong W.L., Che C.M. // Chem. Sci. 2016.
doi 10.1002/anie.201712781
Vol. 7. P. 1653. doi 10.1039/C5SC03766B
17. Choi S. J., Kuwabara J., Nishimura, Y., Arai T.,
3. Chi Y., Chou P.T. // Chem. Soc. Rev. 2010. Vol. 39.
Kanbara T. // Chem. Lett. 2012. Vol. 41. P. 65. doi
P. 638. doi 10.1039/b916237b
10.1246/cl.2012.65
18. Boterashvili M., Lahav M., Shankar S., Facchetti A.,
4. Solomatina A.I., Krupenya D.V., Gurzhiy V.V., Zlatkin I.,
van der Boom M.E. // J. Am. Chem. Soc. 2014. Vol. 136.
Pushkarev A.P., Bochkarev M.N., Besley N.A.,
P. 11926. doi 10.1021/ja5066587
Bichoutskaia E., Tunik S.P. // Dalton Trans. 2015.
Vol. 44. P. 7152. doi 10.1039/c4dt03106g
19. Zhang X., Li B., Chen Z.H., Chen Z.N. // J. Mater. Chem.
2012. Vol. 22. P. 11427. doi 10.1039/c2jm30394a
5. Solomatina, A.I., Aleksandrova I.O., Karttunen A.J.,
Tunik S. P., Koshevoy I.O. // Dalton Trans. 2017.
20. Katkova S.A., Mikherdov A.S., Kinzhalov M.A., Novi-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
СИНТЕЗ ЦИКЛОМЕТАЛЛИРОВАННОГО КОМПЛЕКСА ПЛАТИНЫ(II)
597
kov A.S., Zolotarev A.A., Boyarskiy V.P., Kukushkin V.Yu. //
32. Михердов А.С., Тюфяков Н.Ю., Полукеев В.А., Бо-
Chem. Eur. J. 2019. Vol. 25. P. 8590. doi 10.1002/
ярский В.П. // ЖОХ. 2018. T. 88. Вып. 4. С. 631;
chem.201901187
Mikherdov A.S., Tiuftiakov N.Yu., Polukeev V.A.,
Boyarskii V.P. // Russ. J. Gen. Chem. 2018. Vol. 88. N. 4.
21. Mikherdov A.S., Kinzhalov M.A., Novikov A.S., Boyar-
P. 713. doi 10.1134/S1070363218040151
skiy V.P., Boyarskaya I.A., Dar’in D.V., Starova G.L.,
Kukushkin V.Yu. // J. Am. Chem. Soc. 2016. Vol. 138.
33. Михердов А.С., Орехова Ю.А., Боярский В.П. //
P. 14129. doi 10.1021/jacs.6b09133
ЖОХ. 2018. Т. 88. Вып. 10. С. 1677; Mikherdov A.S.,
Orekhova Yu.A., Boyarskii V.P. // Russ. J. Gen.
22. Kinzhalov M.A., Kashina M.V., Mikherdov A.S.,
Chem. 2018. Vol. 88. N. 10. P. 2119. doi 10.1134/
Mozheeva E.A., Novikov A.S., Smirnov A.S., Luzya-
S1070363218100158
nin K.V. // Angew. Chem. Int. Ed. 2018. Vol. 57.
P. 12785. doi 10.1002/anie.201807642
34. Stephens P.J., Devlin F.J., Chabalowski C.F., Frisch M.J //
J. Phys. Chem. 1994. Vol. 98. Vol. 11623. doi 10.1021/
23. Ivanov D.M., Kirina Y.V., Novikov A.S., Starova G.L.,
j100096a001
Kukushkin V.Y. // J. Mol. Struct. 2016. Vol. 1104. P. 19.
doi 10.1016/j.molstruc.2015.09.027
35. Sluch I.M., Miranda A.J., Elbjeirami O., Omary M.A.,
Slaughter L.M // Inorg. Chem. 2012. 51. P. 10728. doi
24. Bikbaeva Z.M., Ivanov D.M., Novikov A.S., Ananyev I.V.,
10.1021/ic301104a
Bokach N.A., Kukushkin V. Yu. // Inorg. Chem. 2017.
36. McKinnon J.J., Jayatilaka D., Spackman M.A. // Chem.
Vol. 56. P. 13562. doi 10.1021/acs.inorgchem.7b02224
Commun. 2007. P. 3814. doi 10.1039/b704980c
25. Christopherson J.C., Topic F., Barrett C.J., Friscic T. //
37. Kinzhalov M.A., Katkova, S.A., Doronina E.P., Novi-
Cryst. Growth Des. 2018. 18. Vol. P. 1245. doi 10.1021/
kov A.S., Eliseev I.I., Ilichev V. A., Kukinov A.A., Staro-
acs.cgd.7b01445
va G.L., Bokach N.A. // Z. Kristallogr. Cryst. Mater.
26. Cavallo G., Metrangolo P., Pilati T., Resnati G.,
2018. Vol. 233. P. 795. doi 10.1515/zkri-2018-2075
Terraneo G. // Cryst. Growth Des. 2014. Vol. 14.
38. Sicilia V., Fornies J., Casas J.M., Martin A., Lopez J.A.,
P. 2697. doi 10.1021/cg5001717
Larraz C., Borja, P., Ovejero C., Tordera D., Bolink H. //
27. Кинжалов М.А., Кашина М.В., Михердов А.С.,.
Inorg. Chem. 2012. Vol. 51. P. 3427. doi 10.1021/
Каткова С.А, Суслонов В.В. // ЖOX, 2018. T. 88.
ic201910t
Вып. 6. С. 1000; Kinzhalov M.A., Kashina M.V.,
39. Saegusa T., Kobayash.S, Ito Y., Yasuda N. // J. Am.
Mikherdov A.S., Katkova S. A., Suslonov V.V. // Russ.
Chem. Soc. 1968. Vol. 90. P. 4182. doi 10.1021/
J. Gen. Chem. 2018. Vol. 88. P. 1180. doi 10.1134/
ja01017a061
s107036321806021x
40. Chu C., Ayres J.A., Stefanescu D.M., Walker B.R.,
28. Кинжалов М.А., Золотарев А.А., Боярский В.П. //
Gorman C.B., Parsons G.N. // J. Phys. Chem. C. 2007.
ЖCХ. 2016. T. 57. № 4. C. 861; Kinzhalov M.A.,
Vol. 111. P. 8080. doi 10.1021/jp065377r
Zolotarev A.A., Boyarskiy V.P. // J. Struct. Chem. 2016.
Vol. 57. P. 822. doi 10.1134/s0022476616040302
41. Palatinus L., Chapuis G. // J. Appl. Crystallogr. 2007.
Vol. 40. P. 786. doi 10.1107/s0021889807029238
29. Kinzhalov M.A., Timofeeva S.A., Luzyanin K.V.,
Boyarskiy V.P., Yakimanskiy A.A., Haukka M.,
42. Sheldrick G.M. // Acta Crystallogr. 2008. Vol. 64. N 1.
Kukushkin V.Y. // Organometallics. 2016. Vol. 35.
P. 112. doi 10.1107/S0108767307043930
P. 218. doi 10.1021/acs.organomet.5b00936
43. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
30. Pawlak T., Niedzielska D., Vicha J., Marek R., Pazder-
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
ski L. // J. Organomet. Chem. 2014. Vol. 759. P. 58. doi
Vol. 42. P. 339. doi 10.1107/S0021889808042726
10.1016/j.jorganchem.2014.02.016
44. CrysAlisPro A.T., Version 1.171.36.20 (release 27-06-
31. Pazderski L., Pawlak T., Sitkowski J., Kozerski L.,
2012)
Szlyk E. // Magn. Reson. Chem. 2009. Vol. 47. P. 932.
45. Bondi A. // J. Phys. Chem. 1964. Vol. 68 P. 441. doi
doi 10.1002/mrc.2491
10.1021/j100881a503
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
598
КАТКОВА и др.
Synthesis of Cyclometallic Complex of Platinum(II)
with Alkynyl Substituted Isocyanide Ligand, Its Structure
and Photophysical Characteristics
S. A. Katkova*, A. A. Leshchev, A. S. Mikherdov, and M. A. Kinzhalov
St. Petersburg State University, St. Petersburg, 199034 Russia
*e-mail: sa_katkova@mail.ru
Received October 17, 2019; revised October 17, 2019; accepted October 21, 2019
The cyclometallic complex of platinum(II) [Pt(ppy)Cl(CNC6H4CCPh)] with phenylpyridine and
[4-(2-phenylethynyl)phenyl]isocyanide ligands was synthesized from dimer [Pt(ppy)Cl]2 and CNC6H4CCPh
isocyanide with yield of 90% The compound structure was characterized using mass spectrometry, IR and NMR
spectroscopy methods, as well as X-ray diffraction analysis. The photophysical parameters of the complex in
the solid phase were studied.
Keywords: platinum complexes, isocyanides, luminescence
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020