ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 4, с. 604-612
УДК 547.458.88
МЕТАЛЛОКОМПЛЕКСЫ
ФАРМАКОФОРСОДЕРЖАЩИХ ПЕКТИНОВ С ИОНАМИ
d-ЭЛЕМЕНТОВ (Cu2+, Co2+, Mn2+)
© 2020 г. Р. Х. Мударисоваa, А. Ф. Сагитоваb,*, О. С. Куковинецb, С. В. Колесовa
a Уфимский институт химии Уфимского исследовательского центра Российской академии наук, Уфа, 450054 Россия
b Башкирский государственный университет, ул. Мингажева 100, Уфа, 450014 Россия
*e-mail: alinusic93@mail.ru
Поступило в Редакцию 4 октября 2019 г.
После доработки 4 октября 2019 г.
Принято к печати 12 октября 2019 г.
Спектральными методами изучено комплексообразование яблочного пектина, модифицированного орга-
ническими фармакофорами (никотиновая, салициловая, 5-аминосалициловая, антраниловая кислоты), с
ионами Cu2+, Co2+, Mn2+ в водных растворах. Установлены состав и ряды устойчивости металлокомплек-
сов, которые соответствуют эмпирическому ряду Ирвинга-Уильямса. Рассчитаны стандартные термоди-
намические характеристики (ΔH°, ΔG°, ΔS°) процесса комплексообразования. Методами ЯМР 13С и ИК
спектроскопии показано, что взаимодействие фармакофорсодержащих пектинов с ионами d-металлов
(Cu2+, Co2+, Mn2+) осуществляется за счет карбонильных и гидроксильных групп модифицированных
полимерных матриц. Определены вязкостные и термические характеристики металлокомплексов.
Ключевые слова: комплексообразование, яблочный пектин, фармакофор, соли биогенных металлов,
константа устойчивости
DOI: 10.31857/S0044460X20040162
Важным источником новых фармацевтиче-
вышают функциональную активность полимерно-
ских субстанций и лекарств являются природные
го лиганда, что отражается на перераспределении
соединения, их производные и синтетические
электронной плотности, увеличении реакционной
аналоги, на основе которых, по разным оценкам,
способности, формировании новых структурных
создается большое количество фармакологически
образований, а также биологической активности
активных веществ. Среди этих соединений обра-
металлокомплексов [11-13]. Изучение особенно-
щает на себя внимание природный полисахарид
стей реакции образования систем металл-пектин-
пектин, повышенный интерес к которому связан
биологически активное низкомолекулярное соеди-
с его хорошо известным лечебно-профилактиче-
нение, т. е. определение констант устойчивости,
ским, диетическим и защитным действием [1-4].
структуры и состава комплексов, исследование
Путем комплексообразования пектина ионами
механизма их образования, а также влияние при-
металлов (биогенными микроэлементами) можно
роды металла, полимерного и низкомолекулярного
получить наноструктурные надмолекулярные си-
лигандов на процессы формирования комплексов
стемы металлокомплексов пектина, обладающих
представляет как теоретический, так и практиче-
рядом ценных физико-химических свойств [5-10].
ский интерес.
В последнее время перспективным представляет-
Ранее нами были установлены закономерно-
ся исследование полимерных металлокомплексов,
сти взаимодействия яблочного пектина, моди-
включающих низкомолекулярные органические
фицированного органическими фармакофорами,
лиганды. Очень часто в процессе комплексообра-
с катионами Cu(II) и Co(II) [12, 14]. В качестве
зования дополнительные лиганды значительно по-
органической низкомолекулярной компоненты
604
МЕТАЛЛОКОМПЛЕКСЫ ФАРМАКОФОРСОДЕРЖАЩИХ ПЕКТИНОВ
605
использованы никотиновая (HL1), салициловая
A
(HL2), 5-аминосалициловая (HL3) и антраниловая
(HL4) кислоты, обладающие фармакологической
активностью [15]. В целях расширения числа био-
генных металлов, включаемых в процессы ком-
плексообразования, в настоящей работе изучено
взаимодействие фармакофорсодержащего пектина
с катионами марганца(II) и проведен сравнитель-
pH
ный анализ влияния природы биогенного металла
Mn(II), Co(II) и Cu(II) и полимерного лиганда на
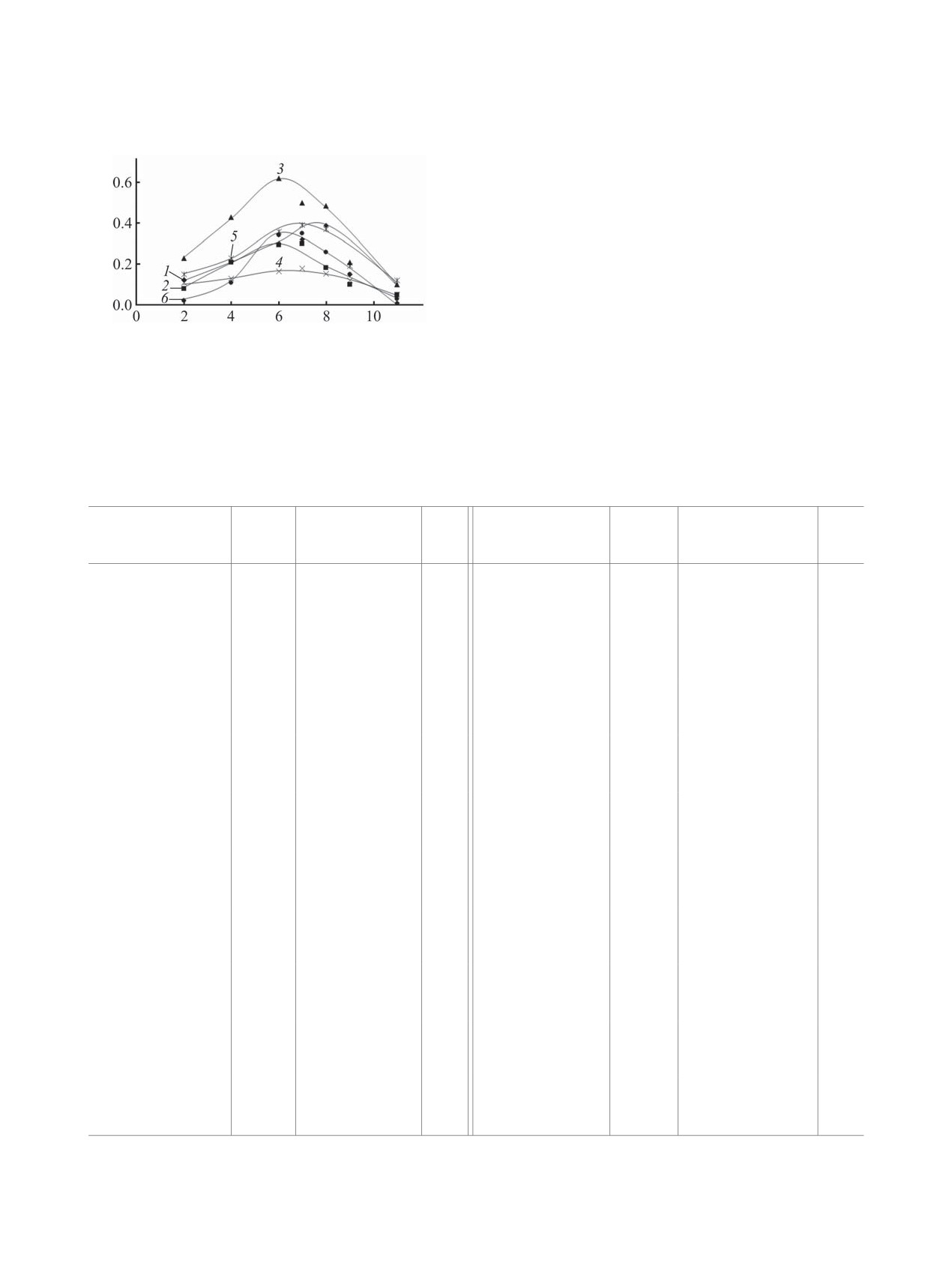
Рис. 1. Зависимость оптической плотности водных рас-
эффективность их взаимодействия.
творов комплексов фармакофорсодержащий пектин-
=
М(II) от рН. спектина = 1.0×10-3моль/л, сМе(II)
Спектры поглощения смесей соли металла(II) и
1.0×10-3моль/л, l = 1.0 см, t = 25°С. 1 - пектин-HL1-
фармакофорсодержащего пектина имеют различия
Cu2+, 2 - пектин-HL1-Co2+, 3 - пектин-HL1-Mn2+, 4 -
как в УФ, так и в видимой областях спектра в за-
пектин-HL2-Cu2+, 5 - пектин-HL2-Co2+, 6 - пектин-
HL2-Mn2+.
висимости от рН среды (табл. 1, рис. 1). При ком-
Таблица 1. Физико-химические характеристики свободного и фармакофорсодержащего пектина с ионами Мn2+, Со2+
и Cu2+
УФ
УФ
[η],
[η],
Образец
спектр,
ν, см-1
Образец
спектр,
ν, см-1
дл/г
дл/г
λ, нм
λ, нм
Пектин
-
3314 (ОН), 1740
2.59
Пектин-HL2-Cu2+
232, 299,
3185 (ОН), 1610
0.55
(С=О), 1149-
726
(СОО-), 1139-1013
1024 (С-О)
(С-О)
Пектин-Со2+
514
3200 (ОН), 1602
1.2
Пектин-HL2-Мn2+
236, 303
3293 (ОН), 1595
0.82
(СОО-), 1144-
(СОО-), 1143-1018
1018 (С-О)
(С-О)
Пектин-Cu2+
805
3307 (ОН), 1609
1.02
Пектин-HL4
240, 317
3304 (ОН), 1750
1.15
(СОО-), 1143-
(С=О), 1155-1015
1019 (С-О)
(С-О)
Пектин-Мn2+
228
3312 (ОН), 1602
1.81
Пектин-HL4-Со2+
243, 320,
3233 (ОН), 1614
0.24
(СОО-), 1145-
517
(СОО-), 1152-1037
1019 (С-О)
(С-О)
Пектин-HL3
226, 307
3305 (ОН), 1740
0.83
Пектин-HL4-Cu2+
331, 786
3276 (ОН), 1606
0.30
(С=О), 1140-
(СОО-), 1109-1018
1014 (С-О)
(С-О)
Пектин-HL3-Со2+
226,
3287 (ОН), 1602
0.42
Пектин-HL4-Мn2+
216, 324
3290 (ОН), 1590
0.36
306, 516
(СОО-), 1144-
(СОО-), 1153-1016
1017 (С-О)
(С-О)
Пектин-HL3-Cu2+
220,
3275 (ОН), 1606
0.40
Пектин-HL1
212, 265
3351 (ОН), 1718
0.81
310, 788
(СОО-), 1140-
(С=О), 1140-1070
1014 (С-О)
(С-О)
Пектин-HL3-Мn2+
228, 309
3291 (ОН), 1602
0.53
Пектин-HL1-Со2+
214, 267,
3337 (ОН), 1604
0.65
(СОО-), 1145-
526
(СОО-), 1152-1018
1017 (С-О)
(С-О)
Пектин-HL2
234, 301
3287 (ОН), 1744
0.92
Пектин-HL1-Cu2+
265, 787
3200 (ОН), 1612
0.71
(С=О), 1139-
(СОО-), 1142-1017
1017 (С-О)
(С-О)
Пектин- HL2-Со2+
237,
3219 (ОН), 1605
0.71
Пектин-HL1-Мn2+
214, 268
3330 (ОН), 1606
0.69
305, 512
(СОО-), 1146-
(СОО-), 1151-1018
1005 (С-О)
(С-О)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
606
МУДАРИСОВА и др.
Таблица 2. Элементный состав комплексов фармакофорсодержащего пектина с ионами Мn2+, Со2+ и Cu2+
Найдено, %
Вычислено, %
Соединение
С
Н
N
М2+
С
Н
N
М2+
Пектин-HL4-Мn2+
42.74
4.74
3.35
6.23
44.11
5.14
3.43
6.74
Пектин-HL3-Мn2+
40.83
4.65
3.24
6.14
42.46
5.18
3.30
6.48
Пектин-HL2-Мn2+
42.84
4.61
-
6.28
44.0
4.88
-
6.72
Пектин-HL3-Мn2+
41.22
4.56
3.01
6.35
42.65
4.82
3.55
6.98
Пектин-Мn2+
34.49
4.66
-
9.47
35.43
5.16
-
10.15
Пектин-HL4-Со2+
44.64
3.32
3.52
7.57
43.13
3.85
3.59
7.49
Пектин-HL3-Со2+
42.50
3.54
2.44
7.12
41.32
3.93
2.67
7.25
Пектин-HL2-Со2+
44.70
3.79
-
7.73
43.02
3.58
-
7.55
Пектин-HL1-Со2+
42.95
4.76
3.44
7.77
41.50
3.46
3.72
7.85
Пектин-Со2+
33.73
4.94
-
13.01
33.26
3.16
-
11.68
Пектин-HL4-Cu2+
43.29
4.89
3.25
7.64
43.66
5.09
3.39
7.70
Пектин-HL3-Cu2+
42.44
4.97
3.12
7.53
42.04
5.13
3.27
7.41
Пектин-HL2-Cu2+
43.21
4.17
-
7.71
43.55
4.84
-
7.68
Пектин-HL1-Cu2+
41.90
4.56
3.18
7.85
42.2
4.77
3.51
7.97
Пектин-Cu2+
33.68
5.19
-
11.08
34.9
5.08
-
11.50
плексообразовании в кислой среде катионы метал-
0.08 м. д. Уменьшение интенсивности и наиболее
ла и катионы водорода конкурируют за донорные
сильный сдвиг в слабое поле на 0.45 м. д. наблюда-
центры лиганда. Формирование максимума свето-
ется у сигнала атома углерода С8, принадлежащего
поглощения и возрастание оптической плотности
карбоксильной группе модифицированного пек-
происходит постепенно с понижением кислотно-
тина. При взаимодействии пектина, содержащего
сти растворов. Комплексообразование начинает-
никотиновую кислоту, с катионами Mn2+ в спектре
ся в кислой среде и продолжается до рН = 6-8 в
ЯМР 13С наблюдается смещение всех сигналов
ядер углерода 13С углеводного фрагмента фарма-
зависимости от природы исходных компонентов
кофорсодержащего пектина в сильное поле на
(рис. 1). Таким образом, при взаимодействии фар-
0.02-0.07 м. д. Кроме того, в спектре вместо сигна-
макофорсодержащего пектина с ионами метал-
ла свободного карбоксилат-аниона при 168.58 м. д.
лов(II) образуются комплексные соединения, что
появляется сигнал при 160.80 м. д., соответствую-
подтверждается смещением λmax в УФ спектрах и
щий координированному с ионом металла карбок-
увеличением интенсивности полос поглощения в
силат-аниону. Это однозначно свидетельствует о
сопоставлении с наблюдаемым для компонентов
том, что в связывании участвуют карбоксильные
системы (табл. 1).
группы лиганда.
Элементный состав металлокомплексов фарма-
С помощью метода ИК спектроскопии выяв-
кофорсодержащих пектинов представлен в табл. 2.
лены спектральные области, в которых наиболее
Для получения более полной информации о
заметно наблюдались различия в характере и ин-
структуре полученных металлокомплексов, из-
тенсивности полос поглощения фармакофорсо-
учены спектры ЯМР 13С на примере систем пек-
держащего пектина по сравнению с его металло-
тин-HL2-Cо2+ и пектин-HL1-Mn2+. При взаимо-
комплексами (табл. 1). Первая область изменений
действии пектина, содержащего салициловую
относится к полосам поглощения валентных ко-
кислоту, с ионами Cо2+ в спектре ЯМР 13С наблю-
лебаний гидроксильных групп, ассоциированных
даются сдвиги сигналов атомов углерода С1, С4
водородной связью (3400-3200 см-1). Значитель-
и С6 ароматического фрагмента полисахаридной
ный сдвиг полос поглощения в низкочастотную
матрицы в слабое поле на 0.08, 0.09 и 0.03 м. д.
область в присутствии катионов металлов (10-
соответственно и сдвиг сигнала углерода С5 на
150 см-1) свидетельствует о разрыве или ослабле-
0.24 м. д. Сигналы всех ядер углерода 13С углевод-
нии водородных связей в результате координации
ного фрагмента сдвигаются в сильное поле на 0.02-
катионов металлов к гидроксильным группам
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
МЕТАЛЛОКОМПЛЕКСЫ ФАРМАКОФОРСОДЕРЖАЩИХ ПЕКТИНОВ
607
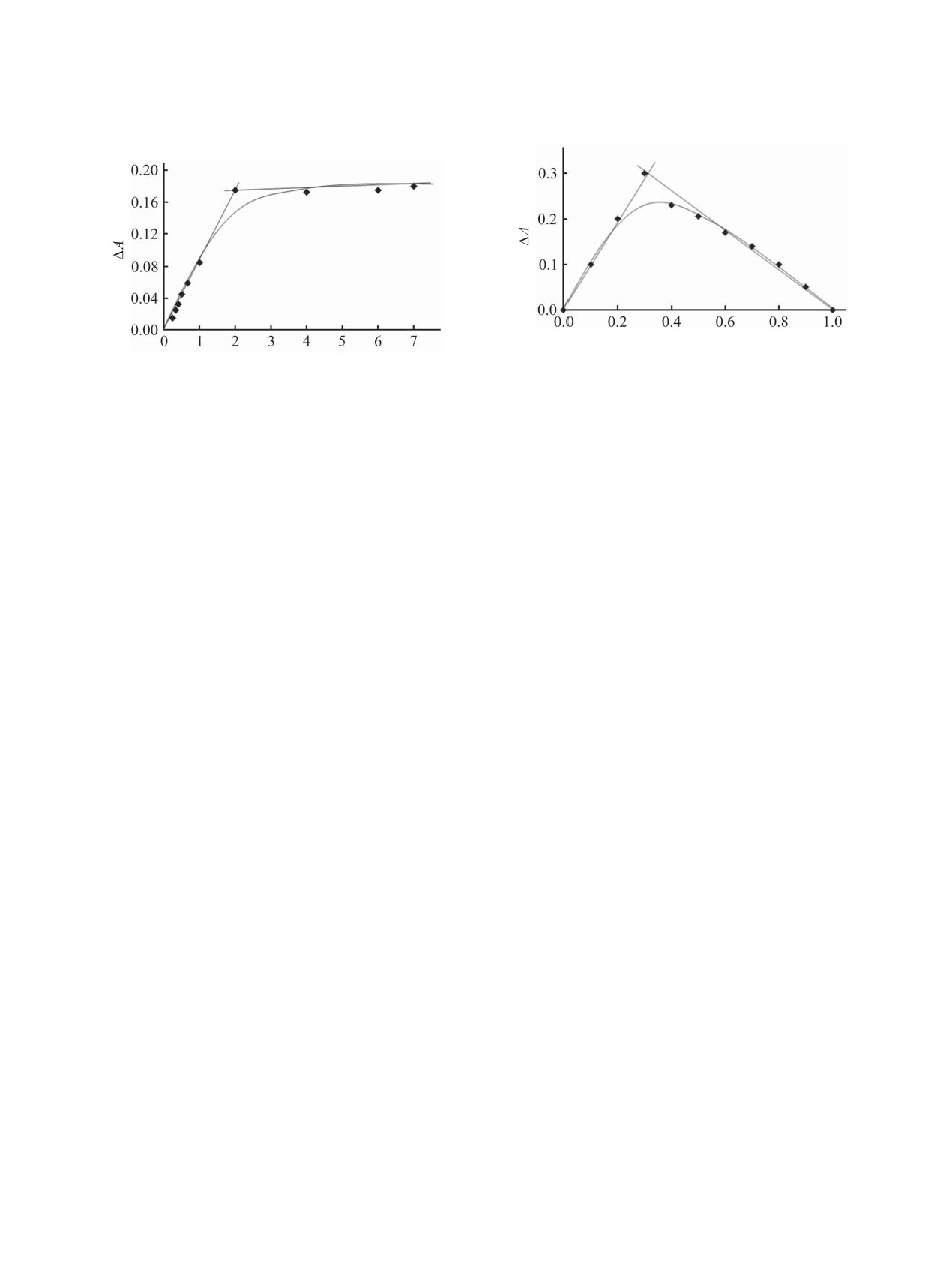
[Cu(II)]/>ɉɟɤɬɢɧ±+/1 + Cu(II)]
>ɉɟɤɬɢɧ±+/4]/[Mn(II)]
Рис. 3. Зависимость изменения оптической плотности
Рис. 2. Кривая насыщения смеси пектин-антраниловая
(∆А) от состава изомолярного раствора для смеси пек-
кислота с хлоридом марганца(II) при 25°С. спектин-HL4 =
тин-никотиновая кислота-Cu(II) при 25°С. спектин-HL1 =
1.0×10-4 моль/л, сMn(II) = 1.0×10-4 моль/л, λ = 324 нм, l =
1.0×10-3моль/л, сCu(II) = 1.0×10-3моль/л, λ = 787 нм, l =
1.0 см, растворитель - вода.
1.0 см, растворитель - вода.
фармакофорсодержащего пектина. Во второй об-
макофорсодержащего пектина приходится одна
ласти ИК спектров наблюдается исчезновение по-
молекула соли металла. Для всех исследуемых ме-
лос поглощения карбоксильных групп при 1740-
таллокомплексов рассчитаны константы устойчи-
1700 см-1 и появление характерной полосы погло-
вости и термодинамические характеристики про-
щения для карбоксианиона при 1590-1610 см-1. .В
цесса, представленные в табл. 3.
третьей из наблюдаемых областей в ИК спектрах
Металлокомплексы фармакофорсодержащих
металлокомплексов происходит изменение полос
пектинов по устойчивости можно расположить в
поглощения валентных колебаний С-О пираноз-
следующие последовательности:
ного цикла (1200-1000 см-1). Наблюдается высо-
пектин-HL1-Cu2+ > пектин-HL4-Cu2+ >
кочастотный сдвиг, обусловленный образованием
пектин-HL3-Cu2+ > пектин-HL2-Cu2+ > пектин-Cu2+
связи ионов указанных металлов с кислородным
пектин-HL3-Со2+ > пектин-HL1-Со2+ >
атомом пиранозного цикла. Известно, что кисло-
пектин-HL2-Со2+ > пектин-HL4-Со2+ > пектин-Со2+
родные атомы гидроксигрупп углеводов в области
пектин-HL1-Мn2+ > пектин-HL3-Мn2+ >
нейтрального и щелочного рН способны связы-
пектин-HL4-Мn2+ > пектин-HL2-Мn2+ > пектин-Мn2+.
вать металлы с образованием прочных хелатных
комплексов [16]. Таким образом, данные ЯМР 13С
Модификация пектина фармакофорами увели-
и ИК спектроскопии свидетельствуют о коорди-
чивает устойчивость образующихся металлоком-
национном взаимодействии свободного и фарма-
плексов меди(II) в 16-166 раз в зависимости от
кофорсодержащего пектина с катионами М2+ не
структуры модифицирующего агента, кобальта(II) -
только за счет СООН-групп, но и посредством ОН-
в 23-93 раза, марганца(II) - в 3-50 раз. Наибо-
групп полимерной матрицы.
лее устойчивыми являются комплексы пектин-
HL1-М2+, где модифицирующим пектин агентом
Анализ изменения поглощения, наблюдаемого
выступает никотиновая кислота. Известно, что
при добавлении неорганической соли к раствору
фармакофорсодержащего пектина в различных
фармакофор, содержащий гетероатом, приводит
концентрациях, позволил рассчитать состав и ве-
к структурированию полимерной матрицы пек-
личину константы устойчивости продуктов взаи-
тин-HL1 [18], что, возможно, и способствует су-
модействия методами мольных отношений и изо-
щественному повышению устойчивости металло-
молярных серий [17]. Графическая зависимость
содержащего комплекса на его основе. Наиболее
(рис. 2, 3) показывает присутствие в растворе
прочными пектинатами состава ML2 являются
комплексов фармакофорсодержащего пектина с
пектинаты Cu2+, наименее - Мn2+. Низкая устойчи-
ионами металла(II) состава 2:1, т. е. при образо-
вость пектинатов Мn2+ согласуется с данными ли-
вании комплекса на два элементарных звена фар-
тературы [16] для продуктов взаимодействия Мn2+
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
608
МУДАРИСОВА и др.
Таблица 3. Термодинамические характеристики комплексообразования свободного и фармакофорсодержащего пек-
тина с ионами Мn2+, Со2+ и Cu2+
Комплекс
lgβк
∆H°, кДж/моль
∆S°, Дж/(моль·K)
∆G°, кДж/моль
Пектин-Cu2+
2.8
-9.1±0.1
35.6±0.2
-19.8±0.1
Пектин-HL3-Cu2+
4.7
-4.0±0.2
87.0±0.1
-30.2±0.1
Пектин-HL2-Cu2+
4.0
-16.2±0.1
35.3±0.1
-26.8±0.1
Пектин-HL4-Cu2+
4.9
-15.3±0.2
50.2±0.1
-30.4±0.1
Пектин-HL1-Cu2+
5.0
-21.5±0.1
34.5±0.1
-31.9±0.1
Пектин-Со2+
2.7
-9.1±0.1
26.3±0.1
-17.1±0.1
Пектин-HL3-Со2+
4.8
-10.8±0.1
75.0±0.1
-33.4±0.1
Пектин-HL2-Со2+
4.4
-22.9±0.2
10.5±0.1
-26.0±0.1
Пектин-HL4-Со2+
4.2
-25.2±0.2
6.7±0.1
-27.8±0.1
Пектин-HL1-Со2+
4.7
-10.3±0.1
46.0±0.1
-27.2±0.1
Пектин-Мn2+
2.6
-7.6±0.1
25.9±0.2
-15.4±0.1
Пектин-HL3-Мn2+
3.7
-22.2±0.2
7.2±0.1
-24.4±0.2
Пектин-HL2-Мn2+
3.1
-13.8±0.1
35.2±0.2
-24.4±0.2
Пектин-HL4-Мn2+
3.2
-13.5±0.1
16.9±0.1
-18.6±0.1
Пектин-HL1-Мn2+
4.3
-8.2±0.1
84.9±0.2
-33.8±0.2
с полиолами, к числу которых относятся углеводы.
тацией центрального атома и лиганда. Таким обра-
Как следует из данных, представленных в табл. 3,
зом, взаимодействие сопровождается частичным
величины констант устойчивости металлоком-
разрушением сольватных оболочек реагентов, в
плексов соотносятся между собой таким образом,
результате чего большое количество воды высво-
что в большинстве случаев могут быть расположе-
бождается в объем растворителя, т. е. дегидрата-
ны в последовательности, соответствующей ряду
ция вносит определяющий вклад в термодинамику
Ирвинга-Уильямса [19].
комплексообразования. Опираясь на информацию
о структуре формирующихся комплексов, полу-
Корреляция между величинами ∆S° и ∆H° при
ченную из данных ИК, ЯМР 13С спектроскопии,
взаимодействии фармакофорсодержащего пекти-
и термодинамические характеристики, комплек-
на с катионами биогенных металлов представляет
сообразования можно предположить одинаковый
собой линейную зависимость изменения энталь-
пии от изменения энтропии при комплексообра-
механизм комплексообразования ионов d-элемен-
тов (Cu2+, Co2+, Mn2+) с фармакофорсодержащими
зовании. На ней имеется только одна область для
пектинами, содержащими в своем составе амино-,
всех исследуемых систем с отрицательными зна-
гидрокси- и карбоксильные группы, который при-
чениями ∆H° и положительными значениями ∆S°,
водит к образованию хелатных структур.
т. е. процессы комплексообразования являются
энтальпийно-энтропийно благоприятными (∆H° <
Термическая стабильность фармакофоров явля-
0, ∆S° > 0) и протекают самопроизвольно (∆G° <
ется важнейшей характеристикой, определяющей
0). Энтальпия в реакции образования металло-
условия хранения лекарственных веществ. Дан-
комплексов складывается, в основном, из вкладов
ные термического анализа образцов на примере
процессов разрыва связей центрального иона с
системы фармакофорсодержащий пектин-Cu2+
молекулами воды, вытеснения некоторого количе-
представлены в табл. 4. Видно, что комплексы пек-
ства молекул воды из гидратных оболочек лиганда
тин-Cu2+ и фармакофорсодержащий пектин-Cu2+
и образования связей между центральным ионом
характеризуются заметно более высокой терми-
и лигандом [20]. Экзотермичность комплексообра-
ческой стабильностью по сравнению с исходным
зования указывает на то, что образование связей
свободным и фармакофорсодержащим пектином:
между центральным ионом и лигандом - энталь-
температуры начала снижения массы (Тн) для ме-
пийно выгодный процесс, величина ∆H° которого
таллокомплексов близки и находятся в интервале
компенсирует затраты тепла, связанные с дегидра-
от 50 до 58°C, т. е. выше по сравнению со значени-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
МЕТАЛЛОКОМПЛЕКСЫ ФАРМАКОФОРСОДЕРЖАЩИХ ПЕКТИНОВ
609
Таблица 4. Термические свойства пектина и его комплексов с ионами Cu2+
Температурные интервалы
Потеря массы, %
Tmax, °С
Образец
разложения продуктов, °С
1
2
∆m1
∆m2
∆m300
1
2
Пектин
37-133
134–300
6.7
44.5
51.2
72
238
Пектин--HL2
32-134
135-300
3.2
67.0
70.2
65
201
Пектин--HL1
32-133
139-300
4.5
66.5
71.0
89
227
Пектин--HL4
36-128
114-300
3.0
46.5
49.5
66
191
Пектин--HL3
33-130
131-300
7.8
31.7
39.5
58
239
Пектин - Cu2+
50-177
178-233
7.7
34.7
42.4
94
262, 284
Пектин--HL2-Cu2+
55-147
148-223
7.4
4.8,
19.6
115
195, 295
224-300
7.4
Пектин--HL1-Cu2+
58-172
173-300
4.7
19.4
24.1
83
296
Пектин--HL4-Cu2+
50-182
183-300
6.6
25.2
31.8
91
272
Пектин--HL3-Cu2+
57-180
181-300
6.1
15.8
21.9
87
290
ями Тн для образцов, не содержащих металл. Коли-
с молекулами воды и с карбоксильными группами
чество низкомолекулярных продуктов, удаляемых
фармакофорсодержащего пектина для разрушения
из металлокомплексов на первой стадии процесса
которых требуется более высокая температура.
Δm1, в интервале температур от 50 до 182°С со-
Обнаружено, что характеристическая вязкость
ставляет 4.7-7.7%, т. е. сопоставимо со значением,
растворов пектиновых металлокомплексов ниже,
полученным для фармакофорсодержащего пек-
чем исходного и модифицированных пектинов
тина. Следует отметить существенное снижение
(табл. 1). Связывание ионов металла с полисаха-
параметра Δm2, характеризующего разложение
ридной матрицей уменьшает электростатическое
продуктов на второй стадии, наблюдаемое для ме-
отталкивание заряженных СОО--групп модифици-
таллокомплексов по сравнению с исходными фар-
рованного полианиона и, следовательно, размеры
макофорсодержащими пектинами. Как следствие,
макромолекулярного клубка. Наибольшее сниже-
общее снижение массы продуктов при 300°С для
ние характеристической вязкости наблюдается для
металлокомплексов на
17.6-60.6% меньше по
системы пектин-HL4 в присутствии ионов Со2+, а
сравнению с образцами, не содержащими медь.
наименьшее - для пектина в присутствии ионов
Причем наибольшей термической устойчивостью
Мn2+. Таким образом, обнаруженные изменения
характеризуются медные комплексы пектина, со-
вязкостных свойств комплексов могут быть связа-
держащие салициловую, 5-аминосалициловую и
ны с заметными структурными преобразованиями
никотиновую кислоты (Δm300 = 19.6, 21.9, 24.1%
макроцепей фармакофорсодержащего пектина в
соответственно), тогда как образец пектин-Cu2+
металлокомплексах.
имеет заметно более низкую термическую ста-
Таким образом, спектрофотометрическими
бильность (Δm300 = 42.4%). Значение максимумов
методами изучено взаимодействие фармакофор-
на кривых ДТГ (Тmax), которые характеризуют наи-
содержащего яблочного пектина с катионами не-
большую скорость разложения продуктов, на вто-
которых биогенных металлов (Cu2+, Co2+, Mn2+)
рой стадии для образцов фармакофорсодержащий
и определен состав образующихся металлоком-
пектин-Cu2+ на 51-81°C выше, чем для образцов,
плексов М2+:фармакофорсодержащий пектин =
не содержащих медь, т. е. процесс разложения
1:2. Обнаружено, что модификация пектина фар-
медьсодержащих продуктов смещен в область
макофорами увеличивает устойчивость металло-
более высоких температур. Анализ полученных
комплексов в 3-166 раз в зависимости от природы
результатов показывает, что металлокомплексы
компонентов системы. Показано, что константы
фармакофорсодержащего пектина по сравнению
устойчивости металлокомплексов уменьшаются
с исходными полимерными матрицами характе-
в ряду Cu2+ > Co2+ > Mn2+ и соответствуют эмпи-
ризуются большей термостабильностью, что об-
рическому ряду Ирвинга-Уильямса, что позволяет
условлено более прочной связью ионов металлов
прогнозировать устойчивость металлокомплексов
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
610
МУДАРИСОВА и др.
при модифицировании структур лигандов. Уста-
го пектина с катионами металлов(II) определяли
новлено, что при взаимодействии фармакофор-
спектрофотометрическими методами изомоляр-
содержащих пектинов с катионами биогенных
ных серий и мольных отношений [17]. Суммарная
металлов образуются энтальпийно-энтропийно
концентрация компонентов в изомолярной серии
стабилизированные металлокомплексные соеди-
составляла 1.0×10-3 моль/л. В сериях растворов с
нения. Введение в фармакофорсодержащий пек-
постоянной концентрацией катиона металла(II),
тин неорганической компоненты во всех случаях
равной 1.0×10-3 моль/л, концентрацию пектина и/
приводит к снижению характеристической вяз-
или фармакофорсодержащего пектина изменяли
кости образцов, что обусловлено структурными
от 0.25×10-4 до 1×10-2 моль/л. Постоянство ион-
преобразованиями макроцепей биополимера в
ной силы поддерживали 0.1 М. раствором NaCl
металлокомплексах. Метод термического анализа
или Na2SO4.
выявил термостабильные свойства металлоком-
Общая методика получения металлосодер-
плексов фармакофорсодержащего пектина.
жащего комплекса. К раствору пектина и/или
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
фармакофорсодержащего пектина объемом 20 мл
прибавляли при 50°С и перемешивании в течение
В экспериментах использовали яблочный пек-
1.0-1.5 ч 0.1 М. раствор NaOH в дистиллирован-
тин товарной марки Unipectine XPP 240 с моле-
ной воде в количестве 0.1 г щелочи на 0.2 г пекти-
кулярной массой 21000 Да и степенью этери-
фицирования 66%; MnCl2·4H2O, CuSO4·5H2O и
на и/или фармакофорсодержащего пектина, затем
СоCl2·6H2O марки ХЧ; никотиновую, салицило-
добавляли раствор соли двухвалентного металла с
вую, 5-аминосалициловую и антраниловую кисло-
концентрацией 0.01 моль/л. Через 30 мин целевой
ты марки ЧДА. Синтез и идентификация фармако-
продукт осаждали ацетоном, центрифугировали,
форсодержащих пектинов описаны в работе [18].
промывали этиловым спиртом, затем диэтиловым
эфиром и сушили при 40-50°С в вакууме [22].
Спектры ЯМР 13C растворов образцов в D2O
Все синтезированные вещества анализировали на
регистрировали на спектрометре Bruker Avance III
медь, кобальт и марганец [23, 24], азот, углерод и
500 MHz. ИК спектры образцов регистрировали на
спектрометре Shimadzu IR Prestige-21 (400-4000
водород на анализаторе марки EUKO EA-3000.
см-1, вазелиновое масло). Электронные спектры
ФОНДОВАЯ ПОДДЕРЖКА
поглощения водных растворов соединений опре-
Работа выполнена в рамках программы фунда-
деляли в кварцевых кюветах толщиной 1 см от-
ментальных научных исследований государствен-
носительно воды на спектрофотометре Specord
M-40 в области 220-900 нм. Показатель рН среды
ных академий на 2019-2021 годы (госзадание
растворов контролировали на pH-метре АНИОН
№ АААА-А17-117011910026-3) с использованием
4100. Основная абсолютная погрешность рН со-
оборудования Центра коллективного пользования
ставляла ±0.01. Необходимое значение рН среды
«Химия» Уфимского института химии Уфимского
раствора создавали добавлением растворов HCl,
федерального исследовательского центра РАН.
Н2SO4 и NaOH. Характеристическую вязкость во-
КОНФЛИКТ ИНТЕРЕСОВ
дных растворов образцов измеряли при 30±1°С в
вискозиметре Уббелоде с висячим уровнем [21].
Авторы заявляют об отсутствии конфликта ин-
Для изучения термического разложения образцов
тересов.
использован метод совмещенного термического
СПИСОК ЛИТЕРАТУРЫ
анализа (термогравиметрия-дифференциальная
1. Марков П.А., Попов С.В., Никитина И.Р., Оводова Р.Г.,
сканирующая калориметрия). Измерения проводи-
Оводов Ю.С. // Химия растительного сырья. 2010.
ли на приборе синхронного термического анализа
№ 1. С. 21; Markov P.A., Popov S.V., Nikitina I.R.,
ТГА-ДСК Mettler Toledo в среде воздуха при ско-
Ovodova R.G., Ovodov Y.S. // Russ. J. Bioorg. Chem.
рости нагревания 5 K/мин в интервале температур
2011. Vol. 37.Р. 817. doi 10.1134/S1068162011070132
от 25 до 300°C.
2. Донченко Л.В., Фирсов Г.Г. Пектин: основные свой-
Состав образующихся соединений при взаимо-
ства, производство и применение. М.: ДеЛи, 2007.
действии пектина и/или фармакофорсодержаще-
276 с.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
МЕТАЛЛОКОМПЛЕКСЫ ФАРМАКОФОРСОДЕРЖАЩИХ ПЕКТИНОВ
611
3. Sriamornsak P. // Univ. Int. J. 2003. Vol. 3. N 1-2.
Iozep A.A., Moskvin A.V. // Pharm. Chem. J. 2009.
Р. 206.
Vol. 43. N 6. P. 341. doi 10.1007/s11094-009-0292-1
4. Sharma R., Ahuja M. // Carbohydr. Polym. 2011. Vol. 85.
14. Сагитова А.Ф., Мударисова Р.Х., Куковинец О.С. //
P. 658. doi 10.1016/j.carbpol.2011.03.034
ЖОХ. 2019. Т. 89. № 7. С. 1079; Sagitova A.F.,
5. Tomihiro М., Akira N., Kiyoshi E. // British J. Nutr.
Mudarisova R.Kh., Kukovinets O.S. // Russ. J. Gen.
2011. Vol. 106. Р. 73. doi 10.1017/S0007114510005842
Chem. 2017. Vol. 89. N 7. P. 1433. doi 10.1134/
6. Minzanova S.T., Mironov V.F., Vyshtakalyuk A.B.,
S1070363219070132
Tsepaeva O.V., Mironova L.G., Mindubaev A.Z.,
15. Машковский М.Д. Лекарственные средства. М.: Ме-
Nizameev I.R., Kholin K.V., Milyukov V.A. // Carbohydr.
дицина, 1984. Т. 2. 405 с.
Polym. 2015. Vol. 134. P. 524. doi 10.1016/j.
16. Алексеев Ю.Е., Гарновский А.Д., Жданов Ю.А. //
carbpol.2015.07.034
Усп. хим. 1998. Т. 67. № 8. С. 723; Alekseev Yu.E.,
7. Максудова Ш.Д., Милушева Р.Ю., Холмуминов А.А.,
Garnovskii A.D., Zhdanov Yu.A. // Russ. Chem.
Рашидова С.Ш. // ХПС. 2010. № 5. С. 576; Maksudova
Rev. 1998. Vol. 67. N 8. P. 649. doi 10.1070/
Sh.D., Milusheva R.Yu., Kholmuminov A.A., Rashidova
RC1998v067n08ABEH000343
S.Sh. // Chem. Nat. Compd. 2010. Vol. 46. N 5. Р. 677.
17. Булатов М.И., Калинкин И.П. Практическое руко-
doi 10.1007/s10600-010-9714-2
8. Минзанова С.Т., Миронов В.Ф., Миронова Л.Г.,
водство по фотометрическим методам анализа. Л.:
Немтарев А.В., Выштакалюк А.Б., Холин К.В., Ни-
Химия, 1986. 432 с.
замеева Г.Р., Милюков В.А. // Изв. АН. Сер. хим.
18. Куковинец О.С., Мударисова Р.Х., Володина В.П.,
2019. Т. 68. № 1. С. 48; Minzanova S.T., Mironov V.F.,
Тарасова А.В., Мокина А.З., Абдуллин М.И. // ХПС.
Mironova L.G., Nemtarev A.V., Vyshtakalyuk A.B.,
2014. № 1. С. 48; Kukovinets O.S., Mudarisova R.K.,
Kholin K.V., Nizameeva G.R., Milyukov V.A. // Russ.
Volodina V.P., Tarasova A.V., Mokina A.Z., Abdul-
Chem. Bull. 2019. Vol. 68. N 1. P. 48. doi 10.1007/
lin M.I. // Chem. Nat. Compd. 2014. Vol. 50. N 1. Р. 50.
s11172-019-2414-6
doi 10.1007/s10600-014-0864-5
9. Miyada T., Nakajima A., Ebihara K. // British J. Nutr.
19. Умланд Ф., Янсен А., Тириг Д., Вюнш Г. Комплекс-
2011. Vol. 106. Р. 73. doi 10.1017/S0007114510005842
ные соединения в аналитической химии. Теория и
10. Dutta R.K. Sahu S. // Eur. J. Pharm. Biopharm. 2012.
практика применения. М.: Мир, 1975. 531 с.
Vol. 82. N 1. P. 58. doi 10.1016/J.ejpb.2012.05.007
20. Эндрюс Л., Кифер Р. Молекулярные комплексы в
11. Феофанова М.А., Францева Ю.В., Журавлев Е.В.,
органической химии. М.: Мир, 1967. 206 с.
Рясенский С.С., Баранова Н.В. // ЖФХ. 2013. Т. 87.
21. Рафиков С.Р., Будтов В.П., Монаков Ю.Б. Введение
№ 8. С. 1432; Feofanova M.A., Frantseva Y.V.,
в физикохимию растворов полимеров. М.: Наука,
Zhuravleva Yu.V., Zhuravlev E.V, Ryasensky S.S.,
1978. 328 с.
Baranova N.V. // Russ. J. Phys. Chem. 2013. Vol. 87.
22. Миронов В.Ф., Карасева А.Н., Цепаева О.В., Вышта-
N 8 P. 1417. doi 10.1134/S0036024413080116
калюк А.Б., Минзанова С.Т., Морозов В.И., Карлин
12. Куковинец О.С., Мударисова Р.Х., Сагитова А.Ф.,
В.В., Юнусов Э.Р., Миндубаев А.З. // Химия и ком-
Абдуллин М.И. // ЖОХ. 2017. Т. 87. № 4. С. 645;
Kukovinets O.S., Mudarisova R.Kh., Sagitova A.F,
пьютерное моделирование. Казань. 2003. С. 45.
Abdullin M.I. // Russ. J. Gen. Chem. 2017. Vol. 87.
23. Золотов Ю.А. Основы аналитической химии. Прак-
N 4. P. 778. doi 10.1134/S1070363217040181
тическое руководство. М.: ВШ, 2001. 463 с.
13. Сибикина О.В., Иозеп А.А., Москвин А.В. // Хим.-
24. Korenman I.M. New titrometric metohds. M.:
фарм. ж. 2009. Т. 43. № 6. С. 35; Sibikina O.V.,
Chemistry, 1983. 173 p.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
612
МУДАРИСОВА и др.
Metal Complexes of Pharmacophore-Containing Pectin
with d-Elements Ions (Cu2+, Co2+, Mn2+)
R. Kh. Mudarisovaa, A. F. Sagitovab,*, O. S. Kukovinetsb, and S. V. Kolesova
a Ufa Institute of Chemistry, Ufa Federal Research Center of the Russian Academy of Sciences, Ufa, 450054 Russia
b Bashkir State University, Ufa, 450078 Russia
*e-mail: alinusic93@mail.ru
Received October 4, 2019; revised October 4, 2019; accepted October 12, 2019
Spectral methods were used to study the complexation of apple pectin modified with organic pharmacophores
(nicotinic, salicylic, 5-aminosalicylic, anthranilic acids) with Cu2+, Co2+, Mn2+ ions in aqueous solutions. The
composition and stability series of metal complexes, which correspond to the empirical Irving-Williams series,
are established. The standard thermodynamic characteristics (ΔH°, ΔG°, ΔS°) of the complexation process are
calculated. It was shown by 13C and IR NMR that the interaction of pharmacophore-containing pectins with
d-metal ions (Cu2+, Co2+, Mn2+) is carried out due to the carbonyl and hydroxyl groups of the modified polymer
matrices. The viscous and thermal characteristics of metal complexes are determined.
Keywords: complexation, apple pectin, pharmacophore, biogenic metal salts, stability constant
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020