ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 4, с. 642-644
ПИСЬМА
В РЕДАКЦИЮ
УДК 547.854.83
ОСОБЕННОСТИ ВЗАИМОДЕЙСТВИЯ
6-МЕТИЛ-2S-ЗАМЕЩЕННЫХ ПИРИМИДИН-4-ОЛОВ
С РЕАКТИВОМ ВИЛЬСМАЙЕРА-ХААКА
© 2020 г. Е. С. Офицерова*, А. А. Шкляренко, И. П. Яковлев
Санкт-Петербургский химико-фармацевтический университет Министерства здравоохранения России,
ул. Профессора Попова 14/А, Санкт-Петербург, 197376 Россия
*е-mail: OfizerovaES@mail.ru
Поступило в Редакцию 1 ноября 2019 г.
После доработки 1 ноября 2019 г.
Принято к печати 21 декабря 2019 г.
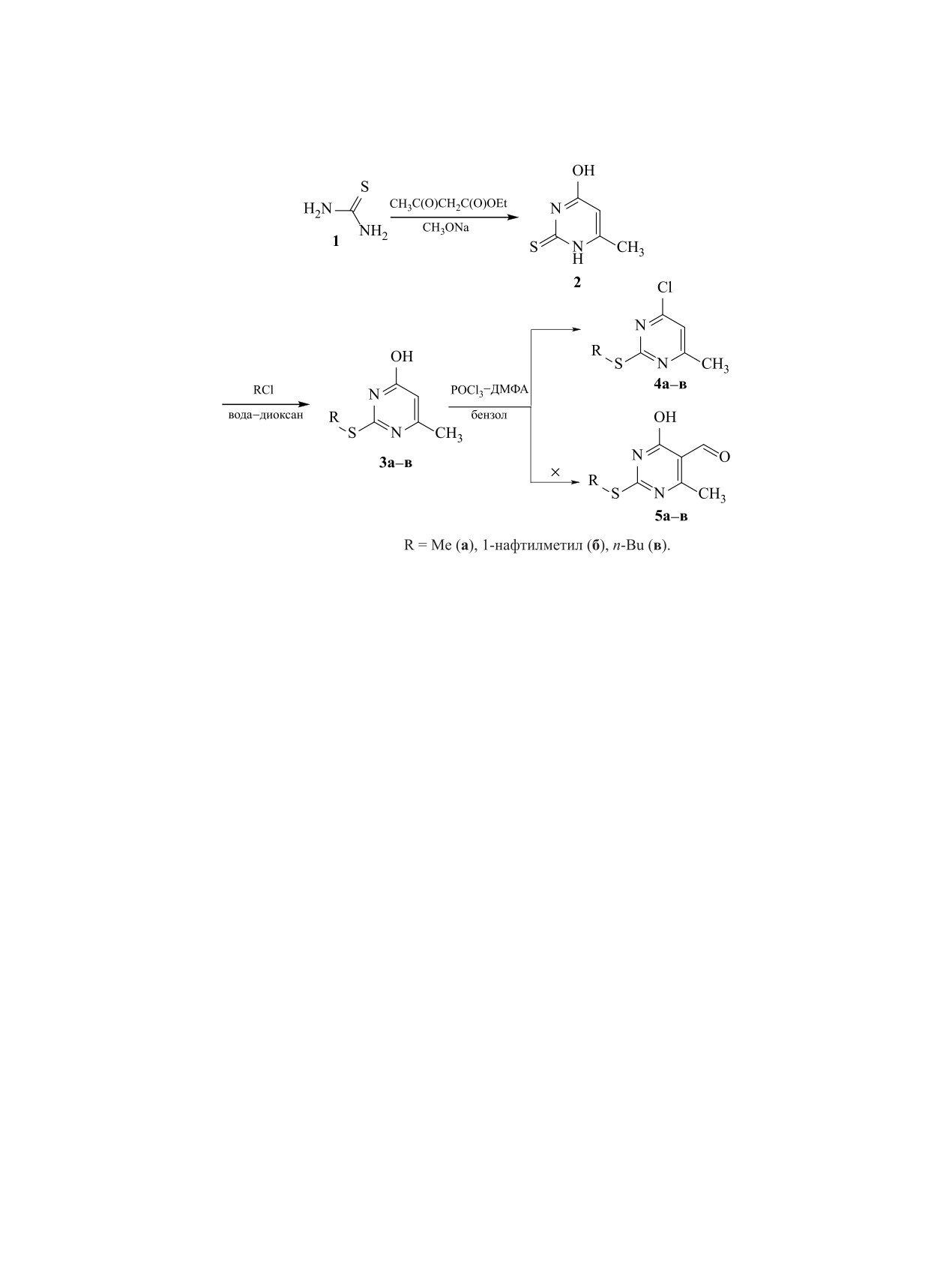
Формилирование 6-метил-2S-замещенных пиримидин-4-олов в условиях реакции Вильсмайера-Хаака
приводит к образованию продуктов нуклеофильного замещения гидроксигруппы. Образование ожида-
емых продуктов формилирования не происходит.
Ключевые слова: формилирование, реактив Вильсмайера-Хаака, 6-метил-2S-замещенные пирими-
дин-4-олы
DOI: 10.31857/S0044460X20040216
Введенная в молекулу органического соеди-
получения новых полигетероциклических струк-
нения карбонильная группа является удобным
тур [6].
инструментом для построения аннелированных
Особого внимания заслуживают 6-метил-2S-
гетероциклических структур
[1], проявляющих
замещенные пиримидин-4-олы
3a-в, получен-
широкий спектр фармакологических свойств [2].
ные взаимодействием тиомочевины 1 с ацетоук-
Наиболее приемлемым способом получения аль-
сусным эфиром [7] с последующим алкилирова-
дегидов является формилирование по Раймеру-
нием по атому серы (схема 1). Как и в случае с
Тиману или по методу Вильсмайера-Хаака.
2S-замещенной тиобарбитуровой кислотой, введе-
Применение реактива Вильсмайера-Хаака
ние формильной группы проводили в условиях ре-
(POCl3-ДМФА) для формилирования большин-
акции Вильсмайера-Хаака с избытком хлорокиси
ства ароматических и гетероароматических сое-
фосфора [4, 5]. Было выявлено, что независимо от
динений достаточно изучено и описано в литера-
величины избытка хлорокиси фосфора протекает
туре [3]. В качестве субстратов для проведения
только нуклеофильное замещение гидроксигруп-
реакции формилирования особое место занима-
пы в молекуле исходного 6-метил-2S-замещенно-
ют производные полиоксипиримидинов. Так, при
го пиримидин-4-ола 3а-в, а образующееся хлор-
формилировании
2S-замещенных производных
производное 4а-в в реакцию формилирования не
тиобарбитуровых кислот [4, 5] одновременно с
вступает.
образованием целевого соединения происходит
параллельное нуклеофильное замещение одной
Общая методика S-алкилирования 4-гидрок-
или нескольких гидроксигрупп пиримидинового
си-6-метилпиримидин-2(1Н)-тиона
(2). Смесь
кольца. Синтезированные таким образом соедине-
5.0 г (35.2 ммоль) 4-гидрокси-6-метилпирими-
ния представляют собой интересные синтоны для
дин-2(1Н)-тиона 2 и 0.8 г (35.2 ммоль) гидроксида
642
ОСОБЕННОСТИ ВЗАИМОДЕЙСТВИЯ 6-МЕТИЛ-2S-ЗАМЕЩЕННЫХ ПИРИМИДИН-4-ОЛОВ
643
Схема 1.
натрия, растворенного в 10 мл воды, перемешива-
м (2Н, СН2), 2.16 с (3Н, СН3), 3.11 т (2Н, SСН2,
ли до полного растворения осадка, затем добавля-
JHH = 7.3 Гц), 5.94 с (1Н, пиримидин), 12.42 уш. c
ли алкилирующий агент (42.24 ммоль), растворен-
(1H, ОН). Найдено, %: C 54.51; H 7.11; N 14.15; O
ный в 10 мл диоксана. Полученную эмульсию пе-
8.08. C9H14N2OS. Вычислено, %: C 54.52; H 7.12;
ремешивали при комнатной температуре в течение
N14.13; O 8.07.
12 ч. Осадок отфильтровывали и сушили.
Общая методика формилирования
6-ме-
6-Метил-2-(метилтио)пиримидин-4-ол
(3a).
тил-2S-замещенных пиримидин-4-олов
3a-в.
Выход 80%, белый порошок, т. пл. 180-182°С
К суспензии
6-метил-2S-замещенного пирими-
(возг.). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 2.16 с
дин-4-ола 3 (2.5 ммоль) в 7.5 мл бензола при ох-
(3Н, СН3), .2.46 с (3Н, SСН3), 5.96 с (1Н, пирими-
лаждении добавляли 5 ммоль диметилформамида
дин), 12.44 уш. c (1H, ОН). Найдено, %: C 46.11; H
и 7.5 ммоль хлорокиси фосфора. Реакционную
5.12; N 17.91; O 10.23. C6H8N2OS. Вычислено, %:
массу выдерживали при 78-80°С в течение 8 ч.
C 46.13; H 5.16; N 17.93; O 10.24.
После охлаждения добавляли мелкорасколотый
лед (50 г), затем перемешивали 1 ч. Осадок от-
6-Метил-2-[(1-нафтилметил)тио]пирими-
фильтровывали и сушили.
дин-4-ол (3б). Выход 75%, белый порошок, т. пл.
200-202°С (возг.). Спектр ЯМР 1Н (ДМСО-d6), δ,
6-Метил-2-(метилтио)-4-хлорпиримидин
м. д.: 2.27 с (3Н, СН3), 4.90 с (2Н, SСН2), 6.04 с
(4a). Выход 80%, белый порощок, т. пл. 30-31°С.
(1Н, пиримидин), 7.44-7.48 м (1Н, НAr), 7.54-7.62
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 2.44 с (3Н, СН3),
м (2Н, НAr), 7.67-7.69 м (1Н, НAr), 7.87-7.89 м
2.55 с (3Н, СН3), 6.86 с (1Н, пиримидин). Найдено,
(1Н, НAr), 7.95-7.97 м (1Н, НAr), 8.13-8.15 м (1Н,
%: C 41.24; H 4.02; N 16.02. C6H7ClN2S. Вычислено,
НAr), 12.51 уш. c (1H, ОН). Найдено, %: C 68.03; H
%: C 41.26; H 4.04; N 16.04.
5.07; N 9.95; O 5.66. C16H14N2OS. Вычислено, %: C
6-Метил-2-[(1-нафтилметил)тио]-4-хлорпи-
68.06; H 5.00; N 9.92; O 5.67.
римидин (4б). Выход 70%, белый порощок, т. пл.
2-(Бутилтио)-6-метилпиримидин-4-ол
(3в).
110-112°С. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 2.46
Выход 67%, белый порошок, т. пл. 85-86°С. Спектр
с (3Н, СН3), 4.92 с (2Н, SСН2), 6.89 с (1Н, пирими-
ЯМР 1Н (ДМСО-d6), δ, м. д.: 0.91 т (3Н, СН2СН3,
дин), 7.40-7.46 м (1Н, НAr), 7.51-7.60 м (2Н, НAr),
JHH = 7.3 Гц), 1.35-1.44 м (2Н, СН2), 1.58-1.66
7.68-7.69 м (1Н, НAr), 7.81-7.83 м (1Н, НAr), 7.88-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
644
ОФИЦЕРОВА и др.
7.90 м (1Н, НAr), 8.16-8.18 м (1Н, НAr). Найдено, %:
2. Schenone S., Bruno O., Bondavalli F., Ranise A., Mosti L.,
C 63.88; H 4.37; N 9.29. C16H13ClN2S. Вычислено,
Menozzi G., Fossa P., Manetti F., Morbidelli L.,
%: C 63.89; H 4.36; N 9.31.
Trincavelli L., Martini C., Lucacchini A. // Eur. J.
2-(Бутилтио)-6-метил-4-хлорпиримидин
Med. Chem. 2004. Vol. 39. P. 153. doi 10.1016/j.
(4в). Выход 70%, светло-желтый порошок, т. пл.
ejmech.2003.11.007
26-27°С. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 0.92
3. Rajput A.P., Girase P.D. // Int. J. Pharm. Chem. Biol.
т (3Н, СН3СН2, JHH = 7.3 Гц), 1.40-1.49 м (2Н,
Sci. 2012. Vol. 3. P. 25.
СН2CH2), 1.64-1.71 м (2Н, СН2CH2), 2.4 с (3Н,
СН3), 3.11 т (2Н, СН2S, JHH = 7.3 Гц), 6.81 с (1Н,
4. Офицерова Е.С., Шкляренко А.А., Федорова Е.В.,
пиримидин). Найдено, %: C 49.86; H 6.03; N 12.92.
Яковлев И.П. // ЖОРХ. 2016. Вып. 52. С. 1382; Ofit-
C9H13ClN2S. Вычислено, %: C 49.88; H 6.05; N
serova E.S., Shklyarenko A.A., Yakovlev I.P., Fedoro-
12.93.
va E.V. // Russ. J. Org. Chem. 2016. Vol. 52. P. 1374.
Спектры ЯМР 1Н регистрировали на спектро-
doi 10.1134/S1070428016090256
метре Bruker в DPX-400 с рабочей частотой 400
5. Офицерова Е.С., Шкляренко А.А., Яковлев И.П. //
МГц, используя в качестве стандарта сигнал рас-
Журнал регистрации и разработки лекарственных
творителя.
средств. 2017. Вып.1. С. 112.
КОНФЛИКТ ИНТЕРЕСОВ
6. Vignaroli G., Mencarelli M., Sementa D., Crespan E.,
Авторы заявляют об отсутствии конфликта
Kissova M., Maga G., Schenone S., Radi M., Botta M. //
интересов.
ACS Comb. Sci. 2014. Vol. 16. P. 168. doi 10.1021/
СПИСОК ЛИТЕРАТУРЫ
co500004e
7. Pivazyan V.A., Ghazaryan E.A., Shainova R.S.,
1. Ali T.E., Ibrahim M.A., El-Gendy Z.M., El-Amin E.M. //
Synth. Commun. 2013. Vol. 43. P. 3329. doi
Tamazyan R.A., Ayvazyan A.G., Yengoyan A.P // J. Chem.
10.1080/00397911.2013.783074
2017. Vol. 2017. P. 1. doi 10.1155/2017/8180913
Some Features of The Reaction of 6-Methyl-2S-substituted
Pyrimidin-4-ols with the Vilsmeier-Haack Reagent
E. S. Ofitserova*, A. A. Shklyarenko, and I. P. Yakovlev
St. Petersburg Chemical and Pharmaceutical University of the Ministry of Health of Russia, St. Petersburg, 197376 Russia
*e-mail: OfizerovaES@mail.ru
Received November 1, 2019; revised November 1, 2019; accepted December 21, 2019
Formylation of 6-methyl-2S-substituted pyrimidin-4-ols under the conditions of the Vilsmeier-Haack reaction
leads to the formation of nucleophilic substitution products of the hydroxyl group. The formation of the expected
formylation products does not occur.
Keywords: formylation, Vilsmeier-Haack reagent, 6-methyl-2S-substituted pyrimidin-4-ol
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020