ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 4, с. 650-653
ПИСЬМА
В РЕДАКЦИЮ
УДК 547.867.3
СИНТЕЗ НОВЫХ 2-ЗАМЕЩЕННЫХ
5-ГИДРОКСИПИРАНО[2,3-d][1,3]ОКСАЗИН-
4,7-ДИОНОВ
© 2020 г. В. О. Комиссарова,*, Н. М. Чернова, Г. Л. Староваb, Т. Л. Семаковаа,
Г. В. Ксенофонтоваа, В. Э. Захса, И. П. Яковлева
а Санкт-Петербургский государственный химико-фармацевтический университет,
ул. Профессора Попова 14/А, Санкт-Петербург, 197376 Россия
b Санкт-Петербургский государственный университет, Санкт-Петербург, 198504 Россия
*e-mail: vladimir.olegovich51@gmail.com
Поступило в Редакцию 5 февраля 2020 г.
После доработки 7 февраля 2020 г.
Принято к печати 8 февраля 2020 г.
Взаимодействие амидов карбоновых кислот с малонилхлоридом в среде ацетонитрила или тетрагидрофу-
рана без нагревания приводит к образованию неизвестных ранее 2-замещенных 5-гидроксипирано[2,3-d]-
[1,3]оксазинов. Методами масс-спектрометрии высокого разрешения, спектроскопии ЯМР и рентгено-
структурного анализа установлена структура полученных соединений.
Ключевые слова: пирано[2,3-d][1,3]оксазин, малонилхлорид, рентгеноструктурный анализ
DOI: 10.31857/S0044460X2004023X
Оксопроизводные 1,3-оксазинов являются цен-
кислот 2а-з с малонилхлоридом 1 в мольном со-
ными реагентами для органического синтеза. Имея
отношении 1:2, в среде ацетонитрила или тетра-
в своей структуре три электрофильных центра,
гидрофурана при 20-25°C. В качестве продуктов
1,3-оксазин-4-оны при взаимодействии с нуклео-
реакции были выделены соединения, охарактери-
фильными реагентами приводят к разнообразным
зованные с помощью масс-спектрометрии высоко-
ациклическим и гетероциклическим соединениям,
го разрешения и спектров ЯМР. Согласно данным
таким как, например, малонамовые кислоты, обла-
масс-спектрометрии, полученные соединения об-
дающие гипотензивным действием [1] и 1,2,4-три-
азолы, обладающие противовирусным действием
[2]. С другой стороны, малоизученной группой
являются родственные конденсированные струк-
туры - пираноксазины.
Ранее Циглер с соавторами [3] показали, что
при взаимодействии амидов карбоновых кислот
2а, б с малонилхлоридом 1 образуются 2-заме-
щенные 4-гидроксипирано[3,4-e][1,3]оксазин-5,7-
дионы 3а, б (схема 1). Реакцию проводили в
довольно жестких условиях: без растворителя и
при нагревании реакционной смеси.
Продолжая исследования в данной области,
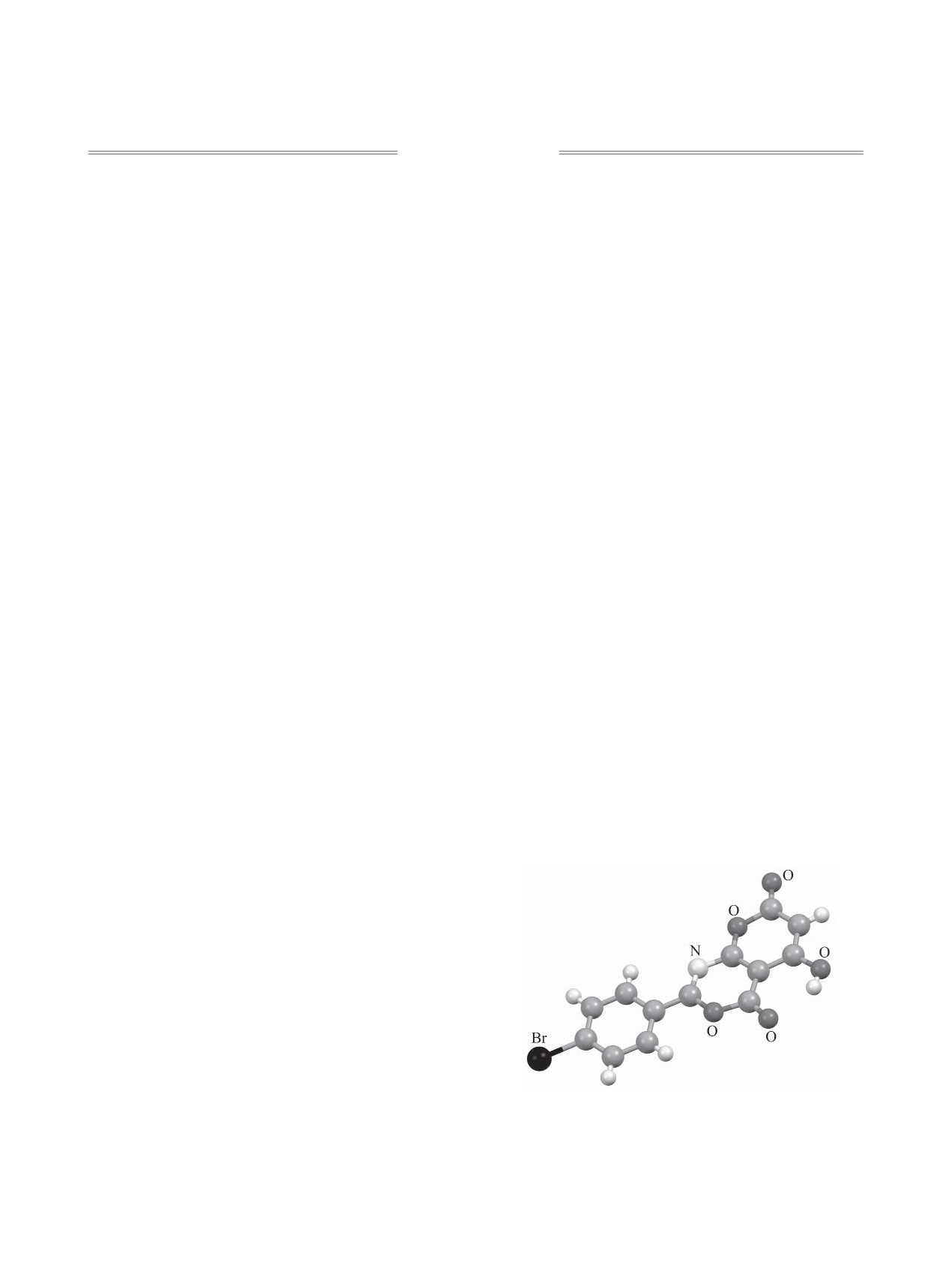
Общий вид молекулы соединения 4д в кристалле по
нами была изучена реакция амидов карбоновых
данным рентгеноструктурного анализа.
650
СИНТЕЗ НОВЫХ 2-ЗАМЕЩЕННЫХ 5-ГИДРОКСИПИР
АНО[2,3-d][1,3]ОКСАЗИН-4,7-ДИОНОВ
651
Схема 1.
O
O O
Cl
O
50 70oC
N
O
2
+
R
ɛɟɡ ɪɚɫɬɜɨɪɢɬɟɥɹ
Cl
NH2
R
O
OH
O
3a,
ɛ
1
2a ɡ
O
O
20 25oC
0H&1 ɢɥɢ ɌȽɎ
N
OH
R
O
O
4a ɡ
5
3K ɚ
0H&6H ɛ
0H2&6H ɜ
12
C6H ɝ
%U&6H ɞ
0H2&6H ɟ
2
3K&+ &+ ɠ ɮɭɪɚɧ ɢɥ ɡ).
ладают той же эмпирической формулой, что и пи-
этом растворялся. Реакционную смесь перемеши-
раноксазины 3а, б, полученные Циглером. Однако
вали в течение 18 ч при комнатной температуре.
выполненный на базе Центра коллективного поль-
Образовавшийся осадок отфильтровывали, про-
зования Санкт-Петербургского государственного
мывали тетрагидрофураном и сушили. Выход 5.7 г
университета рентгеноструктурный анализ моно-
(67%), т. пл. 218-220°C. Спектр ЯМР 1Н, δ, м. д.:
кристалла п-бромфенилзамещенного соединения
5.50 с (1Н, 6-H), 7.52 м (2Н, Ph), 7.79 м (1Н, Ph),
4д показал (см. рисунок), что полученные соеди-
8.20 м (2Н, Ph), 12.77 уш. с (1Н, OH). Спектр ЯМР
нения являются представителями ранее неизвест-
13С, δC, м. д.: 88.53, 93.38, 127.32, 128.07, 131.59,
ной гетероциклической системы - производными
135.01, 154.43, 154.68, 165.87, 167.59, 168.46.
пирано[2,3-d][1,3]оксазина 4а-з [4] (схема 1).
Масс-спектр, m/z: 256.0248 [M - H]- (вычислено
Таким образом, нами установлено, что при
для C13H6NO5: 256.0251).
взаимодействии амидов 2а-з с малонилхлори-
Соединения 4б-з получали аналогично.
дом в соотношении 1:2 в среде ацетонитрила или
5-Гидрокси-2-(4-метилфенил)пирано[2,3-d]-
тетрагидрофурана без нагревания образуются
[1,3]оксазин-4,7-дион (4б). Выход 5.79 г (72%),
2-замещенные
5-гидроксипирано[2,3-d][1,3]окса-
т. пл. 210-212°C. Спектр ЯМР 1Н, δ, м. д.: 2.44
зин-4,7-дионы [5]. Наличие пяти электрофильных
с (3Н, Me), 5.47 с (1Н, 6-H), 7.46 д (2Н, HAr, J =
центров в молекулах полученных соединений по-
8.3 Гц, Ph), 8.09 д (2Н, HAr, J = 8.3 Гц), 12.65 уш. с
зволяет рассматривать их как ценные субстраты
(1Н, OH). Спектр ЯМР 13С, δC, м. д.: 21.53, 88.66,
в реакциях с различными нуклеофильными реа-
93.32, 129.46, 130.08, 130.51, 143.77, 154.39, 154.64,
гентами. Тем самым 2-замещенные 5-гидрокси-
165.92, 167.72, 168.59. Масс-спектр,m/z: 270.0401
пирано[2,3-d][1,3]оксазин-4,7-дионы могут стать
[M - H]- (вычислено для C14H8NO5: 270.0408).
предшественниками новых привилегированных
гетероциклических структур.
5-Гидрокси-2-(4-метоксифенил)пирано-
5-Гидрокси-2-фенилпирано[2,3-d][1,3]окса-
[2,3-d][1,3]оксазин-4,7-дион (4в). Выход 5.94 г
зин-4,7-дион (4а). К суспензии 4 г (10 ммоль)
(78%), т. пл. 221-223°C. Спектр ЯМР 1Н, δ, м. д.:
амида 2а в 25 мл безводного тетрагидрофурана
3.81 с (3Н, MeO), 5.53 с (1Н), 6.97 д (2Н, HAr, J =
при перемешивании и охлаждении медленно по
8.8 Гц), 7.85 д (2Н, HAr, J = 8.8 Гц), 12.84 уш. с (1Н,
каплям прибавляли раствор 9.4 г (20 ммоль) мало-
OH). Спектр ЯМР 13С, δC, м. д.: 49.66, 89.27, 93.73,
нилхлорида в 25 мл тетрагидрофурана, амид при
115.39,
129.83,
131.81,
154.38,
159.93,
163.49,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
652
КОМИССАРОВ и др.
165.63, 167.68, 168.77. Масс-спектр, m/z: 286.0341
122.19, 143.76, 151.01, 153.71, 157.47, 159.74,
[M - H]- (вычислено для C14H8NO6: 286.0357).
167.50, 168.61. Масс-спектр, m/z: 246.0037 [M -
H]- (вычислено для C11H4NO6: 246.0044).
5-Гидрокси-2-(4-нитрофенил)пирано[2,3-d]-
[1,3]оксазин-4,7-дион (4г). Выход 4.15 г (57%),
Спектры ЯМР 1H и 13C растворов синтезиро-
т. пл. 214-216°C. Спектр ЯМР 1Н, δ, м. д.: 5.57 с
ванных соединений в ДМСО-d6 зарегистриро-
(1Н, 6-H), 8.15 д (2Н, HAr, J = 8.8 Гц), 8.42 д (2Н,
ваны на спектрометре Bruker Avance III (400 и
HAr, J = 8.8 Гц), 13.30 с (1Н, OH). Спектр ЯМР
100 МГц соответственно) с использованием оста-
13С, δC, м. д.: 83.07, 89.83, 124.65, 129.56, 139.35,
точного сигнала дейтерированного растворителя
150.30, 159.59, 159.99, 163.97, 168.72, 170.97.
как внутреннего стандарта. Масс-спектры высо-
Масс-спектр, m/z: 301.0114 [M - H]- (вычислено
кого разрешения (HRMS) с ионизацией электро-
для C13H6N2O7: 301.0102).
спреем (ESI) записаны на спектрометре Bruker
micrOTOF. Тонкослойную хроматографию для
2-(4-Бромфенил)-5-гидроксипирано[2,3-d]-
доказательства индивидуальности соединений и
[1,3]оксазин-4,7-дион (4д). Выход 4.15 г (62%),
полноты прохождения реакции выполняли на пла-
т. пл. 220-222°C. Спектр ЯМР 1Н, δ, м. д.: 5.52 с
стинах Silica gel 60 F254 (Merck), элюент - система
(1Н, 6-H), 7.86 д (2Н, HAr, J = 8.5 Гц), 8.10 д (2Н,
этанол-этилацетат (4:1), проявление в УФ свете.
HAr, J = 8.5 Гц), 12.89 уш. с (1Н, OH). Спектр ЯМР
Температуры плавления определяли капиллярным
13С, δC, м. д.: 89.77, 93.92, 128.28, 129.53, 131.13,
методом и не корректировали.
133.04, 154.13, 159.78, 165.04, 167.36, 168.74.
Масс-спектр, m/z: 333.9357 [M - H]- (вычислено
Рентгеноструктурный анализ. Монокристал-
для C13H6NO5Br: 333.9357).
лы соединения 4д были выращены из ацетонитри-
ла. Исследование выполнено на дифрактометре
5-Гидрокси-2-(3-метоксифенил)пирано-
Supernova (Dual, Cuatzero, Atlas) при 100(2) K.
[2,3-d][1,3]оксазин-4,7-дион (4е). Выход 5.33 г
Расшифровка структуры выполнена с использова-
(70%), т. пл. 224-226°C. Спектр ЯМР 1Н, δ, м. д.:
нием программ Olex2 [6], SHELXS [7] и SHELXL
3.87 с (3Н, MeO), 5.50 с (1Н, 6-H), 7.35 м (1Н), 7.56
[8]. Кристаллы моноклинные, C13H6NO5Br, M
псевдотриплет (1H, J = 7.8 Гц), 7.62 м (1Н), 7.78 м
336.10, пространственная группа P21/c (№ 14),
(1Н, HAr), 12.77 уш. с (1Н, OH). Спектр ЯМР 13С,
a = 8.7492(2) Å, b = 11.0703(3) Å, c = 12.0221(3) Å,
δC, м. д.: 55.98, 89.87, 93.69, 113.36, 121.62, 121.82,
β = 95.733(3)°, V = 1158.59(5) Å3, Z = 4, μ(MoKα) =
130.29, 131.10, 154.19, 159.75, 160.07, 165.54,
3.568 мм-1, dвыч = 1.927 г/см3. Измерено 11710 отра-
167.40, 168.52. Масс-спектр, m/z: 286.0361 [M -
жений (6.624° ≤ 2θ ≤ 55°), из них 2661 уникальных
H]-(вычислено для C14H8NO6: 286.0357).
(Rint= 0.0400, Rσ = 0.0317), которые были исполь-
5-Гидрокси-2-(2-фенилэтенил)пирано[2,3-d]-
зованы во всех расчетах; R1 = 0.0275 [отражения
[1,3]оксазин-4,7-дион (4ж). Выход 5.04 г (65%),
с I > 2σ(I)], wR2 = 0.0658 (все данные). Результаты
т. пл. 110-112°C. Спектр ЯМР 1Н, δ, м. д.: 5.60 с
РСА зарегистрированы в Кембриджском центре
(1Н, 6-H), 7.05 д (1H, СН=СН, J = 16.1 Гц), 7.47 м
кристаллографических данных (CCDC 1941265).
(3Н, HAr), 7.88 м (2Н, HAr), 7.99 д (1Н, СН=СН, J =
16.1 Гц), 12.86 уш. с (1Н, OH). Спектр ЯМР 13С, δC,
КОНФЛИКТ ИНТЕРЕСОВ
м. д.: 89.59, 93.33, 118.47, 128.65, 129.59, 132.02,
Авторы заявляют об отсутствии конфликта
134.33, 146.88, 154.33, 159.89, 166.21, 167.43,
интересов.
168.68. Масс-спектр, m/z: 282.0409 [M - H]- (вы-
числено для C15H8NO5: 282.0408).
СПИСОК ЛИТЕРАТУРЫ
5-Гидрокси-2-(фуран-2-ил)пирано[2,3-d][1,3]-
1. Лалаев Б.Ю., Яковлев И.П., Кузьмич Н.Н., Ксено-
оксазин-4,7-дион (4з). Выход 6.77 г (76%), т. пл.
фонтова Г.В., Захс В.Э. // ЖОХ. 2010. Т. 80. Вып. 10.
178-180°C. Спектр ЯМР 1Н, δ, м. д.: 5.45 с (1Н),
С. 1734; Lalaev B.Yu., Yakovlev I.P., Kuz’mich N.N.,
6.91 д (1H, HFu, J = 3.8 Гц), 7.75 д (1H, HFu, J =
Ksenofontova G.V., Zakhs V.E. // Russ. J. Gen.
3.8 Гц), 8.25 с (1Н, HFu), 12.73 уш. с (1Н, OH).
Chem. 2010. Vol. 80. N 10. P. 2043. doi 10.1134/
Спектр ЯМР 13С, δC, м. д.: 89.40, 93.14, 114.55,
S1070363210100269
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020
СИНТЕЗ НОВЫХ 2-ЗАМЕЩЕННЫХ 5-ГИДРОКСИПИР
АНО[2,3-d][1,3]ОКСАЗИН-4,7-ДИОНОВ
653
2. Zaharia V., Silvestru A., Palibroda N., Mogosan C. //
5. Пат. 2705183 С1 (2019). РФ // Б. И. 2019. № 31.
Farmacia. 2011. Vol. 59. N 5. P. 624.
6. Dolomanov O.V., Bourhis L.J., Gildea R.J, Ho-
3. Ziegler E., Meindl H. // Monatsh. Chem. 1964. Vol. 95.
ward J.A.K., Puschmann, H. // J. Appl. Crystallogr.
P. 1318. doi 10.1007/BF00904729
2009. Vol. 42. P. 339. doi 10.1107/S0021889808042726
4. Комиссаров В.О., Чернов Н.М., Яковлев И.П. // Тезисы
7. Sheldrick G.M. // Acta Crystallogr. (A). 2008. Vol. 64.
докл. VII Всерос. науч. конф. студентов и аспиран-
P. 112. doi 10.1107/S0108767307043930
тов с международным участием «Инновации в здо-
8. Sheldrick G.M. // Acta Crystallogr. (C). 2015. Vol. 71. P. 3.
ровье нации». СПб, 2019. C. 227.
doi 10.1107/S2053229614024218
Synthesis of New 2-Substituted 5-Hydroxypyrano[2,3-d]-
[1,3]oxazine-4,7-diones
V. O. Komissarova,*, N. M. Chernova, G. L. Starovab, T. L. Semakovaa, G. V. Ksenofontovaa,
V. E. Zakhsa, and I. P. Yakovleva
а St. Petersburg State University of Chemistry and Pharmacy, St. Petersburg, 197376 Russia
b St. Petersburg State University, St. Petersburg198504 Russia
* e-mail: vladimir.olegovich51@gmail.com
Received February 5, 2020; revised February 7, 2020; accepted February 8, 2020
The reaction of carboxylic acid amides with malonyl chloride in acetonitrile or tetrahydrofuran without heating
leads to the formation of previously unknown 2-substituted 5-hydroxypyrano[2,3-d][1,3]oxazines. The structure
of the obtained compounds was established by high resolution mass spectrometry, NMR spectroscopy, and
X-ray analysis.
Keywords: pyrano[2,3-d][1,3]oxazine, malonyl chloride, X-ray analysis
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 4 2020