ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 5, с. 664-674
УДК 547.462.3:547.745:544.43:544.18
ВЗАИМОДЕЙСТВИЕ МАЛЕИНОВОГО АНГИДРИДА
И N-ВИНИЛПИРРОЛИДОНА ИЛИ ИХ СМЕСИ С
2,2-ДИФЕНИЛ-1-ПИКРИЛГИДРАЗИЛОМ
© 2020 г. Т. Г. Тюринаa,*, О. М. Заречнаяa,
В. В. Зайцеваa, С. Ю. Зайцевb
aИнститут физико-органической химии и углехимии имени Л. М. Литвиненко,
ул. Р. Люксембург 70, Донецк, 283114 Украина
b Федеральный научный центр животноводства «Всероссийский научно-исследовательский
институт животноводства имени академика Л. К. Эрнста», Подольск, 142132 Россия
*e-mail: t_tiurina@mail.ru
Поступило в Редакцию 24 сентября 2019 г.
После доработки 24 сентября 2019 г.
Принято к печати 2 октября 2019 г.
Методом спектрофотометрии показано, что N-винилпирролидон и/или малеиновый ангидрид взаимо-
действуют с 2,2-дифенил-1-пикрилгидразилом в растворе. В рамках методов PM6 и теории функционала
плотности [B3LYP/6-31+G(d)] для газовой фазы оценены термохимические характеристики наиболее
вероятных реакций с участием указанных веществ. Предполагается, что стабильный радикал присое-
диняет молекулу мономера, образующийся новый радикал может участвовать в реакциях продолжения
цепи. Наиболее вероятным путем обрыва является рекомбинация олигомерных радикалов.
Ключевые слова: N-винилпирролидон, малеиновый ангидрид, 2,2-дифенил-1-пикрилгидразил, спек-
трофотометрия, квантово-химические расчеты
DOI: 10.31857/S0044460X20050029
Синтез и свойства сополимеров малеиново-
лов, например
2,2-дифенил-1-пикрилгидразила
го ангидрида являются предметом исследования
(DPPH●), за расходованием которого легко про-
многих специалистов, поскольку благодаря свой-
следить по изменению оптической плотности [5].
ственным этим полимерам биосовместимости,
Кроме того, с помощью радикала DPPH● обнару-
растворимости в воде, четко определенной струк-
живают соединения, содержащие подвижный атом
туре с чередованием звеньев сомономеров, они со-
водорода, чаще всего природные фенолы [5-7], ре-
ответствуют требованиям фармакологии и меди-
акция DPPH● с подобными веществами (RН) про-
цины для носителей лекарственных препаратов и
текает по механизму HAT (hydrogen atom transfer)
других биологически активных веществ [1, 2].
[7] (схема 1).
Среди пар малеиновый ангидрид-сомономер
Целью данной работы являлось эксперимен-
значительный теоретический интерес представля-
тальное изучение расходования стабильного ра-
ет взаимодействие π-акцептора (малеиновый ан-
дикала DPPH● в присутствии малеинового анги-
гидрид) с сильным электронодонором (N-винил-
дрида, N-винилпирролидона и их смесей и оценка
пирролидоном, π-р-π-донор). Исследования, про-
активационных и термодинамических параметров
веденные нами [3, 4], указывают на то, что в смеси
возможных реакций в системах малеиновый анги-
N-винилпирролидон-малеиновый ангидрид про-
дрид-DPPH● и N-винилпирролидон-DPPH●.
текают реакции, приводящие к появлению ради-
Чтобы получить доказательства образования
кальных частиц. Наличие таких частиц обычно
радикальных продуктов в смеси N-винилпирол-
обнаруживают с помощью стабильных радика-
лидона и малеинового ангидрида в отсутствие
664
ВЗАИМОДЕЙСТВИЕ МАЛЕИНОВОГО АНГИДРИДА И N-ВИНИЛПИРРОЛИДОНА
665
Схема 1.
O2N
O2N
Â
H
RH +
N N
NO2
RÂ +
N
N
NO2
O2N
O2N
радикального инициатора или источника ионизи-
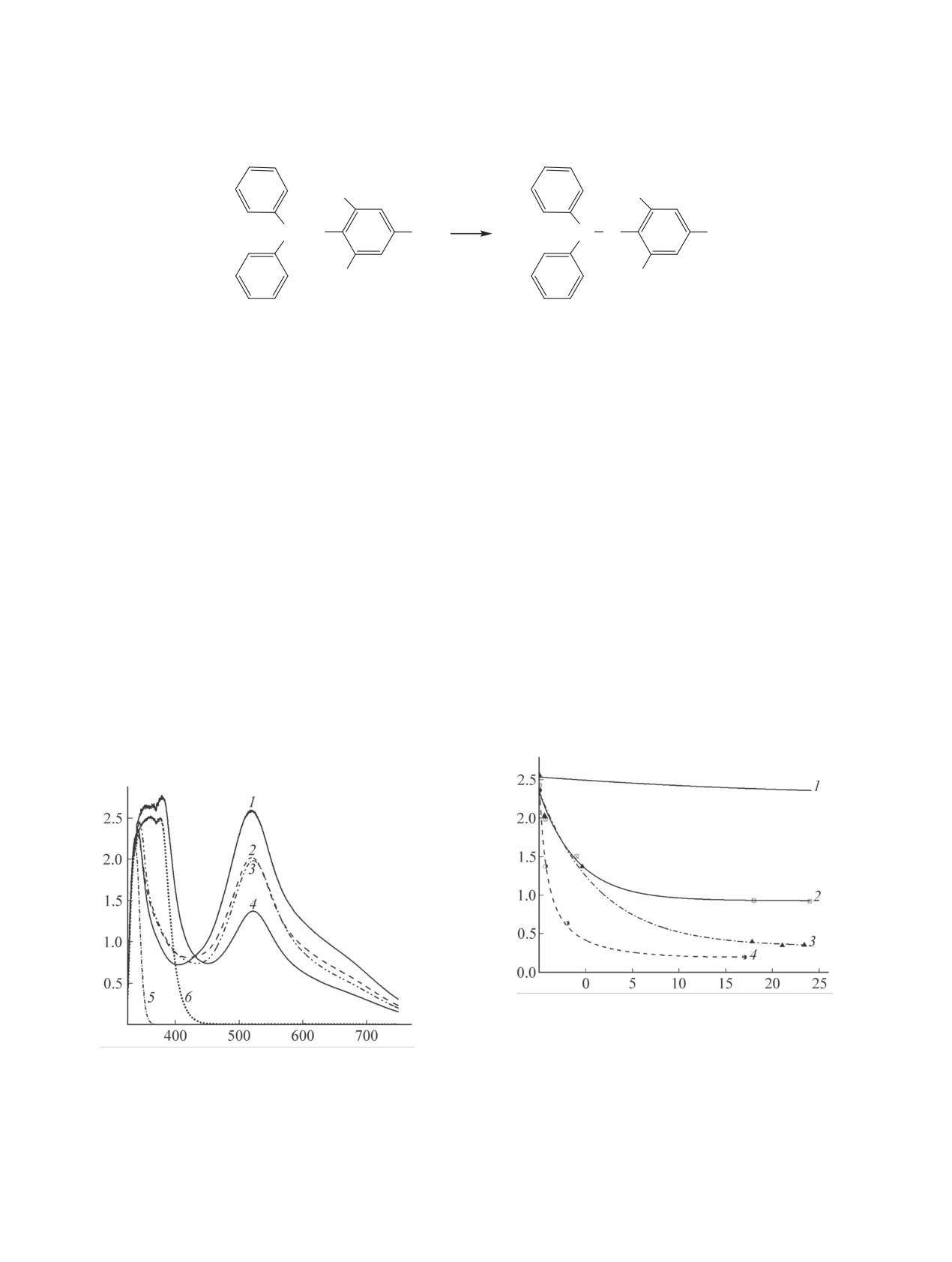
щий вид спектра и положение максимума по-
рующего излучения, было проведено исследова-
лосы практически не изменяется: λmax = 520 нм
ние растворов N-винилпирролидона, малеинового
для DPPH● и его смеси с N-винилпирролидоном,
ангидрида и их смесей в присутствии стабильного
λmax ~522 нм - для смеси с малеиновым анги-
радикала DPPH● методом спектрофотометрии. Об-
дридом (рис. 1, 1-3). Более того, в области 325-
наружено, что при смешивании растворов DPPH●,
425 нм спектры смесей DPPH● с N-винилпирро-
малеинового ангидрида и/или N-винилпирроли-
лидоном и малеиновым ангидридом (рис. 1, 4) и
дона в метилэтилкетоне поглощение раствора по
смеси N-винилпирролидона с малеиновым ан-
полосе 520 нм (А520) уменьшается, причем с раз-
гидридом (рис. 1, 6) подобны друг другу, однако
личной скоростью в начальный период и при по-
отличаются от спектров DPPH● без добавок или с
следующей выдержке (рис. 1, 2).
добавками только одного из мономеров. Наличие
широкой полосы при 330-400 нм свидетельствует
Поглощение в видимой области характерно
об образовании донорно-акцепторного комплекса
только для DPPH●, тогда как растворы других
между N-винилпирролидоном и малеиновым ан-
индивидуальных компонентов в диапазоне 360-
гидридом и соответствует практике определения
800 нм прозрачны. Лишь в спектре малеинового
его константы равновесия по данным УФ спектро-
ангидрида (рис. 1, 5) наблюдается полоса с макси-
скопии в диапазоне длин волн 370-410 нм [8, 9].
мумом при 336 нм и низким коэффициентом экс-
тинкции (А336 = 0.54 при [малеиновый ангидрид] =
В отсутствие добавок величина А520 раствора
1.2 моль/л; ε = 0.46 л∙моль-1∙см-1). В растворе
DPPH● в течение суток остается достаточно ста-
DPPH● и его смесях с каждым из мономеров об-
бильной, хотя несколько снижается со временем,
A520
A
IJ ɱ
Ȝ ɧɦ
Рис. 2. Изменение во времени оптической плотно-
сти полосы 520 нм (А520) для растворов, содержащих
Рис. 1. Электронные спектры растворов, содержащих
2.43×10-4 моль/л DPPH• (1) и его смеси с добавкой
2.43×10-4 моль/л DPPH• (1-4), а также по 1.2 моль/л
(1.2 моль/л) малеинового ангидрида (2), N-винилпир-
N-винилпирролидона (2, 4, 6) и/или малеинового анги-
ролидона (3), N-винилпирролидона и малеинового
дрида (3-6). Растворитель - метилэтилкетон, l = 10 мм,
ангидрида (4). Растворитель - метилэтилкетон, l =
25°С, выдержка - 34 мин.
10 мм, 25°С.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
666
ТЮРИНА и др.
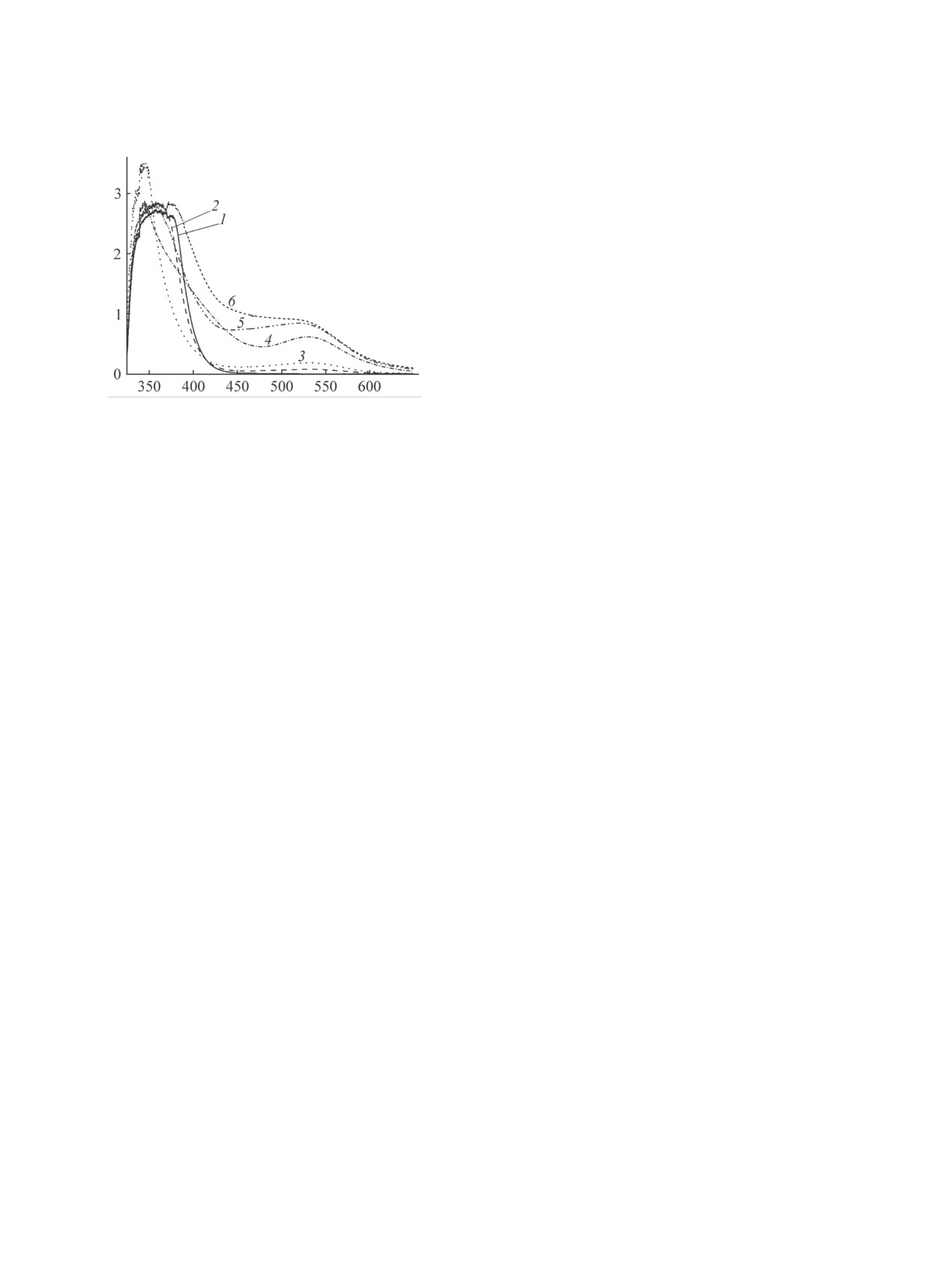
показано на примере полимеризации малеино-
A
вого ангидрида [10]. Для того чтобы выявить это
влияние в изучаемых системах, был проведен ряд
экспериментов в атмосфере инертного газа. На
рис. 3 показаны электронные спектры растворов
N-винилпирролидона с малеиновым ангидридом в
метилэтилкетоне после выдержки в атмосфере воз-
духа (спектры 1-4) и аргона (спектры 5, 6), в том
числе в присутствии DPPH● (4, 6). В спектрах 1 и
2 смеси N-винилпирролидона с малеиновым анги-
дридом (рис. 3), записанных после приготовления
Ȝ ɧɦ
и через 22 ч, как и в спектре 6 (рис. 1, выдержка
34 мин) имеется широкая интенсивная полоса в
Рис. 3. Электронные спектры растворов смесей N-винил-
области от 340 до 380 нм. Она сужается и лока-
пирролидон-малеиновый ангидрид в метилэтилкетоне
при выдержке в атмосфере воздуха (1-4) и аргона (5,
лизуется при 340 нм после выдержки в течение
6). Концентрация мономеров, моль/л: 1-4 - по 1.2; 5,
~100 ч, вместе с тем появляется новая полоса при
6 - по 2.4; добавка DPPH•, моль/л: 4 - 2.43·10-4, 6 -
530 нм (рис. 3, 3). Росту поглощения здесь способ-
5.4·10-4 (для записи спектров 5 и 6 смеси разбавлены
ствует также удаление кислорода (рис. 3, 5): так,
в 5 раз). Время выдержки, ч: 1 - 0, 2 - 22, 3, 4 -125, 5,
6 - 96; 25°С.
при продувке аргоном величина А530 возросла в
21.5 раз, хотя концентрация мономеров была уве-
примерно на 6% от исходной величины в течение
личена только в 2 раза. Все эти факты указывают
24 ч (рис. 2, 1). Введение 1.2 моль/л N-винилпир-
на то, что полоса при 530 нм относится к продук-
ролидона снижает указанную величину на ~21%
там реакции.
за 38 мин, за 24 ч - на ~ 85% (рис. 2, 3). Достаточно
При наличии в смеси N-винилпирролидона и
большую активность проявляет в этом процессе и
малеинового ангидрида добавки DPPH● (рис. 3, 4)
малеиновый ангидрид, однако в присутствии это-
после длительной выдержки (125 ч) также видна
го мономера скорость уменьшения величины А520
отмеченная в спектре 3 интенсивная полоса при
раствора после 5 ч выдержки резко снижается, а
340 нм, однако присущая DPPH● полоса с мак-
через ~ 15 ч она практически не изменяется, вы-
симумом при 520 нм отсутствует, что свидетель-
ходя на плато при достижении ~ 50% от исходной
ствует о полном его расходовании. В то же время
величины А520 (рис. 2, 2). Таким образом, в присут-
ствии как N-винилпирролидона, так и малеиново-
в этом спектре, как и в спектре 3, также имеется
полоса при 530 нм с той разницей, что за один и
го ангидрида величина А520, а значит, и концентра-
ция радикалов DPPH●, существенно уменьшается
тот же промежуток времени (125 ч) интенсивность
со временем, причем изменение оптической плот-
этой полосы в присутствии DPPH● в ~ 3 раза выше.
ности за первые ~ 4 ч в обоих случаях практиче-
Еще в большей степени ускорению процесса спо-
ски одинаково. Если же в раствор DPPH● вводить
собствует удаление кислорода (в спектрах 5 и 6 ве-
N-винилпирролидон и малеиновый ангидрид в со-
личина А530 возрастает в 11 раз с учетом разбавле-
отношении 1:1, снижение А520 во времени проис-
ния). Таким образом, именно в смеси мономеров
ходит с гораздо большей скоростью, и через 5-7 ч
и при наличии, и в отсутствие радикала DPPH●,
выдержки полоса при 520 нм уже не наблюдается
протекают процессы образования новых соедине-
(рис. 2, 4). Существенное ускорение расходования
ний, вероятно, с несколькими сопряженными свя-
радикалов DPPH● в этой смеси прямо указывает
зями С=С-С=О, С=С-N, в том числе радикалов,
на образование в ней радикальных частиц, что
по схеме, предложенной нами ранее [4]. Наблюда-
было показано ранее квантово-химическими рас-
емое увеличение скорости реакций в смеси N-ви-
четами [4].
нилпирролидона и малеинового ангидрида, про-
На ход процессов в изучаемых смесях может
дуцирующей радикальные частицы, при наличии
оказывать влияние кислород воздуха, как было
DPPH● и удалении кислорода вполне закономерно.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
ВЗАИМОДЕЙСТВИЕ МАЛЕИНОВОГО АНГИДРИДА И N-ВИНИЛПИРРОЛИДОНА
667
Таблица 1. Величины параметров уравнения (4) в зависимости от наличия добавок малеинового ангидрида,
N-винилпирролидона или их смеси ([DPPH●] = 2.43×10-4 моль/л) для периода 0-35 мин
Вещество (концентрация, моль/л)
Константа
малеиновый
N-винилпирролидон
малеиновый ангидрид-N-винилпирролидон
ангидрид (1.2)
(1.2)
(по 1.2)
(по 1.0)
(по 0.6)
Акон (у0)
1.80±0.03
1.92±0.01
1.108±0.005
1.157±0.008
1.35±0.02
А1
0.025±0.005
0.13±0.02
0.278±0.005
0.33±0.01
1.1±0.8
k1×102, c-1
0.7±0.3
1.5±0.3
0.67±0.02
0.78±0.04
2.0±0.6
А2
0.51±0.02
0.593±0.007
1.217±0.002
1.129±0.005
0.98±0.01
k2×104, c-1
4.3±0.4
8.0±0.4
6.05±0.06
5.55±0.09
4.3±0.1
R2
0.9994
0.9989
0.99997
0.9999
0.9996
Однако в системах, содержащих кроме DPPH●
при анализе кинетических результатов взаимодей-
только один из мономеров, процесс расходования
ствия DPPH● с полифенолами или растительными
этого радикала не может протекать таким же об-
экстрактами [13-15]. В то же время сравнение те-
разом. Чтобы составить представление о механиз-
оретической и экспериментальной кривой пока-
ме процесса, прежде всего, был проведен анализ
зывает плохое соответствие в начальный период
экспериментально полученных кинетических ре-
реакции (4-10 мин) и необходимость разбивать
зультатов. Поскольку уменьшение поглощения для
зависимость на несколько временных участков.
данной системы равносильно расходованию ради-
Обработка массивов экспериментальных данных
калов DPPH●, причем [DPPH●]0 << [малеиновый
с применением экспоненциальных функций раз-
ангидрид]0
([N-винилпирролидон]0), изменение
личных типов показала, что более полно все точки
оптической плотности раствора во времени рас-
кривой А-τ за период 0-35 мин описываются экс-
сматривали в рамках кинетики реакции первого
поненциальным уравнением ExpDec2 (3), которое
порядка относительно радикала DPPH●. Отметим,
можно записать в виде (4).
что такой порядок был установлен для реакций от-
(3)
рыва атома Н от фенольных соединений (механизм
(4)
HAT) в ряде работ [7, 11-13].
Здесь Акон
- оптическая плотность раствора
На правомерность такого подхода указывает то,
(520 нм) в момент времени, соответствующий кон-
что полученные в данной работе массивы данных
и k2
цу указанного периода (~35 мин). Величины k
1
А-τ описываются экспоненциальным уравнением
здесь можно рассматривать как эффективные кон-
(1) или в логарифмической форме (2).
станты реакции псевдопервого порядка расходова-
ния радикала DPPH● в условиях избытка второго
(1)
реагента. Найденные величины всех коэффициен-
(2)
тов и констант из уравнения (4) приведены в табл. 1.
Коэффициенты уравнения (2) соответствуют
Применение подобных двухчленных уравнений
величине поглощения в различные моменты реак-
было предложено при изучении реакции DPPH● с
ции: a = Акон для анализируемого периода времени
природными полифенолами [16, 17], однако кон-
τ, a + b = А0 при τ = 0, откуда b = А0 - Акон, эта ве-
станты трактовались авторами как характеризую-
личина пропорциональна изменению концентра-
щие реакции фенольных гидроксильных групп с
ции DPPH● в ходе реакции за весь период τ. Итак,
различной активностью, а коэффициенты при экс-
выражение (2) тождественно уравнению, обычно
понентах exp(-kiτ) - как вклад групп с большей и
применяемому для реакций псевдопервого по-
меньшей активностью. В данном случае подобная
рядка: ln[(А0 - Акон)/(А - Акон)] = kτ, а коэффици-
трактовка не имеет под собой оснований. Един-
ент с равен kэф - эффективной константе скорости
ственное возможное предположение: слагаемые
реакции. Подобная обработка предложена также
Аi·exp(-kiτ) относятся к двум протекающим в си-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
668
ТЮРИНА и др.
лидон-малеиновый ангидрид, предположительно
инициирующего процесс образования радикалов
в смеси [4].
Анализ данных изменения А520 за период до
22-30 ч показал, что эти результаты описываются
только уравнением (2), причем малое количество
точек на кривых А-τ (рис. 2) приводит к невысокой
точности полученных параметров (табл. 2). Следу-
ет отметить, что величины k снижаются почти на
порядок по сравнению с k2 (табл. 1). Кроме того,
увеличение k с ростом концентрации N-винилпир-
ролидона или малеинового ангидрида не вполне
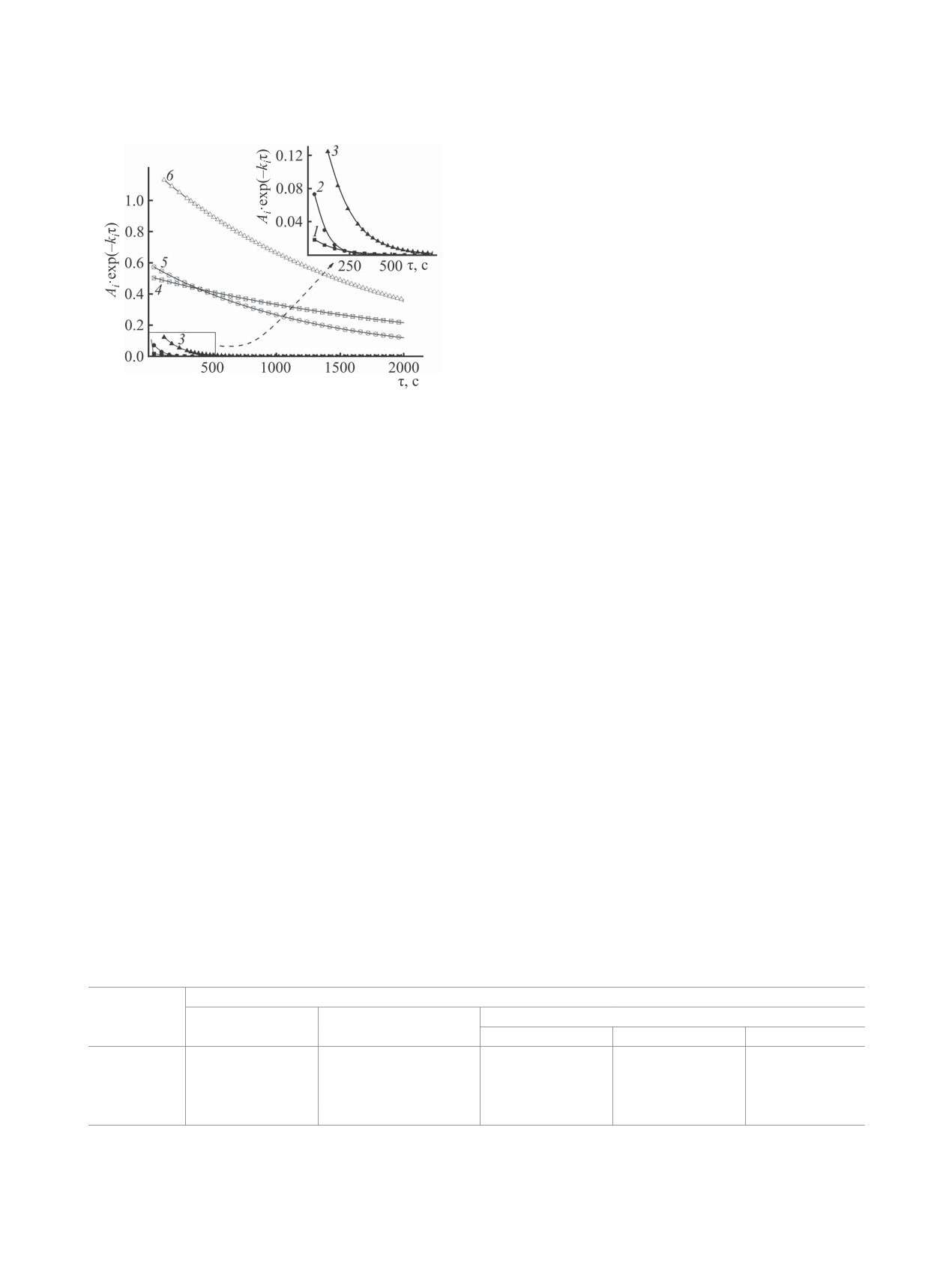
Рис. 4. Изменение величины слагаемых Аiexp(-kiτ)
линейно, что может быть связано с низкой точно-
в уравнении (4) во времени для растворов, содержа-
стью определения этой величины для смеси с со-
щих малеиновый ангидрид (1, 4), N-винилпирролидон
держанием N-винилпирролидона и малеинового
(2, 5) и их смесь (3, 6) в количестве 1.2 моль/л. i = 1
ангидрида 1 моль/л.
(1-3), 2 (4-6).
Выявленные факты указывают на сложный ме-
ханизм процессов, протекающих в смесях изучае-
стеме реакциям с участием радикала DPPH●. При
мых веществ с DPPH●. Прежде всего, в растворах,
этом величина А1exp(-k1τ) составляет от 4 (мале-
содержащих DPPH● и только один из мономеров
иновый ангидрид) до 12% (N-винилпирролидон)
(малеиновый ангидрид или N-винилпирролидон),
от Σ Аiexp(-kiτ) при τ = 30 с и быстро снижается
радикалы DPPH● могут участвовать в наиболее
практически до 0 за 5-6 или 10-12 мин в растворах
распространенных элементарных реакциях сво-
с добавками малеинового ангидрида, N-винилпир-
бодных радикалов - отрыве атома Н от молекул
ролидона или их смеси (рис. 4).
мономеров и присоединении к их двойной связи. В
Более того, по реакции с константой k1 расхо-
лактамном цикле N-винилпирролидона, действи-
дуется 0.8, 2.9 или 5.3% DPPH● от его исходного
тельно, имеются лабильные атомы Н [4, 18], од-
количества в растворе, содержащем малеиновый
нако для малеинового ангидрида реакция отрыва
ангидрид, N-винилпирролидон или их смесь соот-
представлялась неожиданной. Ранее сообщалось о
ветственно. Это означает, что указанная реакция
возможности прямого отрыва атома Н от двойной
не только реализуется в весьма краткий началь-
связи малеимида [19], однако при этом его молеку-
ный период, но и не вносит существенный вклад
ла была предварительно фотосенсибилизирована.
в общий процесс, хотя величина k1 превышает k2.
Для основной реакции, характеризующейся кон-
Кроме того, при взаимодействии виниловых
стантой k2, обнаруживается линейная зависимость
мономеров с DPPH●, кроме обрыва цепи, возмож-
величины k2 от содержания N-винилпирролидона
но также дополнительное ее зарождение, на что
(или малеинового ангидрида), которое пропорци-
может расходоваться около 10% исходного количе-
онально концентрации комплекса N-винилпирро-
ства этого радикала [6]. Поэтому не исключено, что
Таблица 2. Величины параметров уравнения (2) в зависимости от наличия добавок малеинового ангидрида,
N-винилпирролидона или их смеси ([DPPH●] = 2.43×10-4 моль/л) для периода 0.6-30 ч
Вещество (концентрация, моль/л)
Константа
малеиновый
N-винилпирролидон
малеиновый ангидрид-N-винилпирролидон
ангидрид (1.2)
(1.2)
(по 1.2)
(по 1.0)
(по 0.6)
Акон (у0)
0.923±0.001
0.31±0.02
0.21±0.02
0.13±0.04
0.21±0.04
А
1.197±0.003
1.87±0.04
1.56±0.05
1.5±0.6
1.7±0.1
k×104, c-1
0.490±0.003
0.35±0.02
1.19±0.08
0.6±0.2
0.7±0.1
R2
0.99999
0.9983
0.9976
0.89
0.995
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
ВЗАИМОДЕЙСТВИЕ МАЛЕИНОВОГО АНГИДРИДА И N-ВИНИЛПИРРОЛИДОНА
669
Схема 2.
Авторы [10] считали целесообразным включе-
k
ние реакций с участием кислорода в общую схему
DPPH + M
DPPH-H + M,
(2.1)
полимеризации, в частности метилметакрилата в
k
2
DPPH + M
DPPH-M,
(2.2)
присутствии DPPH● под действием УФ облучения,
k
M + M
M-M,
(2.3)
однако в работах [21, 22] выявлено, что DPPH●
k
не является хорошей ловушкой активных кисло-
DPPH-M + M
M,
(2.3')
родсодержащих частиц. В рассматриваемом нами
k
4
DPPH + M
DPPH-M,
(2.4)
случае отсутствие воздействия света и радикаль-
k
ных инициаторов в системе позволяет исключить
M + M
M-M,
(2.5)
возможность реакции с кислородом и образования
k5
M + M
M.
(2.5')
пероксирадикалов, по крайней мере, в течение
первых часов реакции. В дальнейшем наличие по-
DPPH● способен инициировать полимеризацию
глощения при 530-540 нм не исключает образова-
малеинового ангидрида в отсутствие радикально-
ния в системе 2-(4-гидроксифенил)-2-фенил-1-пи-
го инициатора, однако обычно этот процесс про-
крилгидразина (304, 424 и 556 нм в бензоле [21]).
водят в намного более жестких условиях (75°С, в
При наличии в системе радикалов DPPH● и
массе, 0.14-0.49 моль/л пероксида бензоила [20]).
мономера следует ожидать протекания реакций
Таблица 3. Активационные (#) и термодинамические параметры реакций, рассчитанные методами B3LYP/6-31+G(d)
и РМ6a
∆G#,
∆H#,
ΔS#,
∆G,
∆H,
ΔS,
№
Реакция
кДж/моль
кДж/моль
Дж/(моль∙K)
кДж/моль
кДж/моль
Дж/(моль∙K)
Реакции с участием малеинового ангидрида
1
DPPH• + M → DPPH-Н + М•
220.2
169.2
-171.0
177.4
179.0
5.5
(243.8)
(196.4)
(-157.8)
(168.4)
(168.1)
(-0.9)
2
DPPH• + M → DPPH-М•
189.0
132.0
-191.2
164.3
104.9
-199.3
(121.8)
(61.9)
(-201.1)
(85.7)
(25.2)
(-202.9)
3
M• + M → М-М•
43.8
2.65
-138.0
-126.6
-177.9
-172.2
3'
DPPH-М• + M → DPPH-М-М•
(547.0)
(482.5)
(-216.5)
(-201.6)
(-105.8)
(-201.6)
4
DPPH• + M• → DPPH-М
-
-
-
-199.0
-257.7
-196.7
5
M• + M• → М-М
-
-
-
-466.3
-524.6
-195.7
Реакции с участием N-винилпирролидонаб
1-1
DPPH• + М → DPPH-Н + М1•
181.6
125.3
-188.9
67.0
69.8
9,6
(144.6)
(83.5)
(-205.0)
(0.6)
(-1.05)
(-5.5)
1-2
DPPH• + М → DPPH-Н + М2•
202.6
154,8
-160.2
83.4
86.5
10.6
1-3
DPPH• + М → DPPH-Н + М3•
188.2
137.0
-188.9
62.8
65.5
8.8
(191.5)
(134.9)
(-190.7)
(45.6)
(43.8)
(-5.7)
2
DPPH• + М → DPPH-М•
177.1
121.9
-185.1
146.8
90.3
-189.7
3
М2• + М → М-М•
76.2
24.8
-172.1
-1.4
-52.9
-172.7
3'
DPPH-М• + М → DPPH-
(93.1)
(41.9)
(-171.5)
(-5.6)
(-70.1)
(-216.2)
М-М•
4-1
DPPH• + М1• → DPPH-М1
-
-
-
-9.3
-81.0
-240.8
4-2
DPPH• + М3• → DPPH-М3
-
-
-
-17.6
-84.8
-225.6
5-1
М1• + Мi• → М1-Мi
-
-
-
-175.3÷-
-242.8÷-302.8
-226.0÷
240.4
-209.1
5-2
Мi• + Мj• → Мi-Мj
-
-
-
-199.8÷-
-2629÷-285.6
-211.7÷
222.8
-210.5
а В скобках указаны значения, рассчитанные методом РМ6. б Индексы i, j = 1, 2, 3 указывают на положение радикального центра
в лактамном цикле N-винилпирролидона
1
N
O
2
3
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
670
ТЮРИНА и др.
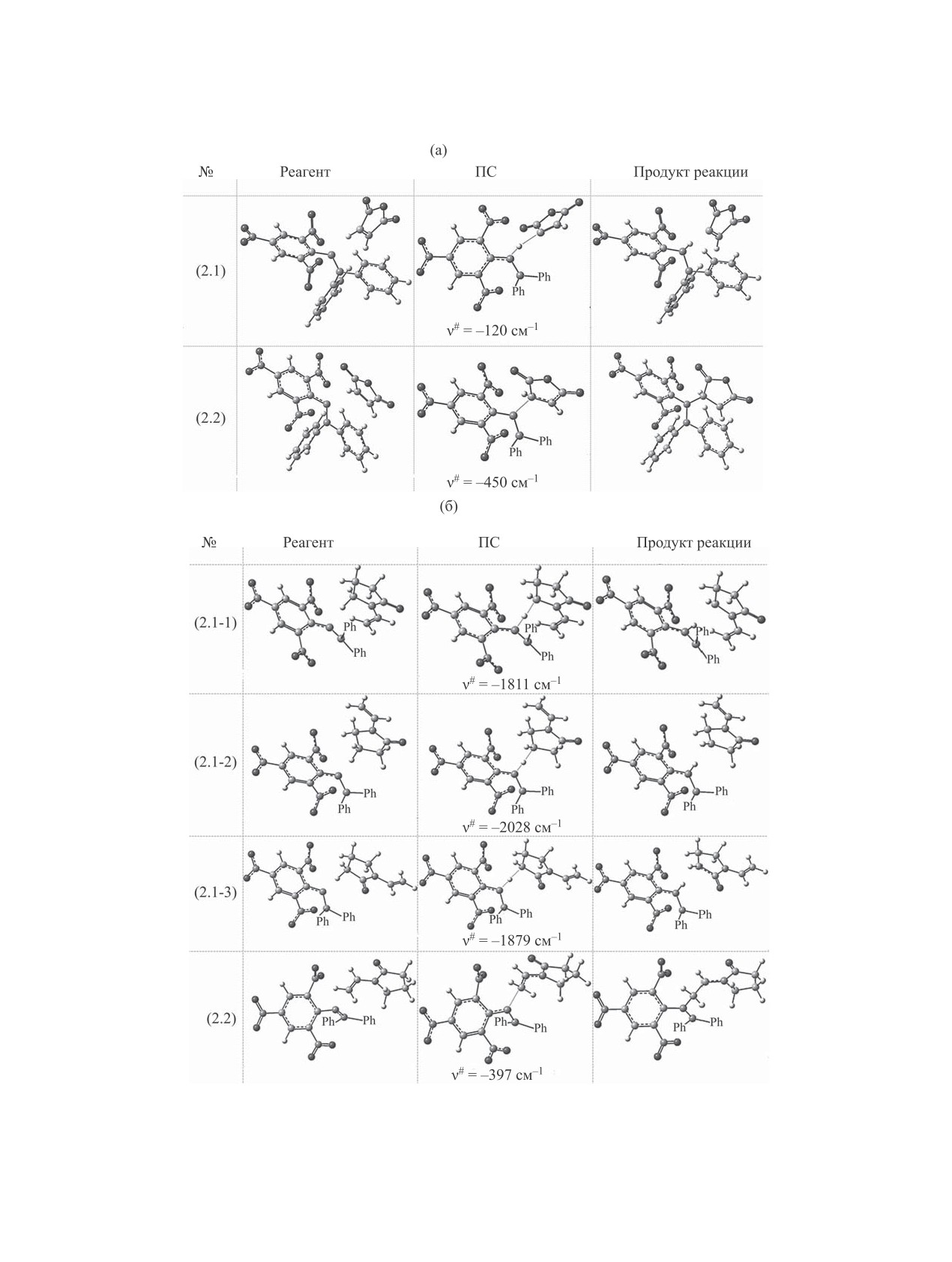
Рис. 5. Оптимизированные структуры исходных соединений, переходного состояния (ПС) и продуктов реакций (2.1)-(2.2)
с участием малеинового ангидрида (а) и N-винилпирролидона (б). Указана мнимая частота колебания в седловых точках ν#;
фенильные фрагменты радикала DPPH•, затрудняющие визуализацию реакционного центра, обозначены как Ph.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
ВЗАИМОДЕЙСТВИЕ МАЛЕИНОВОГО АНГИДРИДА И N-ВИНИЛПИРРОЛИДОНА
671
между ними с образованием нерадикальных про-
Процесс отрыва атома Н от цикла N-винилпир-
дуктов присоединения, предположительно имею-
ролидона требует существенно меньших затрат
щих низкое поглощение при λ = 520-540 нм [13,
энергии, чем для малеинового ангидрида, при-
23]. Тогда взаимодействие DPPH● с мономером М
чем величины термодинамических параметров
(малеиновым ангидридом или N-винилпирролидо-
для отрыва из положения рядом с атомом азота
ном) можно представить схемой 2. В схему 2 не
или группой С=О практически совпадают. Этот
результат вполне соответствует представлению о
включена реакция между радикалами DPPH-М● и
DPPH●, так как это взаимодействие невозможно
лабильности атомов Н в лактамном цикле N-ви-
нилпирролидона [4, 18]. В то же время рекомбина-
по стерическим причинам.
ция радикалов N-винилпирролидона дает гораздо
С целью выявления наиболее вероятного меха-
меньший экзотермический эффект по сравнению
низма процесса было проведено квантово-хими-
с малеиновым ангидридом, что может быть связа-
ческое моделирование фрагментов поверхности
но с определенными стерическими затруднениями
потенциальной энергии для реакций (2.1)-(2.5).
при подходе двух пятичленных циклов.
Оптимизированные структуры реагентов, пере-
Из двух путей реакции малеинового ангидри-
ходных состояний и продуктов, образующихся в
да (или N-винилпирролидона) с DPPH● более оп-
реакциях (2.1) и (2.2), представлены на рис. 5. Ак-
тимальным и кинетически, и термодинамически,
тивационные и термодинамические параметры ре-
представляется присоединение (2.2). Действитель-
акций расходования радикала DPPH● (2.1) и (2.2),
но, рассмотрим соотношение констант скорости
роста цепи (2.3) и возможных элементарных актов
этих реакций k1/k2, которое можно записать, с уче-
с участием радикалов М● - безактивационных эк-
том общего выражения для константы скорости
зотермичных реакций рекомбинации как с DPPH●,
реакции согласно теории активированного ком-
так и друг с другом [реакции (2.4), (2.5)], - даны в
плекса, в виде уравнения (5).
табл. 3.
Свободная энергия Гиббса является функцией
(5)
состояния системы, включающей влияние как эн-
тальпийных, так и энтропийных факторов на на-
Используя величины соответствующих акти-
правленность реакций и устойчивость продуктов,
вационных параметров (табл. 3), получим соотно-
поэтому мы в основном исходили из оценок этой
шение k1/k2, равное ~ 3.4×10-6 для реакций DPPH●
расчетной характеристики. Результаты модели-
с малеиновым ангидридом или 0.16-3.4×10-5 для
рования показывают, что все элементарные реак-
реакций с N-винилпирролидоном в зависимости
ции DPPH● как с малеиновым ангидридом, так и
от места отрыва атома Н. Естественно, такое опре-
с N-винилпирролидоном характеризуются доста-
деление соотношения носит ориентировочный ха-
точно высокими барьерами активации, давая в ре-
рактер, тем не менее, оно позволяет утверждать,
зультате термодинамически нестабильные продук-
что в обоих случаях расходование DPPH● должно
ты. В целом, реакции радикала DPPH● (2.1) и (2.2)
протекать преимущественно по реакции (2.2).
из-за стерического экранирования радикального
Реакции (2.4) и (2.5) являются безактивацион-
центра характеризуются значительным энтропий-
ными, однако сопоставление величин ∆G для них
ным вкладом в барьеры свободной энергии ∆G#:
показывает, что обрыв должен протекать фактиче-
величина -T∆S# составляет 25-30% (табл. 3). По-
ски только за счет рекомбинации радикалов моно-
лученные величины ∆G≠ и ∆G реакций (2.1) и (2.2)
меров или олигомерных радикалов, заканчиваю-
указывают на эндотермичность процесса взаимо-
щихся звеном мономера.
действия DPPH● с мономером и необходимость
При использовании данной схемы расходова-
нагрева для его протекания, хотя в эксперименте
ние радикала DPPH● протекает по реакции (2.2)
оно осуществлялось при 25°С. Необходимую экзо-
и его скорость должна быть пропорциональна
термичность может дать рекомбинация радикалов
концентрации мономера. Такое предположение
DPPH● и мономера или двух радикалов мономеров
действительно хорошо соответствует результа-
[реакции (2.4) и (2.5), табл. 3].
там, полученным для смеси N-винилпирролидо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
672
ТЮРИНА и др.
на и малеинового ангидрида в начальный период
Квантово-химические расчеты в рамках полу-
(~35 мин) и удовлетворительно - данным k для
эмпирического метода PM6 прводили с использо-
времени процесса до 30 ч. Снижение скорости при
ванием программы MOPAC2012 [24], полученные
увеличении времени выдержки (рис. 2, табл. 2) мо-
геометрические характеристики основных стацио-
жет быть связано с увеличением вклада реакций
нарных точек использовали в качестве начального
роста и изменением вязкостных параметров смеси.
приближения для уточненных расчетов в рамках
теории функционала плотности DFT. Геометрию
Данные табл. 3 показывают, что между результа-
тами расчетов параметров реакции с применением
структур реагентов и продуктов реакций опти-
мизировали по всем независимым переменным
методов PM6 и DFT наблюдается закономерное от-
(условие сходимости по энергии - 10-6 а.е.) и без
личие в абсолютных значениях ∆S, ∆H и ∆G, одна-
ко в ряду реакций с участием N-винилпирролидона
каких-либо ограничений по симметрии: на уровне
B3LYP/6-31+G(d) - для систем с закрытыми обо-
и его радикалов наблюдается удовлетворительное
лочками и UB3LYP/6-31+G(d) - для систем с от-
совпадение по активационным параметрам, а в
ряду реакций с участием малеинового ангидрида
крытыми оболочками. В последнем случае контро-
и его радикала - как по активационным параме-
лировали ожидаемые значения оператора квадрата
полного спинового момента <S2>: они составили
трам, так и по термодинамическим. Для величин
∆S и ∆H реакций с участием N-винилпирролидона
во всех случаях не более 0.77, что свидетельствует
(М●), рассчитанных методом PM6, по сравнению
о незначительном (менее 3%) вкладе в волновую
функцию состояний высокой мультиплетности,
с методом DFT наблюдается занижение значений,
вплоть до инверсии знаков для некоторых реакций
тогда загрязнение спина может быть признано не
(DPPH• + М → DPPH-Н + Мi•, DPPH• + М1•) и,
оказывающим существенного влияния на точность
структур и энергий исследованных радикалов [25].
как следствие, худшей согласованности величин
∆G между полуэмпирическими и DFT-расчетами.
Для полученных стационарных точек был прове-
Несмотря на эти результаты, считаем, что актива-
ден гармонический колебательный анализ с целью
тестирования на соответствие минимуму (мнимых
ционные параметры, полученные методом PM6,
вполне пригодны для сравнительной оценки в
частот не обнаружено), а также для расчета термо-
ряду исследуемых реакций при отсутствии резуль-
химических характеристик.
татов расчета методами более высокого уровня.
Поиск седловых точек на поверхностях потен-
циальной энергии реакций предварительно осу-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ществляли на уровне UB3LYP/6-31G. Для про-
N-Винилпирролидон (Merck) предваритель-
верки непрерывной связи рассчитанных седловых
но сушили гидроксидом калия и дважды пере-
точек с локальными минимумами реагентов и про-
гоняли в вакууме, отбирая фракцию с т. кип.
дуктов выполняли расчет внутренней координа-
91±0.05°С (6 мм рт. ст.). Малеиновый ангидрид
ты реакции (IRC) в масс-взвешенных декартовых
очищали двойной возгонкой (т. пл. 53°С). 2,2-Ди-
координатах с шагом 0.2 бор·а.е.м.1/2. Полученные
фенил-1-пикрилгидразил (DPPH)
(95%, Sigma)
структуры использовали в качестве начального
использовали без дополнительной очистки. Ме-
приближения для локализации переходных состо-
тилэтилкетон марки ОСЧ (Merсk) использовали
яний на уровне UB3LYP/6-31+G(d), с дальнейшим
также без дополнительной очистки.
решением колебательной задачи; для каждого из
Электронные спектры растворов DPPH● и его
переходных состояний найдена единственная от-
смесей с добавками малеинового ангидрида и
рицательная частота. Все результаты получены с
N-винилпирролидона в метилэтилкетоне реги-
помощью программы Gamess [26] и относятся к
стрировали при 298 K с помощью спектрофото-
основному состоянию и стандартным условиям
метров Specord UV-VIS и UV-1801S (A&E Lab,
(T = 298 K, p = 1 атм) в приближении идеального
Китай) в области 300-750 нм, применяя кварцевые
газа. При определении активационных и термоди-
кюветы с толщиной слоя 10 мм. В ходе выдержки
намических параметров реакций относительные
различной продолжительности растворы предо-
энергии корректировали учетом энергий нулевых
храняли от воздействия света.
колебаний и термических поправок.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
ВЗАИМОДЕЙСТВИЕ МАЛЕИНОВОГО АНГИДРИДА И N-ВИНИЛПИРРОЛИДОНА
673
БЛАГОДАРНОСТИ
12. Goupy P., Dufour C., Loonis M., Dangles O. // J. Agric.
Food Chem. 2003. Vol. 51. N 3. P. 615. doi 10.1021/
Авторы выражают благодарность Л.И. Опейде
jf025938l
за любезно предоставленные данные по измене-
13. Momen Heravi M., Haghi B., Morsali A., Ardalan P.,
нию оптической плотности (А520) в растворах сме-
сей малеинового ангидрида и DPPH● во времени.
Ardalan T. // J. Chem. Health Risks. 2012. Vol. 2. N 2.
P. 43. doi 10.22034/jchr.2012.543994
КОНФЛИКТ ИНТЕРЕСОВ
14. Foti M.C., Daquino C., Geraci C. // J. Org. Chem.
Авторы заявляют об отсутствии конфликта
2004. Vol. 69. N 7. P. 2309. doi 10.1021/jo035758q
интересов.
15. Chat O.A., Najar M.H., Dar A.A. // Colloids Surf.
СПИСОК ЛИТЕРАТУРЫ
(A). 2013. Vol. 436. Р. 343. doi 10.1016/j.colsurfa.
2013.06.035
1. Kamada H., Tsutsumi Y., Yoshioka Y., Yamamoto Y.,
Kodaira H., Tsunoda S., Okamoto T., Mukai Y., Shiba-
16. Bernardi A.P.M., López-Alarcón C., Aspee A., Rech S.,
ta H., Nakagawa S., Mayumi T. // Clin. Cancer Res.
Von Poser G.L., Bride R., Lissp E.// J. Chil. Chem.
2004. Vol. 10. N 7. P. 2545. doi 10.1158/1078-0432.
Soc. 2007. Vol. 52. N 4. Р. 1326. doi 10.4067/ S0717-
CCR-03-0544
97072007000400013
2. Popescu I., Suflet D.M., Pelin I.M., Chiţanu G.C. // Rev.
17. Moţ A.C., Silaghi-Dumitrescu R., Sârbu C. // J. Food
Roum. Chim. 2011. Vol. 56. N 3. Р. 173.
Compost. Anal. 2011. Vol. 24. N 4-5. Р. 516.
3. Зайцева В.В., Тюрина Т.Г., Зайцев С.Ю. // ЖОрХ.
doi 10.1016/j.jfca.2010.11.006
2015. Т. 51. № 8. С. 1093; Zaitseva V.V., Tyurina T.G.,
18. Fechine G.J.M., Barros J.A.G., Catalani L.H. //
Zaitsev S.Yu. // Russ. J. Org. Chem. 2015. Vol. 51. N 8.
Polymer. 2004. Vol. 45. Р. 4705. doi 10.1016/j.
P. 1071. doi 10.1134/S1070428015080035
polymer.2004.05.006
4. Тюрина Т.Г., Заречная О.М., Зайцева В.В., Зай-
19. Ng L.-T., Swami S., Jönsson S. // Radiat. Phys.
цев С.Ю. // ЖОХ. 2017. Т. 87. № 3. С. 485; Tyurina T.G.,
Chem. 2004. Vol. 69. Р. 321. doi 10.1016/S0969-
Zarechnaya O.M., Zaitseva V.V., Zaitsev S.Yu. // Russ.
806X(03)00476-6
J. Gen. Chem. 2017. Vol. 87. N 3. P. 489. doi 10.1134/
20. Joshi R. // Macromol. Chem. 1962. Vol. 53. Р. 33. doi
S1070363217030197
10.1002/macp.1962. 020530105
5. Molyneux P. // Songklanakarin J. Sci. Technol. 2004.
21. Hristea E.N., Hillebrand M., Caproiu M.T., Caldararu H.,
Vol. 26. N 2. P. 211.
Constantinescu T., Balaban A.T. // Arkivoc. 2002.
6. Розанцев Э.Г., Гольдфейн М.Д., Трубников А.В. // Усп.
P. 123. doi 10.3998/ark.5550190.0003.213
хим. 1986. Т. 55. Вып. 11. С. 1881; Rozantsev E.G.,
22. Ionita P. // Chem. Pap. 2005. Vol. 59. N 1. Р. 11.
Gol’dfein M.D., Trubnikov A.V. // Russ. Chem.
Rev. 1986. Vol. 55. N 11. P. 1070. doi 10.1070/
23. Hristea E.N., Caproiu M.T., Pencu G., Hillebrand M.,
RC1986v055n11ABEH003242
Constantinescu T., Balaban A.T. // Int. J. Mol. Sci. 2006.
7. Litwinienko G., Ingold K.U. // J. Org. Chem. 2004.
Vol. 7. N 5. Р. 130. doi 10.3390/ i7050130
Vol. 69. N 18. Р. 5888. doi 10.1021/jo049254j
24. Stewart J.J.P. MOPAC2012, Stewart Computational
8. Fehérvári F., Azori M., Földes-Berezsnich T., Tudős F. //
Chemistry, Colorado Springs, CO, USA.
Polymer Bull. 1987. Vol. 18. P. 225. doi 10.1007/
25. Young D. Computational chemistry: a practical guide for
BF00255114
applying techniques to real world problems. New York:
9. Hu Z., Zhang Z. // Macromolecules. 2006. Vol. 39.
Wiley, 2001. P. 227.
P. 1384. doi 10.1021/ma051997z.
26. Schmidt M.W., Baldridge K.K., Boatz J.A., Elbert S.T.,
10. Osugi J., Sasaki M. // Rev. Phys. Chem. Japan. 1964.
Gordon M.S., Jensen J.H., Koseki S., Matsunaga N.,
Vol. 34. N 2. Р. 65.
Nguyen K.A., Su S., Windus T.L., Dupuis M.,
11. Нogg J.S., Lohmаnn D.Н., Russel K.E. // Can. J. Chem.
Montgomery J.A. // J. Comput. Chem. 1993. Vol. 14.
1961. Vol. 39. Р. 1588. doi 10.1139/v61-202
N 11. P. 1347. doi 10.1002/jcc.540141112
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
674
ТЮРИНА и др.
Interaction of Maleic Anhydride and N-Vinylpyrrolidone
or Mixtures Thereof with 2,2-Diphenyl-1-picrylhydrazyl
T. G. Tyurinaa,*, O. M. Zarechnayaa,
V. V. Zaitsevaa,
and S. Yu. Zaitsevb
a L.M. Litvinenko Institute of Physical Organic and Coal Chemistry, Donetsk, 83114 Ukraine
b L.K. Ernst Federal Science Center for Animal Husbandry, Podolsk, 142132 Russia
*e-mail: t_tiurina@mail.ru
Received September 24, 2019; revised September 24, 2019; accepted October 2, 2019
By spectrophotometry there was showed that N-vinylpyrrolidone and/or maleic anhydride interacted with
2,2-diphenyl-1-picrylhydrazyl radical in solution. In the framework of the such methods as PM6 and density
functional theory at the B3LYP/ 6-31+G(d) level for the gas phase, the thermochemical characteristics of the
most probable reactions involving the above substances were estimated. It is assumed that the stable radical
attaches to the monomer molecule, the resulting new radical can participate in chain extension reactions. The
most likely termination is the recombination of oligomeric radicals.
Keywords: N-vinylpyrrolidone, maleic anhydride, 2,2-diphenyl-1-picrylhydrazyl, spectrophotometry, B3LY-
P/6-31+G(d) calculation
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020