ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 5, с. 690-695
УДК 547.854.4
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА 5-ГИДРОКСИ-
1,3,6-ТРИМЕТИЛУРАЦИЛА В ВОДНЫХ РАСТВОРАХ
© 2020 г. С. Ф. Петрова, Т. Р. Нугуманов, Ю. З. Хазимуллина,
А. Р. Гимадиева, С. П. Иванов*
Уфимский институт химии Уфимского федерального исследовательского центра Российской академии наук,
пр. Октября 71, Уфа, 450054 Россия
*e-mail: ivanov_sp@anrb.ru
Поступило в Редакцию 26 декабря 2019 г.
После доработки 26 декабря 2019 г.
Принято к печати 30 декабря 2019 г.
Методами УФ и ЯМР 1Н, 13С, 15N спектроскопии изучена структура 5-гидрокси-1,3,6-триметилурацила.
Определены константы и термодинамические характеристики его кислотно-основного равновесия в
водных растворах. С использованием полученных результатов установлен порядок стадий диссоциации
5-гидрокси-6-метилурацила в водных растворах.
Ключевые слова: 5-гидрокси-6-метилурацил, 5-гидрокси-1,3,6-триметилурацил, спектроскопия ЯМР,
константа диссоциации
DOI: 10.31857/S0044460X20050054
Урацил и его производные в водных растворах
Ранее нами в качестве модельных соединений
представляют собой слабые двухосновные кис-
были получены метилпроизводные соединения
лоты [1-3]. Для многих 5- и/или 6-замещенных
1, в которых один из водородов атома азота, спо-
производных урацила рKа первой ступени дис-
собный к диссоциации, замещен на метильную
социации определены [4], но место первичного
группу [13, 14]. Выделить модельное соединение
депротонирования урацила не установлено. На
с метильной группой у атома кислорода при С5 не
основании квантово-химических расчетов для
удалось.
большинства производных урацила наиболее вы-
Нами синтезирован в качестве модельного со-
годно образование аниона с отрывом протона от
единения
5-гидрокси-1,3,6-триметилурацил
2,
атома N1 пиримидинового кольца [4, 5].
доказана его структура и изучены кислотно-ос-
5-Гидрокси-6-метилурацил
1 проявляет ряд
новные свойства. Соединение 2 было получено
уникальных фармакологических свойств [6]. Со-
окислением 1,3,6-триметилурацила 3 [15] персуль-
единение 1 подвергается окислению в щелочной
фатом аммония в щелочной среде с последующим
водной среде через стадию депротонирования мо-
кислотным гидролизом (схема 2). Другой способ
лекулы (схема 1) [7-10].
получения соединения 2 [16] не применяли из-за
более низкого выхода.
Экспериментальные значения рK1 и рK2 для
соединения 1 составляют 8.71 и 10.25 [11]. Hа ос-
Структура соединения 2 доказана методами
новании расчетных данных предложен порядок
ЯМР 1H, 13С, и 15N спектроскопии. Вследствие
депротонирования молекулы 1 в щелочных вод-
изолированности метильных групп и отсутствия
ных растворах при 25°С [12]: сначала отщепля-
на соседних атомах углерода протонов сигналы
ется протон от атома N1 пиримидинового кольца
групп СН3 при атомах азота проявляются в виде
(рK1 = 8.5), затем от кислорода гидроксильной
синглетов в диапазоне 2.22-3.33 м. д. Как следует
группы при атоме С5 (рK2 = 10.41) и, наконец, от
из данных ЯМР 13С, метильные группы при атомах
атома азота N3 (рK3 = 12.2).
N1 и N3 вызывают смещение сигналов атомов С2
690
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА 5-ГИДРОКСИ-1,3,6-ТРИМЕТИЛУР
АЦИЛА
691
Схема 1.
O
O
O
H
OH
OH
OH
N
4
HN
N
3
5
OH
2
6
1
O
N CH3
O
N CH3
O
N
CH3
H
H
AN1
AN3
1
O
O
HN
O N
CH3
H
AO5
O
O
O
OH
O
O
1/2 O2, H2O
O C
N
OH
N
+
H3C C
+H3C C
N
2H2O
O
C
NH2
OH
O
O
N
CH3
O
N CH3
H
Схема 2.
O
O
O
H3C
H3C
OH
(NH4)2S2O8, NaOH
H3C
OSO3NH4
H2SO4, 80°C
N
N
N
60°C
O
N
CH3
O
N
CH3
O
N
CH3
CH3
CH3
CH3
3
2
и С4 урацильного кольца в сильное поле на 0.39 и
от cпектров нейтральных растворов
смещением
2.43 м. д. соответственно по сравнению со спек-
химических сдвигов сигналов атомов углерода С4,
тром соединения 1.
С5, СН3-N1 в слабое поле, а атомов С2, С6, СН3-
Отнесение сигналов проводили с использовани-
ем двумерных спектров. В спектре 1Н-13С НМВС
соединения 2 наблюдаются корреляции протонов
метильной группы при атоме С6 с протонами ме-
тильной группы при атоме N1 и с атомами С4, С5 и
С6, протонов метильной группы при N3 - c атома-
ми C2 и С4, протонов метильной группы при атоме
N1 - с атомами С2 и С6. В спектре 1Н-15N НМВС
соединения 3, кроме прямой корреляции атома N1
c протонами метильной группы при атоме N1, на-
блюдается дальнее взаимодействие с протонами
метильной группы при С6 и прямая корреляция
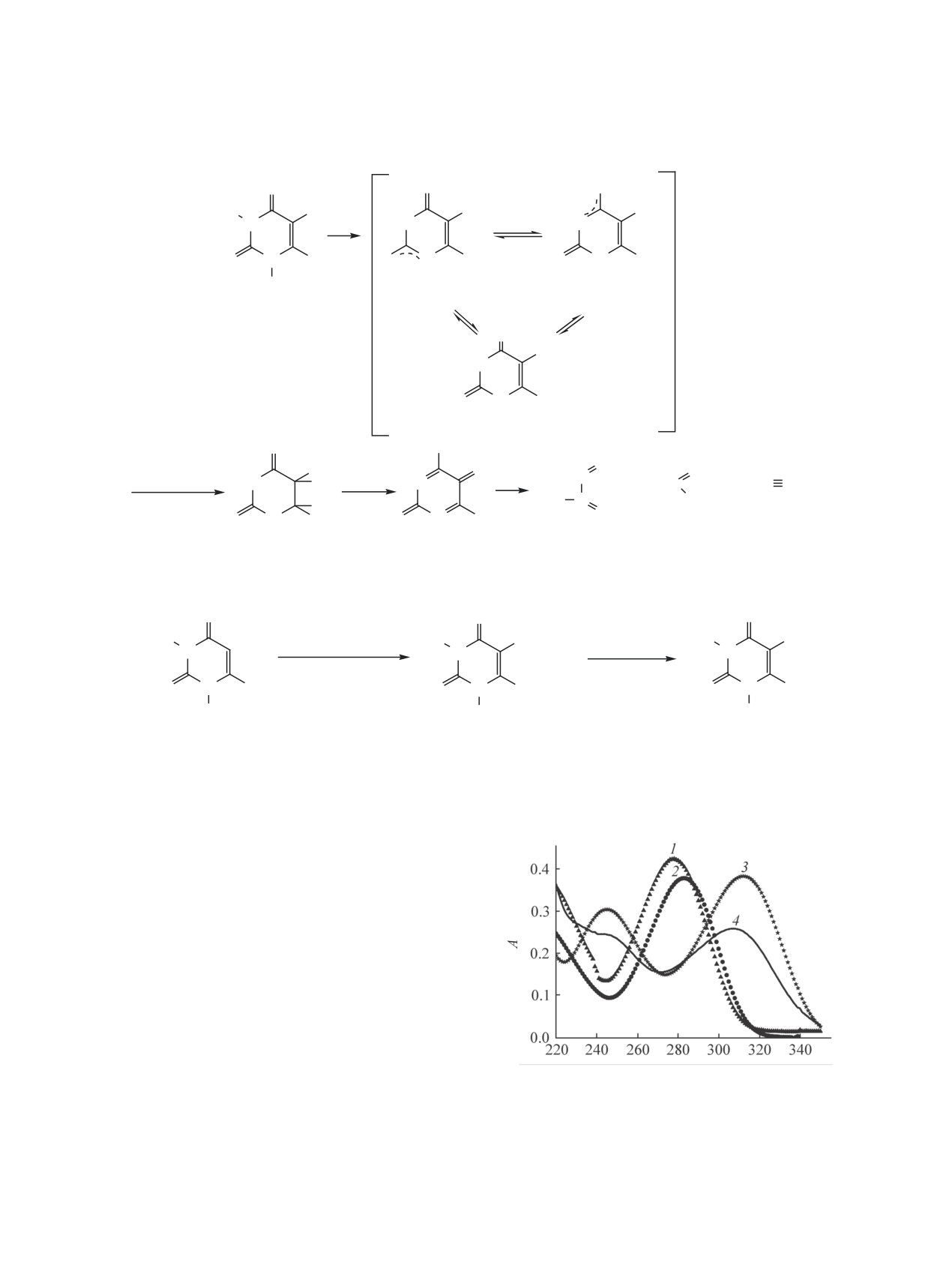
Ȝ ɧɦ
атома азота c протонами метильной группы при N3.
УФ спектры водных растворов соединений 1 (1, 3) и 2
Данные ЯМР щелочного раствора соединения
(2, 4) при рН = 5.75 (1, 2), 12 (3, 4), с = 2×10-5 моль/л,
2 с эквимолярным количеством KОН отличаются
l = 1 см.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
692
ПЕТРОВА и др.
Таблица 1. Параметры спектров ЯМР 13C и 15N соединений 1 и 2 в водных растворах
δС, м. д.
Соединение
С2
С4
С5
С6
СН
3
-С6
СН3-N1
СН3-N3
N1
N3
1
151.15
162.63
127.79
137.11
12.38
-
-
130.56
-
1+KОН
151.89
166.49
135.37
131.37
12.65
-
-
132.68
-
2
150.76
160.20
127.41
136.46
12.36
31.19
27.48
125.38
153.40
2+KОН
150.12
163.72
136.50
130.62
11.48
31.51
27.61
124.67
153.28
С6, N1 и N3 - в сильное поле, что, по-видимому,
ствуют об энергетической невыгодности депрото-
связанно с отщеплением протона от единственно
нирования соединения 2 в водных растворах.
возможной группы, а именно от гидроксильной
Исходя из полученных констант диссоциации
группы при атоме С5 (табл. 1). Как видно из дан-
исходного 1 [рK1(1) = 8.80] и его модельных метили-
ных ЯМР 13С щелочного раствора соединения 2,
рованных соединений [рK1(-N3) = 9.38, рK1(-N1) =
наибольшее смещение сигналов наблюдается для
9.62], определенных ранее [14], можно предполо-
атомов углерода С5 и С6 (на 9.09 и 5.84 м. д. со-
жить порядок его диссоциации в водной щелочной
ответственно). Аналогичное смещение сигналов
среде: по первой ступени происходит отрыв про-
наблюдается при диссоциации соединения 1 [10].
тона от гидроксильной группы, затем от атома N3
Следовательно, депротонирование соединения 1
и, наконец, от атома N1. Поскольку величины рK1
по первой ступени происходит по гидроксильной
соединений 1 и 2 близки, то очевидно, что преоб-
группе при атоме С5.
ладающая форма в водном щелочном растворе -
В УФ спектре соединения 2 имеется максимум
анион, образующийся с отрывом протона от ги-
в области 283 нм (см. рисунок, 2), обусловлен-
дроксильной группы.
ный поглощением цепи сопряжения С=С-С=О.
Для оценки доли анионных форм соединения 1
Как видно из УФ спектров, замещение водорода
в щелочной среде (мольное соотношение 1:KOH =
у атомов азота на метильную группу приводит к
1:1), была составлена система уравнений (1) с тре-
батохромному сдвигу максимума полосы погло-
щения по сравнению со спектром исходного сое-
мя неизвестными (ср. [14]).
динения 1 (λmax = 278 нм) с уменьшением интен-
сивности максимума.
(1)
В водной щелочной среде для исходного соеди-
Здесь рK1(-N1), рK1(-N3) и рK1(-O5) - константы
нения 1 и его N,N-диметилпроизводного 2 наблю-
диссоциации модельных метилированных сое-
дается батохромный сдвиг на ~30 нм. Учитывая,
динений, способных депротонироваться, соот-
что единственно возможным местом депротони-
ветственно, только по атомам N1, N3, O5; рK1(1) -
рования соединения 2 является гидроксильная
константа диссоциации соединения 1; х1, х2 и х3 -
группа при атоме С5, можно предположить, что
мольные доли анионов, образующихся при отще-
депротонирование соединения 1 по первой сту-
плении протона от атомов N1, N3, О5 соответственно.
пени также происходит по гидроксильной группе
при атоме С5.
В результате решения уравнения получены зна-
чения х1 = 0.0009, х2 = 0.0071, х3 = 0.992 при 25°С,
Методом потенциометрического титрования
т. е. при добавлении эквимолярного количества
[17] определены константы диссоциации соеди-
KOH в водном растворе соединение 1 практически
нения 2. Величины рK1 и термодинамические
полностью переходит в анионную форму с отры-
характеристики кислотно-основного равновесия
вом протона от гидроксильной группы.
приведены в табл. 2. Величины рK1 модельно-
го соединения 2 и исходной молекулы 1 схожи, а
Таким образом, исходя из соотношения ани-
энтальпийный и энтропийный фактор свидетель-
онных форм, полученных по данным рKа и ЯМР
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА 5-ГИДРОКСИ-1,3,6-ТРИМЕТИЛУР
АЦИЛА
693
Таблица 2. Константы и термодинамические характеристики кислотно-основного равновесия соединений 1 и 2 в
водных растворах (0.1 М. KNO3)
Соединение
Т, °С
рK1
ΔG298, кДж/моль
ΔH, Дж/моль
ΔS298, Дж/(моль·K-1)
1
20
8.85±0.05
50±3
9.5±0.8
-138±5
25
8.80±0.07
35
8.76±0.04
45
8.71±0.05
2
20
8.96±0.02
51±4
3.2±0.6
-164±7
25
8.93±0.02
35
8.84±0.04
45
8.57±0.05
спектроскопии, предложен порядок стадий депро-
точного сигнала воды. Спектры ЯМР 13С с пода-
тонирования 5-гидрокси-6-метилурацила в водных
влением по протонам (WALTZ-16) регистрировали
растворах: на первой стадии отщепляется протон
при следующих условиях: спектральное окно -
от гидроксильной группы при атоме С5, на второй -
29.8 кГц, количество точек - 64K, длительность
от атома N3 и на третьей - от атома N1.
возбуждающего импульса (30°) - 3.2 мкс, релак-
сационная задержка - 2 с, количество прохожде-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ний - 2k. Двумерные спектры регистрировали в
KOH (Sigma-Aldrich, 99%), D2O (DeuteroGmbH,
стандартных режимах многоимпульсных последо-
99%) и ДМСО-d6 (DeuteroGmbH, 99%) использова-
вательностей программного обеспечения прибора
ли без дополнительной очистки.
с использованием методик [18] (1H-13C HSQC) и
Величины рK1 определяли по стандартной ме-
[19, 20] (1H-13C HMBC). Электронные спектры
тодике [17] методом потенциометрического ти-
поглощения регистрировали на спектрофотометре
трования в термостатируемом реакторе объемом
Shimadzu UV-1800 в области 200-350 нм с исполь-
25 мл, снабженном обратным холодильником, при
зованием кварцевых кювет, l = 1 см. Концентрация
20, 25, 35 и 45°С. Температуру поддерживали при
растворов всех исследуемых соединений состав-
помощи термостата LOIP LT-205. При титровании
ляла 2×10-5 моль/л. В качестве растворителя ис-
использовали рН-метр рН-150МИ с комбиниро-
пользовали бидистиллированную воду.
ванным стеклянным электродом ЭСК-10307. Ка-
Методика приготовления растворов. Для
либровку электрода проводили с помощью стан-
регистрации спектров ЯМР в нейтральной сре-
дартных буферных растворов. Для поддержания
де сухие навески соединений 1, 2 (0.012 и 0.013 г
постоянной ионной силы в титруемом растворе
соответственно) растворяли в 0.8 мл D2O. Для
использовали 0.1 М. раствор KNO3. В качестве
регистрации спектров соединений 1, 2 в ще-
растворителя применяли свежеперегнанный би-
лочной среде к раствору KOH с концентрацией
дистиллят. Концентрацию свежеприготовленного
0.088 моль/л (0.004 г в 0.8 мл растворителя) в D2O
раствора гидроксида калия устанавливали кислот-
добавляли сухие навески соединений 1, 2 (0.012
но-основным титрованием фиксаналом 0.01 М.
HCl (индикатор - фенолфталеин).
и 0.013 г соответственно). Для регистрации спек-
тра ЯМР 1,3,6-триметилурацил-5-аммония суль-
Спектры ЯМР 1Н, 13С и 15N регистрировали
фата сухую навеску 0.018 г растворяли в 0.8 мл
на импульсном спектрометре Bruker Avance III
ДМСО-d6.
с рабочими частотами 500.13 (1H), 125.47 (13C) и
50.58 МГц (15N) с использованием 5 мм датчика
1,3,6-Триметилурацил-5-аммония сульфат.
с Z-градиентом PABBO при постоянной темпера-
К 1 г (0.005 моль) соединения 3 [15] с чистотой не
туре образца 298 K в D2O. Химические сдвиги в
менее 95% (ВЭЖХ), растворенному в 7 мл 24%-
спектрах ЯМР 1Н приведены относительно оста-
ного раствора NaOH, порциями добавляли 1.68 г
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
694
ПЕТРОВА и др.
(0.0075 моль) сухого персульфата аммония. Реак-
4. Ilyina M.G., Khamitov E.M., Ivanov S.P., Khursan S.L. //
ционную смесь интенсивно перемешивали при
Comput. Theor. Chem. 2016. Vol. 1078. P. 81. doi
10.1016/j.comptc.2015.12.024
60°С в течение 4 ч, затем охлаждали. Кристаллы
5. Markova N., Enchev V., Ivanova G. // J. Phys. Chem.
отделяли и перекристаллизовывали из воды. Вы-
2010. Vol. 114. P. 13154. doi 10.1021/jp1063879
ход 0.97 г (73%), белый порошок, т. пл. 210°C.
6. Мышкин В.А., Бакиров А.Б. Оксиметилурацил
Спектр ЯМР 1H (ДМСО-d6), δ, м. д.: 2.54 с (3Н,
(Очерки экспериментальной фармакологии). Уфа,
СН3С6), 3.05 с (3Н, N3СН3), 3.30 с (N1СН3), 7.01
2001. 218 с.
с (4H, O3SOC5) Спектр ЯМР 13С (D2О), δС, м. д.:
7. Иванов С.П., Конкина И.Г., Байкова И.П., Спири-
хин Л.В., Муринов Ю.И. // ХГС. 2002. № 11. С. 1609;
13.81 (СН3С6), 27.31 (N3СН3), 30.27 (N1СН3),
Ivanov S.P., Konkina I.G., Baikova I.P., Spirikhin L.V.,
126.39 (С5), 130.86 (С6), 154.50 (С2), 154.96 (С4).
Murinov Yu.I. // Chem. Heterocycl. Compd. 2002. N 11.
5-Гидрокси-1,3,6-триметилурацил
(2).
1 г
P.1424. doi 10.1002/chin.200327138
(0.0037 моль)
1,3,6-триметилурацил-5-аммоний
8. Петрова С.Ф., Нугуманов Т.Р., Лобов А.Н., Ива-
сульфата растворяли в 5 мл нагретой до 80°С ди-
нов С.П., Муринов Ю.И. // Вестн. Баш. унив. 2016.
Т. 21. Вып. 3. С. 626.
стиллированной воды, затем по каплям прибавля-
9. Петрова С.Ф., Остахов С.С., Иванов С.П., Нугума-
ли 0.2 мл (0.0037 моль) конц. H2SO4. Полученную
нов Т.Р., Муринов Ю.И., Хурсан С.Л. // Химия высо-
смесь перемешивали при 80°С в течение 1 ч, затем
ких энергий. 2018. Т. 52. № 6. С. 468; Petrova S.F.,
охлаждали. Кристаллы отфильтровывали и су-
Ostakhov S.S., Ivanov S.P., Nugumanov T.R., Muri-
шили. Выход 0.63 г (88%), белый порошок, т.
nov Y.I., Khursan S.L. // High Energy Chem. 2018.
пл. 185°C. УФ спектр, λmax, нм (ε, моль-1∙л·см-1):
Vol. 52. N 6. P. 480. doi 10.1134/ S0023119318060116
283 (7536). Спектр ЯМР 1H (D2O), δ, м. д.: 2.22 с
10. Петрова С.Ф. Автореф. дис. … канд. хим. наук.
Уфа, 2018. 23 с.
(3Н, СН3С6), 3.23 с (3Н, N3СН3), 3.32 с (N1 СН3).
11. Иванов С.П. Автореф. дис. … канд. хим. наук. Уфа,
Спектр ЯМР 13С (D2О), δС, м. д.: 12.36 (СН3С6),
2003. 22 с.
27.4 (N3СН3), 31.194 (N1СН3), 127.41 (С5), 136.46
12. Amorati R., Valgimigli L., Pedulli G.F., Grabovskiy S.A.,
(С6), 150.76 (С2), 160.20 (С4). Спектр ЯМР 15N
Kabal’nova N.N., Chatgilialoglu C. // Org. Lett. 2010.
(D2О), δN, м. д.: 125.38 (N1), 153.40 (N3).
Vol. 12. N 18. P. 4130. doi 10.1021/o11017245
13. Петрова С.Ф., Нугуманов Т.Р., Лобов А.Н., Спири-
ФОНДОВАЯ ПОДДЕРЖКА
хин Л.В., Муринов Ю.И., Иванов С.П. // ЖОХ. 2018.
Т. 88. Вып. 1. С. 143; Petrova S.F., Nugumanov T.R.,
Работа выполнена в рамках государственных
Lobov A.N., Spirikhin L.V., Murinov Y.I., Ivanov S.P. //
заданий Министерства науки и высшего образо-
Russ. J. Gen. Chem. 2018. Vol. 88. N 1. P. 136. doi
вания (№ AAAA-A20-120012090029-0 и ААА-
0.1134/S1070363218010231
А-А19-119011790021-4) с использованием обо-
14. Петрова С.Ф., Нугуманов Т.Р., Спирихин Л.В., Мури-
рудования Центров коллективного пользования
нов Ю.И., Иванов С.П. // ЖОХ. 2018. Т. 88. Вып. 6.
«Химия» и «Агидель» Уфимского федерального
С. 895; Petrova S.F., Nugumanov T.R., Spirikhin L.V.,
исследовательского центра РАН.
Murinov Y.I., Ivanov S.P. // Russ. J. Gen. Chem. 2018.
Vol. 88. N 6. P. 1076. doi 10.1134/S107036321806004X
КОНФЛИКТ ИНТЕРЕСОВ
15. Фаттахов А.Х. Дис. … канд. хим. наук. Уфа, 2011.
127 с.
Авторы заявляют об отсутствии конфликта
16. Пат. РФ. 2000298 (1991) // Б. И. 1993. № 33-36.
интересов.
17. Альберт А., Сержент Е. Константы ионизации кис-
СПИСОК ЛИТЕРАТУРЫ
лот и оснований. М.: Химия, 1964. 180 с.
18. Davis A.L., Keeler J., Laue E.D., Moskau D.J. //
1. Wempen I., Fox J.J. // J. Am. Chem. Soc. 1964. Vol. 86.
J. Magn. Res. 1992. Vol. 98. N 1. P. 207. doi
P. 2474. doi 10.1021/ja01066a034
10.1016/0022-2364(92)90126-R
2. Иоффе Б.В., Костиков Р.Р., Разин В.В. Физические
19. Hurd R.E., John B.K. // J. Magn. Res. 1991. Vol. 91. N 3.
методы определения строения органических соеди-
P. 648. doi 10.1016/0022-2364(91)90395-A
нений. М.: ВШ, 1984. 336 с.
20. Willker W., Leibfritz D., Kerssebaum R., Bermel W. //
3. Stimson M.M. // J. Am. Chem. Soc. 1949. Vol. 71.
Magn. Res. Chem. 1993. Vol. 31. N 3. P. 287. doi
P. 1470. doi 10.1021/ ja01172a093
10.1002/mrc.1260310315
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА 5-ГИДРОКСИ-1,3,6-ТРИМЕТИЛУР
АЦИЛА
695
Acid-Basic Properties of 5-Hydroxy-1,3,6-trimethyluracil
in Aqueous Solutions
S. F. Petrova, T. R. Nugumanov, Yu. Z. Khazimullina, A. R. Gimadieva, and S. P. Ivanov*
Ufa Institute of Chemistry of the Russian Academy of Sciences,Ufa, 450054 Russia
*e-mail: ivanov_sp@anrb.ru
Received December 26, 2019; revised December 26, 2019; accepted December 30, 2019
5-Hydroxy-1,3,6-trimethyluracil was studied using 1H, 13C, and 15N NMR and UV spectroscopy. The constants
and thermodynamic characteristics of its acid-base equilibrium in aqueous solutions are determined. The order
of dissociation of 5-hydroxy-6-methyluracil in aqueous solutions was established.
Keywords: 5-hydroxy-6-methyluracil, 5-hydroxy-1,3,6-trimethyluracil, NMR spectroscopy, dissociation
constant
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020