ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 5, с. 715-722
УДК 547.722.3
ВЗАИМОДЕЙСТВИЕ N'-[2-ОКСО-5-R-ФУPАН-3(2Н)-
ИЛИДЕН]АЦИЛГИДРАЗИДОВ С ПЕРВИЧНЫМИ И
ВТОРИЧНЫМИ СПИРТАМИ
© 2020 г. И. А. Кизимоваa,*, Н. М. Игидовa, М. А. Киселевa, Д. В. Ивановb, А. И. Сюткинаa
a Пермская государственная фармацевтическая академия Министерства здравоохранения Российской Федерации,
ул. Екатерининская 101, Пермь, 614990 Россия
b Пермский государственный национальный исследовательский университет, Пермь, 614068 Россия
*e-mail: icekingakiratotsuka@gmail.com
Поступило в Редакцию 13 декабря 2019 г.
После доработки 13 декабря 2019 г.
Принято к печати 22 декабря 2019 г.
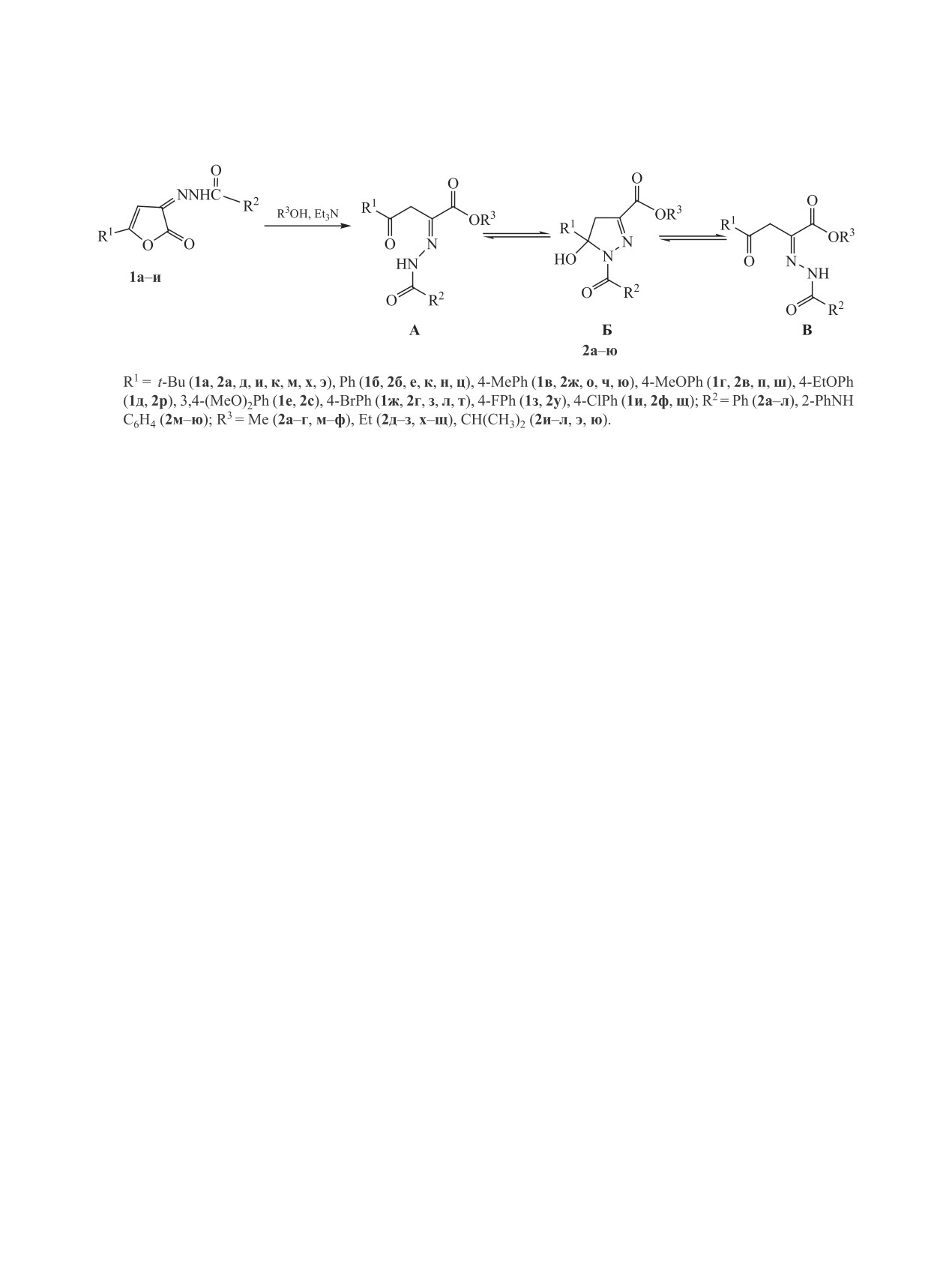
При действии первичных и вторичных спиртов на N'-[2-оксо-5-R-фуpан-3(2H)-илиден]ацилгидразиды
происходит дециклизация фуранового кольца с образованием алкиловых эфиров 2-[2-(арилкарбонил)-
гидразинилиден]-4-R-4-оксобутановых кислот.
Ключевые слова: N'-[2-оксо-5-R-фуpан-3(2H)-илиден]ацилгидразиды, алкиловые эфиры 2-[2-(арилкар-
бонил)гидразинилиден]-4-R-4-оксобутановых кислот, первичные и вторичные спирты
DOI: 10.31857/S0044460X20050091
3-Гидразинилиден(имино)-3H-фуран-2-оны,
кристаллические вещества, растворимые в диме-
имеющие в своем составе несколько реакцион-
тилсульфоксиде, диметилформамиде, трудно рас-
ных центров, широко используются в качестве
творимые в изопропиловом спирте, не раствори-
полифункциональных синтонов при получении
мые в воде и гексане.
ациклических и гетероциклических соединений
В ИК спектрах синтезированных соединений
[1-5]. Реакции N'-[2-оксофуpан-3(2H)-илиден]-
наблюдаются полосы поглощения валентных ко-
ацилгидразидов, полученных ранее [6, 7], изуче-
лебаний связей N-H в области 3380-3145 см-1,
ны только с первичными ароматическими и гете-
сложноэфирной карбонильной группы в области
роциклическими аминами [8, 9]. В продолжение
1745-1666 см-1, а также валентные колебания свя-
исследования реакционной способности N'-[2-ок-
зи С=N в области 1642-1574 см-1.
софуpан-3(2H)-илиден]ароилгидразидов 1a-и мы
Данные спектров ЯМР 1Н полученных соедине-
исследовали их взаимодействие с ОН-нуклеофи-
ний в ДМСО-d6 свидетельствуют о их существова-
лами.
нии в виде двух гидразонных форм А (6-86%) и В
Дециклизация фуранового кольца в соедине-
(2-69%), а также циклической формы Б (6-92%),
ниях 1a-и при действии первичных и вторичных
кроме соединений 2д, к, с, ф. Последние находят-
спиртов протекает только в присутствии катали-
ся в виде смеси гидразонной формы А и цикличе-
тических количеств триэтиламина и приводит к
ской формы Б. В спектре гидразонной формы А
образованию соответствующих алкиловых эфиров
присутствуют сигнал протонов метиленовой груп-
2-[2-(арилкарбонил)гидразинилиден]-4-R-4-оксо-
пы при 4.07-4.65 м. д. и сигнал протона группы
бутановых кислот 2а-ю, существующих в раство-
NH при 11.07-11.45 м. д. Сигнал протонов мети-
рах в виде смеси таутомерных форм (схема 1).
леновой группы гидразонной формы В находится
Полученные соединения 2а-ю представляют
при 3.86-4.42 м. д, сигнал протона аминогруппы -
собой бесцветные или окрашенные в желтый цвет
при 12.77-13.05 м. д. В спектре ЯМР цикличе-
715
716
КИЗИМОВА и др.
Схема 1.
ской формы Б два несимметричных дублетных
фуран-2(3Н)-она добавляли
20 мл первичного
сигнала протонов метиленовой группы находятся
или вторичного спирта и 0.001 моль триэтилами-
при 2.91-3.32 и 3.31-3.46 м. д., а сигнал протона
на (катализатор). Смесь нагревали 10-30 мин при
полуацетальной гидроксильной группы - в виде
64-83°С. После охлаждения до 0°С осадок от-
синглета в диапазоне 5.73-7.33 м. д. или в области
фильтровывали и перекристаллизовывали из про-
ароматических протонов.
пан-2-ола.
В масс-спектре соединения 2м присутствуют
Метил-5,5-диметил-4-оксо-2-[2-(фенилкар-
бонил)гидразинилиден]гексаноат
(2a). Выход
пик молекулярного иона [M]+, m/z 395 (9.0), и пики
0.78 г (51%), желтые кристаллы, т. пл. 153-154°C
фрагментных ионов, подтверждающих структуру.
(пропан-2-ол). ИК спектр, ν, см-1: 3310, 1745, 1705,
Таким образом, реакция дециклизации N'-[2-
1672, 1600. Спектр ЯМР 1Н, δ, м. д.: форма A (71%),
оксо-5-R-фуpан-3(2H)-илиден]ацилгидразидов
1.17 c (9H, t-Bu), 3.71 c (3Н, МеO), 4.11 с (2Н, СН2),
под действием нуклеофильных реагентов откры-
7.67 м (5Н, НAr), 11.07 с (NH); форма Б (11%), 1.05
вает широкие возможности в синтезе новых по-
c (9H, t-Bu), 2.97 д (1H, C4H2, J = 20.0 Гц), 3.45 д
тенциально биологически активных производных
(1H, C4H2, J = 20.0 Гц), 3.73 с (3Н, МеО), 6.33 уш.
ацилпировиноградных кислот.
с (1Н, ОH), 7.67 м (5Н, НAr); форма В (18%), 1.15 c
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(9H, t-Bu), 3.78c (3Н, МеO), 3.86 с (2Н, СН2), 7.67
м (5Н, НAr), 12.77 уш. с (1Н, NH). Найдено, %: C
ИК спектры записаны на приборе ФСМ-1201 в
63.14; H 6.62; N 9.20. C16H20N2O4. Вычислено, %:
вазелиновом масле. Спектры ЯМР сняты на при-
C 63.16; H 6.60; N 9.22.
боре BrukerAvanceIII в ДМСО-d6 при 400 (1H) и
Метил-4-оксо-4-фенил-2-[2-(фенилкарбо-
100 МГц (13С). Химическую чистоту соединений
нил)гидразинилиден]бутаноат (2б). Выход 0.94 г
и протекание реакций контролировали методом
(58%), бесцветные кристаллы, т. пл. 140-141°C
ТСХ на пластинах Sorbfil ПТСХ П-А-УФ-254 в
(пропан-2-ол). ИК спектр, ν, см-1: 3335, 3269, 1721,
системе диэтиловый эфир-бензол-ацетон (10:9:1),
1687, 1637, 1590. Спектр ЯМР 1Н, δ, м. д.: форма
детектирование проводили парами иода. Элемент-
A (13%), 3.76 с (3Н, МеО), 4.65 с (2Н, СН2), 7.63 м
ный анализ проводили на приборе Leco CHNS-932.
(10Н, НAr), 11.40 уш. с (1Н, NH); форма Б (74%),
Температуры плавления (разложения) определяли
3.32 д (1H, C4H2, J = 20.0 Гц), 3.38 д (1H, C4H2, J =
на приборе SMP40. Полученные данные элемент-
20.0 Гц), 3.80 с (3Н, МеО), 7.28 уш. с (1Н, OH), 7.63
ного анализа соответствуют расчетным.
м (10Н, НAr); форма В (13%), 3.79 с (3Н, МеО), 4.42
Алкил-2-[(2-арилкарбонил)гидразинили-
с (2Н, СН2), 7.63 м (10Н, НAr), 13.01 с (1Н, NH).
ден]-4-оксо-4-R-бутаноаты 2а-ю. К суспензии
Найдено, %: C 66.67; H 4.94; N 8.64. C18H16N2O4.
0.01 моль соответствующего 3-гидразинилиден-
Вычислено, %: C 66.65; H 4.96; N 8.61.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
ВЗАИМОДЕЙСТВИЕ N'-[2-ОКСО-5-R-ФУPАН-3(2Н)-ИЛИДЕН]АЦИЛГИДР
АЗИДОВ
717
Метил-4-(4-метоксифенил)-4-оксо-2-[2-(фе-
7.17 с (OH), 7.62 м (10Н, НAr); форма В (35%), 1.14
нилкарбонил)гидразинилиден]бутаноат
(2в).
т (3Н, Ме, J = 7.1 Гц), 4.36 с (2Н, СН2), 7.62 м (10Н,
Выход 0.96 г (54%), желтые кристаллы, т. пл.
НAr), 12.95 уш. с (1Н, NH). Найдено, %: C 67.45; H
143-145°C (пропан-2-ол). ИК спектр, ν, см-1: 3231,
5.36; N 8.28. C19H18N2O4. Вычислено, %: C 67.47;
3145, 1721, 1658, 1603. Спектр ЯМР 1Н, δ, м. д.:
H 5.33; N 8.29.
форма A (59%), 3.76 с (3Н, МеО), 4.59 с (2Н, СН2),
Этил-4-(4-метилфенил)-4-оксо-2-[2-(фе-
7.55 м (9Н, НAr), 11.25 с (1Н, NH); форма Б (36%),
нилкарбонил)гидразинилиден]бутаноат
(2ж).
3.28 д (1H, C4H2, J = 20.0 Гц), 3.40 д (1H, C4H2, J =
Выход 0.99 г (56%), желтые кристаллы, т. пл.
20.0 Гц), 3.88 с (3Н, МеО), 7.55 м (10Н, НAr + OH);
119-120°C (пропан-2-ол). ИК спектр, ν, см-1: 3236,
форма В (5%), 3.79 с (3Н, МеО), 4.35 с (2Н, СН2),
3145, 1715, 1683, 1662, 1605. Спектр ЯМР 1Н, δ,
7.55 м (9Н, НAr), 12.98 уш. с (1Н, NH). Найдено, %:
м. д.: форма A (36%), 1.23 м (3Н, Ме), 2.29 с (3Н,
C 64.40; H 5.12; N 7.91. C19H18N2O5. Вычислено,
Ме), 4.23 м (2Н, СН2), 4.57 с (2Н, СН2), 7.57 м (9Н,
%: C 64.42; H 5.15; N 7.93.
НAr), 11.30 с (1Н, NH); форма Б (54%), 1.23 м (3Н,
Метил-4-(4-бромфенил)-4-оксо-2-[2-(фенил-
Ме), 2.40 с (3Н, Ме), 3.26 д (1H, C4H2, J = 20.0 Гц),
карбонил)гидразинилиден]бутаноат (2г). Выход
3.34 д (1H, C4H2, J = 20.0 Гц), 4.23 м (2Н, СН2), 7.07
1.25 г
(62%), бесцветные кристаллы, т. пл.
уш. с (OH), 7.57 м (9Н, НAr); форма В (10%), 1.14
148-150°C (пропан-2-ол). ИК спектр, ν, см-1: 3310,
т (3Н, Ме, J = 20.0 Гц), 2.34 с (3Н, Ме), 4.23 м (2Н,
1718, 1638, 1586. Спектр ЯМР 1Н, δ, м. д.: форма
СН2), 4.32 с (2Н, СН2), 7.57 м (9Н, НAr), 12.95 уш.
A (15%), 3.74 с (3Н, МеО), 4.59 с (2Н, СН2), 7.60
с (1Н, NH). Найдено, %: C 68.17; H 5.72; N 7.95.
м (9Н, НAr), 11.25 с (1Н, NH); форма Б (83%), 3.31
C20H20N2O4. Вычислено, %: C 68.19; H 5.70; N 7.92.
д (1H, C4H2, J = 20.0 Гц), 3.37 д (1H, C4H2, J =
Этил-4-(4-бромфенил)-4-оксо-2-[2-(фенил-
20.0 Гц), 3.78 с (3Н, МеО), 7.26 с (1Н, ОН), 7.60 м
карбонил)гидразинилиден]бутаноат (2з). Выход
(9Н, НAr); форма В (2%), 3.77 с (3Н, МеО), 4.34 с
1.38 г (66%), желтые кристаллы, т. пл. 106-107°C
(2Н, СН2), 7.60 м (9Н, НAr), 12.86 уш. с (1Н, NH).
(пропан-2-ол). ИК спектр, ν, см-1: 3358, 1710, 1637,
Найдено, %: C 53.62; H 3.75; N 6.95. C18H15BrN2O4.
1588. Спектр ЯМР 1Н, δ, м. д.: форма A (13%), 1.24
Вычислено, %: C 53.64; H 3.73; N 6.97.
м (3Н, Ме), 4.23 м (2Н, СН2), 4.58 с (2Н, СН2), 7.63
Этил-5,5-диметил-4-оксо-2-[2-(фенилкарбо-
м (9Н, НAr), 11.30 с (1Н, NH); форма Б (85%), 1.24
нил)гидразинилиден]гексаноат (2д). Выход 0.81 г
м (3Н, Ме), 3.31 д (1H, C4H2, J = 20.0 Гц), 3.36 д
(52%), бесцветные кристаллы, т. пл. 130-131°C
(1H, C4H2, J = 20.0 Гц), 4.23 м (2Н, СН2), 7.33 с
(пропан-2-ол). Спектр ЯМР 1Н, δ, м. д.: форма A
(OH), 7.63 м (9Н, НAr); форма В (2%), 1.14 т (3Н,
(88%), 1.18 c (9H, t-Bu), 1.24 т (3Н, Ме, J = 7.0 Гц),
Ме, J = 20.0 Гц), 4.23 м (2Н, СН2), 4.35 с (2Н, СН2),
4.13 с (2Н, СН2), 4.18 к (2Н, СН2, J = 7.0 Гц), 7.63
7.63 м (9Н, НAr), 12.94 уш. с (1Н, NH). Найдено, %:
м (5Н, НAr), 11.27 с (1Н, NH); форма Б (12%), 1.06
C 54.69; H 4.11; N 6.71. C19H17BrN2O4. Вычислено,
c (9H, t-Bu), 1.20 т (3Н, Ме, J = 7.0 Гц), 2.95 д (1H,
%: C 54.66; H 4.14; N 6.73.
C4H2, J = 20.0 Гц), 3.46 д (1H, C4H2, J = 20.0 Гц),
4.20 к (2Н, СН2, J = 7.0 Гц), 7.67 м (6Н, НAr + ОН).
Изопропил-5,5-диметил-4-оксо-2-[2-(фе-
Спектр ЯМР 13С, δС, м. д: 13.89, 25.52, 25.93, 35.85,
нилкарбонил)гидразинилиден]гексаноат
(2и).
43.93, 60.94, 61.15, 103.05, 127.70, 128.08, 128.80,
Выход 1.01 г (61%), бесцветные кристаллы, т. пл.
130.82, 131.79, 141.96, 133.16, 163.79, 209.88. Най-
95-96°C (пропан-2-ол). Спектр ЯМР 1Н, δ, м. д.:
дено, %: C 64.13; H 6.97; N 8.80. C17H22N2O4. Вы-
форма A (25%), 1.28 м (15Н, t-Bu, 2Ме), 4.12 с (2Н,
числено, %: C 64.15; H 6.94; N 8.83.
СН2), 5.09 м (1Н, СН), 7.70 м (5Н, НAr), 11.08 с (1Н,
Этил-4-оксо-4-фенил-2-[2-(фенилкарбонил)
NH); форма Б (6%), 1.10 с (9Н, t-Bu), 1.21 м (6Н,
гидразинилиден]бутаноат
(2е). Выход
0.93 г
2Ме), 2.98 д (1H, C4H2, J = 20.0 Гц), 3.45 д (1H,
(55%), желтые кристаллы, т. пл. 98-100°C (про-
C4H2, J = 20.0 Гц), 4.23 м (2Н, СН2), 5.09 м (1Н,
пан-2-ол). ИК спектр, ν, см-1: 3358, 1709, 1638,
СН), 5.76 уш. с (OH), 7.70 м (5Н, НAr); форма В
1588. Спектр ЯМР 1Н, δ, м. д: форма A (17%), 3.77
(69%), 1.21м (15Н, t-Bu, 2Ме), 3.89 с (2Н, СН2), 5.09
т (3Н, Ме, J = 7.1 Гц), 4.60 с (2Н, СН2), 7.62 м (10Н,
м (1Н, СН), 7.70 м (5Н, НAr), 12.96 уш. с (1Н, NH).
НAr), 11.30 с (1Н, NH); форма Б (48%), 3.28 д (1H,
Найдено, %: C 65.04; H 7.28; N 8.43. C18H24N2O4.
C4H2, J = 20.0 Гц), 3.36 д (1H, C4H2, J = 20.0 Гц),
Вычислено, %: C 65.06; H 7.25; N 8.46.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
718
КИЗИМОВА и др.
Изопропил-4-оксо-4-фенил-2-[2-(фенилкар-
Метил-(Z)-4-оксо-4-фенил-2-{2-[2-(фенил-
бонил)гидразинилиден]бутаноат
(2к). Выход
амино)фенилкарбонил]гидразинилиден}бута-
1.06 г (60%), желтые кристаллы, т. пл. 95-96°C
ноат (2н). Выход 1.04 г (50%), желтые кристаллы,
(пропан-2-ол). Спектр ЯМР 1Н, δ, м. д.: форма A
т. пл. 100-102°C (пропан-2-ол). ИК спектр, ν, см-1:
(17%), 1.21д (6Н, 2Ме, J = 6.3 Гц), 4.59 с (2Н, СН2),
3341, 1720, 1646, 1594. Спектр ЯМР 1Н, δ, м. д.:
4.99 м (1Н, СН), 7.63 м (10Н, НAr), 11.29 с (1Н,
форма A (24%), 3.76 c (3Н, МеO), 4.60 с (2Н, СН2),
NH); форма Б (51%), 1.25 т (6Н, 2Ме, J = 5.9 Гц),
7.31 м (14Н, НAr), 8.56 уш. с (1Н, NH), 11.46 с (1Н,
3.27 д (1H, C4H2, J = 20.0 Гц), 3.35 д (1H, C4H2, J =
NH); форма Б (76%), 3.29 д (1H, C4H2, J = 20.0 Гц),
20.0 Гц), 5.06 т. д (1Н, СН, J = 6.2, 4.1 Гц), 7.16 уш.
3.36 д (1H, C4H2, J = 20.0 Гц), 3.79 с (3Н, МеО),
с (OH), 7.63 м (10Н, НAr); форма В (32%), 1.14 д
7.31 м (16Н, НAr + NH + ОН). Спектр ЯМР 13С,
(6Н, 2Ме, J = 6.3 Гц), 4.33 с (2Н, СН2), 5.06 т. д (1Н,
δС, м. д: 50.92, 52.34, 94.26, 117.89, 118.31, 119.04,
СН, J = 6.2 Гц), 7.63 м (10Н, НAr), 13.01 с (1Н, NH).
119.55,
120.94,
121.57,
124.75,
127.39,
127.94,
Найдено, %: C 68.14; H 5.75; N 7.98. C20H20N2O4.
128.72, 129.15, 129.20, 130.59, 131.46, 132.42,
Вычислено, %: C 68.16; H 5.73; N 7.96.
133.54, 135.98, 141.94, 142.52, 142.85, 143.84,
Изопропил-4-(4-бромфенил)-4-оксо-2-[2-(фе-
145.18, 161.48, 164.73, 167.38, 194.11. Найдено, %:
C 69.39; H 5.14; N 10.14. C24H21N3O4. Вычислено,
нилкарбонил)гидразинилиден]бутаноат
(2л).
%: C 69.36; H 5.16; N 10.17.
Выход 1.38 г (64%), желтые кристаллы, т. пл.
116-117°C (пропан-2-ол). Спектр ЯМР 1Н, δ, м. д.:
Метил-(Z)-4-метилфенил-4-оксо-2-{2-[2-(фе-
форма A (23%), 1.21 д (6Н, 2Ме, J = 6.3 Гц), 4.56 с
ниламино)фенилкарбонил]гидразинилиден}бу-
(2Н, СН2), 4.99 м (1Н, СН), 7.62 м (9Н, НAr), 11.19
таноат (2о). Выход 1.37 г (64%), желтые кристал-
с (1Н, NH); форма Б (71%),1.25 м (6Н, 2Ме), 3.29
лы, т. пл. 135-136°C (пропан-2-ол). ИК спектр, ν,
д (1H, C4H2, J = 20.0 Гц), 3.34 д (1H, C4H2, J =
см-1: 3351, 1719, 1678, 1642, 1594. Спектр ЯМР 1Н,
20.0 Гц), 5.05 м (1Н, СН), 7.31 уш. с (OH), 7.62
δ, м. д.: форма A (19%), 2.41c (3Н, Ме), 3.78c (3Н,
м (9Н, НAr); форма В (6%), 1.14 д (6Н, 2Ме, J =
МеO), 4.56 с (2Н, СН2), 7.24 м (13Н, НAr), 8.56 с
6.3 Гц), 4.32 с (2Н, СН2), 5.05 м (1Н, СН), 7.62 м
(1Н, NH), 11.45 с (1Н, NH); форма Б (48%), 2.38 с
(9Н, НAr), 12.96 уш. с (1Н, NH). Найдено, %: C
(3Н, Ме), 3.26 д (1H, C4H2, J =20.0 Гц), 3.34 д (1H,
55.70; H 4.44; N 6.50. C20H19BrN2O4. Вычислено,
C4H2, J = 20.0 Гц), 3.78 с (3Н, МеО), 7.24 м (15Н,
%: C 55.73; H 4.42; N 6.53.
НAr + NH + ОН); форма В (3%), 2.30 с (3Н, Ме),
3.72 с (3Н, МеО), 4.32 с (2Н, СН2), 7.24 м (14Н,
Метил-(Z)-5,5-диметил-4-оксо-2-{2-[2-(фенил-
НAr + NH). Спектр ЯМР 13С, δС, м. д: 20.58, 21.16,
амино)фенилкарбонил]гидразинилиден}гекса-
37.46, 50.88, 52.31, 94.3, 116.56, 117.83, 118.33,
ноат (2м). Выход 1.60 г (81%), желтые кристаллы,
118.95,
119.05,
119.52,
120.94,
121.58,
123.65,
т. пл. 152-154°C (пропан-2-ол). ИК спектр, ν, см-1:
3380, 3202, 1722, 1640, 1584. Спектр ЯМР 1Н, δ,
124.7, 128.36, 128.49, 129.14, 129.26, 130.3, 130.57,
131.42, 133.42, 133.56, 136.58, 139.60, 141.94,
м. д.: форма A (86%), 1.15 c (9H, t-Bu), 3.73 c (3Н,
142.53, 142.63, 143.84, 144.02, 145.12, 161.51,
МеO), 4.08 с (2Н, СН2), 7.24 м (9Н, НAr), 8.50 уш.
164.73, 167.38, 193.69. Найдено, %: C 69.92; H
с (1Н, NH), 11.32 с (1Н, NH); форма Б (14%), 2.91
5.40; N 9.78. C25H23N3O4. Вычислено, %: C 69.94;
д (1H, C4H2, J = 20.0 Гц), 3.43 д (1H, C4H2, J =
20.0 Гц), 3.72 с (3Н, МеО), 6.46 уш. с (1Н, ОH),
H 5.43; N 9.76.
7.24 м (10Н, НAr + NH). Спектр ЯМР 13С, δС, м. д:
Метил-(Z)-4-(4-метоксифенил)-4-оксо-2-
25.41, 25.87, 35.92, 43.96, 52.13, 116.72, 117.7,
{2-[2-(фениламино)фенилкарбонил]гидразини-
118.95,
119.07,
121.47,
129.07,
130.26,
132.33,
лиден}бутаноат (2п). Выход 1.11 г (50%), желтые
141.96, 143.73, 146.25, 161.22, 164.39, 209.79.
кристаллы, т. пл. 100-102°C (пропан-2-ол). ИК
Масс-спектр, m/z (Iотн, %): 395 (9.0) [M]+, 336 (4.0)
спектр, ν, см-1: 3356, 1725, 1684, 1673, 1645, 1595.
[M - COOCH3]+, 196 (100.0) [2-(PhNH)С6Н4CO]+,
Спектр ЯМР 1Н, δ, м. д.: форма A (58%), 3.79c (3Н,
168 (7.0) [M - COOCH3 - PhNHPh]+. Найдено, %:
МеO), 3.87c (3Н, МеO), 4.54 с (2Н, СН2), 7.24 м
C 66.82; H 6.37; N 10.63. C22H25N3O4. Вычислено,
(13Н, НAr), 8.57 уш. с (1Н, NH), 11.45 с (1Н, NH);
%: C 66.84; H 6.34; N 10.65.
форма Б (37%), 3.28 д (1H, C4H2, J = 20.0 Гц), 3.34
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
ВЗАИМОДЕЙСТВИЕ N'-[2-ОКСО-5-R-ФУPАН-3(2Н)-ИЛИДЕН]АЦИЛГИДР
АЗИДОВ
719
д (1H, C4H2, J = 20.0 Гц), 3.75 с (3Н, МеО), 3.85 с
94.19, 109.06, 110.62, 111.02, 111.35, 116.59, 117.18,
(3Н, МеО), 7.24 м (15Н, НAr + NH + ОН); форма В
117.58,
118.45,
118.99,
119.02,
119.37,
121.02,
(5%), 3.72 с (3Н, МеО), 3.79 с (3Н, МеО), 4.30 с (2Н,
121.59, 123.23, 123.57, 128.89, 129.15, 129.25,
СН2), 7.24 м (14Н, НAr + NH), 12.99 уш. с (1Н, NH).
130.26, 130.54, 131.36, 132.4, 141.93, 142.49, 143.8,
Спектр ЯМР 13С, δС, м. д: 37.22, 50.67, 52.29, 55.08,
145.22, 148.64, 153.52, 164.7, 167.4, 192.64. Найде-
55.61, 94.25, 113.27, 113.94, 116.58, 117.86, 118.30,
но, %: C 67.96; H 5.48; N 9.14. C26H25N3O5. Вычис-
118.97,
119.05,
119.53,
120.91,
121.59,
123.74,
лено, %: C 67.98; H 5.46; N 9.17.
126.10, 128.96, 129.14, 129.26, 130.29, 130.62,
Метил-(Z)-4-(4-бромфенил)-4-оксо-2-{2-[2-
132.42, 141.94, 142.65, 143.85, 145.13, 158.57,
(фениламино)фенилкарбонил]гидразинил-
161.53, 163.53, 163.47, 164.74, 167.46, 192.58. Най-
иден}бутаноат (2т). Выход 1.24 г (50%), желтые
дено, %: C 67.41; H 5.20; N 9.43. C25H23N3O5. Вы-
кристаллы, т. пл. 133-135°C (пропан-2-ол). ИК
числено, %: C 67.43; H 5.22; N 9.46.
спектр, ν, см-1: 3257, 1707, 1656, 1574. Спектр
Метил-(Z)-4-оксо-2-{2-[2-(фениламино)фе-
ЯМР 1Н, δ, м. д.: форма A (12%), 3.76 с (3Н, МеО),
нилкарбонил]гидразинилиден}-4-(4-этоксифе-
4.58 с (2Н, СН2), 7.26 м (13Н, НAr), 8.55 уш. с (1Н,
нил)бутаноат (2р). Выход 1.63 г (71%), желтые
NH), 11.45 с (1Н, NH); форма Б (86%), 3.26 д (1H,
кристаллы, т. пл. 130-132°C (пропан-2-ол). ИК
C4H2, J = 20.0 Гц), 3.35 д (1H, C4H2, J = 20.0 Гц),
спектр, ν, см-1: 3354 ш, 3205, 1722, 1667, 1598.
3.79 с (3Н, МеО), 7.26 м (14Н, НAr + ОН); форма
Спектр ЯМР 1Н, δ, м. д.: форма A (39%), 1.32 т
В (2%), 3.73 с (3Н, МеО), 4.35 с (2Н, СН2), 7.26
(3Н, Ме, J = 7.0 Гц), 3.79c (3Н, МеO), 4.02 к (2H,
м (14Н, НAr + NH), 13.02 уш. с (1Н, NH). Спектр
OCH2CH3, J = 7.0 Гц), 4.54 с (2Н, СН2), 7.27 м
ЯМР 13С, δС, м. д: 50.67, 52.35, 61.30, 93.71, 118.21,
(13Н, НAr), 8.57 с (1Н, NH), 11.45 с (1Н, NH); фор-
118.39,
119.05,
119.70,
120.67,
120.84,
123.92,
ма Б (57%), 1.37 т (3Н, Ме, J = 7.0 Гц), 3.28 д (1H,
127.23, 129.13, 129.25, 130.20, 130.50, 130.78,
C4H2, J = 20.0 Гц), 3.33 д (1H, C4H2, J = 20.0 Гц),
131.47, 131.82, 141.94, 142.43, 142.81, 145.27,
3.75 с (3Н, МеО), 4.16 к (2H, OCH2CH3, J = 7.0 Гц),
161.42,167.30, 193.34. Найдено, %: C 58.31; H 4.08;
7.24 м (15Н, НAr + NH + ОН); форма В (4%), 1.32 т
N 8.50. C24H20BrN3O4. Вычислено, %: C 58.33; H
(3Н, Ме, J = 7.0 Гц), 3.72 с (3Н, МеО), 4.29 с (2Н,
4.06; N 8.52.
СН2), 7.24 м (14Н, НAr + NH), 13.02 уш. с (1Н, NH).
Метил-(Z)-4-оксо-2-{2-[2-(фениламино)фе-
Спектр ЯМР 13С, δС, м. д: 14.41, 14.62, 37.19, 50.79,
нилкарбонил]гидразинилиден}-4-(4-фторфе-
52.28, 63.00, 63.63, 94.28, 113.74, 114.33, 116.57,
нил)бутаноат (2у). Выход 1.10 г (51%), желтые
117.86,
118.29,
118.96,
119.05,
119.53,
120.91,
кристаллы, т. пл. 123-125°C (пропан-2-ол). ИК
121.59, 123.66, 126.08, 128.80, 129.14, 129.26,
спектр, ν, см-1: 3345 ш, 3169 ш, 1717, 1692, 1640,
130.29, 130.62, 131.41, 132.42, 134.42, 140.99,
1595. Спектр ЯМР 1Н, δ, м. д.: форма A (68%), 3.75
141.94, 142.50, 142.64, 143.85, 145.04, 157.82,
c (3Н, МеO), 4.58 с (2Н, СН2), 7.36 м (12Н, НAr), 8.56
161.45, 162.76, 164.75, 167.37, 192.54. Найдено, %:
уш. с (1Н, NH), 11.44 с (1Н, NH); форма Б (24%),
C 67.96; H 5.48; N 9.14. C26H25N3O5. Вычислено,
3.21 д (1H, C4H2, J = 20.0 Гц), 3.37 д (1H, C4H2, J =
%: C 67.98; H 5.46; N 9.17.
20.0 Гц), 3.79 с (3Н, МеО), 7.36 м (14Н, НAr + NH +
Метил-(Z)-4-(3,4-диметоксифенил)-4-оксо-
ОН); форма В (8%), 3.82 c (3Н, МеO), 4.32 с (2Н,
2-{2-[2-(фениламино)фенилкарбонил]гидрази-
СН2), 7.36 м (13Н, НAr + NH). Спектр ЯМР 13С,
нилиден}бутаноат (2с). Выход 1.31 г (55%), жел-
δС, м. д.: 37.50, 50.71, 52.27, 93.73, 114.40, 114.62,
тые кристаллы, т. пл. 103-105°C (пропан-2-ол).
115.58,
115.80,
116.56,
118.14,
118.95,
119.59,
ИК спектр, ν, см-1: 3279, 1714, 1668, 1589. Спектр
120.80, 121.51, 123.82, 126.92, 127.00, 129.07,
ЯМР 1Н, δ, м. д.: форма A (48%), 3.75 с (3Н, МеО),
129.19, 130.24, 130.46, 131.14, 131.23, 131.38,
3.75 с (3Н, МеО), 4.56 с (2Н, СН2), 7.26 м (12Н,
132.38, 132.67, 138.50, 141.87, 142.35, 142.68,
НAr), 8.57 с (1Н, NH), 11.14 с (1Н, NH); форма A
143.76, 145.15, 161.39, 164.63, 167.29, 192.69. Най-
(52%), 3.27 д (1Н, СН2, J = 20.0 Гц), 3.36 д (1Н,
дено, %: C 66.51; H 4.65; N 9.69. C24H20FN3O4. Вы-
СН2, J = 20.0 Гц), 3.75 с (3Н, МеО), 3.75 с (3Н,
числено, %: C 66.54; H 4.63; N 9.67.
МеО), 7.24 м (14Н, НAr + NH + ОН). Спектр ЯМР
Метил-(Z)-4-оксо-2-(2-[2-(фениламино)фе-
13С, δС, м. д: 37.19, 52.3, 55.47, 55.58, 55.65, 55.86,
нилкарбонил]гидразинилиден}-4-(4-хлорфе-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
720
КИЗИМОВА и др.
нил)бутаноат (2ф). Выход 1.40 г (62%), желтые
94.28, 116.53, 117.31, 117.63, 118.45, 118.94, 119.04,
кристаллы, т. пл. 132-134°C (пропан-2-ол). Спектр
119.42,
119.53,
119.66,
120.99,
121.58,
121.98,
ЯМР 1Н, δ, м. д.: форма A (24%), 3.79 с (3Н, МеО),
123.55, 124.69, 128.23, 128.35, 128.49, 128.82,
4.58 с (2Н, СН2), 7.36 м (13Н, НAr), 8.54 уш. с (1Н,
129.14, 129.25, 129.29, 129.33, 130.31, 130.62,
NH), 11.44 с (1Н, NH); форма Б (76%), 3.13 д (1H,
131.43, 132.37, 133.53, 133.60, 136.53, 139.69,
C4H2, J = 20.0 Гц), 3.35 д (1H, C4H2, J = 20.0 Гц),
141.95, 142.57, 142.62, 144.00, 144.14, 161.01,
3.75 с (3Н, МеО), 7.36 м (14Н, НAr + OH), 8.92 уш.
161.40, 164.18, 167.39, 193.76, 196.31. Найдено, %:
с (1Н, NH). Спектр ЯМР 13С, δС, м. д: 50.70, 52.35,
C 69.92; H 5.40; N 9.78. C25H23N3O4. Вычислено,
93.66, 118.19, 119.03, 119.36, 119.71, 120.83, 123.95,
%: C 69.94; H 5.43; N 9.76.
126.88, 127.84, 128.85, 129.12, 130.10, 130.49,
Этил-(Z)-4-оксо-4-метилфенил-2-{2-[2-(фе-
131.46, 132.09, 141.48, 142.40, 142.81, 145.26,
ниламино)фенилкарбонил]гидразинилиден}бу-
161.42, 167.29. Найдено, %: C 64.07; H 4.48; N 9.34.
таноат (2ч). Выход 1.86 г (84%), желтые кристал-
C24H20ClN3O4. Вычислено, %: C 64.05; H 4.46; N
лы, т. пл. 155-157°C (пропан-2-ол). ИК спектр,
9.37.
ν, см-1: 3351, 1712, 1685, 1577. Спектр ЯМР 1Н,
δ, м. д.: форма А (23%), 1.23 т (3Н, CH2CH3, J =
Этил-(Z)-5,5-диметил-4-оксо-2-{2-[2-(фенил-
7.1 Гц), 2.30 с (3Н, Ме), 4.26 м (2Н, CH2CH3), 7.25
амино)фенилкарбонил]гидразинилиден}гекса-
м (13Н, НAr), 8.56 уш. с (1Н, NH), 11.44 с (1Н, NH);
ноат (2х). Выход 1.76 г (86%), желтые кристаллы,
форма Б (73%), 1.26 т (3Н, CH2CH3, J = 7.1 Гц),
т. пл. 129-130°C (пропан-2-ол). ИК спектр, ν, см-1:
2.41 с (3Н, Ме), 3.26 д (1H, C4H2, J = 20.0 Гц), 3.33
3378, 1709, 1639, 1589. Спектр ЯМР 1Н, δ, м. д.:
д (1H, C4H2, J = 20.0 Гц), 7.25 м (15Н, НAr + NH +
форма A (85%), 1.15 с (9Н, t-Bu), 1.23 м (3Н,
ОН); форма В (4%), 1.12 т (3Н, CH2CH3, J =
CH2CH3), 4.07 с (2Н, СН2), 4.18 к (2Н, CH2CH3,
7.1 Гц), 2.38 с (3Н, Ме), 4.30 с (2Н, СН2), 7.25 м
J = 7.1 Гц), 7.25 м (13Н, НAr), 8.48 уш. с (1Н,
(14Н, НAr + NH), 13.04 уш. с (1Н, NH). Спектр
NH), 11.31 с (1Н, NH); форма Б (15%), 1.03 с (9H,
ЯМР 13С, δС, м. д: 13.98, 20.58, 21.15, 37.45, 50.93,
t-Bu), 1.23 м (3Н, CH2CH3), 2.91 д (1H, C4H2, J =
61.12, 61.26, 94.28, 116.54, 117.63, 118.45, 119.04,
20.0 Гц), 3.43д (1H, C4H2, J = 20.0 Гц), 4.18 к (2Н,
121.00, 123.55, 124.69, 128.35, 128.49, 129.14,
CH2CH3, J = 7.1 Гц), 6.45 уш. с (1Н, OH), 7.25 м
129.25, 129.34, 131.43, 133.60, 136.53, 139.69,
(10Н, НAr + NH). Спектр ЯМР 13С, δС, м. д: 13.97,
141.95, 142.57, 142.62, 144.00, 145.40, 161.01,
25.54, 25.97, 35.98, 43.99, 61.01, 116.78, 119.00,
164.18, 167.39, 193.77. Найдено, %: C 70.41; H
119.16,
121.50,
129.04,
129.24,
130.36,
132.34,
5.68; N 9.47. C26H25N3O4. Вычислено, %: C 70.43;
142.07, 143.75, 163.85, 209.85. Найдено, %: C
H 5.65; N 9.49.
67.46; H 6.65; N 10.26. C23H27N3O4. Вычислено, %:
Этил-(Z)-4-(4-метоксифенил)-4-оксо-2-
C 67.48; H 6.63; N 10.29.
{2-[2-(фениламино)фенилкарбонил]гидразинил-
Этил-(Z)-4-оксо-4-фенил-2-{2-[2-(фенилами-
иден}бутаноат (2ш). Выход 1.15 г (50%), жел-
но)фенилкарбонил]гидразинилиден}бутаноат
тые кристаллы, т. пл. 140-142°C (пропан-2-ол).
(2ц). Выход 1.83 г (87%), желтые кристаллы, т. пл.
ИК спектр, ν, см-1: 3352, 3164, 1706, 1681, 1595.
142-144°C (пропан-2-ол). ИК спектр, ν, см-1: 3380,
Спектр ЯМР 1Н, δ, м. д.: форма А (86%), 1.23
3276, 1714, 1684, 1640, 1595. Спектр ЯМР 1Н, м. д.:
м (3Н, CH2CH3), 3.87 с (3Н, МеО), 4.22 м (2Н,
форма A (25%), 1.23 т (3Н, CH2CH3, J = 7.1 Гц), 4.23
СН2СН3), 4.53 с (2Н, СН2), 7.25 м (13Н, НAr), 8.53
т (2Н, CH2CH3, J = 7.1 Гц), 4.56 с (2Н, СН2), 7.27 м
уш. с (1Н, NH), 11.43 с (1Н, NH); форма В (14%),
(14Н, НAr), 8.56 уш. с (1Н, NH), 11.44 с (1Н, NH);
1.23 м (3Н, CH2CH3), 3.75 с (3Н, МеО), 4.22 м (2Н,
форма Б (49%), 1.25 т (3Н, CH2CH3, J =7.1 Гц),
СН2СН3), 4.26 с (2Н, СН2), 7.25 м (14Н, НAr + NH).
3.26 д (1H, C4H2, J =20.0 Гц), 3.33 д (1H, C4H2, J =
Спектр ЯМР 13С, δС, м. д: 13.91, 37.13, 55.01, 55.53,
20.0 Гц), 4.23 м (2Н, CH2CH3), 7.27 м (15Н, НAr +
61.05, 113.20, 113.87, 116.50, 118.34, 118.90, 118.96,
ОН), 9.01 уш. с (1Н, NH); форма В (6%), 1.12 т (3Н,
121.50, 126.02, 128.91, 129.07, 129.19, 130.21,
CH2CH3, J = 7.1 Гц), 4.23 м (2Н, CH2CH3), 4.30
130.54, 131.35, 132.32, 134.53, 141.88, 143.74,
с (2Н, СН2), 7.27 м (15Н, НAr + NH), 13.05 уш. с
163.40, 164.13, 192.60. Найдено, %: C 67.96; H
(1Н, NH). Спектр ЯМР 13С, δС, м. д: 13.52, 13.98,
5.48; N 9.14. C26H25N3O5. Вычислено, %: C 67.94;
20.58, 21.15, 37.44, 43.74, 50.93, 61.11, 61.28, 61.72,
H 5.45; N 9.16.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
ВЗАИМОДЕЙСТВИЕ N'-[2-ОКСО-5-R-ФУPАН-3(2Н)-ИЛИДЕН]АЦИЛГИДР
АЗИДОВ
721
Этил-(Z)-4-оксо-2-{2-[2-(фениламино)фенил-
СН2), 5.08 м (1Н, СН), 7.26 м (9Н, НAr), 8.91 уш. с
карбонил]гидразинилиден}-4-(4-хлорфенил)
(1H, NH), 12.97 с (1H, NH). Найдено, %: C 70.88; H
бутаноат (2щ). Выход 1.72 г (74%), желтые кри-
5.95; N 9.18. C27H27N3O4. Вычислено, %: C 70.85;
сталлы, т. пл. 112-114°C (пропан-2-ол). ИК спектр,
H 5.97; N 9.16.
ν, см-1: 3329 ш, 3257, 1705, 1666, 1589. Спектр
КОНФЛИКТ ИНТЕРЕСОВ
ЯМР, м. д.: форма А (6%), 1.23 т (3Н, CH2CH3, J =
7.1 Гц), 4.26 м (2Н, CH2CH3), 4.57 с (2Н, СН2), 7.28
Авторы заявляют об отсутствии конфликта
м (13Н, НAr), 8.53 уш. с (1Н, NH), 11.40 с (1Н, NH);
интересов.
форма Б (92%), 1.26 т (3Н, CH2CH3, J = 7.1 Гц),
СПИСОК ЛИТЕРАТУРЫ
3.17 д (1H, C4H2, J = 20.0 Гц), 3.35 д (1H, C4H2, J =
1. Кириков А.Ю., Игидов Н.М., Гольдштейн А.Г., Ко-
20.0 Гц), 4.26 м (2Н, CH2CH3), 7.28 м (15Н, НAr +
тегов В.П., Махмудов Р.Р. // Научные ведомости
NH + ОН); форма В (2%), 1.12 т (3Н, CH2CH3, J =
БелГУ. Серия Медицина. Фармация. 2012. Т. 19.
7.1 Гц), 4.26 м (2Н, CH2CH3), 4.34 с (2Н, СН2), 7.28
№ 16. C. 135.
м (15Н, НAr + NH), 13.03 уш. с (1Н, NH). Спектр
2. Рубцов А.Е., Залесов В.В. // ЖОрХ. 2007. Т. 43.
ЯМР 13С, δС, м. д:13.98, 50.76, 61.30, 93.63, 118.03,
Вып. 5. С. 739; Rubtsov A.E., Zalesov V.V. // Russ. J.
118.32,
120.90,
123.85,
126.69,
127.84,
129.13,
Org. Chem. 2007. Vol. 43. N 5. P. 735. doi 10.1134/
S1070428007050156
130.53, 131.47, 132.06, 141.50, 142.49, 142.75,
3. Шипиловских С.А., Рубцов А.Е. // Изв. АН. Сер. хим.
145.54, 160.92, 167.30, 193.21. Найдено, %: C
2014. № 9. С. 2205; Shipilovskikh S.A., Rubtsov A.E. //
64.73; H 4.78; N 9.06. C25H22ClN3O4. Вычислено,
Russ. Chem. Bull. 2014. Vol. 63. N 9. P. 2205. doi
%: C 64.71; H 4.76; N 9.03.
10.1007/s11172-014-0722-4
Изопропил-5,5-диметил-4-оксо-2-{2-[2-(фе-
4. Пулина Н.А., Залесов В.В., Быстрицкая О.А., Руб-
ниламино)фенилкарбонил]гидразинилиден}-
цов А.Е., Кутковая Н.В. // Хим.- фарм. ж. 2009. Т. 43.
№ 8. С. 17; Pulina N.A., Zalesov V.V., Bystritskaya O.A.,
гексаноат (2э). Выход 1.14 г (54%), желтые кри-
Rubtsov A.E., Kutkovaya N.V. // Pharm. Chem. J. 2009.
сталлы, т. пл. 105-107°C (пропан-2-ол). Спектр
Vol. 43. N 8. P. 444. doi 10.1007/s11094-009-0334-8
ЯМР 1Н, δ, м. д.: форма А (60%), 1.07 с (9Н, t-Bu),
5. Залесов, В.В., Рубцов А.Е. // ХГС. 2004. № 2.
1.25 д (6Н, 2Ме, J = 6.3 Гц), 4.07 с (2Н, СН2), 5.02
С. 163; Zalesov V.V., Rubtsov A.E. // Chem. Heterocycl.
м (1Н, СН), 7.24 м (5Н, НAr), 8.40 уш. с (1H, NH),
Compd. 2004. Vol. 40. N 2. P. 133. doi 10.1023/B:CO
11.15 с (1H, NH); форма Б (8%), 1.18 т (6Н, Ме,
HC.0000027884.75379.14
J = 3.7 Гц), 2.95 д (1H, C4H2, J = 20.0 Гц), 3.41 д
6. Кизимова И.А., Игидов Н.М., Чащина С.В., Чер-
нов И.Н., Рубцов А.Е. // ЖОрХ. 2019. Т. 55. Вып. 11.
(1H, C4H2, J = 20.0 Гц), 5.09 м (1Н, СН), 5.73 уш. с
С. 1737. doi 10.1134/S0514749219110119; Kizimo-
(OH), 7.24 м (6Н, НAr + NH); форма В (32%), 1.18 т
va I.A., Igidov N.M., Chaschina S.V., Chernov I.N.,
(6Н, Ме, J = 3.3 Гц), 3.84 с (2Н, СН2), 5.09 м (1Н,
Rubtsov A.E. // Russ. J. Org. Chem. 2019. Vol. 55.
СН), 7.24 м (5Н, НAr), 8.91 уш. с (1H, NH), 12.98
N 11. P. 1704. doi 10.1134/S1070428019110101
уш. с (1H, NH). Найдено, %: C 68.06; H 6.90; N
7. Игидов Н.М., Киселев М.А., Рубцов А.Е. // ЖОрХ.
9.92. C24H29N3O4. Вычислено, %: C 68.04; H 6.93;
2016. Т. 52. Вып. 4. С. 540; Igidov N.M., Kiselev M.A.,
N 9.95.
Rubtsov A.E. // Russ. J. Org. Chem. 2016. Vol. 52. N 4.
P. 526. doi 10.1134/S1070428016040084
Изопропил-4-(4-метилфенил)-4-оксо-2-
8. Киселев М.А., Игидов Н.М., Чернов И.Н., Токсаро-
{2-[2-(фениламино)фенилкарбонил]гидразини-
ва Ю.С., Рубцов А.Е. // ЖОрХ. 2017. Т. 53. Вып. 6.
лиден}бутаноат (2ю). Выход 1.19 г (52%), желтые
С. 903; Kiselev M.A., Igidov N.M., Chernov I.N.,
кристаллы, т. пл. 123-125°C (пропан-2-ол). Спектр
Toksarova Y.S., Rubtsov A. E. // Russ. J. Org.
ЯМР 1Н, δ, м. д.: форма А (40%), 1.24 д (6Н, Ме,
Chem. 2017. Vol. 53. N 6. P. 920. doi 10.1134/
J = 6.3 Гц), 2.43 с (3Н, Ме), 4.52 с (2Н, СН2), 5.08
S1070428017060173
9. Кизимова И.А., Игидов Н.М., Дмитриев М.В.,
м (1Н, СН), 7.26 м (9Н, НAr), 8.47 уш. с (1H, NH),
Чащина С.В., Махмудов Р.Р., Сюткина А.И. //
11.27 с (1H, NH); форма Б (48%), 1.29 м (6Н, Ме),
ЖОХ. 2019. Т. 89. Вып. 12. С. 1820. doi 10.1134/
2.32 с (3Н, Ме), 3.26 д (1H, C4H2, J = 20.0 Гц), 3.36
S0044460X19120035; Kizimova I.A., Igidov N.M., Dmi-
д (1H, C4H2, J = 20.0 Гц), 5.02 м (1Н, СН), 7.26
triev M.V., Chashchina S.V., Makhmudov R.R., Siutki-
м (11Н, НAr + NH + ОН); форма В (32%), 1.17 д
na A.I. // Russ. J. Gen. Chem. 2019. Vol. 89. N 12.
(6Н, 2Ме, J = 6.3 Гц), 2.43 с (3Н, Ме), 26 с (2Н,
P. 2345. doi 10.1134/S107036321912003X
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
722
КИЗИМОВА и др.
Reactions of N'-[2-Oxo-5-R-furan-3(2H)-ylidene]acylhydrazides
with Primary and Secondary Alcohols
I. A. Kizimovaa,*, N. M. Igidova, M. A. Kiseleva, D. V. Ivanovb, and A. I. Syutkinaa
a Perm State Pharmaceutical Academy of the Ministry of Health of the Russian Federation, Perm, 614990 Russia
b Perm State National Research University, Perm, 614068 Russia
*e-mail: icekingakiratotsuka@gmail.com
Received December 13, 2019; revised December 13, 2019; accepted December 22, 2019
Reactions of primary and secondary alcohols with N'-[2-oxo-5-R-furan-3(2H)-ylidene]acylhydrazides resulted in
the furan ring decylization to form 2-[2-(arylcarbonyl)hydrazinylidene]-4-alkyl esters of R-4-oxobutanoic acids.
Keywords: N'-[2-oxo-5-R-furan-3(2H)-ylidene]acylhydrazides, alkyl esters of 2-[2-(arylcarbonyl)hydraz-
inylidene]-4-R-4-oxobutanoic acids, primary and secondary alcohols
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020