ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 5, с. 723-729
УДК 547.551.525.211.1
СИНТЕЗ И ПРОТИВОМИКРОБНАЯ АКТИВНОСТЬ
МЕТИЛ-4-АРИЛ-2-{4-[(4,6-ДИМЕТИЛПИРИМИДИН-
2-ИЛ)СУЛЬФАМОИЛ]ФЕНИЛАМИНО}-4-ОКСОБУТ-
2-ЕНОАТОВ И ИХ СЕРЕБРЯНЫХ СОЛЕЙ
© 2020 г. В. Л. Гейна,*, О. В. Бобровскаяа, Е. А. Машкинаа, В. В. Новиковаа,
Р. Р. Махмудовb, А. Н. Янкинc, С. Е. Даниловd, Е. А. Хволиса,
В. Д. Белоноговаа, Д. К. Гуляева
a Пермская государственная фармацевтическая академия, ул. Полевая 2, Пермь, 614990 Россия
b Пермский государственный национальный исследовательский университет, Пермь, 614990 Россия
с Национальный исследовательский университет ИТМО, Санкт-Петербург, 197101 Россия
d Санкт-Петербургский государственный университет, Санкт-Петербург, 199034 Россия
*e-mail: geinvl48@mail.ru
Поступило в Редакцию 27 декабря 2019 г.
После доработки 27 декабря 2019 г.
Принято к печати 12 января 2020 г.
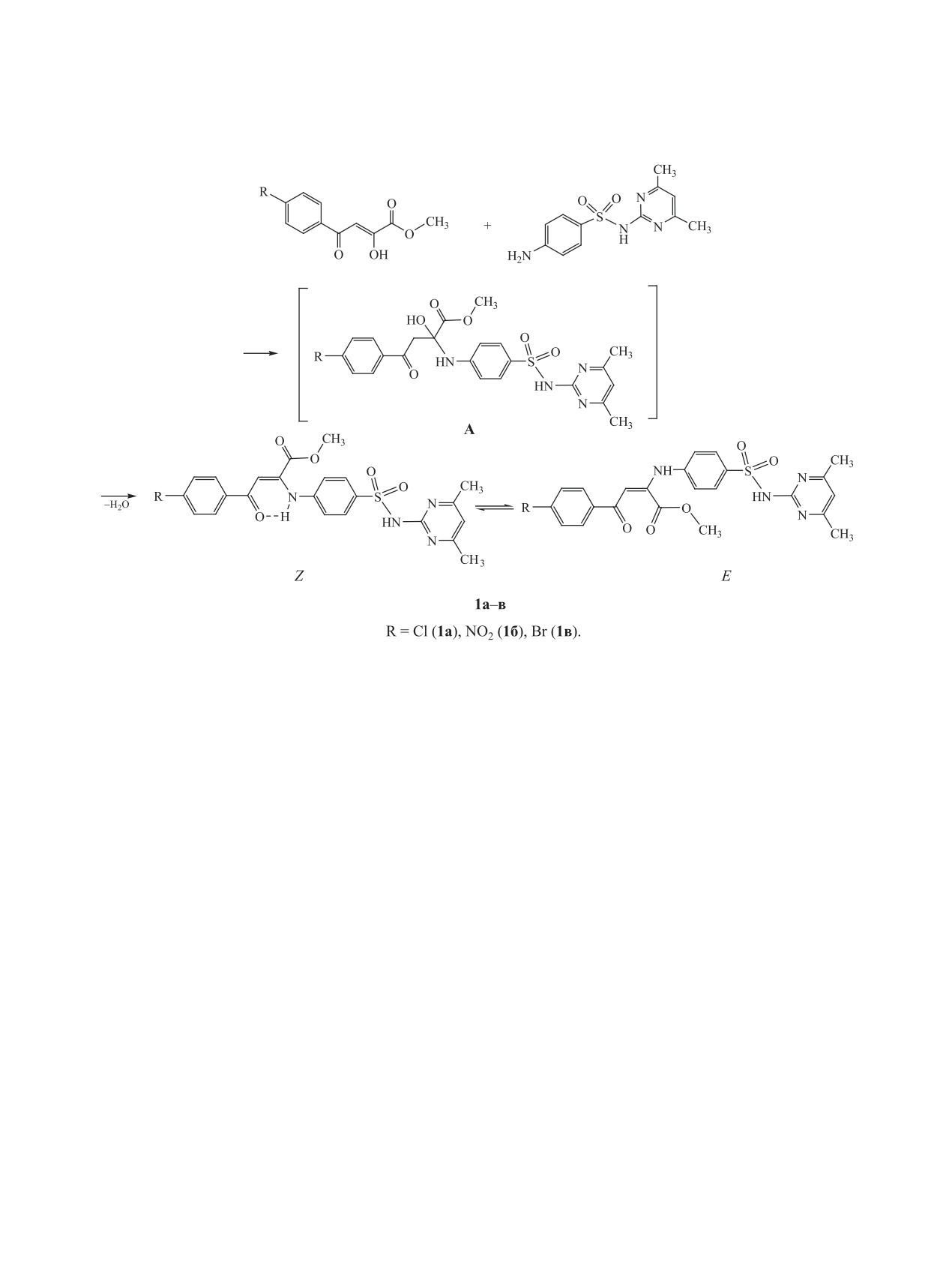
Реакцией метиловых эфиров ароилпировиноградных кислот с 2-(4-аминобензолсульфамидо)-4,6-ди-
метилпиримидином в смеси уксусная кислота-этанол (1:1) синтезированы новые метил-(2Z)-4-арил-2-
{4-[(4,6-диметилпиримидин-2-ил)сульфамоил]фениламино}-4-оксобут-2-еноаты, при взаимодействии
которых с нитратом серебра в среде этанол-ДМФА (2:1) образуются соответствующие соли. Изучена
противомикробная активность полученных соединений.
Ключевые слова: метил-(2Z)-4-арил-2-{4-[(4,6-диметилпиримидин-2-ил)сульфамоил]фениламино}-4-
оксобут-2-еноаты, 2-(4-аминобензолсульфамидо)-4,6-диметилпиримидин (сульфадимидин), серебряные
соли, противомикробная активность
DOI: 10.31857/S0044460X20050108
В последние годы модификация молекул из-
Однако реакции солеобразования по сульфа-
вестных лекарственных средств является одним из
мидной группе енаминоэфиров ароилпировино-
направлений поиска новых биологически актив-
градных кислот с ионами серебра и других ме-
ных соединений. На роль таких объектов можно
таллов не были изучены. С целью синтеза ранее
рассматривать бензолсульфониламиды, которые
неизвестных енаминоэфиров ароилпировино-
используются как лекарственные средства, обла-
градных кислот, их дальнейшей химической мо-
дающие антибактериальной, антисептической,
дификации и исследования противомикробной
диуретической, гипогликемической и другими ви-
активности взаимодействием метиловых эфиров
дами биологической активности [1]. Ранее нами
ароилпировиноградных кислот с 2-(4-аминобензо-
были синтезированы соединения, содержащие в
лсульфамидо)-4,6-диметилпиримидином в смеси
своем составе остатки сульфаниламидов, таких
уксусная кислота-этанол в соотношении 1:1 осу-
как стрептоцид, сульфацил, сульгин, норсульфа-
ществлен синтез новых метил-(2Z)-4-арил-2-{4-
зол, сульфадимезин [2-9], получены натриевые
[(4,6-диметилпиримидин-2-ил)сульфамоил]фени-
соли пирроло[3,4-с]пиразол-3-онов [10] и пира-
ламино}-4-оксобут-2-еноатов 1а-в (схема 1).
зол-3-карбоксамидов [11], а также их серебряные
Реакция протекает по механизму, описанному
соли [11, 12].
ранее в работах [4, 6, 8]. На первой стадии арома-
723
724
ГЕЙН и др.
Схема 1.
тическая аминогруппа сульфадимидина присоеди-
синглет протона SO2NH группы (11.88-11.90 м. д.).
няется по двойной связи α-карбонильной группы
По данным ЯМР 1Н, соединения 1а-в существуют
исходного метилового эфира ароилпировиноград-
в виде Z- и Е-изомеров с преобладанием Z-формы.
ной кислоты с образованием промежуточного сое-
Исходя из соотношения значений интегральной
динения А (карбиноламина), дегидратация которо-
интенсивности сигналов протона группы NH на
го приводит к соединениям 1а-в (cхема 1).
Z-форму приходится ~ 76-90%, на Е-форму ~ 10-
24%.
Соединения 1а-в - ярко-желтые кристалличе-
ские вещества, растворимые в ДМСО, ДМФА, при
В спектре ЯМР 13С соединения 1б наблюдают-
нагревании - в этаноле, изопропаноле, диоксане,
ся сигналы химических сдвигов ядер атомов угле-
уксусной кислоте и не растворимые в воде.
рода метоксигруппы (53.63) и карбонильной груп-
пы (186.94).
В ИК спектрах соединений 1а-в присутствуют
полосы валентных колебаний аминогрупп (3211-
В масс-спектре соединения 1б присутствует
3207 см-1), сложноэфирной и кетонной карбониль-
пик молекулярного иона с m/z 512.1239 [M + H]+,
ных групп (1745-1742 и 1618-1600 см-1), SO2-груп-
подтверждающий указанную структуру.
пы (1350-1346, 1158 см-1). В спектрах ЯМР 1Н
С целью модификации структуры метил-(2Z)-
соединений 1а-в кроме сигналов ароматических
4-арил-2-{4-[(4,6-диметилпиримидин-2-ил)-
протонов присутствуют синглеты двух CH3-групп
сульфамоил]фениламино}-4-оксобут-2-еноатов,
пиримидинового цикла при 2.26 м. д., трех ме-
приводящей к соединениям, обладающим про-
токсильных протонов СН3O (3.76-3.87 м. д.),
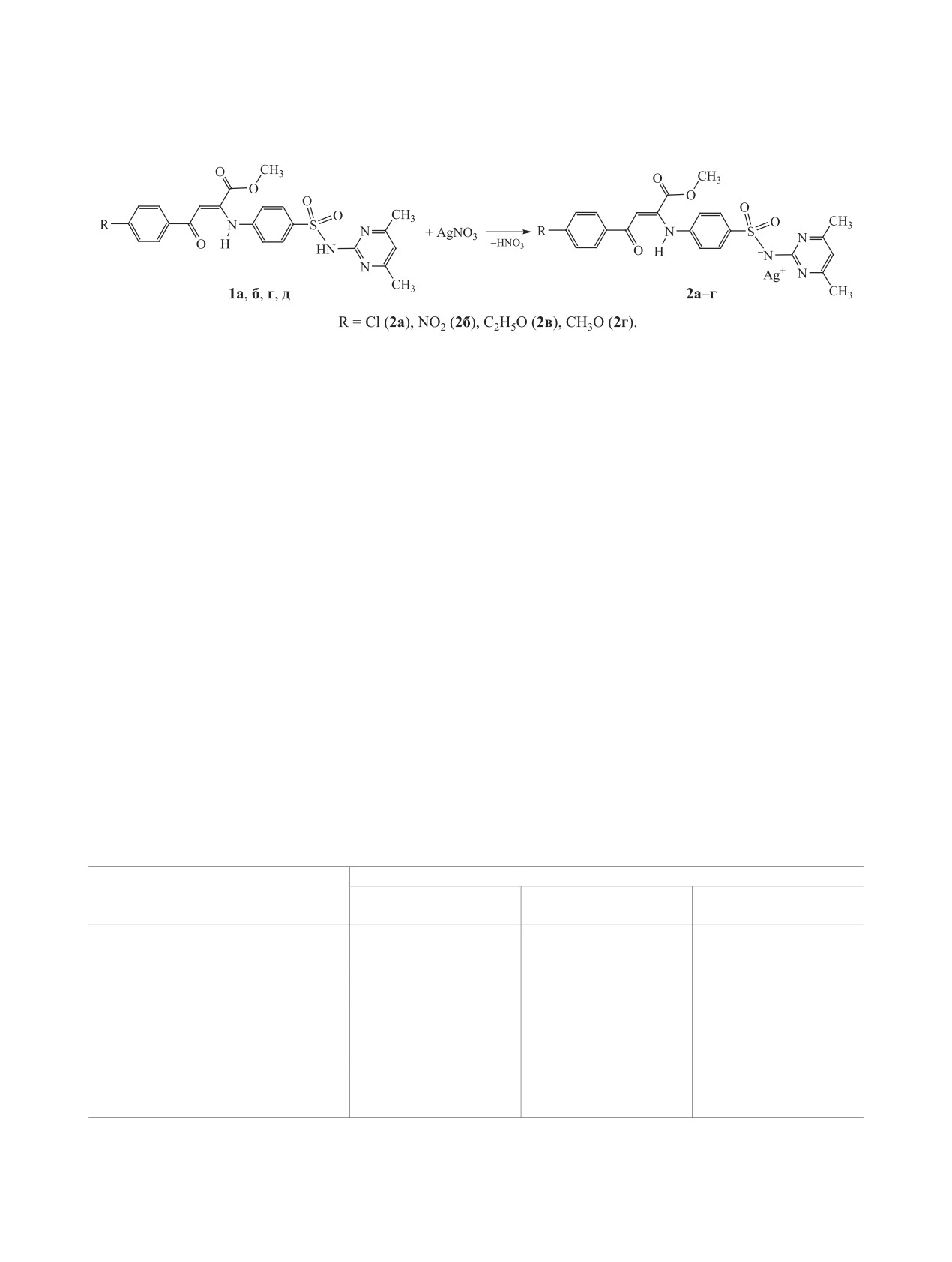
тивомикробной активностью, были получены их
протона С5H пиримидинового цикла
(6.62-
серебряные соли 2а-г. Последние образуются
6.63 м. д.), метинового протона в области 6.73-
при добавлении к горячему раствору метил-(2Z)-
6.75 м. д., протонов аминогрупп NHE (10.06-
4-арил-2-{4-[(4,6-диметилпиримидин-2-ил)суль-
10.08 м. д.) и NHZ (11.64-11.70 м. д.), уширенный
фамоил]фениламино}-4-оксобут-2-еноатов 1а, б,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
СИНТЕЗ И ПРОТИВОМИКРОБНАЯ АКТИВНОСТЬ
725
Схема 2.
г, д в среде этанол-ДМФА (2:1) эквимолярного
аминогрупп NHE (10.01-10.23 м. д.) и NHZ (11.67-
количества серебра нитрата (2%-ный раствор в
11.79 м. д.). Сигналы протонов других групп на-
этаноле) (схема 2). Синтез исходных (2Z)-4-арил-
блюдаются в ожидаемых областях. Характерной
2-{4-[(4,6-диметилпиримидин-2-ил)сульфамоил]-
особенностью спектров ЯМР 1Н полученных сое-
фениламино}-4-оксобут-2-еноатов 1г, д описан
динений 2а-г является отсутствие сигнала прото-
ранее [8].
на группы SO2NH в области 11.88-11.90 м. д. По
данным ЯМР 1Н, соединения 2а-г могут суще-
Соединения 2а-г - желтые кристаллические
ствовать в виде Z- и Е-изомеров с преобладанием
вещества, растворимые при нагревании в ДМСО,
Z-формы (2а, б), а также в виде Z-изомеров (2в,
ДМФА, ледяной уксусной кислоте и не раствори-
г). Исходя из соотношения значений интеграль-
мые в этаноле, изопропаноле, воде.
ной интенсивности сигналов протона группы NH
В ИК спектрах соединений
2а-г присут-
на Z-форму приходится ~ 70-100%, на Е-форму
ствуют полосы валентных колебаний амино-
~ 0-30%.
группы
(3432-3115 см-1), сложноэфирной и
кетонной карбонильных групп (1744-1729 и 1629-
В масс-спектре соединения
2в присутству-
ет пик молекулярного иона с m/z 617.0724 [M]+,
1619 см-1), SO2-группы
(1375-1315,
1141-
639.0408 [M + Na - H]+, 657.0469 [M + K + H]+,
1140 см-1). В спектрах ЯМР 1Н соединений 2а-г,
подтверждающий указанную структуру.
кроме сигналов ароматических протонов, присут-
ствуют синглеты двух CH3-групп пиримидиново-
Синтезированные соединения 1а-в, 2а-г были
го цикла при 2.33-2.37 м. д., трех метоксильных
исследованы на наличие антибактериальной и
протонов СН3O (3.74-3.76 м. д.), протона С5H
противогрибковой активности. Скрининг проти-
пиримидинового цикла (6.54-6.64 м. д.), метино-
вомикробной активности осуществляли в отноше-
вого протона в области 6.69-6.74 м. д., протонов
нии типовых штаммов Staphylococcus aureus ATCC
Таблица 1. Противомикробная активность соединений 1а-в, 2а-г
МПК, мкг/мл
Соединение
S. aureus
E. coli
C. albicans
ATCC 6538-P
ATCC 25922
NCTC 885-653
1а
1000.0
500.0
1000.0
1б
1000.0
500.0
1000.0
1в
1000.0
1000.0
1000.0
2а
0.75
1.5
31,2
2б
5.9
2.5
31,2
2в
4.0
1.5
62.5
2г
5.9
1.25
31.2
Диоксидин (1%-ный раствор)
62.5
31.2
-
Флуконазол
-
-
2.0→64.0а
а Данные работы [13].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
726
ГЕЙН и др.
Таблица 2. Противомикробная активность соединения 2а
МПК, мкг/мл
Соединение
S. epidermidis
E. faecalis
S. abony
P. aeruginosa
B. cereus АТСС
АТСС 14990
ATCC 29212
№103/39
АТСС 9027
10702
2а
15.6
125.0
62.5
31.2
31.2
Диоксидин
500.0
500.0
7.8
500.0
31.2
(1%-ный раствор)
6538-P, Escherichia coli ATCC 25922, Candida
трометре Bruker micrOTOF. Элементный анализ
albicans NCTC 885-653 в двух повторах. Результа-
проведен на приборе Perkin Elmer 2400. Темпера-
ты испытаний представлены в усредненном виде в
туры плавления определены на приборе Melting
табл. 1. Как видно из представленных данных, ме-
Point М-565.
тил-(2Z)-4-арил-2-{4-[(4,6-диметилпиримидин-2-
Метил-(2Z)-2-{4-[(4,6-диметилпирими-
ил)сульфамоил]фениламино}-4-оксобут-2-еноаты
дин-2-ил)сульфамоил]фениламино}-4-ок-
1а-в обладают низкой противомикробной актив-
со-4-(4-хлорфенил)бут-2-еноат (1а). К 2.78 г (0.01
ностью. Введение в структуру 1а-в ионов серебра
моль) 2-(4-аминобензолсульфамидо)-4,6-диметил-
с образованием серебряных солей 2а-г приводит к
пиримидина, растворенного при нагревании в 15
резкому усилению противомикробного действия в
мл ледяной уксусной кислоты, добавляли 2.40 г
отношении изучаемых культур.
(0.01 моль) метилового эфира 4-хлорбензоилпи-
Соединение
2а, проявившее высокую ан-
ровиноградной кислоты, растворенного в 15 мл
этанола. Реакционную смесь кипятили в течение
тибактериальную активность, было под-
вергнуто углубленному исследованию в от-
10 мин. Выпавший при охлаждении осадок от-
фильтровывали и перекристаллизовывали из эта-
ношении других типовых штаммов бактерий
нола. Выход 3.21 г (64%), т. пл. 120-122°С (EtOH).
Государственной коллекции патогенных микроор-
ИК спектр, ν, см-1: 3207 (NН), 1742 (СОэфир),
ганизмов Staphylococcus epidermidis АТСС 14990,
1618 (СОкетон), 1348, 1158 (SО2). Спектр ЯМР 1H,
Enterococcus faecalis ATCC 29212, Pseudomonas
δ, м. д.: 2.26 c (6H, CH3), 3.76 c (3H, СООСН3),
aeruginosa АТСС 9027, Salmonella abony №103/39,
6.63 с (1H, C5H), 6.75 с (1Н, СН=), 7.16-8.02 м (8Н,
Bacillus cereus АТСС 10702. Результаты испыта-
CHAr), 10.06 с (0.2Н, NНЕ), 11.64 с (0.8Н, NНZ),
ний представлены в табл. 2. В результате прове-
11.88 уш. с (1Н, SO2NH). Найдено, %: С 55.04; Н
денных экспериментов установлено, что соеди-
4.27;N 11.21;S 6.47. С23H21ClN4O5S. Вычислено,
нение 2а обладает высокой антибактериальной
%: С 55.14; Н 4.23; N 11.18;S 6.40.
активностью в отношении Staphylococcus aureus
ATCC 6538-P, Escherichia coli ATCC 25922, в отно-
Соединения 1б, в получали аналогично.
шении остальных изученных штаммов данное со-
Метил-(2Z)-2-{4-[(4,6-диметилпирими-
единение проявляет среднюю антибактериальную
дин-2-ил)сульфамоил]фениламино}-4-(4-ни-
активность.
трофенил)-4-оксобут-2-еноат (1б). Выход
3.63
(71%), т. пл. 125-127°С (EtOH). ИК спектр, ν,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
см-1: 3209 (NН), 1745 (СОэфир), 1600 (СОкетон),
Спектры ЯМР 1Н записаны на приборе Bruker
1346, 1158 (SО2). Спектр ЯМР 1H, δ, м. д.: 2.26 с
AM-300
(300 МГц) и Bruker Avance III HD
(6H, CH3), 3.87 с (3H, СООСН3), 6.62 с (1H, C5H),
(400 МГц) в ДМСО-d6, внутренний стандарт -
6.73 с (1Н, СН=), 7.07-8.33 м (8Н, CHAr), 10.08 с
ТМС. Спектры ЯМР 13С записаны на прибо-
(0.24Н, NНЕ), 11.70 с (0.76Н, NНZ), 11.90 уш. с (1Н,
ре Bruker Avance III HD (100 МГц) в ДМСО-d6.
SO2NH). Спектр ЯМР 13С, δС, м. д.: 23.00 (CH3),
ИК спектры сняты на ИК Фурье-спектрометре
53.63 (CH3O), 53.81, 99.32, 120.69, 120.84, 124.18,
IRAffinity-1 Shimadzu (Япония) в KBr. Масс-спек-
124.40, 124.51, 129.37, 129.73, 129.91, 130.40,
тры высокого разрешения записаны на масс-спек-
143.25, 150.07, 150.66, 186.94 (СО). Масс-спектр
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
СИНТЕЗ И ПРОТИВОМИКРОБНАЯ АКТИВНОСТЬ
727
(HRMS-ESI), m/z: 512.1239 [M + H]+. Найдено, %:
(СОкетон), 1347, 1141 (SО2). Спектр ЯМР 1Н, δ, м. д.:
С 54.13; Н 4.08; N 13.78 S 6.16. С23H21N5O7S. Вы-
2.33 c (6H, CH3), 3.76 c (3H, СООСН3), 6.64 с (1H,
числено, %: С 54.01; Н 4.14; N 13.69; S 6.27.
C5H), 6.74 с (1Н, СН=), 7.20-8.33 м (8Н, CHAr),
10.23 c (0.3Н, NНЕ), 11.79 с (0.7Н, NНZ). Найдено,
Метил-(2Z)-4-(4-бромфенил)-2-{4-[(4,6-ди-
метилпиримидин-2-ил)сульфамоил]фенил-
%: С 44.78; Н 3.31; N 11.26; S 5.10. С23H20AgN5O7S.
амино}-4-оксобут-2-еноат
(1в). Выход
3.76 г
Вычислено, %: С 44.67; Н 3.26; N 11.33; S 5.19.
(69%), т. пл. 139-141°С (EtOH). ИК спектр, ν,
Серебряная соль метил-(2Z)-2-{4-[(4,6-диме-
см-1: 3211 (NН), 1742 (СОэфир), 1617 (СОкетон),
тилпиримидин-2-ил)сульфамоил]фенилами-
1350, 1158 (SО2). Спектр ЯМР 1H, δ, м. д.: 2.26 c
но}-4-оксо-4-(4-этоксифенил)бут-2-еноата
(2в).
(6H, CH3), 3.76 с (3H, СООСН3), 6.62 с (1H, C5H),
Выход 2.16 г (70%), т. пл. 270-272°С (EtOH). ИК
6.75 с (1Н, СН=), 7.17-8.02 м (8Н, CHAr), 10.07 с
спектр, ν, см-1: 3250 (NН), 1729 (СОэфир), 1628
(0.1Н, NНЕ), 11.65 с (0.9Н, NНZ), 11.88 уш. с (1Н,
(СОкетон), 1316, 1141 (SО2). Спектр ЯМР 1Н, δ, м. д.:
SO2NH). Спектр ЯМР 13С, δС, м. д.: 22.91 (CH3),
1.35 т (3Н, CH3CH2O, J = 7.0 Гц), 2.35 c (6H, CH3),
52.57 (CH3OE), 53.24 (CH3OZ), 95.08, 98.53, 111.68,
3.74 с (3H, СООСН3), 4.13 к (2Н, СН3СН2О, J =
113.49,
119.72,
119.98,
125.97,
126.85,
131.45,
7.0 Гц), 6.55 с (1H, C5H), 6.69 с (1Н, СН=), 6.94-
131.84, 136.76, 137.43, 142.69, 147.29, 148.73,
8.04 м (8Н, CHAr), 11.67 с (1Н, NНZ). Масс спектр
156.10, 164.12, 165.46, 167.11, 185.97 (COE), 189.06
(HRMS-ESI), m/z: 617.0724 [M]+, 639.0408 [M +
(COZ). Найдено, %: С 50.77; Н 3.84; N 10.21;S 5.94.
Na - H] +, 657.0469 [M + K + H]+. Найдено, %: С
С23H21BrN4O5S. Вычислено, %: С 50.65; Н 3.88; N
48.50; Н 4.12; N 9.15; S 5.26. С25H25AgN4O6S. Вы-
10.27; S 5.88.
числено, %: С 48.63; Н 4.08; N 9.07; S 5.19.
Серебряная соль метил-(2Z)-2-{4-[(4,6-ди-
Серебряная соль метил-(2Z)-2-{4-[(4,6-ди-
метилпиримидин-2-ил)сульфамоил]фенил-
метилпиримидин-2-ил)сульфамоил]фенил-
амино}-4-оксо-4-(4-хлорфенил)бут-2-еноата
амино}-4-(4-метоксифенил)-4-оксобут-2-еноата
(2а). К горячему раствору 2.50 г (0.005 моль) ме-
(2г). Выход 2.23 г (74%), т. пл. 266-268°С (EtOH).
тил-(2Z)-2-{4-[(4,6-диметилпиримидин-2-ил)
ИК спектр, ν, см-1: 3357 (NН), 1733 (СОэфир), 1629
сульфамоил]фениламино}-4-оксо-4-(4-хлорфе-
(СОкетон), 1315, 1140 (SО2). Спектр ЯМР 1Н, δ, м. д.:
нил)бут-2-еноата 1а в 30-35 мл смеси этанол-
2.37 с (6H, CH3), 3.76 с (3H, СООСН3), 3.87 с (1Н,
ДМФА (2:1) приливали горячий раствор 0.85 г
CH3О), 6.54 с (1H, C5H), 6.70 с (1Н, СН=), 6.98-
(0.005 моль) серебра нитрата в 42.5 мл этанола
8.04 м (8Н, CHAr), 11.67 с (1Н, NНZ). Найдено, %: С
(2%-ный раствор). Выпавший осадок отфильтро-
47.88; Н 3.79; N 9.37; S 5.35. С24H23AgN4O6S. Вы-
вывали, промывали на фильтре от следов серебра
числено, %: С 47.77; Н 3.84; N 9.29; S 5.31
нитрата этанолом и водой, сушили, снова промы-
Противогрибковую и антибактериальную ак-
вали этанолом и сушили. Выход 1.88 г (62%), т. пл.
тивность полученных соединений
1а-в,
2а-г
268-270°С (EtOH). ИК спектр, ν, см-1: 3432 (NН),
определяли пробирочным методом двукратных
1738 (СОэфир), 1619 (СОкетон), 1375, 1140 (SО2).
серийных разведений в жидкой питательной сре-
Спектр ЯМР 1Н, δ, м. д.: 2.37 с (6H, CH3), 3.76 с
де [14]. Исследуемые соединения массой 0.05 г
(3H, СООСН3), 6.57 с (1H, C5H), 6.73 с (1Н, СН=),
растворяли в 5 мл ДМСО, получая основной рас-
7.11-8.09 м (8Н, CHAr), 10.01 c (0.3Н, NНЕ), 11.75 с
твор вещества в концентрации 104 мкг/мл. Данный
(0.7Н, NНZ). Найдено, %: С 45.31; Н 3.37; N 9.30; S
раствор служил основой для рабочего раствора,
5.21. С23H20AgClN4O5S. Вычислено, %: С 45.45; Н
имеющего концентрацию 2×103 мкг/мл, который
3.32; N 9.22; S 5.28.
последовательно разводили двукратно в жидкой
Соединения 2б-г получали аналогично.
питательной среде в ряду из 10 пробирок. Концен-
Серебряная соль метил-(2Z)-2-{4-[(4,6-диме-
трация исследуемых соединений в первой пробир-
тилпиримидин-2-ил)сульфамоил]фенилами-
ке ряда разведений в питательной среде составляла
но}-4-(4-нитрофенил)-4-оксобут-2-еноата
(2б).
1000.0 мкг/мл. Для определения антибактериаль-
Выход 2.19 г (71%), т. пл. 222-224°С (EtOH). ИК
ной активности использовали бульон Хоттингера,
спектр, ν, см-1: 3115 (NН), 1744 (СОэфир), 1625
для определения противогрибковой активности -
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
728
ГЕЙН и др.
бульон Сабуро. Для приготовления взвеси дрож-
3. Гейн В.Л., Бобровская О.В., Ковтоногова И.В.,
жевых культур применяли двухсуточные культуры,
Новикова В.В. // ЖОХ. 2015. Т. 85. Вып. 4. С. 588;
выращенные на агаре Сабуро. Для определения
Gein V.L., Bobrovskaya O.V., Kovtonogova I.V.,
Novikova V.V. // Russ. J. Gen. Chem. 2015. Vol. 85.
антибактериальной активности использовали ти-
N 4. P. 833. doi 10.1134/S1070363215040106
повые суточные культуры, выращенные на пита-
тельном агаре. Концентрация микробных клеток в
4. Гейн В.Л., Бобровская О.В., Ковтоногова И.В., Бело-
опыте составила 2-5×105 КОЕ/мл (для бактерий),
ногова В.Д., Данилов Ю.Л., Насакин О.Е., Казанце-
2-5×104 КОЕ/мл (для грибов). В качестве положи-
ва М.И. // ЖОрХ. 2016. Т. 52. Вып. 12. С. 1771;
Gein V.L., Bobrovskaya O.V., Kovtonogova I.V.,
тельного контроля использовали питательную сре-
Belonogova V.D., Danilov Yu.L., Nasakin O.E.,
ду с внесенной исследуемой культурой. В качестве
Kazantseva M.I. // Russ. J. Org. Chem. 2016. Vol. 52.
отрицательного контроля использовали интакт-
N 12. P. 1764. doi 10.1134/S1070428016120083
ную питательную среду. Посевы инкубировали в
термостате при температуре 26±1°С (для грибов),
5. Гейн В.Л., Бобровская О.В., Ковтоногова И.В., Сели-
верстов Г.В., Русских А.А., Белоногова В.Д., Аниси-
37±1°С (для бактерий). Оценку роста бактерий
мова А.Г., Ягонцева Т.А. // Бутлеровск. сообщ. 2016.
проводили визуально через 20-24 ч инкубирова-
Т. 48 Вып. 12. С. 26; Gein V.L., Bobrovskaya O.V.,
ния, антимикотическую активность - на 40-48 ч и
Kovtonogova I.V., Seliverstov G.V., Russkih A.A.,
70-72 ч инкубирования. В качестве значения МПК
Belonogova V.D., Anisimova A.G., Yagontseva T.A. //
(минимальной подавляющей концентрации) при-
Butlerov Commun. 2016. Vol. 48. N 12. P. 26.
нимали концентрацию соединения в последней
6. Гейн В.Л., Бобровская О.В., Дмитриев М.В. // ЖОрХ.
прозрачной пробирке серии разведения. В каче-
2017. Т. 53. Вып. 6. С. 881; Gein V.L., Bobrovskaya O.V.,
стве эталона сравнения антибактериальной актив-
Dmitriev M.V. // Russ. J. Org. Chem. 2017. Vol. 53. N 6.
ности использовали диоксидин. Фунгистатиче-
P. 898. doi 10.1134/S1070428017060148
ский эффект исследуемых соединений сравнивали
7. Гейн В.Л., Бобровская О.В., Гейн Л.Ф. // ЖОрХ. 2014.
с действием флуконазола.
Т. 50. Вып. 11. С. 1703; Gein V.L., Bobrovskaya O.V.,
ФОНДОВАЯ ПОДДЕРЖКА
Gein L.F. // Russ. J. Org. Chem. 2014. Vol. 50. N 11.
Работа выполнена при поддержке Санкт-Пе-
P. 1692. doi 10.1134/S1070428014110268
тербургского государственного университета (за-
8. Гейн В.Л., Бобровская О.В., Дмитриев М.В, Мах-
явка на развитие материально-технической базы
мудов Р.Р., Белоногова В.Д. // ЖОХ. 2018. Т. 88.
СПбГУ №33402376) с использованием оборудо-
Вып. 6. С. 914; Gein V.L., Bobrovskaya O.V., Dmitri-
вания ресурсных центров Научного парка СПбГУ
ev M.V., Makhmudov R.R., Belonogova V.D. // Russ. J.
Gen. Chem. 2018. Vol. 88. N 6. Р. 1095. doi: 10.1134/
«Ресурсный Образовательный Центр по направле-
S1070363218060087
нию химия», «Методы анализа состава вещества»,
«Оптические и лазерные методы исследования» и
9. Гейн В.Л., Бобровская О.В., Русских А.А., Дмитри-
«Магнитно-резонансные методы исследования».
ев М.В., Янкин А.Н. // ЖОрХ. 2019. Т. 55. № 5. С.
693; Gein V.L., Bobrovskaya O.V, Russkikh A.A., Dmitri-
КОНФЛИКТ ИНТЕРЕСОВ
ev M.V., Yankin A.N. // Russ. J. Org. Chem. 2019.
Авторы заявляют об отсутствии конфликта
Vol. 55. N. 5. P. 602. doi 10.1134/S107042801905004X
интересов.
10. Бобровская О.В., Гейн В.Л., Селиверстов Г.В., Ча-
щина С.В., Дмитриев М.В. // ЖОХ. 2017. Т. 87.
СПИСОК ЛИТЕРАТУРЫ
Вып. 12. С. 1957; Bobrovskaya O.V., Gein V.L.,
1. Машковский М.Д. Лекарственные средства. М.: Но-
Seliverstov G.V., Chashchina S.V., Dmitriev M.V. // Russ.
вая волна, 2012. 1206 с.
J. Gen. Chem. 2017. Vol. 87. N 12. Р. 2776. doi 10.1134/
2. Гейн В.Л., Бобровская О.В., Ситникова А.А. //
S1070363217120040
ЖОХ. 2014. Т. 84. Вып. 4. С. 548; Gein V.L., Bobrov-
11. Гейн В.Л., Бобровская О.В., Русских А.А., Новико-
skaya O.V., Sitnikova A.A. // Russ. J. Gen. Chem. 2014.
ва В.В., Гейн О.Н., Карпенко Ю.Н., Чащина С.В.,
Vol. 84. N 4. P. 629. doi 10.1134/S1070363214040045
Дмитриев М.В., Янкин А.Н. // ЖОХ. 2019. Т. 89.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
СИНТЕЗ И ПРОТИВОМИКРОБНАЯ АКТИВНОСТЬ
729
№ 4. С. 542; Gein V.L., Bobrovskaya O.V., Rus-
Med. Mycology. 2013. Vol. 51. N 1. P. 53. doi
skikh A.A., Novikova V.V., Gein O.N., Karpenko Yu.N.,
10.3109/13693786.2012.692489
Chashchina S.V., Dmitriev M.V., Yankin A.N. // Russ.
14. Руководство по проведению доклинических ис-
J. Gen. Chem. 2019. Vol. 89. N 4. Р. 680. doi 10.1134/
следований лекарственных средств / Под ред. А.Н.
S1070363219040078
Миронова, Н.Д. Бунятян, А.Н. Васильева, О.Л.
12. Гейн В.Л., Бобровская О.В., Селиверстов Г.В., Но-
Верстаковой, М.В. Журавлевой, В.К. Лепахина,
викова В.В., Махмудов Р.Р. Пат. РФ 2698328 (2019).
Н.В. Коробова, В.А. Меркулова, С.Н. Орехова, И.В.
13. Cordeiro R.A., Teixeira C.E.C., Brilhante R.S.N.,
Castelo-Branco D.S.C.M., Paiva M.A.N., Leite J.J.G.,
Сакаевой, Д.Б. Утешева, А.Н. Яворского. М.: Гриф
Lima D.T., Monteiro A.J., Sidrim J.J.C., Rocha M.F.G. //
и К, 2012. Ч. 1. 944 с.
Synthesis and Antimicrobial Activity of Methyl (2Z)-4-Aryl-2-
{4-[(4,6-dimethylpyrimidin-2-yl)sulfamoyl]phenylamino}-
4-oxobut-2-enoates and Their Silver Salts
V. L. Geina,*, O. V. Bobrovskayaa, E. A Mashkinaa, V. V. Novikovaa, R. R. Makhmudovb,
A. N. Yankinc, S. E. Danilovd, E. A. Hvolisa, V. D. Belonogovaa, and D. K. Gulyaeva
a Perm State Pharmaceutical Academy, Perm, 614990 Russia
b Perm State Natsional Research University, Perm, 614990 Russia
с National Research University ITMO, St. Petersburg, 197101, Russia
d St. Petersburg State University, St. Petersburg, 199034 Russia
*e-mail: geinvl48@mail.ru
Received December 27, 2019; revised December 27, 2019; accepted January 12, 2020
By the reaction of methyl esters of aroylpyruvic acids with 2-(4-aminobenzenesulfamido)-4,6-dimethylpyri-
midine in a mixture of acetic acid-ethanol (1:1) the new methyl (2Z)-4-aryl-2-{4-[(4,6-dimethylpyrimidin-2-yl)-
sulfamoyl]phenylamino}-4-oxobut-2-enoates were synthesized, which interact with silver nitrate in ethanol-
DMF (2:1) to form their silver salts. The antimicrobial activity of the compounds was studied.
Keywords: мethyl (2Z)-4-aryl-2-{4-[(4,6-dimethylpyrimidin-2-yl)sulfamoyl]phenylamino}-4-oxobut-2-enoates,
2-(4-aminobenzenesulfamido)-4,6-dimethylpyrimidine (sulfadimidine), silver salts, antimicrobial activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020