ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 5, с. 736-743
УДК 547.36:547.37:547.78
СИНТЕЗ ВЕРДАЗИЛЬНЫХ РАДИКАЛОВ,
СОДЕРЖАЩИХ ИНТЕРНАЛЬНЫЙ
СОПРЯЖЕННЫЙ ДИИНОВЫЙ ФРАГМЕНТ,
ОТЛИЧАЮЩИЙСЯ ЧИСЛОМ МЕТИЛЕНОВЫХ
ГРУПП, И ИХ СПОСОБНОСТЬ К ТВЕРДОФАЗНОЙ
ПОЛИМЕРИЗАЦИИ
© 2020 г. С. Г. Кострюков*, М. К. Пряничникова, А. Ш. Козлов,
А. А. Буртасов, Б. С. Танасейчук
Национальный исследовательский Мордовский государственный университет имени
Н. П. Огарёва, ул. Большевистская 68, Саранск, 430005 Россия
*e-mail: kostryukov_sg@mail.ru
Поступило в Редакцию 21 ноября 2019 г.
После доработки 21 ноября 2019 г.
Принято к печати 28 ноября 2019 г.
На основе несимметричных алкадиинильных эфиров п-гидроксибензальдегида получены вердазиль-
ные радикалы, на примере которых изучено влияние степени удаленности сопряженного диинильного
фрагмента от объемного тетразинильного заместителя на способность к твердофазной полимеризации
при УФ облучении. Показано, что скорость твердофазной полимеризации увеличивается с ростом числа
метиленовых групп в алкадиине и сопровождается сохранением радикального центра.
Ключевые слова: вердазил, лейкооснование, гидразон, формазан, несимметричный диин, твердофазная
полимеризация
DOI: 10.31857/S0044460X20050121
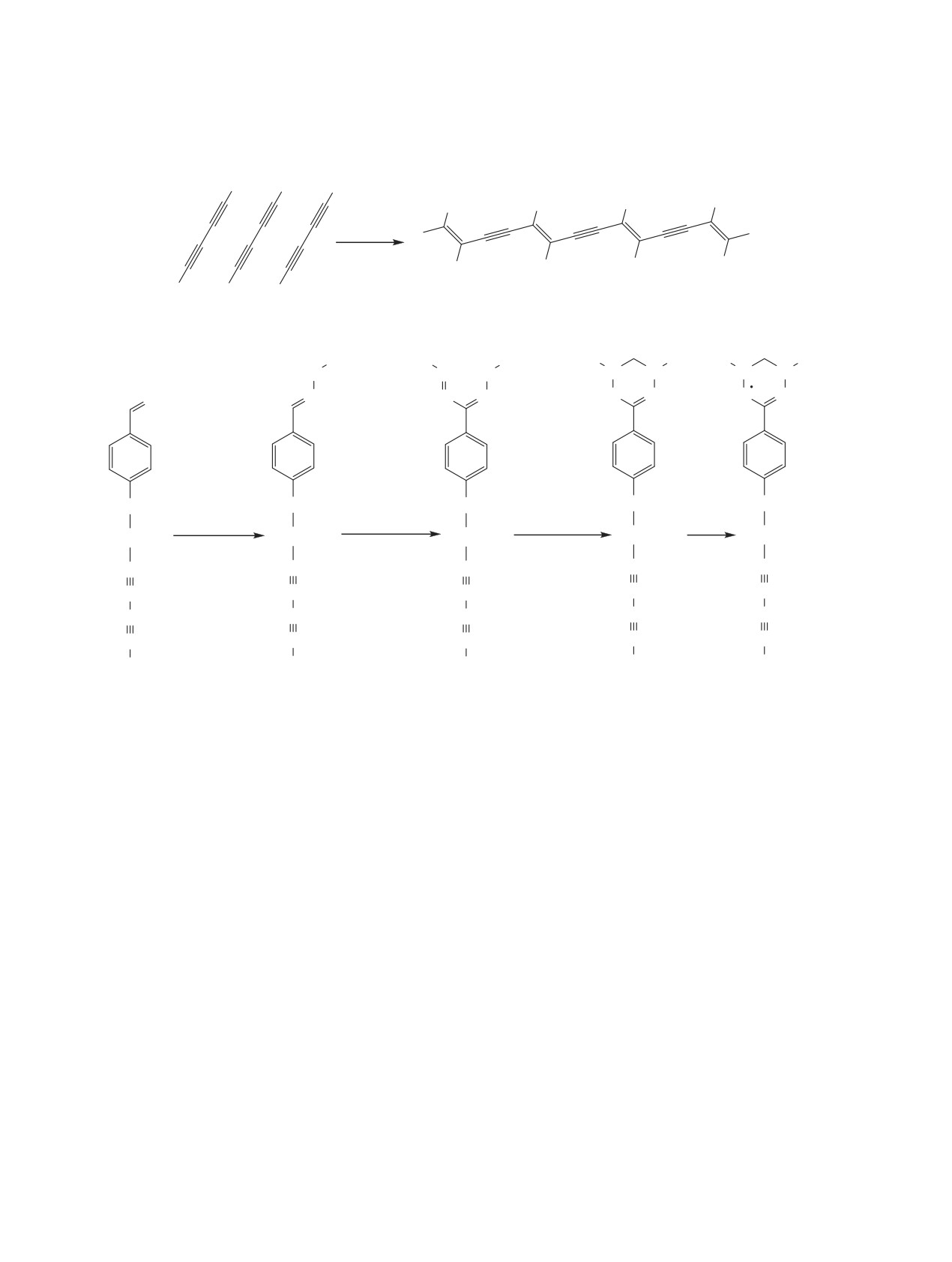
Полимеры, содержащие в боковой цепи в ка-
Как известно, сопряженные алкадиины при фо-
честве заместителей стабильные радикалы, такие
тохимическом инициировании легко полимеризу-
как феноксилы, нитроксилы, вердазилы и другие,
ются с образованием полиеновой структуры [12]
привлекают широкое внимание исследователей
(схема 1).
в связи с возможностью их использования в ка-
Ранее нами была изучена полимеризация диа-
честве строительных блоков при создании мате-
цетиленов, содержащих в качестве заместителей
риалов для органических аккумуляторов [1-4] и
имидазолильные радикалы [13]. Было показано,
магнитов [5-9]. Наибольший интерес в этом плане
что существуют стерические затруднения при
представляют полимеры, полученные из алкади-
проведении полимеризации таких радикалов в
инов, содержащих свободнорадикальный фраг-
твердой фазе. Большие по объему дифенилимида-
мент, так как при их полимеризации образуется
золильные фрагменты мешают образованию пра-
сопряженная полимерная цепь, а наличие в ней
вильным образом структурированных полимеров.
заместителей с неспаренным электроном придает
Большое значение для процесса полимеризации
данным полимерам магнитные, оптоэлектронные,
имеют также наличие и характер функциональных
электро- и фотопроводящие, люминесцентные и
групп в радикальном фрагменте, а также степень
другие уникальные свойства [10, 11].
удаленности диалкинильного фрагмента от ра-
736
СИНТЕЗ ВЕРДАЗИЛЬНЫХ РАДИКАЛОВ
737
Схема 1.
H
H
H
H
H
H
H
+
+
O < 350 ɧɦ
R
R
R
R
R
R
R
Схема 2.
Ph
Ph
Ph
Ph
Ph
Ph
Ph
HN
N
HN
N
N
N
N
N
N
N
HN
N
N
N
O
O
O
O
O
O
PhNHNH2
PhN2Cl, NaOH
CH2O, NaOH
PbO2
(CH2)n
(CH2)n
(CH2)n
(CH2)n
(CH2)n
AcONa, EtOH
AcONa, EtOH
O2, ȾɆɎȺ
C6H6
C
20oC
C
0oC
C
50-55oC
C
50oC
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
CH2OH
CH2OH
CH2OH
CH2OH
CH2OH
2a, ɛ
3a, ɛ
4a, ɛ
5a, ɛ
1a, ɛ
n = 1 (a), 2 (ɛ).
дикального центра [11-14]. Кроме того, имидазо-
наличие в качестве заместителя вердазильного ра-
лильные радикалы в обычных условиях существу-
дикала должно мешать процессу полимеризации.
ют в виде димеров, распадающихся на радикалы
Удаление же объемного радикального центра от
в твердой фазе при фотохимическом воздействии,
диинильного фрагмента должно способствовать
поэтому изучить процесс твердофазной полимери-
упорядоченной твердофазной полимеризации ал-
зации на примере дифенилимидазолильных ради-
кадиина.
калов, содержащих диинильный фрагмент, оказа-
В связи с этим, мы обратились к изучению воз-
лось весьма проблематично.
можности твердофазной полимеризации на при-
Вердазильные радикалы, как известно, не спо-
мере несимметричных сопряженных алкадиинов
собны к образованию димеров. В мягких условиях
1a, б, содержащих с разной степенью удаленности
при обычной температуре они существуют неогра-
от тройной связи свободнорадикальный верда-
ниченно долгое время и могут вступать в реакции,
зильный фрагмент. Алкадиины 1a, б были полу-
характерные для обычных химических соедине-
чены из алкадиинильных эфиров п-гидроксибен-
ний, не теряя парамагнитных свойств [15].
зальдегида 2a, б [16].
Однако, в связи с тем, что объемные заместите-
Вердазильные радикалы 1a, б получали соглас-
ли, стоящие вблизи от диинового фрагмента, пре-
но схеме 2, исходя из соответствующих формаза-
пятствуют процессу полимеризации [16] в силу
нов 4a, б, которые, в свою очередь, получали из
создания значительных стерических затруднений,
фенилгидразонов 3a, б. Формазаны 4a, б циклизо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
738
КОСТРЮКОВ и др.
Ƚɫ
ɚ
ɛ
Ɇɚɝɧɢɬɧɨɟ ɩɨɥɟ Ƚɫ
Ɇɚɝɧɢɬɧɨɟ ɩɨɥɟ Ƚɫ
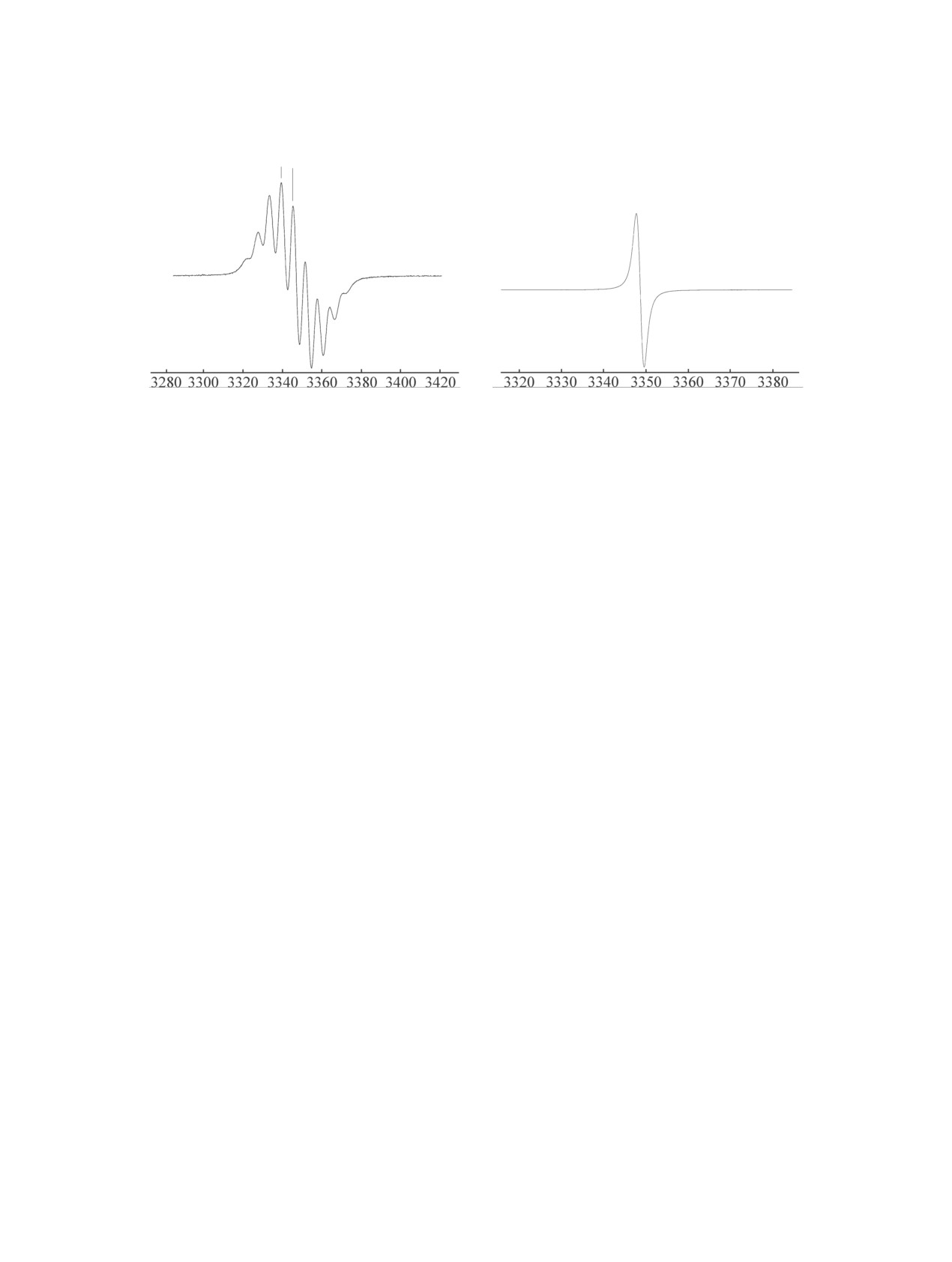
Рис. 1. Спектры ЭПР вердазила 1а в бензоле (а) и твердом состоянии (б).
вали формальдегидом в присутствии гидроксида
Радикалы 1a, б представляют собой мелко-
натрия и кислорода с последующим окислением
кристаллические вещества темно-зеленого с бу-
образовавшегося лейкооснования 5a, б диоксидом
роватым оттенком цвета. Вердазилы 1a, б оха-
свинца.
рактеризованы с использованием ИК, УФ, ЭПР
спектроскопии и масс-спектрометрии. В ИК спек-
Гидразоны 3a, б получены конденсацией аль-
трах присутствует полоса колебаний в области
дегидов 2a, б с солянокислым фенилгидразином с
~1150-1160 нм, характерная для вердазильных
выходом ~60-65% (схема 2) и охарактеризованы с
радикалов. Бензольные растворы соединений 1a, б
помощью ИК, ЯМР 1Н и 13С спектроскопии. Так,
дают устойчивые во времени типичные спектры
в ИК спектрах соединений 3a, б присутствуют по-
ЭПР, содержащие 9 широких линий с отношени-
лосы валентных колебаний, характерные для аро-
ем интенсивностей 1:4:10:16:19:16:10:4:1, вызван-
матического кольца, связи С=N гидразона, СН2-,
ным взаимодействием неспаренного электрона с
NH- и ОН-групп.
четырьмя спектрально эквивалентными атомами
Азосочетание соединений 3a, б с хлоридом фе-
азота тетразинового цикла. В качестве примера
нилдиазония приводит к образованию формазанов
на рис. 1 представлен спектр ЭПР вердазила 1а в
4a, б с выходом ~70% (схема 2). Строение соедине-
растворе и твердом состоянии. В видимой области
спектра вердазилов 1a, б присутствуют максиму-
ний 4a, б также подтверждено данными ИК, ЯМР
мы поглощения с λmax = 355 (ε = 13500) и 718 нм
1Н, 13С спектроскопии и масс-спектрометрии.
(ε = 6500) (1а) и λmax = 380 (ε = 14100) и 735 нм
Стандартная циклизация формазанов 4a, б с
(ε = 6950) (1b).
использованием в качестве алкилирующего аген-
В процессе УФ облучения радикалов 1a, б
та формальдегида в присутствии молекулярного
в твердом состоянии происходит изменение их
кислорода воздуха [17] протекает в течение ~15
окраски до темно-бурой, что косвенно свидетель-
мин, но приводит в нашем случае к образованию
ствует о процессе твердофазной полимеризации.
лейкооснований 5а, б, которые являются устой-
При этом сигнал ЭПР сохраняется, но форма сиг-
чивыми по отношению к кислороду воздуха. Для
нала меняется. На рис. 2 приведены спектры ЭПР
последующего окисления лейкооснований 5a, б до
полимеров, полученных из соединений 1a, б. Бен-
радикалов 1a, б был использован диоксид свинца.
зольные растворы радикалов 1a, б после УФ об-
При этом в течение 5-10 мин происходило окис-
лучения также приобретают темно-бурую окраску
ление лейкооснований 5a, б до соответствующих
и сохраняют устойчивый сигнал ЭПР (рис. 2), что
радикалов 1a, б, о чем свидетельствует изменение
указывает на протекание процесса полимеризации
окраски бензольного раствора от практически бес-
без затрагивания радикального центра и в раство-
цветной до темно-зеленой.
рах.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
СИНТЕЗ ВЕРДАЗИЛЬНЫХ РАДИКАЛОВ
739
ɚ
ɛ
ɜ
Ɇɚɝɧɢɬɧɨɟ ɩɨɥɟ Ƚɫ
Ɇɚɝɧɢɬɧɨɟ ɩɨɥɟ Ƚɫ
Ɇɚɝɧɢɬɧɨɟ ɩɨɥɟ Ƚɫ
Рис. 2. Спектры ЭПР полимеров радикала 1а (а), радикала 1б (б) и радикала 1б в бензоле (в).
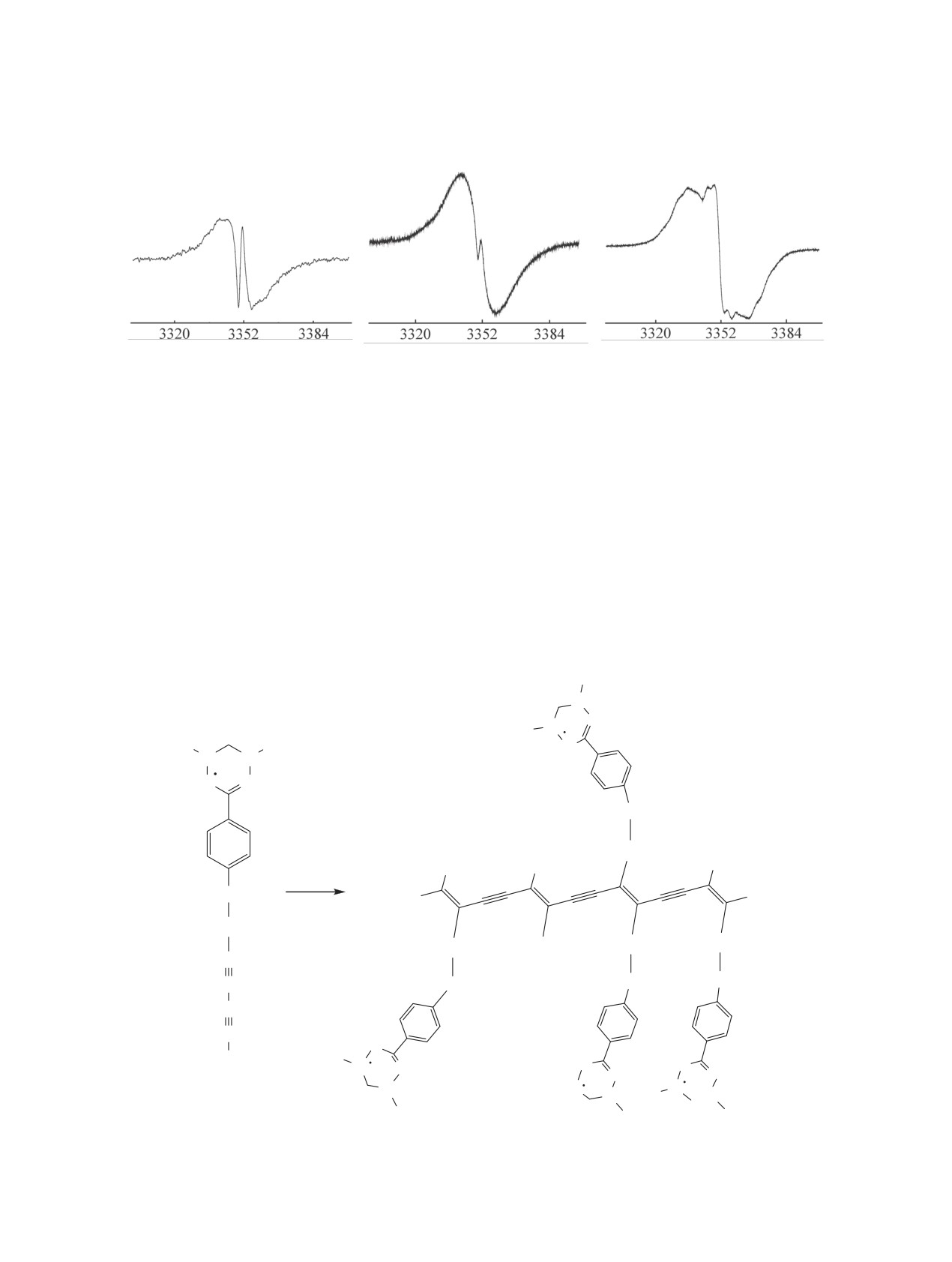
Уширение сигнала ЭПР, по нашему мнению,
своем составе лишь одну метиленовую группу. Об
свидетельствует об образовании полимера не-
этом свидетельствует и визуальное наблюдение за
упорядоченного строения, а наличие в спектре
изменением окраски соединений 1а, б в процессе
острого пика говорит о присутствии исходных
УФ облучения во времени. Предполагаемый в на-
мономеров. Разная интенсивность данного пика
шем случае процесс полимеризации вердазильных
у радикалов 1a, б свидетельствует о различной
радикалов, содержащих диалкинильный фрагмент,
конверсии мономеров в полимер. Таким образом,
представлен на схеме 3.
можно констатировать, что соединение 1б с дву-
мя метиленовыми группами полимеризуется зна-
Более быстрое изменение окраски в процессе
чительно легче соединения 1а, которое имеет в
УФ облучения протекает в случае вердазильного
Схема 3.
Ph
N
N
Ph
N
Ph
Ph
N
N N
N N
O
n
(CH
2)n
CH2OH
CH2OH
CH2OH
ɍɎ
O
(CH2)n
HOH2C
(CH2)n
(CH2)n
(CH2)n
C
O
O
C
O
C
C
N
CH2OH
Ph
N
N
N N
N
N
N
Ph NN Ph
N N
Ph
Ph
Ph
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
740
КОСТРЮКОВ и др.
Диапазон изменения окраски кристаллов тетразинилов 1а, б при УФ облучении во времени
Соединение
Время УФ облучения, ч
и окраска кристаллов
2
5
10
24
1а
Без видимых
Незначительное
Незначительное
Появление бурой
(зеленые с буроватым оттенком)
изменений
побурение
побурение
окраски
1б
Незначительное
Появление бурой
Появление бурой
Появление
(зеленые с буроватым оттенком)
побурение
окраски
окраски
темно-бурой окраски
радикала 1б, в котором дииновый фрагмент от ра-
[12], вызванную поглощением в синей или крас-
дикального центра отделен двумя метиленовыми
ной области видимой части спектра в зависимости
группами (см. таблицу). Так, если кристаллы со-
от структуры образующегося полимера [10].
единения 1б становятся бурыми по истечении ~4-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
5 ч, то кристаллы вердазила 1а в течение этого вре-
мени только слегка буреют. Кроме того, кристаллы
Растворители перед использованием высуши-
соединения 1б и по мере стояния на воздухе бу-
вали и перегоняли. ИК спектры получены в та-
реют значительно быстрее, чем кристаллы верда-
блетках KBr на Фурье-спектрометре ИнфраЛЮМ
зила 1а. Разное по времени протекание изменения
ФТ-02. Спектры ЯМР 1Н и 13С сняты на спектро-
окраски кристаллов радикалов 1a и 1б, содержа-
метре JNM-ECX400 Jeol (400.1 и 100.6 MГц соот-
щих один или два метиленовых фрагмента соот-
ветственно) для растворов веществ в CDCl3. Эле-
ветственно, указывает на то, что введение второй
ментный анализ выполнены на СHNS-анализаторе
метиленовой группы, отделяющей диинильный
Vario MICRO. Условия аналитической ТСХ: адсор-
фрагмент от объемного радикального, приводит
бент - Silufol UV-245, элюент - бензол; проявление
к ускорению полимеризации, так как в этом слу-
в иодной камере. Для колоночной хроматографии
чае изменение окраски от буро-зеленой до темно-
использовали силикагель L40/100 μ; элюент - бен-
бурой наступает быстрее.
зол. Температуры плавления определены в запа-
янных стеклянных капиллярах с использованием
Таким образом, с определенной долей уверен-
анализатора точки плавления МР-50 MettlerToledo.
ности можно сказать, что введение метиленовых
Масс-спектры получены с помощью электронной
фрагментов, отделяющих объемный вердазиль-
ионизации (70 эВ) на спектрометре KONIK RBK-
ный фрагмент от сопряженного диинильного, спо-
HRGC 5000B-MSQ12 в режиме положительной
собствует твердофазной полимеризации несимме-
ионизации. Электронные спектры в видимой об-
тричных сопряженных диинов, т. е. структурные
ласти (бензол) зарегистрированы на спектрофото-
особенности мономерных радикалов 1а, б опре-
метре Shimadzu UV-2600. Спектры ЭПР сняты с
деляют их поведение в процессе полимеризации.
помощью спектрометра ESP 70-03 XD/2.
Это согласуется и с исследованиями, проведенны-
ми нами ранее на несимметричных сопряженных
(п-Формилфенокси)гекса-2,4-диин-1-ол
2а и
динах с разной степенью удаленности диинового
(п-формилфенокси)гепта-2,4-диин-1-ол
2б были
фрагмента от объемного п-гидроксибензальдегид-
получены по литературной методике [16].
ного [16].
Общая методика синтеза фенилгидразонов
Однако говорить о том, что произошла упоря-
3a, б. К раствору 0.0055 моль (0.80 г) гидрохло-
доченная твердофазная полимеризация радикалов
рида фенилгидразина и 1.13 г безводного ацетата
1a, б, мы не вправе, так как УФ облучение прово-
натрия в 15 мл воды добавляли при постоянном
дили при атмосферном давлении, когда контроли-
перемешивании небольшими порциями раствор
руемая упорядоченная твердофазная полимериза-
0.005 моль альдегида 2 в 20 мл этанола. По оконча-
ция практически невозможна [1]. Кроме того, как
нии прибавления реакционную смесь перемеши-
правило, полимеры с упорядоченной полиеновой
вали при комнатной температуре ~20 мин. Осадок
структурой имеют глубокую интенсивную окраску
отфильтровывали и промывали на фильтре водой,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
СИНТЕЗ ВЕРДАЗИЛЬНЫХ РАДИКАЛОВ
741
затем сушили на воздухе. Целевые продукты 3а и
ной смеси выше 5°С. По окончании прибавления
3б очищали перекристаллизацией.
реакционную смесь выдерживали в течение 12 ч
Фенилгидразон 6-(п-формилфенокси)гекса-
при температуре ~5°С. Осадок отфильтровывали,
промывали на фильтре горячей водой и сушили на
2,4-диин-1-ола (3а). Выход 1.12 г (74%), белые
воздухе. Целевые соединения очищали перекри-
кристаллы, т. пл. 95-96°С (вода-пропан-2-ол, 2:1).
сталлизацией из этанола.
ИК спектр, ν, см-1: 1250 (С-О-С), 1480, 1520 (Ar),
1620 (С=N), 2970 (С-Н СН2), 2280 (-С≡С-С≡С-),
3-{4-[(6-Гидроксигекса-2,4-диин-1-ил)окси]-
3250 (N-Н), 3350 (О-Н). Спектр ЯМР 1Н (CDCl3),
фенил}-1,5-дифенилформазан (4а). Выход 0.50 г
δ, м. д.: 3.82 с (2H), 4.50 с (2H), 7.08 т. т (1H, J =
(43.3%), мелкокристаллическое вещество тем-
7.9, 1.2 Гц), 7.17 д. т (2H, J = 8.2, 1.2 Гц), 7.25 д. д
но-вишневого цвета, т. пл. 183-184°С (этанол).
(2H, J = 8.8, 1.1 Гц), 7.33 д. д (2H, J = 8.8, 1.9 Гц),
ИК спектр, ν, см-1: 1250 (С-О-С), 1495, 1610 (Ar),
7.40-7.47 м (2H), 7.85 с (1H), 14.49 уш. с (1Н, NH).
1615 (С=N), 2950 (С-Н СН2), 2400 (-С≡С-С≡С-),
Спектр ЯМР 13C (CDCl3), δС, м. д.: 50.3 (СН2OH),
3200 (N-Н), 3400 (О-Н). Спектр ЯМР 1Н (CDCl3),
57.2 (СН2), 66.1 (-С≡), 70.7 (-С≡), 71.3 (-С≡), 77.8
δ, м. д.: 3.81 с (2H), 4.54 с (2H), 5.22 уш. с (1Н),
(-С≡), 114.6, 115.4, 124.8, 127.1, 129.3, 129.7, 134.3,
7.04 д. д (2H, J = 8.3, 1.1 Гц), 7.27 д. т (2H, J = 8.1,
142.6, 145.5, 160.6. Найдено, %: С 74.96; Н 5.32.
1.2 Гц) 7.34 т. т (1H, J = 7.6, 1.2 Гц), 7.40-7.51
C19H16N2O2. Вычислено, %: С 74.98; H 5.30.
м (9H), 14.56 уш. с (1H, NH). Спектр ЯМР 13C
Фенилгидразон 6-(п-формилфенокси)гепта-
(CDCl3), δС, м. д.: 50.2 (СН2ОН), 56.9 (СН2), 69.7
(-С≡), 70.7 (-С≡), 70.8 (-С≡), 78.9 (-С≡), 114.5,
2,4-диин-1-ола (3б). Выход 1.08 г (67.8%), белые
114.7, 122.1, 124.7, 124.7, 127.0, 129.2, 129.2, 131.7,
кристаллы, т. пл. 140-141°С (вода-пропан-2-ол,
145.4, 153.1, 155.2, 161.1. Mасс-спектр (ЭУ, 70 эВ),
2:1). ИК спектр, ν, см-1: 1270 (С-О-С), 1502, 1611
m/z (Iотн, %): 408 (5) [M]+, 390 (15), 316 (60), 304
(Ar), 1621 (С=N), 2950 (С-Н, СН2), 2250 (-С≡С-
С≡С-), 3210 (N-Н), 3351 (О-Н). Спектр ЯМР 1Н
(40), 211 (100), 93 (60).Найдено, %: С 73.33; Н 7.83.
С25Н20N4O2. Вычислено, %: С 73.24; Н 7.85.
(CDCl3), δ, м. д.: 2.72 т (2H, J = 7.3 Гц), 3.81 с (2H),
4.51 т (2H, J = 7.3 Гц), 7.07 т. т (1H, J = 7.9, 1.2 Гц),
3-{4-[(7-Гидроксигепта-3,5-диин-1-ил)окси]-
7.16 д. т (2H, J = 8.2, 1.2 Гц), 7.24 д. д (2H, J = 8.8,
фенил}-1,5-дифенилформазан (4б). Выход 0.38 г
1.1 Гц), 7.32 д. д (2H, J = 8.8, 1.9 Гц), 7.40-7.47 м
(35.0%), мелкокристаллическое вещество тем-
(2H), 7.84 с (1H), 14.48 уш. с (1Н, NH). Спектр ЯМР
но-вишневого цвета, т. пл. 105-106°С (этанол).
13C (CDCl3), δС, м. д.: 19.9 (СН2), 50.2 (СН2OH),
ИК спектр, ν, см-1: 1251 (С-О-С), 1500, 1620 (Ar),
65.2 (СН2), 67.1 (-С≡), 70.7 (-С≡), 73.3 (-С≡), 78.9
1615 (N=N), 2950 (С-Н, СН2), 2400 (-С≡С-С≡С-),
(-С≡), 114.5, 115.3, 124.7, 127.1, 129.2, 129.8, 134.2,
1640 (N-Н), 3400 (О-Н). Спектр ЯМР 1Н (CDCl3),
142.5, 145.4, 160.5. Найдено, %: С 75.43; Н 5.72.
δ, м. д.: 2.72 т (2H, J = 7.2 Гц), 3.81 с (2H), 4.52
C20H18N2O2. Вычислено, %: С 75.45; H 5.70.
т (2H, J = 7.2 Гц), 5.19 уш. с (1Н), 7.11 д. д (2H,
Общая методика синтеза формазанов 4a, б.
J = 8.3, 1.2 Гц), 7.26 д. т (2H, J = 8.1, 1.2 Гц), 7.34
т. т (1H, J = 7.6, 1.2 Гц), 7.39-7.50 м (9H), 14.60
К охлажденному до ~0°С раствору 0.0026 моль
уш. с (1H, NH). Спектр ЯМР 13C (CDCl3), δС, м. д.:
соединения 3 в 6 мл бутан-2-ола прибавляли ох-
19.9 (СН2), 50.2 (СН2), 60.2 (СН2), 67.1 (-С≡), 70.7
лажденный до ~0°С раствор 0.47 г гидроксида на-
(-С≡), 73.3 (-С≡), 78.9 (-С≡), 114.5, 114.7, 122.2,
трия и 0.67 г ацетата натрия в 10 мл бутан-2-ола.
Отдельно готовили хлорид фенилдиазония следу-
124.7, 127.1, 129.2, 129.2, 131.7, 145.4, 153.1, 155.0,
160.5. Mасс-спектр (ЭУ, 70 эВ), m/z (Iотн, %): 422
ющим образом: к раствору 0.0028 моль (0.360 г)
(4) [M]+, 392 (12), 330 (50), 316 (40), 211 (100), 93
гидрохлорида анилина в 2 мл воды добавляли рас-
(60). Найдено, %: С 73.85; Н 5.31. С26Н22N4О2. Вы-
твор 0.0042 моль (0.31 г) нитрита натрия в 1.5 мл
числено, %: 73.92; Н 5.25.
воды, затем 1 мл концентрированной соляной кис-
лоты, поддерживая температуру реакционной сме-
Общая методика синтеза тетразинилов 1a, б.
си в интервале 0-5°С. Полученный раствор соли
Через смесь 0.56 ммоль формазана 4, 0.013 моль
фенилдиазония по каплям при постоянном пере-
формальдегида в виде 1 мл 40%-ного раствора
мешивании приливали к раствору фенилгидразона
формалина, 12.5 мл N,N-диметилформамида и 1 мл
3, не допуская повышения температуры реакцион-
2 н. раствора гидроксида натрия пропускали при
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
742
КОСТРЮКОВ и др.
комнатной температуре в течение 2 ч кислород воз-
КОНФЛИКТ ИНТЕРЕСОВ
духа.1 Реакционную смесь выдерживали 30 мин
Авторы заявляют об отсутствии конфликта
при температуре 50-55°С, продолжая пропускать
интересов.
воздух. После охлаждения до комнатной темпе-
ратуры смесь выливали в 50 мл дистиллирован-
CПИСОК ЛИТЕРАТУРЫ
ной воды и экстрагировали диэтиловым эфиром.
1. Schwartz P.-O., Pejic M., Wachtler M., Bäuerle P. //
Эфирный экстракт промывали водой до нейтраль-
Synth. Met. 2018. Vol. 243. P. 51. doi 10.1016/j.
ной реакции промывных вод и сушили безводным
synthmet.2018.04.005
сульфатом магния. После отгонки эфира получали
2. Gopinath A., Sultan Nasar A. // Polymer. 2019.
мелкокристаллический продукт 5 светло-бурого
Vol. 178. N 12 P. 1601. doi 10.1016/j.poly-
цвета.
mer.2019.121601
3. Liang Y., Yao Y. // Joule. 2018. Vol. 2. N9. P. 1690. doi
Смесь 0.56 моль соединения 5, 0.0005 моль
10.1016/j.joule.2018.07.008
(0.120 г) оксида свинца(IV) и 50 мл бензола выдер-
4. Muench S., Wild A., Friebe C., Häupler B., Janoschka T.,
живали 2 ч при постоянном перемешивании при
Schubert U.S. // Chem. Rev. 2016. Vol. 116. N 16.
~50°С. Осадок отфильтровывали, фильтрат упари-
P. 9438. doi 10.1021/acs.chemrev.6b00070
вали. Сырой продукт очищали хроматографией на
5. Train C., Norel L., Baumgarten M. // Coord. Chem.
силикагеле L 400/100 (элюент - бензол).
Rev. 2009. Vol. 253. N 19-20. P. 2342. doi 10.1016/j.
ccr.2008.10.004
6-Гидроксигекса-2,4-дииновый эфир 2,4-ди-
6. Novitchi G., Shova S., Lan Y., Wernsdorfer W., Train C. //
фенил-6-п-оксифенил-1,2,3,4-тетрагидро-симм-
Inorg. Chem. 2016. Vol. 55. N 23. P. 12122. doi
тетразинила (1а). Выход 0.100 г (42.3%), мелко-
10.1021/acs.inorgchem.6b02380
кристаллическое вещество темно-зеленого цве-
7. Koivisto B.D., Hicks R.G. // Coord. Chem. Rev. 2005.
та, т. пл. 101-102°С (бензол). ИК спектр, ν, см-1:
Vol. 249. N 23. P. 2612. doi 10.1016/j.ccr.2005.03.012
752.5, 1145.6, 1207.9, 1252 (С-О-С), 1265.1, 1323.0,
8. Miyamoto S., Iwasaki Y., Uemoto N., Hosokoshi Y.,
1488.9, 1505.7, 1585.3, 1615.9 (N=N), 1627.3 (Ar),
Fujiwara H., Shimono S., Yamaguchi H. // Phys.
2950.7 (С-Н, СН2), 2402.8 (-С≡С-С≡С-), 3405.1
Rev. Mat. 2019. Vol. 3. N 6. P. 064410. doi 10.1103/
(О-Н). Mасс-спектр (ЭУ, 70 эВ), m/z (Iотн, %): 421
PhysRevMaterials.3.064410
(3) [M]+, 405 (18), 393 (34), 331 (100), 315 (24). Най-
9. Brook D.J.R., Fleming C., Chung D., Richardson C.,
Ponce S., Das R., Srikanth H., Heindl R., Noll B.C. //
дено, %: С 74.10; Н 5.06. C26H21N4O2. Вычислено,
Dalton Trans. 2018. Vol. 47. N 18. P. 6351. doi 10.1039/
%: C 74.09; H 5.02.
c8dt00805a
7-Гидроксигепта-2,4-дииновый эфир 2,4-ди-
10. Liu Y., Qin A., Tang B.Z. // Progr. Polymer Sci. 2018.
фенил-6-п-оксифенил-1,2,3,4-тетрагидро-симм-
Vol. 78. P. 92. doi 10.1016/j.progpolymsci.2017.09.004
тетразинила (1б). Выход 0.088 г (36.1%), мелко-
11. Liu J., Lam J.W.Y., Tang B.Z. // Chem. Rev. 2009.
кристаллическое вещество темно-зеленого цвета,
Vol. 109. N 11. P. 5799. doi 10.1021/cr900149d
т. пл. 115-116°С (бензол). ИК спектр, ν, см-1: 750.1,
12. Menzel H., Horstmann S., Mowery M.D., Cai M.,
1145.6, 1207.29, 1252.5 (С-О-С), 1265.1, 1323.0,
Evans C.E. // Polymer. 2000. Vol. 41. N 22. P. 8113. doi
1488.9, 1505.6, 1585.3, 1622.7 (Ar), 1615.9 (N=N),
10.1016/S0032-3861(00)00148-8
13. Пряничникова М.К., Тихонова Л.Г., Танасейчук Б.С. //
2950.4 (С-Н, СН2), 2400.6 (-С≡С-С≡С-), 3400.8
ЖОрХ. 1997. Вып. 9. С. 1386.
(О-Н). Mасс-спектр (ЭУ, 70 эВ), m/z (Iотн, %): 435
14. Виноградов Т.А. // Усп. хим. 1984. Т. 4. № 1. С. 135.
(3) [M]+, 419 (19), 407 (37), 331 (100), 315 (21). Най-
15. Липунова Г.Н., Федорченко Т.Г., Чупахин О.Н. //
дено, %: С 74.50; Н 5.36. C27H23N4O2. Вычислено,
Усп. хим. 2013. Т. 82. № 8. C. 701; Lipunova G.N.,
%: C 74.46; H 5.32.
Fedorchenko T.G., Chupakhin O.N. // Russ. Chem.
Твердофазная полимеризация. Кристаллы те-
Rev. 2013. Vol. 82. N 8. P. 701. doi 10.1070/
тразинильных радикалов 1а, б облучали УФ лам-
RC2013v082n08ABEH004341
16. Танасейчук Б.С., Пряничникова М.К., Буртасов А.А. //
пой ДРТ-400 при комнатной температуре и визу-
Изв. вузов. Сер. хим. и хим. технол. 2019. Т. 62. №
ально отмечали изменение окраски во времени.
6. С. 15. doi 10.6060/ivkkt201962fp.5860
1 Вишневая окраска формазанов 4a, б исчезала в течение
17. Цебулаева Ю.В., Пряничникова М.К., Танасей-
15 мин и реакционная смесь приобретала светло-бурую
чук Б.С. // Изв. вузов. Сер. хим. и хим. технол. 2018.
окраску.
Т. 61. № 1. С. 23. doi 10.6060/tcct.20186101.5528
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
СИНТЕЗ ВЕРДАЗИЛЬНЫХ РАДИКАЛОВ
743
Synthesis of Verdazyl Radicals Differing in Number
of Methylene Fragments and Their Ability to Solid State
Polymerization
S. G. Kostryukov*, M. K. Pryanichnikova, A. Sh. Kozlov, A. A. Burtasov, and B. S. Tanaseichuk
N.P. Ogarev Mordovia State University, Saransk, 430005 Russia
*e -mail: kostryukov_sg@mail.ru
Received November 21, 2019; revised November 21, 2019; accepted November 28, 2019
Verdazyl radicals were obtained based on non-symmetric alkadiynyl ethers of p-hydroxybenzaldehyde. Using
these radicals, the effect of the degree of remoteness of the conjugated diyne fragment from the radical size
on the ability to solid-state polymerization under UV irradiation was studied. It was shown, that the rate of
solid-state polymerization increases with an increase in the number of methylene groups in alkadiyne and is
accompanied by the conservation of the radical center.
Keywords: verdazyl, tetrazinyl, leuco base, hydrazone, formazan, non-symmetric alkadiyne, solid-phase
polymerization
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020