ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 5, с. 760-766
УДК 547.022.1
СИНТЕЗ, КИСЛОТНЫЕ И СПЕКТРАЛЬНО-
ФЛУОРЕСЦЕНТНЫЕ СВОЙСТВА ПРОИЗВОДНЫХ
ФТАЛОЦИАНИНА
© 2020 г. Ю. Б. Ивановаa,*, О. А. Дмитриеваa, Ю. В. Хрушковаb, Т. В. Любимоваa,b,
А. С. Семейкинb, Н. Ж. Мамардашвилиa
a Институт химии растворов имени Г. А. Крестова Российской академии наук,
ул. Академическая 1, Иваново, 153045 Россия
b Ивановский государственный химико-технологический университет, Иваново, 153460 Россия
*e-mail: jjiv@yandex.ru
Поступило в Редакцию 8 октября 2019 г.
После доработки 8 октября 2019 г.
Принято к печати 18 октября 2019 г.
Получены тетракис{5,6-бис(4-трет-бутилфенил)пиразино[2,3-c]}порфиразин и тетра(4-трет-бутил)-
фталоцианин, спектрофотометрическим методом исследованы их кислотные и спектрально-флуоресцент-
ные свойства в ацетонитриле и толуоле при 298 и 295 K соответственно. Синтезированные соединения
идентифицированы методами электронной абсорбционной, ЯМР 1Н спектроскопии и масс-спектроме-
трии. Выявлено влияние заместителей в молекулярных фрагментах макроцикла на электронно-оптиче-
ские свойства синтезированных соединений.
Ключевые слова: фталоцианин, порфиразин, кислотные и флуоресцентные свойства
DOI: 10.31857/S0044460X20050157
Фталоцианины представляют собой класс гете-
алах, в том числе в наноматериалах для оптоэлек-
роциклических соединений, состоящих из изоин-
троники [1-5].
дольных (бензо[c]пиррольных) колец, соединен-
Фталоцианины - амфотерные соединения. С
ных между собой sp2-гибридизованными атомами
одной стороны, при действии кислот (концентри-
азота. Фталоцианины, структурно родственные
рованной серной или хлорсульфоновой кислот)
природным порфиринам, имеют четыре бензо-
в них возможно последовательное протонирова-
ние (до четырех) мостиковых мезо-атомов азота
льных кольца, сопряженных с макроциклом. Для
макроцикла, с другой - при действии оснований
их электронных спектров характерны две поло-
они легко отщепляют подвижные атомы водорода
сы поглощения: одна в коротковолновой (полоса
пиррольных групп NH с образованием дианионов.
Cope, 300-350 нм), другая - в длинноволновой
Пиррольные протоны могут замещаться катионами
(Q-полоса, 650-670 нм) области. Фталоцианины в
металлов с образованием соответствующих солей
промышленных масштабах используются в каче-
либо комплексных соединений. Фталоцианины и
стве сине-зеленых красителей и пигментов, а их
их производные химически и термически стабиль-
производные находят широкое применение при
ны, они способны образовывать упорядоченные
изготовлении светоизлучающих диодов, ячеек
тонкие пленки с фотопроводимостью и высокой
солнечных батарей, транзисторов, органических
каталитической активностью [6]. Исследования
полупроводников и электрохромных дисплеев, а
производных фталоцианина обладают большим
также молекулярных устройств для хранения, пе-
потенциалом практического использования.
редачи, преобразования и отображения больших
Нами получены тетракис{5,6-бис(4-трет-
объемов информации в функциональных матери-
бутилфенил)пиразино[2,3-c]}порфиразин 1 и те-
760
СИНТЕЗ, КИСЛОТНЫЕ И СПЕКТР
АЛЬНО-ФЛУОРЕСЦЕНТНЫЕ СВОЙСТВА
761
Схема 1.
t-Bu
t-Bu
H
N
CN
2
N CN
O
p-TSA
+
AcOH
N CN
O
H2N
CN
t-Bu
t-Bu
t-Bu
t-Bu
t-Bu
t-Bu
N
N
N
N
N
NH
N
Li
N
(CH2OH)2
N
HN
N
N
N
N
N
t-Bu
t-Bu
t-Bu
t-Bu
1
тра(4-трет-бутил)фталоцианин 2, спектрофото-
в кипящем хинолине (схема 2). Cоединения 1 и 2
метрическим методом исследованы их кислотные
идентифицировали методами электронной абсорб-
и спектрально-флуоресцентные свойства в ацето-
ционной, ЯМР 1Н спектроскопии и масс-спектро-
нитриле и толуоле при 298 и 295 K соответствен-
метрии.
но.
Депротонирование порфиринов, фталоцианина
Тетракис{5,6-бис(4-трет-бутилфенил)пирази-
(H2Pс) и его производных в органических раство-
но[2,3-c]}порфиразин 1 получен с выходом 36.2%
рителях в присутствии оснований происходит по
конденсацией
1,2-бис(4-трет-бутилфенил)этан-
внутрициклическим атомам азота [уравнения (1),
диона с диаминомалеинодинитрилом в уксусной
(2)] [1,7]. По литературным данным, для амилок-
кислоте в присутствии каталитических количеств
си- и тиадиазольных производных фталоцианина
п-толуолсульфокислоты (p-TSA) с последующей
эти процессы протекают в ДМСО [7].
циклотетрамеризацией
5,6-бис(4-трет-бутилфе-
нил)пиразин-2,3-дикарбонитрила в растворе ли-
(1)
тия в этиленгликоле (схема 1).
(2)
Тетра(4-трет-бутил)фталоцианин 2 синтези-
рован с выходом 17.5% циклотетрамеризацией
Здесь Н2Р, HР-, Р2- - молекулярная, моно- и дважды
4-трет-бутилфталонитрила в присутствии лития
депротонированные формы порфирина.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
762
ИВАНОВА и др.
Схема 2.
t-Bu
t-Bu
N
t-Bu
CN
Li
NH
N
ɯɢɧɨɥɢɧ
N
CN
N HN
N
t-Bu
t-Bu
2
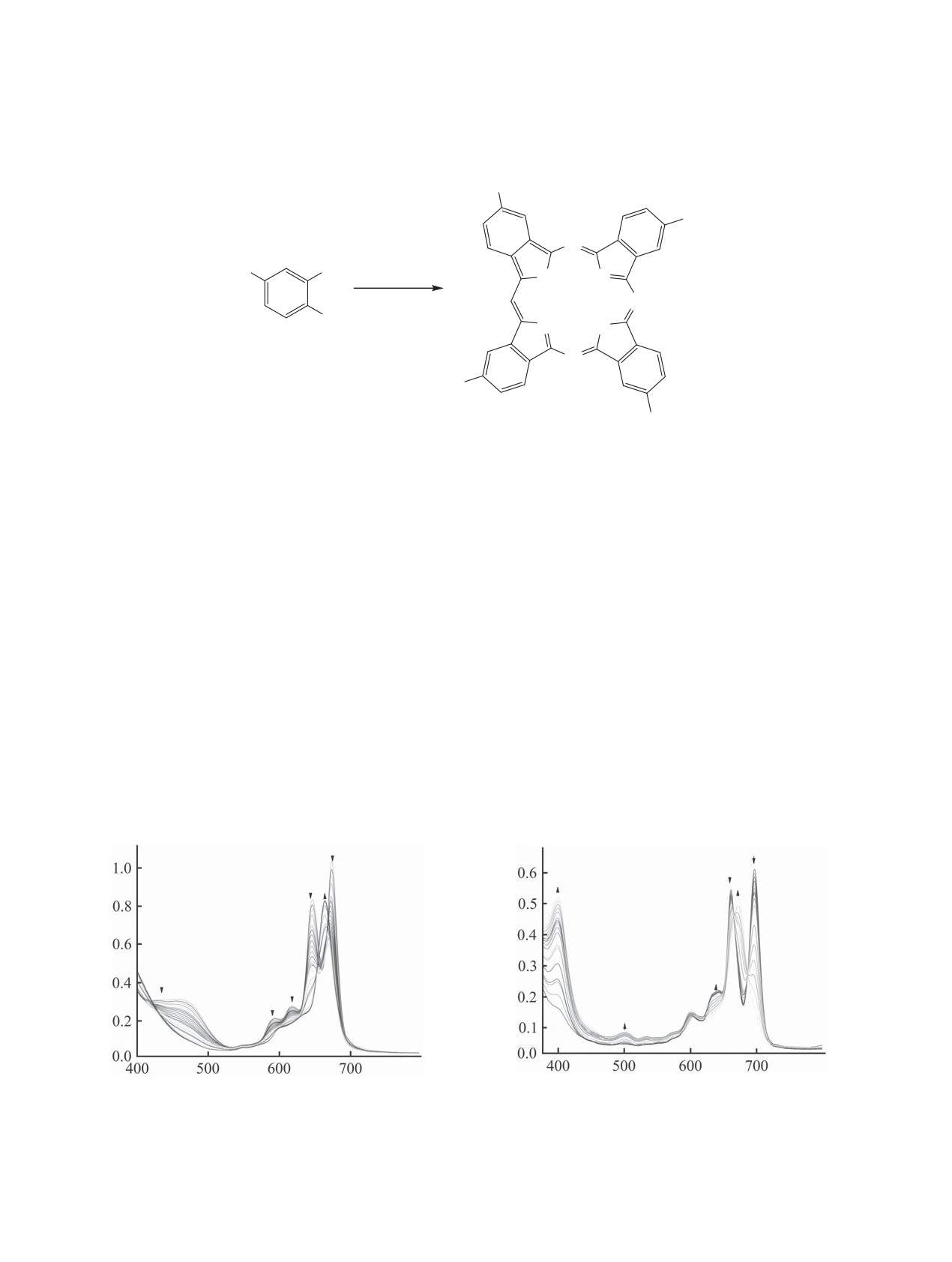
Изучение кислотных свойств порфиринов в
Кислотные свойства соединений 1 и 2 иссле-
среде ДМСО зачастую затруднено, так как при
довали в системе DBU-CH3CN при 298 K. По
растворении порфирин вступает в кислотно-
данным спектрофотометрического титрования со-
основное взаимодействие с электронодонорным
единений 1 и 2 в системе DBU-CH3CN, с увеличе-
центром молекулы ДМСО, и при неполном депро-
нием концентрации DBU в электронных спектрах
тонировании тетрапиррольного макроцикла под-
порфириновых структур наблюдалось образова-
вижность протонов групп NH заметно возрастает,
ние двух семейств спектральных кривых, каждо-
что находит отражение в изменении электронных
му из которых соответствовал свой набор изос-
спектров поглощения [8]. Титрование такой смеси
бестических точек. На рис. 1 и 2 приведены ЭСП
требует введения дополнительных компонентов
соединений 1 и 2 в ацетонитриле при титровании
(органических кислот) для регулирования концен-
0.01 М. ацетонитрильным раствором DBU. Нали-
трации форм смеси. Применение системы ацето-
чие двух семейств изосбестических точек в ЭСП
нитрил-1,8-диазабицикло[5.4.0]ундец-7-ен (DBU)
характерно для ступенчатого депротонирования
значительно облегчает эту задачу, так как порфи-
[9]. При титровании соединения 1 раствором DBU
рины в этой системе находятся в молекулярной
в ацетонитриле электронный спектр, соответству-
форме, что подтверждается электронными спек-
ющий молекулярной форме, с полосами (види-
трами поглощения (ЭСП).
мая область) при λ (ε) = 464 (4.55), 593 (4.38), 616
A
A
Ȝ ɧɦ
Ȝ ɧɦ
Рис. 1. Изменение электронного спектра поглощения
Рис. 2. Изменение электронного спектра поглощения
соединения 1 в системе ацетонитрил-DBU при 298 K
соединения 2 в системе ацетонитрил-DBU при 298 K
(c = 8.78×10-6 моль/л, cDBU = 0-1.85×10-5 моль/л).
(c = 0.92×10-6 моль/л, cDBU = 0-1.15×10-5 моль/л).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
СИНТЕЗ, КИСЛОТНЫЕ И СПЕКТР
АЛЬНО-ФЛУОРЕСЦЕНТНЫЕ СВОЙСТВА
763
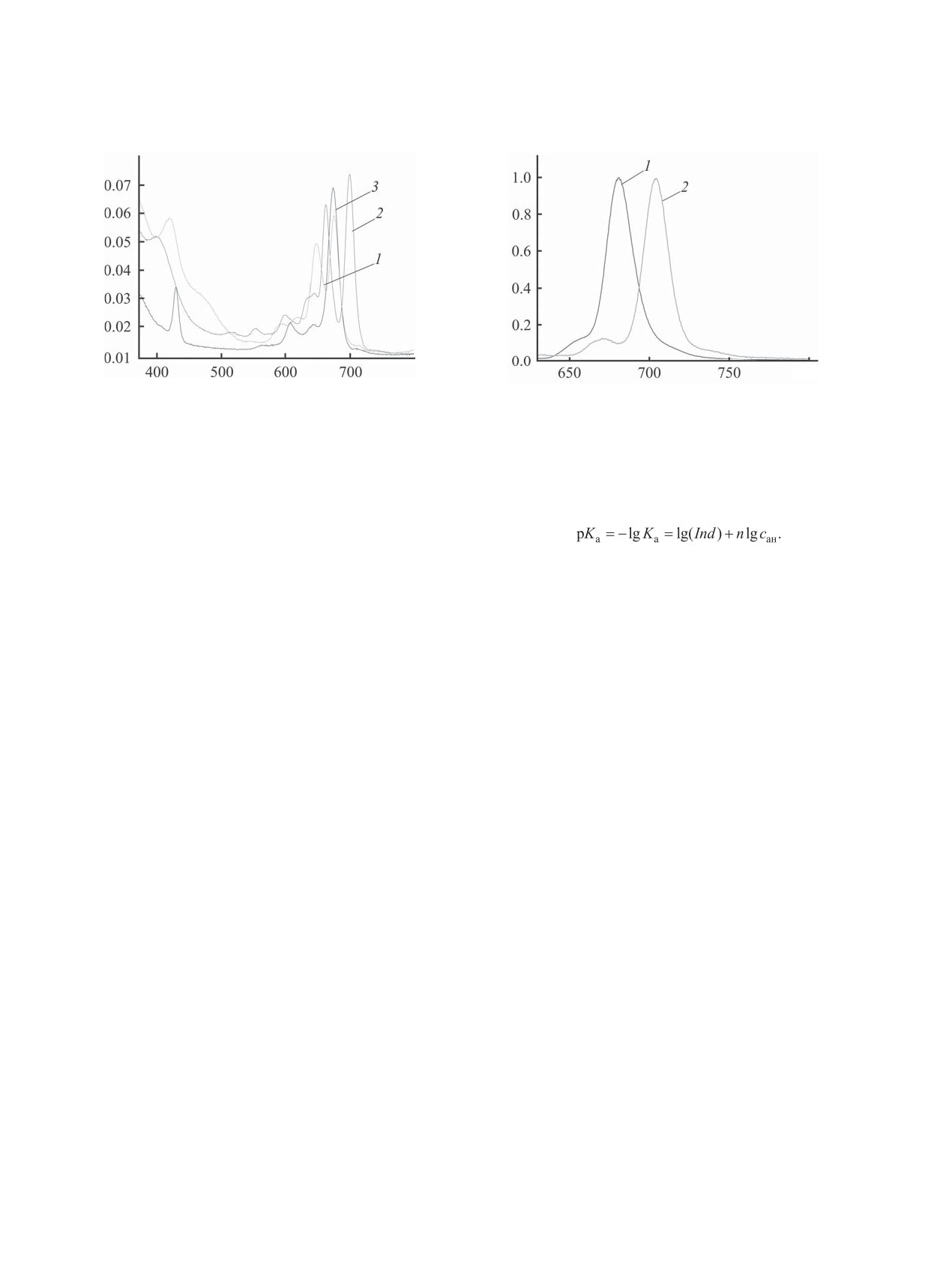
A
I
Ȝ ɧɦ
800
Ȝ ɧɦ
Рис. 3. Электронные спектры поглощения соединений
1 (1) и 2 (2) в толуоле и комплекса ZnPc (3) в пиридине
Рис. 4. Спектры флуоресценции соединений 1 и 2 в
при 295 K.
толуоле при 295 K (λex = 608 нм).
(4.48), 646 (4.97), 674 (5.07) нм и изобестическими
Расчет суммарной константы кислотности про-
точками при 428, 602, 655, 685 нм плавно транс-
водили по уравнению (3).
формировался в спектр, соответствующий дважды
(3)
депротонированной форме, с полосами при λ (ε) =
665 (4.97), 603 (4.29) и изосбестическими точками
Здесь Kа - суммарная константа кислотности,
при 432, 633, 658, 688 нм (рис. 1). Аналогично, при
сан - аналитическое значение концентрации DBU в
титровании соединения 2 раствором DBU в ацето-
растворе, Ind - индикаторное отношение P2-/H2P,
нитриле ЭСП, соответствующий молекулярной
n - число диссоцированных протонов (n = 2).
форме, λ (ε) = 599 (4.21), 638 (4.36), 661 (4.77), 696
Суммарные константы кислотности (рKа) для
(4.82) нм с изобестическими точками при 585, 622,
соединений 1 и 2 в ацетонитриле в системе DBU-
665, 685 нм плавно трансформировался в ЭСП, со-
CH3CN при 298 K составляют 11.11 и 13.12 соот-
ответствующий дважды депротонированной фор-
ветственно. Погрешность измерения констант не
ме, λ (ε) = 400 (4.75), 608 (4.19), 673 (4.75) нм с
превышала 3-5%.
изосбестическими точками при 588, 625, 668, 688
Природа заместителя и его положение в макро-
нм (рис. 2).
цикле оказывают сильное влияние на кислотные
Построенные на основании эксперименталь-
свойства тетрапиррольных макроциклов. Исследо-
ных данных кривые спектрофотометрического
вания показали, что по сравнению со структурой
титрования не имели ярко выраженных ступеней,
тетра(4-трет-бутил)фталоцианина 2 в тетракис-
что не противоречит ступенчатой ионизации, но
{5,6-бис(4-трет-бутилфенил)пиразино[2,3-c]}-
предполагает близкие константы протонирования
порфиразине 1 происходит увеличение кислотных
каждой реакции [9]. Характер изменения погло-
свойств на 2 порядка. Фенильные и трет-бутиль-
щения и наличие изосбестических точек показы-
ные группы проявляют достаточно слабый +I-
вают, что по мере изменения концентраций двух
эффект по отношению к порфириновой системе и
поглощающих центров порфириновой молекулы
приводят к небольшому нарушению планарности
соотношение между ионизированными формами
макроцикла. Атомы азота в структурах исследуе-
при протонировании порфиринов не нарушается.
мых соединений могут участвовать как в перерас-
Коэффициенты экстинкции форм исследованных
пределении электронной плотности по σ-связям,
порфиринов, участвующих в равновесиях (1) и (2)
так и в π-π-сопряжении в макроцикле [10, 11].
в системе DBU-CH3CN, определены с использова-
В соединении 2, вероятно, преобладает влияние
нием данных по поглощению и общей концентра-
мезо-атомов азота на электронную плотность
ции частиц каждого порфирина.
внутрициклических атомов азота, что приводит к
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
764
ИВАНОВА и др.
уменьшению прочности связи N-H. В соединении
Спектрально-флуоресцентные характеристики соеди-
1 под влиянием большого числа трет-бутильных
нений 1 и 2 в толуоле при 295 K (λex 608 нм)
групп, вероятно, происходит увеличение ковалент-
Соединение
λfl , нм
ΔSS, см-1
Qx
ности и прочности связи N-H и уменьшение эф-
1
681.0
130.5
0.41
фективной стабилизации образующегося аниона.
2
704.2
105.6
0.08
Для растворов соединений 1 и 2 в толуоле и
комплекса ZnPc в пиридине были сняты электрон-
ные спектры поглощения (рис. 3), а для раство-
первом возбужденном состоянии. Однако большее
ров соединений 1 и 2 в толуоле - спектры флуо-
значение стоксова сдвига в спектре соединения
ресценции при 295 K. Измерение флуоресценции
1, чем соединения 2, позволяет предположить и
выполняли для сильно разбавленных растворов
большую конформационную подвижность моле-
(<10-7 моль/л) вследствие возможного сильного
кул в первом случае. Согласно литературным дан-
повторного поглощения, наблюдаемого при высо-
ным [16], введение трет-бутильных групп в моле-
ких концентрациях растворов, которое зачастую
кулу должно приводить к уменьшению квантового
может провоцировать батохромное смещение мак-
выхода флуоресценции за счет увеличения коле-
симумов флуоресценции для некоторых фталоциа-
бательной и вращательной подвижности перифе-
нинов [12]. Спектры флуоресценции были норми-
рийных фрагментов, что и наблюдается в случае
рованы на максимум интенсивности. Длина волны
соединения 2 (квантовые выходы флуоресценции
возбуждения 608 нм. Спектры флуоресценции
соединений 1 и 2 равны 0.41 и 0.08 соответствен-
и спектрально-флуоресцентные характеристики
но). Сложная система заместителей в соединении
приведены на рис. 4 и в таблице.
1, как было показано ранее, изменяет геометрию
Спектры флуоресценции образцов в толуоле
молекулы и создает благоприятные условия для
сопоставляли с литературными значениями стан-
увеличения ее флуоресцентных свойств.
дартов (эталонов). В качестве стандарта был вы-
Проведенные исследования показали, что хи-
бран цинковый комплекс фталоцианина (ZnPс),
мическая модификация тетра(4-трет-бутил)фтало-
для которого известен квантовый выход в пириди-
цианина до тетракис[5,6-бис(4-трет-бутилфенил)
не (0.3) [13]. Рассчитаны соответствующие инте-
пиразино]порфиразина приводит к увеличению
гральные интенсивности флуоресценции.
кислотных свойств соединения на два порядка и
Квантовый выход флуоресценции соединений
повышению флуоресцентных свойств молекулы
1 и 2 в толуоле рассчитывали по стандартной ме-
(квантовый выход увеличился более чем в 5 раз).
тодике [14] по формуле (4).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(4)
Спектры ЯМР 1Н получали на спектрофотоме-
тре Bruker. Масс-спектры регистрировали на вре-
Здесь Qx и Qst -
квантовые выходы исследуемо-
мя-пролетном масс-спектрометре Shimadzu Axima
го образца и стандарта, Ax и Ast
- их оптическая
Confidence (MALDI-TOF). Индивидуальность со-
плотность на длине волны возбуждения, Ix и Ist
-
единений контролировали методом ТСХ на пла-
интегральные интенсивности, nx - показатель пре-
стинах Silufol с толщиной слоя 0.5 мм (Merck),
ломления для толуола (1.4969), nst
- показатель
элюент - хлороформ. Очистку и идентификацию
преломления для пиридина (1.5095) [13]. Погреш-
соединений проводили согласно рекомендациям
ность флуориметрических измерений ~ 10%.
[17]. Спектрофотометрическое титрование ацето-
Данные таблицы свидетельствуют о низкой
нитрильными растворами хлорной кислоты в аце-
величине стоксова сдвига (несколько см-1) иссле-
тонитриле проводили на спектрофотометрах Cary
дуемых соединений, что характерно для значи-
100 Varian и СПЕК ССП-715. В качестве раствори-
тельного перекрывания спектров поглощения [15].
теля использовали диполярный апротонный рас-
Вероятно, это связано с незначительной релакса-
творитель ацетонитрил высокой степени очистки
цией геометрии молекулы, которая происходит в
(содержание воды менее 0.03 %), в котором исход-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
СИНТЕЗ, КИСЛОТНЫЕ И СПЕКТР
АЛЬНО-ФЛУОРЕСЦЕНТНЫЕ СВОЙСТВА
765
ные объекты находились в молекулярной форме,
лом. Выход 0.8 г (36.2%), Rf (силуфол) 0.52 (хлоро-
что подтверждалось исходными спектрами порфи-
форм-гексан, 3:1). ЭСП (CHCl3), λmax, нм (lgε): 342
ринов. Методика эксперимента и обработки экспе-
(4.81) , 603 (4.41), 645 (4.59), 664 (5.03), 701 (5.10).
риментальных данных подробно представлены в
Спектр ЯМР 1Н (CDCl3), δ, м. д.: -2.60 уш.с (2H,
работах [18-24].
NH), 1.90 м (36H, t-Bu), 8.15 м (4H, H5), 8.86 м (4H,
5,6-Бис(4-трет-бутилфенил)пиразин-2,3-ди-
H3), 9.16 м (4H, H6). Масс-спектр (MALDI-TOF),
карбонитрил. Раствор
4.0 г
(12.4 ммоль)
m/z: 739.156 [M]+.
бис(4-трет-бутилфенил)этандиона,
1.4
г
КОНФЛИКТ ИНТЕРЕСОВ
(13.0 ммоль) диаминомалеодинитрила и 100 мг
Авторы заявляют об отсутствии конфликта
п-толуолсульфокислоты в 15 мл метанола кипя-
тили 3 ч, затем смесь охлаждали. Осадок отфиль-
интересов.
тровывали, промывали метанолом и сушили на
ФОНДОВАЯ ПОДДЕРЖКА
воздухе при комнатной температуре. Выход 4.2 г
Работа выполнена при поддержке Российского
(85.9%). Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.35 с
научного фонда (грант №19-73-20079) с исполь-
(18H, t-Bu), 7.41 д. т (4H, H3,5Ar, J = 8.6, 1J = 2.1 Гц),
зованием оборудования Верхневолжского регио-
7.55 д. т (4H, H2,6Ar, J = 8.6, 1J = 2.1 Гц). Масс-
нального центра физико-химических исследова-
спектр (MALDI-TOF), m/z: 395.667 [M + H]+.
ний.
Тетракис{5,6-бис(4-трет-бутилфенил)пи-
разино[2,3-c]}порфиразин (1). 50 мг (7.2 ммоль)
СПИСОК ЛИТЕРАТУРЫ
лития pастворяли при нагревании в 10 мл этилен-
1. Березин Б.Д. Координационные соединения порфи-
гликоля, затем прибавляли 400 мг (1.01 ммоль)
ринов и фталоцианина. М.: Наука, 1978. 280 с.
бис(4-трет-бутилфенил)пиразин-2,3-дикарбони-
2. Степанов Б.И. Введение в химию и технологию
трилa. Смесь кипятили 3 ч, затем охлаждали. Оса-
органических красителей. М.: Химия, 1984. 592 с.
док отфильтровывали, промывали водой и сушили
3. Порфирины: спектроскопия, электрохимия, приме-
при 70°С на воздухе, затем растворяли в хлоро-
нение / Под ред. Н.С. Ениколопян. М.: Наука, 1987,
форме, подкисляли трифторуксусной кислотой
384 с.
до изменения окраски с голубоватой на зеленую
4. Stillman M.J., Nyokong T., Leznoff C.C., Lever A.B.P.
и хроматографировали на силикагеле, элюент -
Phthalocyanines: Properties and Applications. New
York: VCH Publ. Inc., 1989. Vol. 1. P. 133.
хлороформом-этанол
(1%). Элюат упаривали,
5. Liu Z., Zhang X., Zhang Y., Jiang J. // Spectrochim.
порфиразин 1 осаждали метанолом, отфильтровы-
Acta (A). 2007. Vol. 67. N 5. P. 1232. doi 10.1016/j.
вали и сушили при 70°С на воздухе. Выход 70 мг
saa.2006.10.013
(17.5%), Rf (силуфол) 0.85 (бензол-метанол, 30:1).
6. Nalwa H.S., Miyata S. Nonlinear optics of organic
ЭСП (CHCl3), λmax, нм (lgε): 372 уш (5.15), 473
molecules and polymers. Boca Raton: CRC Press, 1997.
уш (4.83), 648 (5.18), 679 (5.28). Спектр ЯМР 1Н
P. 886.
(CDCl3), δ, м. д.: -0.66 с (2H, NH), 1.48 с (72H,
7. Шейнин В.Б., Иванова Ю.Б. // ЖФХ. 2007. Т. 81.
t-Bu), 7.58 д (16H, H3,5Ar, J = 8.1 Гц), 8.05 д (16H,
Вып. 8. С. 1419; Sheinin V.B., Ivanova Yu.B. // Russ.
H2,6Ar, J = 8.1 Гц). Масс-спектр (MALDI-TOF), m/z:
J. Phys. Chem. (A). 2007. Vol. 81. N 8. С. 1250. doi
1582.926 [M + 3H]+.
10.1134/S0036024407080134
8. Петров О.А., Осипова Г.В., Хелевина О.Г. // Макро-
Тетра(4-трет-бутил)фталоцианин (2). Смесь
гетероциклы. 2009. Т. 2. Вып. 2. С.151; Petrov O.A.,
3.0 г (16.3 ммоль) 4-трет-бутилфталонитрила и
Osipova G.V., Khelevina O.G. // Macroheterocycles.
0.12 г (17.1 ммоль) лития в 20 мл безводного хино-
2009. Vol. 2. N 2. P. 151.
лина кипятили 3 ч, затем охлаждали и прибавляли
9. Бернштейн И.Я. Спектрофотометрический анализ в
к смеси 30 мл концентрированной соляной кис-
органической химии. М: Химия. 1986. 202 c.
лоты и 150 мл воды при перемешивании. Осадок
10. Андрианов В.Г., Малкова О.В. // Макрогетероциклы.
отфильтровывали, промывали водой и сушили, за-
2009. Т. 2. Вып.130. С. 130; Andrianov V.G., Malko-
тем растворяли в хлороформе и хроматографиро-
va O.V. // Macroheterocycles. 2009. Vol. 2. N 2. С. 130.
вали на оксиде алюминия III степени активности.
11. Hirao H. J. // Phys. Chem. (A). 2011. Vol. 115. N 33.
Элюат упаривали, соединение 1 осаждали метано-
P. 9308. doi 10.1021/jp2052807
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
766
ИВАНОВА и др.
12. Dhami S., Mello A.D., Rumbles G., Bishop S.M., Phil-
Sheinin V.B., Mamardashvili N.Zh. // Russ. J. Gen.
lips D., Beeby A. // Photochem. Photobiol. 1995. Vol. 61.
Chem. 2007. Vol. 77. N 8. P. 1458. doi 10.1134/
N 4. P. 341. doi 10.1111/j.1751-1097.1995.tb08619
S1070363207080270
13. Whalley M.J. // Chem. Soc. 1961. P. 866. doi 10.1039/
20. Ivanova Yu.B., Mamardashvili N.Zh. // J. Fluoresc. 2017.
JR9610000866
Vol. 27. N 5. P. 303. doi 10.1007/s10895-016-1958-1
14. Lakowicz J.R. Principles of Fluorescence Spectroscopy.
21. Иванова Ю.Б., Мамардашвили Н.Ж., Семейкин А.С.,
Maryland: Springer, 2010. P. 954.
Глазунов А.В. // ЖОрХ. 2010. Т. 46. № 6. С. 918;
15. Freyer W., Mueller S., Teuchner K.J. // Photochem.
Ivanova Yu.B., Mamardashvili N.Zh., Semeikin A.S.,
Photobiol. (C). 2004. Vol. 163 N 1-2. P. 231. doi
Glazunov A.V. // Russ. J. Org. Chem. 2010. Vol. 46.
10.1016/j.jphotochem.2003.12.003
N 6. P. 917. doi 10.1134/S1070428010060230
16. Vachova L., Novakova V., Kopecky K., Miletin M.,
22. Крук Н.Н., Старухин А.С., Мамардашвили Н.Ж.,
Zimcik P. // Dalton Trans. 2012. Vol. 41. N 38. P. 11651.
Шейнин В.Б., Иванова Ю.Б. Пат. № 2345352. РФ
doi 10.1039/c2dt31403g
(2009).
17. Карякин Ю.В., Ангелов И.И. Чистые химические
23. Иванова Ю.Б., Чижова Н.В., Пуховская С.Г., Мамар-
реактивы. М.: Химия, 1974. C. 408.
дашвили Н.Ж. // ЖОХ. 2014. Т. 84. Вып. 5. С. 848.;
18. Иванова Ю.Б., Чурахина Ю.И., Мамардашвили Н.Ж. //
Ivanova Y.B., Chizhova N.V., Pukhovskaya S.G.,
ЖОХ. 2008. Т.78. Вып. 4. С. 691; Ivanova Yu.B.,
Mamardashvili N.Z. // Russ. J. Org. Chem. 2014.
Churakhina Yu. I., Mamardashvili N. Zh. // Russ. J.
Vol. 84. N 5. 939. doi 10.1134/S1070363214050260
Gen. Chem. 2008. Vol. 78. N 4. P. 673. doi 10.1134/
24. Nguyen N.T., Mamardashvili G.M., Kulikova O.M.,
S1070363208100265
Scheblykin I.G., Mamardashvili N.Z., Dehaen W. //
19. Иванова Ю.Б., Шейнин В.Б., Мамардашвили Н.Ж. //
RSC Adv. 2014. Vol. 4. N 38. P. 19703. doi 10.1039/
ЖОХ. 2007. T. 77. Вып. 8. C. 1380; Ivanova Yu.B.,
C3RA45660A
Synthesis, Acidic and Spectral-Fluorescent Properties
of Phthalocyanine Derivatives
Yu. B. Ivanovaa,*, O. A. Dmitrievaa, Yu. V. Khrushkovab, T. V. Lyubimovaa,b,
A. S. Semeykinb, and N. Zh. Mamardashvilia
a G. A. Krestov Institute of Solution Chemistry of the Russian Academy of Sciences, Ivanovo, 153045 Russia
b Ivanovo State University of Chemical Technology, Ivanovo, 153460 Russia
* e-mail: jjiv@yandex.ru
Received October 8, 2019; revised October 8, 2019; accepted October 18, 2019
Tetrakis{5,6-bis(4-tert-butylphenyl)pyrazino[2,3-c]}porphyrazine and tetra(4-tert-butyl)phthalocyanine
were obtained, their acidic and spectral fluorescence properties in acetonitrile and toluene were studied
spectrophotometrically at 298 and 295 K, respectively. The synthesized compounds were identified by electronic
absorption, 1H NMR spectroscopy and mass spectrometry methods. The effect of substituents in the molecular
fragments of the macrocycle on the electron-optical properties of the synthesized compounds was revealed.
Keywords: phthalocyanine, porphyrazine, acidic and fluorescence properties
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020