ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 5, с. 773-781
УДК 547.979.733
КИНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ РЕДОКС-СВОЙСТВ
5,10,15,20-ТЕТРАКИС-
(2,5-ДИМЕТОКСИФЕНИЛ)ПОРФИРИНАТА
КОБАЛЬТА(II) В РЕАКЦИИ С ПЕРОКСИДОМ
ВОДОРОДА
© 2020 г. О. Р. Симоноваa, С. А. Здановичa, С. В. Зайцеваa,*, О. И. Койфманa,b
a Институт химии растворов имени Г. А. Крестова Российской академии наук,
ул. Академическая 1, Иваново, 153045 Россия
b Ивановский государственный химико-технологический университет, Иваново, 153000 Россия
*e-mail: svz@isc-ras.ru
Поступило в Редакцию 26 ноября 2019 г.
После доработки 26 ноября 2019 г.
Принято к печати 2 декабря 2019 г.
Спектральными методами исследована реакция 5,10,15,20-тетракис(2,5-диметоксифенил)порфирината
кобальта(II) с пероксидом водорода в ацетонитриле при 298 K. Определены кинетические параметры
и предложен возможный механизм исследуемого редокс-процесса. Установлено, что в ходе реакции
образуется высокоактивная форма порфирината кобальта, способная окислять пероксид водорода. Пока-
зано влияние CH3O-групп, выступающих в качестве редокс-активаторов, на реакционную способность
комплекса. Электрохимическим методом получены потенциалы окисления порфирината кобальта(II),
свидетельствующие о возможности существования одно-, двух- и трехэлектронно окисленных форм
комплекса.
Ключевые слова: порфиринат кобальта, пероксид водорода, редокс-процесс
DOI: 10.31857/S0044460X20050170
В моделировании природных биокатализаторов
водит к патологическому изменению и разруше-
важное значение имеет сопоставимость строения
нию клетки. Нормальное редокс-состояние и его
активного центра природного фермента с его син-
стабилизация обеспечивается работой сложного
тетическим аналогом и воспроизведение высокой
ферментативного комплекса с редокс-регулятора-
каталитической активности.
ми. Однако, возникают ситуации, например, ин-
Особенности структуры порфиринатов метал-
токсикация организма, при которых наблюдается
лов, широкий спектр ее архитектурного дизайна
нарушение контроля уровня генерации активных
определяют практически значимые свойства этих
форм кислорода. В этом случае необходимо допол-
соединений и дают возможность использовать их
нительное введение в организм синтетических ре-
для создания биомиметиков [1-8], в том числе ре-
докс-регуляторов, с хорошими инактивационными
докс-регуляторов свободнорадикального окисле-
способностями.
ния, способных предупреждать патологические
Активность и селективность порфиринатов
изменения организма, сопровождающиеся старе-
металлов зависят от модификации периферии ма-
нием и тяжелыми заболеваниями.
кроциклического лиганда и окружения его коор-
Активные формы кислорода инициируют
динационного центра [9-17]. Так, редокс-свойства
свободнорадикальное окисление, которое при-
порфиринатов кобальта и приоритетное прохожде-
773
774
СИМОНОВА и др.
ние окислительных реакций по металлу или макро-
циклу находятся в зависимости от донорно-акцеп-
торных свойств заместителей и их числа, а также
от наличия алкильных лигандов на металлическом
центре [16, 17]. В работах [12-15] показана актив-
ность порфиринатов кобальта в стимулировании
электрокаталитического восстановления кислоро-
да по прямому четырехэлектронному механизму.
Авторы отмечают, что электрохимия, каталитиче-
ская активность и селективность комплексов ко-
бальта находятся под сильным влиянием структу-
ры их редокс-сайта. Так, например, порфиринаты
кобальта в зависимости от природы и положения
заместителей в макроцикле могут катализировать
восстановление кислорода посредством двух- или
Реакцию проводили при постоянной кон-
четырехэлектронного переноса. Без заместителей
центрации порфирината кобальта(II) (с = 5.49×
в мезо-положениях порфиринового кольца, ката-
10-6 моль/л) с различными добавками пероксида
лиз восстановления O2 может идти до H2O2 и H2O
водорода (интервал концентраций от 6.34×10-6 до
[13]. Введение арильных мезо-заместителей, на-
2.56 моль/л) в режиме непрерывного термоста-
тирования. Контроль прохождения редокс-пре-
пример фенильной группы, в соединения кобальта
вращений осуществлялся методом электронной
приводит к каталитическому восстановлению О2
спектроскопии. Интермедиаты и продукты иссле-
до Н2О2, в то время как порфирины, содержащие
дуемого процесса идентифицированы с помощью
небольшие алкильные группы в мезо-положении,
УФ, ИК спектроскопии и масс-спектрометрии.
способны к спонтанному образованию димеров
Реакция комплекса 5,10,15,20-тетракис(2,5-ди-
Ван-дер-Ваальса, обладающих большей каталити-
метоксифенил)порфирината кобальта(II) с перок-
ческой активностью в реакции восстановления O2
сидом водорода (с = 6.34×10-6-1.29×10-4 моль/л)
четырьмя электронами [13-15].
идет во времени и сопровождается изменениями
Известно, что порфиринаты металлов облада-
электронного спектра поглощения (ЭСП) комплек-
ют деструктивной способностью по отношению к
са. Наблюдаются две серии спектральных кривых
пероксидам [18-20]. Однако остаются вопросы в
с изобестическими точками. Первый набор спек-
области исследования закономерностей зависимо-
тральных линий показывает снижение интенсив-
сти структура-свойства. Недостаточно детально
ности и батохромное смещение полосы при λ =
изучены механизмы процесса активации свобод-
413 нм на 19 нм, исчезновение полосы при λ =
норадикального окисления и способы его регули-
528 нм с одновременным появлением полосы при
рования. Одним из решений этой проблемы может
λ = 544 нм (рис. 1а, 1, 2). Данная трансформация
служить модификация периферии макроцикла ре-
ЭСП свидетельствует об одноэлектронном окис-
докс-активными заместителями и изменение окру-
лении порфирината кобальта по катиону металла
CoII→CoIII [16, 21-24]. Изменение электронной
жения координационного центра комплекса, кото-
структуры комплекса CoIITPP(OCH3)8 в ходе реак-
рые обеспечат анти- или прооксидантное действие
ции ([H2O2] = 1.29×10-4 моль/л, τ = 3 мин) сопрово-
порфиринов металлов.
ждается появлением в его ИК спектре полосы при
В настоящей работе представлены исследова-
547 см-1, относящейся к колебаниям связи Co-O.
ния реакции
5,10,15,20-тетракис(2,5-диметокси-
Полоса колебаний ν(Co-Np) с частотой 456 см-1
фенил)порфирината кобальта(II) CoIITPP(OCH3)8
смещается в низкочастотную область на 12 см-1.
с пероксидом водорода в ацетонитриле при 295 K.
Это свидетельствует об изменение положения ато-
Показано влияние редокс-активных заместителей
ма металла в координационном центре, вызванно-
на каталазные свойства комплекса.
го образованием комплекса (OH)CoIIITPP(OCH3)8.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
КИНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ РЕДОКС-СВОЙСТВ
775
Рис. 1. Изменение ЭСП CoIITPP(OCH3)8 (c = 5.49×10-6 моль/л) в ходе реакции с пероксидом водорода (c = 1.29×
10-4 моль/л) в ацетонитриле при 295 K. (а) [H2O2] = 1.29×10-4 моль/л, 1 - исходный комплекс CoIITPP(OCH3)8, 2 - форма
[CoIIITPP(OCH3)8]+, 3 - форма [CoIIITPP(OCH3)•]2+, 4 - восстановленная форма; (б) [H2O2] = 1.4 моль/л.
Трансформация второй серии спектральных
В диапазоне концентраций пероксида водо-
кривых заключаются в смещении полос при λ =
рода от 8.0×10-4 до 1.29×10-2 моль/л спектраль-
432 и 544 нм до 434 и 547 нм, соответственно, с
ные изменения в ходе реакции с порфиринатом
одновременным появлением полос при λ = 500 и
кобальта(II) представляют собой лишь одну се-
617 нм (рис. 1а, 2, 3). Данные изменения говорят
рию кривых с изобестическими точками, харак-
об окислении комплекса по порфириновому ли-
теризующую образование радикальной формы
ганду [16, 22, 25-27] с образованием радикальной
[CoIIITPP(OCH3)•]2+. Ее ЭСП аналогичен спек-
формы [CoIIITPP(OCH3)•]2+. В ИК спектре реак-
тральной кривой 3 (рис. 1а). Переход CoII в CoIII
ционной смеси комплекса (OH)CoIIITPP(OCH3)8 с
происходит очень быстро.
пероксидом ([H2O2] = 1.29×10-4 моль/л, τ = 10 мин)
Дальнейшее увеличение концентрации перок-
полоса ν(Co-О) = 547 см-1 смещается в красную
сида водорода ([H2O2] = 1.14×10-1-2.56 моль/л)
область спектра на 7 см-1, а полоса ν(Co-Np) с
приводит к мгновенному двухэлектронному окис-
частотой 444 см-1 смещается в высокочастотную
лению порфирината кобальта(II) с образованием
область на 6 см-1. Полос, относящихся к колебани-
активной формы [CoIIITPP(OCH3)•]2+ (λmax = 434,
ям связей Cα-Cβ и Cα-N в пирролах радикальной
500, 548 и 619 нм), способной окислять Н2О2 с
формы, где радикал локализован в порфириновом
выделением кислорода. В ЭСП имеет место на-
кольце [19, 20, 27], не зафиксировано. Присутству-
рушение монотонности спектральной кривой в
•
ют полосы колебаний δ(С-Н) = 619 см-1, в ОСН
результате хаотических дискретных флуктуаций,
•
[28] и ν(С-Н) = 2867, 3160 см-1 в ОСН
[29-31].
незначительной интенсивности (рис. 1б). В ИК
Это свидетельствует о локализации радикала на
спектре реакционной смеси, зарегистрированного
периферии макроцикла. Также наблюдается поло-
через 2 мин после добавления Н2О2 с концентраци-
са колебаний связи О-О с частотой 920 см-1 [32]. В
ей 0.8 моль/л, также имеют место полосы колеба-
Н2О2 колебания связи в пероксогруппе находятся
ний ν(С-Н) = 2882, 3178 см-1 в ОСН•, ν(О-О) с ча-
в диапазоне 880-830 см-1 и не проявляются в об-
стотой 922 см-1 и возникает полоса при 1635 см-1,
ласти 1000-900 см-1 [33], а колебания связи О-О в
соответствующая колебаниям связей C=O, харак-
терная для хинонов [36-38].
МО2 обычно проявляются в 1152-990 см-1 [34, 35].
Таким образом, в реакционной смеси присутству-
В масс-спектре реакционной смеси ([H2O2] =
ет соединение, отличное от пероксида водорода,
1.29×10-1 моль/л) присутствуют сигналы моле-
имеющее в своем составе пероксогруппу.
кулярных пиков m/z = 868. 7, 913.9, 929.8, 944.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
776
СИМОНОВА и др.
8 и 960.8, которые указывают на наличие ион-
одного из метиновых мостиков тетрапиррольного
ной формы комплексов (ОН)CoTPP(OCH3)4(О)4,
кольца по α- или мезо-положению, с образованием
(ОН)CoTPP(OCH3)7(О), (ОН)CoTPP(OCH3)7(ОО),
нециклического тетрапиррола. Далее происходит
(ОН)CoTPP(OCH3)7(ОСН2ОH)
и
его фрагментация до низкомолекулярных соедине-
(ОН)CoTPP(OCH3)7(ОСН2ООН) соответственно.
ний [42-44].
Обнаруженные формы, являются интермедиата-
Следует заметить, что реакция незамещенного
ми и продуктами реакции порфирината кобальта
аналога порфирината кобальта (СоТРР) с перокси-
с пероксидом водорода. Некоторые из них могут
дом водорода ([H2O2] = 1.5 моль/л) не сопровожда-
быть очень активны в дальнейших редокс-превра-
ется окислением последнего. Окисленный ком-
щениях. Выступая инициаторами свободноради-
плекс [СоТРР•]2+ имеет ЭСП (λmax = 431, 498, 546,
кальных реакций, эти соединения сами становятся
616 нм), сходный со спектром [CoIIITPP(OCH3)
•]2+,
уязвимыми и подвергаются мономолекулярному
что говорит об одинаковом электронном состоянии
или индуцированному распаду.
молекул. Однако в случае [СоТРР•]2+ радикал нахо-
В диапазоне низких концентраций пероксида
дится в кольце макроцикла и данная форма не явля-
водорода при выдерживании во времени реакци-
ется такой активной [45], как [CoIIITPP(OCH3)
•]2+,
онной смеси происходит восстановление ради-
где радикал локализаван на заместителе.
кальной формы порфирината кобальта (рис. 1а, 3,
Методом циклической вольтамперометрии
4). В ЭСП восстановленной формы нет полосы при
определены редокс-потенциалы электрохимиче-
λmax = 617 нм, наблюдается изменение интенсив-
ского окисления порфирината кобальта(II) в ацето-
ности и батохромное смещение основных полос
нитриле. На вольтамперограмме зарегистрировано
на 1-4 нм по сравнению с ЭСП активной формы
три максимума, расположенных в области потен-
(рис. 1а, 3, 4). Смещение полос может быть связа-
циалов 0.22-1.25 В. Первый потенциал полуволны
но как с трансформацией заместителей в фениль-
Е1/2 = 0.28 В отвечает переходу Co2+ ↔ Co3+ [23].
ном фрагменте, так и с образованием донорно-ак-
Второй и третий потенциалы Е1/2 = 0.62 и 1.15 В
цепторной связи с молекулой воды или спирта.
связаны с окислением порфиринового лиганда
Одним из продуктов реакции окисления перок-
L↔L+ и L+↔L2+ соответственно. Второй потенци-
сида водорода является порфиринат кобальта(III)
ал имеет значение ниже, чем соответствующий по-
c бензохиноновым заместителем в макроцикле, о
тенциал для реакции с CoIITPP (Е1/2 = 1.19 В), где
чем свидетельствуют данные ИК и масс-спектро-
радикал локализуется на порфириновом кольце
метрии, рассмотренные выше. В области высоких
[26]. Это говорит о более легком окислении макро-
концентраций Н2О2 восстановленный комплекс
цикла исследуемого комплекса, которое идет на
зафиксировать спектрально невозможно из-за вы-
периферии, а именно на метоксильном заместите-
сокой скорости образования радикальной формы.
ле с образованием ОСН
•.
Окисление пероксида водорода сопровожда-
С учетом полученных в ходе исследований
ется деградацией комплекса, скорость и степень
спектральных и электрохимических характери-
которой зависит от концентрации Н2О2. В низком,
стик двухэлектронное окисление порфирината
среднем и высоком диапазоне концентраций за
кобальта(II) пероксидом водорода описывается
60 мин реакции степень деградации составляет 3,
уравнением (1). Следует заметить, что окислению
12 и 35% соответственно. Деструкция комплекса
по атому кобальта предшествует быстрая коорди-
идет без изменения степени окисления кобаль-
нация молекулы пероксида, с ее последующей ак-
та(III), о чем свидетельствует неизменность поло-
тивацией.
жения основных полос ЭСП. Имеет место лишь
падение их интенсивности (рис. 1б). Разрушение
(1)
порфиринового хромофора комплекса, подобно
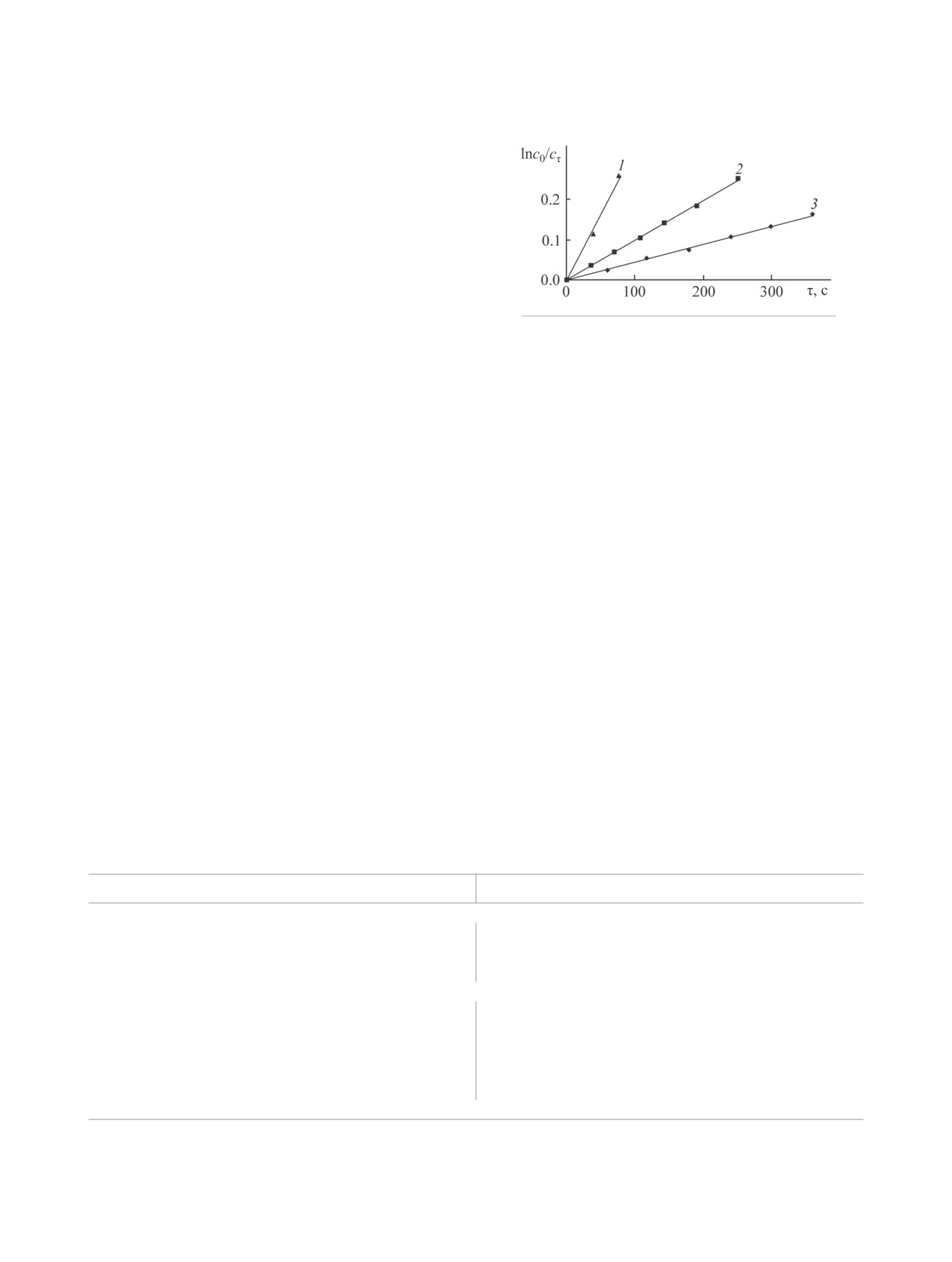
Линейная зависимость концентрации ком-
ферментативному распаду гемма крови и деструк-
ции хлорофилла [39-41]. Оно связано с нарушени-
плекса от времени в координатах ln(c0/cτ) от f(τ)
ем сопряжения в системе π-электронов и разрывом
и удовлетворительное постоянство значений эф-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
КИНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ РЕДОКС-СВОЙСТВ
777
фективной константы скорости (kэф) (рис. 2, см.
таблицу) свидетельствуют о том, что процесс идет
в условиях первого порядка по комплексу. Из ли-
нейной зависимости по уравнению (2) определе-
ны константы скорости прямых реакции kv1 и kv2
(kv2 << kv1, см. таблицу) и порядки по Н2О2 (n =
1 и 0 на первой и второй стадии соответственно).
Данные кинетические параметры позволяют запи-
сать уравнения скорости (3, 4) для каждой прямой
Рис. 2. Зависимость ln(с0/сτ)-f(τ) для первой стадии
реакции процесса (1).
реакции CoIITPP(OCH3)8 с Н2О2. [CoIITPP(OCH3)8] =
lgkэф = lgkv + nlgсH2O2,
(2)
5.49×10-6 моль/л, [H2O2] = 1.2945×10-4 (1), 1.29×10-5
–dсCoIITPP(OCH3)8/dt = kv1 сCoIITPP(OCH3)8∙сH2O2,
(3)
(2), 6.34×10-6 моль/л (3).
–dс[CoIIITPP(OCH3)8]+/dt = kv2∙с[CoIIITPP(OCH3)8]+.
(4)
можная схема образования активной формы пор-
Продуктом двухэлектронного окисления ком-
фирината кобальта и окисления пероксида водоро-
плекса CoIITPP(OCH3)8, как отмечалось выше, яв-
да (схема 1). Следует учитывать, что полная схема
ляется активная форма порфирината кобальта(III)
включает в себя еще целый ряд редокс-превраще-
с радикалом на атоме углерода метоксигруппы. В
присутствии кислорода он превращается в пере-
ний.
кисный радикал ОСН2ОО• [46], который способен
На основании вышеизложенного можно заклю-
окислять пероксид водорода до Н2О и О2. В ходе
чить, что в исследуемой окислительной реакции
этого окисления могут генерироваться соедине-
активным центром, наряду с атомом металла и
ния, имеющие в своем составе редокс-активато-
макроциклическим кольцом, выступают пери-
ры типа ОСН2О•, ArOO•, ArO• и Ar•. Такого рода
ферийные заместители порфиринового лиганда.
интермедиаты параллельно окислению пероксида
Локализация радикала на метоксигруппе и после-
водорода, способны к другим редокс-превращени-
дующая ее трансформация в ходе редокс-превра-
ям с образованием низкомолекулярных радикаль-
щений приводит к образованию активных интер-
ных продуктов, приводящих к деструкции порфи-
медиатов, способных, в свою очередь, окислять
рината кобальта. В том числе может наблюдаться
пероксида водорода до воды и О2. Увеличение
генерирование пероксильного радикала HOO• ,
числа редокс-активаторов и их сочетание в одной
который также участвует в свободнорадикальных
молекуле позволит получить новые эффективные
реакциях.
биомиметики природных окислительных фермен-
На основании спектральных и кинетических
тов. Каталазная активность порфирината кобальта
характеристик редокс-процесса предложена воз-
индуцированная редокс-активаторами, позволяет
Кинетические параметры реакции порфирината кобальта(II) с пероксидом водорода в ацетонитриле при 295 K
с(Н2О2)×104, моль/л
kэф×103, с-1
[CoIITPP(OCH3)8] = 5.49×10-6 моль/л
0.063
4.064
0.129
7.831
1.290
30.22
kv1 = 9.77 с-1∙моль-1∙л1
0.129
0.182
1.290
0.448
8.000
0.807
12.900
1.192
40.000
1.539
kv2 = 0.013 с-1∙моль-1∙л1
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
778
СИМОНОВА и др.
Схема 1.
рассматривать его как перспективную молекуляр-
фторопластовой крышке. Активную поверхность
ную систему для создания таких моделей.
рабочего электрода тщательно очищали в дис-
тиллированной воде перед каждым измерением,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
а затем в диметилформамиде. Рабочий электрод
Спектры ЭСП комплекса регистрировали в ди-
погружали в ячейку с исследуемым раствором, где
апазоне от 350 до 800 нм при 295 K на приборе
потенциал рабочего электрода достигал устойчи-
Varian Cary 50 с использованием кварцевых кювет
вого значения через 10 мин. Аргон барботировали
толщиной 1 см. Погрешность термостатирования
через капиллярную трубку в течение 30 мин, что-
составляла ±0.1 K. Масс-спектры (MALDI-TOF)
бы дезоксигенировать растворы перед электрохи-
регистрировали на времяпролетном масс-спек-
мическими измерениями.
трометре с матрично-ассоциированной лазерной
Ацетонитрил очищали по методике
[49].
десорбцией Axima Confidence. ИК спектры ре-
Перхлорат тетрабутиламмония (98.0%, Aldrich)
гистрировали на ИК Фурье-спектрометре Bruker
очищали перекристаллизацией из этанола. Раствор
Vertex 80 с помощью приставки Harrick MVP2
порфиринового комплекса [с = (2-4)×10-4 M.] со-
SeriesTM (материал призмы - алмаз) в области
держал 0.02 М. перхлората тетрабутиламмония в
4000-390 см-1 (по 64 сканирований в среднем) с
качестве вспомогательного электролита. Пероксид
разрешением 2 см-1 при комнатной температуре
водорода (30%) и ацетонитрил (99.8%) - коммер-
с использованием метода НПВО (нарушенного
ческие продукты (Sigma-Aldrich).
полного внутреннего отражения) в ацетонитри-
ле. Электрохимические измерения проводили
Синтез 5,10,15,20-тетракис(2,5-диметоксифе-
методом циклической вольтамперометрии с ис-
нил)порфирината кобальта(II) проводили по ме-
пользованием потенциостата Elins P-30SM в со-
тодике [47] реакцией 5,10,15,20-тетракис(2,5-ди-
ответствии с методикой [48]. Эксперименты про-
метоксифенил)порфина (29.0 мг, 0.04 ммоль) c
водились в трехэлектродной терморегулируемой
ацетатом кобальта(II) Co(AcO)2·4H2O (47.0 мг,
(25±0.5°С) электрохимической ячейке в свежепри-
0.19 ммоль) в кипящем ацетонитриле в атмосфере
готовленных растворах. В качестве рабочего элек-
инертного газа в течение 60 мин. Окончание реак-
трода использовалась полированная полоса золота
ции определяли по прекращению изменений в УФ
(Dropsens DRP-C220AT), жестко закрепленная во
видимой части электронного спектра поглощения
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
КИНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ РЕДОКС-СВОЙСТВ
779
комплекса. После упаривания растворителя под
СПИСОК ЛИТЕРАТУРЫ
вакуумом и промывки осадка водой, комплекс хро-
1. Patel M., Day B.J. // Trends Pharmacol. Sci. 1999. Vol. 20.
матографировали на оксиде алюминия (элюент -
N 9. P. 359. doi 10.1016/S0165-6147(99)01336-X
хлороформ). Выделенный комплекс сушили в ва-
2. Dismukes G.C.// Chem. Rev. 1996. Vol. 96. N 7.
кууме. Выход 95%. ИК спектр (CH3CN), ν, см-1:
P. 2909. doi 10.1021/cr950053c
3041-2973 (C-H), 1653-1378 (колебания порфи-
3. Collman J.P., Lee V.J., Kellen-Yuen C.J., Zhang X.,
ринового и бензольных циклов), 1271-1263 (CPh-
Ibers J.A., Brauman J.I. // J. Am. Chem. Soc. 1995.
О-С), 1168 (C-О, ОСН3), 1042 (CPh-О-С), 729-655
Vol. 117. N 2. P. 692. doi 10.1021/ja00107a013
(C-N), 457 (Co-Np). ЭСП (СН3СN), λmax, нм (lgε):
4. Авдеев М.В., Багрий Е.И., Маравин Г.В., Коро-
413 (5.14), 528 (4.16). Масс-спектр (MALDI-TOF),
лев Ю.М. // Кинетика и катализ. 2002. Т. 43. № 1.
m/z: 911.86 [C52H44N4O8Co]+.
С. 43.; Avdeev M.V., Bagri, E.I., Maravin G.B., Koro-
Для получения кинетических параметров и
lev Yu.M. // Kinetics and Catalysis. 2002. Vol. 43. N 1.
оптимизации величин эффективной константы
P. 38. doi 10.1023/A:1014240927361
скорости (kэф) и константы скорости реакции (kv),
5. Arasasingham R.D., He G.-X., Bruce T.C.// J. Am.
использовали методику [50]. Реакцию проводи-
Chem. Soc. 1993. Vol. 115. N 18. P. 7985. doi 10.1021/
ли в условиях постоянной концентрации порфи-
ja00071a008
рината кобальта(II) (с = 5.49×10-6 моль/л) и раз-
6. Зайцева С.В., Зданович С.А., Кудрик Е.В., Койф-
личных концентрациях пероксида водорода (с =
ман О.И. // ЖНХ. 2017. Т. 62. № 9. С. 1265.
6.34×10-6-2.56 моль/л) в ацетонитриле при 295 K.
doi 10.7868/S0044457X17090197; Zaitseva S.V.,
Для серии свежеприготовленных растворов через
Zdanovich S.A., Kudrik E.V., Koifman O.I. // Russ. J.
определенные промежутки времени регистри-
Inorg. Chem. 2017. Vol. 62. N 9. P. 1257. doi 10.1134/
ровали ЭСП и проводили измерения оптической
S0036023617090194
плотности на максимумах поглощения комплекса.
7. Capobianchi A., Paoletti A.M., Rossia G., Zanotti G.,
По уравнению формально первого порядка (5), с
Pennesi G. // Sens. Actuators (B). 2009. Vol. 142. N 1.
учетом изменения оптической плотности раствора
P. 159. doi 10.1016/j.snb.2009.08.021
на рабочих длинах волн при λ = 413 и 434 нм были
8. Zanotti G., Angelini N., Notarantonio S., Paoletti A.M.,
определены эффективные константы скорости в
Pennesi G., Rossi G., Lembo A., Colonna D., Di
условиях избытка пероксида.
Carlo A., Reale A., Brown T.M., Calogero G. // Int. J.
kэф = 1/τ·ln(с0/сτ).
(5)
Photoenergy. 2010. Vol. 2010. Article ID 136807. doi
Здесь с0, сτ - концентрация комплекса в моменты
10.1155/2010/136807
времени 0 и τ.
9. Милаева Е.Р.// Рос. хим. ж. 2004. № 4. С. 20.
Константу скорости реакции и порядок по пе-
10. Meunier B., Robert A., Pratviel G., Bernadou J. In: The
роксиду определяли оптимизацией зависимости
Porphyrin Handbook / Eds K.M. Kadish, K.M. Smith,
lgkэф-lgс0(Н2О2) с использованием метода наи-
R. Guilard. New York: Academic Press, 2000. Vol. 4.
меньших квадратов.
Ch. 31. P. 119.
ФОНДОВАЯ ПОДДЕРЖКА
11. Batinic-Haberle I. In: Methods in Enzymology / Ed.
L. Packer. New York: Academic Press, 2002. Vol. 349.
Работа выполнена при поддержке Российского
P. 223. doi 10.1016/S0076-6879(02)49337-8
научного фонда (соглашение № 18-03-00369-а) с
12. Trojánek A., Langmaier J., Samec Z.// Electrochem.
привлечением оборудования Верхневолжского ре-
Commun. 2006. Vol. 8. N 3. P. 475. doi 10.1016/j.
гионального центра физико-химических исследо-
elecom.2006.01.004
ваний.
13. Song E., Shi C., Anson F.C. // Langmuir. 1998. Vol. 14.
КОНФЛИКТ ИНТЕРЕСОВ
N 15. P. 4315. doi 10.1021/la980084d
Авторы заявляют об отсутствии конфликта
14. Shi C., Steiger B., Yuasa M., Anson F.C. // Inorg. Chem.
интересов.
1997. Vol. 36. N 20. P. 4294. doi 10.1021/ic970516s
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
780
СИМОНОВА и др.
15. Shi C., Anson F.C. // Inorg. Chem. 1998. Vol. 37. N 5.
28. Tan L.Y., Winer A.M., Pimentel G.C. // J. Chem. Phys.
P. 1037. doi 10.1021/ic971255p
1972. Vol. 57. N 9. P. 4028. doi 10.1063/1.1678876
16. Kadish K.M., Li J., Van Caemelbecke E., Ou Z., Guo N.,
29. Zhang X.K., Parnis J.M., Lewars E.G., March R.E. //
Autret M., D’Souza F., Tagliatesta P. // Inorg. Chem.
Can. J. Chem. 1997. Vol. 75. N 3. P. 276. doi 10.1139/
1997. Vol. 36. N 27. P. 6292. doi 10.1021/ic970789n
v97-031
17. Fukuzumi S., Miyamoto K., Suenobu T., Van Caemel-
30. Scherer J.J., Aniolek K.W., Cernansky N.P., Rakest-
becke E., Kadish K.M. // J. Am. Chem. Soc. 1998. Vol.
raw D.J. // J. Chem. Phys. 1997. Vol. 107. N 16. P. 6196.
120. N 12. P. 2880. doi 10.1021/ja973257e
doi 10.1063/1.474284
18. Зайцева С.В., Тюрин Д.В., Зданович С.А., Кой-
31. Diken E.G., Weddle G.H., Headrick J.M., Weber J.M.,
фман О.И. // ЖНХ. 2019. Т. 64. № 6. C. 660. doi
Johnson M.A. // J. Phys. Chem. (A). 2004. Vol. 108.
10.1134/S0044457X19060187; Zaitseva S.V., Tyu-
N 46. P. 10116. doi 10.1021/jp0404403
rin D.V., Zdanovich S.A., Koifman O.I. // Russ. J.
32. Oxley J., Smith J., Brady J., Dubnikova F., Kosloff R.,
Inorg. Chem. 2019. Vol. 64. N 6. P. 815. doi 10.1134/
Zeiri L., Zeiri Y. // Appl. Spectrosc. 2008. Vol. 62. N 8.
S0036023619060184
P. 906. doi 10.1366/000370208785284420
19. Zaitseva S.V., Simonova O.R., Zdanovich S.A., Koif-
33. Pettersson M., Tuominen S., Räsänen M. // J. Phys.
man O.I. // Macroheterocycles. 2018. Vol. 11. N 1. P. 29.
Chem. (A). 1997. Vol. 101. N. 6. P. 1166. doi 10.1021/
doi 10.6060/mhc180173s
jp962946u
20. Гришина Е.Г., Макарова А.С., Кудрик Е.В., Макаро-
34. Amanullah S., Singha A., Dey A. // Coord. Chem. Rev.
ва С.В.,, Койфман О.И. // ЖФХ. 2016. Т. 90. № 3.
2019. Vol. 386. P. 183. doi 10.1016/j.ccr.2019.01.021
С. 477. doi 10.7868/S0044453716030134; Grishi-
35. Kitagawa T., Ozaki Y. In: Metal Complexes with
na E.S., Kudrik E.V., Makarova A.S., Makarov S.V.,
Tetrapyrrole Ligands I / Ed. J.W. Buchler. Heidelberg:
Koifman O.I. // Russ. J. Phys. Chem. (A). 2016. Vol. 90.
Springer, 1987. P. 71. doi 10.1007/BFb0036790
N 3. P. 704. doi 10.1134/S0036024416030134
36. Patil A.O., Curtin D.Y., Paul I.C. // J. Am. Chem. Soc.
21. Mu X.H., Kadish K.M.// Inorg. Chem. 1989. Vol. 28.
1984. Vol. 106. N 2. P. 348. doi 10.1021/ja00314a017
N 19. P. 3743. doi 10.1021/ic00318a025
37. Yoshida R., Isozaki K., Yokoi T., Yasuda N., Sadakane K.,
22. Ye L., Fang Y., Ou Z., Xue S., Kadish K.M. // Inorg.
Iwamoto T., Takaya H., Nakamura M. // Org. Biomol.
Chem. 2017. Vol. 56. N 21. P. 13613. doi 10.1021/acs.
Chem. 2016. Vol. 14. N 31. P. 7468. doi 10.1039/
inorgchem.7b02405
c6ob00969g
23. Тесакова М.В., Носков А.В., Базанов М.И., Берези-
38. Fukushima K., Sakurada M. // J. Phys. Chem. 1976.
на Н.М., Парфенюк В.И. // ЖФХ 2012. Т. 86. № 1.
Vol. 80. N 12. P. 1367. doi 10.1021/j100553a022
С. 13; Tesakova M.V., Noskov A.V., Bazanov M.I.,
39. Gozzelino R., Jeney V., Soares M.P. // Annu. Rev.
Berezina N.M., Parfenyuk V.I. // Russ. J. Phys.
Pharmacol. Toxicol. 2010. N 50. P. 323. doi 10.1146/
Chem. (A). 2012. Vol. 86. N 1. P. 9. doi 10.1134/
annurev.pharmtox.010909.105600
S0036024411120326
40. Sugishima M., Sakamoto H., Higashimoto Y., Nogu-
24. Mamardashvili G., Kaigorodova E., Simonova O.,
chi M., Fukuyama K. // J. Biol. Chem. 2003. Vol. 278.
Mamardashvili N. // J. Coord. Chem. 2018. Vol. 71.
N 34. P. 32352. doi 10.1074/jbc.M303682200
N 24. P. 4194. doi 10.1080/00958972.2018.1535112
41. Zhang H., Liu N., Zhao J., Ge F., Xu Y., Chen Y. //
25. Gasyna Z., Stillman M.J. // Inorg. Chem. 1990. Vol. 29.
Chemosphere. 2019. Vol. 223. P. 659. doi 10.1016/j.
N 25. P. 5101. doi 10.1021/ic00350a017
chemosphere.2019.01.135
26. Wolberg A., Manassen J. // J. Am. Chem. Soc. 1970.
42. Müller T., Rafelsberger M., Vergeiner C., Kräutler B. //
Vol. 92. N 10. P. 2982. doi 10.1021/ja00713a010
Angew. Chem. Int. Ed. 2011. V. 50. N 45. P. 10724. doi
27. Zaitseva S.V., Tyulyaeva E.Yu., Simonova O.R.,
10.1002/anie.201103934
Zdanovich S.A., Tyurin D.V., Koifman O.I. // J.
43. Симонова О.Р., Зданович С.А., Зайцева С.В. //
Coord. Chem. 2018. Vol. 71. N 16-18. P. 2995. doi
ЖОХ. 2010. Т. 80. Вып. 12. С. 2051; Simonova O.R.,
10.1080/00958972.2018.1506109
Zdanowich S.A., Zaitseva S.V. // Russ. J. Gen.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
КИНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ РЕДОКС-СВОЙСТВ
781
Chem. 2010. Vol. 80. N 12. С. 2512. doi 10.1134/
47. Adler A. D., Longo F. R., Kampas F. Kim J. // J. Inorg.
S1070363210120182
Nucl. Chem. 1970. Vol. 32. N 7. P. 2443. doi
10.1016/0022-1902(70)80535-8
44. Симонова О.Р., Зайцева С.В., Койфман О.И. // ЖОХ.
2016. Т. 86. Вып. 6. С. 992; Simonova O.R., Zaitse-
48. Kuzmin S.M., Chulovskaya S.A., Parfenyuk V.I. // J.
va S.V., Koifman O.I. // Russ. J. Gen. Chem. 2016.
Porph. Phthal. 2014. Vol. 18. N 7. P. 585. doi 10.1142/
Vol. 86. N 6. С. 1322. doi 10.1134/S1070363216060177
S108842461450031X
45. Wang D., Groves J.T. // Proc. Nat. Acad. Sci. 2013.
49. Беккер X., Домшке Г., Фангхенель Э., Фишер М.
Vol. 110 N 39. P. 15579. doi 10.1073/pnas.1315383110
Органикум. М.: Мир, 1992. Т. 2. 474 c.
46. Di Tommaso S., Rotureau P., Crescenzi O., Adamo C. //
50. Экспериментальные методы химической кинетики /
Phys. Chem. Chem. Phys. 2011. Vol. 13. N 32. P. 14636.
Под ред. Н.М. Эмануэля, Г.Б. Сергеева. М.: ВШ,
doi 10.1039/c1cp21357a
1980. 375с.
Kinetic Studies of Redox Properties of Cobalt(II)
5,10,15,20-Tetrakis(2,5-dimethoxyphenyl)porphyrinate
in Reaction with Hydrogen Peroxide
O. R. Simonovaa, S. A. Zdanovicha, S. V. Zaitsevaa,*, and O. I. Koifmana,b
a G.A. Krestov Institute of Solutions Chemistry of the Russian Academy of Sciences, Ivanovo, 153045 Russia
b Ivanovo State University of Chemistry and Technology, Ivanovo, 153000 Russia
*e-mail: svz@isc-ras.ru
Received November 26, 2019; revised November 26, 2019; accepted December 2, 2019
The reaction of 5,10,15,20-tetrakis(2,5-dimethoxyphenyl)cobalt(II) porphyrinate with hydrogen peroxide in
acetonitrile at 298 K was studied using spectral methods. Kinetic parameters were determined and a possible
mechanism of the studied redox process was proposed. The initial complex generates a highly active species
capable of oxidizing hydrogen peroxide during the reaction. The CH3O groups at peripheral position of mac-
rocycle are shown to effect on the reactivity of the complex and act as redox activators. The possibility of the
existence of one-, two-, and three-electron oxidized forms of the studied complex was supported by electro-
chemical measurements.
Keywords: cobalt porphyrinate, hydrogen peroxide, redox process
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020