ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 5, с. 782-786
УДК 541.64
ВЗАИМОДЕЙСТВИЕ ПОЛИАКРИЛОВОЙ КИСЛОТЫ
С ИОНАМИ МЕДИ, КОБАЛЬТА И НИКЕЛЯ
В ВОДНЫХ РАСТВОРАХ
© 2020 г. А. С. Чевтаев, А. И. Табунщиков, А. С. Озерин*, Ф. С. Радченко, И. А. Новаков
Волгоградский государственный технический университет, пр. Ленина 28, Волгоград, 400005 Россия
*e-mail: asozerin@vstu.ru
Поступило в Редакцию 10 декабря 2019 г.
После доработки 10 декабря 2019 г.
Принято к печати 5 января 2020 г.
Методами потенциометрического и спектрофотометрического титрования изучены закономерности вза-
имодействия полиакриловой кислоты с ионами меди, кобальта и никеля в водных растворах. В водных
растворах при pH ~3 полиакриловая кислота не образует комплексов с ионами кобальта и никеля. С
ионами меди комплекс образуется, однако равновесие коплексообразования смещено в сторону обра-
зования аквакомплексов меди. Методом просвечивающей электронной микроскопии установлено, что
полученные в присутствии полиакриловой кислоты частицы металлов распределяются по размерам в
относительно широком интервале.
Ключевые слова: комплексы полимер-металл, ионы меди, никеля и кобальта, полиакриловая кислота,
наночастицы
DOI: 10.31857/S0044460X20050182
Композитные материалы на основе макромо-
клубков полимера (нанореакторах), а не равномер-
лекул полимеров и наноразмерных частиц метал-
но во всем объеме раствора [6].
лов (медь, никель, кобальт) находят широкое при-
При изучении закономерностей комплексо-
менение в качестве токопроводящих чернил [1],
образования ионов меди, никеля, кобальта с по-
материалов с диэлектрическими и магнитными
лиэтиленимином установлено [7, 8], что ионы
свойствами [2, 3], в катализе [4]. Получение нано-
металлов образуют комплексы только с непрото-
размерных частиц металлов в присутствии макро-
нированными функциональными группами поли-
молекул полимеров реализуется в виде так назы-
этиленимина, что возможно только в щелочной
ваемого псевдоматричного синтеза, суть которого
среде. В щелочных водных растворах указанные
состоит в узнавании макромолекулой растущей
ионы металлов превращаются в нерастворимые
частицы, достигающей определенного размера, и
гидроксиды. В связи с этим приходилось исполь-
последующей адсорбции макромолекулы на по-
зовать низкие концентрации солей металлов, что
верхности частицы с образованием экрана, пре-
значительно ограничивает применение поли-
пятствующего дальнейшему увеличению размера
мер-коллоидных комплексов на основе металли-
частицы [5]. В разбавленных растворах полимеров
ческих частиц и полимера.
для получения частиц с наименьшим размером и
узким распределением по размерам необходимо
Другой полиэлектролит, способный образовать
использовать в качестве прекурсоров комплексы
комплексы с ионами металлов, которые имеют не-
ионов металлов с макромолекулами полимеров.
заполненную d-орбиталь, - полиакриловая кисло-
В этом случае частицы твердой фазы образуют-
та [9], водные растворы которой характеризуются
ся преимущественно внутри макромолекулярных
низким значением pH. Методами потенциометри-
782
ВЗАИМОДЕЙСТВИЕ ПОЛИАКРИЛОВОЙ КИСЛОТЫ
783
Ȝ ɧɦ
Ȝ ɧɦ
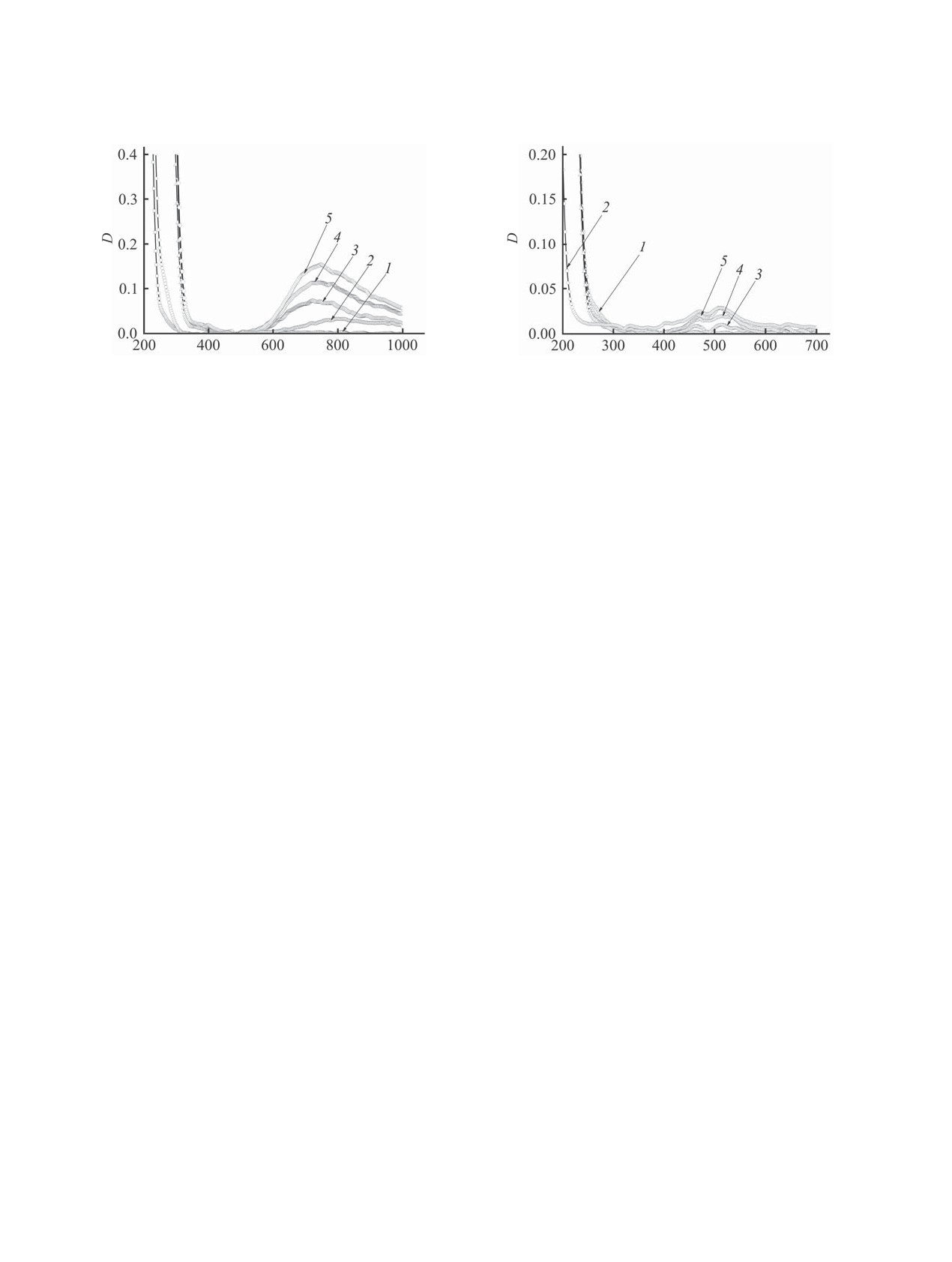
Рис. 1. Спектры поглощения водных растворов по-
Рис. 2. Спектры поглощения водных растворов по-
лиакриловой кислоты (1), CuSO4 (2) и смеси водных
лиакриловой кислоты (1), CoSO4 (2) и смеси водных
растворов с мольными соотношениями полиакриловая
растворов с мольными соотношениями полиакриловой
кислота:CuSO4 = 5.0 (3), 2.5 (4),1.0 (5).
кислота:CоSO4 = 5.0 (3), 2.5 (4), 1.0 (5).
ческого и спектрофотометрического титрования
в кислой среде (pH ~3) лишь малая доля ионов
нами изучены закономерности образования ком-
Cu2+(менее 10 %) связана в комплекс с карбоксиль-
плексов макромолекул полиакриловой кислоты с
ными группами полиакриловой кислоты, а основ-
ионами Cu2+, Co2+, Ni2+ с целью использования их
ная их часть находится в виде аквакомплексов [10].
в качестве прекурсоров при получении нанораз-
Спектр поглощения раствора CoSO4 (рис. 2, 2)
мерных металлических частиц.
характеризуется двумя максимумами, λ 470 и 512
На кривых потенциометрического титрования
нм, а спектр раствора NiSO4 - максимумом при λ =
полиакриловой кислоты (исходный рН = 2.98) во-
400 нм (рис. 3, 2). При добавлении к водному рас-
дными растворами СuSO4, СoSO4 и NiSO4 скачков
твору полиакриловой кислоты растворов CoSO4
не наблюдается, как и не наблюдается изменения
(рис. 2, 3-5) и NiSO4 (рис. 3, 3-5) в спектрах не
окраски растворов, что может свидетельствовать
наблюдается сдвига максимумов, а оптическая
об отсутствии образования комплексов макро-
плотность смесей увеличивается пропорциональ-
молекул полиакриловой кислоты с ионами Cu2+,
но концентрации солей металлов. Следовательно,
Co2+, Ni2+.
образования комплексов ионов металлов с функ-
Результаты спектрофотометрического титро-
циональными группами полиакриловой кислоты
не происходит.
вания водного раствора полиакриловой кислоты
растворами солей металлов представлены на рис.
О возможности использования полиакриловой
1-3. Спектр поглощения раствора CuSO4 (рис. 1,
кислоты для синтеза частиц металлов путем хими-
2) имеет максимум при длине волны λ = 800 нм. В
ческого восстановления их ионов в нанореакторах
спектре раствора полиакриловой кислоты (рис. 1,
можно судить не только по закономерностям ком-
1) максимумов в диапазоне длин волн 200-1000 нм
плексообразования полиакриловая кислота-Me2+,
не наблюдается. В спектре смеси водных раство-
но и по анализу кривых распределения образую-
ров полиакриловой кислоты и CuSO4 наблюдается
щихся частиц по размеру.
гипсохромный сдвиг максимума (λ = 740 нм), что
Синтез частиц меди, кобальта и никеля в при-
может являться следствием образования комплек-
сутствии полиакриловой кислоты проводили при
сов. Определить предельный состав комплекса по-
избытке полимера с целью создания условий, мак-
лиакриловая кислота-Cu2+не удалось.
симально способствующих получению частиц
Оптическая плотность смесей растворов поли-
внутри макромолекулярных клубков (нанореак-
акриловой кислоты и CuSO4 в точке максимума
торах), а не во всем объеме раствора. На рис. 4
увеличивается пропорционально концентрации
представлены диаграммы распределения частиц
сульфата меди. Это может быть связано с тем, что
по размерам. Диаграммы распределения по разме-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
784
ЧЕВТАЕВ и др.
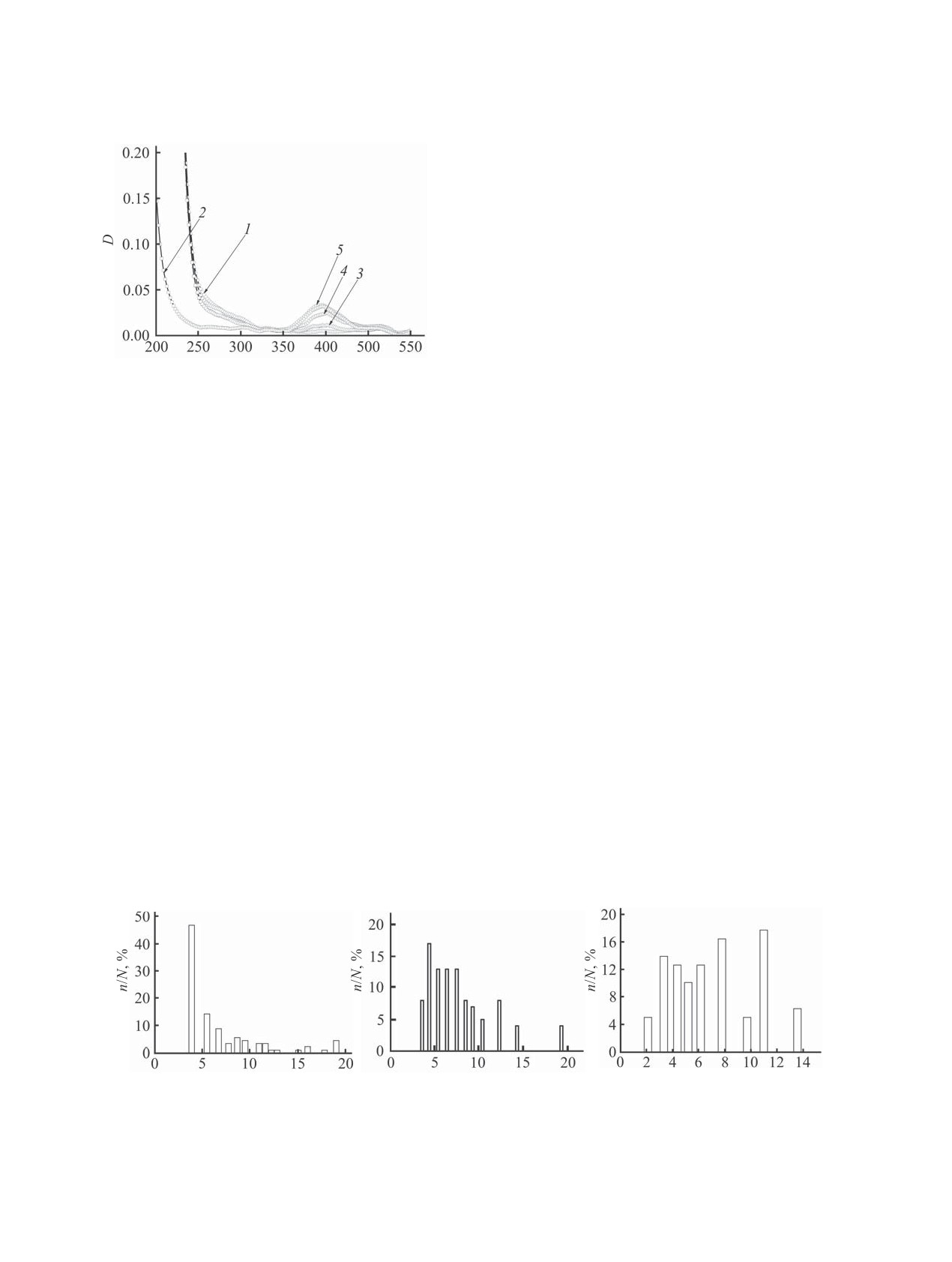
ных клубков (нанореакторах). Основная доля ио-
нов меди, не связанная в комплекс с полиакрило-
вой кислотой, восстанавливается во всем объеме
раствора, образуя более крупные частицы. Это
предположение подтверждается тем, что массовая
доля частиц с размером 3.8 нм составляет менее
0.2 мас%.
Таким образом, полиакриловая кислота в кис-
лой среде не образует комплексов с ионами ко-
бальта и никеля, с ионами меди комплекс образу-
ется, но доля ионов меди, связанных в комплекс,
Ȝ ɧɦ
очень мала. Следовательно, полиакриловая кис-
Рис. 3. Спектры поглощения водных растворов по-
лота не может быть использована в качестве ста-
лиакриловой кислоты (1), NiSO4 (2) и смеси водных
билизатора для получения наноразмерных частиц
растворов с мольными соотношениями полиакриловая
кислота:NiSO4 = 5.0 (3), 2.5 (4), 1.0 (5).
кобальта, никеля и меди с узким распределением
их по размерам.
рам для частиц кобальта и никеля характеризуют-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ся широким интервалом: 3.6-19.3 нм для кобальта
В работе использовали 25 мас%-ный водный
и 2.1-13.5 нм для никеля. При этом и для кобальта,
раствор полиакриловой кислоты (М
250000,
и для никеля доли частиц разных размерных фрак-
Aldrich Chemical Co.), сульфат меди пентагидрат,
ций не сильно различаются. Следовательно, обра-
сульфат кобальта гептагидрат, сульфат никеля геп-
зование частиц кобальта и никеля происходит не в
тагидрат (99%, Aldrich Chemical Co.), боргидрид
нанореакторах, а во всем объеме раствора.
натрия (99%, Aldrich Chemical Co.). В качестве
Диаграмма распределения частиц меди по раз-
растворителя для приготовления растворов ис-
мерам (рис. 4а) также характеризуется широким
пользовали бидистиллированную воду.
диапазоном (от 3.8 до 19.0 нм). Однако в отличие
Потенциометрическое титрование. К 50 мл
от кобальта и никеля у меди доля фракции неболь-
водного раствора полиакриловой кислоты (с =
ших частиц с размером 3.8 нм составляет около
0.01 моль/л) прибавляли по 0.5 мл водного рас-
50%. Это может быть связано с тем, что образова-
твора соответствующей соли металла при интен-
ние частиц меди происходит одновременно двумя
сивном перемешивании. Концентрации растворов
способами. Малая часть ионов меди, связанных с
солей всех трех металлов составляли 0.1 моль/л.
макромолекулой полиакриловой кислоты в ком-
ЭДС измеряли после каждого добавления порции
плекс, восстанавливается с образованием частиц
титранта с использованием вольтметра V7-40/4. В
малых размеров (3.8 нм) внутри макромолекуляр-
качестве электрода сравнения использовали хлор-
ɚ
ɛ
ɜ
d ɧɦ
d ɧɦ
d ɧɦ
Рис. 4. Диаграмма распределения по размерам частиц меди (а), кобальта (б) и никеля (в), полученных в присутствии по-
лиакриловой кислоты.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
ВЗАИМОДЕЙСТВИЕ ПОЛИАКРИЛОВОЙ КИСЛОТЫ
785
серебряный электрод ЭСр-10103, а в качестве ин-
КОНФЛИКТ ИНТЕРЕСОВ
дикаторных электродов - проволоку из меди мар-
Авторы заявляют об отсутствии конфликта
ки ММ (ГОСТ 859-2014), кобальта марки К1Ау
интересов.
(ГОСТ 123-98) и никеля марки Н1у (ГОСТ 849-97).
СПИСОК ЛИТЕРАТУРЫ
Спектрофотометрическое титрование. К
50 мл водного раствора полиакриловой кислоты
1. Qi T., Wang X., Yang J., Xiao F. // J. Mat. Sci. 2019.
(с = 0.01 моль/л) прибавляли по 0.5 мл водно-
Vol. 30. P. 12669. doi 10.1007/s10854-019-01630-4
го раствора соответствующей соли металла при
2. Abdurakhmanov U., Boitmuratov F. T., Mukhamedov G.I.,
интенсивном перемешивании. Концентрация
Fionov A S., Yurkov G.Yu. // J. Com. Tech. Electr. 2010.
растворов солей всех трех металлов составляла
Vol. 55. P. 221. doi 10.1134/S1064226910020154
0.05 моль/л. После каждого добавления порции
3. Suwanwatana W., Yarlagadda S., Gillespie J.W., Jr. //
J. Mat. Sci. 2003.Vol. 38. P. 565. doi 10.1023/
титранта отбирали аликвоту 4.5 мл для снятия
A:1021854026668
спектров поглощения в интервале длин волн от
4. Чернавский П.А., Панкина Г.В., Лермонтов А.С.,
200 до 1000 нм с шагом 2 нм. После снятия спек-
Лунин В.В. // Кинетика и катализ. 2003. Т. 44. №
тра раствор аликвоты возвращали в стакан для ти-
5. С. 718; Chernavskii P.A., Pankina G.V., Lermontov
трования. Спектры снимали на спектрофотометре
A.S., Lunin V.V // Kinetics and Catalysis. 2003. Vol. 44.
СФ-2000 (ОКБ «Спектр», Россия) в кварцевой кю-
P. 657. doi 10.1023/A:1026146123264
вете с толщиной поглощающего слоя 1 см.
5. Паписов И.М. // Высокомол. соед. (А). 1997. Т. 39.
Синтез частиц металлов в присутствии по-
№ 3. С. 562; Papisov I.M. // Polymer Sci. (B). 1997.
лиакриловой кислоты. Восстановление катио-
Vol. 39. P. 122.
нов металлов в присутствии полиакриловой кис-
6. Кротикова О.А., Озерин А.С., Радченко Ф.С., Но-
лоты проводили при комнатной температуре. В
ваков И.А. // Высокомол. соед. (А). 2017. Т. 59. № 3.
2.5 мл свежеприготовленного 0.1 М. раствора бор-
C. 215; Krotikova O.A., Ozerin A.S., Radchenko F.S.,
гидрида натрия при интенсивном перемешивании
Novakov I.A. // Polym. Sci. (A). 2017. Vol. 59. P. 288.
вносили 25 мл раствора, содержащего 0.01 моль/л
doi 10.1134/S0965545X17030105
полиакриловой кислоты и 0.005 моль/л соли соот-
7. Устякина Д.Р., Чевтаев А.С., Табунщиков А.И.,
ветствующего металла. Перемешивание продол-
Озерин А.С., Радченко Ф.С., Новаков И.А. //
жали до прекращения выделения водорода.
Высокомол. соед. (Б). 2019. Т. 61. № 3. C. 179.
Ustaykina D.R., Chevtaev A.S., Tabunschikov A.I.,
Измерение размеров синтезированных ча-
Ozerin A.S., Radchenko Ph.S., Novakov I.A. //
стиц проводили на просвечивающем электрон-
Polym. Sci. (B). 2019. Vol. 61. P. 261. doi 10.1134/
ном микроскопе LEO912 AB OMEGA (CarlZeiss,
S1560090419030151
Германия) с разрешающей способностью
0.2-
8. Новаков И.А., Радченко Ф.С., Озерин А.С., Чевта-
0.3 нм при ускоряющем напряжении 100 кВ. Об-
ев А.С., Табунщиков А.И., Устякина Д.Р. // Изв.
разцы синтезировали непосредственно перед
ВолгГТУ. Сер. Химия и технология элементооргани-
измерением. Каплю исследуемого раствора по-
ческих мономеров и полимерных материалов. 2019.
мещали на подложку из формвара и сушили при
№ 5 (228). C. 74.
комнатной температуре. Для определения сред-
9. Сергеев Б.М., Кирюхин М.В., Бахов Ф.Н., Серге-
него размера частиц и построения диаграмм рас-
ев В.Г. // Вестн. Московск. унив. Сер. 2 Химия. 2001.
пределения частиц по размерам использовали
Т. 42. № 5. С. 308.
программный комплекс ImageJ [11], обрабатывая
10. Zezin A.A., Feldman V.I., Abramchuk S.S., Dane-
выборку из 500-600 частиц.
lyan G.V., Dyo V.V., Plamper F.A., Mullerd A.H.E.
Pergushov D.V. // Phys. Chem. Chem. Phys. 2015.
ФОНДОВАЯ ПОДДЕРЖКА
Vol. 17. P. 11490. doi 10.1039/C5CP00269A
Работа выполнена при финансовой поддержке
11. Schneider C.A., Rasband W.S., Eliceiri K.W. // Nature
гранта РФФИ, проект № 18-03-00594.
Methods. 2012. Vol. 9. P. 671. doi 10.1038/nmeth.2089
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
786
ЧЕВТАЕВ и др.
Interaction of Polyacrylic Acid with Copper, Cobalt,
and Nickel Ions in Aqueous Solutions
A. S. Chevtaev, A. I. Tabunshchikov, A. S. Ozerin*, F. S. Radchenko, and I. A. Novakov
Volgograd State Technical University, pr. Lenina 28, Volgograd, 400005 Russia
*e-mail: asozerin@vstu.ru
Received December 10, 2019; revised December 10, 2019; accepted January 5, 2020
Regularity of the interaction of polyacrylic acid with copper, cobalt and nickel ions was studied by potentio-
metric and spectrophotometric analysis in aqueous solutions. It was shown that polyacrylic acid in aqueous
solutions at pH≈3 does not form complexes with cobalt and nickel ions. A complex is formed with copper ions,
however, the equilibrium of the coplexing reaction is strongly biased towards copper aquacomplexes. The
sizes of metal particles were determined using transmission electron microscopy. The size distribution of metal
particles synthesized in the presence of polyacrylic acid is characterized by a wide distribution.
Keywords: polymer-metal complexes, copper, nickel and cobalt ions, polyacrylic acid, nanoparticles
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020