ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 5, с. 787-790
УДК 544.015.4
ОКСИД САМАРИЯ ПРИ ВЫСОКИХ ТЕМПЕРАТУРАХ.
СУБЛИМАЦИЯ И ТЕРМОДИНАМИКА
© 2020 г. В. Л. Столярова*, В. А. Ворожцов, С. И. Лопатин, С. М. Шугуров
Санкт-Петербургский государственный университет, Университетская наб. 7-9,
Санкт-Петербург, 190034 Россия
*e-mail: v.stolyarova@spbu.ru
Поступило в Редакцию 13 декабря 2019 г.
После доработки 13 декабря 2019 г.
Принято к печати 18 декабря 2019 г.
Методом высокотемпературной масс-спектрометрии изучены процессы испарения и термодинамиче-
ские свойства оксида самария в интервале температур 2265-2668 K. Определены энтальпия испарения
Sm2O3 и энтальпия образования газообразного монооксида самария при 298 K. Получены зависимости
парциальных давлений SmO и Sm над Sm2O3 от температуры в указанном интервале.
Ключевые слова: испарение, термодинамические свойства, оксид самария, высокотемпературная
масс-спектрометрия
DOI: 10.31857/S0044460X20050194
Оксид самария наряду с другими редкозе-
При комнатной температуре Sm2O3 характе-
мельными оксидами - незаменимый компонент
ризуется двумя полиморфными модификациями:
специальных стекол, керамики, люминофоров и
низкотемпературной моноклинной (B) и термо-
высокотемпературных защитных покрытий, вос-
динамически стабильной кубической (C) [5, 6].
требованных в авиационной и космической тех-
Переход из кубической модификации в моноклин-
нике. Потенциально возможно использования ке-
ную протекает при 900 K, энтальпия этого пере-
рамики с оксидами самария и гафния при выборе
хода составляет 6±3 кДж/моль [6]. Согласно при-
материалов для литья лопаток газотурбинных дви-
нятым в настоящее время данным [6], стандартная
гателей с использованием жаропрочных сплавов
энтальпия образования (ΔfH°) моноклинной и ку-
[1, 2] и для получения перспективных термоба-
бической модификаций Sm2O3 равна -1823.0±4.0 и
рьерных покрытий нового поколения [3, 4]. Одна-
-1826.8±4.8 кДж/моль соответственно.
ко при высоких температурах до 3000 K области
Стандартную энтальпию образования газо-
эксплуатации указанных выше материалов, вклю-
образного монооксида самария определяли не-
чающих оксид самария, могут в значительной сте-
однократно. В температурном интервале 2333-
пени лимитироваться протеканием селективных
2499 K измерена энтальпия реакции (1) [7].
процессов испарения компонентов, приводящих
Sm2O3 (кр.) = 2SmO (газ) + O (газ).
(1)
к изменению совокупности физико-химических
свойств.
Величина ΔfH°(SmO, газ, 298 K) также была
получена при измерении констант равновесия га-
Этим продиктована необходимость проведе-
зофазных реакций с участием SmO [8, 9]. Имею-
ния исследования с целью получения достоверной
щиеся в литературе данные о величине стандарт-
информации о процессах испарения и термоди-
ной энтальпия образования газообразного оксида
намических свойствах оксида самария при вы-
SmO систематизированы в таблице [6-9].
соких температурах. Решение указанной задачи
выполнено нами методом высокотемпературной
При испарении оксида самария Sm2O3 в темпе-
масс-спектрометрии с использованием вольфра-
ратурном интервале 2250-2500 K в масс-спектре
мовой эффузионной камеры Кнудсена.
пара нами идентифицированы ионы SmO+ и Sm+.
787
788
СТОЛЯРОВА и др.
Стандартные энтальпии образования SmO (газ)
ΔrH(298),
- ΔfH(298),
Т, K
Реакция
Ссылка
кДж
кДж/моль
2333-2499
Sm2O3 (кр.) = 2 SmO (газ) + O (газ)
1839.1
113.6
[7]
а
2265-2668
Sm2O3 (кр.) = 2 SmO (газ) + O (газ)
1884 ±81
94 ±41
2360-2500
Sm (газ) + YO (газ) =SmO (газ) + Y (газ)
135.2
170.9
[7]
2155-2485
Sm (газ) +NO2 (газ) = SmO (газ) +NO (газ)
-
116.6
[8]
2087-2298
Al (газ) + SmO (газ) = AlO (газ) + Sm (газ)
3.5
109.0
[9]
2110-2295
Al(газ) + SmO (газ) = AlO (газ) + Sm (газ)
2.6
101.6
[9]
105.3 ±8.0
[6]
Рекомендованные величины
117 ±17
[11]
а Данные, полученные в настоящей работе.
В указанном температурном интервале соотноше-
Здесь Kp(T) - константа равновесия реакции при
ние величин ионных токов SmO+ и Sm+ зависит
температуре Т, R - газовая постоянная, ΔrH(T) -
от температуры. Для определения молекулярных
энтальпия реакции при температуре, отвечающей
предшественников в масс-спектре пара над Sm2O3
середине температурного интервала измерений.
были определены энергии появления этих ионов
Для середины температурного интервала изме-
методом исчезающего ионного тока с использова-
рений (2466 K) энтальпия реакции (1) составляет
нием золота в качестве стандарта [10]. Получен-
1754±81 кДж. Для пересчета этого значения на
ные величины для SmO+ (5.0 эВ) и Sm+ (5.2 эВ)
298 K были привлечены справочные данные [11-
в пределах погрешности измерений ±0.3 эВ соот-
13] и получена величина 1884±81 кДж, которая в
ветствуют энергии ионизации SmO и атомарного
пределах погрешности измерений согласуется с
самария соответственно [10]. Это позволяет утвер-
ранее полученными данными [7].
ждать, что в изученном температурном интервале
С использованием найденной в настоящей ра-
Sm2O3 переходит в пар [уравнения (1), (2)].
боте энтальпии реакции (1) и стандартных энталь-
Sm2O3 (кр.) = 2Sm (газ) + 3O (газ).
(2)
пий образования Sm2O3 (кр.) [6], Sm (газ) [12] и O
Определение зависимостей интенсивности
(газ) [13], рассчитана величина стандартной эн-
ионных токов SmO+ и Sm+ от температуры и из-
тальпии образования SmO (газ), -94±41 кДж/моль.
мерение парциальных давлений молекулярных
Рекомендуемая величина стандартной энталь-
форм пара SmO и Sm методом полного изотерми-
пии образования SmO (газ) (-105.3 ±8.0 кДж/моль)
ческого испарения позволили получить зависимо-
[6] базируется на результатах измерения констант
сти парциальных давлений монооксида самария и
равновесия серии обменных газофазных реакций
атомарного самария от температуры в интервале
(см. таблицу) с участием газообразного моноокси-
2265-2668 K [уравнения (3) и (4) соответственно].
да самария. Таким образом, наблюдаемое различие
между полученной в настоящей работе величиной
(3)
стандартной энтальпии образования газообразно-
го монооксида самария и соответствующими зна-
(4)
чениями, приведенными в работах [7-9], связаны,
При 2466 K соотношение парциальных давле-
по-видимому, с погрешностями и достоверностью
ний p(SmO)/p(Sm) равно 3.2. Величина энтальпии
использованных в указанных работах значений эн-
реакции (1) найдена по уравнению (5).
тальпий образования и теплоемкостей участников
изученных ранее реакций.
(5)
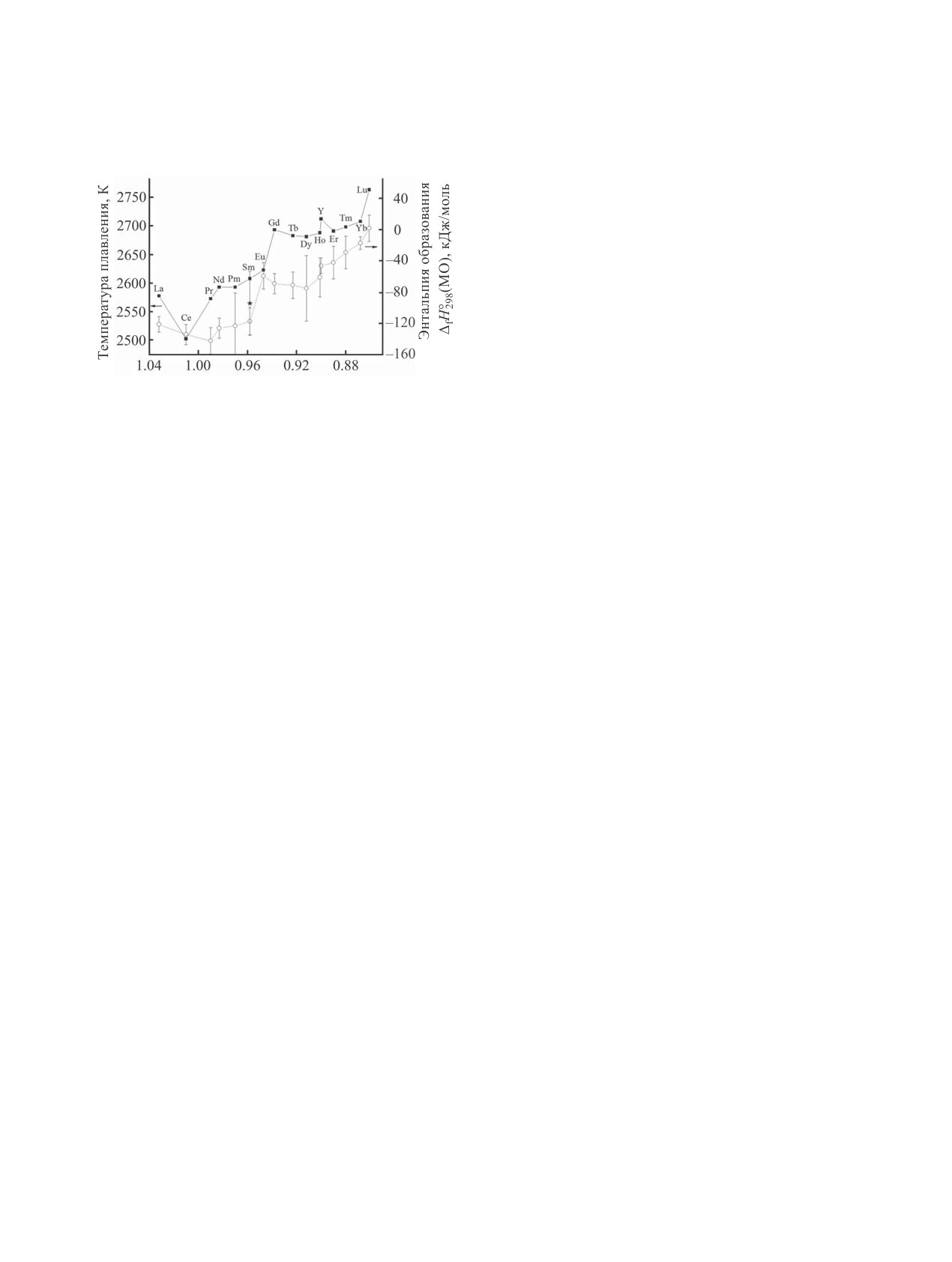
На рисунке сопоставлены температуры плав-
ления оксидов редкоземельных элементов [14] и
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
ОКСИД САМАРИЯ ПРИ ВЫСОКИХ ТЕМПЕР
АТУРАХ
789
метре МС-1301 [16]. Образец Sm2O3 испаряли из
вольфрамовой эффузионной камеры Кнудсена,
нагреваемой электронной бомбардировкой. Тем-
пературу измеряли оптическим пирометром ЭОП-
66 с точностью ±10 K в интервале температур
2100-2750 K. Перед экспериментом масс-спек-
трометр калибровали по стандарту давления пара
CaF2 [13].
Авторы благодарят Ф.Н. Карачевцева за про-
веденную идентификацию исследуемого образца
Sm2O3.
ɂɨɧɧɵɣ ɪɚɞɢɭɫ Ⱥ
ФОНДОВАЯ ПОДДЕРЖКА
Зависимости температуры плавления (■) оксидов
Работа выполнена при поддержке Российского
редкоземельных элементов [14] и энтальпии образо-
фонда фундаментальных исследований (проект
вания газообразных оксидов металлов (○) [11] при
№ 19-03-00721).
298 K от ионного радиуса элемента [15]. Звездочкой
отмечена полученная нами стандартная энтальпия
КОНФЛИКТ ИНТЕРЕСОВ
образования SmO (газ), равная -94±41 кДж/моль.
Авторы заявляют об отсутствии конфликта
энтальпии образования газообразных MO [11] при
интересов.
298 K в зависимости от ионного радиуса редкозе-
СПИСОК ЛИТЕРАТУРЫ
мельного элемента [15] и отмечена найденная в
настоящей работе стандартная энтальпия образо-
1. Каблов Е.Н., Толорайя В.Н. // Авиационные материа-
вания SmO (газ) (-94±41 кДж/моль). Эта величина
лы и технологии. 2012. С. 105; Kablov E.N., Toloraiya
V.N. // Aviat. Mater. Technol. 2012. P. 105.
хорошо согласуется с тенденцией изменения тем-
ператур плавления и энтальпии образования LnO
2. Литые лопатки газотурбинных двигателей: сплавы,
(газ), где Ln = La-Lu.
технология, покрытия / Под ред. Е.Н. Каблова. М.:
Наука, 2006. 632 с.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
3. Cao X. // J. Mater. Sci. Technol. 2007. Vol. 23. N 1.
Оксид самария Sm2O3 (СмО-Л, ТУ 48-4-523-89)
P. 15.
приобретен в ИПК «Юмэкс» (Уфа, Россия). Количе-
4. Kuznetsov S.A. // Chem. Papers. 2012. Vol. 66. N 5.
ство примесей в Sm2O3 определяли методом атомно-
P. 511. doi 10.2478/s11696-012-0132-8.
эмиссионной спектроскопии с индуктивно связан-
5. Диаграммы состояния силикатных систем / Под ред.
ной плазмой на спектрометре Agilent 5100 (Agilent
Н.А. Торопова. Л.: Наука, 1969. 372 с.
Technologies, Малгрейв, Австралия). Доля основ-
6. Konings R.J.M., Benes O., Kovacs A., Manara D.,
ного вещества в Sm2O3 ≥ 99.8 мол%, количество
Sedmidubský D., Gorokhov L.N., Iorish V.S., Yungman V.,
примесей Ca, Fe и Y не превышало 0.03, 0.05,
Shenyavskaya E., Osina E. // J. Phys. Chem. Ref. Data.
0.19 мол% соответственно. Методом порошко-
2014. Vol. 43. P. 013101. doi 10.1063/1.4825256
вой рентгеновской дифракции на дифрактометре
7. Ames L.L., Walsh P.N., White D. // J. Phys. Chem. 1967.
EMPYREAN (PANalytical, Алмело, Нидерланды)
Vol. 71. N 8. P. 2707. doi 10.1021/j100867a049
установлено, что исходный образец Sm2O3 пред-
ставлен моноклинной модификацией В. Количе-
8. Dickson C.R., Zare R.N. // Chem. Phys. 1975. Vol. 7.
ство воды в Sm2O3 (11.3%) найдено путем опре-
N 3. P. 361. doi 10.1016/0301-0104(75)87019-4
деления потерь массы Sm2O3 при изотермическом
9. Hildenbrand H.L. // Chem. Phys. Lett. 1977. Vol. 48.
выдерживании в муфельной печи при 873 K. В ра-
N 2. P. 340. doi 10.1016/0009-2614(77)80328-X
боте использовали отожженный при 873 K Sm2O3.
10. Lias S.G., Bartmess J.E., Liebman J.F., Holmes J.L.,
Исследования проведены методом высокотем-
Levin R.D., Mallard W.G. // J. Phys. Chem. Ref. Data.
пературной масс-спектрометрии на масс-спектро-
1988. Vol. 17. Suppl. 1. P. 1.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020
790
СТОЛЯРОВА и др.
11. Pedley J.B., Marshall E.M.J. // Phys. Chem. Ref. Data.
14. Zinkevich M. // Prog. Mater. Sci. 2007. Vol. 52. N 4.
1983. Vol. 12. N 4. P. 967. doi 10.1063/1.555698
P. 597. doi 10.1016/J.PMATSCI.2006.09.002
12. Barin I. Thermochemical Data of Pure Substances.
15. Shannon R.D. // Acta Crystallogr. (A). 1976. Vol. 32.
Weinheim: VCH Verlagsgesellschaft mbH, 1995. 1885 p.
N 5. P. 751. doi 10.1107/S0567739476001551
13. Термодинамические свойства индивидуальных ве-
16. Семенов Г.А., Николаев Е.Н., Францева К.Е. Приме-
ществ. Справочник / Под ред. В.П. Глушко. М.: АН
нение масс-спектрометрии в неорганической химии.
СССР, 1978-1984. Т. 1-4.
Л.: Химия, 1976. 152 с.
Samarium Oxide at High Temperatures: Sublimation
and Thermodynamics
V. L. Stolyarova*, V. A. Vorozhtcov, S. I. Lopatin, and S. M. Shugurov
St. Petersburg State University, St. Petersburg, 190034 Russia
*e-mail: v.stolyarova@spbu.ru
Received December 13, 2019; revised December 13, 2019; accepted December 18, 2019
Vaporization processes and thermodynamic properties of samarium oxide in the temperature range 2265-
2668 K were studied by the high temperature mass spectrometric method. Values of vaporization enthalpy of
Sm2O3 as well as enthalpy of formation of samarium monoxide at the temperature 298 K were determined.
Dependencies of partial pressures of SmO and Sm over Sm2O3 as a function of temperature were obtained in
the range mentioned above.
Keywords: vaporization, thermodynamic properties, samarium oxide, high temperature mass spectrometry
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 5 2020