ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 6, с. 837-842
УДК 547.724;547.732.7
СИНТЕЗ НОВЫХ ЗАМЕЩЕННЫХ
3-(ТИОФЕН-2-ИЛ)ИМИНО-3Н-ФУРАН-2-ОНОВ
© 2020 г. С. А. Шипиловскихa,b,*, А. Е. Рубцовa
a Пермский государственный национальный исследовательский университет,
ул. Букирева 15, Пермь, 614990 Россия
b Уральский федеральный университет имени первого Президента Б. Н. Ельцина, Екатеринбург, 620002 Россия
*e-mail: shipilovskikh@psu.ru
Поступило в Редакцию 12 февраля 2020 г.
После доработки 20 марта 2020 г.
Принято к печати 23 марта 2020 г.
Изучена внутримолекулярная циклизация замещенных 4-(гет)арил-4-оксо-2-тиениламинобут-2-еновых
кислот в присутствии уксусного или пропионового ангидрида, которая протекает с образованием заме-
щенных 3-тиенилимино-3Н-фуран-2-онов.
Ключевые слова: тиофены Гевальда, 2,4-диоксобутановые кислоты, 3-(тиофен-2-ил)имино-3Н-фуран-
2-оны
DOI: 10.31857/S0044460X20060037
Одной из фундаментальных задач органиче-
зо[b]тиофен-2-иламино}бут-2-еновых кислот под
ской химии является синтез новых соединений,
действием уксусного ангидрида [17] на основе
имеющих практическое применение, в том числе в
модельного этилового эфира 2-амино-4,5,6,7-те-
качестве фармацевтических препаратов. Благодаря
трагидробензо[b]тиофен-3-карбоновой кислоты, а
наличию нескольких возможных центров для ну-
также изучен ряд их химических свойств [18-20].
клеофильной атаки в молекулах 3-имино(гидразо-
В предложенной работе нами продолжены ис-
но)-3H-фуран-2-онов, эти соединения позволяют
следования в данной области и изучена возмож-
получать на своей основе различные ациклические
ность модификации структуры как в 5 положении
и гетероциклические структуры [1-7]. Эти реак-
фуранового кольца, так и в тиофеновом замести-
ции часто протекают с сохранением фрагмента
теле. Была исследована возможность введения
2,4-диоксобутановой кислоты, имеющей широкое
гетероциклических заместителей R в фурановом
применение в области медицинской химии [8-12].
кольце на примере тиофен-2-ильного фрагмента.
В то же время фрагмент аминотиофена Гевальда
Для увеличения возможного разнообразия были
обнаружен в многочисленных биологически ак-
получены
3-тиенилимино-3Н-фуран-2-оны, со-
тивных и природных соединениях [13-16], а вве-
держащие несимметричные алифатические и
дение такого фармакофорного фрагмента в струк-
ароматические заместители в положениях R2 и
туру 3-имино-3Н-фуран-2-онов является важным
R3 тиофенового кольца, а также гидрированные
с точки зрения поиска потенциальной биологиче-
циклические пяти-, семи- и восьмичленные коль-
ской активности.
ца (R2+R3).
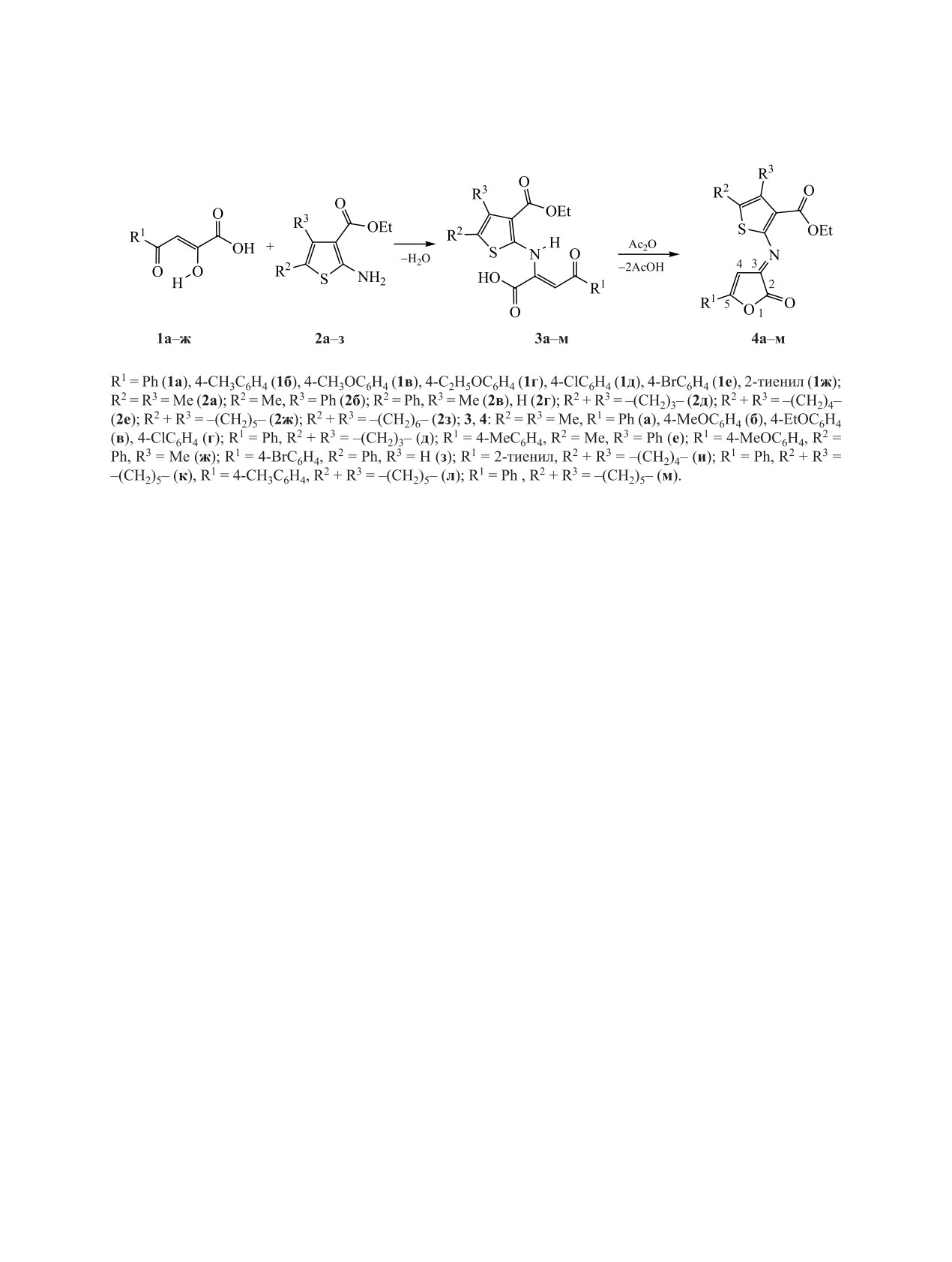
Ранее нами был предложен простой способ
получения ряда этиловых эфиров 2-[5-арил-2-ок-
Внутримолекулярная циклизация замещенных
софуран-3(2H)-илиденамино]-4,5,6,7-тетрагидро-
4-(гет)арил-4-оксо-2-тиениламинобут-2-еновых
бензо[b]тиофен-3-карбоновых кислот внутри-
кислот 3а-м протекает при медленном нагревании
молекулярной циклизацией (Z)-4-арил-4-ок-
до 140°С в уксусном или пропионовом ангидриде
со-2-{3-(этоксикарбонил)-4,5,6,7-тетрагидробен-
при перемешивании в течение 20-60 мин (схема 1).
837
838
ШИПИЛОВСКИХ, РУБЦОВ
Схема 1.
Целевые 3-тиенилимино-3Н-фуран-2-оны получе-
саны на приборе Bruker Avance III (400 и 100 MГц
ны с выходами 67-87%.
соответственно) в CDCl3 или ДМСO-d6. Элемент-
ный анализ выполнен на приборе Leco CHNS-932.
Соединения 4а-м окрашенные кристалличе-
Химическую чистоту соединений и протекание
ские вещества, хорошо растворимые в хлороформе,
реакций контролировали методом ТСХ на пласти-
ДМСО, при нагревании в толуоле, этаноле и нера-
нах Sorbfil в системе Et2O-бензол-ацетон (10:9:1),
створимые в воде и алканах. В ИК спектрах фура-
детектирование проводили в УФ свете и парами
нонов 4a-м присутствует полоса поглощения в об-
иода. Температуры плавления определяли на при-
ласти 1788-1812 см-1, характерная для валентных
боре SMP40.
колебаний лактонной карбонильной группы фура-
нового цикла. Полоса поглощения в области 1705-
Исходные замещенные 4-арил-4-оксо-2-тиени-
1726 см-1 соответствует валентным колебаниям
ламинобут-2-еновые кислоты 3а-м получены по
С=О сложноэфирной группы. В спектрах ЯМР 1Н
методике [21], соединения 3а-е, з, и описаны ра-
соединений 4a-м в растворе ДМСО-d6 или CDCl3
нее.
отсутствуют сигналы протона аминогруппы, ха-
4-(4-Метоксифенил)-4-оксо-2-[(5-фенил-3-
рактерного для соединений 3a-м, синглет виниль-
(этоксикарбонил)тиофен-2-ил)амино]бут-2-
ного протона С4Н гетероцикла наблюдается в об-
еновая кислота (3ж). Выход 3.97 г (88%), красные
ласти слабого поля. Спектры ЯМР 13С фуранонов
кристаллы, т. пл. 186-187°С (этанол). ИК спектр,
4а-г, и-м, записанные в растворе ДМСO-d6 или
ν, см-1: 1674 ш (COOEt), 3384 (NH). Спектр ЯМР
CDCl3, характеризуются наличием сигналов угле-
1Н (ДМСO-d6), δ, м. д.: 0.99 т (3H, CH3CH2O, J =
родов С2 (162.0-164.4 м. д.), С5 (160.6-163.2 м. д.),
7.1 Гц), 3.84 с (3H, ОCH3), 4.11 к (2H, CH3CH2O,
С3 (144.5-146.9 м. д.) и С4 (96.5-98.8 м. д.). Также
J = 7.1 Гц), 6.59 с (1H, С=CH), 7.00 с (1Н, HAr), 7.52
в спектрах отсутствуют сигналы С=O, характер-
м (9Н, HAr), 12.61 с (1Н, NH). Найдено, %: C 63.89;
ные для исходных бутеновых кислот 3.
H 4.65; N 3.13; S 7.06. C24H21NO6S. Вычислено, %:
C 63.85; H 4.69; N 3.10; S 7.10.
Таким образом, показана возможность моди-
фикации структуры 3-тиенилимино-3Н-фуран-2-
4-Оксо-4-фенил-2-({3-(этоксикарбонил)-
онов как по положению 5 фуранового кольца, так и
5,6,7,8-тетрагидро-4Н-циклопента[b]тио-
в тиофеновом заместителе.
фен-2-ил}амино)бут-2-еновая кислота (3к). Вы-
ход 3.72 г (90%), красные кристаллы, т. пл. 144-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
145°С (этанол). ИК спектр, ν, см-1: 1677 ш (COOEt),
ИК спектры записаны на приборе ФСМ-1202 в
3216 (NH). Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.47 т
вазелиновом масле. Спектры ЯМР 1Н и 13С запи-
(3H, CH3CH2O, J = 7.1 Гц), 1.68 м (2H, CH2), 1.76 м
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
СИНТЕЗ НОВЫХ ЗАМЕЩЕННЫХ 3-(ТИОФЕН-2-ИЛ)ИМИНО-3Н-ФУР
АН-2-ОНОВ
839
(2H, CH2), 1.90 м (2H, CH2), 2.88 м (2H, CH2), 3.11
Этиловый эфир (E)-4,5-диметил-2-{[2-ок-
м (2H, CH2), 4.47 к (2H, CH3CH2O, J = 7.1 Гц), 7.18
со-5-фенилфуран-3(2Н)-илиден]амино}тио-
с (1H, С=CH), 7.55 м (2Н, HAr), 7.64 м (1Н, HAr),
фен-3-карбоновой кислоты (4а). Выход 2.91 г
8.05 м (2Н, HAr), 11.83 с (1Н, NH). Спектр ЯМР 13C
(82%), темно-красные кристаллы, т. пл. 169-170°С
(CDCl3), δC, м. д.: 13.6, 26.2, 27.1, 27.6, 28.7, 31.5,
(толуол). ИК спектр, ν, см-1: 1715 (COOEt), 1794
61.1, 95.6, 120.2, 128.1, 128.4, 133.1, 133.3, 137.0,
(COлактон). Спектр ЯМР 1Н (ДМСO-d6), δ, м. д.: 1.31
139.9, 140.4, 146.2, 161.7, 163.4, 188.9. Найдено, %:
т (3H, CH3CH2O, J = 6.6 Гц), 2.13 с (3Н, CH3), 2.44 с
C 63.90; H 5.64; N 3.37; S 7.73. C22H23NO5S. Вы-
(3Н, CH3), 4.31 к (2H, CH3CH2O, J = 6.6 Гц), 7.23 с
числено, %: C 63.91; H 5.61; N 3.39; S 7.75.
(1H, HAr), 7.61 м (3Н, HAr), 8.02 м (2Н, HAr). Спектр
4-(4-Метилфенил)-4-оксо-2-({3-(этоксикар-
ЯМР 13C (ДМСO-d6), δС, м. д.: 12.1, 13.6, 14.1, 60.9,
бонил)-5,6,7,8-тетрагидро-4Н-циклопента[b]-
98.3, 126.6, 126.7, 129.2, 132.5, 132.9, 135.3, 137.4,
тиофен-2-ил}амино)бут-2-еновая кислота (3л).
145.2, 146.1, 162.6, 164.1, 165.6. Найдено, %: C
Выход 3.84 г (92%), красные кристаллы, т. пл.
64.20; H 4.85; N 3.93; S 9.00. C19H17NO4S. Вычис-
166-167°С (этанол). ИК спектр, ν, см-1: 1679 ш
лено, %: 64.21; H 4.82; N 3.94; S 9.02.
(COOEt), 3327 (NH). Спектр ЯМР 1Н (CDCl3), δ,
Этиловый эфир (E)-4,5-диметил-2-{[5-(4-ме-
м. д.: 1.47 т (3H, CH3CH2O, J = 7.1 Гц), 1.69 м (2H,
токсифенил)-2-оксофуран-3(2Н)-илиден]ами-
CH2), 1.74 м (2H, CH2), 1.92 м (2H, CH2), 2.48 с
но}тиофен-3-карбоновой кислоты (4б). Выход
(3H, CH3), 2.88 м (2H, CH2), 3.12 м (2H, CH2), 4.47
3.34 г (87%), темно-красные кристаллы, т. пл. 172-
к (2H, CH3CH2O, J = 7.1 Гц), 7.17 с (1H, С=CH),
173°С (толуол). ИК спектр, ν, см-1: 1713 (COOEt),
7.35 м (2Н, HAr), 7.95 м (2Н, HAr), 11.76 с (1Н, NH).
Спектр ЯМР 13C (CDCl3), δC, м. д.: 13.6, 21.2, 26.2,
1798 (COлактон). Спектр ЯМР 1Н (ДМСO-d6), δ,
27.1, 27.6, 28.7, 31.5, 61.1, 95.7, 120.0, 128.3, 129.2,
м. д.: 1.31 т (3H, CH3CH2O, J = 7.1 Гц), 2.11 с (3Н,
133.0, 134.2, 139.8, 140.6, 144.4, 146.0, 161.8, 163.1,
CH3), 2.42 с (3Н, CH3), 3.87 с (3Н, OCH3), 4.30 к
188.5. Найдено, %: C 64.60; H 5.86; N 3.29; S 7.54.
(2H, CH3CH2O, J = 7.1 Гц), 7.06 с (1H, HAr), 7.12 м
C23H25NO5S. Вычислено, %: C 64.62; H 5.89; N
(2Н, HAr), 7.96 м (2Н, HAr). Спектр ЯМР 13C (ДМ-
3.28; S 7.50.
СO-d6), δC, м. д.: 12.1, 13.5, 14.0, 55.7, 60.8, 96.6,
4-Оксо-4-фенил-2-({3-(этоксикарбо-
114.9, 118.9, 128.9, 132.3, 134.4, 136.2, 145.3, 146.5,
нил)-4,5,6,7,8,9-гексагидроциклоокта[b]тио-
162.8, 163.2, 164.2, 165.8. Найдено, %: 62.30; H
фен-2-ил}амино)бут-2-еновая кислота
(3м).
5.00; N 3.66; S 8.32. C20H19NO5S. Вычислено, %: C
Выход 3.50 г (82%), красные кристаллы, т. пл.
62.32; H 4.97; N 3.63; S 8.32.
170-171°С (этанол). ИК спектр, ν, см-1: 1688 ш
Этиловый эфир (E)-4,5-диметил-2-{[5-(4-
(COOEt), 3203 (NH). Спектр ЯМР 1Н (CDCl3), δ,
этоксифенил)-2-оксофуран-3(2Н)-илиден]ами-
м. д.: 1.36 м (2H, CH2), 1.46 т (3H, CH3CH2O, J =
но}тиофен-3-карбоновой кислоты (4в). Выход
7.2 Гц), 1.57 м (2H, CH2), 1.73 м (4H, CH2), 2.91 м
3.31 г (83%), темно-красные кристаллы, т. пл. 168-
(2H, CH2), 3.00 м (2H, CH2), 4.48 к (2H, CH3CH2O,
169°С (толуол). ИК спектр, ν, см-1: 1710 (COOEt),
J = 7.2 Гц), 7.19 с (1H, С=CH), 7.55 м (2Н, HAr),
1796 (COлактон). Спектр ЯМР 1Н (ДМСO-d6), δ,
7.65 м (1Н, HAr), 8.07 м (2Н, HAr), 12.19 с (1Н, NH).
м. д.: 1.32 т (3H, CH3CH2O, J = 7.1 Гц), 1.38 т (3H,
Спектр ЯМР 13C (CDCl3), δC, м. д.: 13.6, 25.0, 25.1,
CH3CH2O, J = 6.9 Гц), 2.15 с (3Н, CH3), 2.44 с (3Н,
25.8, 26.6, 29.2, 31.8, 60.9, 96.1, 118.4, 127.3, 128.1,
CH3), 4.19 к (2H, CH3CH2O, J = 6.9 Гц), 4.31 к (2H,
128.4, 132.0, 133.0, 137.0, 137.1, 142.9, 145.9, 161.7,
CH3CH2O, J = 7.1 Гц), 7.04 с (1H, HAr), 7.12 м (2Н,
163.5, 189.0. Найдено, %: C 64.66; H 5.87; N 3.25; S
HAr), 7.95 м (2Н, HAr). Спектр ЯМР 13C (ДМСO-d6),
7.57. C23H25NO5S. Вычислено, %: C 64.62; H 5.89;
δ, м. д.: 12.0, 13.4, 13.9, 14.3, 60.6, 63.8, 96.5, 115.5,
N 3.28; S 7.50.
118.8, 128.9, 132.4, 133.9, 135.8, 145.7, 146.9, 162.7,
Синтез
3-тиенилимино-3Н-фуран-2-онов
164.1, 166.0. . Найдено, %: C 63.10; H 5.33; N 3.52;
4а-м. Раствор 0.01 моль кислот 3a-м в 10 (8) мл
S 8.05. C20H19NO5S. Вычислено, %: C 63.14; H
уксусного (пропионового) ангидрида медленно
5.30; N 3.51; S 8.03.
нагревали до 140°С и перемешивали в течение 20
(60) мин. Полученный раствор охлаждали, осадок
Этиловый эфир (E)-4,5-диметил-2-{[2-оксо-
отфильтровывали и промывали безводным диэти-
5-(4-хлорфенил)фуран-3(2Н)-илиден]амино}ти-
ловым эфиром.
офен-3-карбоновой кислоты (4г). Выход 3.38 г
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
840
ШИПИЛОВСКИХ, РУБЦОВ
(87%), темно-красные кристаллы, т. пл. 159-161°С
Этиловый эфир (E)-2-{[5-(4-бромфенил)-2-
(толуол). ИК спектр, ν, см-1: 1705 (COOEt), 1800
оксофуран-3(2Н)-илиден]амино}-4-фенилтио-
(COлактон). Спектр ЯМР 1Н (ДМСO-d6), δ, м. д.: 1.32
фен-3-карбоновой кислоты (4з). Выход 3.75 г
т (3H, CH3CH2O, J = 7.1 Гц), 2.13 с (3Н, CH3), 2.44 с
(78%), темно-красные кристаллы, т. пл. 184-185°С
(3Н, CH3), 4.32 к (2H, CH3CH2O, J = 7.1 Гц), 7.26 с
(толуол). ИК спектр, ν, см-1: 1721 (COOEt), 1812
(1H, HAr), 7.63 м (2Н, HAr), 8.03 м (2Н, HAr). Спектр
(COлактон). Спектр ЯМР 1Н (ДМСO-d6), δ, м. д.: 1.14
ЯМР 13C (ДМСO-d6), δC, м. д.: 12.0, 13.7, 14.0, 60.9,
т (3H, CH3CH2O, J = 7.1 Гц), к 4.23 (2H, CH3CH2O,
J = 7.1 Гц), 7.23 с (1H, HAr), 7.44 м (4H, HAr), 7.83 м
98.8, 125.6, 128.3, 129.3, 132.6, 135.6, 137.5, 137.8,
(2Н, HAr), 8.04 м (3Н, HAr). Найдено, %: C 57.25; H
144.9, 146.0, 162.4, 164.1, 164.4. Найдено, %: 58.50;
H 4.12; N 3.58; S 8.25. C19H16ClNO4S. Вычислено,
3.38; N 2.92; S 6.65. C23H16BrNO4S. Вычислено, %:
C 57.27; H 3.34; N 2.90; S 6.65.
%: C 58.54; H 4.14; N 3.59; S 8.22.
Этиловый эфир (E)-2-{[2-оксо-5-(тиофен-2-
Этиловый эфир (E)-2-{[2-оксо-5-фенилфу-
ил)фуран-3(2Н)-илиден]амино}-4,5,6,7-тетраги-
ран-3(2Н)-илиден]амино}-5,6-дигидро-4Н-ци-
дробензо[b]тиофен-3-карбоновой кислоты (4и).
клопента[b]тиофен-3-карбоновой кислоты (4д).
Выход 3.17 г (82%), темно-красные кристаллы,
Выход 2.72 г (74%), темно-красные кристаллы,
т. пл. 173-174°С (толуол). ИК спектр, ν, см-1: 1714
т. пл. 187-188°С (толуол). ИК спектр, ν, см-1: 1719
(COOEt), 1794 (COлактон). Спектр ЯМР 1Н (ДМ-
(COOEt), 1797 (COлактон). Спектр ЯМР 1Н (ДМ-
СO-d6), δ, м. д.: 1.42 т (3H, CH3CH2O, J = 7.1 Гц),
СO-d6), δ, м. д.: 1.32 т (3H, CH3CH2O, J = 6.9 Гц),
1.87 м (4H, СН2), 2.76 м (2H, СН2), 2.81 м (2H,
2.41 м (2Н, СН2), 2.93 м (2Н, СН2), 3.04 м (2Н,
СН2), 4.40 к (2H, CH3CH2O, J = 7.1 Гц), 6.71 с (1Н,
СН2), 4.28 к (2H, CH3CH2O, J = 6.9 Гц), 7.37 с (1H,
HAr), 7.23 м (1Н, HAr), 7.68 м (1Н, HAr), 7.74 м (1Н,
HAr), 7.66 м (3Н, HAr), 8.08 м (2Н, HAr). Найдено,
HAr). Спектр ЯМР 13C (ДМСO-d6), δC, м. д.: 13.7,
%: C 65.36; H 4.68; N 3.80; S 8.72. C20H17NO4S. Вы-
21.8, 22.3, 24.6, 25.2, 60.6, 96.6, 128.5, 130.0, 130.2,
числено, %: C 65.38; H 4.66; N 3.81; S 8.73.
131.8, 131.8, 135.6, 138.3, 144.5, 148.7, 160.6, 162.0,
Этиловый эфир (E)-5-метил-2-{[5-(4-метил-
163.4. Найдено, %: C 58.92; H 4.43; N 3.60; S 16.59.
фенил)-2-оксофуран-3(2Н)-илиден]амино}-
C19H17NO4S2. Вычислено, %: C 58.90; H 4.42; N
4-фенилтиофен-3-карбоновой кислоты
(4е).
3.61; S 16.55.
Выход 3.31 г (77%), темно-красные кристаллы,
Этиловый эфир (E)-2-{[2-оксо-5-фенил-
т. пл. 142-143°С (толуол). ИК спектр, ν, см-1:
фуран-3(2Н)-илиден]амино}-5,6,7,8-тетраги-
1721 (COOEt), 1801 (COлактон). Спектр ЯМР 1Н
дро-4Н-циклопента[b]тиофен-3-карбоновой
(ДМСO-d6), δ, м. д.: 0.97 т (3H, CH3CH2O, J =
кислоты (4к). Выход 3.16 г (80%), темно-красные
6.9 Гц), 2.42 с (3Н, СН3), 2.43 с (3Н, СН3), 4.07 к
кристаллы, т. пл. 142-144°С (толуол). ИК спектр,
(2H, CH3CH2O, J = 6.9 Гц), 7.35 м (8H, HAr), 8.05
ν, см-1: 1722 (COOEt), 1788 (COлактон). Спектр
м (2Н, HAr). Найдено, %: C 69.58; H 4.94; N 3.24; S
ЯМР 1Н (CDCl3), δ, м. д.: 1.32 т (3H, CH3CH2O,
7.40. C25H21NO4S. Вычислено, %: C 69.59; H 4.91;
J = 7.1 Гц), 1.59 м (2H, СН2), 1.70 м (2H, СН2), 1.84
N 3.25; S 7.43.
м (2H, СН2), 2.70 м (2H, СН2), 2.91 м (2H, СН2),
Этиловый эфир (E)-4-метил-2-{[5-(4-метокси-
4.32 к (2H, CH3CH2O, J = 7.1 Гц), 7.24 с (1Н, HAr),
фенил)-2-оксофуран-3(2Н)-илиден]амино}-5-
7.61 м (3Н, HAr), 8.01 м (2Н, HAr). Спектр ЯМР 13C
фенилтиофен-3-карбоновой кислоты
(4ж).
(CDCl3), δC, м. д.: 14.0, 26.7, 27.3, 27.7, 29.8, 31.3,
Выход 3.20 г (67%), темно-красные кристаллы,
61.0, 98.4, 126.6, 126.7, 129.2, 132.8, 136.6, 139.4,
т. пл. 157-160°С (толуол). ИК спектр, ν, см-1:
144.4, 144.5, 144.7, 162.6, 164.4, 165.2. Найдено, %:
1717 (COOEt), 1803 (COлактон). Спектр ЯМР 1Н
C 66.84; H 5.34; N 3.57; S 8.10. C22H21NO4S. Вы-
(ДМСO-d6), δ, м. д.: 1.32 т (3H, CH3CH2O, J =
числено, %: C 66.82; H 5.35; N 3.54; S 8.11.
7.1 Гц), 2.28 с (3Н, СН3), 3.89 с (3Н, OСН3), 4.33 к
Этиловый эфир (E)-2-{[2-оксо-5-(метилфе-
(2H, CH3CH2O, J = 7.1 Гц), 7.15 м (2Н, HAr), 7.27 с
нил)фуран-3(2Н)-илиден]амино}-5,6,7,8-тетра-
(1H, HAr), 7.54 м (5H, HAr), 8.06 м (2Н, HAr). Найде-
гидро-4Н-циклопента[b]тиофен-3-карбоновой
но, %: C 67.11; H 4.77; N 3.13; S 7.15. C25H21NO5S.
кислоты (4л). Выход 3.52 г (86%), темно-красные
Вычислено, %: C 67.10; H 4.73; N 3.13; S 7.17.
кристаллы, т. пл. 156-157°С (толуол). ИК спектр,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
СИНТЕЗ НОВЫХ ЗАМЕЩЕННЫХ 3-(ТИОФЕН-2-ИЛ)ИМИНО-3Н-ФУР
АН-2-ОНОВ
841
ν, см-1: 1718 (COOEt), 1798 (COлактон). Спектр
J. Organ. Chem. 2015. Vol. 50. P. 1853. doi 10.1134/
ЯМР 1Н (CDCl3), δ, м. д.: 1.44 т (3H, CH3CH2O, J =
s1070428014120288
7.1 Гц), 1.59 м (2H, СН2), 1.70 м (2H, СН2), 1.84
4. Гавкус Д.Н., Майорова О.A., Борисов М.Ю. Егоро-
м (2H, СН2), 2.70 м (2H, СН2), 2.91 м (2H, СН2),
ва A.Ю. // ЖОрХ. 2012. Т. 48. С. 1230; Gavkus D.N.,
4.32 к (2H, CH3CH2O, J = 7.1 Гц), 7.24 с (1Н, HAr),
Maiorova O.A., Borisov M.Y., Egorova A.Y. // Russ.
7.61 м (3Н, HAr), 8.01 м (2Н, HAr). Спектр ЯМР
J. Organ. Chem. 2012. Vol. 48. P. 1229. doi 10.1134/
13C (CDCl3), δC, м. д.: 13.8, 21.2, 26.5, 27.2, 27.8,
s107042801209014x
30.1, 31.6, 61.0, 96.5, 124.1, 125.9, 129.3, 132.9,
5. Шипиловских С.А., Рубцов А.Е. // ЖОрХ. 2014.
134.3, 140.0, 143.2, 144.3, 145.5, 161.8, 162.6, 163.3,
Т. 50. № 2. С. 305; Shipilovskikh S.A., Rubtsov A.E. //
164.4. Найдено, %: C 67.43; H 5.65; N 3.40; S 7.86.
Russ. J. Org. Chem. 2014. Vol. 50. P. 298. doi 10.1134/
C23H23NO4S. Вычислено, %: C 67.46; H 5.66; N
s1070428014020286
3.42; S 7.83.
6. Sayed H.H., Hashem A.I., Yousif N.M., El-Sayed W.A.
Этиловый эфир (E)-2-{[2-оксо-5-фенилфу-
// Arch. Pharm. 2007. Vol. 6. P. 315. doi 10.1002/
ран-3(2Н)-илиден]амино}-4,5,6,7,8,9-гексаги-
ardp.200700043
дроциклоокта[b]тиофен-3-карбоновой кислоты
(4м). Выход 3.44 г (84%), темно-красные кри-
7. Шипиловских С.А., Рубцов А.Е. // Изв. АН. Сер. хим.
сталлы, т. пл. 148-149°С (толуол). ИК спектр, ν,
2014. № 9. С. 2205; Shipilovskikh S.A., Rubtsov A.E. //
см-1: 1726 (COOEt), 1793 (COлактон). Спектр ЯМР
Russ. Chem. Bull. 2015. Vol. 63. P. 2205. doi 10.1007/
1Н (CDCl3), δ, м. д.: 1.36 м (2H, СН2), 1.45 т (3H,
s11172-014-0722-4
CH3CH2O, J = 7.1 Гц), 1.54 м (2H, СН2), 1.75 м (4H,
8. Dias A., Bouvier D., Crepin T., McCarthy A.A.,
СН2), 2.82 м (2H, СН2), 2.91 м (2H, СН2), 4.45 к
Hart D.J., Baudin F., Cusack S., Ruigrok R. W. // Nature.
(2H, CH3CH2O, J = 7.1 Гц), 7.54 с (3Н, HAr), 7.87 м
2009. Vol. 458. P. 914. doi 10.1038/nature07745
(3Н, HAr). Спектр ЯМР 13C (CDCl3), δC, м. д.: 13.7,
9. Baughman B.M., Jake Slavish P., DuBois R.M.,
24.8, 25.2, 25.3, 27.2, 29.7, 31.6, 60.8, 125.9, 128.1,
Boyd V.A., White S.W., T.R. Webb // ACS Chem. Biol.
128.4, 128.6, 131.9, 132.0, 133.0, 137.0, 137.2, 145.8,
2012. Vol. 7. P. 526. doi 10.1021/cb200439z
161.6, 163.5, 164.0. Найдено, %: C 67.49; H 5.65; N
10. Deore R.R., Chen G.S., Chen C.S., Chang P.T.,
3.40; S 7.84. C23H23NO4S. Вычислено, %: C 67.46;
Chuang M.H., Chern T.R., Wang H.C., Chern J.W. //
H 5.66; N 3.42; S 7.83.
Curr. Med. Chem. 2012. Vol. 19. P. 613. doi
ФОНДОВАЯ ПОДДЕРЖКА
10.2174/092986712798918833
Работа выполнена при финансовой поддержке
11. Hu L., Zhang S., He X., Luo Z., Wang X., Liu W.,
Российского научного фонда (проект № 18-73-
Qin X. // Bioorg. Med. Chem. 2012. Vol. 20. P. 177. doi
00091).
10.1016/j.bmc.2011.11.014
КОНФЛИКТ ИНТЕРЕСОВ
12. Sharma H., Sanchez T.W., Neamati N., Detorio M.,
Schinazi R.F., Cheng X., Buolamwini J.K. // Bioorg.
Авторы заявляют об отсутствии конфликта
Med. Chem. Lett. 2013. Vol. 23. P. 6146. doi 10.1016/j.
интересов.
bmcl.2013.09.009
СПИСОК ЛИТЕРАТУРЫ
13. Mohamed M.F.A., Youssif B.G.M., Shaykoon M.S.A.,
1. Сюткина А.И., Игидов Н.М., Дмитриев М.В.,
Abdelrahman M.H., Elsadek B.E.M., Aboraia A.S.,
Махмудов Р.Р., Новикова В.В. // ЖОХ. 2019. Т. 89.
Abuo-Rahma G.E.A. // Bioorg. Chem. 2019. Vol. 91.
№ 7. С. 1026; Siutkina A.I., Igidov N.M., Dmitriev M.V.,
P. 103127. doi 10.1016/j.bioorg.2019.103127
Makhmudov R.R., Novikova V.V. // Russ. J. Gen. Chem.
14. Fyfe T.J., Zarzycka B., Lim H.D., Kellam B., Mistry S.N.,
2019. Vol. 89. P. 1388. doi 10.1134/s1070363219070065
Katrich V., Scammells P.J., Lane J.R., Capuano B. //
2. Mayorova O.A., Yegorova A.Y. // Magn. Reson. Chem.
J. Med. Chem. 2019. Vol. 62. P. 174. doi 10.1021/acs.
2015. Vol. 10 P. 853-856. doi 10.1002/mrc.4270
jmedchem.7b01565
3. Шипиловских С.А., Рубцов А.Е. // ЖОрХ. 2014. Т 50.
15. Fayed A.A., Alahmadi Y.M., Yousif M.N.M., Yousif N.M.,
№ 12. С. 1869; Shipilovskikh S.A., Rubtsov A.E. // Russ.
Amer A.A., El-Farargy A.F., Ouf N.H., Gad F.A. // Russ.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
842
ШИПИЛОВСКИХ, РУБЦОВ
J. Gen. Chem. 2019. Vol. 89. P. 1887. doi 10.1134/
Shipilovskikh D.A., Rubtsov A.E. // Russ. J. Org. Chem.
s1070363219090251
2017. Vol. 53. P. 137. doi 10.1134/s1070428017010274
16. Bozorov K., Nie L.F., Zhao J., Aisa H.A. // Eur. J.
20. Васильева А.Ю., Ваганов В.Ю., Шипиловских С.А.,
Med. Chem. 2017 Vol. 140. P. 465. doi 10.1016/j.
Рубцов А.Е. // ЖОрХ. 2018. Т. 54. № 8. С. 581;
ejmech.2017.09.039
Vasileva A.Y., Vaganov V.Y., Shipilovskikh S.A., Rub-
17. Шипиловских С.А., Рубцов А.Е., Залесов В.В. // ХГС.
tsov A.E. // Russ. J. Org. Chem. 2018. Vol. 54. P. 582.
2009. № 6. С. 832; Shipilovskikh S.A., Rubtsov A.E.,
doi 10.1134/s1070428018040115
Zalesov V.V. // Chem. Heterocycl. Compd. 2009. Vol. 45.
21. Шипиловских С.А., Махмудов Р.Р., Лупач Д.Ю.,
P. 658. doi 10.1007/s10593-009-0334-3
Павлов П.Т., Бабушкина Е.В., Рубцов А.Е. // Хим.-
18. Shipilovskikh S.A., Rubtsov A.E. // J. Org. Chem. 2019.
фарм. ж. 2013. Т. 47. № 7. С. 26; Shipilovskikh S.A.,
Vol. 84. P. 15788. doi 10.1021/acs.joc.9b00711
Makhmudov R.R., Lupach D.Y., Pavlov P.T., Babushki-
19. Шипиловских С.А., Шипиловских Д.А., Рубцов А.Е. //
na E.V., Rubtsov A.E. // Pharm. Chem. J. 2013. Vol. 47.
ЖОрХ. 2017. Т. 53. № 1. С. 138; Shipilovskikh S.A.,
P. 366. doi 10.1007/s11094-013-0960-z
Synthesis of New Substituted
3-(Thiophen-2-yl)imino-3H-furan-2-ones
S. A. Shipilovskikha,b,* and A. E. Rubtsova
a Perm State University, Perm, 614990, Russia
b Ural Federal University, Yekaterinburg, 620002 Russia
*e-mail: shipilovskikh@psu.ru
Received February 12, 2020; revised March 20, 2020; accepted March 23, 2020
The intramolecular cyclization of substituted 4-oxo-4-(het)aryl-2-(thiophen-2-ylamino)but-2-enoic acids in
the presence of acetic or propionic anhydride afforded a series novel substituted 3-(thiophen-2-yl)iminofuran-
2(3H)-ones.
Keywords: Gewald thiophene, 2,4-dioxobutanoic acids, 3-(thiophen-2-yl)iminofuran-2(3H)-one
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020