ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 6, с. 877-887
УДК 544.164:547.7:544.18:544.362
СПЕКТРАЛЬНОЕ И КВАНТОВО-ХИМИЧЕСКОЕ
ИССЛЕДОВАНИЕ ОСНОВНОСТИ
ФЕНИЛЗАМЕЩЕННЫХ ПОРФИРИНОИДОВ
© 2020 г. Д. Б. Березинa,*, А. Е. Лихонинаa, О. В. Шухтоa, Д. Р. Каримовa,
И. Н. Серовa, М. А. Крестьяниновb
a Ивановский государственный химико-технологический университет, Научно-исследовательский институт
макрогетероциклических соединений, пр. Шереметевский 7, Иваново, 153000 Россия
b Институт химии растворов имени Г. А. Крестова Российской академии наук, Иваново, 153045 Россия
*е-mail: berezin@isuct.ru
Поступило в Редакцию 25 декабря 2019 г.
После доработки 25 декабря 2019 г.
Принято к печати 31 декабря 2019 г.
Изучены электронные спектры поглощения катионных форм порфириноидов в ацетонитриле и в бензоле
с добавлением уксусной или трифторуксусной кислот, рассчитаны величины констант кислотно-основ-
ного взаимодействия. Ряды изменения основности исследованных соединений, полученные из спек-
трофотометрических, квантово-химических (DFT, B3LYP, CC-pVDZ с привлечением NBO-анализа) и
термодинамических данных, согласуются между собой.
Ключевые слова: порфириноиды, кислотно-основное взаимодействие, основные центры, NBO-анализ
DOI: 10.31857/S0044460X20060078
Изучение кислотно-основных форм аромати-
тионных форм корролов, изомерных и N-замещен-
ческих макрогетероциклов - порфиринов (Н2Р) и
ных порфириноидов, а также изучению их свойств
их аналогов, порфириноидов (НnPn), - позволяет
методами электронной спектроскопии поглощения
не только решить ряд фундаментальных задач, на-
и испускания, спектроскопии ЯМР 1Н, спектроэлек-
пример установить взаимосвязь между строением
трохимии, рентгеноструктурного, квантово-химиче-
макроцикла и его базовыми физико-химическими
ского и термического анализа [1-9, 12-15, 22-28].
характеристиками или продвинуться в понимании
Анализ данных проводился с учетом специфиче-
механизма реакции металлокомплексообразования
ских таутомерных процессов в молекулах порфири-
Н2Р [1-11], но и реализовать ряд возможностей
ноидов [2, 4-7, 9, 14, 23, 24]. При этом кислотно-ос-
практического применения этих соединений. Дву-
новные взаимодействия обычно обсуждаются в
кратно протонированные формы порфиринов и их
рамках отдельного класса НnPn или же в сравнении
аналогов - хорошие модели для изучения свойств
с порфиринами.
неплоских ароматических макрогетероциклов [1,
Нами изучено влияние структуры макроцикли-
2, 11-15], а также перспективны в качестве высо-
ческого контура молекул различных классов, по-
кочувствительных молекулярных сенсоров на ани-
лярности и основности растворителя, а также
оны [2, 16, 17]. Они участвуют в целом ряде рН-за-
силы кислоты на основность ряда порфириноидов:
висимых процессов, включая протекающие in vivo
мезо-тетрафенилпорфирина
1 (H2{ms-Ph}4P) как
при фотодинамической инактивации опухолей и
реперного соединения, его N-замещенного анало-
патогенных микроорганизмов [18-21].
га 2 (H[N-Me]{ms-Ph}4P), а также инвертирован-
При исследовании основности аналогов порфи-
ного (H2[2-N,21-CH]{ms-Ph}4P, 5а) и H[2-NH,21-
ринов уделяется внимание вопросам химической
CH]·{ms-Ph}4P, 5б) аналогов, β-фенилзамещенного
[1-4, 6-9] или электрохимической [5] генерации ка-
порфицена 3 (H2{β-Ph}4Por) и мезо-трифенилкор-
877
878
БЕРЕЗИН и др.
Схема 1.
рола 4 (H3{ms-Ph}3Cor) (схема 1). Протонирование
образовываться уже в ледяной уксусной кислоте, а
соединений НnPn изучали в неполярной (бензол) и
полностью титрование заканчивается в присутствии
полярной (ацетонитрил) апротонных средах в при-
следов сильных кислот (табл. 1) [1].
сутствии уксусной и трифторуксусной (TFA) кислот.
(1)
Для подтверждения основности порфириноидов и
(2)
вероятности образования ими конкретных катион-
ных форм были проведены квантово-химические
ЭСП изомера мезо-тетрафенилпорфирина пор-
расчеты ожидаемых структур Н2Р·nHX методом
фицена 3, напротив, в АсOH не изменяется, а спек-
DFT с применением NBO-анализа [23, 24, 29-33].
трально фиксируемый дикатион образуется только
Отличительная особенность большинства пор-
в сильнокислых средах (H2SO4 или TFA) (рис. 1),
фириноидов 2-5 [2-4, 9, 15, 25] - асимметричность
либо в системах CHCl3-TFA или MeСN-TFA с
(поляризованность) их молекул, включая асимме-
высокой концентрацией кислоты (0.1-0.5 и 0.2-
трию расположения центров основности. Соеди-
0.6 моль/л соответственно) (рис. 2). Результаты
нения 1-3 имеют внутри координационной поло-
спектрофотометрического титрования соединения
сти молекулы два оснóвных sp2-атома азота (=N-),
3 показывают, что тангенс угла наклона индикатор-
подвергающихся протонированию с образованием
ной зависимости lgInd = f(сTFA), как и у соедине-
моно- (1) и дикатионов (2) в среде сильных кислот
ния 1, близок к двум, что подтверждает образова-
(рис. 1) [1, 3, 8]. В случае соединения 1 спектрально
ние дикатиона [8]. В случае соединения 2 дикатион
фиксируемый симметричный дикатион с характер-
образуется уже при добавлении в MeCN 0.02 моля
ным электронным спектром поглощения начинает
TFA (табл. 1). Исходя из полученных в ходе спек-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
СПЕКТР
АЛЬНОЕ И КВАНТОВО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ
879
Таблица 1. Параметры кислотно-основного взаимодействия соединений 1-5 в системах органический раствори-
тель-кислота НХ при 298 Kа
Система
Параметр
1
2
3
4
5
MeCN-AcOH
Δб
-
0-0.31
-
0-2.60
0-0.46/0.46-9.00
nНХ
-
2
-
2
3/2
λ
-
530
-
680
800/811
рK3,4 [рK3]/(рK4)
-
(0.85)
-
(0.3)
(0.99)/[-0.51]
MeCN-TFA
Δ
0-18×10-4
0-0.02
0.2-0.6
0-3.36×10-4/4-13.5
0-3.3×10-5/3.3×10-5-
2.1×10-3
nНХ
2
2
2
1/2.8
5.2/1.5
λ
440
675
653
680/607
798/828
рK3,4 [рK3]/(рK4)
1.71
2.25
0.28
(4.80)/[-0.73]
(4.48)/[3.52]
C6H6-AcOH
Δ
-
0-1.25
-
0-17.5
0-4/4-17
nНХ
-
1.6
-
1.6
1.4/3.5
λ
-
572
-
671
790/813
рK3,4 [рK3]/(рK4)
-
0.45
-
(1.02)
(0.01)/[-0.94]
C6H6-TFA
Δ
0-2×10-4
0-0.05
0.1-0.5
0-6.0
0-4.7×10-5/4.7×10-5-
5.12×10-3
CHCl3-TFAв
nНХ
2
1
20
5
1/1
λ
652
675
626
610
790/838
рK3,4 [рK3]/(рK4)
1.98
[3.55]
-
[0.06]
(4.65)/[2.39]
а Погрешность в определении констант составляет не более 10%, λ - аналитическая длина волны, нм; n - число молекул кислоты,
взаимодействующих с макроциклом.
б Δ - интервал концентраций кислоты, моль/л.
в Система использовалась только в случае соединения 3 [8].
трофотометрического титрования данных, можно
(например, соединение 1), макроцикл подверга-
сделать вывод о более высокой основности макро-
ется ступенчатому протонированию. Монокатион
гетероцикла 2 по сравнению с соединениями 1 и
таутомера 5a, который протонируется по перифе-
особенно 3.
рическому N-атому, образуется уже в растворах
Молекула коррола 4 имеет в своем составе толь-
4 М. АсОН в бензоле и 0.46 М. АсОН в ацетони-
ко один sp2-атом азота (=N-) и является однокис-
триле или в присутствии 3.3×10-5-4.7×10-5 М. TFA
лотным N-основанием. Обычно монокатионы кор-
(табл. 1, рис. 2б) в этих же растворителях. Присоеди-
ролов (H4Cor+) образуются в среде кислот средней
нение второго протона к внутрициклическому атому
силы (АсОН) или в разбавленных растворах силь-
азота происходит при более высокой кислотности
ных кислот (ТFA). Вторая ступень протонирования
соединения 4 проходит по атому Смезо в существен-
но более концентрированных растворах сильных
A
кислот и приводит к деароматизации π-системы
макрогетероцикла. Спектрально зафиксировать об-
разование дикатионов Н5Cor2+ можно в 4.0-13.5 М.
растворе TFA (табл. 1) в C6H6 или в MeCN [9].
Инвертированный порфириноид в зависимости
от природы среды может существовать в виде од-
ного из двух таутомеров 5а, 5б или в виде их равно-
весной смеси [24]. В таутомере 5б оба sp2-N-атома
(=N-) расположены в координационной полости
Ȝ ɧɦ
макроцикла, тогда как в таутомере 5а один из них
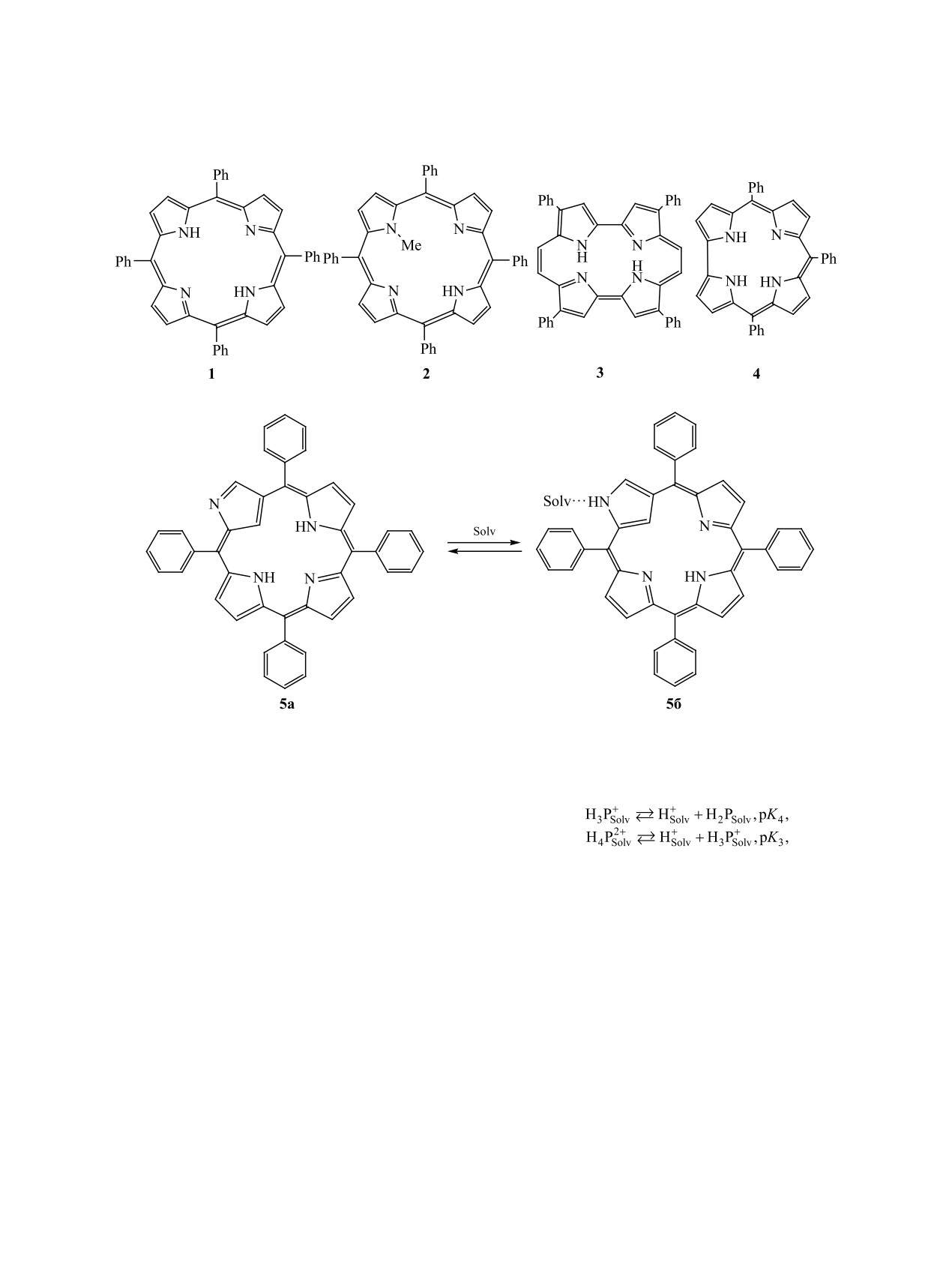
Рис. 1. ЭСП порфицена 3 и его дикатионных форм
мигрирует на периферию молекулы. По сравне-
в различных растворителях при 298 K. 1 - TFA, 2 -
нию с симметрично замещенными порфиринами
H2SO4, 3 - C6H6, 4 - AcOH.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
880
БЕРЕЗИН и др.
ɚ
ɛ
A
A
[5]2+
5
[5]+
Ȝ ɧɦ
Ȝ ɧɦ
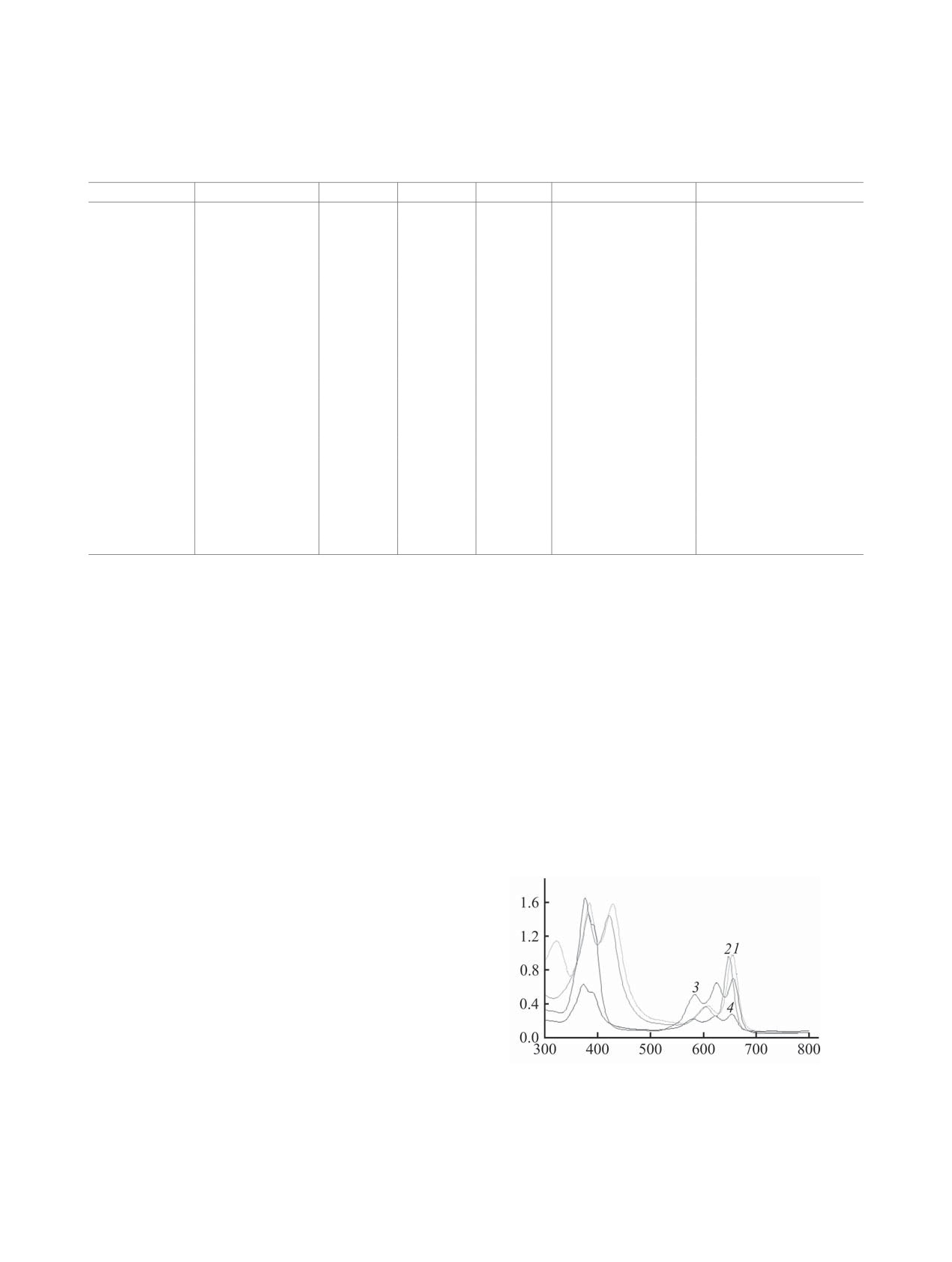
Рис. 2. Изменение ЭСП соединений 3 (a) и 5 (б) в ходе титрования в системе MeCN-TFA (сTFA = 0.2-0.6 и 0-2.1×10-3 моль/л
соответственно) при 298 K.
среды и завершается лишь в 17 и 9 М. АсОН или в 5.1×
и при протонировании порфицена 3, что также при-
10-3 и 2.1×10-3 М. TFA в С6Н6 и в MeCN соответ-
водит к слабому (до 10 нм) гипсохромному сдвигу
ственно (табл. 1).
полос в сильно кислых средах [8, 28]. Выраженное
батохромное смещение полос Qx в молекулах коррола
Из данных табл. 2 следует, что влияние природы
растворителя (сольватохромный эффект) на изме-
4 и инвертированного аналога мезо-тетрафенилпор-
нение электронных спектров поглощения порфи-
фина 5а в ходе монопротонирования макроцикла (от
риноидов 1-5 минимально, если НnPn не являются
20 до 35 и от 55 до 75 нм соответственно) вызвано
NH-активными [1, 26, 34] и не подвергаются прото-
существенной поляризацией низкосимметричных
нированию-депротонированию. Характер изменения
соединений протоном, причем вследствие перифе-
ЭСП при протонировании макроциклов 1-5 опре-
рического расположения и доступности оснóвного
деляется строением молекул и взаимным располо-
центра этот сдвиг максимален у соединения 5а, а при
жением центров основности в них. Длинноволновая
образовании дикатиона достигает 100 нм (табл. 2).
полоса Qx в ЭСП рассматриваемых порфириноидов
Присоединение второго протона к мезо-углеродно-
в ряде случаев претерпевает при N-протонировании
му атому молекулы коррола 4 приводит к раскрытию
батохромное смещение (табл. 2), однако причины
π-системы ароматического макроцикла с гипсохром-
этого различны для соединений разных классов. У
ным сдвигом полосы Qx (Δλ = 45 нм).
мезо-фенилзамещенного порфирина 1 оно вызвано
Квантово-химическая оптимизация геометрии и
возрастанием участия фенильных групп в π-сопряже-
NBO-анализ [23, 29-33] продуктов взаимодействия
нии с основным хромофором при образовании седло-
макроциклов 1-5 с молекулами АсОН и TFA позво-
образно неплоского дикатиона (Δλ = 7-12 нм) [1, 11,
лили определить основные геометрические характе-
12]; при этом монокатион соединения 1 практически
ристики и энергетические параметры кислотно-ос-
не образуется (спектрально не фиксируется) [2, 14].
новного взаимодействия НnPn и НХ (табл. 3) [23]1.
Молекула N-замещенного аналога мезо-тетрафенил-
За исключением порфицена 3, все исследованные
порфина 2 сильно искажена в результате внутрици-
нами порфириноиды взаимодействуют с одной или
клического замещения [3, 13, 15, 25, 27] и практически
двумя молекулами кислот AcОН и TFA (рис. 3). Со-
не испытывает дальнейших структурных изменений
гласно проведенному NBO-анализу, взаимодействие
в ходе протонирования, поэтому батохромный сдвиг
макроцикла 3 с AcОН отсутствует (перенос заря-
при ее протонировании отсутствует (табл. 2). Отсут-
ствуют возможности для поляризации макроцикла
1 За исключением соединения 3, расчеты выполнены ранее в
или возникновения дополнительного π-сопряжения
работе [23].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
СПЕКТР
АЛЬНОЕ И КВАНТОВО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ
881
Таблица 2. Параметры электронных спектров поглощения соединений 1-5 в органических растворителяха, б
λ4, нм
λ3, нм
λ2, нм
λ1, нм
Растворитель
λСоре, нм
Δв
(lgε)
(lgε)
(lgε)
(lgε)
1
C6H6
418 (5.58)
514 (4.33)
548 (3.96)
591 (3.81)
647 (3.68)
-
CHCl3
418 (5.67)
514 (4.29)
549 (3.87)
590 (3.71)
646 (3.55)
-1
ДМФА
416 (5.62)
513 (4.28)
548 (3.91)
590 (3.73)
646 (3.68)
-1
MeCN
-
512
546
583
642
-5
ТFA
-
-
582
659
12
MeCN-(18×10-4 М.) ТFAб
-
-
591
649
7г
C6H6-(2×10-4 М.) TFAб
-
-
603 (4.03)
654 (4.72)
7г
2
499 (3.84) 521
C6H6
426 (5.30)
572 (4.26)
614 (3.78)
677 (3.77)
-
(4.13)
501 (3.88) пл, 533
CHCl3
425(5.30)
574 (4.30)
615 (3.86)
676 (3.84)
-1
(4.17)
498 (3.95) пл, 532
ДМФА
425(5.24)
564 (4.32)
614 (3.90)
676 (3.87)
-1
(4.18)
MeCN
427
527
567
606
671
-6
HOAcб
428 (5.33)
-
559 (3.95)
600 (4.19)
668 (4.36)
-9
-
MeCN-(5×10-4 М.) ТFAа
428
560
603
663
-8г
MeCN-(0.02 М.) ТFAб
444
-
603
666
-5г
MeCN-(0.30 М.) AcОНб
-
565
612
670
-1г
-
C6H6-(6.25×10-5 М.) ТFAа
440
582
624
677
0г
C6H6-(0.05 М.) ТFAб
445
-
612
675
-2г
C6H6-(1.20 М.) AcОНа
538
580
624
667
-10г
C6H6-(12.2 М.) AcОНб
-
-
620
674
-3г
3
C6H6
377 (4.95)
-
586 (4.44)
627 (4.54)
658 (4.59)
-
CHCl3
376 (4.94)
-
584 (4.44)
626 (4.54)
657 (4.57)
-1
MeCN
379
-
581
623
654
-4
385 (4.93),
-
ДМФА
583 (4.43)
626 (4.55)
655 (4.58)
-3
427 (493)
AcОН
374
-
582
622
654
-4
383 (4.89),
-
-
TFAб
604 (4.29)
648 (4.7)
-10
422 (4.89)
MeCN-(0.6 М.) ТFAб
383, 404
-
-
568 пл
655
-3г
CHCl3-(0.5 М.) TFAб
390, 423
-
-
604
650
-7г
4
C6H6
420 (4.97)
565 (4.10)
580 (4.09) пл
617 (3.99)
650 (4.01)
-
CHCl3
415 (4.79)
575 (4.10)
-
613 (4.03)
645 (3.95)
-5
MeCN
413 (4.93)
575 (4.13)
-
617 (4.05)
651 (3.96) пл
1
426 (5.02),
-
ДМФА
536 (3.94)
593 (4.07)
641 (4.53)
-9
447 (4.86)
422 (4.93),
-
AcОН
545 (3.83)
-
681 (4.46)
31
452 (4.74)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
882
БЕРЕЗИН и др.
Таблица 2. (продолжение)
λ4, нм
λ3, нм
λ2, нм
λ1, нм
Растворитель
λСоре, нм
Δв
(lgε)
(lgε)
(lgε)
(lgε)
4
387 (4.65),
-
-
-
425 (4.74),
ТFA
604 (4.40)
-46
440 (4.80),
468 (4.63) пл
-
-
-
MeCN-(3.4×10-4 М.) ТFAа
548
687
36г
-
-
MeCN-(13.5 М.) ТFAб
442
651 пл
606
-45г
MeCN-(2.6 М.) HOAcа
-
-
-
546
683
32г
C6H6-(6 М.) TFAб
-
-
-
-
606
56г
5а и 5бд
C6H6
437 (5.42)
506 (3.89)
542 (4.20)
584 (4.38)
728 (4.28)
-
CHCl3
437 (5.38)
505 (3.95)
541 (4.32)
584 (4.44)
729 (4.41)
1
ДМФАд
442 (5.35)
545 (3.96)
594 (4.08)
644 (4.24)
698 (4.34)
-30
AcОН
459 (5.28)
-
-
663 (4.16)
829 (4.29)
101
705 пл,
MeCN
442 (5.13)
547 (4.00)
588 (4.05)
651 (3.77)
0
728 (3.90)
MeCN-(0.5 M.) AcОНа
-
561
638
800
72г
MeCN-(9.0 M.) AcОНб
544
586
656
811
83г
MeCN-(3.3×10-5 М.) ТFAа
560, 562
611
668
798
70г
MeCN-(2.1×10-3 М.)ТFAб
-
607
669
828
100г
C6H6-(4.0 М.) AcОНа
553
604
662
800
72г
C6H6-(17 М.) AcОНб
544
595
657
813
85г
C6H6-(4.7×10-5 М.) ТFAа
542
593
664
782
54г
C6H6–(5.1×10-3 М.) ТFAб
537
592
662
832
103г
а Длины волн полос поглощения в ЭСП, принадлежащих монокатионной форме порфириноида.
б Длины волн полос поглощения в ЭСП, принадлежащих дикатионной форме порфириноида.
в Δ - интервал концентраций кислоты, моль/л.
г Δλ1 - значения сольватохромных сдвигов длинноволновых полос Qx порфириноидов (относительно бензола, нм) и их смещений
при протонировании.
д Рассчитано относительно соответствующего чистого растворителя (нм). Спектр соответствует таутомерной форме 5б.
да qстаб = 0.006), что согласуется с идентичностью
Квантово-химический анализ геометрии струк-
ЭСП в этой среде спектру свободного основания
туры и энергетики продуктов взаимодействия мо-
(табл. 2, рис. 1). Взаимодействие соединения 3 с
лекул порфириноидов с кислотами подтвердил
более сильным протонодонором TFA протекает по
ожидаемый характер локализации протонов в мо-
двум основным центрам, при этом, исходя из вели-
лекулах НnPn при последовательном образовании
чин двугранных углов, макроцикл в дикатионе оста-
ими моно- и дикатионных форм. Например, как и
ется практически плоским (табл. 3), а характерные
ожидалось, образование монокатиона таутомера 5а
для этого цикла прочные Н-связи сохраняются, и
с участием внешнециклического атома азота энер-
энергия стабилизации (Естаб) соответствующих ор-
гетически более выгодно (Eстаб на 230 кДж/моль
биталей понижается с 205 до ~120 кДж/моль, а ве-
личина Естаб за счет образования дикатиона в TFA
выше по сравнению с протонированием внутрици-
составляет всего 30-40 кДж/моль.
клического атома азота) [23].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
СПЕКТР
АЛЬНОЕ И КВАНТОВО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ
883
ɚ
ɛ
ɜ
ɝ
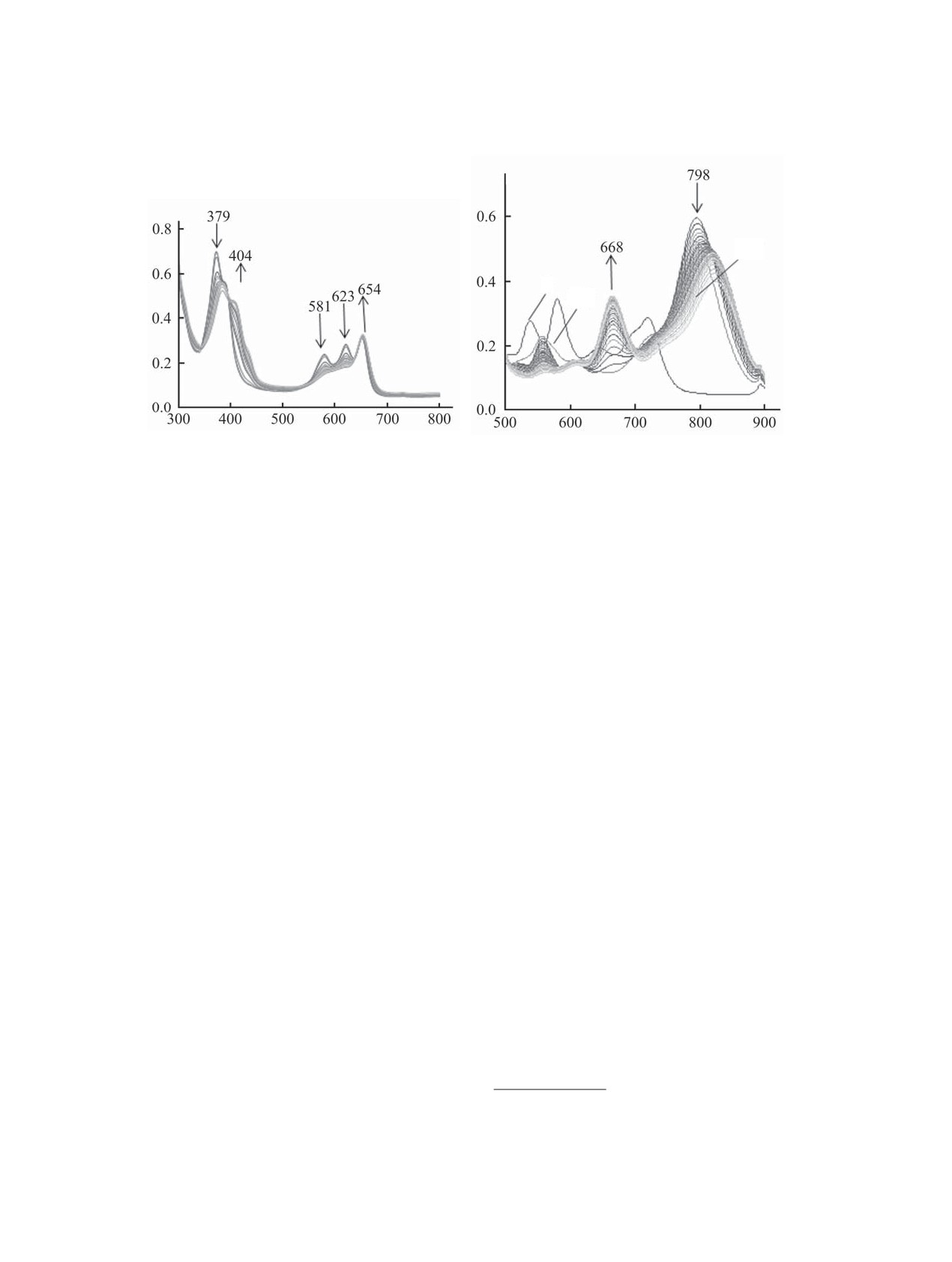
Рис. 3. Оптимизированные структуры катионных солей соединения 3 c двумя молекулами TFA (a), соединения 2 с одной
молекулой АсОН (б) и двумя молекулами TFA (в), а также соединения 4 с молекулой TFA (г).
Полученные нами тангенсы углов наклона (tgα)
по величинам Н0 не позволили ими воспользовать-
индикаторных зависимостей в ходе спектрофо-
ся. В соответствии с вышесказанным, наиболее
тометрического титрования порфириноидов 1-5
оптимальна для сопоставления констант pK4, pK3,4
характеризуют число молекул кислоты nHX, уча-
(табл. 1), рассчитанных из спектрофотометриче-
ствующих в протонировании на рассматриваемой
ских данных система MeCN-TFA, в которой вели-
стадии (табл. 1). Значения tgα сильно зависят от
чины n близки к ожидаемым, а макроциклы 1-5а
природы среды и приближаются к ожидаемым (1
можно расположить в ряд по возрастанию основ-
или 2) по мере возрастания кислотности титранта и
ности (3) (табл. 1). Ряд описывает возрастание
полярности растворителя (например, при переходе
основных свойств как моно-, так и дикатионов
к системе МеCN-TFA). Учет функции кислотности
исследуемых порфириноидов, за исключением
Н0 в системах с менее полярными растворителями
H5Cor2+, вторая ступень протонирования которого
(С6Н6-АсОН, CH2Cl2-TFA) [9, 35] позволяет полу-
идет не по внутрициклическим азотам, а по мезо-
чить тангенсы угла наклона зависимости lg(Ind) =
углеродному атому.
f(lgН0), близкие к действительным [9]. Однако в
MeCN-TFA (pK3,4): 3 (0.28) < 1 (1.71) < 2 (2.25)
изученных нами системах растворителей низкие
концентрации титрантов, либо отсутствие данных
< 4 (4.07) < 5а (8.0).
(3)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
884
БЕРЕЗИН и др.
Таблица 3. Энергетические и структурные параметры трифторацетата порфицена 3
φ, град
r, Å
μ, Д
BSSE
β-β
N-N
Ph
3
1.66-1.67
0.141
44.4-48.2
1913.86
0.011
28.12
-
-
-
-
1.67
-
205.94
0.100
153.7
2.66
-
3·TFA
0.60-3.15
1.441
44.5-52.4
2440.74
3.830
-27.78
16.52
33.05
0.017
176.4
1.72
1.84
127.36
0.047
151.8
1.68
2.84
158.78
0.081
153.8
2.68
2.67
3·2TFA
0.73-3.98
0.373
44.6-52.6
2967.58
0.992
-52.47
30.06
32.34
0.017
175.4
1.73
1.84
39.87
0.021
177.5
1.74
1.82
122.4
0.059
151.7
2.70
2.84
119.0
0.058
151.5
2.70
2.82
Согласно квантово-химическим данным, полу-
внешнециклическому атому азота. Коррол 4 так-
ченным для продуктов взаимодействия макроци-
же может образовать дикатион в кислых средах.
клов с молекулами кислот (Eвз, кДж/моль, табл. 3)
Первая ступень протонирования протекает по
[23], устойчивость моно- и дикатионов соединений
N-основному центру в присутствии небольших
1-5 в TFA возрастает в рядах (4) и (5) соответствен-
добавок кислот, в то время как дикатион образует-
но, что практически полностью согласуется с дан-
ся только в средах с высокой кислотностью (4.0-
ными, полученными в ходе спектрофотометриче-
13.5 М. TFA) с участием одного из Смезо-атомов и
ских измерений.
разрушением ароматической π-системы макроцик-
3 (-27) < 1 (-48) < 2 (-59) < 5б (-62) < 4 (-70)
ла [9].
< 5а (-74),
(4)
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
3 (-52) < 2 (-80) < 1 (-85) < 5б (-106) < 5а (-117). (5)
Объекты исследования 1-5 получены, очищены
Таким образом, наименее основный среди ис-
и спектрально идентифицированы в соответствии
следованных макроциклов порфицен 3 не подвер-
с известными методиками [34, 36-39]. Трифторук-
гается протонированию даже в ледяной уксусной
сусную кислоту марки ХЧ (Acros) перегоняли с ис-
кислоте, а образование его дикатиона наблюдается
пользованием дефлегматора. Уксусную кислоту ХЧ
только в сильно протонодонорных средах (TFA)
(Химреактив) очищали согласно рекомендациям
(табл. 1, рис. 1, 2а, 3a). Отсутствие взаимодей-
[40]. Бензол осушали кипячением над фосфорным
ствия соединения 3 с AcOH подтверждается дан-
ангидридом и перегоняли; MeCN марки «Aldrich»
ными NBO-анализа и обусловлено высокой проч-
хроматографической чистоты и хлороформ CHCl3
ностью внутримолекулярных Н-связей в молекуле
марки ХЧ использовали без дополнительной очист-
порфицена [8] (табл. 3). Внутрициклическое N-за-
ки. ДМФА марки Ч предварительно сушили над
мещение молекулы Н2Р 1 приводит к увеличению
молекулярными ситами и перегоняли в вакууме.
основности неплоского макроцикла 2 и дифферен-
цированию силы этих макроциклов как двукис-
Количество воды в растворителях, оцененное ти-
лотных оснований. Соединение 5a в кислых сре-
трованием по Фишеру, составляло менее 0.1%.
дах подвергается ступенчатому протонированию
Исследование кислотно-основных свойств пор-
(рис. 2б), при этом первая стадия протекает по
фириноидов 1-5 проводили методом спектрофото-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
СПЕКТР
АЛЬНОЕ И КВАНТОВО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ
885
метрического титрования. Электронные спектры
Работа выполнена с привлечением оборудова-
поглощения исследуемых соединений регистри-
ния Центра коллективного пользования Иванов-
ровали в среде различных растворителей с исполь-
ского государственного химико-технологического
зованием спектрофотометров Shimadzu U 2000 и
университета.
Drawell G9 в кварцевой кювете с длиной оптиче-
КОНФЛИКТ ИНТЕРЕСОВ
ского пути 1 см. Результаты, полученные в ходе экс-
перимента, а также расчетные данные представле-
Авторы заявляют об отсутствии конфликта
ны в табл. 1, 2.
интересов.
Молярные коэффициенты погашения (ε) в мак-
СПИСОК ЛИТЕРАТУРЫ
симумах полос ЭСП рассчитывали в соответствии
1. Успехи химии порфиринов / Под ред. О.А. Голубчи-
с законом Ламберта-Бугера-Бера (6).
кова. СПб: СПбГУ, 2001. Т. 3. 360 c.
2. Крук Н.Н. Строение и оптические свойства тетра-
(6)
пиррольных соединений. Минск: БГТУ, 2019. 223 с.
3. Березин Д.Б. N-Замещенные порфириноиды:
Здесь А - оптическая плотность на выбранной дли-
строение, спектроскопия, реакционная способность.
не волны, l - длина светопоглощающего слоя (см),
Saarbrücken: Lambert Academic Publishing, 2012. 64 с.
с - молярная концентрация (моль/л).
4. Toganoh M., Furuta H. In: Handbook of porphyrin
Логарифм констант диссоциации протониро-
science / Ed. K.M. Kadish, K.M. Smith, R. Guilard R.
New York: Academic Press, 2010. Vol. 10. p. 295. doi
ванных форм (рK3, рK4, рK3,4) рассчитывали гра-
10.1142/9789814280228_0010
фическим методом, используя зависимость lgInd =
5. Xue S., Ou Zh., Ye L., Lu G., Fang Yu., Jiang X., Ka-
f(cНХ), где НХ = АсОН, TFA) и уравнение (7).
dish K.M. // Chem. Eur. J. 2014. Vol. 21. N 6. P. 2651.
doi 10.1002/chem.201405570
(7)
6. Sakashita R., Ishida M., Furuta H. // J. Phys. Chem. (A).
2015. Vol. 119. N 6. P. 1013. doi 10.1021/jp512229k
где lgInd - логарифм отношения концентраций спек-
7. Ivanova Yu.B., Savva V.A., Mamardashvili N.Z.,
трально фиксируемых форм соединения, выражен-
Starukhin A.S., Ngo Th.H., Dehaen W., Maes W.,
ный соотношением (8).
Kruk M.M. // J. Phys. Chem. (A). 2012. Vol. 116. N 44.
P. 10683. doi 10.1021/jp305325e
8. Березин Д.Б., Таланова А.Е., Шухто О.В., Петро-
(8)
ва Д.В., Гусейнов C.С., Крестьянинов М.А., Се-
мейкин А.С. // ЖОХ. 2015. Т. 85. Вып. 8. С. 1319;
,
Здесь lg[HX] - логарифм концентрации кислоты, A0
Berezin D.B., Talanova A.E., Shukhto O.V., Petro-
Ai и A∞
- начальное, текущее и конечное значение
va D.V., Guseynov S.S., Kresn’yaninov M.A., Semey-
оптической плотности, Ki
- константа кислотно-ос-
kin A.S. // Russ. J. Gen. Chem. 2015. Vol. 85. N 8. P.
новного взаимодействия.
1319. doi 10.1134/S1070363215080150
9. Березин Д.Б., Каримов Д.Р., Кустов А.В. Корролы
Оптимизацию геометрических параметров ма-
и их производные: синтез, свойства, перспективы
кроцикла 3 и продуктов его взаимодействия с одной
практического применения. М.: Ленанд, 2018. 304 с.
или двумя молекулами трифторуксусной кисло-
10. Березин Д.Б., Толдина О.В. // ЖНХ. 2002. Т. 47.
ты выполняли с использованием пакета программ
№ 12. С. 2075; Berezin D.B., Toldina O.V. // Russ. J.
Gaussian 09 [29], метода функционала плотности,
Inorg. Chem. 2002. Vol. 47. N 12. P. 2075.
гибридного функционала B3LYP [30] и базисно-
11. Rosa A., Ricciardi G., Baerends E.J., Romeo A., Scola-
го набора CC-pVDZ [31]. В рамках NBO-анализа
ro L.M. // J. Phys. Chem. (A). 2003. Vol. 107. N 51.
P. 11468. doi 10.1021/jp030999n
[32, 33] рассчитаны энергии взаимодействия кис-
12. Senge M.O. In: The porphyrin handbook / Ed.
лотно-основных центров (Евз), а также энергии
K.M. Kadish, K.M. Smith, R. Guilard R. New York:
стабилизации орбиталей (Естаб), величины перене-
Academic Press, 2000. Vol. 1. P. 239.
сенного заряда (qстаб), геометрия параметров реак-
13. Sazanovich I.V., Panarin A.Y., Bolotin V.L., Chir-
ционных центров катионных солей порфириноида
vony V.S., Berezin D.B., Semeykin A.S., Van Hoek A. //
3. Расчетные данные представлены в табл. 3, а для
J. Porph. Phthaloc. 2005. Vol. 9. N 1. P. 59. doi 10.1142/
макроциклов 1, 2, 4 и 5 - опубликованы ранее [23].
S1088424605000113
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
886
БЕРЕЗИН и др.
14. Kruk M.M., Starukhin A.S., Maes W. // Macro-
J. Chem. Eur. 2002. Vol. 8. N 15. P. 3485. doi 10.1134/
heterocycles. 2011. Vol. 4. N 2. P. 69. doi 10.6060/
S1070363215080150
mhc2011.2.01
29. Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
15. Roucan M., Flanagan K.J., O’Brien J., Senge M.O. //
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
Eur. J. Org. Chem. 2018. Vol. 2018. N 46. P. 6432. doi
Mennucci B., Petersson G.A., Nakatsuji H., Caricato M.,
10.1002/ejoc.201800960
Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G.,
16. Kruk M.M., Starukhin A.S., Mamardashvili N.Zh.,
Sonnenberg J.L., Hada M., Ehara M., Toyota K., Fuku-
Mamardashvili G.M., Ivanova Yu.B., Maltseva O.V. //
da R., Hasegawa J., Ishida M., Nakajima T., Honda Y.,
J. Porph. Phthal. 2009. Vol. 13. N 11. P. 1148. doi
Kitao O., Nakai H., Vreven T., Montgomery J.A., Jr.,
10.1142/S1088424609001492
Peralta J.E., Ogliaro F., Bearpark M., Heyd J.J.,
17. Сесслер Дж.Л., Гейл Ф.А., Вон-Сеоб Х. Химия
Brothers E., Kudin K.N., Staroverov V.N., Kobayashi R.,
анионных рецепторов. М.: Красанд, 2011. 456 с.;
Normand J., Raghavachari K., Rendell A., Burant J.C.,
Sessler J.L., Gale Ph.A., Cho W.-S. Anion Receptor
Iyengar S.S., Tomasi J., Cossi M., Rega N., Millam J.M.,
Chemistry. Cambridge: Royal Soc. Chem. 2006. doi
Klene M., Knox J.E., Cross J.B., Bakken V., Adamo C.,
10.1039/9781847552471-00259
Jaramillo J., Gomperts R., Stratmann R.E., Yazyev O.,
18. Kustov A.V., Belykh D.V., Smirnova N.L., Venediktov E.A.,
Austin A.J., Cammi R., Pomelli C., Ochterski J.W.,
Kudayarova T.V., Kruchin S.O., Berezin D.B. // Dyes
Martin R.L., Morokuma K., Zakrzewski V.G., Voth G.A.,
Pigments. 2018. Vol. 149. P. 553. doi 10.1016/j.
Salvador P., Dannenberg J.J., Dapprich S., Daniels A.D.,
dyepig.2017.09.073
Farkas Ö., Foresman J.B., Ortiz J.V., Cioslowski J.,
19. Yakavets I., Millard M., Zorin V., Lassalle H.-P.,
Fox D.J., Gaussian 09, Revision D. 01, Gaussian, Inc.,
Bezdetnaya L. // J. Controlled Release. 2019. Vol. 304.
Wallingford CT, 2009.
P. 268. doi 10.1016/j.jconrel.2019.05.035
30. Ditchfield R., Hehre W.J., Pople J.A. // J. Chem. Phys.
20. Кустов А.В., Березин M.Б. //J. Chem. Eng. Data. 2013.
1971. Vol. 54. P. 724. doi 10.1063/1.1674902
Vol. 58. N 9. P. 2502. doi 10.1021/je400388j
21. Kustov A.V., Kustova T.V., Belykh D.V., Khudyaeva I.S.,
31. Weinhold F. // J. Mol. Struct. (Theochem). 1997.
Berezin D.B. // Dyes Pigments. 2020. Vol. 173. 107948.
Vol. 398-399. P. 181. doi 10.1016/S0166-
doi 10.1016/j.dyepig.2019.107948
1280(96)04936-6
22. Березин Д.Б, Семейкин А.С., Андрианов В.Г., Бере-
32. Glendening E.D., Reed A.E., Weinhold F. NBO 3.0
зин М.Б. // ЖОХ. 2000. Т. 70. Вып. 9. С. 1541; Bere-
Program manual. University of Wisconsin, Madison,
zin D.B., Semeikin A.S., Andrianov V.G., Berezin M.B. //
1998.
Russ. J. Gen. Chem. 2000. T. 70. N 9. P. 1453.
33. Alabugin I.V., Manoharan M., Peabody S. Weinhold F. //
23. Лихонина А.Е., Крестьянинов М.А., Моршнев Ф.К.,
J. Am. Chem. Soc. 2003. Vol. 125. N 19. P. 5973. doi
Критский Е.Л., Кудаярова Т.В., Березин Д.Б. // ЖФХ.
10.1021/ja034656e
2020. Т. 94. № 1. С. 110; Likhonina A.E., Krestyani-
34. Березин Д.Б., Андрианов В.Г., Семейкин А.С. // Опти-
nov M.A., Morshnev F.K., Kritsky E.L., Kudayarova T.V.,
ка и спектроскопия. 1996. Т. 80. № 4. C. 618.
Berezin D.B. // Russ. J. Phys. Chem. 2020. Vol. 94. N 1.
35. Suslova E.E., Ovchenkova E.N., Lomova T.N. //
P. 98. doi 10.1134/S0044453720010185
Tetrahedron Lett. 2014. Vol. 55. P. 4325. doi 10.1016/j.
24. Березин Д.Б., Таланова А.Е., Крестьянинов М.А.,
tetlet.2014.06.021.
Серов И.Н., Семейкин А.С. // ЖФХ. 2016. Т. 90.
36. Latos-Grażyński L. // Inorg. Chem. 1985. Vol. 24. N 11.
№ 10. C. 1465; Berezin D.B., Talanova A.E., Krestya-
P. 1681. doi 10.1021/ic00205a018
ninov M.A., Serov I.N., Semeykin A.S. // Russ. J. Phys.
37. Koszarna B., Gryko D.T. // J. Org. Chem. 2006. Vol. 71.
Chem. 2016. Vol. 90. N 10. P. 1948. doi 10.7868/
N 10. P. 3707. doi 10.1021/jo060007k
S0044453716100058
38. Geier III G.R., Lindsey J.S. // Org. Lett. 1999. Vol. 1.
25. Lavallee D.K. The chemistry and biochemistry of
N 9. P. 1455. doi 10.1021/ol9910114
N-substituted porphyrins. New York: VCH Publ., 1987.
39. Nonell S., Bou N., Borrell J.I., Teixido J., Villanueva A.,
313 p.
Juarranz A., Canete M. // Tetrahedron Lett. 1995. Vol. 36.
26. Berezin D.B., Karimov D.R. // Macroheterocycles. 2009.
N 19. P. 3405.doi 10.1016/0040-4039(95)00493-V
Vol. 2. N 1. P. 42.
40. Бургер К. Сольватация, ионные реакции и ком-
27. Stolzenberg A.M., Simerly S.W., Steffey B.D., Scott H.G. //
плексообразование в неводных средах. М.: Мир,
J. Am. Chem. Soc. 1997. Vol. 119. N 49. P. 11843. doi
1984. 256 с.; Burger K. Solvation, ionic and complex
10.1021/ja972210q
28. Fowler C.J., Sessler J.L., Lynch V.M., Waluk J., Gebau-
formation reactions in non-aqueous solvents.
er A., Lex J., Heger A., Zuniga-y-Rivero F., Vogel E. //
Amsterdam: Elsevier, 1983.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
СПЕКТР
АЛЬНОЕ И КВАНТОВО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ
887
Spectral and Quantum-Chemical Study of Basicity
of Phenyl-Substituted Porphyrinoids
D. B. Berezina,*, A. E. Likhoninaa, O. V. Shukhtoa, D. R. Karimova,
I. N. Serova, and M. A. Krest’yaninovb
a Ivanovo State University of Chemical Technology, Research Institute of Macroheterocyclic Compounds,
Ivanovo, 153000 Russia
b G.A. Krestov Institute of Solution Chemistry of the Russian Academy of Sciences, Ivanovo, 153045 Russia
*e-mail: berezin@isuct.ru
Received December 25, 2019; revised December 25, 2019; accepted December 31, 2019
The electronic absorption spectra of cationic forms of porphyrinoids in acetonitrile and in benzene with the
addition of acetic or trifluoroacetic acids were studied, and the values of the acid-base interaction constants were
calculated. The series of changes in the basicity of the studied compounds obtained from spectrophotometric,
quantum chemical (DFT, B3LYP, CC-pVDZ using NBO analysis) and thermodynamic data are consistent with
each other.
Keywords: porphyrinoids, acid-base interaction, basic centers, NBO analysis
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020