ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 6, с. 888-895
УДК 541.515:577.112.3:544.431.15:678.048
ПРО(АНТИ)ОКСИДАНТНЫЕ СВОЙСТВА
АМИНОКИСЛОТ И ИХ ПРОИЗВОДНЫХ В
ПРИСУТСТВИИ ИОНОВ Fe2+ И Cu2+
© 2020 г. О. А. Милачa, И. В. Мельситоваa, И. Л. Юрковаa,b,*
a Белорусский государственный университет, ул. Ленинградская 14, Минск, 220030 Республика Беларусь
b Научно-исследовательский институт физико-химических проблем Белорусского государственного университета,
Минск, 220030 Республика Беларусь
*e-mail: yurkovail@tut.by
Поступило в Редакцию 10 февраля 2020 г.
После доработки 10 февраля 2020 г.
Принято к печати 16 февраля 2020 г.
С помощью флуоресцентного зонда (терефталевой кислоты) оценена способность аминокислот и их
производных акцептировать и/или содействовать образованию радикалов HO˙ в системах Cu2+-H2О2,
Fe2+(ЭДТА)-H2О2. В диапазоне концентраций 0.005-30 мM. по увеличению значения IC50 аминокислоты
располагаются в ряд: Trp < Phe ≤ Met ≤ His < Gly ≤ Glu < α-Ala < Cys << β-Αla << Tau (система с ионами
Cu2+); His ≤ Met < Trp ≤ Cys << β-Αla < Tau ≤ Glu < α-Ala < Gly (система со свободными ионами Fe2+).
В присутствии меди(II) цистеин и его производные, глутамин, α-аланин и гистидин (S) способствуют
образованию HO˙ и действуют как антиоксиданты при молярном соотношении S:Cu2+ >2:1, а для гисти-
дина при ≥ 1:1. Цистеин является прооксидантом в системе с Fe2+-ЭДТА.
Ключевые слова: аминокислота, гидроксильный радикал, прооксидант, ион Fe2+(Cu2+), флуоресцентный
зонд, радикал-акцепторная активность
DOI: 10.31857/S0044460X2006008X
Аминокислоты и их производные являются
и токсичная частица [E°(HO·, H+/H2O) = 2.73 В,
частью антиоксидантной системы организма для
E°' = 2.31 В при рН = 7.25], известная в настоя-
защиты клеток от окислительного стресса [1, 2].
щее время [2]. Радикалы НО˙ инициируют процес-
Последний развивается в результате нарушения
сы деструкции важнейших биомолекул с высокой
баланса оксиданты-антиоксиданты и характери-
скоростью (109-1010 M.-1с-1) и играют решающую
зуется чрезмерным накоплением активных форм
роль в развитии патологий [2, 3]. В настоящее вре-
кислорода (О2˙-, Н2О2, НСlО, НО˙) [2]. Активные
мя нет никакой известной ферментативной реак-
формы кислорода способны индуцировать по-
ции, способной деактивировать НО˙ in vivo. Один
вреждения компонентов клеток и органов в целом.
из путей образования НО˙ в организме - это разло-
Окислительный стресс играет ключевую роль в
жение H2О2, катализируемое ионами переходных
развитии многих патологий (воспаления, атеро-
металлов (Fe2+, Cu+ и др.) (схема 1) [2, 3].
склероз, инсульт, инфаркт, диабет и др.) [1, 2].
Увеличение свободных (не связанных с белка-
Среди активных форм кислорода гидроксиль-
ми или слабо связанных с аминокислотами) ионов
ный радикал (НО˙) - самая реакционноспособная
меди и железа вследствие нарушения гомеостаза
Схема 1.
Cu2+(Fe3+) + H2O2 → Cu+(Fe2+) + O2˙- + 2H+, kv ~ 4.6×102 М.-1с-1
O2˙- + Fe3+(Cu2+) → Fe2+(Cu+) + O2, kv ~ 1×108 (1×109) М.-1с-1
Fe2+(Cu+) + H2O2 → Fe3+(Cu2+) + HO˙ + OH-, kv ~ 76 (4.7×103) М.-1с-1
888
ПРО(АНТИ)ОКСИДАНТНЫЕ СВОЙСТВА АМИНОКИСЛОТ И ИХ ПРОИЗВОДНЫХ
889
коррелирует с развитием заболеваний (сердеч-
Схема 2.
но-сосудистые, нейродегенеративные, рак и др.),
патогенез которых сопряжен с образованием ак-
тивных форм кислорода [4].
Роль аминокислот и их производных в регу-
хиометрией реакции концентрация радикалов НО˙
лировании активных процессов, опосредованных
прямо пропорциональна интенсивности флуорес-
активными формами кислорода, в биосистемах
ценции 2-гидрокситерефталата.
интенсивно исследуется [1, 2]. Однако, несмотря
на большой накопленный материал, детальный
Аминокислоты и их производные могут различ-
механизм вовлечения аминокислот и их произ-
ным образом влиять на уровень НО˙ в тест-систе-
водных в регулирование свободно-радикальных
ме, включающей ионы Fe2+(Cu2+) и терефталевую
реакций, в частности в условиях Fe2+(Cu2+)-опо-
кислоту. С одной стороны, аминокислоты, взаи-
средованного генерирования HO˙, остается откры-
модействуя с Fe2+(Cu2+), могут влиять на способ-
тым. В присутствии ионов переходных металлов
ность редокс-систем генерировать НО˙. С другой
(Fe2+, Cu2+, Co2+) аминокислоты самостоятельно
стороны, они могут акцептировать образующиеся
или в сочетании с другими веществами способны
НО˙, и, тем самым, конкурировать с терефталевой
как ингибировать, так и интенсифицировать про-
кислотой 1 за их присоединение (схема 2). В ко-
цессы окисления в клетках [1, 2, 5-9]. Исследова-
нечном итоге эти процессы будут приводить к из-
ния антиоксидантных свойств аминокислот и их
менению концентрации 2-гидрокситерефталата 2.
производных проводятся при различных условиях
Про/антиоксидантные свойства веществ оце-
in vitro/vivo, зачастую данные противоречивы, их
нивали по их способности влиять на кинетику
трудно сопоставить и прогнозировать действие от-
гидроксилирования терефталевой кислоты и ин-
дельных аминокислот.
дексу IC50 (концентрация полумаксимального ин-
Задачей данной работы было оценить способ-
гибирования).
ность различных аминокислот и их производных
Действие аминокислот и их производных в
акцептировать и/или содействовать образованию
присутствии ионов меди(II). В условиях Cu2+-
радикалов HO˙ в присутствии как ионов Fe2+, так и
опосредованного генерирования НО˙ наиболь-
Cu2+ при одинаковых условиях. Для тестирования
шие различия во влиянии аминокислот и их про-
был выбран метод флуоресцентных зондов, бази-
изводных на окисление терефталевой кислоты
рующийся на использовании терефталевой кисло-
выявлено на начальном участке исследованно-
ты. Данный метод обладает высокой чувствитель-
го концентрационного диапазона. Наибольшей
ностью и прост в исполнении. Для генерирования
НО˙-акцептирующей способностью обладают
HO˙ использовали следующие редокс-системы:
ароматические аминокислоты Trp и Phe. В их при-
Cu2+(Fe2+)-H2О2, Fe2+/ЭДТА-H2О2. Концентраци-
сутствии значительно снижается выход 2-гидрок-
онный диапазон тестируемых соединений нахо-
ситерефталата и они обладают низкими индекса-
дился в области 5×10-6-2×10-2 моль/л, в отдель-
ми IC50 (см. таблицу).
ных случаях он расширялся.
Среди серосодержащих аминокислоты лучшей
Терефталевая кислота является специфичным и
антирадикальной активностью обладает Met и его
высокочувствительным детектором НО˙ (~10-9 М.),
сульфоксид. В присутствии Cys (с = 5×10-6-1×
она не реагирует с другими активными форма-
10-4 моль/л) и его N-ацетилированного аналога
ми кислорода (О2˙-, 1О2, Н2О2) [10]. Вследствие
(NAC) гидроксилирование терефталевой кислоты
симметричности молекулы терефталевая кислота
усиливается в значительной степени. Это свиде-
(рKа1 = 3.51, рKа2 = 4.82) взаимодействует с НО˙
тельствует о том, что уровень НО˙ в системе воз-
с образованием только одного моногидроксилиро-
растает. В указанном диапазоне стимулирующим
ванного изомера - 2-гидрокситерефталата 2. Дан-
эффектом обладают также Glu и протеиногенный
ный продукт является стабильным и в отличие от
α-Ala. Увеличение выхода 2-гидрокситерефталата
терефталевой кислоты обладает флуоресценцией
наблюдается и в присутствии His. Однако активи-
(λex = 315 нм, λem = 418 нм). В соответствии со сте-
рующее действие His проявляется в более узкой
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
890
МИЛАЧ и др.
Индексы IC50 исследованных соединений и константы скоростей реакций с гидроксильным радикалом
IC50, ммоль/л
Соединение
Cu
2+-H2O2
Fe2+-H2O2
Fe2+/ЭДТА-H2O2
kНО˙, М.-1∙с-1 [3, 11]
(0.05:5 ммоль/л)
(0.1:1 ммоль/л)
(0.1:0.1:1 ммоль/л)
Trp
0.015 ± 0.001
0.072 ± 0.008
0.071 ± 0.007
1.3×1010
(рН = 6.0-8.5)
Phe
0.071 ± 0.006
-
-
6.5×109
(рН = 5.8-8)
Met
0.075 ± 0.006
0.047 ± 0.005
-
8.3×109 (рН = 6-7)
MetSO
0.046 ± 0.004
0.083 ± 0.008
-
1×1010
His
0.078 ± 0.007
0.038 ± 0.004
0.280 ± 0.030
5×109 (рН = 6.0-7.0)
Gly
0.158 ± 0.015
24.8 ± 1.70
> 30
1.7×107 (рН = 5.8-6.0)
Glu
0.189 ± 0.021
7.88 ± 0.46
1.55 ± 0.14
2.3×108 (рН = 6-7)
α-Ala
0.241 ± 0.026
9.26 ± 0.74
9.97 ± 0.80
7.7×107 (рН = 5.5-6.8)
Cys
0.69 ± 0.08
0.082 ± 0.008
3.28 ± 0.29
3.5×1010, 4.7×1010
(рН = 7)
NAC
1.16 ± 0.093
0.099 ± 0.01
1.99 ± 0.18
1.36×1010
β-Ala
5.67 ± 0.39
3.42 ± 0.32
5.25 ± 0.47
-
Tau
>30
7.37 ± 0.59
-
2.4×106-1.4×107
GSH
0.111 ± 0.010
0.034 ± 0.003
0.739 ± 0.072
1.3×1010 (рН = 5.5)
GSSG
0.024 ± 0.002
0.222 ± 0.024
0.466 ± 0.050
9.6×109 (рН = 7)
Cyst
0.344 ± 0.035
-
-
-
Car
0.073 ± 0.007
0.041 ± 0.004
0.289 ± 0.030
4.0×109
NaN3
0.051 ± 0.005
0.044 ± 0.004
0.046 ± 0.005
1.2×1010
(pH = 7.9-13)
ДМСО
0.035 ± 0.004
-
-
7.0×109
области концентраций (5×10-6-1×10-5 моль/л) и он
татов для Car, His и β-Αla указывают на важность
имеет, в отличие от Cys, Glu и α-Ala, более низкий
наличия пептидной связи для проявления антира-
уровень IC50. Все аминокислоты, обнаруживаю-
дикальных свойств дипептида.
щие прооксидантный эффект, работают как анти-
GSH (L-γ-глутамил-L-цистеинилглицин) при
оксиданты при молярном соотношении аминокис-
с = 5×10-6-5×10-5 моль/л интенсифицирует окис-
лота:Cu2+ >2:1, за исключением His, для которого
ление терефталевой кислоты с образованием
оно ≥1:1. НО˙-Акцепторные свойства Gly прояв-
2-гидрокситерефталата. При этом его окисленная
ляются также при соотношении аминокислота:
форма (GSSG) не обладает таким эффектом. Для
Cu2+ > 2:1, а непротеиногенного β-Αla - при соот-
дисульфида цистамина (Сyst), известного радио-
ношении >10:1. Индекс IC50 для β-Αla в >20 раз
протектора, прооксидантного действия также не
выше, чем для α-Ala. Сульфокислота Tau, не вхо-
наблюдали. Из полученных данных следует, что
дящая в состав белков, не влияет на гидроксили-
влияние GSH на гидроксилирование терефталевой
рование терефталевой кислоты.
кислоты, как и для свободных аминокислот, зави-
Значимую роль в регулировании процессов,
сит от соотношения пептид:Cu2+. Максимальный
опосредованных активными формами кислоро-
прооксидантный эффект GSH наблюдается при
да, играют такие производные аминокислот, как
соотношении 1:1, а заметный антиоксидантный -
карнозин (Car) и глутатион (GSH) [1, 2]. В рабо-
при >2:1. Величины его индекса IC50 составляют
те выявлено, что Car (β-аланил-L-гистидин) эф-
0.056, 0.111, 0.160 и 0.210 ммоль/л соответствен-
фективно снижает уровень НО˙ в той же области
но для сCu2+ = 0.025, 0.05, 0.075 и 0.1 ммоль/л при
концентраций (>1×10-5 моль/л), где проявляются
[H2O2] = const. Прооксидантные свойства GSH
аналогичные свойства His. Совокупность резуль-
коррелируют с таковыми для Cys и Glu, входящи-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
ПРО(АНТИ)ОКСИДАНТНЫЕ СВОЙСТВА АМИНОКИСЛОТ И ИХ ПРОИЗВОДНЫХ
891
ми в его состав. Несмотря на свое активирующее
[14]. Надо отметить, что дисульфид GSSG, в от-
действие в малых дозах, GSH имеет низкий индекс
личие от GSH, обладает более высокой антиради-
IC50, сравнимый с таковым для Car.
кальной активностью. В работе [15] показано, что
в условиях Cu+-опосредованного генерирования
В Cu2+-содержащей системе по увеличению
НО˙ цистин и GSSG более эффективны в ингиби-
значений IC50 аминокислоты располагаются в сле-
ровании ДНК-повреждений, чем Cys и GSH.
дующий ряд, включающий референтный азид на-
трия: Trp < NaN3 ≤ Phe ≤ Met ≤ His < Gly ≤ Glu <
Полученные данные указывают на то, что свой
α-Ala < Cys << β-Αla << Tau.
вклад в протекторное действие аминокислоты
вносит их способность связывать ионы Cu2+/Cu+
В соответствии с работами [3, 11], по снижению
в комплексы [1, 16-19]. Cys и GSH образуют ком-
константы скорости реакции с гидроксильным
плексы как с Cu2+, так и с Cu+, причем более ста-
радикалом (kНО˙) исследованные аминокислоты
бильные с восстановленной медью [16]. Антиок-
располагаются следующим образом: Cys ≥ Trp ≥
сидантный эффект Gly, α-Ala и Glu, несмотря на
NaN3 > Met > His ≈ Phe >> Glu > α-Ala > Gly >
низкие значения kНО˙, видимо, связан с их хорошей
Tau (см. таблицу). Сопоставление величин kНО˙ и
аффинностью к ионам Cu2+/Cu+ [17-19]. Gly, α-Ala
IC50 исследованных аминокислот указывают на то,
и His в низких концентрациях обладают в ~3-4 раза
что с их участием в условиях Cu2+-опосредован-
большей Cu2+-хелатирующей активностью, чем
ного образования НО˙ протекают сложные про-
Tau и β-Ala [20]. His и Car (0.5-5 ммоль/л) хорошо
цессы. Полученные данные обращают внимание
ингибировали Н2О2-CuSO4-аскорбат-индуциро-
на то, что нужно учитывать не только скорость
ванное окисление ДНК, а β-Ala был неэффективен
взаимодействия аминокислоты с НО˙, но также
[7]. Антиоксидантные свойства MetSO снижаются
их способность влиять на соотношение Cu2+:Cu+
на 25% при переходе от систем с несвязанными
и координировать ионы меди таким образом, что
Cu+ к хелатированным 2,2'-бипиридином [21].
это может воздействовать на каталитическую ак-
Действие аминокислот и пептидов зависит от
тивность последних в реакциях с H2O2. Так, от-
их молярного соотношения с Cu2+, что может быть
сутствие НО˙-акцепторной активности Таu согла-
связано с процессами комплексообразования. Уве-
суется с его низкой константой (kНО˙) и данными
личение количества Cys или GSH в 2 раза в срав-
работ [9, 12], указывающими на то, что он слабо
нении с Cu(I) сопровождается образованием ста-
ингибирует свободно-радикальную деструкцию
бильных комплексов, что препятствует участию
биомолекул, инициированную НО˙. Однако в слу-
Cu(I) в реакции Фентона (схема 1) [16, 22, 23].
чае Cys, Gly и α-Ala такой корреляции нет, хотя в
Действие аминокислот и их производных в
условиях γ-радиолиза первый проявляет высокие
присутствии ионов железа(II). В условиях Fe2+-
НО˙-акцепторные свойства в отличие от простей-
Н2О2-опосредованного окисления терефталевой
ших аминокислот [2]. Известно, что биотиолы -
кислоты влияние тестируемых соединений от-
эффективные радиопротекторы [2].
личается от их действия в присутствии Cu2+ (см.
Прооксидантный эффект аминокислот и про-
таблицу). Важным отличием является то, что ни
изводных можно объяснить нуклеофильными
одна аминокислота не обнаруживает прооксидант-
свойствами их функциональных групп, способ-
ного эффекта. Самый низкий индекс IC50 характе-
ных восстанавливать Cu(II) до Cu(I) и, тем самым,
рен для His, он обладает высокой антирадикальной
содействовать ускорению разложения H2О2 и, сле-
активностью при данных условиях. Хотя, согласно
довательно, повышению уровня НО˙. Наибольшее
работе [8], в присутствии аскорбата His ускорял
прооксидантное действие проявляют Cys и его
деструкцию биомолекул, индуцированную Fe2+-
производные, несущие SH-группу. Это согласу-
Н2О2. Cys и его производные являются эффектив-
ется с двоякой ролью биотиолов в регулировании
ными НО˙-акцепторами, а Glu, α-Ala и Gly теряют
свободнорадикальных процессов [5, 6, 9]. His за
свою активность, что отражается в их высоких
счет имидазольной группы также может служить
значениях IC50. Среди пептидов отличие наблю-
нуклеофилом и способствовать восстановлению
дается только для GSH, в диапазоне 5×10-6-5×
Cu2+ [13], и, тем самым, активизировать процес-
10-4 моль/л он более эффективен, чем его окислен-
сы деструкции, что согласуется с данными работы
ная форма.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
892
МИЛАЧ и др.
дантный эффект), так и ослаблять (антиоксидант-
ный) каталитическую активность металла.
Наиболее существенное отличие в действии
аминокислот в сравнении с системой со свободны-
ми ионами Fe2+ выявлено для Cys и его N-ацети-
лированного аналога. Данные тиолы способству-
ют гидроксилированию терефталевой кислоты в
диапазоне концентраций 5×10-6-1×10-3 моль/л, за-
метный ингибирующий эффект наблюдали при с =
5×10-3 моль/л. GSH не оказывает прооксидантного
действия, однако протекторный эффект, схожий по
силе в системе Fe2+-H2О2, оказывает при увеличе-
нии концентрации более чем в 10 раз.
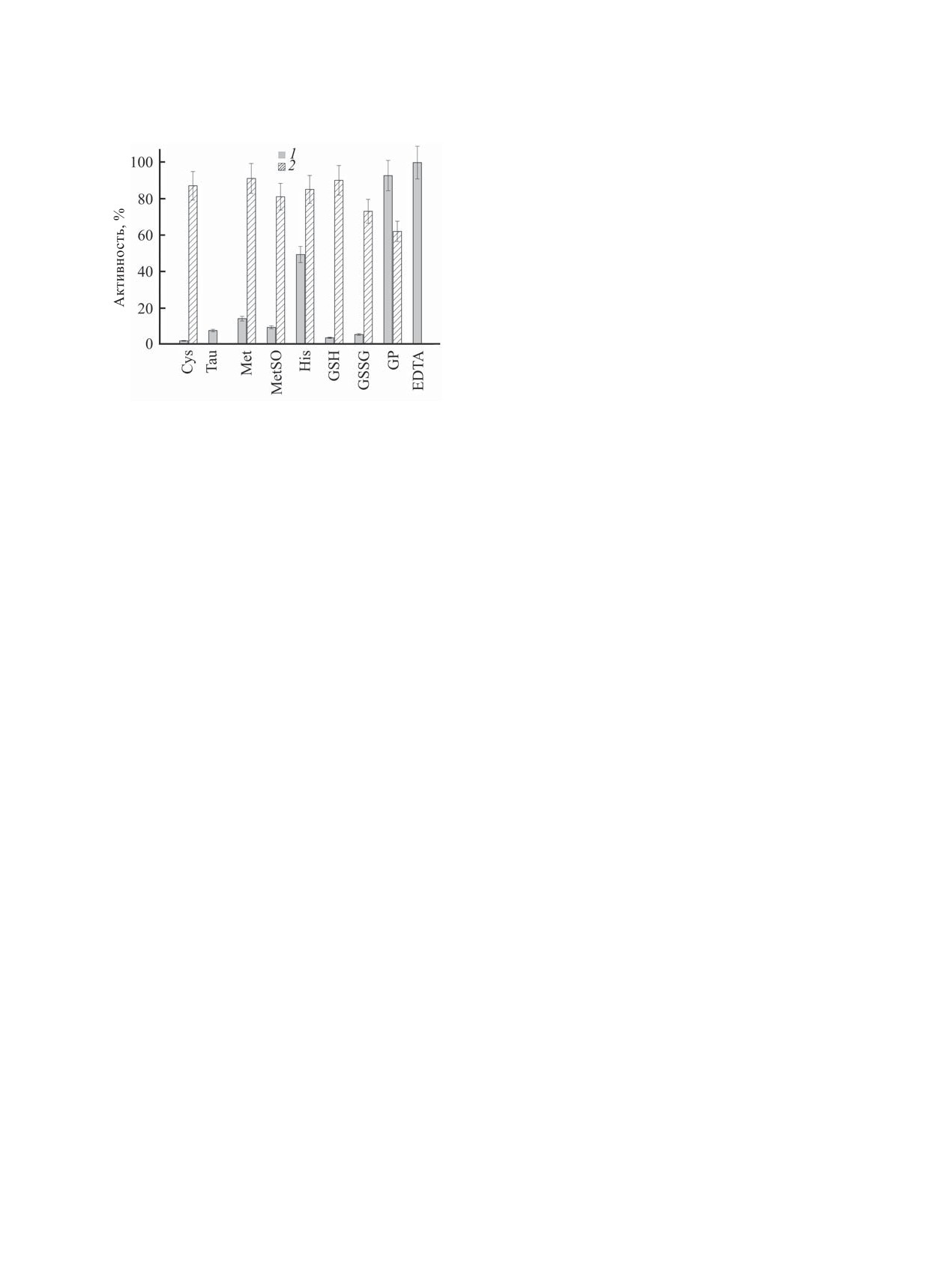
Способность тестируемых соединений (S) хелатиро-
Прооксидантное действие биотиолов (RSН)
вать Fe2+ (1, [S] = 10 ммоль/л) и ингибировать образо-
можно объяснить нуклеофильными свойствами
вание 2-гидрокситерефталата 2 в тест-системе тереф-
талевая кислота-Fe2+-H2О2 (0.06:0.1:1 ммоль/л) (2,
сульфгидрильной группы. Перенос электрона в
[S] = 0.5 ммоль/л).
водной среде от Cys и GSH к ионам железа(III)
при физиологических условиях протекает очень
В системе, содержащей свободные Fe2+, по уве-
медленно [2]. Активность тиолов коррелирует с
личению индекса IC50 аминокислоты располага-
pKa-значениями их SH-групп (GSH 9.2, Cys 8.5,
ются в следующий ряд: His ≤ NaN3 ≤ Met < Trp ≤
рН = 7.4). Окислительная модификация низкомо-
Cys << β-Αla < Tau ≤ Glu < α-Ala < Gly.
лекулярных тиолов предпочтительна при повыше-
НО˙-Акцепторные свойства аминокислот ис-
нии их нуклеофильных свойств путем перевода в
следовали также в системе Fe2+-H2O2, в которую
тиолатную форму (RS¯). В выбранных условиях
вводили этилендиаминтетрауксусную кислоту
эксперимента, по-видимому, возможно прямое
(ЭДТА), образующую комплекс Fe2+/ЭДТА (lgK =
взаимодействие Cys с комплексом Fe3+/ЭДТА, что
14.3). Добавка ЭДТА, с одной стороны, повыша-
приводит к восстанавлению ионов Fe3+ и, тем са-
ет эффективность системы, т. е. усиливает ката-
мым, возвращает их в каталитический цикл раз-
литический эффект железа(II) в реакции Фентона
ложения H2О2. Активирующее действие GSH и
(схема 1) {E°(Fe3+/Fe2+) = 0.77 В, E°(Fe3+-ЭДТА/
Cys на Fe2+/ЭДТА-опосредованный свободнора-
Fe2+-ЭДТА) = 0.13 В [2]}, а с другой - препятству-
дикальный процесс наблюдали в работе [9], хотя,
ет связыванию ионов железа с тестируемыми сое-
согласно данным [6], трипептид и N-ацетилиро-
динениями.
ванный цистеин ускоряли пероксидное окисление
липидов, индуцированное нехелатированными ио-
Согласно полученным данным, His и Car эф-
нами Fe2+.
фективнее в системе со свободными ионами Fe2+,
что может указывать на вклад в их антиоксидант-
Таким образом, методом флуоресцентных зон-
ное действие связывания Fe2+/Fe3+ [24, 25]. В на-
дов выявлено различие в антиоксидантном дей-
шем эксперименте Fe2+-хелатирующая активность
ствии аминокислот и их производных в зависи-
His, в отличие от других аминокислот, наилучшим
мости от того, какие ионы Fe2+(Cu2+) опосредуют
образом коррелирует с антирадикальной (см. рису-
образование радикалов НО˙. Отдельные аминокис-
нок). Согласно данным работы [24], His эффекти-
лоты и их производные - эффективные промоторы
вен в связывании Fe(III), а Glu нет. Gly и α-Ala спо-
или протекторы только в присутствии Cu2+. Дан-
собны образовывать комплексы с ионами железа,
ные простого экспресс-анализа позволяют сделать
хотя и менее прочные, чем с ионами меди [26].
вывод о том, что в присутствии ионов Fe2+(Cu2+)
Однако данные аминокислоты не проявляют зна-
про(анти)оксидантное действие аминокислот и
чимой активности в присутствии Fe2+. Надо отме-
пептидов обусловлено балансом их НО˙-акцептор-
тить, что образование комплексов аминокислоты с
ных, восстановительных и комплексообразующих
ионами металлов может как усиливать (проокси-
свойств. Полученные результаты полезны для раз-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
ПРО(АНТИ)ОКСИДАНТНЫЕ СВОЙСТВА АМИНОКИСЛОТ И ИХ ПРОИЗВОДНЫХ
893
работки эффективных антиоксидантов, нутрицев-
ления каждого компонента растворы тщательно
тиков, лекарственных препаратов на основе ами-
перемешивали на приборе Vortex Mixer. Далее
нокислот и понимания детального механизма их
тест-системы инкубировали при комнатной темпе-
действия при определенных условиях.
ратуре в течение 5 или 9 мин. Время с момента по-
следнего перемешивания до измерения в каждой
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
серии было одинаковым и отмечалось строго по
В работе использовали L-цистеин (Cys), N-аце-
секундомеру. Для определения длительности ин-
тил-L-цистеин (NAC), таурин (2-аминоэтансуль-
кубирования теста изучали кинетическое поведе-
фоновая кислота) (Tau), L-метионин (Met), L-ме-
ние реакции образования 2-гидрокситерефталата.
тионин сульфоксид (МеtSO), L-гистидин (His),
После введения H2O2 в реакционную смесь тереф-
L-триптофан (Trp), глицин (Gly), L-фенилаланин
талевая кислота-M2+ интенсивность флуоресцен-
(Phe), L-глутаминовую кислоту (Glu), α-аланин
ции при 418 нм записывали как функцию времени.
(α-Ala), β-аланин (β-Ala), карнозин (Car), глутати-
Данные оценивали, используя метод конкури-
он восстановленный (GSH) и окисленный (GSSG),
рующих реакций. Терефталевая кислота 1 и те-
динатриевую соль глицеро-2-фосфата (GP), тереф-
стируемое соединение (S) конкурируют за взаи-
талевую кислоту, феррозин (Fz) производста фир-
модействие с гидроксильным радикалом (схема 2).
мы «Sigma-Aldrich» (Германия). Азид натрия, ги-
Сигнал флуоресценции (F) измеряли как функцию
дропероксид, диметилсульфоксид, цистамин, соли
концентрации тестируемого соединения ([1] = }
металлов (CuSO4·5H2O, FeSO4·7H2O) и натрие-
const) и строили графики в координатах F-[S].
вая соль ЭДТА - коммерческие продукты (ЗАО
Так как флуоресцентный сигнал в системе про-
«Вектон», Россия). Все использованные в работе
порционален только концентрации 2-гидроксите-
реактивы и растворители имели аналитическую
рефталата 2, то для обработки экспериментальных
степень чистоты. Водные растворы готовили с ис-
результатов использовали адаптированное уравне-
пользованием деионизированной воды.
ние Штерна-Фольмера (1).
Cпектры флуоресценции в диапазоне
350-
(1)
550 нм получали на спектрофлуориметре Solar
CM2203. Оптическое поглощение проб измеряли
Здесь [S] и [1] - концентрации тестируемого сое-
на спектрофотометре Specord S600.
динения и терефталевой кислоты соответственно;
Определение антирадикальной активно-
F0 и F - интенсивность сигнала флуоресценции
сти соединений. Тест-система для исследования
2-гидрокситерефталата при λem = 418 нм в отсут-
НО˙-акцепторной способности соединений име-
ствие и в присутствии тестируемого соединения
ла следующий состав: терефталевая кислота-
соответственно.
Cu2+(Fe2+, Fe2+/ЭДТА)-H2O2, фосфатно-солевой
Для расчета индекса IC50 уравнение (1) пере-
буфер (PBS, 10 ммоль/л, рН = 7.4). Общий объем
группировали и преобразовали в логарифмиче-
реакционной системы составлял 2 мл. Изначально
скую зависимость, а затем получали прямую в
готовили исходные концентрированные растворы
координатах: log[F0/F - 1]- log[S]. Концентрацию
реагентов, затем их аликвоты добавляли в тест-си-
стему для достижения необходимых концентра-
тестируемого вещества, при которой наблюда-
ется уменьшение флуоресценции по сравнению
ций компонентов. Исходный раствор терефтале-
вой кислоты (с = 1×10-2 моль/л) готовили путем
с контролем в два раза (индекс IC50), получали
растворения 0.0118 г кислоты в 25 ммоль/л раство-
при значении log(F0/F - 1) = 0 [если F = 1/2Fo, то
ре NaOH. В тест-системе конечная концентрация
log(F0/F - 1) = 0]. В качестве контроля использова-
терефталевой кислоты составляла 6×10-5 моль/л.
ли NaN3, что объясняется его устойчивыми анти-
радикальными свойствами в условиях Fe2+(Cu2+)-
При тестировании соединений строго соблюда-
опосредованного генерирования НО˙ [2].
ли следующий порядок добавления растворов ре-
агентов: PBS, терефталевая кислота, тестируемое
Для расчета относительной константы ско-
соединение, соль металла, H2O2. Для достижения
рости реакции (kS,HO˙) тестируемого соедине-
однородности во всем объеме пробы после добав-
ния (S) с НО˙ строили графики в координатах:
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
894
МИЛАЧ и др.
(F0/F - 1)-([S]/[1]). По тангенсу угла наклона пря-
экспериментальной серии проводили 3-5 парал-
мой (F0/F - 1)-([S]/[1]), равному kS,ОН/(k1,ОН·[1]),
лельных опытов. Оценку линейной связи между
рассчитывали величину kS,HO˙ с учетом того, что
количественными переменными проводили с по-
k1,НО˙ = 4.4×109 M.-1·с-1 [10]. Рассчитанные в дан-
мощью коэффициента Пирсона. Гипотезу о нали-
ной работе значения kS,НО˙ для NaN3, ДМСО, Trp
чии достоверной положительной корреляции счи-
и Tau, равные 8.6×109, 5.2×109, 1.06×1010, 1.3×
тали подтвержденной при R2 = 0.97-0.99 (р < 0.05).
107 М.-1с-1 соответственно, хорошо согласуют-
КОНФЛИКТ ИНТЕРЕСОВ
ся с литературными данными (см. таблицу). Это
дополнительно указывает на то, что выбранный
Авторы заявляют об отсутствии конфликта
метод тестирования хорошо подходит для экс-
интересов.
пресс-оценки антирадикальной активности соеди-
СПИСОК ЛИТЕРАТУРЫ
нений при заданных условиях.
Ингибирующую активность соединений (%)
1. Vertuani S., Angusti A., Manfredini S. // Curr.
Pharm. Des. 2004. Vol. 10. P. 1677. doi 10.2174/
рассчитывали по уравнению (2).
1381612043384655
(2)
2. Halliwell B., Gutteridge J.M.C. Free radicals in biology
and medicine, fourth edition. Oxford: University press,
Определение Fe2+-хелатирующей способно-
2012. 851 p.
сти соединений. Способность соединений хелати-
3. Buxton G.V., Greenstock C.L., Helman W.P., Ross A.B. //
ровать ионы Fe2+ оценивали в соответствии с ме-
J. Phys. Chem. Ref. Data. 1988. Vol. 17. N 2. P. 513. doi
тодикой, основанной на образовании устойчивого
10.1063/1.555805
водорастворимого комплекса между феррозином
4. Valko M., Jomova K.,·Rhodes C.J., Kuca K., Musülek K. //
(Fz) и Fe2+ (рН = 4-9) [27]. Тестируемые соедине-
Arch. Toxicol. 2016. Vol. 90. P. 1. doi 10.1007/s00204-
ния конкурируют с Fz за связывание Fe2+, в резуль-
015-1579-5
тате чего уменьшается количество окрашенного
5. Yin J.-J., Fu P.P., Lutterodt H., Zhou Y.-T., Antho-
комплекса Fe(II)Fz3.
line W.E., Wamer W. // J. Agric. Food Chem. 2012.
Vol. 60. P. 2554. doi 10.1021/jf204724w
К 0.2 мл образца добавляли 0.2 мл раствора
6. Sagrista M.L., Garcia A.E., Africa De Madariaga M.,
FeSO4
(5×10-5 моль/л). Реакцию инициирова-
Mora M. // Free Rad. Res. 2002. Vol. 36. N 3. P. 329.
ли добавлением 0.2 мл раствора феррозина (2.5×
doi 10.1080/10715760290019354
10-4 моль/л). Смесь хорошо встряхивали и остав-
7. Mozdzan M., Szemraj J., Rysz J., Nowak D. // Basic
ляли при комнатной температуре в темноте на
Clin. Pharmacol. Toxicol. 2005. Vol. 96. P. 352. doi
15 мин. После достижения в смеси равновесия
10.1111/j.1742-7843.2005.pto_03.x
измеряли оптическое поглощение пробы при λ =
8. Шендикова Е.Н., Мельситова И.В., Юркова И.Л. //
562 нм. Глицеро-2-фосфат и ЭДТА были использо-
Химия высоких энергий. 2016. Т. 50. N 4. С. 260.;
ваны в качестве стандартных соединений.
Shendikova E.N., Mel’sitova I.V., Yurkova I.L. // High
Хелатирующую активность
(%) соединений
Energy Chem. 2016. Vol. 50. N 4. Р. 249. doi 10.7868/
рассчитывали по уравнению (3).
S0023119316040173
9. Шендикова Е.Н., Мельситова И.В., Юркова И.Л. //
(3)
Химия высоких энергий. 2017. Т. 51. N 5. С. 380.;
Shendikova E.N., Mel’sitova I.V., Yurkova I.L. // High
Здесь Aк и Aо - величина оптической плотности
Energy Chem. 2017. Vol. 51. N 5. P. 363. doi 10.7868/
комплекса Fe(II)Fz3 соответственно без добавок и
S002311931705014X
в присутствии исследуемого образца.
10. Page S.E., Arnold W.A, McNeill K. // J. Environ. Monit.
2010. Vol. 9. N 12. P. 1658. doi 10.1039/c0em00160k
Статистический анализ. Для обработки полу-
11. Aruoma O.I., Halliwell B., Hoey B.M., Butler J. //
ченных экспериментальных результатов применя-
Biochem J. 1988.Vol. 256. P. 251. doi 10.1042/
ли методы математической статистики, включая
bj2560251
статистические функции программ Excel и Origin
12. Shi X., Flynn D.C., Porter D.W., Leonard S.S.,
8. Достоверность полученных результатов контро-
Vallyathan V., Castranova V. // Ann. Clin. Lab. Sci.
лировали с помощью t-теста Стьюдента. В каждой
1997. Vol. 27. P. 365.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
ПРО(АНТИ)ОКСИДАНТНЫЕ СВОЙСТВА АМИНОКИСЛОТ И ИХ ПРОИЗВОДНЫХ
895
13. Christensen A.M., Schaefer J., Kramer K.J., Morgan T.D.,
21. Ramoutar R.R., Brumaghim J.L. // Main Group Chem.
Hopkins T.L. // J. Am. Chem. Soc. 1991. Vol. 113.
2007. Vol. 6. P. 143. doi 10.1080/10241220802012387
P.6799. doi 10.1021/ja00018a013
22. Hanna P.M., Mason R.P. // Arch. Biochem.
14. Gutierrez-Correa J., Stoppani A.O. // Free Rad. Res.
Biophys. 1992. Vol. 295. P. 205. doi 10.1016/0003-
Vol. 27. P. 543. doi 10.3109/10715769709097858
9861(92)90507-s
15. Battin E.E., Brumaghim J.L. // J. Inorg. Biochem. 2008.
23. Spear N., Aust S.D. // Arch Biochem Biophys. 1995.
Vol. 102. P. 2036. doi 10.1016/j.jinorgbio.2008.06.010
Vol. 317. Р. 142. doi 10.1006/abbi.1995.1146
16. Fernanda M., Leal C., van den Berg C.M.G. //
24. Nair N.G. Perry G.S., Smith M.A., Reddy V.P. // J.
Aquatic Geochem. 1998. Vol. 4. P. 49. doi 10.1023/
Alzheimer’s Dis. 2010. Vol. 20. P. 57. doi 10.3233/
A:1009653002399
JAD-2010-1346
17. Cerda B.A., Wesdemiotis C. // J. Am. Chem. Soc. 1995.
25. Vera-Aviles M., Vantana E., Kardinasari E., Koh N.L.,
Vol. 117. P. 9734. doi 10.1021/ja00143a017
Latunde-Dada G.O. // Pharmaceuticals. 2018. Vol. 11.
18. Senapati1 U., Mandal B., Bankura K.P. // Rasayan
P. 111. doi 10.3390/ph11040111
J. Chem. 2017. Vol. 10. P. 981. doi 10.7324/
26. Marino T., Toscano M., Russo N., Grand A. // J. Phys.
RJC.2017.1031798
Chem. (B). 2006. Vol. 110. P. 24666. doi 10.1021/
19. Umadevi P., Senthilkumar L. // RSC Adv. 2014. Vol. 90.
P. 49040. doi 10.1039/C4RA08155B
jp0645972
20. Wu H.-C., Shiau C.-Y., Chen H.-M., Chiou T.-K. // J.
27. Carter P. // Anal. Biochem. 1971. Vol. 40. P. 450. doi
Food Drug Anal. 2003. Vol. 11. P. 148.
10.1016/0003-2697(71)90405-2
Pro(anti)oxidant Properties of Amino Acids
and Their Derivatives in The Presence of Fe2+ and Cu2+ Ions
O. A. Milacha, I. V. Mel’sitovaa, and I. L. Yurkovaa,b,*
a Belarussian State University, 220030 Belarus
b Research Institute of Physicochemical Problems, Belarussian State University, Minsk, 220030 Belarus
*e-mail: yurkovail@tut.by
Received February 10, 2020; revised February 10, 2020; accepted February 16, 2020
Fluorescent probe, terephthalic acid, was used for rapid analysis of the ability of amino acids and their deriva-
tives to accept and/or promote the formation of HO˙ radicals in the Cu2+-H2O2, Fe2+/EDTA-H2O2 systems. In
the concentration range of 0.005-30 mM., according to the increase in IC50, amino acids are ranked as follows:
Trp < Phe ≤ Met ≤ His < Gly ≤ Glu < α-Ala < Cys << β-Αla << Tau (system with Cu2+); His ≤ Met < Trp ≤
Cys << β-Αla < Tau ≤ Glu < α-Ala < Gly (system with free Fe2+). In the presence of copper(II), Cys and its
derivatives, Glu, α-Ala, His (S) intensify HO˙ formation, and act as antioxidants in molar ratio of S:Cu2+ > 2:1,
only for His this ratio is ≥1:1. Cys is also a prooxidant in the system with Fe2+/EDTA.
Keywords: amino acid, hydroxyl radical, prooxidant, Fe2+(Cu2+) ion, fluorescent probe, radical scavenging
activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020