ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 6, с. 896-905
УДК 541.49:54-39
ПРОТОНИРОВАНИЕ ПРОИЗВОДНЫХ ФЕРРОЦЕНА
СИЛЬНЫМИ КИСЛОТАМИ. КИНЕТИЧЕСКИЕ
ЗАКОНОМЕРНОСТИ РЕДОКС-ИЗОМЕРИИ
ФЕРРОЦЕНИЛКАРБЕНИЕВЫХ ИОНОВ
© 2020 г. В. М. Фомин*, А. В. Маркин, Н. Н. Шуклина
Нижегородский государственный университет имени Н. И. Лобачевского,
пр. Гагарина 23, Нижний Новгород, 603950 Россия
*e-mail: niih325@bk.ru
Поступило в Редакцию 10 января 2020 г.
После доработки 10 января 2020 г.
Принято к печати 16 января 2020 г.
Методом электронной спектроскопии по накоплению катионов ферроцения изучена кинетика редокс-изо-
мерии ферроценилкарбениевых ионов, полученных протонированием производных ферроцена хлорной
кислотой в диоксане. Показано, что характер зависимостей скорости накопления катиона ферроцения от
концентрации реагентов, имеющих в ряде случаев экстремальный вид, определяется природой метал-
локомплексов и соотношением начальных концентраций металлокомплекса и кислоты. Стабилизация
карбокатионов за счет их сольватации такими растворителями как ацетонитрил, ДМФА и ДМСО, а также
путем координации с исходным соединением приводит к частичной или полной потере ими способности
к редокс-изомерии. Приведены схемы протонирования металлокомплексов и результаты их кинетиче-
ского анализа, подтверждающие полученные концентрационные зависимости.
Ключевые слова: производные ферроцена, протонирование, ферроценилкарбениевый ион, редокс-изо-
мерия, катион ферроцения, сольватация
DOI: 10.31857/S0044460X20060091
Редокс-изомерия является уникальным явле-
непосредственно саму стадию редокс-изомерии,
нием в химии карбокатионов [1], свойственным
приводящую к образованию соответствующих ка-
только производным ферроцена, в которых окис-
тионов ферроцения. В этих же работах было пока-
лительный и восстановительный реакционные
зано, что в избытке ферроценилметанола карбока-
центры входят в состав одной и той же молекулы.
тион FcC+H2 обладает повышенной стабильностью
До последнего времени внимание исследователей
к редокс-изомерии, что было объяснено образова-
было в основном обращено на изучение свойств
нием донорно-акцепторного комплекса. Исходя
карбокатионов, полученных при протонировании
из этого, становится понятным и влияние соот-
ферроценилметанола [1-4], ферроценилметилме-
ношений концентраций металлокомплекса и кис-
танола [5] и винилферроцена [4]. При изучении
лоты в реакционной смеси на выход FcC+H2: при
протонирования ферроценилметанола и винил-
[FсСH2ОН]/[HClO4] > 50-100 он в десятки раз
ферроцена хлорной и трифторуксусной кислотами
выше, чем при
[HClO4]/[FсСH2ОН] > 50-100.
(НХ) в диоксане методом электронной спектро-
Не менее важным для изучения свойств ферро-
скопии авторам [3, 4] удалось зафиксировать об-
ценилкарбениевых ионов является установленное
разование карбокатиона по полосе поглощения с
в работе [3] влияние природы растворителя на вы-
λmax = 600 нм и изучить некоторые свойства карбо-
ход карбокатионов FсC+H2, который снижается в
катионов FcC+H2 и FcC+H2CH3, а также наблюдать
ряду Diox ≈ MeCN >> Diox-H2O (1:1) ≈ EtOH ≈
896
ПРОТОНИРОВАНИЕ ПРОИЗВОДНЫХ ФЕРРОЦЕНА
897
A
A
A
Ȝ ɧɦ
t ɫ
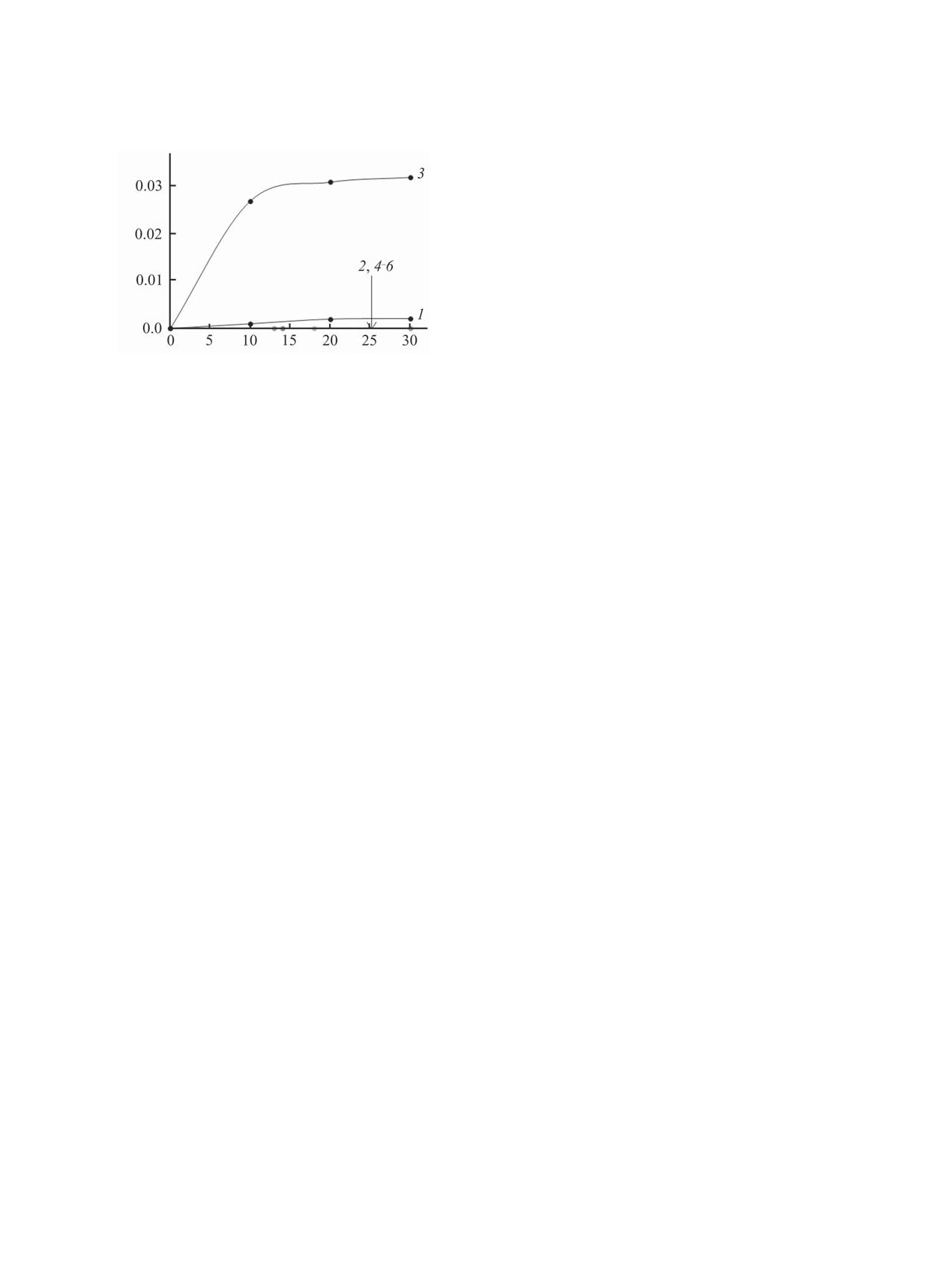
Рис. 1. Электронные спектры реакционных смесей,
содержащих HClO4 и соединения 1 (1, 5), 2 (2), 3 (3), 4
Рис. 2. Кинетические кривые накопления катиона фер-
(4), в диоксане. c01-4 = 0.001 M., c0HX = 0.1 M. (1-4), c01 =
роцения при протонировании соединений 1-4 хлорной
0.05 M., c0HX = 0.001 M. (5), τ = 15 с.
кислотой в диоксане.
ДМФА ≈ ДМСО. Изучение процессов протони-
ферроцена с гидроксильными, карбонильными
рования производных ферроцена с различными
и карбоксильными функциональными группами
функциональными группами представляет несо-
сильными кислотами (НХ) и кинетику редокс-и-
мненный интерес также в связи с влиянием этих
зомерии образующихся при этом карбокатионов в
процессов на кинетику и механизм окисления
зависимости от природы металлокомплекса и рас-
металлокомплексов различными окислителями в
творителя.
присутствии сильных кислот, поскольку в их от-
Исследование кинетики проводили спектрофо-
сутствие оно или не идет, или идет очень медлен-
тометрически по изменению интенсивности по-
но. Примеров такого влияния достаточно много
лос поглощения карбокатионов с λmax = 600 нм и
[6-9]. Особенно показательными в этом смысле
катиона ферроцения с λmax = 628 нм со временем
являются результаты работы [6], свидетельству-
в электронном спектре реакционной смеси. По-
ющие о том, что радикально-цепное окисление
следовательность операций при снятии спектров
ферроценилуксусной кислоты кислородом, доста-
была следующей: сначала готовили растворы ис-
точно легко протекающее в отсутствие кислот НХ
следуемого производного ферроцена в использу-
вообще, в присутствии HClO4 не происходит, что,
емом растворителе, вносили их в кювету, после
по мнению авторов, связано с образованием карбо-
чего барботировали через раствор с помощью
катиона при протонировании окисляемого соеди-
стеклянного капилляра аргон в течение 3 мин. Да-
нения, ингибирующего его окисление путем свя-
лее снимали поглощение фона, вводили кислоту,
зывания пероксидных радикалов, ведущих цепь,
убирали капилляр и закрывали кювету. Исследова-
за счет донорно-акцепторного взаимодействия.
ли динамику изменения спектра в течение 3 мин,
Приведенные данные, представляющие несо-
первые четыре точки обычно снимали в течение
мненный интерес для химии ферроцена, носят
первой минуты.
фрагментарный характер, если учесть, что число
Одна из особенностей протонирования ферро-
производных ферроцена, способных образовывать
ценилметанола 1 хлорной кислотой в диоксане за-
ферроценилкарбениевые ионы при их протониро-
ключается в том, что при варьировании отношения
вании, весьма значительно [1], а свойства карбо-
начальных концентраций [1]0/[HX]0 можно зафик-
катионов могут существенно отличаться.
сировать либо образование карбокатиона FcC+H2
В свете изложенного представляло интерес из-
по полосе поглощения с λmax = 600 нм, если [1]0 >
учить особенности протонирования производных
[HX]0, либо катиона ферроцения Fc+C·H2 (скорее
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
898
ФОМИН и др.
с электронодонорными центрами и индуктивного
A
эффекта, а также сольватирующий эффект раство-
рителей.
Из общих соображений можно предположить,
что вышеупомянутые карбокатионы более ста-
бильны, чем карбокатион FcC+H2 из-за возмож-
ности взаимодействия вакантной р-орбитали ато-
ма углерода, участвующей в редокс-изомерии, не
только с π-системой электронов Ср-лиганда, но и с
орбиталью неподеленной пары электронов сосед-
t ɫ
него атома кислорода. Высокая стабильность кар-
бокатиона FсC+(ОН)СH3СОСH3, образующегося
Рис. 3. Кинетические кривые накопления катиона фер-
при протонировании соединения 4, объясняется
роцения при протонировании соединения 2 хлорной
кислотой в диоксане (1), этаноле (2), смеси диоксан-
также сильным электроноакцепторным влиянием
О (1:1) (3), ацетонитриле (4), ДМФА (5) и ДМСО (6).
Н2
второй ацетильной группы, приводящим к повы-
c03 = 0.001 M., c0HX = 0.1 M.
шению потенциала ионизации атома железа.
всего, в димерной форме) по полосе поглощения с
Результаты изучения влияния природы рас-
λmax = 628 нм, если процесс проводить в избытке
творителей на накопление катионов ферроцения
кислоты (рис. 1).
при протонировании соединений 1-4 в избытке
При протонировании FcCOOH (2), FcCOCH3
кислоты приведены на рис. 3 на примере соеди-
(3) и 1,1’Fc(COCH3)2 (4) в тех же условиях зафик-
нения 2. Начальная скорость накопления катио-
сировать образование соответствующего ферроце-
на ферроцения снижается в ряду растворителей
нилкарбениевого иона по электронным спектрам
Diox >> Diox-H2O (1:1) > MeCN ≥ EtOH ≥
реакционной смеси в видимой области при ши-
ДМФА = ДМСО, который практически полностью
роком варьировании начальных концентраций ме-
совпадает с приведенным выше рядом растворите-
таллокомплексов и кислоты не удается. Электрон-
лей, характеризующим их влияние на выход кар-
ные спектры реакционных смесей, содержащих
бокатиона FcC+H2 при протонировании соедине-
соединения 2-4 и кислоту, имеют только полосы
ния 1 в условиях, когда его концентрация намного
поглощения катионов ферроцения, отличающиеся
больше концентрации кислоты. Это позволяет за-
положением λmax и интенсивностью (рис. 1).
фиксировать карбокатион, но исключить при этом
его редокс-изомерию. Логично предположить, что
Результаты проведенных исследований сви-
этот же ряд растворителей характеризует их вли-
детельствуют о том, что скорость накопления со-
яние на выход карбокатионов, образующихся при
ответствующих катионов ферроцения зависит от
протонировании соединений 2-4, и именно этот
природы металлокомплекса, увеличиваясь в ряду:
фактор обусловливает наблюдаемое влияние при-
1 > 3 > 2 > 4 (рис. 2). Последовательность распо-
роды растворителей на скорость редокс-изомерии
ложения металлокомплекса в приведенном ряду
карбокатионов.
можно объяснить различием, с одной стороны, в
способности к протонированию различных функ-
Это влияние можно рассматривать как резуль-
циональных групп, обусловливающей выход кар-
тат специфической сольватации карбокатиона
бокатиона, а с другой - способности образующих-
указанными растворителями или прямого взаи-
ся карбокатионов к редокс-изомерии. По данным
модействия с ними. Действительно, координация
работы [10], реакционная способность карбока-
карбокатиона с молекулой растворителя, облада-
тионов в отношении той или иной реакции опре-
ющей высокой электронодонорной способностью,
деляется, прежде всего, их термодинамической
такой как у ДМФА или ДМСО, может приводить к
стабильностью, и чем она выше, тем ниже реак-
перемещению катионного центра на один из ато-
ционная способность. В качестве факторов ста-
мов растворителя. Именно в этих растворителях
билизации карбокатионов отмечаются делокали-
редокс-изомерия карбокатионов или незначитель-
зация положительного заряда за счет сопряжения
на, или не наблюдается. В пользу такого объясне-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
ПРОТОНИРОВАНИЕ ПРОИЗВОДНЫХ ФЕРРОЦЕНА
899
Схема 1.
щие: ΔrG≠IS - энергию внутрисферной перестрой-
+
ки, ΔrG≠OS - энергию реорганизации сольватной
FcC
+ ROH
FcCOR + H+
оболочки, ΔrG≠ES - энергию электростатического
R = H ɢɥɢ Alk.
взаимодействия. Первая составляющая должна
учитывать изменение конфигурации и длин связей
ния говорит и тот факт, что при добавлении к 3 мл
в карбокатионе при его превращении в активи-
раствора карбокатиона в ацетонитриле, получен-
рованный комплекс, вклад второй составляющей
ного протонированием соединения 1 в условиях
вытекает из существенного различия в энергиях
его избытка по отношению к кислоте (А = 2.8 при
сольватации карбокатиона, которая должна быть
λmax = 600 нм) добавок ДМФА и ДМСО объемом
значительной величиной, и катиона ферроцения,
0.1 мл наблюдается мгновенное уменьшение ин-
который, как известно [1], мало склонен к сольва-
тенсивности полосы поглощения карбокатиона в
тации. Третья имеет основной смысл для переход-
1.7 и 2.2 раза соответственно. Этанол, как и вода,
ного состояния, в котором положительный заряд,
может вступать в прямое взаимодействие с карбо-
предположительно, должен быть поделен между
катионом, сопровождаемое выделением протона
атомами углерода и железа.
и нейтрального соединения (схема 1), что вообще
Для сравнения можно отметить, что, по данным
характерно для реакции этих реагентов с любыми
работ [6, 8, 9, 11, 12], окислению соединений 1-4
карбокатионами [10].
пероксидом водорода в присутствии CF3COOH
Рассмотренная картина была бы неполной,
способствуют апротонные растворители с высо-
если бы не была отмечена еще одна очевидная за-
ким значением диэлектрической проницаемости.
кономерность влияния природы растворителя на
Характер влияния протонсодержащих раствори-
скорость редокс-изомерии карбокатионов, а имен-
телей EtOH, Diox-H2O, способных образовывать
но ее снижение в приведенном ряду растворителей
водородные связи и с окисляемым веществом и
симбатно увеличению их диэлектрической прони-
с окислителем, на скорость процесса более слож-
цаемости, что эквивалентно увеличению в этом же
ный. Все это подчеркивает принципиальное от-
ряду свободной энергии неспецифической сольва-
личие между закономерностями окисления ме-
тации, стабилизирующей карбокатион, которую
таллокомплексных соединений, протекающего с
можно оценить по уравнению (1) [10].
разделением зарядов, и редокс-изомерии карбо-
катионов, сопровождаемой сменой носителя по-
(1)
ложительного заряда, хотя и приводящих в обоих
где r - радиус иона.
случаях к образованию одного и того же продукта
Наблюдаемую симбатность проявления эффек-
реакции - катиона ферроцения.
тов специфической и неспецифической сольвата-
Как уже отмечалось выше, связанный в ком-
ции карбокатионов в процессе их редокс-изоме-
плекс с исходным соединением ферроценилкарбе-
рии в одном ряду растворителей следует, видимо,
ниевый ион теряет свою способность к редокс-и-
рассматривать не как случайное совпадение, а как
зомерии. Это позволяет предположить, что по
закономерность, свойственную процессу прото-
мере увеличения концентрации металлокомплекса
нирования производных ферроцена с различными
и вероятности его координации с карбокатионом
функциональными группами в целом.
в условиях, когда задаваемая концентрация НХ
мала и постоянна, следует ожидать сначала увели-
Если предположить, что процесс редокс-изоме-
чения скорости накопления катиона ферроцения, в
рии ферроценилкарбениевых ионов протекает по
соответствии с основным постулатом химической
механизму внешнесферного переноса электрона,
кинетики, а затем, после достижения некоторого
то с общих позиций при оценке их реакционной
максимума, ее снижения вследствие дезактивации
способности необходимо учитывать факторы,
карбокатиона. Данное предположение, действи-
влияющие на свободную энергию активации этой
тельно, было подтверждено при протонировании
стадии, т. е. значения ΔrG≠. Согласно работе [11],
не только соединения
1, но и соединений 2 и 3,
величина ΔrG≠ включает следующие составляю-
отличающихся свойствами протонируемых функ-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
900
ФОМИН и др.
Схема 2.
E + S
K ESk2
E + P
S
Ks
Ek2
ES
2
влияя тем самым на форму экстремальной зависи-
c(HClO4
ɦɨɥɶ ɥ
мости, которая может быть симметричной (β = 0)
и асимметричной (β > 0).
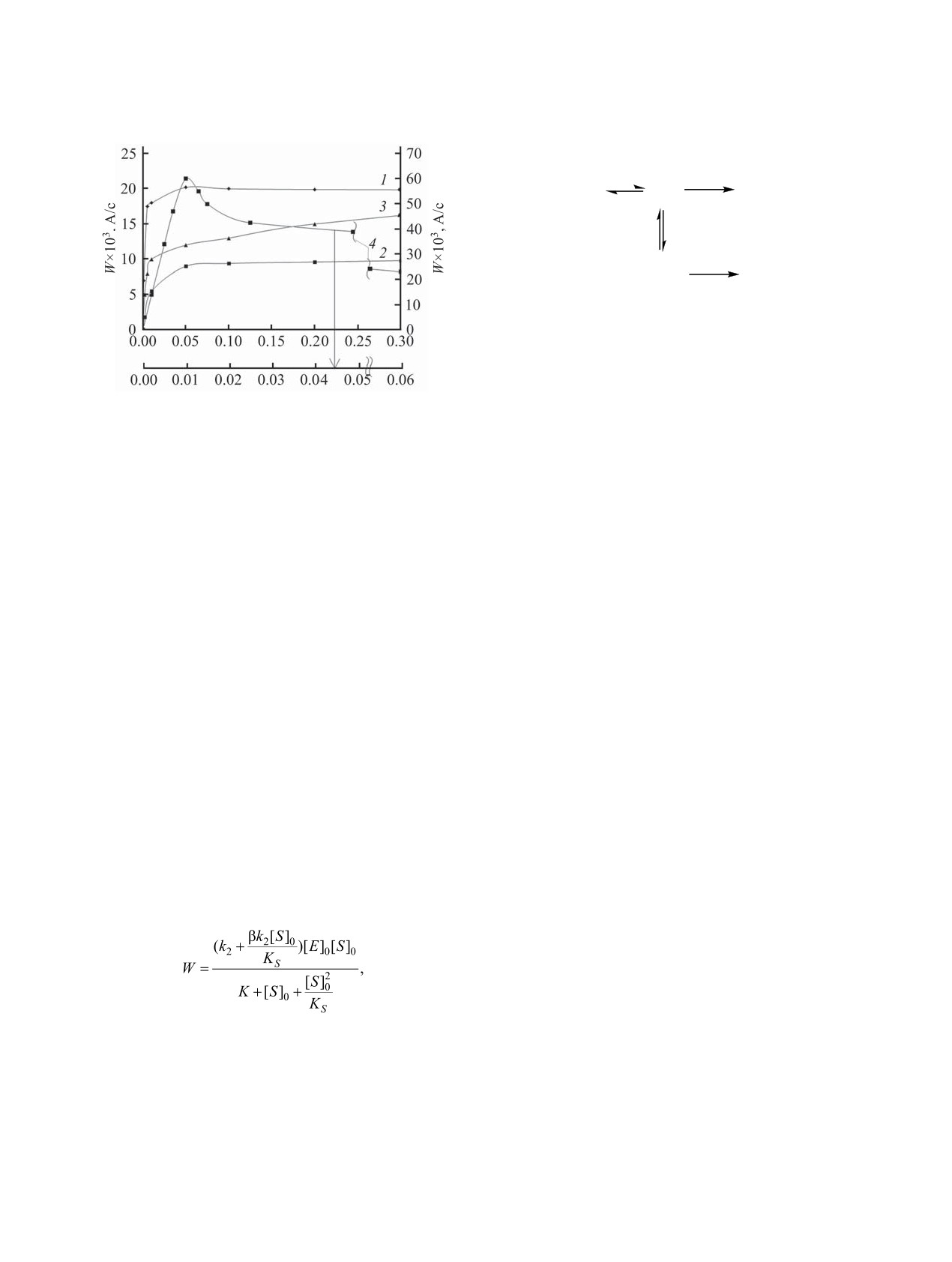
Рис. 4. Зависимость скорости накопления катиона фер-
В соответствии с работой [13], различие в
роцения от концентрации кислоты при протонировании
симметрии полученных зависимостей WFc+
=
соединений 1-4 (1-4) в диоксане. c01-4 = 0.001 M.
f([complex]0) для соединений 1-3 свидетельству-
циональных групп и составом образующихся
ет о разной степени стабилизации карбокатионов
карбокатионов (рис. 4). Из приведенного рисунка
в координационных комплексах, FcC+O·FcCOOH,
видно, что установленные экстремальные зави-
FcC+(OH)CH3·FcCOCH3, по причине различий в
симости для указанных соединений отличаются
донорных и акцепторных свойствах взаимодей-
друг от друга своей симметричностью. Для сое-
ствующих партнеров и их стерической располо-
динения 1 восходящая и нисходящая ветви кривой
женности к взаимодействию, а также возможности
практически симметричны, для соединений 2 и 3
их существования в виде вырожденного равно-
ниспадающая ветвь является более пологой, чем
весия двух структур, как это предполагается для
восходящая.
комплекса FcC+H2·FcCH2OH [4], и, как следствие
этого, их разной реакционной способности. Это
Стабилизацию карбокатионов за счет их ко-
говорит о необходимости учета коэффициента β в
ординации с исходным соединением и ее кине-
константе скорости изомерного превращения ко-
тическое проявление в виде приведенных экстре-
ординационных комплексов при анализе схем про-
мальных зависимостей можно уподобить явлению
тонирования соединений 2 и 3.
субстратного ингибирования ферментативных
реакций при увеличении концентрации субстрата
Результаты изучения кинетики накопления ка-
S, обусловленному образованием менее активного
тиона ферроцения при протонировании соедине-
фермент-субстратного комплекса ES2 из более ак-
ний 1-4 в зависимости от концентрации кислоты
тивного ES (схема 2) [13].
говорят о том, что для соединений 1-3 при увели-
чении концентрации кислоты скорость редокс-и-
Результатом субстратного ингибирования так-
зомерии увеличивается, стремясь к предельному
же является экстремальная зависимость началь-
ной скорости реакции от концентрации [S]0, опи-
значению WFe+max, в то время как для соединения
сываемая уравнением (2).
4 эта зависимость является экстремальной и асси-
метричной по форме (рис. 3). Причина такой ано-
малии заключается, по всей видимости, в том, что
(2)
при увеличении концентрации кислоты в соеди-
нении 4 последовательно протонируются сначала
одна, потом другая ацетильные группы [14], а об-
- константы равновесия стадий диссо-
где K и KS
разующийся при этом дикарбокатион уже не скло-
циации фермент-субстратных комплексов ES и
нен к редокс-изомерии. В пользу этого говорит тот
ES2
соответственно.
факт, что в электронном спектре реакционной сме-
Коэффициент β, который может изменяться
си фиксируется полоса поглощения только одно-
в пределах 0 ≤ β < 1 характеризует способность
го катиона ферроцения с λmax = 648 нм при любой
комплекса ES2 превращаться в продукты реакции,
концентрации кислоты.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
ПРОТОНИРОВАНИЕ ПРОИЗВОДНЫХ ФЕРРОЦЕНА
901
На основании полученных результатов рассмо-
нию максимальной скорости реакции WFe+max, что
трим схемы протонирования соединений 1-4 при
и наблюдается в действительности.
различном соотношении начальных концентра-
(7)
ций металлокомплексов и кислоты с целью их по-
В схему 3 можно ввести реакцию (3.3'), основ-
следующего кинетического анализа и получения
ное отличие которой от реакции (3.4) заключается
кинетических уравнений, которые бы адекватно
в том, что редокс-изомерия карбокатиона и обра-
описывали экспериментально установленные за-
зование связи С-С могут происходить синхронно
висимости скорости редокс-изомерии от концен-
и энергия, выделяющаяся при образовании ди-
трации реагентов.
мерного продукта, может быть использована для
Анализ схем протонирования целесообразно
компенсации затрат энергии, необходимой для
начать с протонирования соединения 1 (схема 3),
редокс-превращения карбокатиона, в то время как
для которого однозначно установлено образование
в реакции (3.4) такая компенсация исключена. Ки-
карбокатиона FcC+H2 и возможность его стаби-
нетический анализ схемы 3 с учетом реакции (3.3')
лизации путем координации с исходным соеди-
не приводит к принципиальному изменению ки-
нением. В схеме, как и во всех последующих, не
нетического уравнения (5), кроме появления в его
рассматривается стадия образования в качестве
числителе множителя 2. Вопрос о возможности
промежуточных продуктов оксониевых ионов при
протекания реакции (3.3') остается открытым.
первичном взаимодействии металлокомплекса с
протоном, константа равновесия которой автома-
(3.3')
тически входит в значение K стадии (3.1)
Уравнения, аналогичные уравнениям (5), (6) и
Схема 3.
(7), справедливы для описания процессов прото-
(3.1)
нирования соединений 2 и 3 в идентичных усло-
виях. Применительно к соединению 3 концентра-
(3.2)
ция воды в знаменателе уравнений должна быть
замена на единицу: [FcCH2OH] >> [H+]0, в мате-
(3.3)
риальном балансе по кислоте учитывается концен-
(3.4)
трация комплекса FcC+H2∙FcCH2OH, образующе-
гося на стадии (3.2):
[H+] >> [FcCH2OH], стадия (3.2) не учитывается;
[H+]0 = [H+] + [FcC+H2] + [FcC+H2∙ FcCH2OH]
[FcCH2OH]0=[FcCH2OH]+[FcC+H2]
= [H+] + [FcC+H2] + Ka[FcC+H2∙ FcCH2OH]
Концентрацию FcC+H2 можно найти из выра-
Как и в первом случае, равновесную концентра-
жения для константы равновесия стадии (3.1)
цию FcC+H2 найдем из выражения для константы
(4)
равновесия K (8).
(8)
Тогда выражение для скорости накопления ка-
тиона ферроцения принимает следующий вид:
При небольших концентрациях соединения
(5)
1 уравнение (9) принимает вид, симметричный
уравнению (10).
При малых концентрациях кислоты уравнение
(9)
(5) преобразуется в уравнение (6), отвечающее
первому порядку процесса по концентрации каж-
дого из реагентов и отрицательному первому по
(10)
концентрации воды.
При больших концентрациях соединения 1 оно
(6)
переходит в уравнение минус первого порядка по
металлокомплексу, характеризуя ниспадающую
При больших концентрациях НХ оно переходит
ветвь наблюдаемой экстремальной зависимости
в уравнение (7), которое соответствует достиже-
WFc+ = f([FcCH2OH]0).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
902
ФОМИН и др.
Выражения для материального баланса по кис-
лоте и концентрации FcC+O будут аналогичны
выражениям, которые были использованы при вы-
воде уравнения (9). В результате получим выраже-
ние (13).
Полученное уравнение (13) аналогично уравне-
нию (2), описывающему асимметричную зависи-
мость W = f[S]0 для случая субстратного ингибиро-
c Ɇ. ɦɨɥɶ ɥ
вания ферментативных реакций, когда β > 0 [14].
При больших концентрациях FcCOOH урав-
нение (13) трансформируется в уравнение (14),
Рис. 5. Зависимость скорости накопления катиона
ферроцения от концентрации металлокомплекса при
которое отличается от уравнения (11) и описыва-
протонировании соединений 1-4 (1-4) в диоксане.
ет другой вид ниспадающей ветви зависимости
c0HX = 0.001 M.
WFc+ = f([FcCOOH]0).
(11)
(14)
В противоположность соединению 1 асимме-
тричный характер экстремальных зависимостей
Как уже было отмечено выше, появление экс-
WFc+ = f([FcCOOH]0) и WFc+ = f([FcCOCH3]0) при
тремальной зависимости WFc+ = f([H+]0) для сое-
невысоком фиксированном значении концентра-
динения 4 обусловлено другой причиной, нежели
ции кислоты (c0HX = 0.001 M.) (рис. 4) говорит о
для рассмотренных выше экстремальных зависи-
необходимости учета стадий редокс-изомерии ко-
мостей WFc+ = f([MK]0). Это отражено в схеме 5,
ординированных карбокатионов FcC+O∙FcCOOH
включающей стадии последовательного протони-
и FcC+(OH)CH3∙FcCOCH3 с константами скоро-
рования обеих ацетильных групп, которое приво-
стей βk3 < k3 и βk'3 < k'3 в схемах протонирования
дит к образованию дикарбокатиона, неспособного
указанных соединений и их анализе, что и было
к редокс-изомерии вследствие значительного воз-
сделано на примере соединения 2 (схема 4).
растания потенциала ионизации и, соответствен-
Схема 4.
но стандартного редокс-потенциала атома железа.
(4.1)
Для удобства написания и описания схемы введем
обозначение 4≡FcX2.
(4.2)
Схема 5.
(4.3)
(5.1)
(4.4)
(5.2)
Наличие стадии (4.4) в схеме 4 и отсутствие
аналогичной стадии в схеме 3 говорит о том, что
(5.3)
реакционная способность координационных ком-
(5.4)
плексов может существенно отличаться. В соот-
ветствии со схемой 4, выражение для скорости
(5.5)
накопления катиона ферроцения будет иметь сле-
Стадия (5.2) учитывает возможность взаимо-
дующий вид (12).
действия образовавшегося карбокатиона с атомом
кислорода второй ацетильной группы, приводяще-
го к его стабилизации, что, тем не менее, не лиша-
ет его способности к редокс-изомерии. При этом
следует иметь в виду, что протонирование второй
(12)
ацетильной группы должно протекать значительно
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
ПРОТОНИРОВАНИЕ ПРОИЗВОДНЫХ ФЕРРОЦЕНА
903
труднее (K1 > K3), и, соответственно, медленнее,
му результату, то, по своей сути, он представляет
чем первой, и осуществляться при достаточно вы-
собой весьма необычный способ их окисления до
соких концентрациях кислоты, что и обусловлива-
катионов ферроцения кислотами, парадоксаль-
ет, по-видимому, большую протяженность ниспа-
ность которого заключается в том, что стандарт-
дающей ветви зависимости WFc+ = f([H+]0) (рис. 5).
ные редокс-потенциалы окисляемых соединений
являются существенно более высокими (≥0.6 B),
чем окислителя-протона, для которого этот потен-
циал равен нулю. Можно отметить, по крайней
(15)
мере, две причины, способствующие в конечном
Выражение для материального баланса по кон-
счете окислению производных ферроцена с раз-
центрации соединения НХ может быть представ-
личными функциональными группами при их
лено соотношением (16).
протонировании кислотами: (1) протон выступает
в роли не одноэлектронного окислителя, а акцеп-
тора электронной пары, локализованной на атоме
кислорода функциональной группы, и потому по-
(16)
сле образования донорно-акцепторной связи вхо-
Используя это соотношение, найдем выраже-
дит в состав конечных продуктов реакции - воды
ние для равновесной концентрации карбокатиона
или гидроксидных групп; (2) многостадийность
FcXX+.
механизма окисления, в котором затраты энер-
гии, необходимые для протекания одних реак-
(17)
ций, компенсируются энергией выделяющихся на
других. Наиболее выигрышной стадией, протека-
Подставляя его в уравнение (15), получим урав-
ющей с выделением энергии, является образова-
нение (18) зависимости скорости накопления ка-
ние оксониевых соединений вследствие высокого
)
при
тиона ферроцения Fc+C·(OH)CH3(COCH3
сродства к протону гидроксильных, карбониль-
изменении концентрации кислоты в широком ди-
ных и карбоксильных групп, которое даже выше,
апазоне.
чем сродство воды к протону, которое составляет
-170 ккал/моль [15, 16], и именно эта стадия опре-
(18)
деляет конечный результат процесса.
Из уравнения (18) следует, что при низких
Следует отметить, что протон все-таки может
концентрациях кислоты скорость реакции будет
выступать в роли одноэлектронного окислителя
линейно увеличиваться с ростом последней, при
ферроценовой системы. Это было установлено на
высоких - закономерно уменьшаться после дости-
примере протонирования 1,1-ферроцефана, проте-
жения максимума.
кающего по атому металла и сопровождающегося
выделением водорода. Основной причиной легко-
На основании вышеизложенного можно сде-
го окисления этого соединения является простран-
лать вывод о том, что редокс-изомерия карбо-
ственная сближенность двух присоединившихся
катионов, образующихся при протонировании
протонов и возможность их отщепления в виде H2
производных ферроцена с различными функци-
[17].
ональными группами, является одним из фунда-
ментальных свойств ферроцена, подчиняющимся
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
определенным кинетическим закономерностям. С
Электронные спектры поглощения снимали на
высокой степенью вероятности можно ожидать,
спектрометре ShimadzuUV-1800 в области 200-
что эти закономерности в том или ином виде будут
1100 нм в атмосфере аргона с использованием
проявляться при окислении производных ферро-
кварцевых кювет (l = 10 мм). Работу проводили в
цена окислительными системами, содержащими
спектральном режиме, который предполагает ска-
кислоту.
нирование по длине волны с последующей обра-
Если же рассматривать процесс протонирова-
боткой спектра (определение положения максиму-
ния производных ферроцена по своему конечно-
мов и минимумов, расчет интенсивности полосы
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
904
ФОМИН и др.
поглощения, арифметические операции). Исполь-
7. Фомин В.М., Широков А.Е. // ЖОХ. 2008. Т. 78.
зованные растворители имели квалификацию ХЧ
Вып. 7. С. 1125; Fomin V.M., Shirokov A.E. // Russ. J.
и ЧДА и дополнительной очистке не подвергались.
Gen. Chem. 2008. Vol. 78. N 7. P. 1361. doi 10.1134/
S107036320807013X
КОНФЛИКТ ИНТЕРЕСОВ
8. Фомин В.М., Широков А.Е. // ЖОХ. 2012. Т. 82.
Авторы заявляют об отсутствии конфликта ин-
Вып. 6. С. 921; FominV.M., Shirokov A.E. // Russ. J.
тересов.
Gen. Chem. 2012. Vol. 82. N 6. P. 1080. doi 10.1134/
БЛАГОДАРНОСТЬ
S1070363212060072
9. Фомин В.М., Орлова Е.А., Зайцева К.С. // ЖОХ.
Авторы выражают благодарность ООО
«Синор» за предоставленные образцы исследуе-
2014. Т. 84. Вып. 4. С. 645; Fomin V.M., Orlova E.A.,
Zaitseva K.S. // Russ. J. Gen. Chem. 2014. Vol. 84. N 4.
мых соединений.
P. 722. doi 10.1134/S1070363214040215
СПИСОК ЛИТЕРАТУРЫ
10. Бетел Д., Голд В. Карбониевые ионы. М.: Мир, 1970.
1. Методы элементоорганической химии. Железоорга-
344 с.
нические соединения / Под ред. А.Н. Несмеянова,
11. Шрейвер Д., Эткинс П. Неорганическая химия. М.:
К.А. Кочеткова. М.: Наука, 1983. 544 с.
Мир, 2004. Т. 2. C. 78.
2. Rinehart K.L., Jr., Michejda C.J., Kittle P.A. // J.
12. Фомин В.М., Волкова А.Н. // ЖОХ. 2013. Т. 83.
Am. Chem. Soc. 1959. Vol. 81. P. 3162. doi 10.1021/
Вып. 5. С. 813; Fomin V.M., Volkova A.N. // Rus. J.
ja01521a082
Gen. Chem. 2013. Vol. 83. N 5. P. 949. doi 10.1134/
3. Фомин В.М., Зайцева К.С., Шарова М.Н. // ЖОХ.
S1070363213050125
2016. Т. 86. Вып. 5. С. 815; Fomin V.M., Zaitseva K.S.,
13. Фомин В.М., Кочеткова К.С., Галкина М.С. // ЖФХ.
Sharova M.N. // Russ. J. Gen. Chem. 2016. Vol. 86.
2017. Т. 91. № 7. С. 1186; Fomin V.M., Kochetkova
N 5. P.1077. doi 10.1134/S1070363216050169
K.S., Galkina M.S. // Russ. J. Phys. Chem. (A). 2017.
4. Фомин В.М., Кочеткова K.С., Ключевский К.В. //
Vol. 91. P. 1285. doi 10.1134/S0036024417070111
ЖОХ. 2018. Т. 88. Вып. 5. С. 805; Fomin V.M.,
14. Березин И.В., Мартинек К. Основы физической хи-
Kochetkova K.S., Klyuchevskii K.V. // Russ. J. Gen.
мии ферментативного катализа. М.: ВШ, 1977. 235 с.
Chem. 2018. Vol. 88. N 5. P. 948. doi 10.1134/
S1070363218050183
15. Белл Р. Протон в химии. М.: Мир, 1977. С. 27.
5. Weinmayr V. // J. Am. Chem. Soc. 1955. Vol. 77.
16. Энергии разрыва химических связей. Потенциа-
P. 3009. doi 10.1021/ja01616a026
лы ионизации и сродство к электрону / Под ред.
В.Н. Кондратьева. М.: Наука, 1974. С. 333.
6. Фомин В.М., Широков А.Е. // ЖОХ. 2009. Т. 89.
Вып. 5. С. 756; Fomin V.M., Shirokov A.E. // Russ. J.
17. Bitterwolf T.E., Ling A.C. // J. Organometal.
Gen. Chem. 2009. Vol. 79. N 5. P. 928. doi 10.1134/
Chem. 1972. Vol. 40. P. 29. doi 10.1016/S0022-
S1070363209050119
328X(00)86974-0
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
ПРОТОНИРОВАНИЕ ПРОИЗВОДНЫХ ФЕРРОЦЕНА
905
Protonation of Ferrocene Derivatives with Strong Acids.
Kinetic Relationships of the Redox Isomerism
of Ferrocenyl Carbenium Ions
V. M. Fomin*, A. V. Markin, and N. N. Shuklina
N.I. Lobachevsky Nizhny Novgorod State University, Nizhny Novgorod, 603950 Russia
*e-mail: niih325@bk.ru
Received January 10, 2020; revised January 10, 2020; accepted January 16, 2020
The kinetics of redox isomerisation of ferrocenylcarbenium ions obtained by protonation of ferrocene derivatives
with chloric acid in dioxane was studied by the electron spectroscopy method for accumulation of ferrocenium
cations. It is shown that the nature of the dependences of the rate of accumulation of ferrocenium cation on the
concentration of reagents having in some cases an extreme form is determined by the nature of metal complexes
and the ratio of initial concentrations of metal complex and acid. Stabilization of carbocations through their
salvation with solvents such as acetonitrile, DMF and DMSO, as well as through coordination with the parent
compound, leads to a partial or complete loss of their ability to redox isomerisation. Protonation schemes of
metal complexes and results of their kinetic analysis confirming the obtained concentration dependencies are
given.
Keywords: ferrocene derivatives, protonation, ferrocenylcarbenium ion, redox isomerism, ferrocenium cation,
solvation
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020