ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 6, с. 919-928
УДК 542.61 546.65/66
ЭКСТРАКЦИЯ U(VI), Th(IV) И РЗЭ(III) ОКСИДОМ
{[2-(2-ДИФЕНИЛФОСФОРИЛ)-4-ЭТИЛФЕНОКСИ]-
ЭТИЛ}ДИФЕНИЛФОСФИНА ИЗ АЗОТНОКИСЛЫХ
РАСТВОРОВ
© 2020 г. А. Н. Турановa,*, В. К. Карандашевb, Д. В. Баулинc, В. Е. Баулинd
a Институт физики твердого тела Российской академии наук, Черноголовка,
ул. Академика Осипьяна 2, 142432 Россия
b Институт проблем технологии микроэлектроники и особо чистых материалов Российской академии наук,
Черноголовка, 142432 Россия
с Институт физической химии и электрохимии имени А. Н. Фрумкина Российской академии наук,
Москва, 119991 Россия
d Институт физиологически активных веществ Российской академии наук, Черноголовка, 142432 Россия
*e-mail: turanov@issp.ac.ru
Поступило в Редакцию 4 февраля 2020 г.
После доработки 4 февраля 2020 г.
Принято к печати 16 февраля 2020 г.
Синтезирован новый экстрагент - оксид {[2-(2-дифенилфосфорил)-4-этилфенокси]этил}дифенилфосфина.
Изучена экстракция HNO3 и ионов U(VI), Th(IV) и РЗЭ(III) из азотнокислых растворов растворами этого
соединения в 1,2-дихлорэтане и ионной жидкости - бис[(трифторметил)сульфонил]имиде 1-бутил-3-
метилимидазолия. Определена стехиометрия экстрагируемых комплексов, рассмотрено влияние стро-
ения экстрагента и концентрации HNO3 в водной фазе на эффективность извлечения ионов металлов в
органическую фазу. Показано, что эффективность экстракции значительно увеличивается в присутствии
ионной жидкости в органической фазе.
Ключевые слова: фосфорилподанды, экстракция, редкоземельные элементы, ионные жидкости
DOI: 10.31857/S0044460X20060121
Экстракционные методы широко используются
ционной жесткости молекулы, а также природы
для извлечения и концентрирования и разделения
заместителя при атомах фосфора [12-14]. Среди
актинидов и редкоземельных элементов (РЗЭ) в
известных фосфорилсодержащих подандов про-
азотнокислых средах
[1]. Высокой экстракци-
изводные оксида
{2-[(дифенилфосфорил)мет-
онной способностью по отношению к этим эле-
окси]фенил}дифенилфосфина 2 (схема 1) обла-
ментам обладают полидентатные нейтральные
дают высокой экстракционной способностью по
фосфорорганические соединения
[2,
3], среди
отношению к ионам актинидов и РЗЭ(III) [14],
которых наиболее детально изучены замещенные
превосходя таковую оксидов (диалкилкарбамоил-
диоксиды метилендифосфинов [4], оксиды (диал-
метил)диарилфосфинов. Замена фенильных заме-
килкарбамоилметил)диарилфосфинов [5], а также
стителей при фосфорильных группах на п-толиль-
ациклические аналоги краун-эфиров - поданды
ные или бутильные приводит, соответственно, к
с амидными [6-11] или фосфорильными [12-14]
повышению или резкому снижению экстракци-
концевыми группами.
онной способности по отношению к актинидам
Экстракционная способность и селективность
и РЗЭ в азотнокислых средах [14], что связано
фосфорилсодержащих подандов существенно
с проявлением эффекта аномального арильно-
зависит от длины полиэфирной цепи, конформа-
го упрочнения экстрагируемых комплексов [15].
919
920
ТУРАНОВ и др.
Схема 1.
O
O
Ph
Ph
n
P
O
n
O
P
Ph
Ph
O
O
R
P
P
Ph
Ph
Ph Ph
1 4
5 7
R = H, n = 0 (1), 1 (2), 3 (3); R = Et, n = 2 (4, 6), 1 (5), 3 (7).
Причины этого эффекта неоднократно обсужда-
влияния ионной жидкости - бис[(трифторметил)-
лись в литературе [16-18]. Введение этильного за-
сульфонил]имида
1-бутил-3-метилимидазолия
местителя в положение 4 фениленового фрагмента
(C4mimTf2N) - на экстракцию ионов металлов из
оксида
{2-[(дифенилфосфорил)метокси]фенил}-
растворов HNO3 оксидом {[2-(2-дифенилфосфо-
дифенилфосфина приводит к повышению раство-
рил)-4-этилфенокси]этил}дифенилфосфина 4.
римости реагента в органических растворителях
Не описанный в литературе оксид [2-(2-дифе-
и снижению перехода экстрагента в водную фазу
нилфосфорил)-4-этилфенокси)этил]дифенилфос-
[19], однако мало влияет на изменение его экстрак-
фина 4 был синтезирован по 3-стадийной схеме 2.
ционной способности по отношению к РЗЭ(III).
Взаимодействие оксида (5-этил-2-оксифенил)ди-
Влияние конформационной жесткости и длины
фенилфосфина с этиленхлоргидрином в запаянной
алкиленового мостика между фенольным атомом
ампуле при соотношении реагентов 1:1 и темпера-
кислорода и СН2Р(О) для структурных аналогов
туре 100-120°С в течение 12 ч дает соединение 4а,
фосфина 2 изучено в значительно меньшей степе-
кипячением которого с пятихлористым фосфором
ни [20].
синтезировано хлорпроизводное 4б. Реакция по-
В последнее время возрос интерес к исполь-
следнего с триметилсилиловым эфиром дифенил-
зованию ионных жидкостей в процессах экстрак-
фосфинистой кислоты, который генерировался в
ционного концентрирования и разделения орга-
реакционной среде из дифенилфосфинистой кис-
нических и неорганических соединений [21-24].
лоты и гексаметилдисилазана, c высоким выходом
Экстракция актинидов и РЗЭ(III) бидентаными
дает целевое соединение 4.
нейтральными фосфорорганическими соедине-
Поскольку процесс экстракции ионов металлов
ниями [25-27] и замещенными дигликольамида-
из азотнокислых растворов нейтральными фосфо-
ми [28-30] значительно возрастает в присутствии
рорганическими соединениями сопровождается
ионных жидкостей - бис[(трифторметил)сульфо-
взаимодействием HNO3 с экстрагентом, предвари-
нил]имидов 1-алкил-3-метилимидазолиев. В таких
тельно исследована экстракция HNO3 раствором
системах для количественного извлечения РЗЭ(III)
соединения 4. Данные по распределению HNO3
не требуется значительного избытка ионов NO3- в
между ее водными растворами и раствором со-
водной фазе, что является условием экстракции
единения 4 в дихлорэтане указывают на то, что
этими экстрагентами в традиционных органиче-
при [HNO3] > 2 моль/л отношение концентрации
ских растворителях. Влияние ионных жидкостей
HNO3, связанной в комплексы с экстрагентом, и
на экстракцию ионов металлов в системах с фос-
исходной концентрации экстрагента в органиче-
форилсодержащих подандов изучено в значитель-
ской фазе превышает 1.
но меньшей степени [31].
Полагая, что в органическую фазу переходят
Цель настоящей работы - исследование вли-
комплексы экстрагента (L) с одной и двумя мо-
яния структуры производных {2-[(дифенилфос-
лекулами азотной кислоты, процесс экстракции
форил)метокси]фенил}дифенилфосфина на их
HNO3 может быть описан уравнением (1).
экстракционную способность по отношению к
U(VI), Th(IV) и РЗЭ(III) в азотнокислых средах и
i(H+ + NO3-)(в) + L(o) ↔ (HNO3)iL(o),
(1)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
ЭКСТР
АКЦИЯ U(VI), Th(IV) И РЗЭ(III)
921
Схема 2.
OH
O
OH
O Cl
PCl
(1) NaH
5
O
O
O
(2) ClCH2CH2OH
P
P
P
Ph
Ph
Ph
Ph
Ph
Ph
CH3
CH
3
CH3
4a
4ɛ
Ph2P-OSiMe3
O
Ph
O P
Ph
O
P
Ph
Ph
CH
3
4
где символами (в) и (о) обозначены компонен-
групп экстрагента вследствие ослабления влияния
ты водной и органической фаз соответственно;
индукционного эффекта фосфорильных групп по
i = 1 и 2 - число молекул HNO3 в экстрагируемом
мере увеличения длины алкиленового мостика
сольвате.
между ними.
Эффективные константы экстракции HNO3 (K1
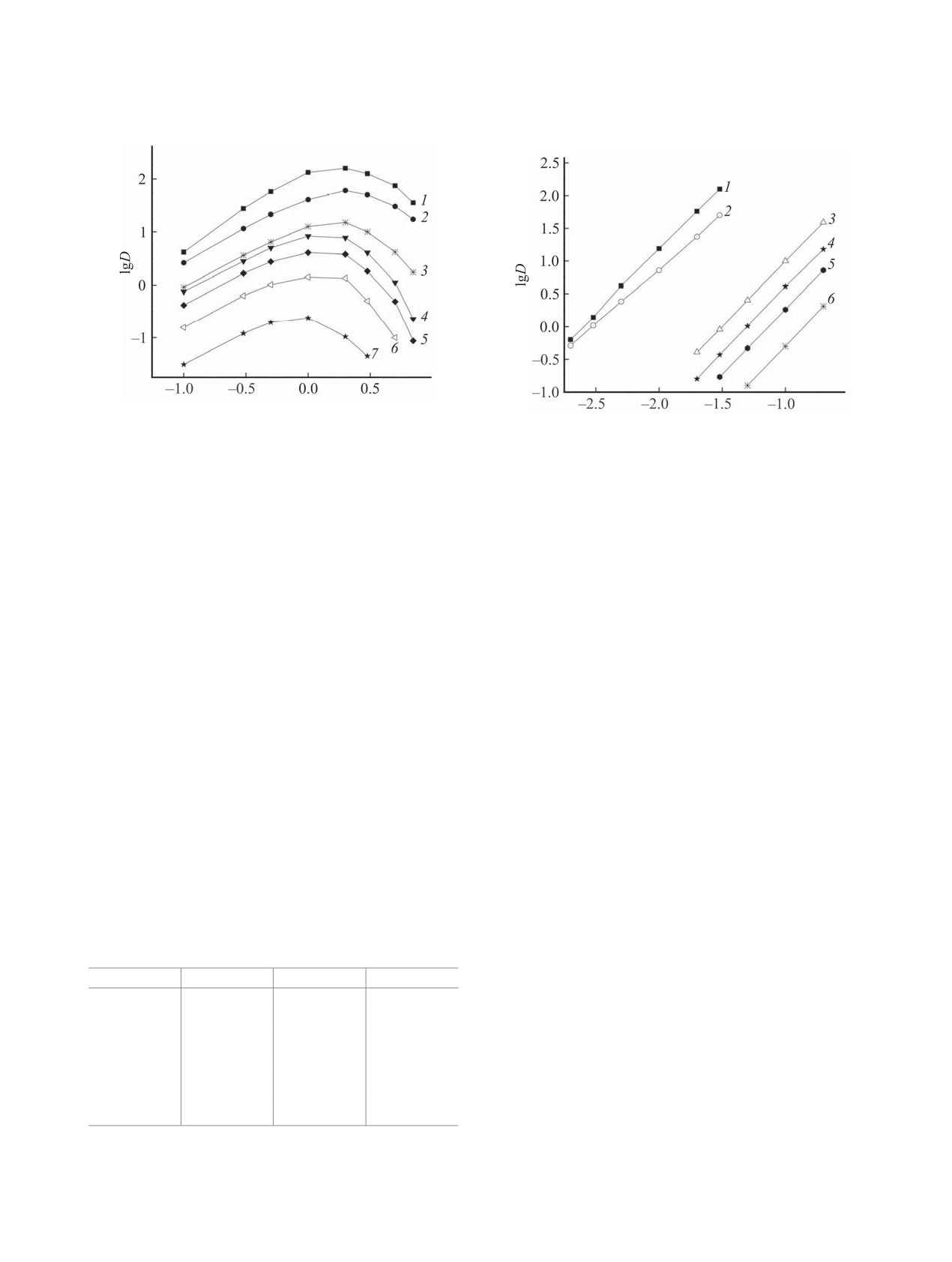
Рассмотрено влияние концентрации HNO3 в
и K2) описываются выражением (2).
равновесной водной фазе на изменение коэффици-
Ki = [(HNO3)iL]/([L]ai),
(2)
ентов распределения U(VI), Th(IV) и РЗЭ(III) при
экстракции раствором соединения 4 в дихлорэта-
где a - активность HNO3 в равновесной водной
не (рис. 1). При экстракции этих ионов получены
фазе, a = [H+][NO3-]γ±2; [L] - равновесная концен-
зависимости коэффициентов распределения (D) от
трация свободного экстрагента в органической
концентрации HNO3 с максимумом, что связано с
фазе. Значения K1 и K2, рассчитанные нелинейным
высаливающим действием ионов NO3- и связыва-
методом наименьших квадратов с использовани-
нием экстрагента азотной кислотой. В случае экс-
ем уравнения (3), приведены в табл. 1. Там же для
тракции РЗЭ(III) положение максимума на кривой
сравнения приведены значения K1 и K2 для соеди-
зависимости lgDLn-lg[HNO3] смещается в область
нения 2.
более высокой кислотности водной фазы по мере
y/[L](исх) = (K1a + 2K2a2)/(1 + K1a + K2a2).
(3)
увеличения атомного номера (Z) РЗЭ, что связа-
Здесь y - общая концентрация комплексов HNO3 c
но с увеличением энергии гидратации ионов Ln3+
экстрагентом в органической фазе, [L](исх) - исход-
вследствие уменьшения их ионных радиусов с
ная концентрация экстрагента.
возрастанием Z. Это приводит к увеличению коэф-
Увеличение экстракционной способности сое-
фициента разделения Lu/La, βLu/La = DLu/DLa, с ро-
динения 4 по отношению к HNO3 может быть свя-
стом концентрации HNO3 (рис. 1). Аналогичный
зано с увеличением расстояния между фосфориль-
характер зависимостей DLn-[HNO3] отмечался при
ными группами молекулы экстрагента. Увеличение
Таблица 1. Эффективные константы экстракции HNO3
констант экстракции HNO3 в ряду диоксидов те-
растворами соединений 2 и 4 в дихлорэтане
трафенилалкилендифосфинов по мере увеличения
длины алкиленового мостика между Р(О)-группа-
Соединение
K1
K2
2
2.70 [12]
0.23 [12]
ми отмечалось ранее [32] и было объяснено увели-
4
3.71±0.06
0.38±0.005
чением донорной способности координирующих
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
922
ТУРАНОВ и др.
lg[HNO3]
lg[L]
Рис. 1. Зависимость коэффициентов распределения
Th(IV) (1), U(VI) (2), Lu(III) (3), Tb(III) (4), Eu(III) (5),
Рис. 2. Зависимость коэффициентов распределения
Nd(III) (6) и La(III) (7) от концентрации HNO3 в рав-
Th(IV) (1), U(VI) (2), Lu(III) (3), Tb(III) (4), Eu(III) (5)
новесной водной фазе при экстракции растворами 0.1
и Nd(III) (6) от концентрации соединения 4 в дихлорэ-
(3-7) и 0.03 моль/л (1, 2) соединения 4 в дихлорэтане.
тане при экстракции из раствора 3 моль/л HNO3.
экстракции РЗЭ(III) растворами соединения 2 в
соединением 4 в виде смеси моно- и дисольватов,
виде координационно-сольватированных нитратов
а ионов Th(IV) и РЗЭ(III) - в форме дисольватов.
[32]. При экстракции РЗЭ(III) соединением 4 из
В виде комплексов такой же стехиометрии эти
азотнокислых растворов наблюдается тенденция
ионы экстрагируются растворами соединения 2 в
увеличения эффективности экстракции РЗЭ(III) с
дихлорэтане [20, 33].
увеличением Z. Это связано с увеличением устой-
Исходя из полученных данных, процесс экс-
чивости комплексов РЗЭ(III) с жесткими по Пир-
тракции ионов РЗЭ(III) из растворов HNO3 соеди-
сону лигандами по мере увеличения плотности
нением 4 может быть описан уравнением (4).
заряда ионов Ln3+ вследствие уменьшения их ион-
Ln3+(в)+ 3NO3-(в)+ 2L(о) ↔ LnL2(NO3)3(о), K2Ln .
(4)
ных радиусов c возрастанием Z [33].
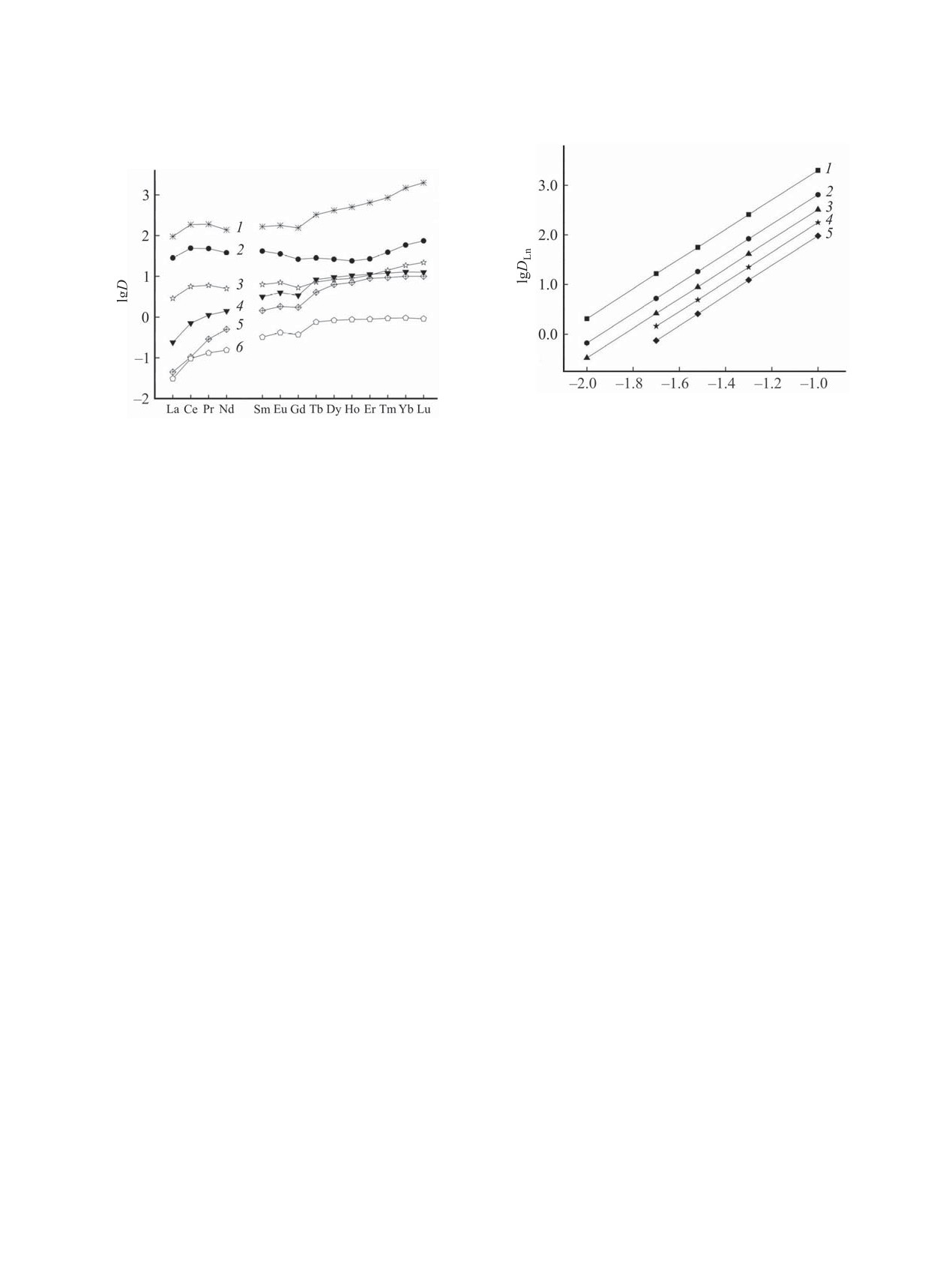
Эффективные константы экстракции РЗЭ(III)
Стехиометрическое соотношение металл-экс-
(K2Ln) рассчитаны нелинейным методом наимень-
трагент в экстрагируемых комплексах определено
ших квадратов с использованием уравнения (5).
методом сдвига равновесия. Угловой наклон за-
DLn = K2Ln[NO3-]3 γ±4[L]исх2f-2,
(5)
висимостей lgD-lg[L] равен 1.67±0.05, 1.97±0.05
где γ± - коэффициент активности соответствующе-
и 1.94±0.05 при экстракции ионов U(VI), Th(IV)
го нитрата РЗЭ(III) [35], f - поправка на связыва-
и РЗЭ(III) соответственно (рис. 2), что указывает
ние экстрагента азотной кислотой (f = 1 + K1a +
на экстракцию U(VI) из азотнокислых растворов
K2a2), и приведены в табл. 2. Там же для сравнения
приведены значения K2Ln для соединения 2. Можно
Таблица 2. Коэффициенты распределения U(VI) и
Th(IV) при экстракции из раствора 2 моль/л HNO3 рас-
видеть, что соединение 4 уступает соединению 2
творами 0.01 моль/л экстрагентов в дихлорэтане
по способности экстрагировать РЗЭ(III).
Экстрагент
lgDTh
lgDU
βTh/U
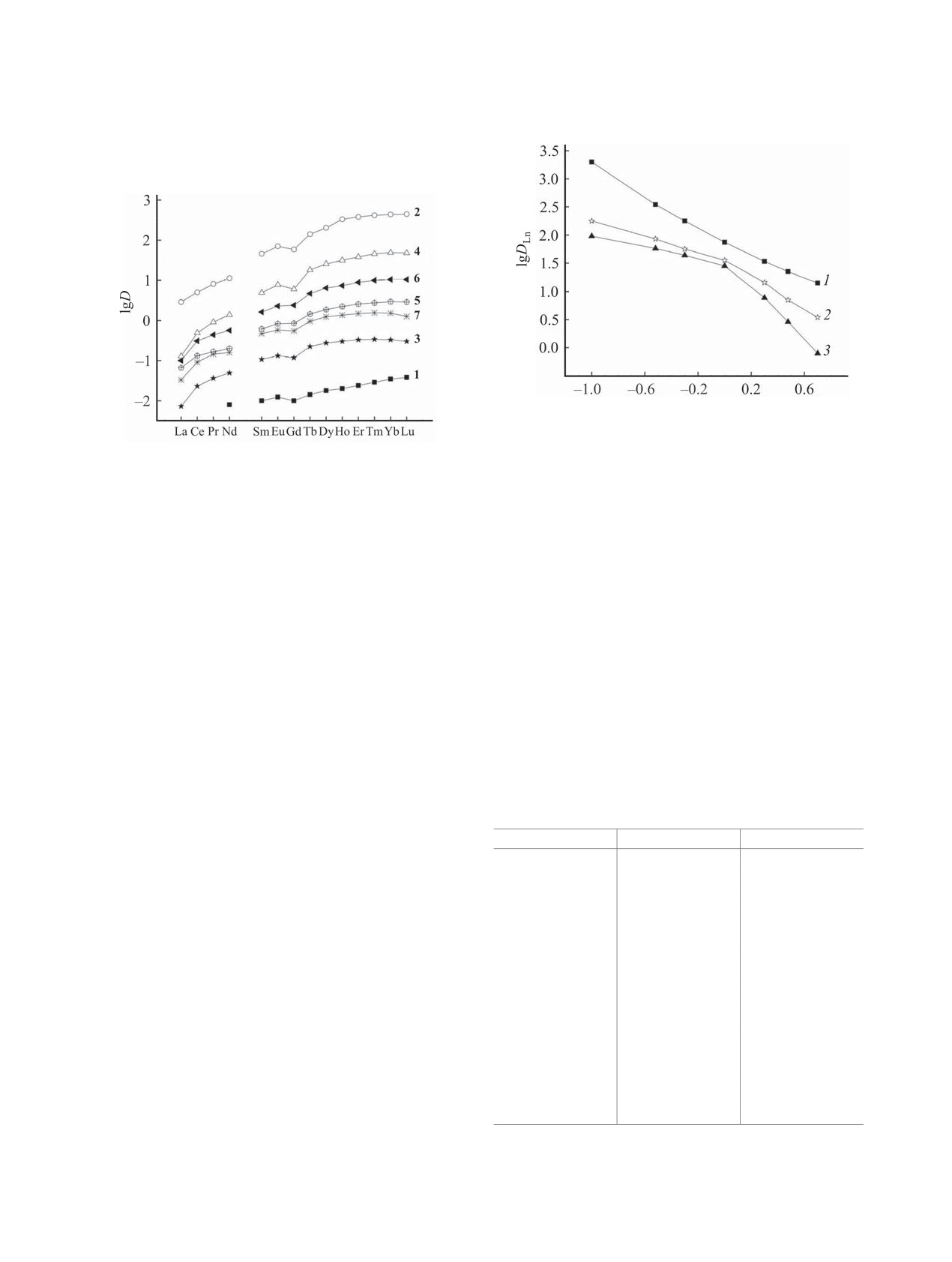
Влияние структуры фосфорилсодержащих по-
1 [20]
0.47
0.32
0.70
дандов 1-7 на эффективность экстракции РЗЭ(III)
2 [20]
0.84
2.82
95.5
из нитратных растворов рассмотрено путем сопо-
3 [20]
0.33
-1.42
0.02
ставления величин коэффициентов распределения
4
1.02
1.40
2.40
РЗЭ(III), определенных в одинаковых эксперимен-
5 [20]
0.51
1.25
5.50
тальных условиях (рис. 3). Данные для соедине-
6 [20]
0.75
1.13
2.40
ний 1-3 и 5-7 взяты из нашей предыдущей работы
7 [20]
0.85
-0.82
0.02
[14]. Из рассматриваемых соединений фосфинат 1
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
ЭКСТР
АКЦИЯ U(VI), Th(IV) И РЗЭ(III)
923
lg[HNO3]
Рис. 4. Зависимость коэффициентов распределения
Рис. 3. Экстракция РЗЭ(III) из растворов 4 моль/л
Lu(III) (1), Eu(III) (2) и La(III) (3) от концентрации
NH4NO3 растворами 0.01 моль/л соединений 1-7 в
HNO3 в равновесной водной фазе при экстракции рас-
дихлорэтане.
творами 0. 1 моль/л соединения 4 в ионной жидкости.
экстрагирует ионы РЗЭ(III) наименее эффективно,
нений 3 и 7 (n = 3) по отношению к Th(IV) даже
что связано ослаблением донорной способности
ниже, чем у фосфината 1. Экстракция U(VI) сое-
его фосфорильной группы по сравнению с соеди-
динениями 5-7 увеличивается по мере увеличения
нениями 2-7. Для соединений 2-4 с фениленовым
n в ряду 5 < 6 < 7. В ряду соединений 2-4 значе-
фрагментом значения DLn снижаются с увеличе-
ния DU изменяются немонотонно с увеличением n:
нием длины алкиленового мостика между фосфо-
набольшую экстракционную способность в ряду
этих фосфорилсодержащих подандов проявляет
рильной группой и эфирным атомом кислорода в
соединение 4 (n = 2). Селективность разделения
ряду 2 > 4 > 3. В ряду соединений 5-7 значения
тория и урана уменьшается с увеличением n для
DLn изменяются немонотонно с увеличением n:
соединений 2-4 и 5-7. При экстракции соединени-
набольшую экстракционную способность в ряду
ями 3 и 7 (n = 3) DU > DTh.
этих фосфорилсодержащих подандов проявляет
соединение 6 (n = 2). Сравнение значений DLn для
пар соединений 2 и 5, 4 и 6 показало, что соедине-
Таблица
3. Эффективные константы экстракции
РЗЭ(III) из растворов HNO3 растворами соединений 2
ния 2 и 4 с фениленовым фрагментом экстрагиру-
и 4 в дихлорэтане
ют РЗЭ(III) более эффективно, чем их структурные
Ln(III)
K2Ln (4)
K2Ln (2) [13]
аналоги 5 и 6 с этиленовым фрагментом. Однако
La(III)
5.27 ± 0.05
6.96
замена этиленового фрагмента в молекуле соеди-
Ce(III)
5.74 ± 0.05
7.16
нения 7 на фениленовый приводит к уменьшению
Pr(III)
5.95 ± 0.05
7.40
DLn для большинства РЗЭ(III) при экстракции сое-
Nd(III)
6.05 ± 0.06
7.68
динением 3 (рис. 3).
Sm(III)
6.43 ± 0.06
7.86
Для сравнения экстракционной способности
Eu(III)
6.47 ± 0.05
8.01
соединений 1-7 по отношению к U(VI) и Th(IV),
Gd(III)
6.38 ± 0.06
4.94
а также коэффициента разделения тория и урана
Tb(III)
6.72 ± 0.05
8.38
(βTh/U = DTh/DU) в табл. 3 представлены данные по
Dy(III)
6.80 ± 0.06
8.49
экстракции U(VI) и Th(IV) из азотнокислых рас-
Ho(III)
6.81 ± 0.05
8.58
творов в сопоставимых условиях. При экстракции
Er(III)
6.77 ± 0.07
8.66
Tm(III)
6.71 ± 0.05
8.64
ионов Th(IV) соединениями 2-4 и 5-7 значения
Yb(III)
6.71 ± 0.06
8.62
DTh снижаются с увеличением длины алкиленово-
Lu(III)
6.64 ± 0.05
8.62
го мостика (n). Эстракционная способность соеди-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
924
ТУРАНОВ и др.
lg[L]
Рис. 5. Экстракция РЗЭ(III) из растворов HNO3 раство-
Рис. 6. Зависимость коэффициентов распределения
рами 0.1 моль/л соединения 4 в ионной жидкости (1-3)
Lu(III) (1), Er(III) (2), Tb(III) (3), Eu(III) (4) и La(III) (5)
и дихлорэтане (4-6). Концентрация HNO3, моль/л: 1,
от концентрации соединения 4 в ионной жидкости при
6 - 0.1; 2, 4 - 1.0; 3, 5 - 3.0.
экстракции из раствора 0.1 моль/л HNO3.
Эффективность экстракции U(VI), Th(IV) и
(табл. 1), что связано со значительно большей ги-
РЗЭ(III) из азотнокислых растворов соедине-
дрофобностью аниона Tf2N- по сравнению с NO3-.
нием 4 значительно возрастает в присутствии
Величина синергетического эффекта при экс-
C4mimTf2N. Это может быть связано с увеличе-
тракции РЗЭ(III) в системе с ионных жидкостей
нием гидрофобности экстрагируемых комплексов
S = D/D0 (где D и D0 - коэффициенты распределе-
вследствие замещения ионов NO3- более гидро-
ния РЗЭ(III) в присутствии и отсутствие ионных
фобными Tf2N- [36]. В присутствии ионных жид-
жидкостей в органической фазе) уменьшается с
костей в органической фазе изменяется характер
увеличением [HNO3]. Так, при экстракции Eu(III)
зависимости lgDLn-[HNO3] (рис. 4). Снижение
величина S уменьшается от 400 до 3.9 с ростом
DLn с ростом [HNO3] связано со снижением кон-
[HNO3] от 0.1 до 3 моль/л. Характер зависимости
центрации свободного экстрагента в органической
DLn-Z при экстракции РЗЭ(III) из азотнокислых
фазе вследствие взаимодействия соединения 4 как
растворов растворами соединения 4 в ионных
с HNO3, так и HTf2N, присутствующей в системе
жидкостях и дихлорэтане несколько различает-
вследствие заметного перехода ионов C4mim+ и
ся (рис. 5). Можно видеть, что при экстракции из
Tf2N- в водную фазу [37].
раствора 3 моль/л HNO3 величина S уменьшается
Экстракция HTf2N соединением 4 может быть
в ряду РЗЭ от 64 (La) до 1.2 (Er), а затем увеличи-
описана уравнением (6), а константа экстракции -
вается до 2.2 (Lu).
выражением (7).
Стехиометрическое соотношение РЗЭ(III)-4 в
H+(в) + Tf2N-(в) + L(o) ↔ HTf2NL(o),
(6)
комплексах, экстрагируемых в присутствии ион-
KHTf2N = [HTf2NL]/([L][H+][Tf2N-]).
(7)
ных жидкостей, составляет 1:3 (рис. 6), т. е. в си-
Концентрационная константа экстракции
стеме ионных жидкостей наблюдается увеличение
HTf2N соединением 4 в дихлорэтане рассчитана,
сольватных чисел в экстрагируемых комплексах
исходя из данных по зависимости коэффициента
по сравнению с экстракцией растворами соедине-
распределения иона Tf2N- от концентрации соеди-
ния 4 в дихлорэтане (рис. 2). Это связано со слабой
нения 4 в органической фазе и концентраций ионов
координирующей способностью ионов Tf2N- [38],
Tf2N- и H+ в водной. Предварительно установлено,
которые находятся, по-видимому, во внешней ко-
что в условиях эксперимента ионы Li+ и Cl- не пе-
ординационной сфере экстрагируемого комплек-
реходят в органическую фазу. Величина KHTf2N =
са, тогда как в отсутствие ионных жидкостей ионы
(6.31±0.5)×104 значительно превышает величину
РЗЭ(III) экстрагируются соединениями 2 и 4 в
константы экстракции HNO3 этим соединением
виде координационно-сольватированных нитратов
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
ЭКСТР
АКЦИЯ U(VI), Th(IV) И РЗЭ(III)
925
LnL2(NO3)3, в которых ионы NO3- участвуют в ко-
соединения 4а в 15 мл бензола добавляли 1.0 г
ординации ионов Ln3+ [19].
(5.0 ммоль) PCl5. Полученную смесь кипятили в
Представленные данные показали, что соеди-
течение 6 ч, затем упаривали в вакууме. К остат-
нение 4 превосходит по экстракционной способ-
ку добавляли 15 мл 10%-ного раствора NaНCO3,
ности по отношению к U(VI), Th(IV) и РЗЭ(III)
и смесь экстрагировали CHCl3 (3×30мл). Экстракт
соединение 6, в молекуле которого фениленовый
промывали разбавленной (1:2) HCl (3×30 мл), упа-
мостик заменен конформационно подвижным
рили в вакууме, затем добавляли 15 мл диэтилово-
этиленовым фрагментом, но уступает своему
го эфира. Осадок отфильтровывали и сушили. Вы-
структурному аналогу 2 с метиленовым мости-
ход 1.5 г (90.6%), т. пл. 93-95°С (гексан). Cпектр
ком между СН2Р(О) группой и эфирным атомом
ЯМР 1Н (CDCl3), δ, м. д.: 1.23 т (3Н, СН3СН2, 3J =
кислорода. Эффективность экстракции РЗЭ(III)
7.6 Гц), 2.64 к (2H, CH2CH3, 3J = 7.6 Гц), 3.12 т (2Н,
{[2-(2-дифенилфосфорил)-4-этилфенокси]этил}-
СН2CH2OH, 3J = 6.3 Гц), 3.96 т (2Н, CH2CH2OH,
дифенилфосфином из азотнокислых растворов
3J = 6.2 Гц), 6.79 м (1H, Ar-Н), 7.28-7.56 м (7Н,
значительно увеличивается в присутствии ионной
Ar-Н), 7.71-7.79 м (5Н, Ar-Н). Cпектр ЯМР 31P
жидкости - бис[(трифторметил)сульфонил]имида
(CDCl3): δР 27.6 м. д. Найдено, %: С 68.45, 68.59; H
1-бутил-3-метилимидазолия в органической фазе.
5.72, 5.57; P 8.23, 8.28. C22H22O3P. Вычислено, %:
С 68.66; H 5.76; P 8.31.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2-(Дифенилфосфорил)-1-[2-(дифенилфос-
Спектры ЯМР 1H и 31Р записаны на спектро-
финоил)этокси]-4-этилбензол (4). Раствор 1.3 г
метре Bruker СХР-200. Температуры плавления
(5.0 ммоль) дифенилфосфинистой кислоты в 10 мл
измерены на приборе Boetius PHMK 05. Для коло-
гексаметилдисилазана в токе сухого аргона на-
ночной хроматографии использовали силикагель
гревали при 130°С в течение 1 ч, затем добавляли
марки L с размером частиц 100-150 мкм.
1.53 г (4.0 ммоль) соединения 4б. Полученную
2-[2-(Дифенилфосфорил)-4-этилфенокси]-
смесь выдерживали при 220°C в течение 4 ч.
этанол (4а). К суспензии 2.50 г (7.8 ммоль)
После охлаждения добавляли 10 мл этанола и
4-этил-2-дифенилфосфорилфенола [39] в 20 мл
1 мл 30%-ного раствора Н2О2, полученную смесь
безводного диоксана добавляли 0.33 г (7.8 ммоль)
кипятили 1 ч, затем упаривали в вакууме. Оста-
55%-ной суспензии NaH в вазелиновом масле.
ток хроматографировали на колонке с силикаге-
Смесь кипятили 0.5 ч, затем упаривали раствори-
лем, в качестве элюента использовали CHCl3 и
тель в вакууме. Полученный фенолят переносили
смесь CHCl3-i-PrOH (100:1). Выход 1.7 г (77.3%),
в ампулу, добавляли 0.65 г (8.0 ммоль) этиленхлор-
т. пл.
185-186°С (бензол-гексан). Cпектр ЯМР
гидрина и запаянную ампулу нагревали в течение
1Н (CDCl3), δ, м. д.: 1.78 т (СН3СН2, 3J = 7.6 Гц),
26 ч при 130°С. После охлаждения содержимое
2.14 м [2H, CH2CH2Р(О)], 2.59 к (2Н, СН2СН3, J =
ампулы растворяли в 30 мл CHCl3, переносили в
7.6 Гц), 6.78 м (1H, Ar-Н), 7.33-7.78 м (22 Н, Ar-
делительную воронку и промывали разбавленной
Н). Cпектр ЯМР 31P (CDCl3), δP, м. д.: 27.79, 29.47.
(1:2) HCl (3×30 мл), затем упаривали в вакууме.
Найдено, %: С 74.02, 73.89; H 5.72, 5.57; P 11.03,
Остаток хроматографировали на колонке с сили-
10.96. C34H32O3P2. Вычислено, %: С 74.17; H 5.86;
кагелем, элюент - CHCl3. Выход 1.67 г (58.6%),
P 11.25.
т. пл.
122-124°С (бензол-гексан). Cпектр ЯМР
1Н (CDCl3), δ, м. д.: 1.10 т (3Н, СН3СН2, 3J =
В качестве органических разбавителей исполь-
7.6 Гц), 2.51 к (2H, CH2CH3, 3J = 7.4 Гц), 3.62 м (2Н,
зовали 1,2-дихлорэтан марки ХЧ без дополнитель-
СН2CH2OH), 4.09 м (2Н, CH2CH2OH), 5.0 уш. с
ной очистки и C4mimTf2N, синтезированный и
(1Н, СН2CH2OH), 6.9 м (2H, Ar-Н), 7.35 м (1Н,
очищенный по известной методике [40]. Растворы
Ar-Н), 7.52 м (6Н, Ar-Н), 7.72-7.79 м (4Н, Ar-Н).
экстрагента готовили по точной навеске. Исходные
Cпектр ЯМР 31P (CDCl3): δР 30.86 м. д. Найдено, %:
водные растворы U(VI), Th(IV) и РЗЭ(III) готовили
С 72.15, 72.09; H 6.12, 6.07; P 8.23, 8.38. C22H23O3P.
растворением соответствующих нитратов в воде с
Вычислено, %: С 72.12; H 6.33; P 8.45.
последующим добавлением HNO3 или NH4NO3.
1-(2-Хлорэтокси)-2-(дифенилфосфорил)-
Исходная концентрация ионов металлов составля-
4-этилбензол (4б). К раствору 1.58 г (4.3 ммоль)
ла 2×10-6 моль/л. Контакт фаз осуществляли при
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
926
ТУРАНОВ и др.
комнатной температуре на роторном аппарате для
вой поддержке Российского фонда фундаменталь-
перемешивания со скоростью 60 об/мин в течение
ных исследований (грант № 18-29-24069_мк).
1 ч. Предварительно установлено, что этого време-
КОНФЛИКТ ИНТЕРЕСОВ
ни достаточно для установления постоянных зна-
чений коэффициентов распределения элементов в
Авторы заявляют об отсутствии конфликта
экстракционных системах.
интересов.
Концентрацию U(VI), Th(IV) и РЗЭ(III) в ис-
СПИСОК ЛИТЕРАТУРЫ
ходных и равновесных водных растворах опреде-
1. Myasoedov B.F., Kalmykov S.N., Kulyako Yu.M.,
ляли методом масс-спектрометрии с индуктивно
Vinokurov S. E. // Geochem. Int. 2016. Vol. 54. N 13.
связанной плазмой (ИСП-МС) с использованием
P. 1156. doi 10.1134/S0016702916130115
масс-спектрометра X-7 (Thermo Scientific, США).
2. Аляпышев М.Ю., Бабаин В.А., Устынюк Ю.А. // Усп.
Содержание элементов в органической фазе опре-
хим. 2016. Т. 85. № 9. С. 943; Alyapychev M.Yu., Baba-
деляли после реэкстракции раствором 0.1 моль/л
in V.A., Ustynyuk Yu.A. // Russ. Chem. Rev. 2016.
оксиэтилидендифосфоновой кислоты. Коэффици-
Vol. 85. N 9. P. 943. doi 10.1070/RCR4588
енты распределения элементов рассчитывали как
3. Leoncini A., Huskens J., Verboom W. // Chem. Soc. Rev.
отношение их концентраций в равновесных орга-
2017. Vol. 46. P. 7229. doi 10.1039/C7CS00574A
нической и водной фазах. Погрешность определе-
4. Розен А.М., Николотова З.И., Карташева Н.А. //
Радиохимия. 1986. Т. 28. № 3. С. 407.
ния коэффициентов распределения не превышала
5. Чмутова М.К., Литвина М.Н., Прибылова Г.А.
5%.
Иванова Л.А., Смирнов И.В., Шадрин А.Ю , Мясое-
Концентрацию ионов Tf2N- в равновесных
дов Б.Ф. // Радиохимия. 1999. Т. 41. № 4. С. 331.
водных фазах определяли атомно-эмиссионным
6. Narita H., Yaita T., Tamura K., Tachimori S. //
методом с ионизацией пробы в индуктивно свя-
Radiochim. Acta. 1998. Vol. 81. P. 223. doi 10.1524/
занной плазме с использованием спектрометра
ract.1998.81.4.223
iCAP-6500 Duo (Thermo Scientific, США).
7. Sasaki Y., Sugo Y., Suzuki S., Tachimori S. // Solvent
Extr. Ion Exch. 2001. Vol. 19. P. 91. doi 10.1081/SEI-
Концентрацию HNO3 в равновесной водной
100001376
фазе определяли потенциометрическим титрова-
8. Zhui Z.-X, Sasaki Y., Suzuki S., Kimura T. // Analyt.
нием раствором NaOH, в органической - таким
Chim. Acta. 2004. Vol. 527. P. 163. doi 10.1016/j.
же образом после реэкстракции HNO3 водой. Па-
aca.2004.09.023
раллельно определяли содержание HNO3 в орга-
9. Sasaki Y., Sugo Y., Morita K., Nash K.L. //
нической фазе при экстракции кислоты чистым
Solvent Extr. Ion Exch. 2015. Vol. 33. P. 625. doi
дихлорэтаном (холостой опыт). Результаты холо-
10.1080/07366299.2015.1087209
стого опыта учитывали при расчете общей концен-
10. Campbell E., Holfeltz V.E., Hall G.B., Nash K.L.,
трации комплексов HNO3 с экстрагентом в органи-
Lumetta G.J., Levitskaia T.G. // Solvent Extr. Ion
ческой фазе.
Exch. 2018. Vol. 36. P. 331. doi 10.1080/
07366299.2018.1447261
БЛАГОДАРНОСТЬ
11. Ansari S.A., Mohapatra P.K., Leoncini A., Ali S.M.,
Авторы выражают благодарность ООО
Singhadeb A., Huskens J., Verboom W. // Dalton Trans.
2017. Vol. 46. P. 11355. doi 10.1039/C7DT03831C
«Сорбент-Технологии» за предоставление для ис-
12. Туранов А.Н., Карандашев В.К., Евсеева Н.К., Бау-
следований бис[(трифторметил)сульфонил]имида
лин В.Е., Ушакова А.П. // Радиохимия. 1999. Т. 41.
1-бутил-3-метилимидазолия.
№ 3. С. 219.
ФОНДОВАЯ ПОДДЕРЖКА
13. Turanov A.N., Karandashev V.K., Baulin V.E. //
Solvent Extr. Ion Exch. 1999. Vol. 17. P. 1423. doi
Работа выполнена в рамках государственно-
10.1080/07366299908934656
го задания Института физики твердого тела РАН,
14. Turanov A.N., Karandashev V.K., Baulin V.E., Yarke-
Института проблем технологии микроэлектро-
vich A.N., Safronova Z.V. // Solvent Extr. Ion Exch.
ники и особо чистых материалов РАН, Инсти-
2009. Vol. 27. P. 551. doi 10.1080/07366290903044683
тута физической химии и электрохимии им.
15. Розен А.М., Николотова З.И., Карташева Н.А.,
А.Н. Фрумкина РАН и Института физиологически
Юдина К.С. // Докл. АН СССР. 1975. Т. 222. № 5.
активных веществ РАН и при частичной финансо-
С. 1151.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
ЭКСТР
АКЦИЯ U(VI), Th(IV) И РЗЭ(III)
927
16. Розен А.М., Крупнов Б.В. // Усп. хим. 1996. Т. 65.
30. Panja S., Mohapatra P.K., Tripathi S.C., Gandhi P.M.,
№ 11. С. 1052; Rozen A.M., Krupnov B.V. // Russ.
Janardan P. // Sep. Purif. Technol. 2012. Vol. 96. P. 289.
Chem. Rev. 1996. Vol. 65. N 11. P. 973. doi 10.1070/
doi 10.1016/j.seppur.2012.06.015
RC1996v065n11ABEH000241
31. Туранов А.Н., Карандашев В.К., Баулин Д.В., Бау-
17. Кабачник М.И., Мясоедов Б.Ф., Мастрюкова Т.А.,
лин В.Е., Цивадзе А.Ю. // ЖНХ. 2019. Т. 62. № 3.
Поликарпов Ю.М., Чмутова М.К., Нестерова Н.П. //
С. 323; Turanov A.N., Karandashev V.K., Baulin D.V.,
Изв. АН. Cер. хим. 1996. № 11. С. 2624.
Baulin V.E., Tsivadze A.Yu. // Russ. J. Inorg. Chem. 2019.
18. Цветков Е.Н., Евреинов В.И., Бондаренко Н.А.,
Vol. 64. N 3. P. 407. doi 10.1134/S0036023619030203
Сафронова З.В. // ЖОХ. 1996. Т. 66. № 7. С. 1081.
32. Розен А.М., Беркман З.А., Бертина Л.Э., Дени-
19. Демин С.В., Жилов В.И., Нефедов С.Е. Баулин В.Е.,
сов Д.А., Зарубин А.И., Коссых В.Г., Николото-
Цивадзе А.Ю. // ЖНХ. 2012. Т. 57. № 6. С. 970; De-
ва З.И., Писарева С.А., Юдина К.С. // Радиохимия.
min S.V., Nefedov S.E., Zhilov V.I. Baulin V.E., Tsivad-
1976. Т. 18. № 4. С. 493.
ze A.Y. // Russ. J. Inorg. Chem. 2012. Vol. 57. N 6.
33. Туранов А.Н, Карандашев В.К., Баулин В.Е. //
P. 897. doi 10.1134/S0036023612060095
Радиохимия. 2001. Т. 43. № 1. С. 66; Turanov A.N.,
20. Туранов А.Н., Карандашев В.К., Баулин В.Е. // Ради-
Karandashev V.K., Baulin V.E. // Radiochemistry. 2001.
охимия. 1998. Т. 40. № 1. С. 36.
Vol. 43. N 1. P. 72. doi 10.1023/A:1012830323836
21. Koel M. // Crit. Rev. Anal. Chem. 2005. Vol. 35. P. 177.
34. Яцимирский К.Б., Костромина Н.А., Шека З.А., Да-
doi 10.1080/10408340500304016
виденко К., Крисс Е.Е., Ермоленко В.И. Химия ком-
22. Kolarik Z. // Solvent Extr. Ion Exch. 2013. Vol. 31.
плексных соединений редкоземельных металлов.
P. 24. doi 10.1080/07366299.2012.700589
Киев: Наукова думка, 1966. 494 с.
23. Billard I. // Handbook on the Physics and Chemistry of
35. Власов В.С., Розен А.М. // Радиохимия. 1988. Т. 30.
Rare Earths. 2013. Vol. 43. Ch. 256. P. 213.
№ 1. С. 146.
24. Mohapatra P.K. // Chem. Prod. Proc. Model. 2015.
36. Туранов А.Н., Карандашев В.К., Яркевич А.Н. //
Vol. 10. P. 135.
Радиохимия. 2018. Т. 60. № 2. С. 153; Turanov A.N.,
25. Nakashima K., Kubota F., Maruyama T., Goto M. //
Karandashev V.K., Yarkevich A.N. // Radiochemistry.
Anal. Sci. 2003. Vol. 19. P. 1097. doi 10.2116/
2018. Vol.
60. N
2. P.
170. doi
10.1134/
analsci.19.1097
S1066362218020078
26. Туранов А.Н., Карандашев В.К., Баулин В.Е. // ЖНХ.
37. Gaillard C., Boltoeva M., Billard I. Georg S., Mazan V.,
2008. Т. 53. № 6. С. 1045; Turanov A.N., Karanda-
Ouadi A., Ternova D., Hennig C. // ChemPhysChem.
shev V.K., Baulin V.E // Russ. J. Inorg. Chem. 2008.
2015. Vol. 16. P. 2653. doi 10.1002/cphc.201500283
Vol. 53. N 6. С. 970. doi 10.1134/S0036023608060272.
38. Binnemans K. // Chem. Rev. 2007. Vol. 107. P. 2593. doi
27. Туранов А.Н, Карандашев В.К., Баулин В.Е. //
10.1021/cr050979c
Радиохимия. 2008. Т. 50. № 3. С. 229; Turanov A.N.,
Karandashev V.K., Baulin V.E. // Radiochemistry. 2008.
39. Shuvaev S., Kotova O., Utochnikova V., Vaschenko A.,
Vol. 50. N 3. P. 266. doi 10.1134/S1066362208030090
Puntus L., Baulin V, Kuzmina N., Tzivadze A. // Inorg.
28. Shimojo K., Kurahashi K., Naganava H. // Dalton Trans.
Chem. Commun. 2012. Vol. 20. Р. 73. doi 10.1016/j.
2008. Vol. 37. P. 5083. doi 10.1039/B810277P
inoche.2012.02.020
29. Turanov A.N., Karandashev V.K., Baulin V.E. //
40. Bonhote P., Dias A.P., Papageorgiou N., Kalyanasun-
Solvent Extr. Ion Exch. 2008. Vol. 26. P. 77. doi
daram K., Grätzel M. // Inorg. Chem. 1996. Vol. 35.
10.1080/07366290801904871
P. 1168. doi 10.1021/ic951325x
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
928
ТУРАНОВ и др.
Extraction of U(VI), Th(IV), and Rare Earth Elements(III)
with {[2-(2-Diphenylphosphoryl)-4-ethylphenoxy]ethyl}-
diphenylphosphine Oxide from Nitric Acid Solutions
A. N. Turanova,*, V. K. Karandashevb, D. V. Baulinc, and V. E. Baulind
a Institute of Solid State Physics of the Russian Academy of Sciences, Chernogolovka, 142432 Russia
b Institute of Problems of Microelectronics Technology and High-Purity Materials of the Russian Academy of Sciences,
Chernogolovka, 142432 Russia
c A.N. Frumkin Institute of Physical Chemistry and Electrochemistry of the Russian Academy of Sciences,
Moscow, 119991 Russia
d Institute of Physiologically Active Substances of the Russian Academy of Sciences, Chernogolovka, 142432 Russia
*e-mail: turanov@issp.ac.ru
Received February 4, 2020; revised February 4, 2020; accepted February 16, 2020
A new extractant {[2-(2-diphenylphosphoryl)-4-ethylphenoxy]ethyl}diphenylphosphine oxide was synthesized.
The extraction of HNO3 and U(VI), Th(IV) and rare earth elements(III) ions from nitric acid solutions with
solutions of this compound in 1,2-dichloroethane and an ionic liquid {1-butyl-3-methylimidazolium bis[(triflu-
oromethyl)sulfonyl]imide} was studied. The stoichiometry of the extracted complexes was determined, and the
influence of the structure of the extractant and the concentration of HNO3 in the aqueous phase on the efficiency
of extraction of metal ions in the organic phase was considered. It was shown that the extraction efficiency is
significantly increased in the presence of an ionic liquid in the organic phase.
Keywords: phosphoryl podands, extraction, rare earth elements, ionic liquids
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020