ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 6, с. 948-952
УКД 544.653.1:546
ВЗАИМОСВЯЗЬ КИСЛОТНО-ОСНОВНЫХ СВОЙСТВ
ФЕРРИТА КОБАЛЬТА С ЕГО КАТАЛИТИЧЕСКОЙ
АКТИВНОСТЬЮ В РЕАКЦИИ РАЗЛОЖЕНИЯ
ОКСИДА АЗОТА(I)
© 2020 г. К. О. Денисова, А. А. Ильин*, Р. Н. Румянцев, А. П. Ильин
Ивановский государственный химико-технологический университет, пр. Шереметевский 7, Иваново, 153000 Россия
*e-mail: ilyin@isuct.ru
Поступило в Редакцию 10 декабря 2019 г.
После доработки 3 февраля 2020 г.
Принято к печати 6 февраля 2020 г.
Установлена взаимосвязь количества кислотных и основных центров феррита кобальта с его каталити-
ческими свойствами в реакции разложения оксида азота(I). Методами индикаторов Гаммета и термоде-
сорбции аммиака выявлено распределение кислотно-основных центров в зависимости от соотношения
компонентов Fe2O3-Co3O4. Увеличение количества основных центров позволяет понизить температуру
разложения N2O на 122°С. Методом ИК спектроскопии идентифицирована природа кислотных и основ-
ных центров на поверхности CoFe2O4.
Ключевые слова: феррит кобальта, оксид азота(I), кислотно-основные свойства, каталитическая ак-
тивность
DOI: 10.31857/S0044460X20060169
Для понимания природы и механизма процес-
в каждом отдельном случае характеризует кислот-
сов, протекающих на поверхности катализато-
но-основной центр на поверхности [5]. К достоин-
ра, необходимо изучение его физико-химических
ствам метода относится простота, доступность и
свойств. Активность и селективность существу-
возможность изучения всего комплекса характе-
ющих гетерогенных катализаторов и многоком-
ристик катализатора, составляющих кислотно-ос-
понентных систем во многом зависят от электро-
новный параметр поверхности, и его изменение
нодонорных и электроноакцепторных свойств их
под влиянием разного рода воздействий [6]. При-
поверхности [1]. Согласно современным представ-
менение индикаторного метода позволяет оценить
лениям [2], поверхность катализаторов бифункци-
изменение кислотности поверхности катализато-
ональна, так как на ней располагаются основные и
ров до и после модифицирования как проявление
кислотные центры Бренстеда и Льюиса [3]. Опре-
суммарного эффекта взаимодействия с водой кис-
деление типа и количества активных центров по-
лотных и основных центров Льюиса и Бренстеда
зволяет прогнозировать реакционную и сорбцион-
[7]. Наиболее полную и достоверную информацию
ную способность поверхности, механизм работы
о природе поверхности сорбционных материалов
катализатора в зависимости от условий синтеза,
получают при исследовании распределения актив-
влияние модифицирующих добавок и ряд других
ных центров в широком энергетическом интерва-
факторов [4].
ле с шагом 0.5-1.0 ед. контролируемого параметра,
Индикаторный метод - один из наиболее про-
это позволяет определить наличие или отсутствие
стых способов определения кислотно-основных
кислотно-основных центров адсорбции [8]. Рас-
центров на поверхности твердых тел. В основе ме-
пределение активных центров по величине рKа
тода лежит адсорбция индикаторов, рKа которых
на поверхности твердых тел - один из основных
948
ВЗАИМОСВЯЗЬ КИСЛОТНО-ОСНОВНЫХ СВОЙСТВ ФЕРРИТА КОБАЛЬТА
949
ɍɫɢɥɟɧɢɟ ɷɥɟɤɬɪɨɧɨɞɨɧɨɪɧɵɯ ɫɜɨɣɫɬɜ
ɍɫɢɥɟɧɢɟ ɷɥɟɤɬɪɨɧɨɚɤɰɟɩɬɨɪɧɵɯ ɫɜɨɣɫɬɜ
2ș ɝɪɚɞ
pKa
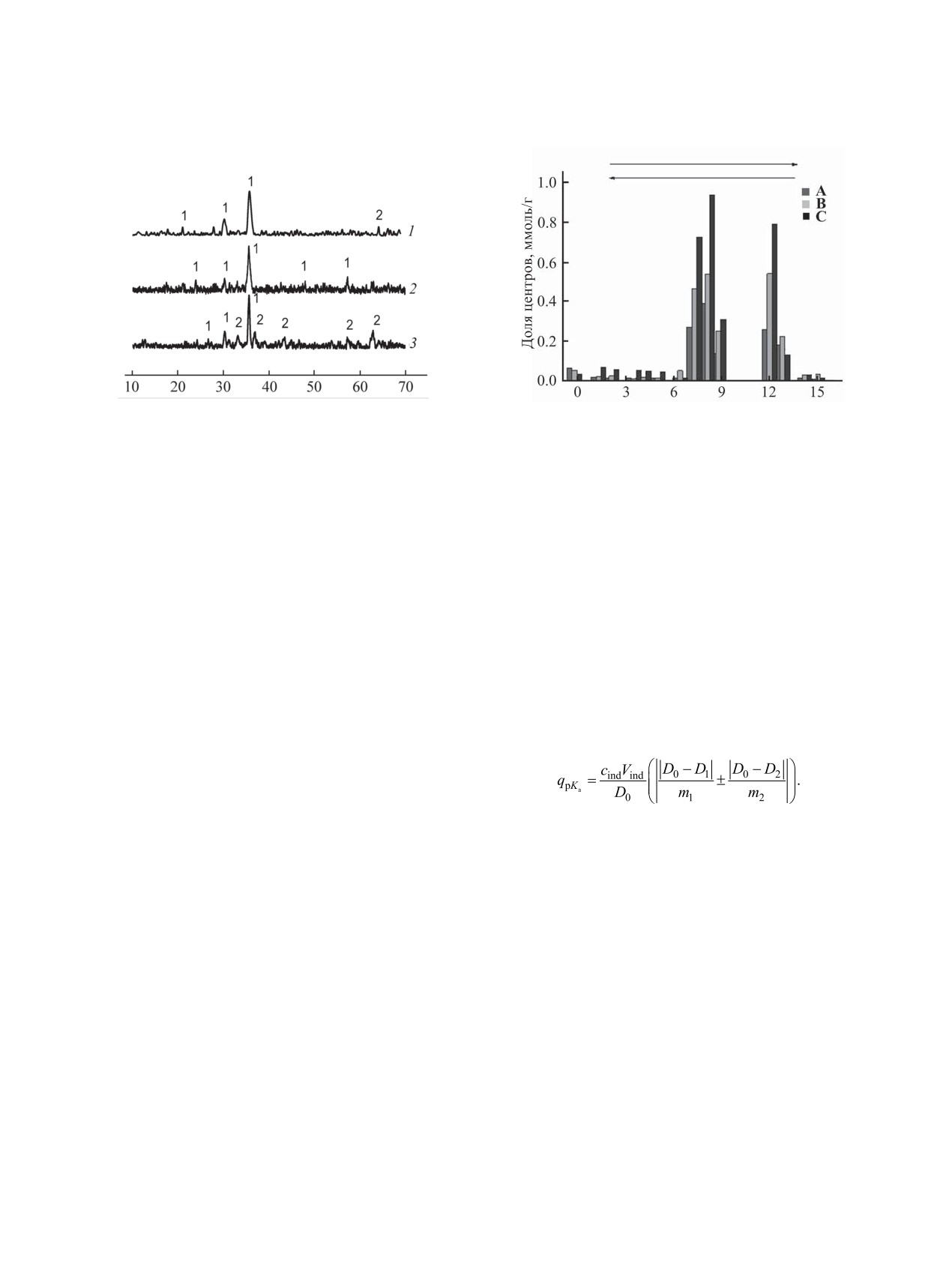
Рис. 1. Рентгенограммы системы Fe2O3-Co3O4 с соот-
Рис. 2. Диаграмма распределения кислотно-основных
ношением 74:26 (1), 66:34 (2), 56:44 (3). Индексируе-
центров на поверхности феррита кобальта для образ-
мые фазы: 1 - СоFe2O4, 2 - Co3O4.
цов А-С.
параметров, по которому можно контролировать
Кислотно-основные свойства поверхности об-
поверхность и изменять ее каталитическую актив-
разцов катализатора изучали индикаторным ме-
ность в различных процессах.
тодом Гаммета [9]. Заключение о природе и силе
кислотно-основных центров делали на основании
Соединения со структурой шпинели обладают
данных адсорбции индикаторов Гаммета из водной
уникальными физико-химическими свойствами.
среды [9]. Сила кислотно-основных центров по-
Эта уникальность обусловлена, прежде всего, су-
верхности катализатора определяется величиной
ществованием широкой области нестехиометрии
рKа индикатора, адсорбирующегося в сопряжен-
по кислороду. Ферриты со структурой шпинели
ной форме, а количество индикатора отражает ко-
проявляют высокую каталитическую активность
личество центров данной силы на поверхности.
во многих химических процессах, таких как сред-
Долю активных центров (qpKa, моль/г) с данным
нетемпературная конверсия монооксида углерода
значением рKа рассчитывали по формуле (1).
водяным паром, окисление аммиака и разложение
N2O.
(1)
Нами исследованы кислотно-основные харак-
теристики феррита кобальта со структурой шпине-
Здесь синд и Vинд - концентрация и объем раствора
ли с различными соотношениями исходных компо-
индикатора, m1 и m2 - масса катализатора при из-
нентов (Fe2O3-Co3O4) и выявлена их взаимосвязь
мерении оптической плотности D1 и D2; знак «-»
с каталитической активностью в реакции разло-
соответствует однонаправленному изменению ве-
жения N2O. Из оксалатов железа (FeC2O4·2H2O) и
личин D1 и D2 относительно D0, а знак «+» - раз-
кобальта (CoC2O4·2H2O) были приготовлены три
нонаправленному.
образца катализатора на основе оксидов кобальта
На рис. 2 приведены диаграммы распределе-
и железа с соотношением Fe2O3-Co3O4 0.26:0.74
ния кислотно-основных центров на поверхности
(А), 0.66:0.34 (В), 0.56:0.44 (С). На рентгенограм-
образцов А-С феррита кобальта. На поверхности
мах образцов А и С наблюдаются рефлексы, харак-
чистого феррита кобальта CoFe2O4 присутствуют
терные для фазы феррита кобальта CoFe2O4 и ок-
как кислотные, так и основные центры Бренстеда
сида кобальта Co3O4 (рис. 1). По-видимому, оксид
и Льюиса. Информация о их распределении и ко-
железа в составе образцов находится в мелкодис-
личестве имеет важное значение при разработке
персном рентгеноаморфном состоянии. Образец В
катализаторов с заданными свойствами, так как
однофазный, и на рентгенограмме индексируется
от дифференциальной кислотности феррита ко-
только фаза феррита кобальта CoFe2O4.
бальта, которая напрямую связана с соотношени-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
950
ДЕНИСОВА и др.
Кислотно-основные характеристики и каталитические свойства образцов А-С модифицированного феррита кобальта
Состав катализатора
Т100,
Sуд,
ТПДNH3,
Индикаторный метод, ммоль/г
Образец
Т50, °C а
Co
O4:Fe2O3 (%)
°C
м2/г
ммоль/г б
кислотные центры
основные центры
3
А
26:74
423
580
89.5
0.105
0.105
1.05
В
34:66
478
540
117
0.14
0.16
1.84
С
44:56
387
458
197
0.315
0.318
2.78
а Т50 и Т100 - температуры, при которых достигается 50- и 100%-ная степень разложения N2O соответственно.
б ТПДNH3 - метод термопрограммированной десорбции аммиака.
ем числа центров Бренстеда и Льюиса, зависит их
представлены катионами Co(II). Эти центры спо-
каталитическая активность во многих процессах
собны взаимодействовать по донорно-акцепторно-
[10, 11].
му механизму с молекулами, включающими атомы
Индикаторы с наиболее низкими значениями
с не поделенной электронной парой или несущие
pKa селективно адсорбируются на активных цен-
отрицательный заряд [12]. Основные центры Лью-
трах поверхности CoFe2O4 льюисовского оснóвно-
иса образованы атомами кислорода с двухэлек-
го типа. Данные активные центры способны к за-
тронными орбиталями, способными вступать в
хвату протона при гидролитической диссоциации
химические взаимодействия с передачей электро-
молекулы воды. По мере роста величины pKa ин-
нов на энергетический уровень адсорбированной
дикаторов их селективная адсорбция происходит
молекулы.
на бренстедовских кислотных центрах (pKa = 0-7),
Для идентификации природы кислотных и ос-
которые могут быть идентифицированы, как функ-
новных центров на поверхности катализатора был
циональные группы Co-ОН и Fe-OH. Протонодо-
использован метод ИК спектроскопии [13]. Слабые
норные свойства этих групп близки, поскольку
кислотные центры обнаруживаются при волновых
близки значения ионных и октаэдрических кова-
числах около 629 и 971 cм-1, соответствующих ко-
лентных радиусов. Бренстедовские оснóвные цен-
лебаниям связей O2-Fe3+ и Fe3-Fe3+ в октаэдриче-
тры (рKа = 7.4, 8.1, 8.9, 12, 13) представлены груп-
ском окружении. Интенсивная полоса поглощения
пами CoO-ОН, а льюисовские кислотные центры
при 1649 cм-1 относится к группе С=О бидентат-
(pKa = -0.2, 1.4, 2, 3, > 14) - группами, способными
ного карбонатного иона. Кроме того, проявляются
к захвату гидроксильной группы при диссоциатив-
слабые полосы поглощения некоординированного
ной адсорбции воды [10]. На поверхности образ-
карбонатного иона CO32-. В спектре присутствуют
ца феррита кобальта стехиометрического состава
валентная асимметричная полоса молекулы H2O и
преобладают кислотные центры средней и слабой
полоса валентного колебания О-Н молекулы HDO
силы (рKа = 4.1-7.3).
в диапазоне 3680-2997 см-1 (максимум 3469 см-1)
Как видно из рис. 2, при снижении доли оксида
[14]. Сильная полоса при 713 см-1 обусловлена
кобальта (образец А) уменьшается сила кислот-
растяжением связи Co-O в ферритовой фазе.
ных центров, которая оценивается по величине
Таким образом, методы индикаторов Гаммета,
рKа индикатора. Количество кислотных центров
термодесорбции аммиака и ИК спектроскопии эф-
также уменьшается, и на поверхности наблюда-
фективны и дополняют друг друга при исследова-
ется преобладание основных центров, рKа = 7.26,
нии распределения кислотно-основных центров
8.75 и 12.5. На поверхности образца С происхо-
на поверхности катализатора. Полученные данные
дит симбатное возрастание кислотных и основ-
позволяют предвидеть каталитические свойства
ных центров, рKа = 2.6, 7.3 и 8.75. Таким образом,
поверхности, прогнозировать эффективность ис-
можно утверждать, что на поверхности всех об-
пользования системы Fe2O3-Co3O4 при формиро-
разцов, независимо от соотношения компонентов
вании и стабилизации активной фазы катализатора
Fe2O3-Co3O4, присутствуют основные центры,
разложения N2O. Метод термопрограммирован-
рKа = 7.3-12.8.
ной десорбции аммиака менее информативен, чем
Кислотные центры Льюиса - это координаци-
индикаторный. Он позволяет оценить суммарную
онно-ненасыщенные центры поверхности, кото-
кислотность по Льюису и Бренстеду, что позво-
рые в случае феррита кобальта и оксида кобальта
ляет более точно определить общую кислотность
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
ВЗАИМОСВЯЗЬ КИСЛОТНО-ОСНОВНЫХ СВОЙСТВ ФЕРРИТА КОБАЛЬТА
951
поверхности катализатора. Увеличение количе-
ства основных центров свидетельствует об усиле-
нии электронодонорных, а уменьшение их доли -
о возрастании электроноакцепторных свойств.
Сравнение общей кислотности образцов, оценен-
ной методом термодесорбции аммиака и индика-
торным методом, показывает хорошую воспроиз-
водимость результатов (см. таблицу).
Существенное влияние на температуру полного
разложения N2O (Т100) оказывает присутствующий
в катализаторе оксид кобальта. Такой катализатор
способен адсорбировать N2O на кислотно-актив-
Ɍɟɦɩɟɪɚɬɭɪɚ °ɋ
ных центрах поверхности феррита кобальта.
Нами было высказано предположение, что
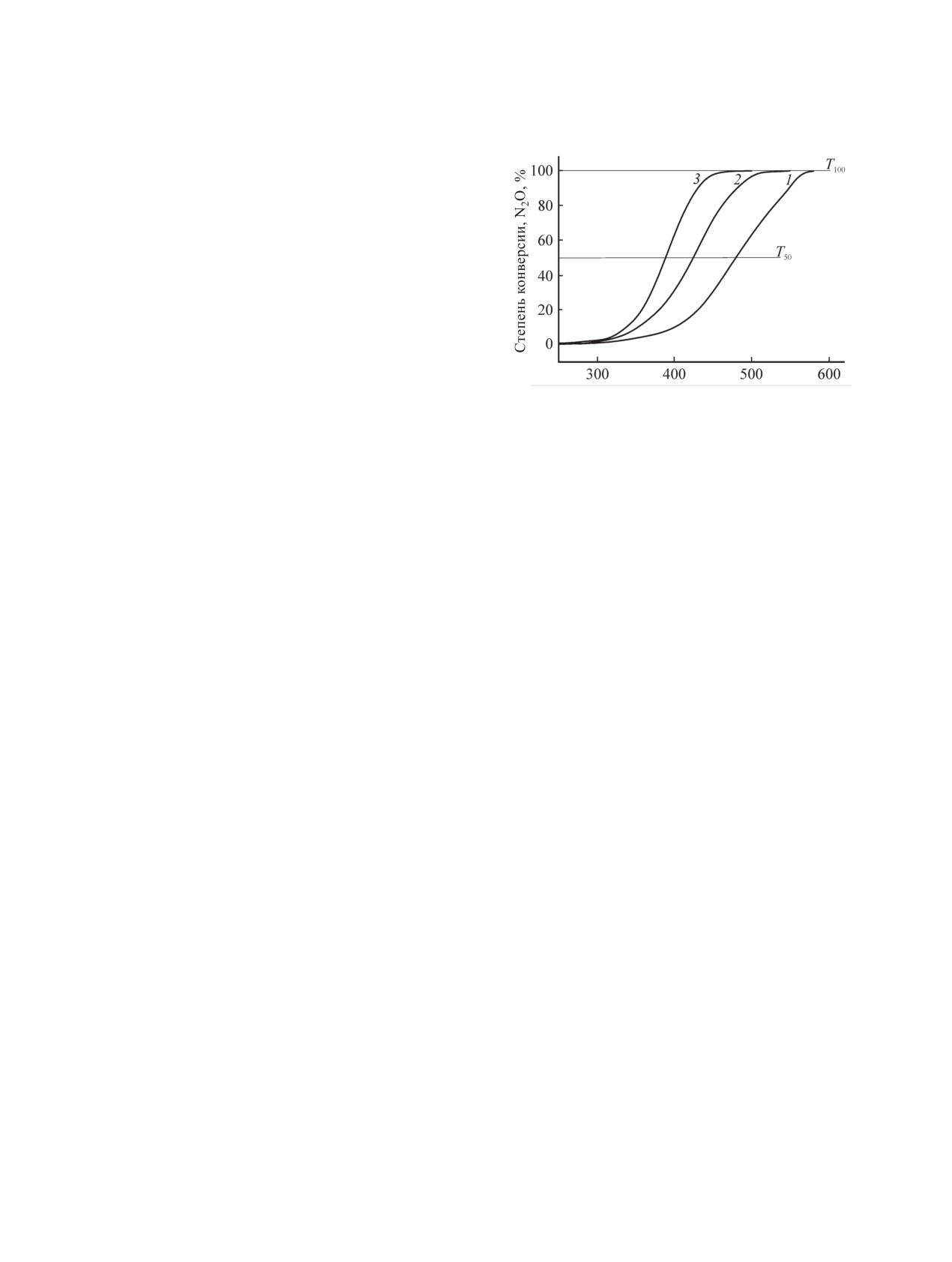
Рис. 3. Каталитическая активность образцов А-С мо-
дифицированного феррита кобальта в реакции разло-
увеличение кислотных центров на поверхности
жения N2O. 1 - образец А; 2 - образец В; 3 - образец С.
ферритных катализаторов позволяет повысить их
активность при разложении N2O. В таблице сопо-
феррита кобальта. Возможность управлять донор-
ставлены данные о количестве и силе поверхност-
но-акцепторными свойствами поверхности фер-
ных активных центров образцов катализатора с
рита кобальта представляет несомненный интерес
различными соотношениями компонентов.
для создания эффективных катализаторов, так как
Как следует из представленных данных (см.
наличие сильных кислотных центров определяет
его каталитическую активность в процессах раз-
таблицу, рис. 3), наиболее активным катализато-
ложения N2O, а присутствие основных центров
ром в реакции разложения N2O является образец,
необходимо учитывать при прогнозировании спо-
полученный путем прокаливания механоактиви-
собности образовывать адсорбционные комплексы.
рованной смеси оксалатов кобальта и железа в
соотношении 44% Co3O4 и 56% Fe2O3 при 300°С.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
100%-ная степень разложения N2O образца С до-
Удельную поверхность синтезированных об-
стигается при температуре 458°С. Для образца
разцов катализатора определяли многоточечным
феррита кобальта В 100%-ная степень разложения
методом Брунауэра-Эммета-Теллера по низкотем-
N2O наблюдается при 540°С, количество кислот-
пературной адсорбции N2 с помощью автоматиче-
ных центров по сравнению с образцом А в струк-
ского газоадсорбционного анализатора Sorbi-МS.
туре феррита кобальта В увеличивается. Наиболь-
Кислотные свойства образцов определяли на ИК
шее количество кислотных центров имеет образец
спектрометре TENSOR II (Bruker AXS Gmbb).
катализатора c избытком Co3O4 (С).
Образцы катализатора готовили активацией
Каталитическая активность феррита кобальта,
компонентов - оксалатов железа (FeC2O4·2H2O) и
в котором оксиды Fe2O3 были частично замещены
кобальта (CoC2O4·2H2O), взятых в соотношениях
оксидом кобальта Co3O4, значительно выше. Су-
0.26:0.74, 0.66:0.34, 0.56:0.44 (в пересчете на ок-
ществование Co3O4, в структуре феррита кобаль-
сиды Fe2O3-Co3O4). Оксалаты гомогенизировали
та приводит к более полному взаимодействию с
30 мин в ролико-кольцевой вибрационной мельни-
Fe2O3, и увеличению числа как кислотных, так и
це VM-4, после чего полученную смесь прокали-
основных активных центров (см. таблицу). Кроме
вали 6 ч в муфельной печи при 300°С.
того, Co3O4 является более активным в реакции ка-
Каталитическую активность образцов исследо-
талитического разложения N2O.
вали на установке проточного типа ПКУ-2 в реак-
Все вышесказанное доказывает, что набор кис-
ции разложения N2O в интервале температур 150-
лотных и основных центров, силы и концентрации
500°С. Состав реакционной газовой смеси: 1 об%
формирует индивидуальный дискретно-локаль-
N2O, остальное - N2. Кислотно-основные свойства
ный кислотно-основной спектр для поверхности
поверхности образцов катализатора изучали инди-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
952
ДЕНИСОВА и др.
каторным методом Гаммета [9]. Интенсивность
поверхности твердых тел. Екатеринбург: ИХТТ УрО
окраски измеряли на фотоэлектрическом концен-
РАН. 2010. С. 43.
трационном колориметре КФК-2МП.
6. Екимова И.А. // Ползуновский вестник. 2013. № 1.
С. 67.
ФОНДОВАЯ ПОДДЕРЖКА
7. Пахнутова Е.А., Слижов Ю.Г. // Неорг. матер. 2015.
Т. 51. № 6. С. 634. doi 10.7868/S0002337X15050127;
Работа выполнена в рамках государственного
Pakhnutova E.A., Slizhov Y.G. // Inorg. Mater. 2015.
задания (тема № FZZW-2020-0010). Практическая
Vol. 51. N 6. P. 572. doi 10.1134/S002016851505012X
часть работы выполнена в рамках плана работ
8. Минакова Т.С. Адсорбционные процессы на
Лаборатории синтеза, исследований и испытания
поверхности твердых тел. Томск: ТомГУ, 2007. 284 с.
каталитических и адсорбционных систем для про-
9. Сычев М.М., Минакова Т.С., Слижов Ю.Г., Шило-
цессов переработки углеводородного сырья (со-
ва О.А. Кислотно-основные характеристики
зданной при поддержке Министерства образова-
поверхности твердых тел и управление свойствами
ния и науки РФ на 2012-2022 гг.). Теоретическая
материалов и композитов. СПб: Химиздат, 2016.
часть работы выполнена при стипендиальной под-
276 с.
держке Президента РФ (СП-3800.2019.1).
10. Кустов Л.М. // Рос. xим. ж. 1998. № 1-2. С. 163.
11. Ушаков А.В, Карпов И.В., Лепешев А.А., Федо-
КОНФЛИКТ ИНТЕРЕСОВ
ров Л.Ю., Шайхадинов А.А. // ЖТФ. 2016. T. 86. № 1.
Авторы заявляют об отсутствии конфликта
C. 105; Ushakov A.V., Karpov I.V., Lepeshev A.A., Fe-
интересов.
dorov L.Yu., Shaikhadinov A.A. // J. Tech. Phys. 2016.
Vol. 86. N 1. P. 103. doi 10.1134/S1063784216010230
СПИСОК ЛИТЕРАТУРЫ
12. Карпова С.С., Мошников В.А., Максимов А.И.,
1. Захарова Н.В., Сычев М.М. // Конденсированные
Мякин С.В., Казанцева Н.Е. // Физика и техника
среды и межфазные границы. 2010. Т. 13. № 1. С. 56.
полупроводников. 2013. T. 48. № 8. С. 1022; Karpo-
2. Yuan M., Su Y., Deng W., Zhou H. // Chem. Eng. J.
va C.C., Moshnikov V.A., Maksimov A.I., Myakin S.V.,
2019. N 375. P. 13035. doi 10.1016/j.cej.2019.122091
Kazantseva N.E. // Semiconductors. 2013. Vol. 47. N 8.
3. Антошкина Е.Г., Смолко В.А. // Вестник ЮУрГУ.
P. 1026. doi 10.1134/S1063782613080095
Сер. Математика, физика, химия. 2008. T. 10. № 7.
13. Паукштис Е.А. ИК спектроскопия в гетерогенном
С. 65.
кислотно-основном катализе. Новосибирск: Наука,
4. Рязанов М.А. // Изв. Коми научного центра УрО РАН.
1992. С. 256.
2011. Т. 6. № 2. С. 25.
14. Davydov A. A. Molecular spectroscopy of oxide catalyst
5. Кузнецов М.В. Современные методы исследования
surfaces. Chichester: Wiley, 2003. 684 р.
Relationship of Acid-Basic Surface Properties
with Catalytic Activity
K. O. Denisova, A. A. Ilyin*, R. N. Rumyantsev, and A. P. Ilyin
Ivanovo State University of Chemical Technology, Ivanovo, 153000 Russia
*e-mail: ilyin@isuct.ru
Received December 10, 2019; revised February 3, 2020; accepted February 6, 2020
A relationship between the number of acidic and basic centers of cobalt ferrite and catalytic properties in the
decomposition of nitric oxide(I) was established. The methods of Hammett’s indicators and thermal desorption of
ammonia revealed the distribution of acid-base centers depending on the ratio of the components Fe2O3-Co3O4.
It was shown that an increase in the number of main centers allows one to lower the decomposition temperature
of N2O by 122°С. Using IR spectroscopy, the nature of the acidic and basic centers of the CoFe2O4 surface
was identified. The ability to control the catalytic properties of cobalt ferrite by directionally controlling the
acid-base state of the surface was demonstrated.
Keywords: cobalt ferrite, nitrous oxide, acid-base properties, catalytic activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020