ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 6, с. 975-979
ПИСЬМА
В РЕДАКЦИЮ
УДК 547.785.5
ЭФФЕКТИВНЫЙ МЕТОД СИНТЕЗА
ДИАЛКИЛ-Z-1,2-БИС[(1,5-R-1Н-ИМИДАЗОЛ-2-ИЛ)-
СУЛЬФАНИЛ]ЭТЕНИЛФОСФОНАТОВ
© 2020 г. Д. М. Егоров*, А. А. Бабушкина, Ю. Л. Питерская, А. В. Догадина
Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
*e-mail: diavoly@mail.ru
Поступило в Редакцию 4 марта 2020 г.
После доработки 4 марта 2020 г.
Принято к печати 10 марта 2020 г.
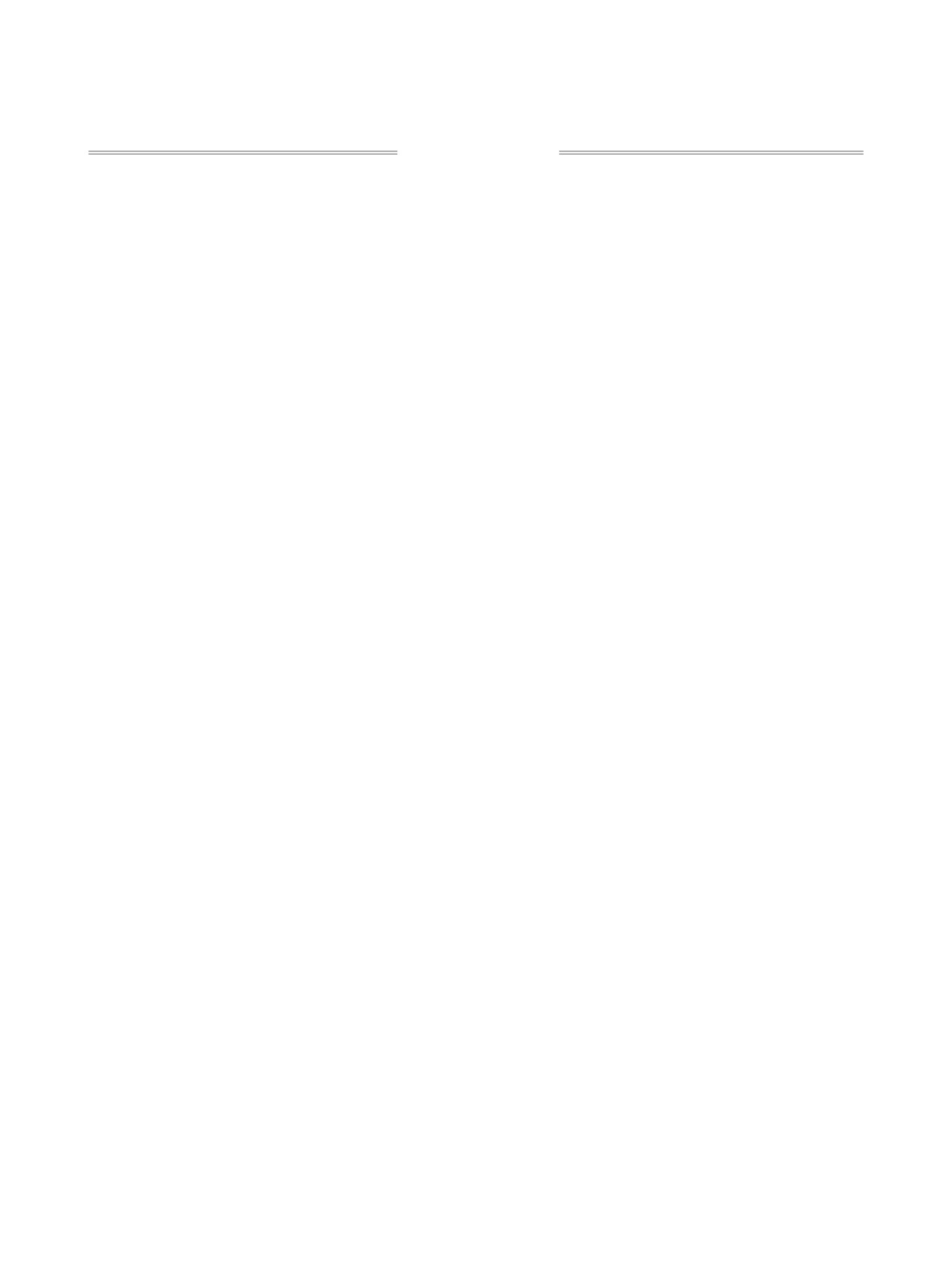
Предложен метод синтеза новых диалкил-Z-1,2-бис[(1,5-R-1Н-имидазол-2-ил)сульфанил]этенилфосфо-
натов, основанный на реакции диалкилхлорэтинфосфонатов с 1,5-замещенными имидазол-2-тионами
в безводном ацетонитриле.
Ключевые слова: фосфорилирование, диалкилхлорэтинфосфонат, 1,5-замещенные имидазол-2-тионы,
функционализация, вицинальные алкены
DOI: 10.31857/S0044460X20060200
Создание функционализированных алкенов
имидазол-2-тионами приводит к образованию
является актуальной задачей органической химии
смеси продуктов геминального и вицинального
[1-3]. Данные соединения привлекают интерес
строения в соотношении ~1:1 [15].
ученых различных областей науки [4-7]. Суще-
Неожиданный результат был получен при про-
ствует несколько основных подходов к синтезу
ведении реакции диалкилхлорэтинфосфонатов с
вицинальных дисульфанилалкенов. Один из них
1-замещенными бензимидазол-2-тионами. Было
включает постадийное замещение атомов галоге-
установлено, что несмотря на их структурную
на в дигалогеналкенах [8, 9], при этом как в случае
близость с имидазол-2-тионами и бензимидазол-2-
1,2-, так и в случае 1,1-дигалогеналкенов, проис-
тионом, в аналогичных условиях реакция при-
ходит образование продуктов вицинального стро-
водит к образованию исключительно продуктов
ения. Другой удобный метод синтеза вицинальных
циклического строения [16].
дисульфанилалкенов основан на реакции присое-
В данной работе нами представлены результаты
динения органических дисульфидов к ацетилену и
исследования реакции диалкилхлорэтинфосфо-
его производным [10-13].
натов 1а-в с 1-бензил- и 1,5-дифенил-1Н-имида-
Ранее нами были изучены особенности ре-
зол-2-тионами 2а, б. Установлено, что взаимодей-
акции диалкилхлорэтинфосфонатов с
1-метил-
ствие проходит с высокой хемо- и региоселектив-
3Н-имидазол-2-тионами и
4,5-замещенными
ностью, приводя к образованию соответствующих
имидазол-2-тионами. Было показано, что в слу-
вицинальных алкенфосфонатов, а именно диал-
чае 1-метил-3Н-имидазол-2-тионов реакция про-
кил-Z-1,2-бис[(1,5-дифенил-1Н-имидазол-2-ил)-
текает хемо- и региоселективно с образованием
сульфанил]этенилфосфонатов 3, 4 и диалкил-Z-
только продуктов вицинального строения [14].
1,2-бис[(1-бензил-1Н-имидазол-2-ил)сульфанил]-
В отличие от этого реакция с 4,5-замещенными
этенилфосфонатов 5-7 с выходом 85-93% (схема 1).
975
976
ЕГОРОВ и др.
Схема 1.
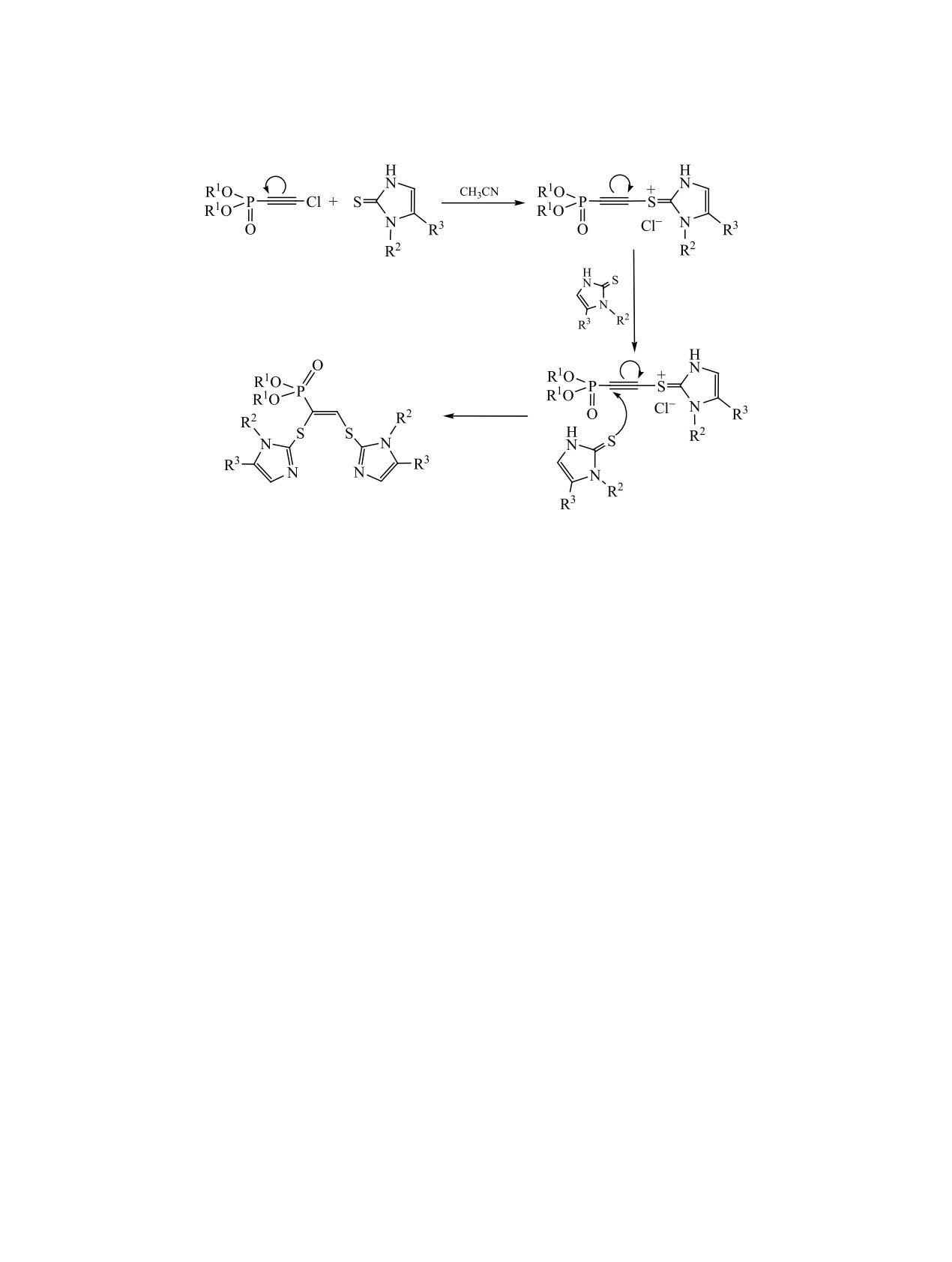
Строение фосфонатов 3-7 установлено на ос-
мидазол-2-тионами включает две стадии (схема 2).
новании данных спектроскопии ЯМР 1Н, 13С, 31Р.
Мы предполагаем, что на первом этапе реакции
Так, химический сдвиг фосфора алкенфосфонатов
происходит нуклеофильное замещение атома хло-
ра в исходном диалкилхлорэтинфосфонате атомом
3-7 лежит в интервале 8.51-14.19 м. д., характер-
серы соответствующего имидазол-2-тиона, при-
ном для фосфонатов со связью Р-Сsp2. В спектре
водящее к образованию промежуточного сульфе-
ЯМР 1Н олефиновый протон представлен дублет-
ниевого катиона. В образующемся интермедиате
ным сигналом в слабом поле 7.64-8.46 м. д. (3ЈНР =
поляризация тройной связи изменяется на проти-
11.6-15.3 Гц), значение константы согласуется с
воположную, что позволяет второй молекуле ими-
Z-конфигурацией алкенфосфонатов, однозначно
дазол-2-тиона атаковать фосфорзамещенный атом
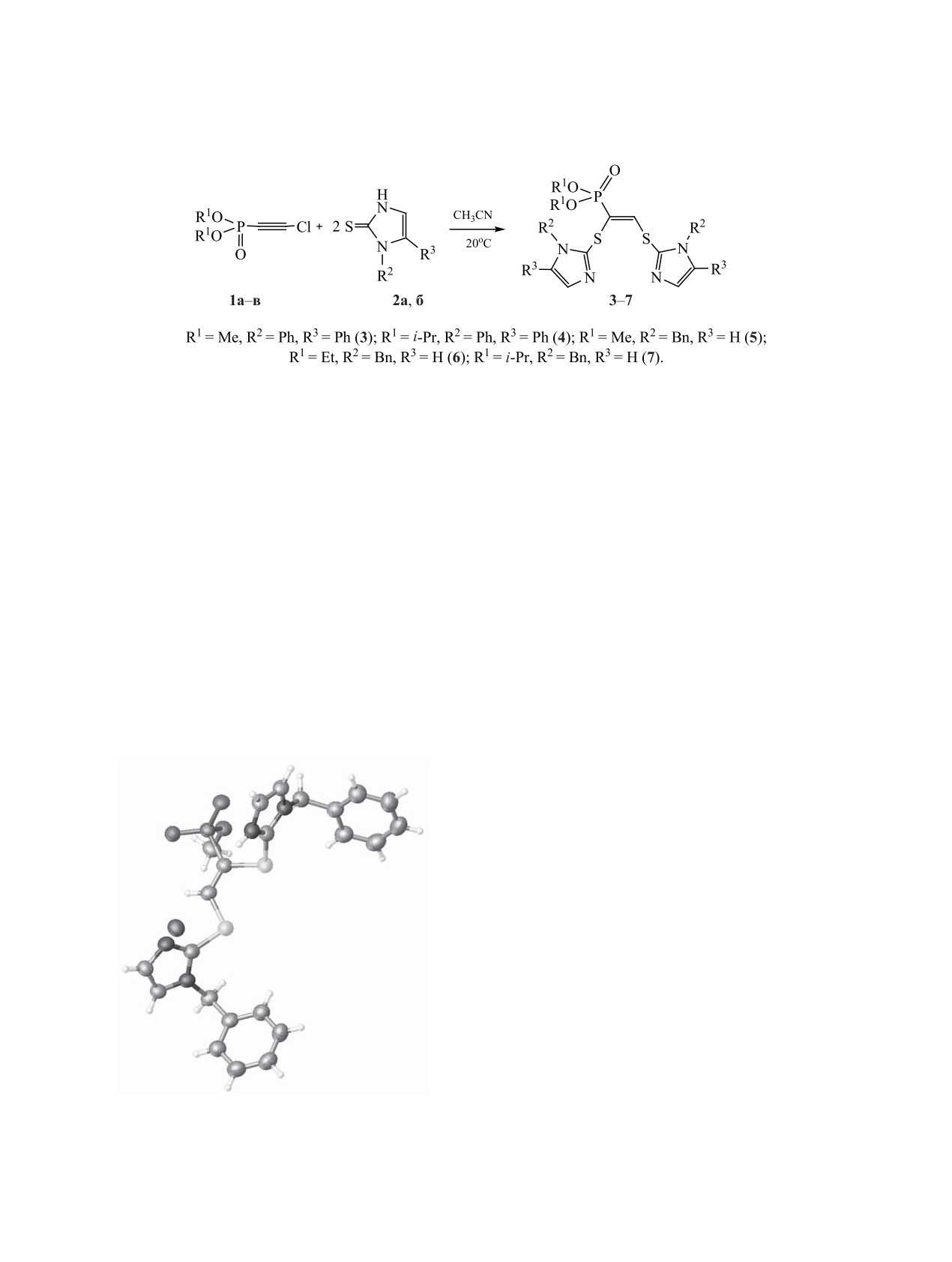
установленной по данным РСА на примере соеди-
углерода ацетиленовой связи с образованием ко-
нения 3а (см. рисунок). Следует отметить, что при
нечного алкенфосфоната.
перекристаллизации соединения 3 происходит де-
Общая методика синтеза соединений 3-7.
залкилирование до моноэфира 3а.
Смесь 2.5 ммоль диалкилхлорэтинфосфоната 1а-в,
Вероятный механизм реакции диалкилхлорэ-
5 ммоль соответствующего 3Н-имидазол-2-тиона
тинфосфонатов с 1-бензил- и 1,5-дифенил-1Н-и-
2 в 10 мл абсолютного ацетонитрила выдержива-
ли при интенсивном перемешивании при комнат-
ной температуре в течение 3-6 ч. Осадок отфиль-
тровали, промывали раствором карбоната калия
и сушили. Из фильтрата отгоняли растворитель
в вакууме. Остаток перекристаллизовывали из
петролейного эфира с добавлением небольшого
количества этилацетата. Получили дополнительно
10-20% фосфоната.
Диметил-Z-1,2-бис[(1,5-дифенил-1Н-имида-
зол-2-ил)сульфанил]этенилфосфонат (3). Выход
87%, т. пл. 154-155°С. Спектр ЯМР 1H, δ, м. д.:
3.60 д (6Н, ОСН3, 3JНР = 11.3 Гц), 7.00-7.41 м
(20Н, Ph), 7.25, 7.28 с (2Н, NНС=СPh), 8.23 д (1Н,
РС=СН, 3JНР = 15.3 Гц). Спектр ЯМР 13C, δC, м. д.:
53.25 д (СН3О, 2JСР = 6.1 Гц), 114.85 д (РС=СН,
1JСР = 196.6 Гц), 127.69 и 127.73 (NCH=), 127.84
и 128.13 (п-CPh), 128.39 и 128.45 (о-CPh), 129.20 и
129.58 (м-CPh), 135.27 (ипсо-СС=), 135.84 (ипсо-
СN=), 136.90 д (РС=СН, 2JСР = 14.5 Гц), 151.28,
Общий вид молекулы фосфоната 3а в кристалле (CCDC
151.50 (SС=N). Спектр ЯМР 31P: δР 14.19 м. д.
1884767).
Масс-спектр, m/z: 637.7228 [M + Н]+.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
ЭФФЕКТИВНЫЙ МЕТОД СИНТЕЗА ДИАЛКИЛ-Z-1,2-БИС[(1,5-R-1Н-ИМИДАЗОЛ-2-ИЛ)-...
977
Схема 2.
Диизопропил-Z-1,2-бис[(1,5-дифенил-1Н-
и 144.01 (SС=N). Спектр ЯМР 31P: δР 11.52 м. д.
имидазол-2-ил)сульфанил]этенилфосфонат (4).
Масс-спектр, m/z 513.5841 [M + Н]+.
Выход 85%, т. пл. = 146-148°С. Спектр ЯМР 1H,
Диэтил-Z-1,2-бис[(1-бензил-1Н-имидазол-
δ, м. д.: 1.27 д и 1.29 д [12Н, OСН(CH3)2, 3JНН =
2-ил)сульфанил]этенилфосфонат
(6).
Выход
6.1 Гц], 4.73 д. септетов [2Н, ОCH(СН3)2,3JНН = 6.1,
91%, т. пл. 165-166°С. Спектр ЯМР 1H, δ, м. д.:
3JНР = 12.5 Гц), 6.97-7.42 м (20Н, Ph), 7.19 c и 7.23 с
1.00 т (6Н, ОСН2СН3, 3JНН = 7.3 Гц), 3.81 д. к (4Н,
(2Н, NНС=СPh), 8.46 д (1Н, РС=СН, 3JНР = 15.1 Гц).
ОСН2СН3, 3JНН = 7.3, 3JНР = 13.8 Гц), 5.23 с и 5.27 с
Спектр ЯМР 13C, δC, м. д.: 24.10 д [(СН3)2СНО,
(4Н, СН2Ph), 7.01-7.14 м (10Н, СНPh), 7.24 д (2Н, ,
3JСР = 12.1 Гц], 71.56 д [(СН3)2СНОР, 2JCP = 5.4 Гц],
NСН=СНN=, 3JНН = 1.2 Гц), 7.29 д (1Н, NСН=СНN=,
113.23 д (РС=СН, 1JСР = 197.2 Гц), 128.73 и 128.85
3JНН = 1.2 Гц), 7.34 д (1Н, NСН=СНN=, 3JНН =
(NCH=), 127.89 и 128.21 (п-CPh), 128.42 и 128.51
1.2 Гц), 7.87 д (1Н, РС=СН, 3JНР = 13.8 Гц). Спектр
(о-CPh), 129.17 и 129.48 (м-CPh), 135.30 (ипсо-СC=),
ЯМР 13C, δC, м. д.: 16.08 д (СН3СН2, 3JСР = 6.7 Гц),
135.91 (ипсо-СN=), 137.01 д (РС=СН, 2JСР = 14.7 Гц),
51.23 и 51.74 (СН2Рh), 63.36 д (СН3СН2, 2JСР =
151.35 и 151.53 (SС=N). Спектр ЯМР 31P: δР 9.71 м.
5.4 Гц), 116.15 д (РС=СН, 1JСР = 194.55 Гц); 123.45,
д. Масс-спектр, m/z: 693.8291 [M + Н]+.
123.89, 124.22, 124.89, 127.48, 128.11, 128.92 (СPh),
Диметил-Z-1,2-бис[(1-бензил-1Н-имидазол-
128.69 д (РС=СН, 2JСР = 14.6 Гц), 134.02 и 134.98
2-ил)сульфанил]этенилфосфонат
(5).
Выход
(о-СPh), 135.36 и 135.43 (ипсо-CPh), 154.05 и 154.26
93%, т. пл. 170-171°С. Спектр ЯМР 1H, δ, м. д.:
(SС=N). Спектр ЯМР 31P: δР 9.51 м. д. Масс-спектр,
3.53 д (6Н, ОСН3, 3JНР = 11.3 Гц), 5.49 с и 5.54
m/z: 541.6372 [M + Н]+.
с (4Н, СН2Ph), 7.29 д и 7.30 д (4Н, о-СН, 3JНН =
Диизопропил-Z-1,2-бис[(1-бензил-1Н-имида-
1.3 Гц), 7.38-7.45 м (6Н, м,п-СН), 7.53 д и 7.66 д
зол-2-ил)сульфанил]этенилфосфонат (7). Выход
(2Н, NСН=СНN=, 3JНН = 2.0 Гц), 7.64 д (1Н, РС=СН,
91%, т. пл. 161-163°С. Спектр ЯМР 1H, δ, м. д.: 1.04 д
3JНР = 11.6 Гц), 7.64 д и 7.76 д (2Н, NСН=СНN=,
и 1.10 д [12Н, OСН(CH3)2, 3JНН = 6.3 Гц], 4.38 д.
3JHH = 2.0 Гц). Спектр ЯМР 13C, δC, м. д.: 50.78 и
септетов [2Н,ОCH(СН3)2, 3JНН=6.3Гц, 3JНР=12.5Гц],
50.96 (СН2Ph), 52.06 д (СН3О, 2JСР = 8.7 Гц), 121.67
5.19 с и 5.23 с (4Н, СН2Ph), 6.32 д (1Н, NСН=СНN=,
(СН=СНNBn), 123.13 д (РС=СН, 1JСР = 193.0 Гц),
3JНН = 2.4 Гц), 6.51 д (1Н, NСН=СНN=, 3JНН =
123.54 (CH=CHNBn), 124.29 (CH=CHN=), 125.08
2.5 Гц),
6.97-7.08 м
(10Н, Ph),
7.19 д
(1Н,
(CH=CHN=), 127.61 и 128.26 (о-СPh), 128.80 д
NСН=СНN=, 3JНН = 2.4 Гц), 7.36 д (1Н, NСН=СНN=,
(РС=СН, 2JСР = 14.8 Гц), 129.04 (п-СPh), 133.88 и
3JНН = 2.5 Гц), 7.84 д (1Н, РС=СН, 3JНР = 14.0 Гц).
134.09 (м-СPh), 136.45 и 137.52 (ипсо-CPh), 143.83
Спектр ЯМР 13C, δC, м. д.: 22.97 т [(CH3)2СН,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
978
ЕГОРОВ и др.
3JPС
= 5.4 Гц), 50.92 и 51.03 (CH2Ph), 73.33 д
Luo Y., Hou Z. // Sci. Adv. 2017. Vol. 3. N 7. P. 1. doi
[(CH3)2СНОР, 2JPС = 6.1 Гц), 113.89 д (РС=СН,
10.1126/sciadv.1701011
1JСР = 202.6 Гц), 122.58 (м-СPh), 125.72 д (РС=СН,
6. Harvison M.A., Lowe A.B. // Macromol. Rapid Commun.
2JСР = 14.2 Гц), 132.07 и 132.51 (о-СPh), 143.14 и
2011. Vol. 32. P. 779. doi 10.1002/marc.201100156.
145.35 (ипсо-СPh), 156.21 и 156.44 (SС=N). Спектр
7. Wang Y.-S., Cheng C.-C., Ye Y.-S., Yen Y.-C., Chang F.-C. //
ЯМР 31P: δР 8.51 м. д. Масс-спектр, m/z: 569.6904
ACS Macro Lett. 2012. Vol. 1. N 1. P. 159. doi 10.1021/
[M + Н]+.
mz200009x
8. Xu H., Chen W., Chen J., Wu H. // Synthesis. 2012.
Спектры ЯМР 1Н, 13С, 31Р сняты на спектроме-
Vol. 44. P. 380. doi 10.1055/s-0031-1290067
тре Bruker Avance III HD 400 NanoBay на частотах
9. Леванова Е.П., Никонова В.С., Розенцвейг И.Б., Рус-
400.17 (1H), 100.62 (13C) и 161.98 МГц (31P). В ка-
савская Н.В., Албанов А.И., Корчевин Н.А. // ЖОрХ.
честве растворителя использован дейтерирован-
2017. Т. 53. Вып. 8. C. 1172; Levanova E.P., Nikono-
ный хлороформ.
va V.S., Rosentsveig I.B., Russavskaya N.V., Alba-
ФОНДОВАЯ ПОДДЕРЖКА
nov A.I., Korchevin N.A. // Russ. J. Org. Chem. 2017.
Работа выполнена при финансовой поддержке
Vol. 53. N 8. P. 1186. doi 10.1134/S107042801708005X
10. Ananikov V.P., Kabeshov M.A., Beletskaya I.P. // Synlett.
Российского фонда фундаментальных исследова-
2005. Vol. 6. P. 1015. doi 10.1055/s-2005-865195
ний (грант № 18-33-00430) в рамках базовой части
11. Chen J., Chen S., Xu X., Tang Z., Au C.-T., Qiu R. // J. Org.
государственного задания Министерства науки и
Chem. 2016. Vol. 81. P. 3246. doi 10.1021/acs.
высшего образования (№ 785.00.Х6019) с исполь-
joc.6b00203
зованием оборудования Инжинирингового центра
12. Rodygin K.S., Gyrdymova Y.V., Zarubaev V.V. //
Санкт-Петербургского государственного техноло-
Mendeleev Commun. 2017. Vol. 27. P. 476. doi
гического института.
10.1016/j.mencom.2017.09.015
КОНФЛИКТ ИНТЕРЕСОВ
13. Degtyareva E.S., Erokhin K.S., Kashin A.S., Anani-
Авторы заявляют об отсутствии конфликта
kov V.P. // Appl. Catal. (A). 2019. Vol. 571. P. 170. doi
интересов
10.1016/j.apcata.2018.12.018
14. Егоров Д.М., Питерская Ю.Л., Догадина А.В. //
СПИСОК ЛИТЕРАТУРЫ
ЖОХ. 2015. Т. 85. Вып. 2. С. 333; Egorov D.M., Piter-
1. Saczewski F., Stencel A., Bienczak A.M., Langows-
skaya Y.L., Dogadina A.V. // Russ. J. Gen. Chem. 2015.
ka K.A., Michaelis M., Werel W., Halasa R., Reszka P.,
Vol. 85. N 2. P. 502. doi 10.1134/S1070363215020255
Bednarski P.J. // Eur. J. Med. Chem. 2008. Vol. 43. N 9.
15. Егоров Д.М., Питерская Ю.Л., Миронов В.Ф., Дога-
P. 1847. doi 10.1016/j.ejmech.2007.11.017
дина А.В. // ЖОХ. 2015. Т. 85. Вып. 9. С. 1564; Ego-
2. Besset T., Cahard D., Pannecoucke X. // J. Org. Chem.
rov D.M., Piterskaya Yu.L., Mironov V.F., Dogadina A.V. //
2013. 79. N 1. P. 413. doi 10.1021/jo402385g
Russ. J. Gen. Chem. 2015. Vol. 85. N 9. P. 1564. doi
3. Suero M.G., Bayle E.D., Collins B.S.L., Gaunt M.J. //
10.1134/S1070363215090273
J. Am. Chem. Soc. 2013. Vol. 135. N 14. P. 5332. doi
16. Егоров Д.М., Питерская Ю.Л., Карцев Д.Д., Полуке-
10.1021/ja401840j
ев В.А., Кривчун М.Н., Догадина А.В. // ЖОХ. 2018.
4. Mahesh K., Karpagam S., Putnin T., Le H., Bui T.,
Т. 88. Вып. 9. С. 1478; Egorov D.M., Piterskaya Yu.L.,
Ounnunkad K., Goubard F. // J. Photochem. Photobiol.
(A). 2019. Vol. 371. P. 238. doi 10.1016/j.jphoto-
Kartsev D.D., Polukeev V.A., Krivchun M.N., Dogadi-
chem.2018.11.024
na A.V. // Russ. J. Gen. Chem. 2018. Vol. 88. N 9.
5. Wang C., Luo G., Nishiura M., Song G., Yamamoto A.,
P. 1824. doi 10.1134/S1070363218090104
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020
ЭФФЕКТИВНЫЙ МЕТОД СИНТЕЗА ДИАЛКИЛ-Z-1,2-БИС[(1,5-R-1Н-ИМИДАЗОЛ-2-ИЛ)-...
979
Effective Synthesis of Dialkyl
Z-1,2-Bis[(1,5-R-1H-imidazol-2-yl)sulfanyl]ethenylphosphonates
D. M. Egorov*, A. A. Babushkina, Yu. L. Piterskaya, and A. V. Dogadina
St. Petersburg State Technological Institute (Technical University), St. Petersburg, 190013 Russia
*e-mail: diavoly@mail.ru
Received March 4, 2020; revised March 4, 2020; accepted March 10, 2020
A method for the synthesis of new dialkyl Z-1,2-bis[(1,5-R-1H-imidazol-2-yl)sulfanyl]ethenylphosphonates
based on the reaction of dialkyl chloroethylphosphonates with 1,5-substituted imidazole-2-thiones in anhydrous
acetonitrile was developed.
Keywords: phosphorylation, dialkyl chloroethylphosphonate, 1,5-substituted imidazole-2-thiones, function-
alization, vicinal alkenes
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 6 2020